乳酸菌是一种革兰氏阳性菌,大多数为厌氧菌,少数为兼性厌氧菌,可以分解食品中的大分子物质,包括降解难消化的多糖和转化不需要的风味物质。同时,它们在代谢过程中还可以产生包括短链脂肪酸、胺类、细菌素、维生素和胞外多糖在内的多种产物。基于上述乳酸菌的代谢特性,其在食品行业中应用广泛,常用来发酵生产酸乳、泡菜及肉类制品等[1]。
益生菌是一类广泛分布于人类和动物肠道中的活性微生物,摄入一定量时可对宿主健康产生益处[2-3]。乳酸菌是益生菌的重要组成部分,具有维持肠道菌群稳定、提高机体免疫力、调节血脂等多种益生作用[4-6]。随着研究人员对乳酸菌功能特性的不断挖掘以及大众对肠道菌群紊乱、血脂、血压不稳定等健康问题的担忧,使乳酸菌在食品以及生物与医药等行业得到了极大关注。此外,乳酸菌作为发酵肉制品(如干香肠、发酵火腿)的核心功能菌,其高密度培养可显著提升发酵效率,延长产品货架期。优化后的菌体可作为高效发酵剂,降低发酵肉制品的生产成本,推动发酵肉制品行业的高效生产。
高密度培养技术是一种在微生物发酵等领域广泛应用的技术,旨在通过优化培养基成分、培养条件以及采用特定的培养策略使微生物细胞在单位体积的培养基中达到较高的细胞密度。该技术相较于常规培养具有以下优点[7]:1)可实现微生物的高细胞密度和高生产率;2)缩小生物反应器体积,使培养过程更安全;3)简化下游产物的分离纯化步骤;4)缩短细胞培养周期;5)设备投入少,节约成本。在培养微生物细胞时,能够以相对低廉的成本实现高生产率和高产品效益,已经成为食品和药品等领域的研究热点之一。国内外学者常利用高密度培养技术培养乳酸菌,该技术可以精准调控发酵温度、按需调节pH值、及时补入营养物质,即突破乳酸菌生长的限制性因素,创造乳酸菌生长的最适环境。
由于发酵是一个复杂的细胞动态代谢过程,各种影响发酵的元素之间具有非线性关系,传统发酵数据的获取大多依靠离线分析和专家经验,发酵条件的控制也高度依靠经验判断或大量的基础实验试错,具有一定的滞后性和盲目性,无法满足现代智能精准发酵生产的需求[8]。基于此,本文整理了在传统高密度培养技术的基础上借助人工智能(artificial intelligence,AI)技术和高精度、高灵敏度的生物传感器驱动乳酸菌细胞发酵的相关研究,归纳学者们提出的多变量耦合算法模型与个性化适配策略,较传统方法显著提升了菌体密度,从而满足高效、精准及智能化的现代发酵生产需求。旨在推动乳酸菌高密度培养技术的理论发展,也为乳酸菌的工业化培养提供参考。
1 乳酸菌培养基配方优化
由于不同种类乳酸菌的基因片段、代谢方式不同,导致它们对营养物质的需求和对外界环境的适应性不同,因此个性化地调整培养基配方可以有效实现乳酸菌菌体密度的提高,培养基配方优化是实现乳酸菌高密度培养的最基础手段之一[9]。
1.1 传统发酵技术优化培养基配方
截至目前,国内对于乳酸菌培养基优化采取的主要方法是单因素结合响应面法分析。响应面法有诸多优点,它在设计实验、构建模型和评估自变量时优势显著,还能很好地分析因素之间的交互作用[10]。通过探究乳酸菌的最适碳源、氮源、无机盐及生长因子等培养基组分以达到优化的目的。
1.1.1 碳源与氮源
碳源是构成微生物培养基的核心成分之一,主要作用是为微生物细胞代谢提供能量(ATP)来源,保证细胞正常生长。Su Xin等[11]评估12 种碳源对培养嗜酸性乳杆菌IMAU81186的生长效果,发现碳源物质为葡萄糖时效果最好,但是单一碳源在提高菌株生物量方面存在局限性。在培养基中额外添加一定浓度的蔗糖能显著提高细胞密度,优化后嗜酸乳杆菌IMAU81186的活菌数增加7.03 倍。
氮源是乳酸菌蛋白质和核酸的重要组成部分,参与细胞代谢调节,是培养基成分中关键的营养物质。孙雨佳等[12]采用鱼蛋白胨、酵母浸粉、大豆蛋白胨3 种氮源进行复配,更换MRS培养基中的氮源,最终确定培养植物乳植杆菌NCU137的最优氮源为酵母浸粉,其次是大豆蛋白胨。优化后的培养基最终活菌数达到9.2×109 CFU/mL,是基础MRS培养基普通培养条件的3.67 倍。此外,研究人员通过实验比对分析得到,额外添加酵母膏作为氮源对高密度培养乳酸菌过程中提高生长速率的效果最好[13]。
因此可以说明,相较于单一种类的营养物质,2 种或多种营养物质复配使用可有效提高细胞密度。此外,对于特定的乳酸菌菌种来说存在最适宜其生长的营养物质类型。但对于复配碳源/氮源提高菌体密度的协作机制尚不清楚,具体如何协作、2 种或多种营养物质之间存在的联系都是研究人员需要额外探索的问题。
1.1.2 无机盐与生长因子
培养基中加入的无机盐主要起到缓冲作用,通过缓冲盐体系调节环境pH值,使其恒定在乳酸菌的适宜生长范围[13]。许多阳离子如Mg2+、Ca2+和Mn2+等可以促进酶的活性及转运结合能力,例如,Mn2+、Mg2+能显著提高格氏乳杆菌的最大比生长率,而Zn2+、Cu2+会抑制其生长[14]。
生长因子是指微生物自身不能合成、需要在培养基中额外加入的一类维持微生物正常生命活动的特殊物质,主要包括维生素类物质、核苷酸(嘌呤、嘧啶)和氨基酸等物质。乳酸菌通过分泌酶将促生长因子分解为基础营养物质,以此推动自身生长与代谢,主要分解途径有2 种:1)转运蛋白将促生长因子完整运入细胞,经胞内酶系进行糖酵解、磷酸化后利用;2)胞外酶先水解促生长因子,转运蛋白再将水解产物运入胞内二次水解或直接参与代谢。多数乳酸菌为嘌呤、嘧啶营养缺陷型,对脱氧核苷存在特殊需求[15]。研究[16]发现,乳球菌在嘌呤含量增加时,不仅生长能力显著提升,对多种胁迫的抗性也明显增强。Yao Chunxiao等[17]研究发现,VB5、VC和生物素这些生长因子是培养希腊乳杆菌过程中不可缺少的重要成分。Lü Xuepeng等[18]在研究嗜酸乳杆菌KLDS 1.0738细胞的生长过程中发现,培养体系中多种氨基酸被消耗,这些氨基酸保护了细胞免受低pH值环境的损伤。
培养基配方优化提高乳酸菌细胞密度的相关研究见表1。表中数据表明,传统培养基成分优化能有效提高菌体密度且不同研究的配方调整均呈现出良好的优化效果。
表1 培养基配方优化提高乳酸菌细胞密度的相关研究
Table 1 Recent studies on optimization of culture medium for high-density cultivation of lactic acid bacteria
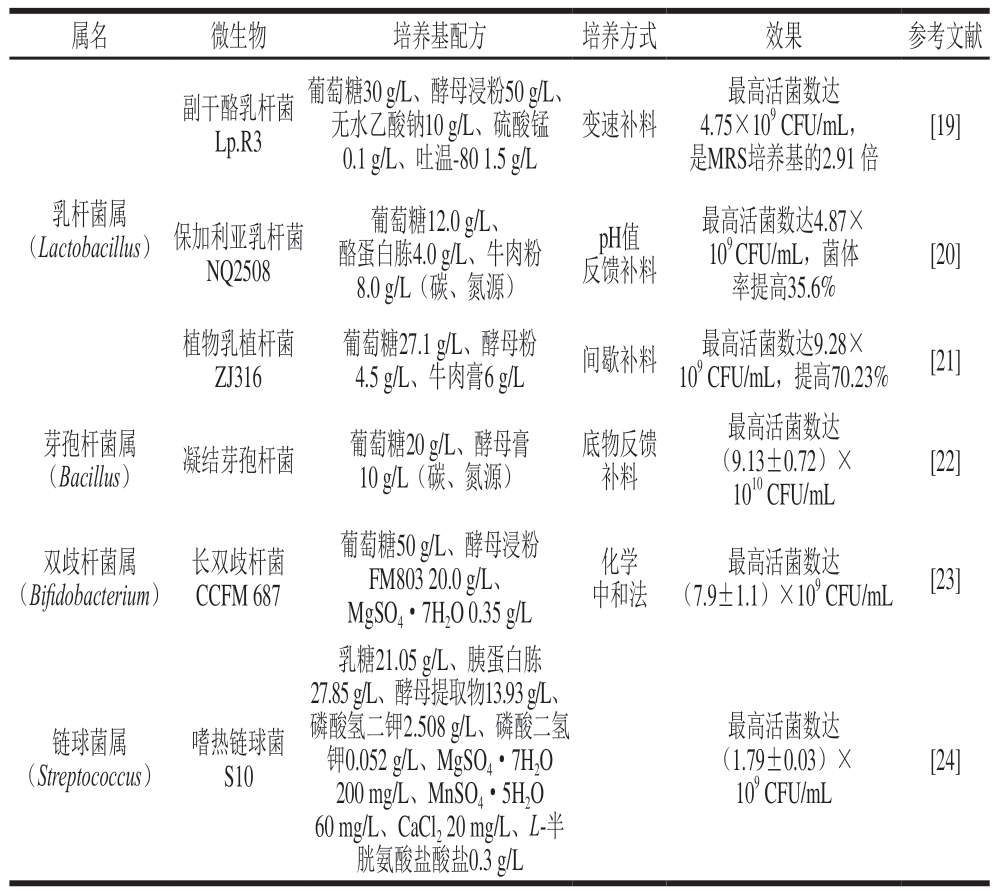
属名微生物培养基配方培养方式效果参考文献副干酪乳杆菌Lp.R30.1 g/L、吐温-80 1.5 g/L 是MRS培养基的2.91 倍5乳08杆菌酪蛋8.葡0白g萄胨/L糖(4.1 0碳2 g.、0/L g、氮/L牛源、肉)粉反p馈H补值料最10高9率 C活F提菌U高/数m 3L达5,.6 4%菌.87体×[20]植16杆菌葡4萄.5糖g/L 27、.1牛g/肉L、膏酵6 g母/L粉间歇补料109最C高FU活/m菌L,数提达高9.2 7 8 0×.23%[21]孢杆菌葡1萄0 g糖/L 2(0碳g/L、、氮酵源母)膏底物补反料馈(最9 1.0高1 13 0 活±C F菌0 U.7数/2 m)达L×[22]M杆68菌7葡M萄gF S糖M O5 8 4·00 3 g 7 /2 HL 0 2、.O0酵g 0/.L母3、5浸g/粉L中化和学法(7.9±最1.高1)活×菌1数09达CFU/mL[23]乳糖21.05 g/L、胰蛋白胨27.85 g/L、酵母提取物13.93 g/L、嗜热S链10球菌磷60钾酸 2 m0 0氢g.0胱0/二L5 m氨2、g钾g/酸L C/2 L、a.盐5、C 0 M l酸8 2M n 2 g盐g S 0/S OL 0mO、4.·3g 4· /磷g L 5/7、H L酸H 2 LO二2O-半氢(最1 1.0高7 99 C活±F菌0 U.0/数m3)达L×[24]葡萄糖30 g/L、酵母浸粉50 g/L、无水乙酸钠10 g/L、硫酸锰变速补料最高活菌数达4.75×109 CFU/mL,[19]乳杆菌属(Lactobacillus)保加利亚NQ2植物乳ZJ3(Bacillus)凝结芽芽孢杆菌属双歧杆菌属(Bifidobacterium)长双歧CCF链球菌属(Streptococcus)
1.2 现代发酵技术优化培养基配方
对于乳酸菌的传统培养基优化方法来说,单一采用响应面法虽有一定的优化价值,但该方法十分依赖专家经验或大量的基础实验支撑,并且可预测的变量有限,从而难以实现精准控制发酵条件,具有一定的局限性[25-26]。近年来,算法模型持续革新,相关理论内容也不断完善,强大的数据处理能力和广泛的应用场景受到越来越多的重视。研究人员已开始在响应面法的基础上使用AI技术开展培养基配方优化实验[27-28]。
1.2.1 AI技术在培养基配方优化中的应用
AI技术作为一个多学科交叉的领域,主要包括机器学习(machine learning,ML)、深度学习以及其他相关技术如人工神经网络(artificial neural network,ANN)、遗传算法(genetic algorithm,GA)、模糊逻辑(fuzzy logic,FL)等。截至目前,研究人员已将ANN和ML等技术应用于优化微生物的培养基配方,并取得了一系列的研究进展与成果。例如:Saini等[29]采用遗传算法耦合FL的方法优化蓝绿水藻培养基,成功将藻胆蛋白产量提高;杜稳等[30]利用反向传播神经网络耦合遗传算法的方法优化呕吐毒素降解菌发酵培养基,使生物量提高6.55%;Arab等[31]使用ANN-GA并结合ML优化G×N15砧木体外增殖矿物培养基,得到的培养基具有明显的促增殖作用。可以说明,AI技术适用于优化微生物培养基配方,相较于传统发酵,该方法对微生物的促生长效果更好。
1.2.2 AI技术在乳酸菌培养基配方优化中的应用
由于ML和ANN可以无限接近不同的复杂函数,处理许多传统手段无法预测的数据集。相较于响应面法,ML和ANN可能更适用于某些乳酸菌的培养基配方优化[32-33]。相关研究人员常利用培养基成分和浓度作为模型的输入参数,以菌体密度或生长量作为模型的输出值,进行模型的训练和验证。吴家琳等[34]在响应面法的基础上,借助ML的3 种不同算法(随机森林、深度神经网络和梯度提升决策树)分别构建植物乳植杆菌LP1Z高密度发酵培养基成分优化预测模型,通过Pearson相关系数及决定系数(R2)反映模型的预测性能,当Pearson相关系数绝对值及R2越接近1时,模型预测效能越好。结果表明,梯度提升决策树具有最优的预测效能(Pearson相关系数为0.96,R2为0.92,预测偏差最小,均方根误差为0.02)。依据梯度提升决策树模型预测的最优培养基成分进行实际实验,得到的菌体密度(OD600 nm)为1.61(预测值为1.62,相对误差0.13%),响应面法得到的最优培养基成分实际实验得到的菌体密度为1.59(预测值为1.57,相对误差1.19%)。可以说明,利用ML相关模型优化培养基配方后的菌体发酵密度优于响应面法所获得的菌体密度。赖长龙等[35]通过建立ANN和GA结合的智能模型(ANN-GA)对植物乳植杆菌的培养基成分进行优化。结果表明,植物乳植杆菌最优生物量预测值为11.02 g/L,在最优条件下实际实验得到的生物量为10.86 g/L,误差<2%。实验值与预测值十分接近,说明所训练的ANN-GA模型具有良好的预测和优化能力。在此基础上结合发酵动力学方程、最佳培养条件及间歇补料策略,得到最终菌体产量为12.64 g/L。验证实验根据预测的最优培养基成分结合最优培养条件进行,得到的验证结果和预测值进行数据分析和比对,以此评价预测模型是否可靠。图1路线图展示了构建菌体密度预测模型的2 种途径。
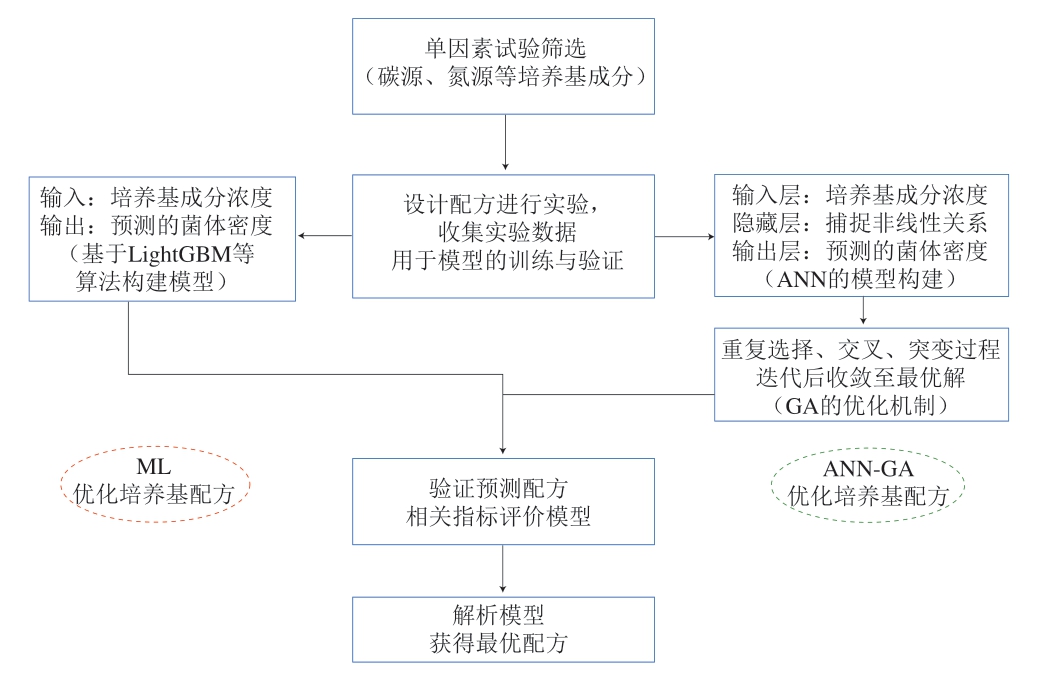
图1 ML与ANN-GA优化培养基配方路线图
Fig.1 Roadmap of ML and ANN-genetic algorithm optimization of culture medium formulation
上述研究均表明AI技术可以有效克服响应面法的不足,能够在响应面法的基础上进行深入优化。利用AI技术进行数据分析与建模可降低实验成本、缩短实验时间、挖掘数据潜在规律、提升配方优化效率。国内外学者对于乳酸菌的各种特性已进行了大量研究也取得了一系列成果,海量的数据集为AI技术在乳酸菌高密度发酵领域的应用提供了基础。现阶段,研究人员既要继续探索各种乳酸菌的发酵特性,也要利用现有的数据集不断开发和优化算法模型,以便后续培养基配方优化方案的不断更新和进步。
尽管ML和ANN等技术手段在培养基配方优化方面已取得重要成果,但仍存在诸多不足[36]。例如:培养基中的各种成分与检测的变量间存在复杂的非线性关系,需深入解析其相互作用机制;其次,不同种类的乳酸菌在生长和繁殖方面存在很大差异,因此需要个性化开发各种乳酸菌的适配算法模型,基础工作量巨大。
2 乳酸菌高密度培养条件优化
2.1 温度
温度主要以2 种相反的方式影响乳酸菌细胞生长。在一定的温度范围内,适当升高温度会提高酶的活性,细胞内的生化反应速率提高,细胞繁殖速率加快[37]。当温度升高到一定程度时,便会对细胞产生负面作用,细胞内的蛋白质、核酸和细胞组分会受到不可逆转的损害[38-39]。继续升高温度时,细胞功能将迅速衰退,造成大量细胞死亡。此外,大部分细胞内的生化反应为放能反应,伴随热量的释放,需要通过冷却等手段保持恒温发酵或者酌情考虑变温发酵[40]。左梦楠等[41]研究发现,37 ℃为发酵乳杆菌BLHN3的最佳生长温度。张静雯[42]在研究副干酪乳酪杆菌PC-01时对比32.5 ℃与37.0 ℃条件下菌株的生物特性,结果表明,菌株在32.5 ℃条件下具有更好的生长特性。说明不同种类的乳酸菌存在最适发酵温度,在该温度条件下菌株的生长特性最好。
2.2 pH值
乳酸菌高密度培养技术的一项关键难点在于pH值的控制,pH值是影响细胞生长和代谢产物生成的一项重要参数[43]。乳酸菌在生长过程中由于糖类代谢会产生乳酸等代谢产物,导致环境pH值不断降低,对细胞生长极其不利。为了克服低pH值环境对乳酸菌发酵的抑制作用,实验室常采用恒pH值发酵,即通过生物反应器中pH值的变化定时定量补入中和液,使pH值始终保持恒定。随着发酵设备的不断更新和完善,发酵罐装置连接计算机系统,当检测到pH值变化时即可自动补入准备好的中和液,如25%氨水[44]。该方法已普遍应用于乳酸菌的高密度培养[44-47]。
2.3 通气
大部分乳酸菌是厌氧菌,所以需要考虑发酵环境中气相这一变量。氧气对乳酸菌细胞的影响效果与温度和pH值存在差异,它可能会影响到乳酸菌的生长和代谢,所以需要降低环境中活性氧的浓度,才能提高乳酸菌的发酵活力[13]。研究[48]表明,乳酸菌在氮气等惰性气体的环境中生理活性、比生长速率、营养物质消耗速率和细胞存活率最高,发酵效果最佳,最大活菌数为1.8×1010 CFU/mL。因此,实验室中常利用氮气保压手段进行乳酸菌的高密度发酵[45,49]。
实验室中,传统的发酵罐装置配备相关温度电极、pH电极及溶氧电极等装置来进行变量的常规在线监测,这些技术已相对成熟,在应用过程中无明显短板,适用于绝大多数微生物发酵过程。伴随着生物制造行业的进步,除了上述电极之外,还出现了许多先进的在线传感设备,如在线光谱仪、在线活细胞传感仪、在线质谱仪及在线显微仪等装置,如图2所示。在线光谱仪(红外光谱、拉曼光谱)具有无需样品预处理、分析速度快和成本低的优点,但也存在应用过程中容易被其他信号干扰的固有缺点。在线活细胞传感仪可以实时监测实际活细胞数量,但对于浑浊体系的兼容性差。在线质谱仪可通过分析尾气进而分析微生物的代谢通路,但设备的造价昂贵,对操作人员的技术要求也高。在线显微仪可实时观察细胞形态、监测细胞形态变化,但单次监测通量低且需要人工判读分析结果。罗艳霞等[50]在培养嗜酸乳杆菌的过程中,使用在线活细胞传感仪测定的活细胞数量与离线平板活菌计数法得到的细胞数量具有很高的相关性(相关系数为0.994),相较于平板活菌计数法,该方法操作简便,不易受外界条件影响,精确性也较高。持续研发新型在线检测设备,提升传感器的精度与灵敏度,积极开发有价值的软传感器,均有助于监测乳酸菌的发酵过程。例如,在微生物发酵过程中,光密度可用于体现微生物浓度。依据这一原理,研究人员开发出一种搭载ANN模型的软传感器。该传感器能够应用于高通量微生物反应器,实现对光密度的实时估算,进而直接反映菌体浓度[51]。
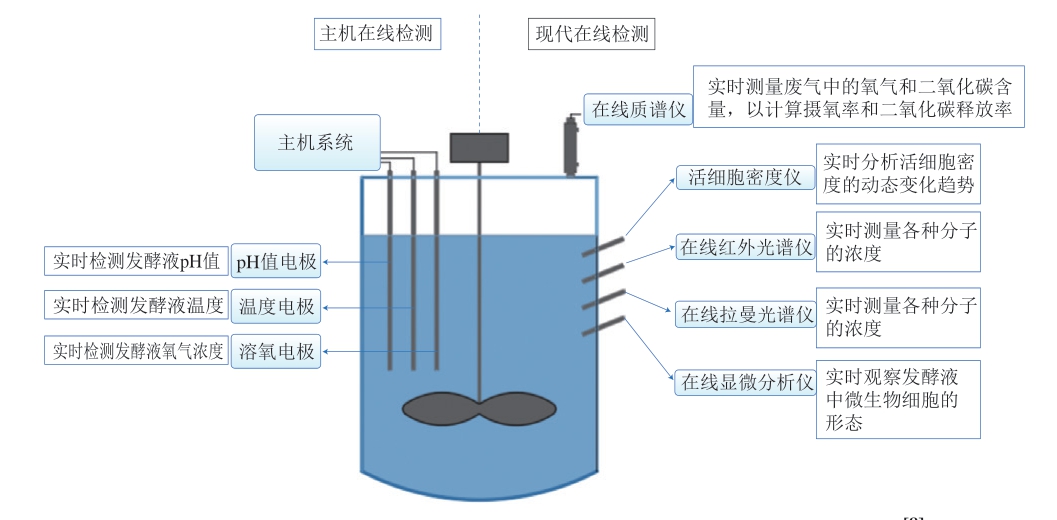
图2 发酵过程中传统检测与先进检测传感仪器示意图[8]
Fig.2 Schematic diagram of traditional and advanced detection sensing instruments in the fermentation process[8]
上述主要提到了3 种对乳酸菌发酵影响十分重要的环境因素。研究人员在探究最适生长条件的过程中常采用单因素试验进行优化,但由于培养环境中各种变量之间可能存在非线性关系,并且乳酸菌在不同条件下的代谢情况可能也不同,传统在线检测方法虽然采集了大量发酵数据,但是对这些数据的解读依然依赖专家的经验和预设参数,在面对复杂的发酵环境时仍存在一定的局限性[8]。随着AI、ML及ANN等技术不断应用于发酵领域,其中ANN技术在预测发酵参数方面已有相关研究。例如,Wang Yunshan等[52]提出ANN结合响应面法模型可用于分析发酵中的关键参数,在应对非线性且噪声干扰显著的微生物发酵过程中具有很强的适应性和可靠性。可以预见,这些新型在线检测设备及相关AI技术模型可能指导调控乳酸菌发酵过程中的关键参数,可为后续研究优化乳酸菌培养条件的研究人员提供参考。
3 乳酸菌的高密度培养方法
乳酸菌细胞进入衰亡期的主要原因之一是代谢物乳酸和少量乙酸、丙酸等不断积累,导致生长环境急剧变化,最终导致大量菌体死亡。为了克服代谢物对乳酸菌发酵的影响,除了化学中和法控制pH值这一手段之外,往往利用补料分批培养、透析培养等手段减缓代谢物带来的影响。表2汇总了常用于乳酸菌高密度培养的方法原理及优缺点。其中,补料分批培养方法普遍适用于乳酸菌的高密度培养[53]。
表2 乳酸菌高密度培养方法
Table 2 Methods for high-density cultivation of lactic acid bacteria
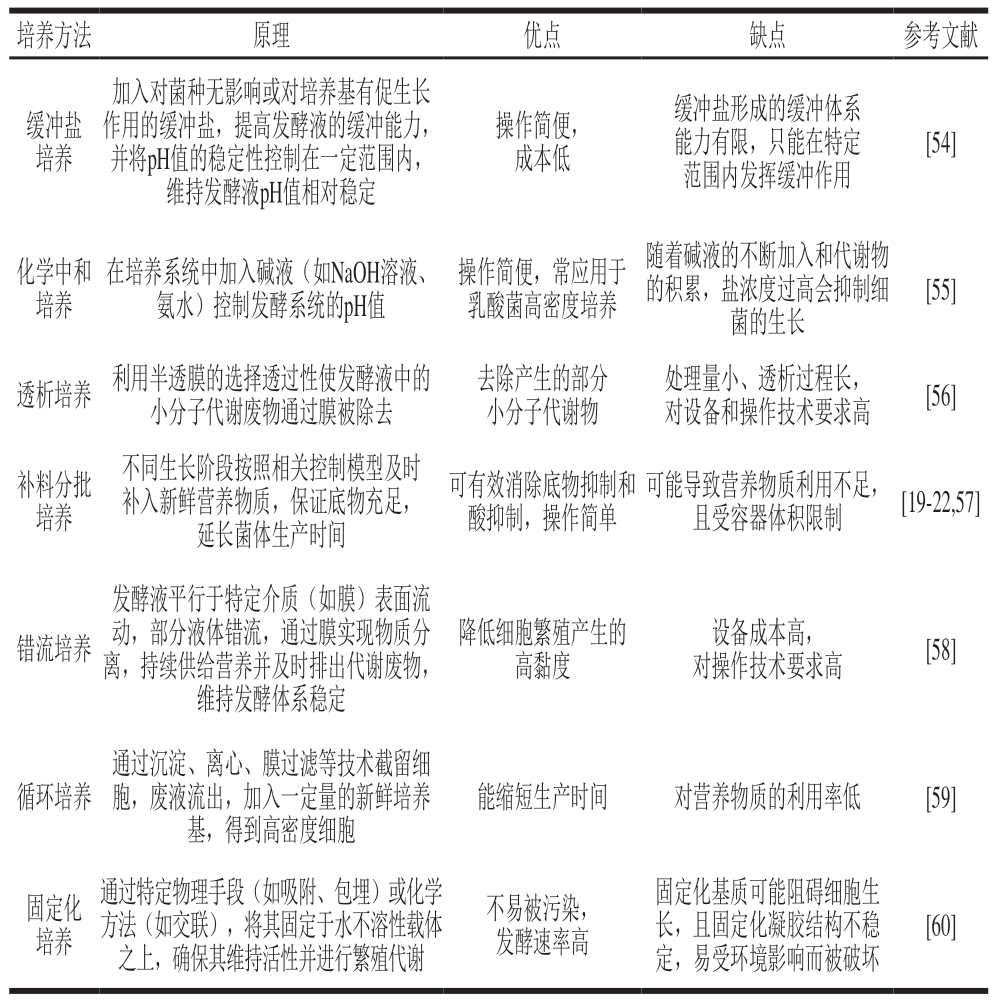
培养方法原理优点缺点参考文献缓冲盐培养加入对菌种无影响或对培养基有促生长作用的缓冲盐,提高发酵液的缓冲能力,并将pH值的稳定性控制在一定范围内,维持发酵液pH值相对稳定操作简便,成本低缓冲盐形成的缓冲体系能力有限,只能在特定范围内发挥缓冲作用[54]化学中和培养在培养系统中加入碱液(如NaOH溶液、氨水)控制发酵系统的pH值操作简便,常应用于乳酸菌高密度培养随着碱液的不断加入和代谢物的积累,盐浓度过高会抑制细菌的生长[55]透析培养 利用半透膜的选择透过性使发酵液中的小分子代谢废物通过膜被除去去除产生的部分小分子代谢物处理量小、透析过程长,对设备和操作技术要求高[56]补料分批培养不同生长阶段按照相关控制模型及时补入新鲜营养物质,保证底物充足,延长菌体生产时间可有效消除底物抑制和酸抑制,操作简单可能导致营养物质利用不足,且受容器体积限制[19-22,57]错流培养发酵液平行于特定介质(如膜)表面流动,部分液体错流,通过膜实现物质分离,持续供给营养并及时排出代谢废物,维持发酵体系稳定降低细胞繁殖产生的高黏度设备成本高,对操作技术要求高[58]循环培养通过沉淀、离心、膜过滤等技术截留细胞,废液流出,加入一定量的新鲜培养基,得到高密度细胞能缩短生产时间对营养物质的利用率低[59]固定化培养通过特定物理手段(如吸附、包埋)或化学方法(如交联),将其固定于水不溶性载体之上,确保其维持活性并进行繁殖代谢不易被污染,发酵速率高固定化基质可能阻碍细胞生长,且固定化凝胶结构不稳定,易受环境影响而被破坏[60]
3.1 传统补料分批培养策略
补料分批培养主要包括反馈补料和非反馈补料2 种方式。非反馈补料模型是以动力学模型为基础,通过预先设置好的参数进行一定量的补料,主要方式包括间歇补料、恒定补料和指数补料。反馈补料依据反应器中某一底物浓度、pH值或溶氧浓度(光密度)等指标的变化,通过建立相关模型或探究出微生物对营养物质的消耗规律来进行流加补料。常用的方式包括溶氧反馈补料、pH值反馈补料[61]。
近期,研究人员在pH-start法的基础上提出了pH值偶联营养物质补料策略。研究发现,某些菌株代谢时营养物质消耗速率和pH值变化速率成一定比例。孙东霞等[62]发现一些菌株厌氧发酵产的酸与代谢消耗的碳源成正比,所以可以同时向反应器中补入营养物质与一定比例的化学中和液,来稳定底物浓度和保持pH值恒定。季学猛等[63]利用pH值偶联营养物质补料策略实现补入碱的同时补入碳源高密度发酵双歧杆菌。陈晓岑等[64]发现保加利亚乳杆菌NQ2508对葡萄糖消耗速率与环境pH值下降速率成正比的特点,应用pH值偶联营养物质补料策略后活菌数达到3.6×109 CFU/mL,发酵产量提高144.9%。说明该策略适用于乳酸菌的高密度培养,既有效克服了pH值变化对乳酸菌细胞生长的不良影响,又及时补入营养物质来确保菌体的正常生长。但pH值偶联营养物质补料对于发酵设备要求高并且需要了解菌株的代谢特性,依然存在很大的研究空间。
表3汇总了常用于乳酸菌高密度培养的补料分批培养策略。
表3 常见乳酸菌补料分批培养策略
Table 3 Common fed-batch strategies of lactic acid bacteria

补料分批类型策略原理缺点参考文献间歇补料策略[21]非反馈补料在发酵过程中周期性检查并间歇性加入新鲜发酵培养基,保证反应器中底物浓度可以满足乳酸菌细胞的生长需求因需定期检查菌体生长情况及在不同阶段进行流加补料,意味着人工成本高;处于生长对数期的细胞会迅速消耗底物,底物缺乏情况可能出现在任何2 个测定间隔期间,一旦补料不及时则会影响细胞生长繁殖恒定补料策略从某一时间开始以恒定的流加速率向培养体系中流入新鲜培养液,保证底物充足由于微生物生长速率有显著差异,若恒定补料速率过低,可能会导致对数期的微生物生长受到抑制;若恒定补料速率过高,可能会导致底物积累,反过来抑制菌体生长[19]底物反馈补料策略需要严格控制底物浓度,使其不会对菌体生长产生抑制并且需要周期性检测底物浓度[22,65]反馈补料培养体系中相关底物浓度不断降低,以其中某一底物浓度的降低为变量进行反馈补料pH值反馈补料策略以环境pH值的变化为变量,根据pH值的变化情况估计营养物质的消耗程度,以此进行反馈补料需要配备高精度的pH值电极,对生物反应器的要求较高,没有在工厂生产中得到广泛使用[20]
3.2 现代技术补料分批培养策略
传统的乳酸菌补料分批培养策略常依赖经验或简单的反馈控制,难以精准匹配菌体生长和代谢的动态需求。而AI模型能够整合多维度数据,深度挖掘其中复杂的非线性关系。ANN及ML等技术在微生物细胞发酵领域具有绝对的优越性,其相应的预测模型可以指导优化补料分批培养策略。已有研究采用ML辅助隔室模型在有限的数据条件下对补料分批培养进行快速建模[66],从而可以进一步分析培养过程中细胞生长速率的变化趋势。Sorensen等[67]在指数补料策略的基础上利用ANN进行建模,通过动态调整补料速率维持鼠李糖乳杆菌的生长。该研究中细胞生长速率的设定值为0.19 h-1,实际维持0.13 h-1,表明ANN驱动的补料控制比传统的补料分批培养更加精准。研究人员在优化培养基和培养条件的基础上,还可利用ANN、ML等技术手段进一步优化其补料分批培养方式,实现现代发酵技术优化乳酸菌细胞的高密度培养。
4 结 语
传统乳酸菌高密度培养技术凭借其成熟的操作体系与低成本优势,在食品发酵和益生菌生产中发挥了重要作用。然而,其依赖人工经验与离线分析的局限性日益凸显,表现为调控滞后、效率低下及代谢抑制难以精准预测等问题,难以满足现代发酵对智能化和精准化的需求。AI技术如ANN、ML通过解析发酵参数间的复杂非线性关系,构建动态预测模型,显著优化了培养基配方与补料策略。大量实验成果也证明,AI技术的应用可以克服传统手段高密度培养乳酸菌的局限性。高精度在线检测设备(光谱仪、活细胞传感仪)的革新实现了对pH值、代谢物浓度等关键参数的实时追踪,为动态调控提供了可靠数据支撑。本文系统归纳了国内外学者在乳酸菌培养中应用AI技术模型和先进硬件设备的研究成果,从培养基优化、培养条件调控及补料分批策略三方面展开分析。这些研究成果不仅为乳酸菌培养提供了理论参考,其采用的优化路线与研究方法也可为后续研究提供理论依据。在此基础上,研究人员可进一步整合培养基优化、补料策略调整,结合先进监测设备与传感技术,开展更为全面的乳酸菌高密度培养优化研究。尽管AI技术在发酵领域展现出巨大潜力,但仍存在许多不足,例如:发酵数据的获取与质量是棘手问题;其次,如何采用AI技术构建和训练发酵模型也是一大难题。在未来,随着科技的持续进步和相关技术的不断成熟,AI技术与生物制造行业紧密联系、深度融合,这一趋势必将推动乳酸菌高密度培养迈向智能化与高效化的全新阶段,实现跨越式发展。使乳酸菌在发酵行业与功能性食品等关键领域发挥更大的作用,加快高活性益生菌及功能代谢产物的规模化生产进程。
[1] WANG Y Q, WU J T, LÜ M X, et al.Metabolism characteristics of lactic acid bacteria and the expanding applications in food industry[J].Frontiers in Bioengineering and Biotechnology, 2021, 9: 612285.DOI:10.3389/fbioe.2021.612285.
[2] 张素平, 林晓颖, 徐明超, 等.棒状腐败乳杆菌Lc7的生物学特性及益生作用[J].微生物学报, 2023, 63(1): 319-332.DOI:10.13343/j.cnki.wsxb.20220318.
[3] MATHUR H, BERESFORD T P, COTTER P D.Health benefits of lactic acid bacteria (LAB) fermentates[J].Nutrients, 2020, 12(6): 1679.DOI:10.3390/nu12061679.
[4] YUE Y, HE Z J, ZHOU Y H, et al.Lactobacillus plantarum relieves diarrhea caused by enterotoxin-producing Escherichia coli through inflammation modulation and gut microbiota regulation[J].Food &Function, 2020, 11(12): 10362-10374.DOI:10.1039/d0fo02670k.
[5] LIU Z J, ZHAO J L, SUN R B, et al.Lactobacillus plantarum 23-1 improves intestinal inflammation and barrier function through the TLR4/NF-κB signaling pathway in obese mice[J].Food & Function,2022, 13(11): 5971-5986.DOI:10.1039/d1fo04316a.
[6] WANG Y, XING X Y, MA Y X, et al.Prevention of high-fat-dietinduced dyslipidemia by Lactobacillus plantarum LP104 through mediating bile acid enterohepatic axis circulation and intestinal flora[J].Journal of Agricultural and Food Chemistry, 2023, 71(19):7334-7347.DOI:10.1021/acs.jafc.2c09151.
[7] 左肖肖, 陆利霞, 李壹, 等.微生物高密度培养策略[J].生物加工过程, 2016, 14(3): 81-86.
[8] 夏建业, 龙东娇, 陈敏, 等.智能生物制造之发酵过程优化: 在线检测、人工智能与数字孪生技术[J].生物工程学报, 2024, 40(5):1001-1021.DOI:10.13345/j.cjb.250032.
[9] 李玉娥, 马玲.乳酸菌高密度培养条件优化研究[J].中国酿造, 2021,40(9): 150-154.
[10] FAN X N, LI Y M, ZHU S N, et al.Role of surfactant in affecting photo-fermentative bio-hydrogen production performance from corncob[J].Bioresource Technology, 2021, 333: 125173.DOI:10.1016/j.biortech.2021.125173.
[11] SU X, MENGHE B, ZHANG H P, et al. In vitro evaluation of intestinal transport and high-density fermentation of Lactobacillus acidophilus[J].Metabolites, 2023, 13(10): 1077.DOI:10.3390/metabo13101077.
[12] 孙雨佳, 黄辉, 刘长根, 等.植物乳杆菌NCU137培养基成分与培养条件的优化[J].中国食品学报, 2022, 22(8): 223-233.DOI:10.16429/j.1009-7848.2022.08.025.
[13] 左梦楠, 刘伟, 全琦, 等.乳酸菌高密度培养技术的研究进展[J].食品工业科技, 2022, 43(19): 436-445.DOI:10.13386/j.issn1002-0306.2021090289.
[14] 郭艳荣.格氏乳杆菌体外筛选及高密度培养工艺研究[D].呼和浩特:内蒙古农业大学, 2020.DOI:10.27229/d.cnki.gnmnu.2020.000948.
[15] 欧阳佳, 王钰, 吴广, 等.乳酸菌促生长因子的研究[J].激光生物学报, 2021, 30(2): 110-116.
[16] RYSSEL M, HVIID A-M M, DAWISH M S, et al.Multi-stress resistance in Lactococcus lactis is actually escape from purineinduced stress sensitivity[J].Microbiology, 2014, 160: 2551-2559.DOI:10.1099/mic.0.082586-0.
[17] YAO C X, CHOU J D, WANG T, et al.Pantothenic acid, vitamin C,and biotin play important roles in the growth of Lactobacillus helveticus[J].Frontiers in Microbiology, 2018, 9: 1194.DOI:10.3389/fmicb.2018.01194.
[18] LÜ X P, LIU G F, SUN X M, et al.Nutrient consumption patterns of Lactobacillus acidophilus KLDS 1.0738 in controlled pH batch fermentations[J].Journal of Dairy Science, 2017, 100(7): 5188-5194.DOI:10.3168/jds.2017-12607.
[19] 方诗会, 熊尧, 张召, 等.副干酪乳杆菌Lp.R3的高密度培养工艺优化[J].食品工业科技, 2024, 45(10): 100-114.DOI:10.13386/j.issn1002-0306.2024060197.
[20] 陈晓岑.保加利亚乳杆菌NQ2508的高密度培养与冷冻干燥保护研究[D].无锡: 江南大学, 2023.DOI:10.27169/d.cnki.gwqgu.2023.000419.
[21] 陈百莹, 郑苗, 邓泽元, 等.植物乳杆菌ZJ316培养基优化和高密度培养的研究[J].中国食品学报, 2020, 20(7): 65-74.DOI:10.16429/j.1009-7848.2020.07.009.
[22] 徐鹏.凝结芽孢杆菌高密度培养及其活菌片的制备[D].南宁: 广西大学, 2020.DOI:10.27034/d.cnki.ggxiu.2020.002723.
[23] 高欣伟, 崔树茂, 唐鑫, 等.长双歧杆菌的最适底物解析和高密度发酵工艺优化[J].食品与发酵工业, 2021, 47(19): 12-20.DOI:10.13995/j.cnki.11-1802/ts.025681.
[24] 宗晓婕.嗜热链球菌S10培养基优化及培养温度对菌体生物量和活性的影响[D].呼和浩特: 内蒙古农业大学, 2023.DOI:10.27229/d.cnki.gnmnu.2023.000699.
[25] HUANG J C, GUO Q, LI X H, et al.A comprehensive review on the application of neural network model in microbial fermentation[J].Bioresource Technology, 2025, 416: 131801.DOI:10.1016/j.biortech.2024.131801.
[26] YANG T, LAI H K, CAO Z M, et al.Comparison of an artificial neural network and a response surface model during the extraction of seleniumcontaining protein from selenium-enriched Brassica napus L.[J].Foods, 2022, 11(23): 3823.DOI:10.3390/foods11233823.
[27] KUMAR R, DHANARAJAN G, SARKAR D, et al.Multi-fold enhancement in sustainable production of biomass, lipids and biodiesel from oleaginous yeast: an artificial neural network-genetic algorithm approach[J].Sustainable Energy & Fuels, 2020, 4(12): 6075-6084.DOI:10.1039/d0se00922a.
[28] BEZERRA C O, CARNEIRO L L, CARVALHO E A, et al.Artificial intelligence as a combinatorial optimization strategy for cellulase production by Trichoderma stromaticum AM7 using peach-palm waste under solid-state fermentation[J].Bioenergy Research, 2021, 14(4):1161-1170.DOI:10.1007/s12155-020-10234-4.
[29] SAINI D K, YADAV D, PABBI S, et al.Phycobiliproteins from Anabaena variabilis CCC421 and its production enhancement strategies using combinatory evolutionary algorithm approach[J].Bioresource Technology, 2020, 309: 123347.DOI:10.1016/j.biortech.2020.123347.
[30] 杜稳, 孙晶, 赵一凡, 等.BP神经网络耦合遗传算法优化呕吐毒素降解菌发酵培养基[J].饲料工业, 2023, 44(1): 95-101.DOI:10.13302/j.cnki.fi.2023.01.014.
[31] ARAB M M, YADOLLAHI A, SHOJAEIYAN A, et al.Artificial neural network genetic algorithm as powerful tool to predict and optimize in vitro proliferation mineral medium for G × N15 rootstock[J].Frontiers in Plant Science, 2016, 7: 1526.DOI:10.3389/fpls.2016.01526.
[32] GREENER J G, KANDATHIL S M, MOFFAT L, et al.A guide to machine learning for biologists[J].Nature Reviews Molecular Cell Biology, 2022, 23(1): 40-55.DOI:10.1038/s41580-021-00407-0.
[33] AMEER K, AMEER S, KIM Y M, et al.A hybrid RSM-ANN-GA approach on optimization of ultrasound-assisted extraction conditions for bioactive component-rich Stevia rebaudiana (Bertoni) leaves extract[J].Foods, 2022, 11(6): 883.DOI:10.3390/foods11060883.
[34] 吴家琳, 李滢, 王涓, 等.基于机器学习的植物乳杆菌LP1Z高密度发酵培养基优化[J].现代食品科技, 2025, 41(4): 131-140.DOI:10.13982/j.mfst.1673-9078.2025.4.0312.
[35] 赖长龙, 曹余, 杨玉, 等.植物乳杆菌发酵动力学及高密度培养研究[J].食品与发酵工业, 2022, 48(20): 137-144.DOI:10.13995/j.cnki.11-1802/ts.030356.
[36] ANTONAKOUDIS A, BARBOSA R, KOTIDIS P, et al.The era of big data: genome-scale modelling meets machine learning[J].Computational and Structural Biotechnology Journal, 2020, 18: 3287-300.DOI:10.1016/j.csbj.2020.10.011.
[37] KNAPP B D, HUANG K C.The effects of temperature on cellular physiology[J].Annual Review of Biophysics, 2022, 51: 499-526.DOI:10.1146/annurev-biophys-112221-074832.
[38] SREEDHARAN D K, ABBASILIASI S, MOHAMED M S, et al.Fermentation strategies for improving the production of bacteriocinlike inhibitory substances by Lactobacillus brevis C23 with nutrient supplementation, pH, and temperature variations[J].Journal of Food Processing and Preservation, 2021, 45(11): e15914.DOI:10.1111/jfpp.15914.
[39] DE LA ROSA F, PEZZONI M, DE TROCH M, et al.Effects of temperature up-shift and UV-A radiation on fatty acids content and expression of desaturase genes in cyanobacteria Microcystis aeruginosa: stress tolerance and acclimation responses[J].Photochemical & Photobiological Sciences, 2024, 23(6): 1167-1178.DOI:10.1007/s43630-024-00584-9.
[40] 彭奎耀, 关成冉, 瓦云超, 等.嗜热链球菌grx02化学限定增殖培养基及变温培养策略的研究[J].中国乳品工业, 2024, 52(2): 5-11; 9.DOI:10.19827/j.issn1001-2230.2024.02.00.
[41] 左梦楠, 刘伟, 张菊华, 等.发酵乳杆菌BLHN3的高密度培养优化[J].食品与机械, 2022, 38(12): 181-189.DOI:10.13652/j.spjx.1003.5788.2022.80588.
[42] 张静雯.温度对副干酪乳酪杆菌高密度培养过程中生长特性的影响机制[D].呼和浩特: 内蒙古农业大学, 2023.DOI:10.27229/d.cnki.gnmnu.2023.000695.
[43] ZHU B F, XU Y.Production of tetramethylpyrazine by batch culture of Bacillus subtilis with optimal pH control strategy[J].Journal of Industrial Microbiology & Biotechnology, 2010, 37(8): 815-821.DOI:10.1007/s10295-010-0726-5.
[44] 王振东.乳酸片球菌I M A U 9 4 3 8 8 的高密度培养研究[D].呼和浩特: 内蒙古农业大学, 2020.DOI:10.27229/d.cnki.gnmnu.2020.000437.
[45] 陈园园.德氏乳杆菌保加利亚亚种QH38-1高密度发酵工艺的优化[D].呼和浩特: 内蒙古农业大学, 2023.DOI:10.27229/d.cnki.gnmnu.2023.001245.
[46] 冯志伟.Pediococcus acidilactici IMAU95219增殖培养基及高密度培养工艺优化[D].呼和浩特: 内蒙古农业大学, 2020.DOI:10.27229/d.cnki.gnmnu.2020.000396.
[47] 苏馨.嗜酸乳杆菌的体外筛选及优良菌株的高密度发酵研究[D].呼和浩特: 内蒙古农业大学, 2021.DOI:10.27229/d.cnki.gnmnu.2021.000716.
[48] 张瑶, 李啸, 潘冬瑞, 等.植物乳杆菌高密度培养通气条件的研究[J].中国酿造, 2013, 32(9): 123-126.
[49] 刘乔.Lactobacillus helveticus IMAU60208高密度发酵工艺研究[D].呼和浩特: 内蒙古农业大学, 2016.
[50] 罗艳霞, 黄明志, 郭元昕, 等.活细胞传感仪在嗜酸乳酸杆菌培养过程中的应用[J].食品工业科技, 2012, 33(21): 152-155; 159.DOI:10.13386/j.issn1002-0306.2012.21.041.
[51] MEDL M, RAJAMANICKAM V, STRIEDNER G, et al.Development and validation of an artificial neural-network-based optical density soft sensor for a high-throughput fermentation system[J].Processes, 2023,11(1): 297.DOI:10.3390/pr11010297.
[52] WANG Y S, YANG G, SAGE V, et al.Optimization of dark fermentation for biohydrogen production using a hybrid artificial neural network (ANN) and response surface methodology (RSM)approach[J].Environmental Progress & Sustainable Energy, 2021,40(1): e13485.DOI:10.1002/ep.13485.
[53] LU Y, XING S Q, HE L P, et al.Characterization, high-density fermentation, and the production of a directed vat set starter of lactobacilli used in the food industry: a review[J].Foods, 2022, 11(19):3063.DOI:10.3390/foods11193063.
[54] E J J, MA L L, CHEN Z C, et al.Effects of buffer salts on the freezedrying survival rate of Lactobacillus plantarum LIP-1 based on transcriptome and proteome analyses[J].Food Chemistry, 2020, 326:126849.DOI:10.1016/j.foodchem.2020.126849.
[55] SINGHVI M, ZENDO T, SONOMOTO K.Free lactic acid production under acidic conditions by lactic acid bacteria strains: challenges and future prospects[J].Applied Microbiology and Biotechnology, 2018,102(14): 5911-5924.DOI:10.1007/s00253-018-9092-4.
[56] BAEHR C, LEUCHTLE B, LEHMANN C, et al.Dialysis shake flask for effective screening in fed-batch mode[J].Biochemical Engineering Journal, 2012, 69: 182-195.DOI:10.1016/j.bej.2012.08.012.
[57] KAWAI M, TSUCHIYA A, ISHIDA J, et al.Suppression of lactate production in fed-batch culture of some lactic acid bacteria with sucrose as the carbon source[J].Journal of Bioscience and Bioengineering, 2020, 129(5): 535-540.DOI:10.1016/j.jbiosc.2019.11.009.
[58] ZHAO L H B, TANG Z Y, GU Y, et al.Investigate the cross-flow flat-plate photobioreactor for high-density culture of microalgae[J].Asia-Pacific Journal of Chemical Engineering, 2018, 13(5): e2247.DOI:10.1002/apj.2247.
[59] CHEN P T, HONG Z S, CHENG C L, et al.Exploring fermentation strategies for enhanced lactic acid production with polyvinyl alcohol-immobilized Lactobacillus plantarum 23 using microalgae as feedstock[J].Bioresource Technology, 2020, 308: 123266.DOI:10.1016/j.biortech.2020.123266.
[60] 冯雷雨, 袁飞怡, 刘峰, 等.餐厨垃圾发酵产乳酸研究进展[J].同济大学学报(自然科学版), 2021, 49(12): 1688-1700.
[61] 连战, 李天罡, 王松江, 等.L-精氨酸发酵过程控制研究[J].食品与发酵科技, 2024, 60(4): 41-45; 103.
[62] 孙东霞, 周子安, 冯志合, 等.pH值调控柠檬酸污泥厌氧发酵产酸及碳源潜力研究[J].中国环境科学, 2022, 42(11): 5198-5207.DOI:10.19674/j.cnki.issn1000-6923.20220620.001.
[63] 季学猛, 王硕.双歧杆菌高密度培养的补料培养基及补料方法[J].实验室科学, 2024, 27(4): 28-31.
[64] 陈晓岑, 徐岩, 刘彦民, 等.基于pH下降速率的反馈补料策略高密度培养保加利亚乳杆菌NQ2508[J].食品与发酵工业, 2024, 50(5):7-13.DOI:10.13995/j.cnki.11-1802/ts.035581.
[65] 徐小芳.副干酪乳杆菌高密度发酵和冷冻干燥工艺研究[D].武汉:华中农业大学, 2024.DOI:10.27158/d.cnki.ghznu.2024.001554.
[66] DE LEON H M, STRAATHOF A, HARINGA C.Dynamic compartment models: towards a rapid modeling approach for fed-batch fermentations[J].Chemical Engineering Science, 2025, 308: 121396.DOI:10.1016/j.ces.2025.121396.
[67] SORENSEN H M, CUNNINGHAM D, BALAKRISHNAN R, et al.Steps toward a digital twin for functional food production with increased health benefits[J].Current Research in Food Science, 2023,7: 100593.DOI:10.1016/j.crfs.2023.100593.