生鲜牛肉肠是由新鲜或冷冻牛肉(或两者的混合物)制成的肉制品,根据法规可添加调味物质[1]。由于生鲜肉类富含营养物质,容易因受到微生物污染而迅速腐败[2]。在肉类贮藏和运输过程中,微生物能够利用碳水化合物、蛋白质和脂肪等营养物质进行代谢,产生氨、硫化物、酮类、醛类等代谢产物[3]。某些细菌的代谢活动会对牛肉的感官特性(如气味、颜色、触感等)产生显著影响,导致异味、变色、黏液和腐败现象的产生[4]。此外,某些细菌在特定的贮藏条件下生长代谢速率较快,能够在肉制品的腐败过程中占据主导地位,进一步加剧腐败现象[5]。
许多研究者分析了肉类腐败过程中的微生物群落,然而,他们更关注微生物的相对丰度而不是致腐强度。在Wen Xiangyuan等[6]的研究中,假单胞菌属的相对丰度在有氧包装羔羊肉中占据优势地位,而乳酸菌属和乳球菌属则在真空包装羔羊肉中占据优势地位。在Yang Jun等[3]的研究中,假单胞菌属、热死环丝菌、肠杆菌和乳酸菌是气调包装冰鲜牛排的优势菌群。还有些研究者将肉制品腐败期间占据优势地位的细菌视为优势腐败菌,例如,付丽等[7]将假单胞菌、热死环丝菌和乳酸菌视为保鲜盒包装冷鲜牛肉的优势腐败菌;张秀凤等[8]将乳酸菌、热死环丝菌和肠杆菌视为冷鲜牛肉的优势腐败菌。
随着肉类腐败研究逐渐深入,研究者们意识到仅依靠相对丰度判定腐败菌存在局限性,应进一步关注菌株在模拟体系中的致腐潜力和在原位体系中的致腐强度。按致腐强度界定,优势腐败菌指能在肉类体系中引发异味、变色、黏液等明显腐败现象的细菌,其在肉类环境中活菌数量较多,但并非最多[9]。除采用产气、产黏液、产异味等定性手段分析外,部分研究者还通过定量测定微生物的腐败代谢物生成量评估腐败菌的致腐能力。挥发性盐基氮是细菌产生的重要腐败代谢物,崔跃慧[10]曾通过对总挥发性盐基氮(total volatile basic nitrogen,TVB-N)产量因子的定量分析评估调理猪肉饼的腐败菌——清酒乳杆菌、哈夫尼菌的原位致腐潜力。顾春涛等[11]探究冷鲜牛肉中的腐败菌,包括假单胞菌、热死环丝菌和蜂房哈夫尼菌在牛肉汁中的致腐潜力,但需注意,牛肉汁仅是一种近似牛肉成分的营养体系,与实际牛肉存在差异。当前,针对生鲜牛肉肠的研究大多聚焦于配方改良方面[12-13],极少有研究着眼于生鲜牛肉肠腐败菌的致腐能力及其评价,该方向研究存在明显不足。本研究旨在通过模拟体系初筛和原位致腐评价分析生鲜牛肉肠腐败菌的致腐特性,为控制生鲜牛肉肠的腐败提供依据。需要说明的是,因微生物受肉品加工环境、地域等影响,本研究结论基于特定样品,可作为研究参考。
1 材料与方法
1.1 材料与试剂
牛后腿肉和胸口油取自中国本土黄牛(18 月龄,草饲,公),购自安徽荷金来农业发展股份有限公司。将其放置在装有冰袋的保温箱内,以低温运输的方式送至实验室。
胶原蛋白肠衣 广西神冠胶原生物集团有限公司;聚乙烯保鲜膜(水蒸气透过率(65±13)g/(100 m2·24 h)、O2透过率(15 344.0±3 068.8)cm3/(m2·24 h)、CO2透过率(69 837.0±13 967.4)cm3/(m2·24 h))新利得塑胶工业(江苏)有限公司。
营养肉汤、营养琼脂、平板计数琼脂(plate count agar,PCA)培养基、MRS(de Man Rogosa Sharpe,MRS)培养基 广东环凯微生物科技有限公司;结晶紫中性红胆盐葡萄糖琼脂(violet red bile glucose agar,VRBGA)培养基、CFC(cephaloridine fucidin cetrimide)培养基、STAA(streptomycin thallous acetate actidione)培养基 青岛海博生物科技有限公司;琼脂、胰蛋白、酵母提取物 北京兰杰柯科技有限公司;明胶(250 冻力) 上海麦克林生化科技有限公司;其余试剂购自国药集团化学试剂(上海)有限公司。
牛肉汁培养基的制备:牛肉用0.1 mol/L磷酸盐缓冲液(pH 6.2)按1∶80(g/mL)比例匀浆,然后用纱布过滤,按照每管10 mL分装至不同试管;牛肉汁琼脂培养基的制备:上述纱布过滤得到的匀浆与15 g/L琼脂混合以制备培养基;上述2 种培养基在安徽束能辐照科技有限公司以12 kGy剂量的电子束辐照灭菌[14-15]。
1.2 仪器与设备
AlphaClean 1300洁净工作台 上海力康精密科技有限公司;BSD-250振荡培养箱 上海博迅实业有限公司;Scientz-09无菌均质机 宁波新芝生物科技股份有限公司;FiveEasy Plus pH计 梅特勒-托利多国际贸易有限公司;K980凯氏定氮仪 海能未来技术集团股份有限公司;AUX HX-J330绞肉机 佛山市海迅电器有限公司;Power Basic电泳仪 上海伯乐生命医学产品有限公司;1600凝胶成像仪 上海天能科技有限公司。
1.3 方法
1.3.1 生鲜牛肉肠的制备
将牛后腿肉和胸口油用3 mm孔径的绞肉机切碎。参考Bumsted等[12]的配方,生鲜牛肉肠的瘦肥比为8∶2(m/m)。向绞碎的后腿肉和脂肪中加入2%(以肉质量计)食盐,混匀,然后立即将混合物填充到直径28 mm的胶原蛋白肠衣中,每根生鲜肠的质量约100 g。将灌好的生鲜肠放在304不锈钢托盘中(长26.5 cm、宽19.5 cm、深4.8 cm),用聚乙烯保鲜膜覆盖托盘,置于(6±2)℃环境中冷藏,分别于第0、2、4、6、8、10天取样,测定微生物及理化指标。
1.3.2 生鲜牛肉肠中腐败菌的分离纯化
参考GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[16]中的样品处理方法,针对冷藏至腐败终点(冷藏第10天)的生鲜牛肉肠样品中的微生物进行选择性培养(CFC、STAA培养基:25 ℃、48 h;PCA、MRS、VRBGA培养基:37 ℃、48 h),挑取选择性培养基上长势较好的典型菌落,反复进行平板划线分离、革兰氏染色、镜检,得到纯化单菌落,转接于营养琼脂斜面保存备用。
1.3.3 腐败菌的初筛
1.3.3.1 产气实验
在每支试管内装入5 mL营养肉汤并倒置一根杜伦管,121 ℃灭菌15 min。待冷却至室温且杜伦管内气体排尽后,每管接入10 μL经2 代活化的菌株,25 ℃静置培养72 h,期间每12 h观察产气情况[17]。
1.3.3.2 产黏实验
各分离菌株于25 ℃条件下,在营养肉汤中活化2 代,接着按1%比例稀释至无菌营养肉汤。取2 μL稀释后的均匀菌液,接种于PCA培养基中央,25 ℃培养72 h。培养结束,用接种环挑取菌落,观察是否产生黏液[18]。
1.3.3.3 产异味实验
各菌株在营养肉汤中活化2 代后,取10 μL菌液加入10 mL牛肉汁培养基,于25 ℃振荡培养2 d,每日进行菌落计数。每日从培养基取3 mL菌液置于离心管,按无异味、弱异味、强异味标准[19]评估异味产生情况。
1.3.3.4 牛肉蛋白水解活性测定
用生理盐水将活化2 代后的菌液稀释至600 nm处的光密度约为0.40,取2 μL细菌稀释液接种在牛肉汁琼脂培养基上,并于25 ℃培养3~5 d,用游标卡尺测量水解区直径[14],以评估菌株对牛肉蛋白的水解活性。
1.3.3.5 脂肪水解活性测定
取1.3.3.4节中的稀释菌液2 μL,接种到添加10 g/L三油酸甘油酯的营养琼脂平板上,并在25 ℃下培养1~10 d。通过测量水解区直径评估菌株的脂肪分解活性[15]。
1.3.3.6 胶原蛋白降解活性测定
胶原蛋白固体培养基由4 g/L蛋白胨、1 g/L酵母提取物、15 g/L琼脂和20 g/L明胶组成。取1.3.3.4节中的稀释菌液2 μL,接种在固体培养基中央。25 ℃培养48 h后,通过测定水解圈直径评估菌株的胶原酶活性[20]。
1.3.4 菌株的分子鉴定
参考李雪菲等[21]的方法对初步筛选得到的腐败菌进行16S rDNA分子鉴定和系统发育树分析。
1.3.5 菌株在牛肉糜体系的致腐能力评价
将活化后的菌株在营养肉汤中稀释至浓度约105 CFU/mL。参照生鲜牛肉肠配方,将牛后腿肉用3 mm孔径的绞肉机切碎,加入2%食盐(以肉质量计)混合,之后由安徽束能辐照科技有限公司采用8 kGy电子束辐照对牛肉糜进行灭菌,确保菌落总数(total viable count,TVC)无法被检出。将稀释后的菌液按1%接种量接种至辐照灭菌后的牛肉糜,使最终细菌含量约为103 CFU/g(以肉质量计),对照组以等体积无菌营养肉汤替代菌液。将各实验组样品均放置在直径15 cm的无菌培养皿中,于(6±2)℃下贮藏,分别于第0、2、4、6、8天取样,测定微生物及理化指标。
1.3.5.1 菌落计数
参照Xiao Yaqing等[22]的方法,在无菌环境下,将10 g牛肉糜样品和90 mL 0.9 g/100 mL NaCl溶液置于无菌均质袋中,用无菌均质机均质2 min,制成1∶10的样品稀释液。随后取1 mL稀释液,加入装有9 mL 0.9 g/100 mL NaCl溶液的试管中,制成1∶100的样品稀释液,以此类推。选择3 个合适稀释梯度的样品稀释液,每个梯度取0.1 mL匀浆涂布于PCA培养基上,每个稀释梯度制备3 个平行样品。测定TVC。
1.3.5.2 pH值的测定
参考Liu Mengyuan等[23]的方法,向10 g牛肉糜样品中加入90 mL 0.9 g/100 mL NaCl溶液,均质2 min,过滤后收集滤液。使用配有自动温度补偿和玻璃电极且已校准的数字pH计测定并记录滤液pH值。
1.3.5.3 TVB-N含量的测定
参考GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》[24]中的方法,将10 g牛肉糜样品与100 mL蒸馏水混合,超声(100 W)处理15 min后过滤。取10 mL滤液置于蒸馏管,加入10 mL 10 g/L MgO溶液。凯氏定氮仪参数设置:硼酸25 mL,稀释水10 mL,碱液0 mL,蒸馏5 min,洗涤水30 mL。
1.3.5.4 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)
在冷藏结束时,参考Sun Weizheng等[25]的方法提取牛肉糜样品中的肌原纤维蛋白(myofibrillar protein,MP)。取10 g牛肉糜样品,按1∶10(g/mL)比例用磷酸盐缓冲溶液A(15.6 mmol/L Na2HPO4、3.5 mmol/L KH2PO4,pH 7.5)连续提取2 次,收集沉淀。随后用含0.6 mol/L NaCl的磷酸盐缓冲溶液A对收集的沉淀进行2 次提取,合并2 次提取所得上清液,得到MP溶液。
参考Garić等[26]的方法对MP进行SDS-PAGE。将提取的MP溶液稀释至质量浓度为1.0 mg/mL,与5×蛋白质加样缓冲液(4∶1,V/V)混合。将混合物于沸水中加热5 min,冷却后取10 mL加入加样孔。电泳仪在80 V下运行30 min,然后将电压增加到120 V以进一步分离。用4%~15%聚丙烯酰胺分离凝胶检测蛋白质条带。染色和脱色后,使用凝胶成像系统对凝胶进行成像。
1.3.5.5 牛肉糜感官评价
参考Yang Jun等[3]的方法对冷藏结束的牛肉糜样品开展感官评价。一方面,评估样品有无异味产生及其强度;另一方面,观察是否因产生黏液而致使黏度上升。
1.3.5.6 腐败菌致腐能力定量分析
使用TVB-N产量因子YTVB-N/TVC[14]对腐败菌在牛肉糜体系中的原位致腐能力进行定量分析,按下式计算:
式中:i、0为贮藏时间/d。
1.4 数据处理
实验重复3 次,结果均表示为平均值±标准差。实验数据统计和显著性分析使用SPSS软件进行,采用Duncan’s多重分析法分析显著性,P<0.05为差异显著。使用Origin 2018软件绘图。
2 结果与分析
2.1 腐败菌的初筛及鉴定结果
2.1.1 腐败菌的初筛结果
从贮藏末期(第10天)的生鲜牛肉肠中共分离出41 株待测菌株(表1)。因各分离菌株均未表现出水解脂肪的能力,表1未列出脂肪水解的数据。与本研究结果不同的是,在Wang Guangyu等[15]的研究中,从冰鲜鸡中分离出的腐败菌具有降解脂肪的能力,这可能是因为鸡皮的脂肪含量较高。腐败微生物产气会致使包装膨胀,出现腐败现象[9]。因此,细菌产气能力是判断其致腐能力的重要指标。培养12~24 h,可观察到菌株V19、V5-2、V10、M3的杜伦管内产生气泡,表明这4 株菌产气能力较强。培养24~48 h,菌株C5、V4出现产气现象,其产气能力一般。培养48~72 h,菌株C6、C10、C15、C19开始产气,产气能力较弱。其余分离菌株在培养过程中均未产气。
表1 分离株致腐能力的初筛结果
Table 1 Screening for the spoilage capacity of isolates
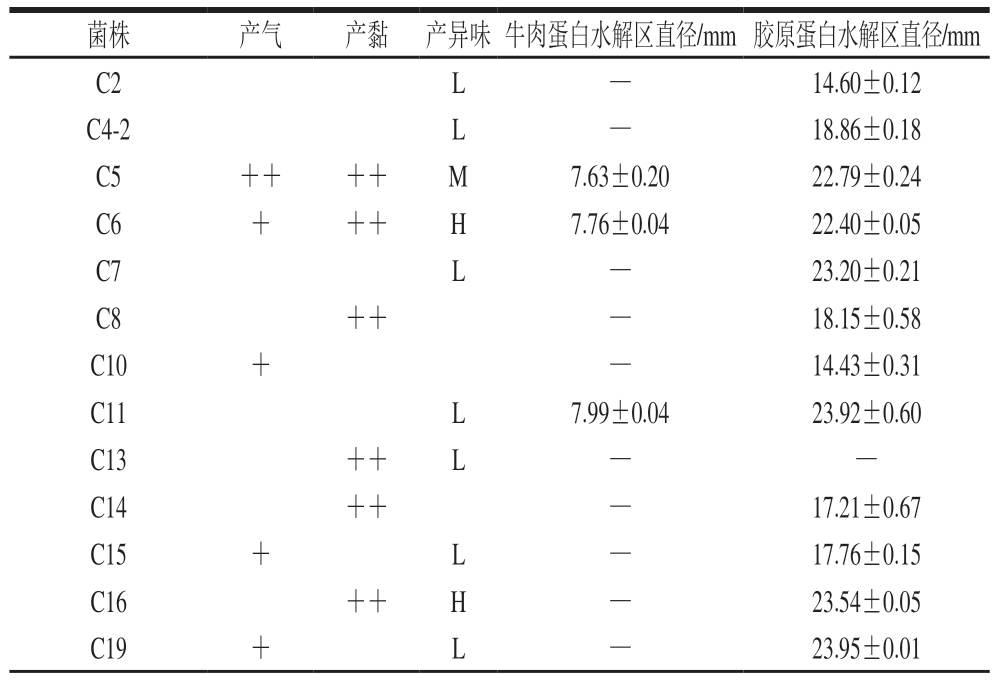
菌株产气产黏 产异味牛肉蛋白水解区直径/mm 胶原蛋白水解区直径/mm C2L—14.60±0.12 C4-2L—18.86±0.18 C5++++M7.63±0.2022.79±0.24 C6+++H7.76±0.0422.40±0.05 C7L—23.20±0.21 C8++—18.15±0.58 C10+—14.43±0.31 C11L7.99±0.0423.92±0.60 C13++L——C14++—17.21±0.67 C15+L—17.76±0.15 C16++H—23.54±0.05 C19+L—23.95±0.01
续表1
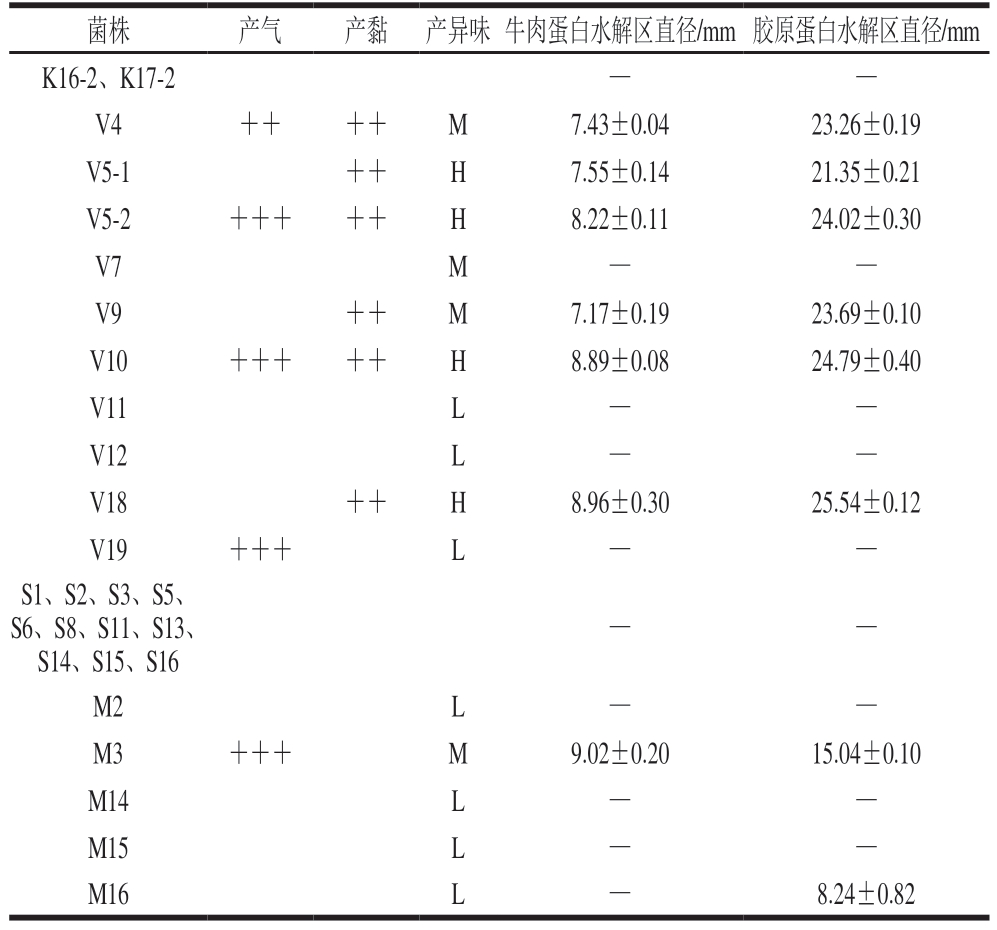
注:C2~C19分离自CFC培养基;K16-2、K17-2分离自PCA培养基;V4~V19分离自VRBGA培养基;S1~S16分离自STAA培养基;M2~M16分离自MRS培养基。产气:+++.12~24 h产气,++.24~48 h产气,+.48~72 h产气;产黏:++.表面湿润,菌落较厚;产异味:H.强异味,M.较强异味,L.弱异味;—.无水解区。
菌株产气产黏 产异味牛肉蛋白水解区直径/mm 胶原蛋白水解区直径/mm K16-2、K17-2——V4++++M7.43±0.0423.26±0.19 V5-1++H7.55±0.1421.35±0.21 V5-2+++++H8.22±0.1124.02±0.30 V7M——V9++M7.17±0.1923.69±0.10 V10+++++H8.89±0.0824.79±0.40 V11L——V12L——V18++H8.96±0.3025.54±0.12 V19+++L——S1、S2、S3、S5、S6、S8、S11、S13、S14、S15、S16——M2L——M3+++M9.02±0.2015.04±0.10 M14L——M15L——M16L—8.24±0.82
腐败菌产生黏液的现象与生物膜的形成以及对蛋白质的降解作用相关[27-28]。菌株C5、C6、C13、V5-1、V5-2、V9的菌落表面湿润、较厚,边缘完整,用接种环挑取能观察到黏液产生,但无拉丝现象;菌株C8、C14、C16、V4、V10、V18的菌落同样表面湿润、较厚,但边缘炸开,以接种环挑取可见黏液,同样无拉丝现象;其余分离菌株均未出现产黏液现象。菌株C6、C16、V5-1、V5-2、V10、V18产生强烈的异味;菌株C5、V4、V7、V9、M3产生较强的异味;菌株C2、C4-2、C7、C11、C13、C15、C19、V11、V12、V19、M2、M14、M15、M16能够产生弱异味;其余分离菌株均未产生明显的异味。菌株C5、C6、C11、V4、V5-1、V5-2、V9、V10、V18表现出较强的牛肉蛋白和胶原蛋白水解活性。菌株K16-2、K17-2及S1~S16均未观察到产气、产黏、产异味、牛肉蛋白和胶原蛋白水解现象。
总体而言,分离自CFC培养基的假单胞菌和分离自VRBGA培养基的肠杆菌展现出较强的模拟体系致腐能力。与本研究结果一致的是,在Wang Guangyu等[15]的研究中,从冰鲜鸡中分离出的荧光假单胞菌具有较强的产黏和产异味能力。张一敏等[29]也曾报道,肠杆菌在有氧条件下会使产品产生黏液和令人不适的氨味。其中,菌株V5-2和V10在产气、产黏、产生异味以及水解牛肉蛋白和胶原蛋白方面表现突出,基于这些特性,初步判定这2 株菌为腐败菌。菌株V18虽产气能力较弱,但在产黏、产生异味和蛋白水解等方面能力较强,且生鲜牛肉肠冷藏时产气并非主要腐败表现,因此也将菌株V18初步认定为腐败菌。基于上述分析,决定对菌株V5-2、V10、V18进行16S rDNA测序。此外,虽然菌株K17-2在前期的初筛环节中未展现出明显的致腐能力,但为了在后续的原位致腐评价实验中能够构建具有强弱差异的对比体系,以更全面地评估致腐能力,同时对K17-2进行了鉴定。
2.1.2 菌株鉴定
将菌株V5-2、V10、V18和K17-2的16S rDNA测序结果在NCBI数据库中进行同源比对,结果显示,菌株V5-2、V10和V18与沙雷氏菌属(Serratia)的相似度超99%,菌株K17-2与库特氏菌属(Kurthia)的相似度超99%。为进一步明确菌种及亲缘关系,以同源比对得到的相似菌株构建系统发育树(图1)。菌株V10被鉴定为变形斑沙雷氏菌(Serratia proteamaculans);菌株V5-2被鉴定为格氏沙雷氏菌(Serratia grimesii);菌株V18被鉴定为液化沙雷氏菌(Serratia liquefaciens);菌株K17-2被鉴定为佐氏库特氏菌(Kurthia zopfii)。
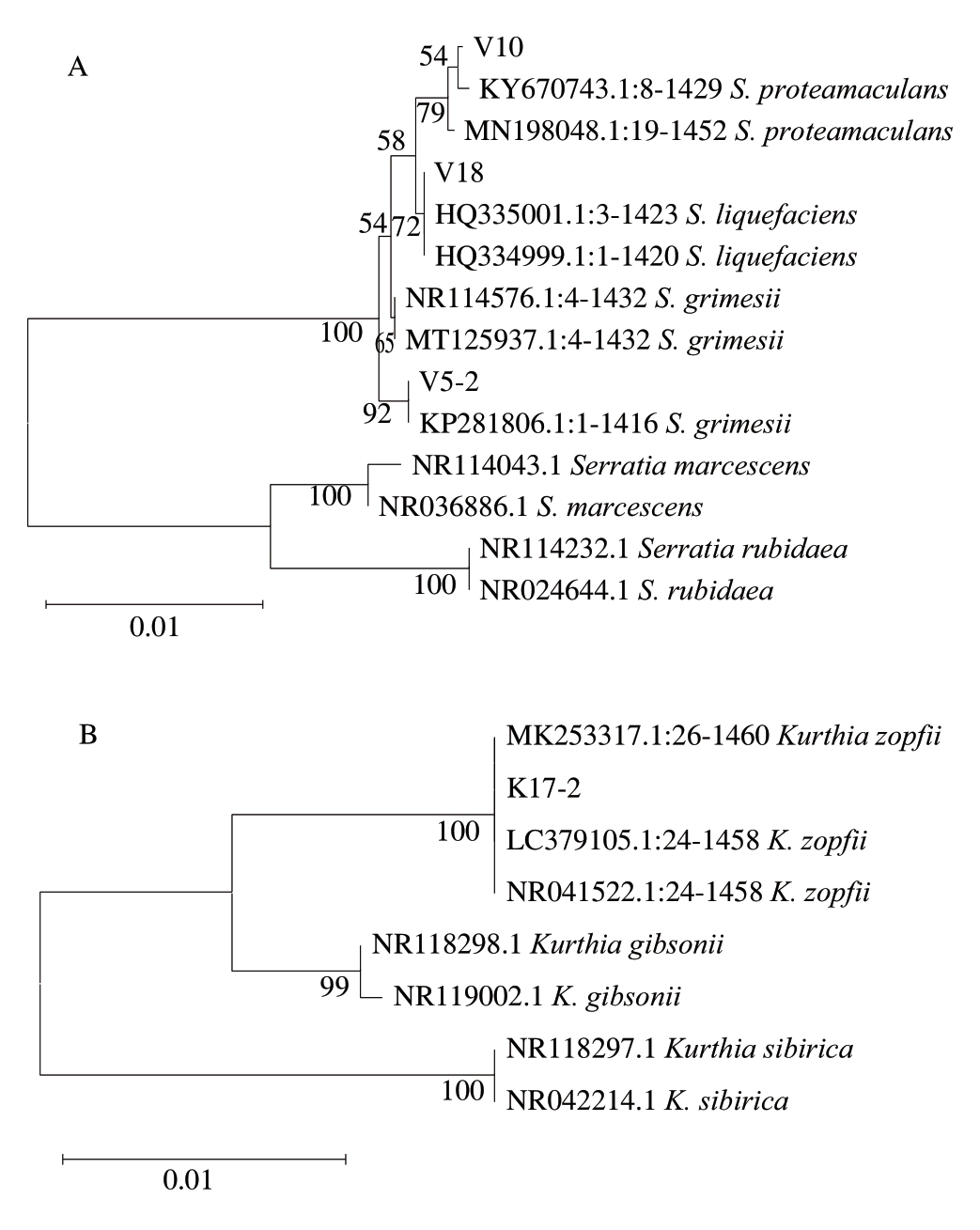
图1 生鲜牛肉肠分离菌株的16S rDNA系统发育树
Fig.1 Phylogenetic trees based on 16S rDNA gene sequences of isolates from fresh beef sausages
A.沙雷氏菌;B.库特氏菌。
沙雷氏菌隶属于肠杆菌科[30],而VRBGA是肠杆菌科选择性培养基[31]。基于此,从VRBGA培养基分离出的菌株V5-2、V10、V18均被鉴定为沙雷氏菌,这一鉴定结果具备合理性。已有报道[9]表明,沙雷氏菌与肉类变质时黏液产生、肉质软化相关。Zhu Yiqun等[4]曾报道,源自牛肉的S.proteamaculans能导致涨袋、肉色变绿等腐败现象的产生。Wang Guangyu等[15]从腐败的冰鲜黄羽鸡中分离出一株S.liquefaciens,并对其体外和原位致腐能力进行评价;Accumanno等[32]从腐败的斑点叉尾鮰(Ictalurus punctatus)中分离出S.grimesii,并对其蛋白酶特性展开研究。这些研究表明,沙雷氏菌是冷藏体系中常见的腐败菌,本研究分离鉴定的S.proteamaculans、S.liquefaciens、S.grimesii均已被证明对特定体系具有致腐能力。菌株K17-2经鉴定为K.zopfii,根据Zhao Fan等[33]的研究,库特氏菌属是猪肉的腐败标志物之一。然而在本研究中,K.zopfii K17-2在模拟体系中的致腐能力较弱,推测是因为菌种差异或本研究的分离源是牛肉而非Zhao Fan等[33]研究的猪肉。选择K.zopfii K17-2开展后续实验,可以将其与具有较强致腐能力的沙雷氏菌进行对比,同时能够验证其在牛肉中的原位致腐能力。
2.2 菌株在牛肉糜体系的原位致腐能力
将菌株S.grimesii V5-2、S.proteamaculans V10、S.liquefaciens V18和K.zopfii K17-2分别接种于辐照灭菌的牛肉糜进行贮藏实验。通过分析牛肉糜的微生物、理化性质和感官特性评估菌株的原位致腐能力。
2.2.1 牛肉糜贮藏期间TVC变化
如图2所示,在牛肉糜的整个贮藏期间内,对照组未检出活菌,表明8 kGy电子束辐照能够有效对牛肉糜进行灭菌处理,同时也说明贮藏环境中不存在外源细菌干扰实验。V5-2、V10、V18、K17-2 4 组的初始TVC分别为3.53、3.41、3.64、3.49(lg(CFU/g))。贮藏第0~2天,4 组的微生物生长速率较为一致。贮藏2~6 d期间,V5-2、V10和V18组的微生物生长速率加快,而K17-2组的增长速率相对较小。贮藏第6天,V5-2、V10、V18和K17-2 4 组的TVC分别达7.87、8.07、8.05、6.44 (lg(CFU/g))。根据Holman等[34]的研究,生鲜牛肉的TVC限值为7(lg(CFU/g)),此时K17-2组的TVC尚未超过该限值。贮藏8 d时,V5-2、V10和V18组的TVC迅速增长至9.22、9.13、9.59(lg(CFU/g));而K17-2组的TVC为6.45(lg(CFU/g)),与贮藏6 d时相比差异不显著。上述结果表明,与K.zopfii K17-2相比,S.grimesii V5-2、S.proteamaculans V10和S.liquefaciens V18在牛肉中的繁殖速率更快,且TVC持续增长。
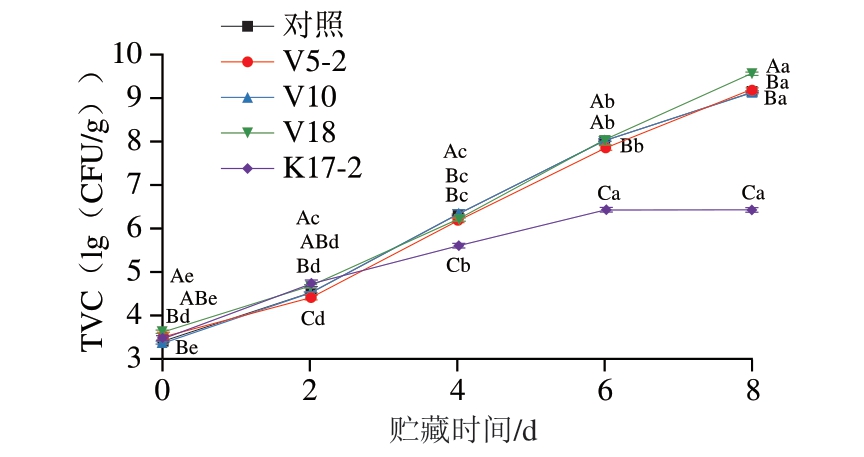
图2 牛肉糜冷藏期间TVC变化
Fig.2 Changes in total viable count of beef mince during refrigeration
大写字母不同表示同一贮藏时间不同处理组间差异显著(P<0.05);小写字母不同表示同一处理组不同贮藏时间差异显著(P<0.05)。图3、4同。
2.2.2 牛肉糜贮藏期间pH值变化
如图3所示,在牛肉糜贮藏开始时,对照组、V5-2、V10、V18、K17-2组的pH值分别为5.69、5.70、5.69、5.70、5.68。贮藏2 d时,各组的pH值无显著差异,贮藏2~4 d,各组的pH值均显著下降(P<0.05)。贮藏第4~6天,除V10组外,其余各组pH值均显著上升(P<0.05)。贮藏第6~8天,对照组pH值显著下降,4 个接菌组pH值显著上升(P<0.05)。贮藏第8天时,对照组、V5-2、V10、V18、K17-2组的pH值分别为5.70、5.88、5.75、5.87、5.72。对照组贮藏第0、8天的pH值之间无显著差异。微生物降解蛋白质会产生胺、NH3和碱性化合物,可能导致肉类贮藏时pH值上升[35]。贮藏第6~8天,V5-2、V10、V18组TVC快速增长,K17-2组TVC并无显著变化,这种差异很可能是造成V5-2、V10、V18组pH值大幅升高,而K17-2组pH值仅从5.71上升至5.72的原因。
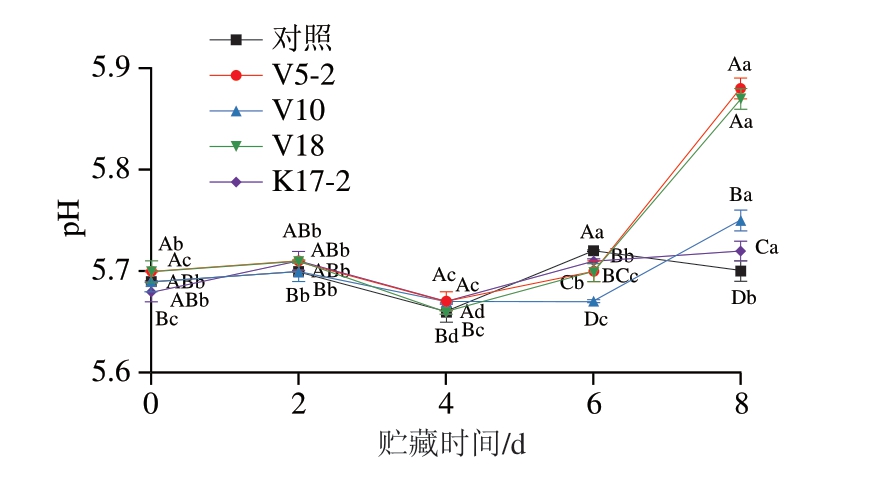
图3 牛肉糜冷藏期间pH值变化
Fig.3 Changes in pH value of beef mince during refrigeration
2.2.3 牛肉糜贮藏期间TVB-N含量变化
如图4所示,在牛肉糜贮藏开始时,对照组、V5-2、V10、V18、K17-2组的TVB-N含量分别为10.22、10.17、9.96、9.98、9.73 mg/100 g,且各组间差异不显著。贮藏第8天时,各组的TVB-N含量分别为10.95、14.90、13.49、13.31、11.18 mg/100 g,均小于15 mg/100 g的限值[36]。对照组贮藏第0、8天的TVB-N含量间差异不显著,4 个接菌组的TVB-N含量均显著升高(P<0.05),其中,K17-2组的TVB-N含量显著低于V5-2、V10、V18组(P<0.05)。结果表明,菌株V5-2、V10、V18及K17-2对牛肉蛋白质的降解作用产生胺、NH3等物质,进而致使TVB-N含量升高。TVB-N含量的升高与TVC的变化及pH值的波动呈现良好的对应关系。
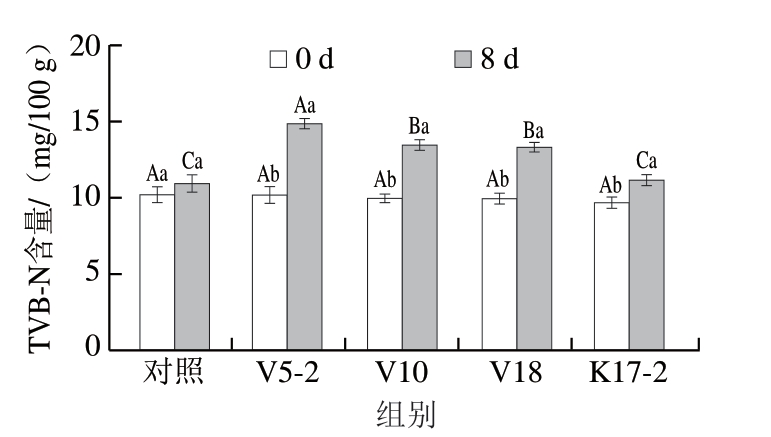
图4 牛肉糜冷藏期间TVB-N含量变化
Fig.4 Change in TVB-N content of beef mince during refrigeration
2.2.4 牛肉糜贮藏期间MP结构变化
如图5所示,牛肉糜贮藏第8天时,S.grimesii V5-2、S.proteamaculans V10、S.liquefaciens V18组均对MP造成了不同程度的降解。在分子质量135 kDa附近,相较于对照组,V10组出现新条带,而V5-2和V18组发生降解。在分子质量100 kDa附近,V5-2、V10、V18 3 组均有新条带出现。原肌球蛋白、肌钙蛋白和肌球蛋白轻链分别产生40、37、18 kDa的条带[37]。与对照组相比,菌株V5-2、V18对原肌球蛋白、肌钙蛋白及肌球蛋白轻链均有降解。可明显看出,对于分子质量<11 kDa的条带,V5-2、V10、V18 3 组均比对照组产生了更多的小分子降解产物。综上,S.grimesii V5-2、S.proteamaculans V10和S.liquefaciens V18均展现出对牛肉MP的降解能力,而K.zopfii K17-2未观察到此类降解现象。Sun Fangda等[38]曾观察到从哈尔滨干香肠中分离的发酵粘液乳杆菌(Limosilactobacillus fermentum)同样具备降解MP的能力。微生物降解蛋白质会产生胺、NH3和碱性化合物,这一系列变化直观地反映在TVB-N含量的上升及pH值的升高上。与此同时,MP结构的改变与TVB-N含量、TVC、pH值的变化呈现良好的对应关系。
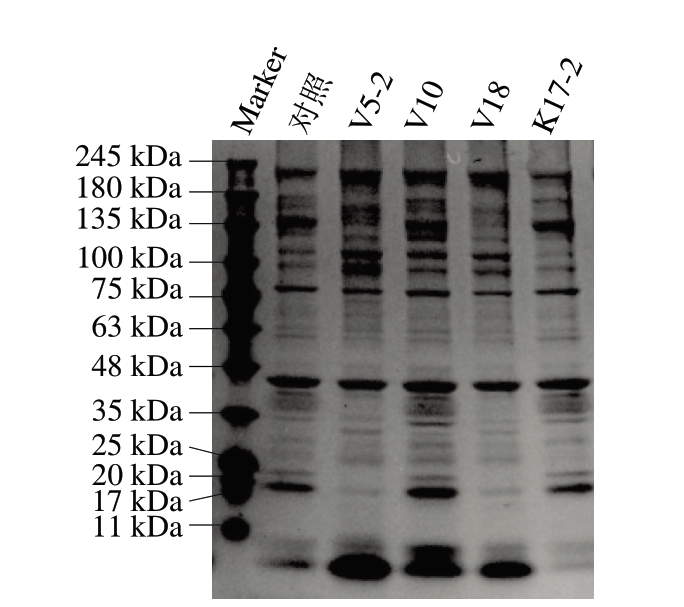
图5 贮藏8 d牛肉糜MP的SDS-PAGE图
Fig.5 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis plot of myofibrillar protein from beef mince stored for 8 d
2.2.5 牛肉糜感官分析
如表2所示,对照组在贮藏结束时未出现异味和黏液,表明牛肉糜冷藏时自然氧化引发的腐败程度有限。V5-2、V10、V18、K17-2 4 组均出现不同程度的感官劣变,表现为产异味和产黏。其中,V5-2和V18组的感官劣变最为严重,V10组次之,K17-2组程度最轻,与腐败菌初筛结果相符(表1)。原因可能是S.grimesii V5-2和S.liquefaciens V18的原位致腐能力最强,S.proteamaculans V10次之,K.zopfii K17-2最弱。肠杆菌在有氧条件下会使产品产生黏液和令人不适的氨味[39],沙雷氏菌能产生乙偶姻等与腐败相关的挥发性有机化合物[15],这可能是V5-2、V10、V18组牛肉糜贮藏末期产异味的原因。腐败菌初筛结果显示,菌株V5-2、V10、V18的菌落湿润、有黏液;SDS-PAGE结果表明,V5-2、V10、V18组能不同程度地破坏MP。当肉类表面微生物形成的生物膜与肉渗出液结合,就会形成黏液[27]。蛋白质过度降解会破坏肌束膜,致使部分肌纤维束塌陷,促使肌纤维彼此黏连[28]。因此,菌株V5-2、V10、V18形成生物膜及降解蛋白质的作用可能是导致牛肉糜贮藏末期肉质变黏的原因。
表2 贮藏8 d牛肉糜的感官评价结果
Table 2 Sensory evaluation of beef mince stored for 8 d
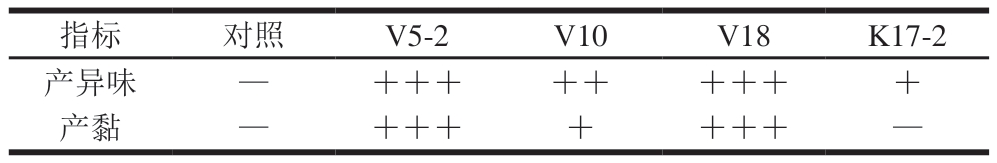
注:—.未观察到;+.弱;++.较强;+++.很强。
指标对照V5-2V10V18K17-2产异味—+++++++++产黏—+++++++—
2.2.6 牛肉糜中腐败菌致腐能力定量分析
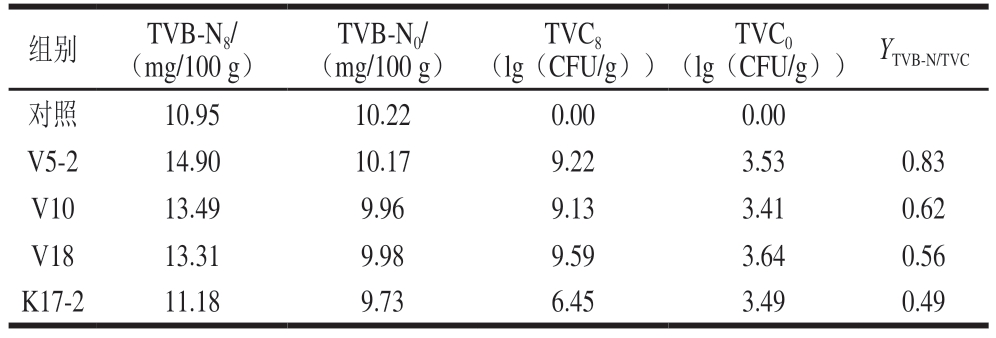
腐败菌的致腐能力因菌种和所处环境而异。挥发性盐基氮作为腐败代谢物,YTVB-N/TVC可作为腐败菌致腐能力的评价指标[40]。崔跃慧[10]对调理猪肉饼中的腐败菌致腐能力进行评价,得到较高的YTVB-N/TVC(4.47~5.56);Shao Liangting等[14]对冰鲜鸡肉的腐败菌致腐能力进行评价,得到较低的Y T V B-N/T V C(0.1 4 ~0.3 7)。由表3 可知,YT V B-N/T V C的范围为0.49~0.83,产品种类、加工方式、贮藏条件及腐败菌的差异可能是造成YTVB-N/TVC不同的原因。V5-2、V10、V18、K17-2 4 组的YTVB-N/TVC分别为0.83、0.62、0.56、0.49。其中,V5-2组的YTVB-N/TVC最高,V10、V18组次之,K17-2组最低。结果表明,S.grimesii V5-2在牛肉糜中的原位致腐能力很强,S.proteamaculans V10、S.liquefaciens V18组较强,K.zopfii K17-2较弱。依据YTVB-N/TVC比较,菌株致腐能力从强到弱依次为V5-2、V10、V18、K17-2。
表3 不同腐败菌的YTVB-N/TVC
Table 3 YTVB-N/TVC of spoilage organisms
组别TVB-N8/(mg/100 g)TVB-N0/(mg/100 g)TVC8(lg(CFU/g))TVC0(lg(CFU/g)) YTVB-N/TVC对照10.9510.220.000.00 V5-214.9010.179.223.530.83 V1013.499.969.133.410.62 V1813.319.989.593.640.56 K17-211.189.736.453.490.49
根据TVC判断,菌株V5-2、V10、V18繁殖速率大体相同;就pH值上升幅度、MP破坏程度及感官劣变状况而言,菌株V5-2和V18强于V10;依据TVB-N含量上升情况,菌株致腐能力排序为V5-2>V10=V18;根据YTVB-N/TVC分析,致腐强度排序为V5-2>V10>V18。总体而言,在3 种致腐菌中,S.grimesii V5-2致腐能力最强,S.proteamaculans V10和S.liquefaciens V18次之。S.grimesii V5-2极有可能是冷藏生鲜牛肉肠的优势腐败菌。
3 结 论
本研究从贮藏末期的冷藏生鲜牛肉肠中分离出41 株分离株。经模拟体系初筛和分子鉴定,确定了3 株致腐能力较强的菌株,分别为S.grimesii V5-2、S.proteamaculans V10和S.liquefaciens V18。原位致腐评价结果表明,3 株菌均具有较强的原位致腐潜力,会使pH值和TVB-N含量升高,一定程度破坏MP结构,导致产黏、产异味的感官劣变。通过定量分析致腐能力可知,3 株菌致腐能力从强到弱依次为S.grimesii V5-2、S.proteamaculans V10和S.liquefaciens V18,其中S.grimesii V5-2致腐能力最强。本研究结果对探究肉源沙雷氏菌致腐机制、控制生鲜牛肉肠腐败具有重要意义。
[1] DE CARVALHO P R D R M, BOLOGNESI V J, LONGHI D A, et al.Assessment of the lipid oxidation, color and sensorial acceptance of fresh sausage formulated with potassium bixinate as a substitute for sodium nitrite and carmine[J].Journal of Food Science and Technology, 2021, 58(12): 4524-4529.DOI:10.1007/s13197-020-04934-0.
[2] KUSWANDI B, DAMAYANTI F, JAYUS J, et al.Simple and lowcost on-package sticker sensor based on litmus paper for realtime monitoring of beef freshness[J].Journal of Mathematical and Fundamental Sciences, 2015, 47(3): 236-251.DOI:10.5614/j.math.fund.sci.2015.47.3.2.
[3] YANG J, YANG X Y, LIN H, et al.Investigation of the relationship between microbiota dynamics and volatile changes in chilled beef steaks held under high-oxygen packaging enriched in carbon dioxide[J].Meat Science, 2022, 191: 108861.DOI:10.1016/j.meatsci.2022.108861.
[4] ZHU Y Q, GU M Q, SU Y H, et al.Recent advances in spoilage mechanisms and preservation technologies in beef quality: a review[J].Meat Science, 2024, 213: 109481.DOI:10.1016/j.meatsci.2024.109481.
[5] PARLAPANI F F, HAROUTOUNIAN S A, NYCHAS G E, et al.Microbiological spoilage and volatiles production of gutted European sea bass stored under air and commercial modified atmosphere package at 2 ℃[J].Food Microbiology, 2015, 50: 44-53.DOI:10.1016/j.fm.2015.03.006.
[6] WEN X Y, ZHANG D Q, LI X, et al.Dynamic changes of bacteria and screening of potential spoilage markers of lamb in aerobic and vacuum packaging[J].Food Microbiology, 2022, 104: 103996.DOI:10.1016/j.fm.2022.103996.
[7] 付丽, 高雪琴, 胡晓波, 等.保鲜盒包装冷鲜牛肉贮藏期间品质及菌相变化[J].食品研究与开发, 2019, 40(14): 35-41.DOI:10.3969/j.issn.1005-6521.2019.14.007.
[8] 张秀凤, 申晓琳, 赵金辉.冷鲜牛肉腐败临界期及特定腐败菌研究[J].黑龙江畜牧兽医, 2018(24): 66-69; 260.DOI:10.13881/j.cnki.hljxmsy.2018.03.0124.
[9] SHAO L T, CHEN S S, WANG H D, et al.Advances in understanding the predominance, phenotypes, and mechanisms of bacteria related to meat spoilage[J].Trends in Food Science & Technology, 2021, 118:822-832.DOI:10.1016/j.tifs.2021.11.007.
[10] 崔跃慧.调理肉饼中特定致腐菌的分离鉴定及货架期预测模型的建立[D].晋中: 山西农业大学, 2019.DOI:10.27285/d.cnki.gsxnu.2019.000603.
[11] 顾春涛, 毕伟伟, 朱军莉.冷鲜牛肉贮藏中菌群结构及优势菌致腐性的分析[J].食品科学, 2019, 40(18): 76-82.DOI:10.7506/spkx1002-6630-20180925-263.
[12] BUMSTED J, FORD E, BLAIR A, et al.Instrumental color measurements have relationships to fat smearing in fresh sausage[J].Foods, 2023, 12(14): 2813.DOI:10.3390/foods12142813.
[13] ALAO B O, FALOWO A B, ALADEJANA E B.Effect of cooking oil on the fatty acid profile of beef sausage fortified with edible deboned meat waste[J].International Journal of Food Science, 2021, 2021:5592554.DOI:10.1155/2021/5592554.
[14] SHAO L T, TIAN Y, CHEN S S, et al.Characterization of the spoilage heterogeneity of Aeromonas isolated from chilled chicken meat:in vitro and in situ[J].LWT-Food Science and Technology, 2022, 162:113470.DOI:10.1016/j.lwt.2022.113470.
[15] WANG G Y, WANG H H, HAN Y W, et al.Evaluation of the spoilage potential of bacteria isolated from chilled chicken in vitro and in situ[J].Food Microbiology, 2017, 63: 139-146.DOI:10.1016/j.fm.2016.11.015.
[16] 卫生部.食品安全国家标准 食品微生物学检验 菌落总数测定:GB 4789.2—2016[S].北京: 中国标准出版社, 2016.
[17] CHEN S S, LIU S L, MA J M, et al.Evaluation of the spoilage heterogeneity of meat-borne Leuconostoc mesenteroides by metabonomics and in situ analysis[J].Food Research International,2022, 156: 111365.DOI:10.1016/j.foodres.2022.111365.
[18] 冯雪萍.产高粘度微生物多糖的菌种筛选及其单糖组分分析[D].无锡: 江南大学, 2013.
[19] ODEYEMI O A, BURKE C M, BOLCH C J S, et al.Evaluation of spoilage potential and volatile metabolites production by Shewanella baltica isolated from modified atmosphere packaged live mussels[J].Food Research International, 2018, 103: 415-425.DOI:10.1016/j.foodres.2017.10.068.
[20] MEHTA D S, METZGER L E, HASSAN A N, et al.The ability of spore formers to degrade milk proteins, fat, phospholipids, common stabilizers, and exopolysaccharides[J].Journal of Dairy Science, 2019,102(12): 10799-10813.DOI:10.3168/jds.2019-16623.
[21] 李雪菲, 潘琼, 罗慧婷, 等.传统发酵酸肉中微生物的分离鉴定及其益生潜力评价[J].食品科学, 2024, 45(14): 75-84.DOI:10.7506/spkx1002-6630-20231127-215.
[22] XIAO Y Q, LI P J, ZHOU Y, et al.Effect of inoculating Lactobacillus pentosus R3 on N-nitrosamines and bacterial communities in dry fermented sausages[J].Food Control, 2018, 87: 126-134.DOI:10.1016/j.foodcont.2017.12.025.
[23] LIU M Y, LUO H T, XIAO Q, et al.Effect of Latilactobacillus sakei and Staphylococcus xylosus on the textural characteristics of dry fermented sausages[J].Food Bioscience, 2024, 59: 103972.DOI:10.1016/j.fbio.2024.103972.
[24] 国家卫生和计划生育委员会.食品安全国家标准 食品中挥发性盐基氮的测定: GB 5009.228—2016[S].北京: 中国标准出版社, 2017.
[25] SUN W Z, CUI C, ZHAO M M, et al.Effects of composition and oxidation of proteins on their solubility, aggregation and proteolytic susceptibility during processing of Cantonese sausage[J].Food Chemistry, 2011, 124(1): 336-341.DOI:10.1016/j.foodchem.2010.06.042.
[26] GARIĆ D A, DUMUT D C, CENTORAME A, et al.Western blotting with fast SDS-PAGE and semi-dry protein transfer[J].Current Protocols, 2023, 3(7): e833.DOI:10.1002/cpz1.833.
[27] WICKRAMASINGHE N N, RAVENSDALE J, COOREY R, et al.Transcriptional profiling of biofilms formed on chilled beef by psychrotrophic meat spoilage bacterium, Pseudomonas fragi 1793[J].Biofilm, 2021, 3: 100045.DOI:10.1016/j.bioflm.2021.100045.
[28] 郑云, 郑爽, 周天硕, 等.肌肉蛋白质降解对发酵肉制品品质影响的研究进展[J].食品工业科技, 2023, 44(18): 476-483.DOI:10.13386/j.issn1002-0306.2022110202.
[29] 张一敏, 朱立贤, 张万刚, 等.生鲜牛肉中的腐败微生物概述[J].食品科学, 2018, 39(13): 289-296.DOI:10.7506/spkx1002-6630-201813043.
[30] GUPTA V, SHARMA S, PAL K, et al.Serratia, no longer an uncommon opportunistic pathogen-case series & review of literature[J].Infectious Disorders Drug Targets, 2021, 21(7): e300821191666.DOI:10.2174/1871526521666210222125215.
[31] 国家卫生和计划生育委员会.食品安全国家标准 食品微生物学检验 肠杆菌科检验: GB 4789.41—2016[S].北京: 中国标准出版社,2017.
[32] ACCUMANNO G M, RICHARDS V A, GUNTHER N W, et al.Purification and characterization of the thermostable protease produced by Serratia grimesii isolated from channel catfish[J].Journal of the Science of Food and Agriculture, 2019, 99(5): 2428-2437.DOI:10.1002/jsfa.9451.
[33] ZHAO F, WEI Z Q, ZHOU G H, et al.Effects of different storage temperatures on bacterial communities and functional potential in pork meat[J].Foods, 2022, 11(15): 2307.DOI:10.3390/foods11152307.
[34] HOLMAN B W B, BEKHIT A E A, WALLER M, et al.The association between total volatile basic nitrogen (TVB-N)concentration and other biomarkers of quality and spoilage for vacuum packaged beef[J].Meat Science, 2021, 179: 108551.DOI:10.1016/j.meatsci.2021.108551.
[35] KARABAGIAS I, BADEKA A, KONTOMINAS M G.Shelf life extension of lamb meat using thyme or oregano essential oils and modified atmosphere packaging[J].Meat Science, 2011, 88(1): 109-116.DOI:10.1016/j.meatsci.2010.12.010.
[36] LIU X X, SONG X S, GOU D J, et al.A polylactide based multifunctional hydrophobic film for tracking evaluation and maintaining beef freshness by an electrospinning technique[J].Food Chemistry, 2023, 428: 136784.DOI:10.1016/j.foodchem.2023.136784.
[37] AZADIAN M, MOOSAVI-NASAB M, ABEDI E.Comparison of functional properties and SDS-PAGE patterns between fish protein isolate and surimi produced from silver carp[J].European Food Research and Technology, 2012, 235(1): 83-90.DOI:10.1007/s00217-012-1721-z.
[38] SUN F D, HU Y Y, YIN X Y, et al.Production, purification and biochemical characterization of the microbial protease produced by Lactobacillus fermentum R6 isolated from Harbin dry sausages[J].Process Biochemistry, 2020, 89: 37-45.DOI:10.1016/j.procbio.2019.10.029.
[39] 孙歌, 武桐煊, 毛衍伟, 等.细菌主导的红肉腐败机制研究进展[J].肉类研究, 2024, 38(8): 63-71.DOI:10.7506/rlyj1001-8123-20240603-134.
[40] DALGAARD P.Qualitative and quantitative characterization of spoilage bacteria from packed fish[J].International Journal of Food Microbiology, 1995, 26(3): 319-333.DOI:10.1016/0168-1605(94)00137-u.