肌纤维是构成肌肉组织的基本结构单位,基于肌球蛋白重链(myosin heavy chain,MyHC)亚型表达谱,哺乳动物骨骼肌纤维可分类为4 种类型,包括MyHC I(慢速氧化型)、MyHC IIa(快速氧化型)、MyHC IIx(中间型)和MyHC IIb(快速酵解型)[1]。骨骼肌肌纤维类型的转化受多种因素影响,包括生理阶段、环境、营养、运动及激素等[2],其各类型占比与肉的品质密切相关。当I型肌纤维占比较高时,肉的嫩度往往更好[3]。已有研究表明,增加I型肌纤维占比可以改善肉的嫩度[4],而IIb型肌纤维占比过高会导致肉色不理想,持水性(water holding capacity,WHC)受损,这些不利影响会降低消费者的购买欲,给肉类行业造成严重的经济损失[5]。因此,探索调控肌纤维类型转化方法,增加肉中I型肌纤维比例,对于肉品产业具有重要的应用价值。
近年来,氧化应激被证实可以影响肌纤维类型的转化。现有研究证据表明,氧化应激可通过损害线粒体功能来调控肌纤维类型转化,具体表现为I型和IIa型的基因表达水平呈现显著下调趋势[6]。研究[7]表明,氧化应激会导致线粒体功能障碍等氧化损伤,从而释放细胞色素c,诱导细胞凋亡。线粒体依赖性凋亡通路作为程序性细胞死亡的关键机制,其激活过程依赖于线粒体释放的细胞色素c,进而激活起始蛋白酶Caspase-9,引发下游Caspase级联反应。启动子Caspase-9激活Caspase-3,最终诱导细胞凋亡[8]。氧化应激产生的活性氧(reactive oxygen species,ROS)会损伤线粒体膜结构,影响线粒体功能并释放线粒体内部存储的促凋亡因子[9]。促凋亡家族成员如B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)和Bcl-2相关X蛋白质(Bcl-2-associated X protein,Bax)的表达失衡会破坏线粒体功能[10],激活凋亡通路[11],进而导致肉品质降低。因此,通过抑制细胞氧化应激和细胞凋亡并调控肌纤维类型,可能是提升肉类品质的有效途径。
白藜芦醇是一种天然多酚物质,广泛存在于虎杖、花生和葡萄等植物中[12],具有很高的营养和药用价值。白藜芦醇具有抗癌、抗氧化、抗炎、代谢调节等多种生物学功能[13-14],可以作为一种畜禽饲料添加剂,用于提高动物的生长性能及改善肉品质[15]。白藜芦醇还可以通过中和ROS平衡细胞氧化还原状态,从而保护细胞生物分子免受氧化损伤[16]。白藜芦醇能够调控肌纤维类型转化,吴少强等[17]研究发现,日粮添加白藜芦醇干预后,肌纤维类型的4 种标志基因表达有显著变化,影响了肌纤维类型的转化。有研究证实,日粮补充白藜芦醇能使母猪背最长肌中I型肌纤维的mRNA表达显著升高,相应蛋白水平也显著升高,同时显著抑制IIb型肌纤维mRNA和蛋白表达[18],从分子水平证实白藜芦醇具有促进慢肌纤维生成、抑制快肌纤维分化的调控作用。然而,其在氧化应激条件下对C2C12细胞肌纤维类型转化的调控作用及分子机制尚未完全阐明。此外,细胞凋亡作为氧化应激诱导的常见表型,可能参与肌纤维类型的重塑过程,但目前相关研究较少。
因此,本研究选择C2C12细胞作为研究对象,建立H2O2诱导的氧化应激模型,探讨白藜芦醇对氧化应激诱导C2C12细胞肌纤维类型的影响,为揭示白藜芦醇调控肌纤维类型转化的分子机制提供新的视角。同时,结合转录组学和凋亡分析,进一步探讨白藜芦醇是否通过抑制氧化应激诱导的细胞凋亡影响肌纤维类型的转化,可为提高肉类品质提供理论依据和数据支持。
1 材料与方法
1.1 材料与试剂
C2C12成肌细胞系 实验室储存细胞。
H 2O 2溶液、慢肌纤维蛋白(s l o w M y H C)抗体(M 8 4 2 1)、快肌纤维蛋白(f a s t M y H C)抗体(M 4 2 7 6) 美国S i g m a 公司;白藜芦醇(纯度≥98%) 美国MedChemexpress生物科技公司;胎牛血清(fetal bovine serum,FBS) 以色列Biological Industries公司;磷酸盐缓冲液(phosphate buffered saline,PBS) 武汉塞维尔生物科技有限公司;增强化学发光(enhanced chemiluminescence,ECL)显影液苏州新赛美生物科技有限公司;聚偏二氟乙烯膜 美国Millipore公司;DMEM培养基、马血清、青链霉素混合液、胰蛋白酶-乙二胺四乙酸(elhylene diamine tetraacetic acid,EDTA)(质量分数0.25%)、胰蛋白酶(不含EDTA)(质量分数0.25%)、Annexin V-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)细胞凋亡检测试剂盒北京索莱宝生物科技有限公司;ROS检测试剂盒 上海碧云天生物技术有限公司;Caspase-9、Caspase-3、Cleaved Caspase-3、Bax、Bcl-2抗体 武汉爱博泰克生物科技有限公司;羊抗兔免疫球蛋白(immunoglobulin,Ig)G、兔抗鼠IgG、β-肌动蛋白抗体 英国Abcam公司。
1.2 仪器与设备
CFX 96实时荧光定量聚合酶链式反应(real-time fluorescence quantitative polymerase chain reaction,real-time PCR)仪、1658029电泳仪、ChemiDoc MP凝胶成像仪美国Bio-Rad公司;3111 CO2培养箱 美国Thermo公司;IX73倒置荧光显微镜 日本Olympus公司;Cyto FLEX S流式细胞仪 美国Beckman Coulter公司。
1.3 方法
1.3.1 细胞培养
细胞培养采用DMEM基础培养液,补充10% FBS及1%青链霉素混合液,培养环境维持在37 ℃、5% CO2的细胞培养箱中。细胞生长密度达到70%左右时开始传代。将细胞接种到6 孔细胞培养板中,待细胞完全贴壁后,更换为DMEM基础培养液中添加2%马血清的培养液,诱导分化4 d,然后在不含或含有400 µmol/L H2O2(10 µmol/L白藜芦醇(Res))的分化培养液中继续培养,实验分为3 组:1)对照组,细胞不作任何特殊处理,培养24 h;2)H2O2组,400 µmol/L H2O2作用细胞24 h;3)Res+H2O2组,用10 µmol/L Res预处理细胞24 h后,再用400 µmol/L H2O2作用24 h。收集细胞样品用于各项指标测定,具体使用浓度参考自本实验室成员孙静等[19]的前期研究。
1.3.2 ROS测定
按照ROS检测试剂盒说明书配制10 µmol/L的2’,7’-二氯荧光素二乙酸酯(2’,7’-dichlorofluorescein diacetate,DCFH-DA)溶液对细胞进行处理。每孔加入1 mL DCFH-DA溶液,37 ℃细胞培养箱内孵育20 min。孵育结束后去DCFH-DA,加入1 mL PBS吹打细胞,收集到离心管中。用不含血清和酚红的培养液洗涤细胞3 次,加入1 mL完全培养基重悬,收集细胞后用流式细胞仪分析。ROS水平由仪器直接得到。
1.3.3 细胞凋亡率测定
培养结束后的细胞,收集细胞培养液到离心管内备用。加入0.5 mL不含EDTA的胰蛋白酶,轻微晃动2 min。加入0.5 mL完全培养基终止消化,收集细胞到离心管中。4 000×g离心5 min,弃上清。加入1 mL 4 ℃的PBS重悬细胞,4 000×g离心3 min,弃上清。用去离子水按体积比1∶9稀释Binding buffer(10×),加入适量稀释后的Binding buffer(1×)重悬细胞,将细胞密度调整为1×105 个/mL。取100 µL细胞悬液,通过滤网过滤至2 mL流式管内。加入5 µL Annexin V-FITC荧光标记物,混匀后,在室温且避光环境下孵育5 min。再加入5 µL碘化丙锭溶液(试剂盒自带),随后再加入400 µL PBS,1 h内使用流式细胞仪检测。细胞凋亡率由仪器直接得到。
1.3.4 mRNA相对表达量测定
1.3.4.1 总RNA提取及引物序列
采用RNA提取试剂盒说明书提取总RNA,随后使用反转录试剂盒将RNA反转录合成cDNA。real-time PCR引物序列信息详见表1,所有引物均由艾科瑞生物技术有限公司(湖南)进行设计与合成。
表1 real-time PCR引物序列
Table 1 Primer sequences used for real-time fluorescence quantitative polymerase chain reaction (PCR)

基因引物序列产物大小/bp MyHC IF:ATCGCTGAATCCCAGGTCAA148 R:ACCAAGATGTGGCACGGCTA MyHC IIaF:CACCCTGGAGCAGACAGAGA84 R:TCCCTGGATTTGCGTGATG MyHC IIxF:AGGGCATCGCTGGAACAGAC96 R:CAGAAGCTGCACACGCTCAC MyHC IIbF:TTTCCAGACCGTGTCTGCTC100 R:GGGATGATGCAGCGTACAAAG Caspase-3F:ACTTCCACGAAAATACTGGCAT32 R:ACTGCTCCTTTTGCTATGGTC Caspase-9F:AAAGCCGAGCCAAGGAAAAC42 R:GCATTCAAGACATAGGCCAGAT BaxF:TGGAGCTGCAGAGGATGATCG21 R:GGCAAAGTAGAAAAGGGCGAC Bcl-2F:CTTCTTTGAGTTCGGAGGGGT26 R:GTTCAGGTACTCGGTCATCCAC GAPDHF:GATGGTGAAGGTCGGAGTGAAC100 R:GTCATTGATGGCGACGATGT
1.3.4.2 real-time PCR
采用SYBR Green嵌合荧光法进行real-time PCR测定。以cDNA为模板,用2-ΔΔCt法计算各基因的mRNA相对表达量,GAPDH作为内参基因。
1.3.5 Western blot
培养结束后的细胞,弃去细胞培养液,用PBS清洗1 次,弃去PBS。加入90 μL裂解缓冲液,收集到离心管中,冰上裂解20 min。把样本放置在离心机中,4 ℃、12 000×g离心10 min。离心结束后,取出上清液,采用BCA蛋白检测试剂盒测定其中的蛋白浓度。取10 μL总蛋白裂解上清液进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,电泳条件为120 V、50 min,转印条件为恒流400 mA、20 min。转印结束后,用切胶片在2 块玻璃板间轻轻撬动,直至完全分离。根据目的蛋白和内参蛋白所在位置,保留合适大小的分离胶。经封闭后,加入抗体稀释液孵育,TBST缓冲液洗涤。采用ECL显影液进行信号检测,通过ImageJ软件分析蛋白水平。
1.3.6 转录组学分析
培养结束后的细胞按照1.3.4.1节步骤提取总RNA,从3 个独立培养中获取样本以减少随机误差,检测提取的RNA浓度和纯度。基于文库质量检测结果,按有效浓度进行归一化混合后,使用Illumina NovaSeq 6000测序系统进行高通量测序。原始数据经FastQC质控后,采用Hisat2将Clean reads比对至RefSeq数据库下载的NC_003210.1参考基因组(比对率>90%)。基因表达水平通过Stringtie软件以每千碱基的片段数每百万映射片段值进行定量分析,该算法同时考虑基因长度和测序深度的影响。随后建立2 个比较组(H2O2 vs.对照和Res+H2O2 vs.H2O2),并从每组中鉴定出差异表达基因(differential expressed genes,DEGs)。对原始读段计数进行标准化,并根据Benjamini-Hochberg法调整P值,以控制错误发现率。DEGs的阈值设定为log2差异倍数(fold change,FC)>1且P<0.05[20]。最后,对不同阶段获得的DEGs进行基因本体论(gene ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析。
1.4 数据处理
用Bio-Rad CFX Manager软件分析基因的相对表达量。用Image Lab软件导出蛋白条带,ImageJ软件量化蛋白表达。ROS水平、细胞凋亡率变化、基因表达和蛋白表达均采用SPSS 19.0软件进行单因素方差分析、LSD法多重比较和独立样本t检验。实验结果用平均值±标准差表示,采用不同字母表示差异显著性(P<0.05)。 使用GraphPad Prism 10.0软件作图。
2 结果与分析
2.1 白藜芦醇对氧化应激C2C12细胞ROS水平的影响
H2O2作为经典的氧化应激诱导剂,常被用于建立细胞损伤模型。如图1所示,与对照组相比,H2O2组细胞内ROS含量呈现出显著升高趋势(P<0.05)。白藜芦醇处理后显著降低了C2C12细胞内ROS水平(P<0.05)。Auti[21]、Shan Qunqun[22]等研究发现,白藜芦醇分别能在缺氧和炎症环境中降低PC12细胞和AF细胞内的ROS含量。Moreira-Pinto等[23]研究发现,白藜芦醇可以在人颗粒细胞诱导应激后减少ROS的形成,从而保护细胞免受氧化应激损伤,与本研究结果相一致。
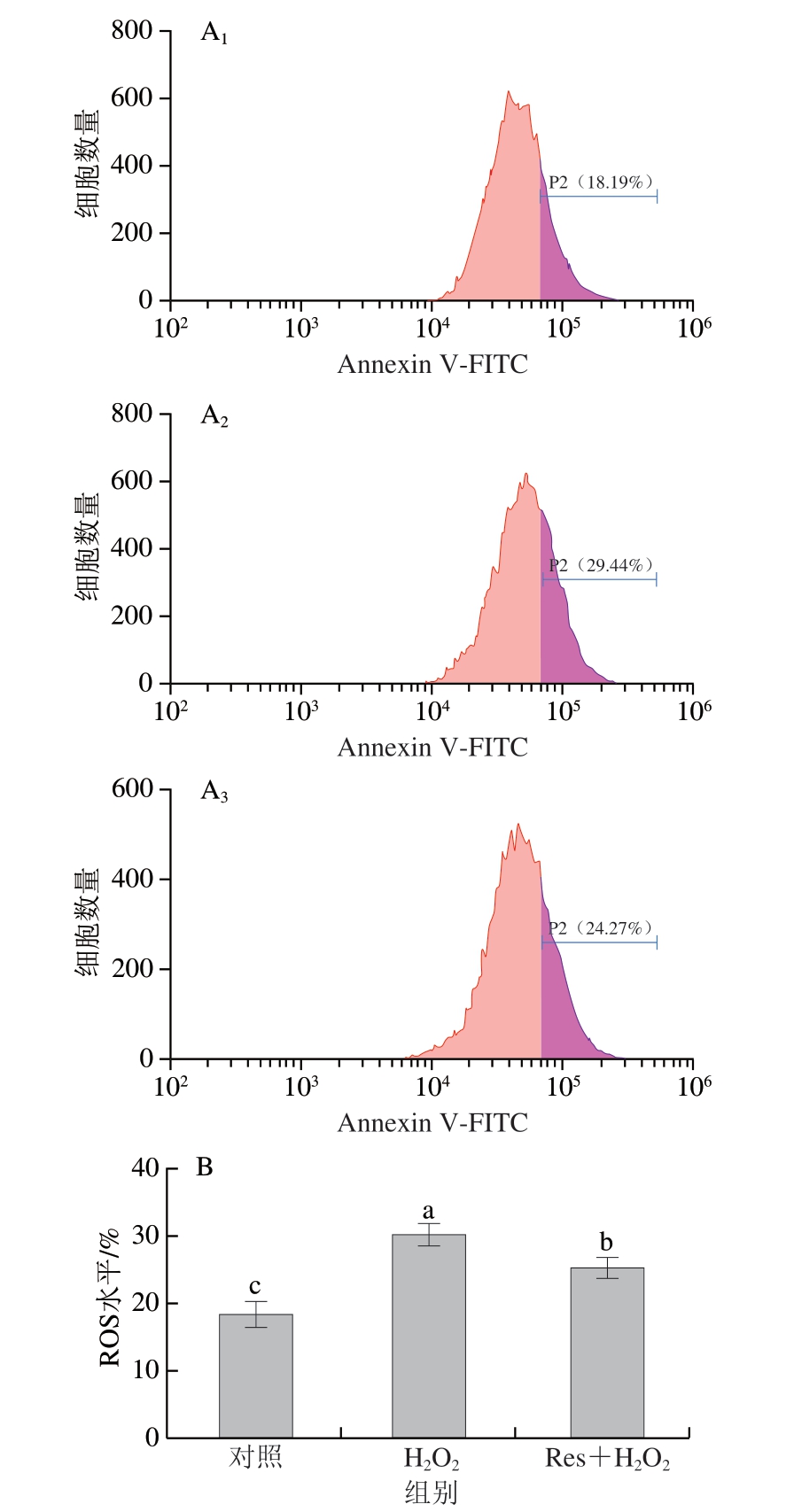
图1 白藜芦醇对氧化应激C2C12细胞内ROS水平的影响
Fig.1 Effects of Res on ROS levels in C2C12 myotubes under oxidative stress
A.流式细胞术检测ROS水平变化,P2.阳性率;下标1.对照组,下标2.H2O2组,下标3.Res+H2O2组,图2A同。B.ROS水平统计分析;小写字母不同表示组间差异显著(P<0.05),图2B、3、4、5B同。
2.2 白藜芦醇对氧化应激C2C12细胞凋亡率的影响
细胞凋亡对于维持细胞稳态至关重要,它作为一种保护机制来消除受损或功能失调的细胞,防止潜在危害在整个生物体中传播[24]。细胞凋亡是由长期应激触发的程序性细胞死亡,受多种信号通路的控制。Bcl-2蛋白家族通过调节线粒体释放细胞色素c控制细胞凋亡[25],这个过程对于维持细胞稳态和抑制疾病发展至关重要。由图2可知,与对照组相比,H2O2组C2C12细胞凋亡率显著增加(P<0.05),早期凋亡率约为4.30%,晚期凋亡率约为9.47%。白藜芦醇显著降低了细胞凋亡率(P<0.05)。石栓霞等[9]研究发现,白藜芦醇预处理对H2O2诱导的Gc-1 spg细胞的线粒体损伤和凋亡均有明显的保护作用。此外,Auti等[21]研究表明,白藜芦醇能够减弱缺氧诱导的PC12细胞凋亡;Shan Qunqun等[22]研究发现,白藜芦醇可以降低炎症环境中AF细胞凋亡率,以上研究结果与本研究的结果一致。此外,3 组细胞均出现1%左右的坏死,这可能是由于实验操作过程导致的细胞机械性损伤。
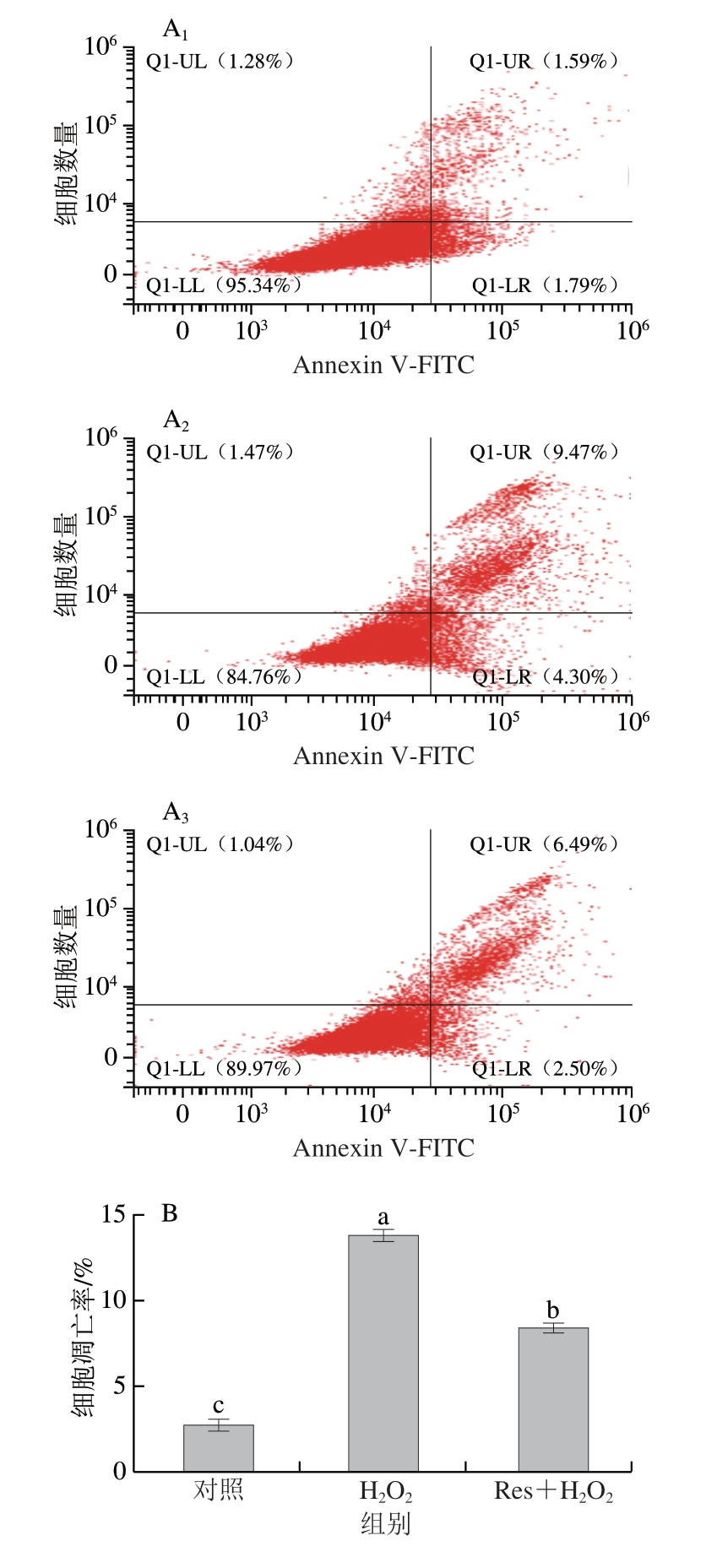
图2 白藜芦醇对氧化应激C2C12细胞凋亡的影响
Fig.2 Effects of Res on the apoptosis of C2C12 myotubes under oxidative stress
A.流式细胞术检测细胞凋亡变化;B.细胞凋亡率统计分析。
2.3 白藜芦醇对氧化应激C2C12细胞肌纤维类型转化的影响
如图3 A 所示,相较于对照组,氧化应激状态下MyHC I和MyHC IIa的mRNA相对表达量显著下降(P<0.05),而MyHC IIx和MyHC IIb的mRNA相对表达量则显著上升(P<0.05)。白藜芦醇干预后,MyHC I和MyHC IIa的mRNA相对表达量显著上升(P<0.05),而MyHC IIx和MyHC IIb的mRNA相对表达量显著下降(P<0.05)。如图3B所示,与对照组相比,氧化应激显著下调慢速MyHC的相对表达量(P<0.05),显著上调快速MyHC的相对表达量(P<0.05)。白藜芦醇干预后,慢速MyHC的相对表达量显著升高(P<0.05),快速MyHC的相对表达量显著降低(P<0.05)。上述结果表明,白藜芦醇可以增加I型和IIa型肌纤维的比例,减少IIb型和IIx型肌纤维的比例,这与吴少强等[17]研究结果类似。
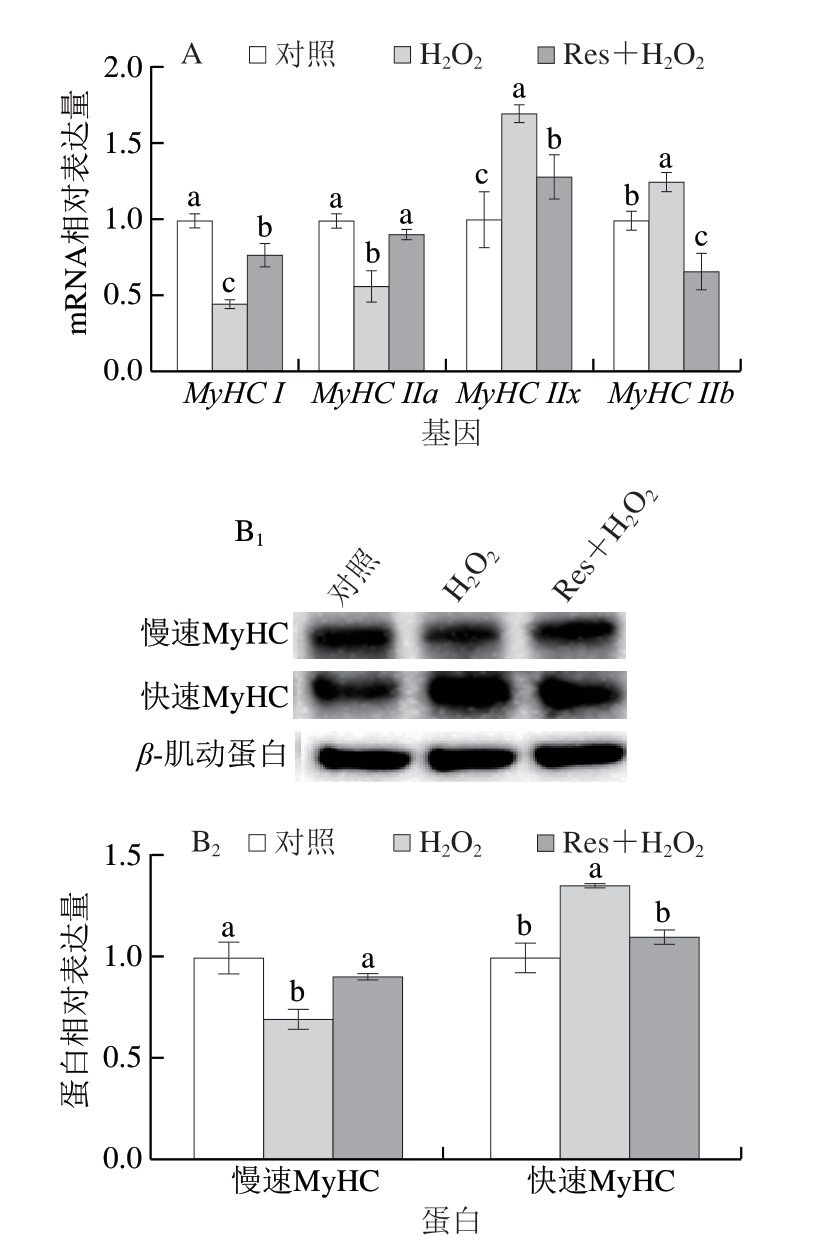
图3 白藜芦醇对氧化应激C2C12细胞肌纤维类型相关基因(A)和蛋白(B)表达的影响
Fig.3 Effects of Res on the expression of genes (A) and proteins (B)related to muscle fiber types in C2C12 myotubes under oxidative stress
下标1.免疫印迹图;下标2.蛋白表达水平统计分析。
2.4 白藜芦醇对氧化应激C2C12细胞凋亡相关基因和蛋白表达的影响
过量的ROS会引起线粒体结构紊乱和功能障碍,并引起氧化损伤,促使线粒体通透性转换孔打开,随后线粒体膜电位降低,导致线粒体内容物释放到细胞质中,进一步激活Caspase级联家族并启动线粒体依赖性细胞凋亡[26-28]。线粒体凋亡途径受Bcl家族蛋白的调节,这些蛋白在调节线粒体功能中起关键作用[29]。Bcl-2和Bax是细胞内源性凋亡通路的关键调控因子,二者的比值反映细胞凋亡的水平[30]。Caspase激活是凋亡刺激触发蛋白水解级联反应过程中的关键节点。Caspase-9主要与线粒体相关的凋亡信号转导相关[31]。为进一步研究白藜芦醇对氧化应激C2C12细胞肌纤维类型转化的影响,检测分析凋亡相关基因和蛋白的表达变化。
如图4所示,与对照组相比,H2O2组细胞中促凋亡因子Caspase-9、Caspase-3和Bax的mRNA相对表达量显著上调(P<0.05),而抗凋亡因子Bcl-2的mRNA相对表达量显著下调(P<0.05),Bcl-2/Bax显著降低(P<0.05)。与H2O2组相比,白藜芦醇处理显著降低了C2C12细胞中Caspase-9、Caspase-3和Bax的mRNA相对表达量(P<0.05),显著增加了抗凋亡因子Bcl-2的mRNA相对表达量(P<0.05)。
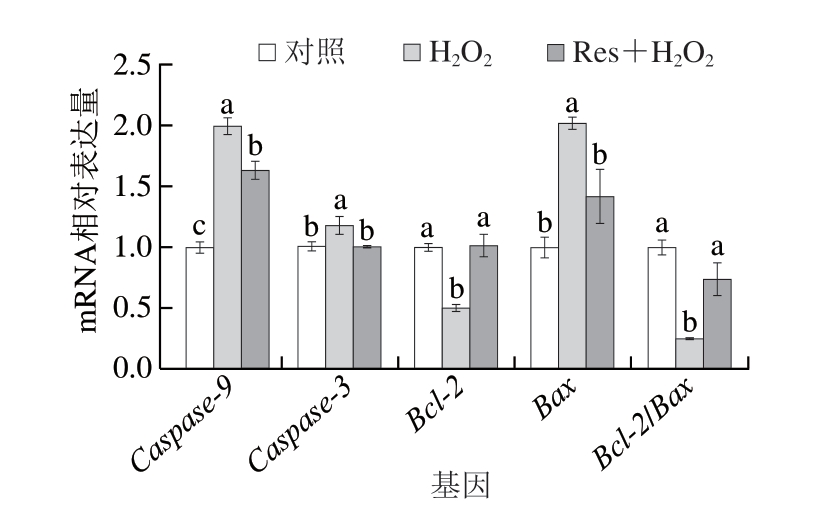
图4 白藜芦醇对氧化应激C2C12细胞凋亡相关基因表达的影响
Fig.4 Effects of Res on gene expression related to the apoptosis of C2C12 myotubes under oxidative stress
如图5所示,与对照组相比,H2O2组细胞中Caspase-9和Caspase-3的蛋白相对表达量显著升高(P<0.05),Bcl-2/Bax显著降低(P<0.05)。与H2O2组相比,白藜芦醇处理显著降低了C2C12细胞中Cleaved Caspase-3的相对表达量,Bcl-2/Bax显著升高(P<0.05)。Auti等[21]研究发现,白藜芦醇可以降低缺氧诱导的促凋亡因子表达。Alshehri等[32]研究发现,白藜芦醇能减少氧化应激诱导的大鼠肝细胞凋亡。综上所述,白藜芦醇对氧化应激诱导细胞凋亡的激活有抑制作用。
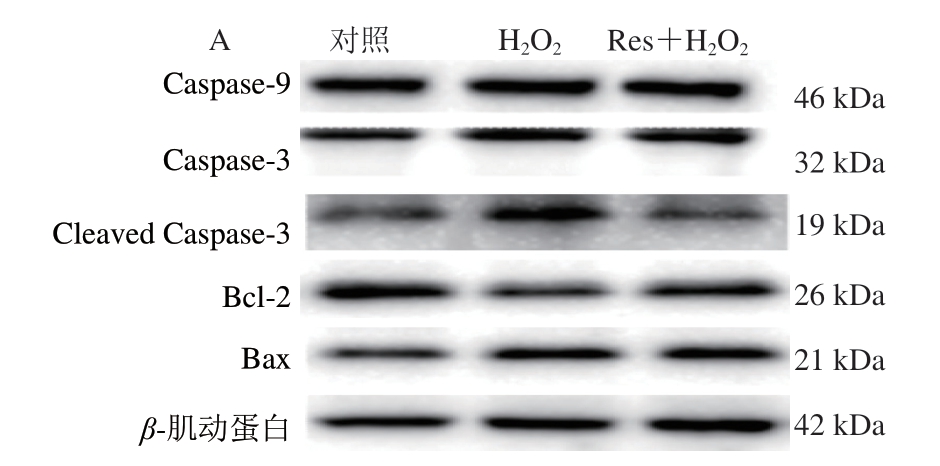
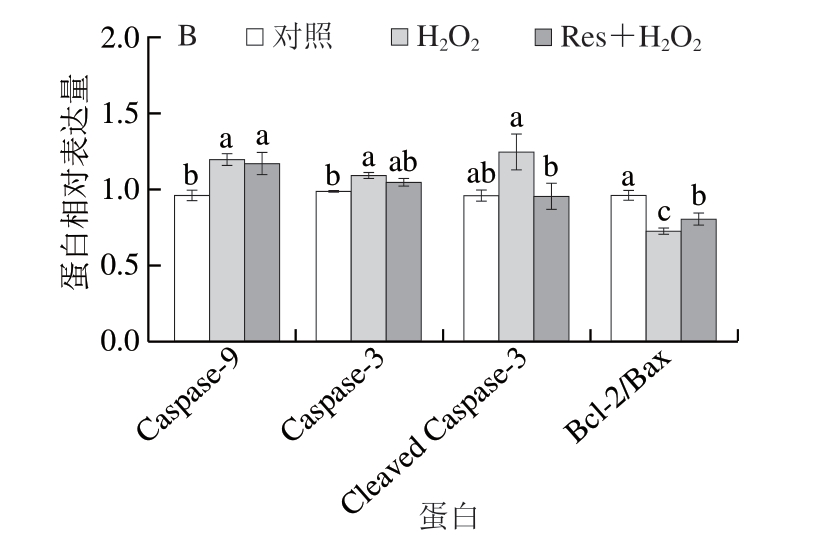
图5 白藜芦醇对氧化应激C2C12细胞凋亡相关蛋白表达的影响
Fig.5 Effects of Res on protein expression related to the apoptosis of C2C12 myotubes under oxidative stress
A.免疫印迹图;B.蛋白表达水平统计分析。
2.5 转录组学分析结果
2.5.1 RNA-seq测序质量评估
本研究的转录组测序工作共对9 个样品进行测序分析,每个样品的测序数据产出率达到100%。所有样品的Reads平均基因组比对率为92.79%,共检测到46 932 个表达基因。经过严格的质量控制流程(包括去除接头序列、N含量过高的低质量Reads等),表明测序数据质量可靠,符合后续生物信息学分析的要求,这些高质量的测序数据为后续的DEGs分析和功能注释提供了可靠的基础。
2.5.2 DEGs筛选
如图6所示,H2O2 vs.对照组和Res+H2O2 vs.H2O2组共有的DEGs分别为121、335 个。这些结果表明,H2O2处理引起了广泛的基因表达变化,而白藜芦醇预处理可显著逆转H2O2诱导的基因表达变化,DEGs的分析为筛选关键调控基因提供了重要线索。
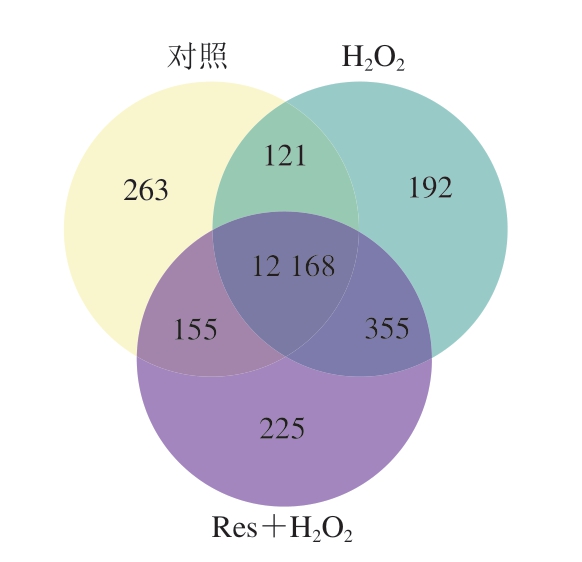
图6 各组间DEGs数量Venn图
Fig.6 Venn diagram of the number of differentially expressed genes among groups
2.5.3 GO分析
GO分析将DEGs依据其功能特性划分为3 个主要类别:生物过程、细胞组分及分子功能。如图7所示,H2O2 vs.对照组的DEGs富集最多的是生物过程,含有1 602 个DEGs。经过H2O2处理,生物过程的注释主要集中在有丝分裂细胞周期的调控过程、核糖核蛋白复合物生物发生过程和氧化-还原过程。细胞组分描述了基因产物在分子水平上的作用,包括细胞器内膜、线粒体内膜和细胞外基质等功能。在分子功能类别中,辅因子结合,转录因子活性、蛋白质结合和转录因子活性构成了较大的类别,三者均涉及调控基因的表达。经过白藜芦醇处理,Res+H2O2 vs.H2O2组的DEGs富集最多的是细胞组分,含有118 个DEGs。细胞组分中的DEGs主要形成以对缺氧的反应和负向调节内吞作用为代表的细胞过程功能注释分支。
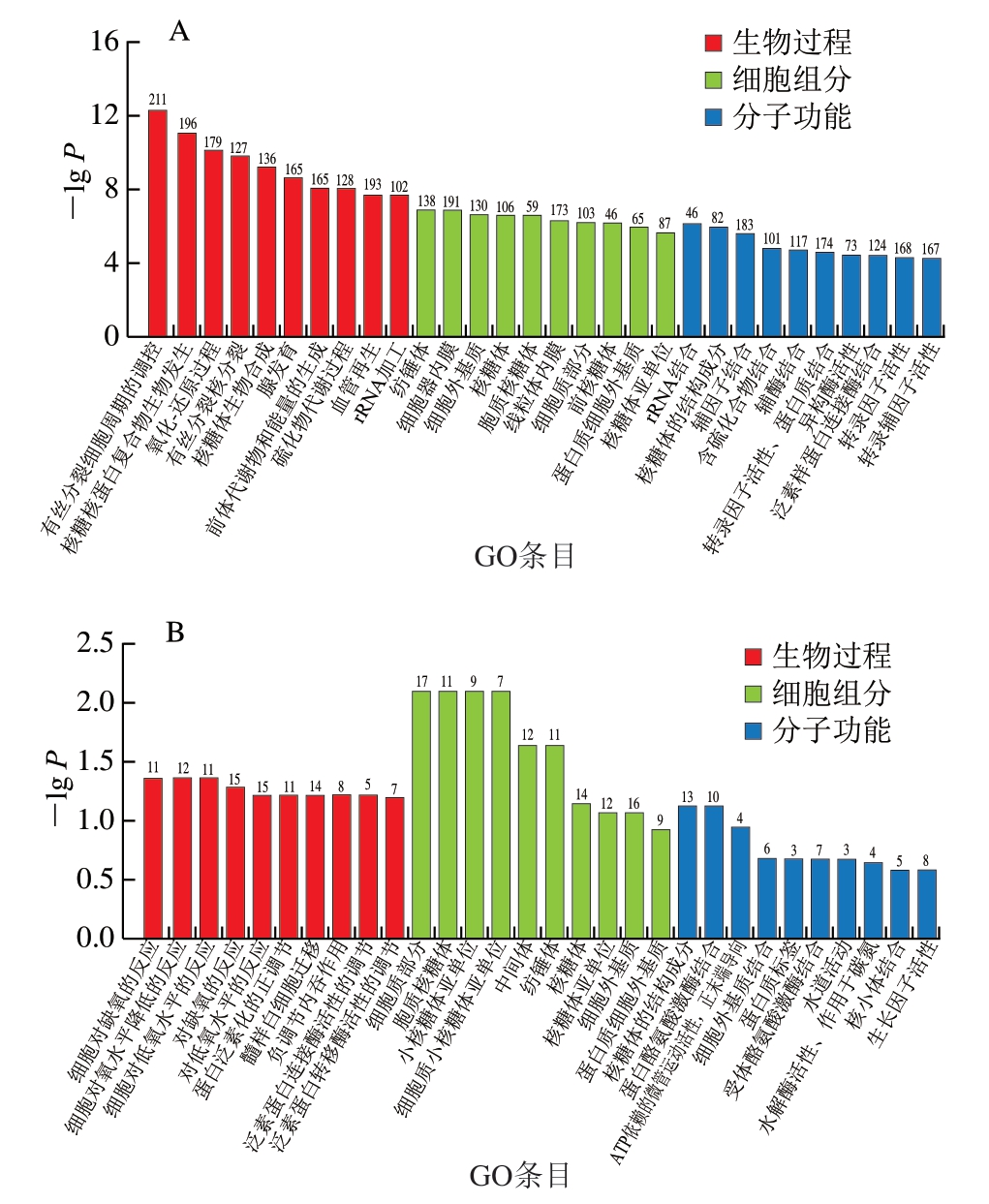
图7 各组DEGs的GO功能分类
Fig.7 Gene ontology functional classification of differentially expressed genes in three groups
A.H2O2 vs.对照组;B.Res+H2O2 vs.H2O2组。图8同。
2.5.4 KEGG分析
KEGG整合了系统水平的代谢网络分析工具,其核心特征包括代谢途径分类、酶学信息注释、反应动力学数据和物种特异性通路图。如图8所示,H2O2 vs.对照组中的DEGs富集在筛选的多个通路中,其中,富集DEGs数量最多的是人类T细胞白血病病毒1感染和脂质与动脉粥样硬化,分别含有104、87 个DEGs。Res+H2O2 vs.H2O2组中的DEGs富集最多的通路是朊病毒疾病和帕金森病,均含有18 个DEGs。
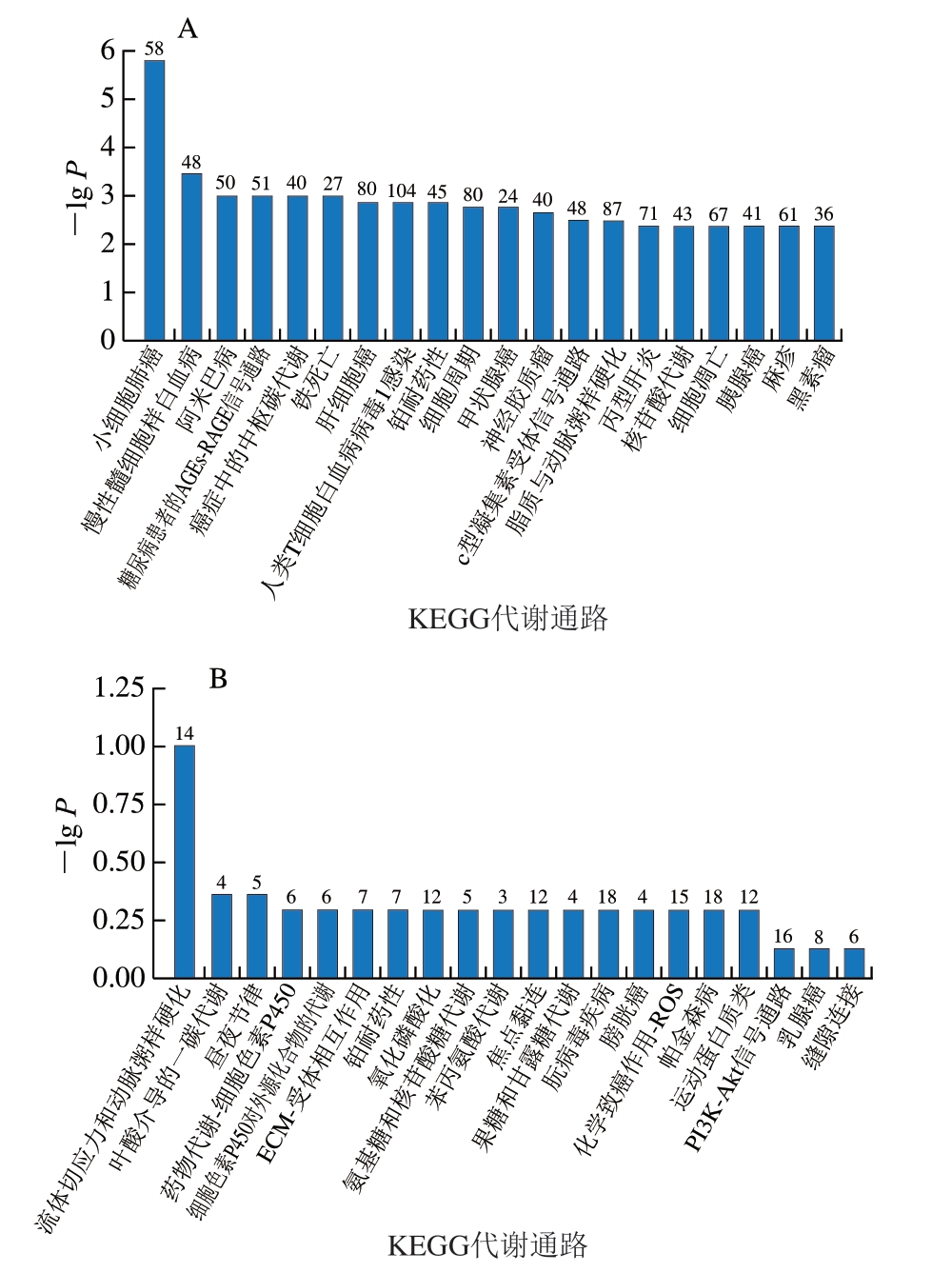
图8 各组DEGs的KEGG代谢通路分析
Fig.8 Kyoto Encyclopedia of Genes and Genomes metabolic pathway analysis of differentially expressed genes in three groups
AGEs.晚期糖基化终末产物(advanced glycosylation end products);RAGE.AGEs受体(receptor of AGEs);ECM.细胞外基质(extracellular matrix);PI3K-Akt.磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B)。
通过KEGG数据库对DEGs进行进一步分析,以总结H2O2 vs.对照组和Res+H2O2 vs.H2O2组的代谢途径变化及其中包含的主要DEGs。经过H2O2处理,凋亡途径中的基因显著上调。选择与凋亡通路相关的关键RNA作为重点研究对象,筛选出的基因及相关通路如表2所示。促凋亡基因Bax在H2O2 vs.对照组表达上调,在Res+H2O2 vs.H2O2组表达下调。抗凋亡基因Bcl-2在H2O2 vs.对照组表达下调,在Res+H2O2 vs.H2O2组表达上调。这与real-time PCR结果(图4)相一致。Lin Shuqin等[33]的转录组学分析结果表明,噻虫啉可以通过促进氧化应激上调促凋亡基因Bax和Caspase-3的表达,下调抗凋亡基因Bcl-2的表达,与本研究结果一致。本研究通过整合氧化应激、肌纤维类型转化与细胞凋亡三者的调控网络,结合转录组测序数据,进行关键分子关联分析凋亡因子与肌纤维标志基因共表达网络,Bcl-2的mRNA表达与MyHC I肌纤维表达呈正相关,H2O2组上调凋亡通路基因表达,白藜芦醇干预后MyHC I肌纤维表达上调。
表2 各组DEGs RNA-seq和real-time PCR数据比较分析
Table 2 Comparative analysis of RNA-seq and real-time PCR data of differentially expressed genes in three groups

名称KEGG通路H2O2 vs.对照组Res+H2O2 vs.H2O2组Plog2FCPlog2FC Bcl-2 凋亡;自噬-动物;凋亡-多物种;线粒体自噬-动物1.44×10-12 -1.70 5.71×10-4 1.89 Bax凋亡;凋亡-多物种1.01×10-13 1.222.17×10-4 -1.29基因
3 结 论
本研究基于转录组学和凋亡分析,探讨了白藜芦醇对氧化应激诱导的C2C12细胞肌纤维类型转化的影响,并揭示了其潜在分子机制。结果表明,白藜芦醇能够逆转氧化应激诱导的C2C12细胞肌纤维类型转化,调控肌纤维类型向氧化型肌纤维转变。氧化应激可显著增加C2C12细胞的凋亡率,而白藜芦醇预处理能降低Caspase-9、Caspase-3、Cleaved Caspase-3和Bax等凋亡相关蛋白的表达,同时上调Bcl-2抗凋亡蛋白的水平。转录组学分析显示,白藜芦醇可能通过抑制凋亡通路维持肌细胞的存活,从而促进肌纤维类型的正常转化。综上所述,本研究证实白藜芦醇可通过抑制氧化应激诱导的细胞凋亡促进C2C12细胞向慢速氧化型肌纤维转化。这些发现为白藜芦醇在改善肉类品质中的应用提供了理论依据,但并没有在体内实验中进一步证明,具有一定的局限性,未来研究可进一步在动物模型中验证其作用,并探索与其他营养或运动干预的协同效应。
[1] GUO X H, WU Y Q, WANG Y Y, et al.MyHCs developmental expression patterns and its effect on muscle fibre characteristics in pig[J].Journal of Applied Animal Research, 2020, 48(1): 176-183.DOI:10.1080/09712119.2020.1756823.
[2] 陈帅.低温环境对断奶仔猪生长性能和骨骼肌纤维的影响及下限温度临界值的探究[D].雅安: 四川农业大学, 2019.DOI:10.27345/d.cnki.gsnyu.2019.000851.
[3] LISTRAT A, GAGAOUA M, NORMAND J, et al.Contribution of connective tissue components, muscle fibres and marbling to beef tenderness variability in longissimus thoracis, rectus abdominis,semimembranosus and semitendinosus muscles[J].Journal of the Science of Food and Agriculture, 2020, 100(6): 2502-2511.DOI:10.1002/jsfa.10275.
[4] LU X, YANG Y Y, ZHANG Y M, et al.The relationship between myofiber characteristics and meat quality of Chinese Qinchuan and Luxi cattle[J].Annual Review of Animal Biosciences, 2021, 34(4):743-750.DOI:10.5713/ajas.20.0066.
[5] ZHANG K, LI X M, ZHAO J S, et al.Protective effects of chlorogenic acid on the meat quality of oxidatively stressed broilers revealed by integrated metabolomics and antioxidant analysis[J].Food & Function,2022, 13(4): 2238-2252.DOI:10.1039/d1fo03622j.
[6] SUN L C Y, MIYAJI N, YANG M, et al.Astaxanthin prevents atrophy in slow muscle fibers by inhibiting mitochondrial reactive oxygen species via a mitochondria-mediated apoptosis pathway[J].Nutrients,2021, 13(2): 379.DOI:10.3390/nu13020379.
[7] SHAUKAT A, HANIF S, SHAUKAT I, et al.Up-regulation of inflammatory, oxidative stress, and apoptotic mediators via inflammatory, oxidative stress, and apoptosis-associated pathways in bovine endometritis[J].Microbial Pathogenesis, 2024, 191: 106660.DOI:10.1016/j.micpath.2024.106660.
[8] MU J, LEI L, ZHENG Y C, et al.Oxidative stress induced by selenium deficiency contributes to inflammation, apoptosis and necroptosis in the lungs of calves[J].Antioxidants, 2023, 12(4): 796.DOI:10.3390/antiox12040796.
[9] 石拴霞, 阎一鑫, 宋诚, 等.白藜芦醇对Gc-1 spg细胞氧化应激损伤的作用研究[J].中国现代医学杂志, 2023, 33(19): 46-54.DOI:10.3969/j.issn.1005-8982.
[10] YANG K, LI X R, YANG S Q, et al.Japanese encephalitis virus infection induces mitochondrial-mediated apoptosis through the proapoptotic protein BAX[J].Frontiers in Microbiology, 2024, 15:1485667.DOI:10.3389/fmicb.2024.1485667.
[11] ISMAIL N Z, MD SAAD S, ADEBAYO I A, et al.The antiproliferative and apoptotic potential of Clinacanthus nutans against human breast cancer cells through targeted apoptosis pathway[J].Environmental Science and Pollution Research, 2022, 29(54): 81685-81702.DOI:10.1007/s11356-022-20858-y.
[12] MENG T T, XIAO D F, MUHAMMED A, et al.Anti-inflammatory action and mechanisms of resveratrol[J].Molecules, 2021, 26(1): 229.DOI:10.3390/molecules26010229.
[13] LI H G, XIA N, HASSELWANDER S, et al.Resveratrol and vascular function[J].International Journal of Molecular Sciences, 2019, 20(9):2155.DOI:10.3390/ijms20092155.
[14] WU S X, XIONG R G, HUANG S Y, et al.Effects and mechanisms of resveratrol for prevention and management of cancers: an updated review[J].Critical Reviews in Food Science and Nutrition, 2022,63(33): 12422-12440.DOI:10.1080/10408398.2022.2101428.
[15] 马玉静, 何荣香, 杨玲, 等.白藜芦醇的生物学功能及其在动物生产中的应用[J].中国畜牧兽医, 2019, 46(11): 3234-3243.DOI:10.16431/j.cnki.1671-7236.2019.11.012.
[16] TRUONG V L, JUN M, JEONG W S.Role of resveratrol in regulation of cellular defense systems against oxidative stress[J].BioFactors,2017, 44(1): 36-49.DOI:10.1002/biof.1399.
[17] 吴少强, 刘雨帆, 韦义荣, 等.白藜芦醇通过PROX1/SIRT1信号通路调控山羊肌纤维类型转化的机制研究[J].畜牧兽医学报, 2025,56(1): 201-212.
[18] MENG Q W, SUN S S, BAI Y S, et al.Effects of dietary resveratrol supplementation in sows on antioxidative status, myofiber characteristic and meat quality of offspring[J].Meat Science, 2020,167: 108176.DOI:10.1016/j.meatsci.2020.108176.
[19] 孙静, 左惠心, 刘昀阁, 等.白藜芦醇通过Akt/FoxO信号通路促进牛肌纤维类型转化的研究[J].食品与发酵工业, 2025, 51(2): 83-90.DOI:10.13995/j.cnki.11-1802/ts.038911.
[20] WANG L K, FENG Z X, WANG X, et al.DEGseq: an R package for identifying differentially expressed genes from RNA-seq data[J].Bioinformatics, 2010, 26(1): 136-138.DOI:10.1093/bioinformatics/btp612.
[21] AUTI A, ALESSIO N, BALLINI A, et al.Protective effect of resveratrol against hypoxia-induced neural oxidative stress[J].Journal of Personalized Medicine, 2022, 12(8): 1202.DOI:10.3390/jpm12081202.
[22] SHAN Q Q, LI N, ZHANG F, et al.Resveratrol suppresses annulus fibrosus cell apoptosis through regulating oxidative stress reaction in an inflammatory environment[J].BioMed Research International,2021, 2021: 1-6.DOI:10.1155/2021/9100444.
[23] MOREIRA-PINTO B, COSTA L, FELGUEIRA E, et al.Low doses of resveratrol protect human granulosa cells from inducedoxidative stress[J].Antioxidants, 2021, 10(4): 561.DOI:10.3390/antiox10040561.
[24] YU H M, GONG Z S, WANG G D, et al.DHA attenuates cartilage degeneration by mediating apoptosis and autophagy in human chondrocytes and rat models of osteoarthritis[J].In Vitro Cellular &Developmental Biology-Animal, 2023, 59(6): 455-466.DOI:10.1007/s11626-023-00781-3.
[25] VOGLER M, BRAUN Y, SMITH V M, et al.The BCL2 family: from apoptosis mechanisms to new advances in targeted therapy[J].Signal Transduction and Targeted Therapy, 2025, 10(1): 91.DOI:10.1038/s41392-025-02176-0.
[26] CHANG M Y, LIU R Q, CHEN B Q, et al.hBMSC-EVs alleviate weightlessness-induced skeletal muscle atrophy by suppressing oxidative stress and inflammation[J].Stem Cell Research & Therapy,2025, 16(1): 46.DOI:10.1186/s13287-025-04175-y.
[27] BERTERO E, POPOIU T A, MAACK C.Mitochondrial calcium in cardiac ischemia/reperfusion injury and cardioprotection[J].Basic Research in Cardiology, 2024, 119(4): 569-585.DOI:10.1007/s00395-024-01060-2.
[28] WANG K X, ZHU Q, LIU W, et al.Mitochondrial apoptosis in response to cardiac ischemia-reperfusion injury[J].Journal of Translational Medicine, 2025, 23(1): 125.DOI:10.1186/s12967-025-06136-8.
[29] 刘斌, 吴孟海, 董静, 等.脂肪基质细胞诱导分化为神经元细胞的实验[J].中国组织工程研究与临床康复, 2010, 14(1): 15-18.
[30] ZHANG R, ZHANG Y Y, XIN X D, et al.Dual-targeting antiproliferation hybrids derived from 1-deoxynojirimycin and kaempferol induce MCF-7 cell apoptosis through the mitochondriamediated pathway[J].Journal of Natural Products, 2021, 84(5): 1534-1543.DOI:10.1021/acs.jnatprod.1c00014.
[31] WANG M Y, CHAO M K, HAN H Z, et al.Hinokiflavone resists HFDinduced obesity by promoting apoptosis in an IGF2BP2-mediated Bim m6A modification dependent manner[J].Journal of Biological Chemistry, 2024, 300(9): 107721.DOI:10.1016/j.jbc.2024.107721.
[32] ALSHEHRI M A, ALISSA M, ALGHAMDI A.Resveratrol attenuates cyclophosphamide-induced hepatic apoptosis in association with the inhibition of oxidative stress and inflammation in a rat model of acute liver injury[J].Tissue and Cell, 2025, 93: 102728.DOI:10.1016/j.tice.2025.102728.
[33] LIN S Q, XIAO Y J, LI S Y, et al.Thiacloprid exposure induces oxidative stress, endoplasmic reticulum stress, and apoptosis in the liver of Mauremys reevesii[J].Ecology and Evolution, 2025, 15(2):e70936.DOI:10.1002/ece3.70936.