风干肠是一种东北特色发酵肉制品,因其独特的风味深受消费者喜爱[1]。传统风干肠采用自然发酵的生产方式,依赖于原料肉和环境中的微生物群落,形成典型的质地和风味[2-3]。自然发酵的风干肠通常生产周期较长,且依赖于经验性的生产方式,其生产条件极易受到环境和季节变化的影响,从而导致优势菌种组成出现显著差异。这种差异进一步引发了不同批次产品在品质和风味上的不稳定现象[4]。因此,为提升东北地区风干肠的产品品质并稳定其风味特征,接种发酵剂是有效的解决途径。该方法不仅能通过调控发酵过程缩短生产周期,还能提高产品安全性及风味等品质特性。
乳酸菌是发酵肉制品生产中常用的发酵剂,可抑制致病菌和腐败菌的繁殖,还可通过降解亚硝胺和生物胺(发酵肉制品中常见的有害物质)提高产品的安全性;促进亚硝基肌红蛋白生成,改善产品的颜色;降解肉中的蛋白质和脂质,促进风味物质的生成,提升产品的风味[5-8]。大量研究表明,乳酸菌在风干肠生产中发挥了积极作用。例如,Sui Yumeng等[9]向风干肠中接种106 CFU/g植物乳植杆菌(Lactiplantibacillus plantarum)SH7(分离自哈尔滨风干肠),显著降低了风干肠中色胺、腐胺、尸胺和组胺的含量。此外,Lu Jiasheng等[10]研究发现,通过向风干肠中接种106 CFU/mL植物乳植杆菌HRB1,显著提升了风干肠中醛类、醇类、酸类和酯类等关键风味化合物含量。
因此,为了解决上述问题并挖掘乳酸菌的应用潜力,本研究设计并构建了一种风干肠模拟体系。已有研究[4]表明,发酵过程对肌浆蛋白的降解作用比对肌原纤维蛋白更为显著,肌浆蛋白是促进风味形成的主要蛋白。基于此,本研究选取肉中的肌浆蛋白作为主要蛋白质来源进行深入分析。在前期研究中,课题组从传统风干肠中成功分离并筛选出3 株优势乳酸菌,分别为植物乳植杆菌、希腊魏斯氏菌(Weissella hellenica)和清酒广布乳杆菌(Latilactobacillus sakei),本研究旨在评估上述3 株乳酸菌在风干肠模拟体系中的发酵特性,重点分析其对风味形成的贡献,同时考察其对产品安全性的影响。
1 材料与方法
1.1 材料与试剂
新鲜猪臀肉、猪背膘取自哈尔滨香坊区比优特超市金锣冷鲜肉的大白猪品种。首先,去除脂肪与结缔组织后,使用无菌生理盐水对猪肉表面进行冲洗,以清除表面附着的杂质与血水。随后,将处理后的猪肉置于无菌操作台上,利用经过高温灭菌的手术刀和砧板,将其各表面均匀切除2 mm。
食盐、葡萄糖、玉泉大曲、味素、亚硝酸钠市购;MRS肉汤培养基、MRS琼脂培养基 青岛海博生物技术有限公司;0.22 μm除菌过滤器 贝兰伯生物技术有限公司。
1.2 仪器与设备
AL-104精密电子分析天平 北京赛多利斯仪器系统有限公司;XFS-260高压蒸汽灭菌锅、SPX-250B-D振荡培养箱 上海申安医用仪器厂;GL-21M高速冷冻离心机湖南湘仪实验室仪器开发有限公司;DELTA320 pH计瑞士Mettler Toledo公司;Mini-PROTEAN电泳系统美国Bio-Rad公司;PEN3便携式电子鼻气味分析仪德国AirSense公司;GCMS-QP2020单四极杆气相色谱-质谱联用仪 日本Shimadzu公司。
1.3 方法
1.3.1 发酵剂的制备
植物乳植杆菌、希腊魏斯氏菌和清酒广布乳杆菌菌株分离于自然发酵风干肠,保藏在东北农业大学肉品加工实验室。菌株在MRS肉汤中活化3 代后,4 ℃、6 000×g离心10 min,收集菌体细胞,以无菌生理盐水洗涤2 次后备用。
1.3.2 风干肠模拟体系的制备
参考Hu Yingying等[11]的方法并稍加修改。将鲜猪肉去除脂肪与结缔组织后切成1 cm3的小块,加入4 倍体积经灭菌的磷酸盐缓冲液(20 mmol/L),匀浆3 min,匀浆液4 ℃、5 300×g离心30 min,取上清液,过滤。随后,使用0.22 µm的除菌过滤器对肌浆蛋白溶液进行除菌处理。按照风干肠的配方,在滤液中添加37.5 g/L食盐、15 g/L葡萄糖、15 g/L玉泉大曲、4.5 g/L味素及0.15 g/L亚硝酸钠,用0.22 µm除菌过滤器过滤后备用。共设置4 个处理组,不接种菌株的模拟体系为对照组,其余3 组分别接种107 CFU/mL植物乳植杆菌、希腊魏斯氏菌、清酒广布乳杆菌,分别命名为LP、WH和LS处理组。然后将其置于25 ℃下振荡培养,于0、2、4、6 d取样,测定pH值、乳酸菌数和肌浆蛋白降解情况,于第6天测定生物胺含量,于第0、6天分别测定样品中的挥发性化合物含量,并进行电子鼻分析和主成分分析(principal component analysis,PCA)。
1.3.3 pH值和乳酸菌数的测定
使用p H 计测定各组发酵液的p H 值[12];参考GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》[13]中的方法测定乳酸菌数。
1.3.4 肌浆蛋白十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)
参考李可等[14]的方法并稍加修改,采用SDS-PAGE法测定蛋白降解情况,分离胶浓度12%,浓缩胶浓度5%。采用0.75 mm凝胶板,上样量为13 μL,初始电压为80 V,待样品进入分离胶后调整为120 V,结束后取出胶片,用染色液(1 g/L考马斯亮蓝R250、650 mL/L异丙醇、100 mL/L冰醋酸、250 mL/L甲醇)染色0.5 h后,用脱色液(850 mL去离子水、50 mL乙醇、100 mL冰乙酸)脱色至透明。
1.3.5 生物胺含量的测定
参考GB 5009.208—2016《食品安全国家标准 食品中生物胺的测定》[15]中的方法测定样品中生物胺含量。
1.3.6 气味特征的测定
参考Yin Xiaoyu等[16]的方法并稍作修改。取3 mL样品放入顶空瓶中,45 ℃水浴加热30 min,随后用电子鼻分析。参数设置:样品准备时间5 s;采样时间间隔1 s;传感器自清洗时间100 s;传感器归零时间5 s;进样流量300 mL/min;样品测试时间60 s。电子鼻的传感器及其响应气味物质种类如表1所示。
表1 电子鼻传感器性能描述
Table 1 Performance description of electronic nose sensors

传感器名称响应气味物质种类W1C芳香成分和苯类W5S氮氧化合物W3C芳香成分和氨类W6S氢化物W5C短链烷烃芳香成分W1S甲基类W1W硫化物W2S醇类、醛类和酮类W2W芳香成分和有机硫化物W3S长链烷烃
1.3.7 挥发性化合物的测定
参考Chen Qian等[17]的方法并稍作修改。采用顶空固相微萃取-气相色谱-质谱法测定挥发性化合物。取3 mL样品放入20 mL顶空瓶中,按照Hu Yingying等[11]所描述的方法,加入3 μL 1,2-二氯苯(100 mg/L)作为内标物,进行半定量分析。密封后置于45 ℃平衡20 min,平衡后于同温度下以50/30 µm DVB/CAR/PDMS萃取头萃取35 min,将萃取头插入气相色谱-质谱仪进样口,解吸3 min,对挥发性化合物进行分析。气相色谱条件:InertCapWax毛细管柱(60 m×0.25 mm,0.25 µm);进样口温度230 ℃;不分流模式进样;以氦气为载气,流速1 mL/min;升温程序:柱初始温度40 ℃,保持3 min,以5 ℃/min升温至200 ℃,后以10 ℃/min升温至230 ℃,保持2 min。质谱条件:电子电离源;离子源温度230 ℃;质量扫描范围m/z 45~500。对于挥发性化合物,将其质谱与NIST17质谱库进行比对,取相似度大于85%的物质作为定性结果;通过内标法进行定量分析,结果以µg/kg表示。
1.4 数据处理
所有实验均重复3 次,结果以平均值±标准差表示。采用Statistix 8.1软件统计、分析数据,使用Tukey HSD程序进行差异显著性分析(P<0.05);采用Origin 2019软件绘图。
2 结果与分析
2.1 不同乳酸菌对风干肠模拟体系pH值和乳酸菌数的影响
由图1A可知,随着发酵的进行,对照组pH值无显著变化,接种乳酸菌的3 个处理组在发酵0~4 d pH值迅速下降,这与乳酸菌代谢碳水化合物产生乳酸、乙酸和丙酸等有机酸有关[18-19]。随后,LP和WH处理组pH值趋于平稳,这可能是因为发酵后期乳酸菌降解蛋白质生成肽、氨基酸和胺等碱性化合物[20-21]。发酵6 d后,接种组的pH值达4.31,显著低于对照组(P<0.05),接种组之间的pH值差异不显著。在风干肠的加工过程中,pH值的降低不仅能够有效抑制腐败菌和致病菌的生长,从而提升产品的食用安全性,同时还能促进亚硝酸盐分解生成亚硝基肌红蛋白,进而有助于产品的发色效果[22]。由图1B可知,对照组在整个发酵过程中均未检出乳酸菌,这是因为实验所用的肌浆蛋白和配料均经过0.22 μm除菌过滤器的除菌处理,保证了对照组始终处于无菌状态。因此,所构建的风干肠模拟体系成功实现了无菌环境的维持,有效排除了杂菌的干扰。此外,经6 d发酵后,LP、WH和LS处理组乳酸菌总数分别由第0天的7.05、7.11、7.17(lg(CFU/mL))增加至8.65、8.83、8.90(lg(CFU/mL))。乳酸菌增殖过程中会产生有机酸、过氧化氢和细菌素等抑菌物质,能够抑制有害微生物的生长繁殖,进而延长产品保质期[7]。
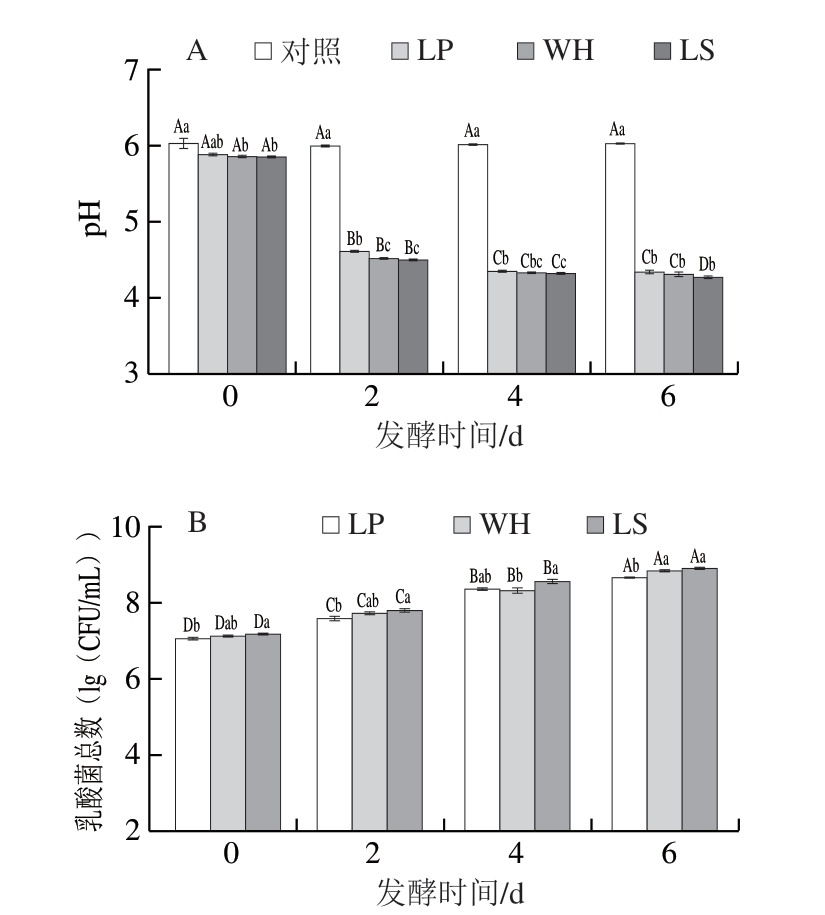
图1 接种不同乳酸菌的风干肠模拟体系发酵过程中pH值(A)和乳酸菌总数(B)的变化
Fig.1 Changes in pH (A) and lactic acid bacterial count (B) in model air-dried sausage system inoculated with different lactic acid bacteria during fermentation
大写字母不同表示同一组别、不同发酵时间差异显著(P<0.05);小写字母不同表示同一发酵时间、不同组间差异显著(P<0.05)。
2.2 不同乳酸菌对风干肠模拟体系SDS-PAGE图谱的影响
蛋白质降解可以提高发酵肉制品的风味和营养价值,通常受肌肉组织中的内源性蛋白酶和参与发酵的微生物产生的蛋白酶的影响[23]。由图2可知,随着发酵的进行,对照组蛋白条带几乎不变,表明内源性蛋白酶在这个过程中对蛋白质的降解作用很小[4];而接种组蛋白条带逐渐变浅并出现新的蛋白条带,表明蛋白质降解主要由乳酸菌蛋白酶引起[24]。发酵2 d后,接种组11 kDa处的条带、25~63 kDa间的条带明显变浅,17 kDa处出现蛋白条带,表明3 种乳酸菌均有较强的蛋白质降解能力;相较于其他处理组,在发酵6 d后,LP处理组中25~48、63~100 kDa范围内的条带基本消失,这表明植物乳植杆菌对蛋白质的降解能力最强。
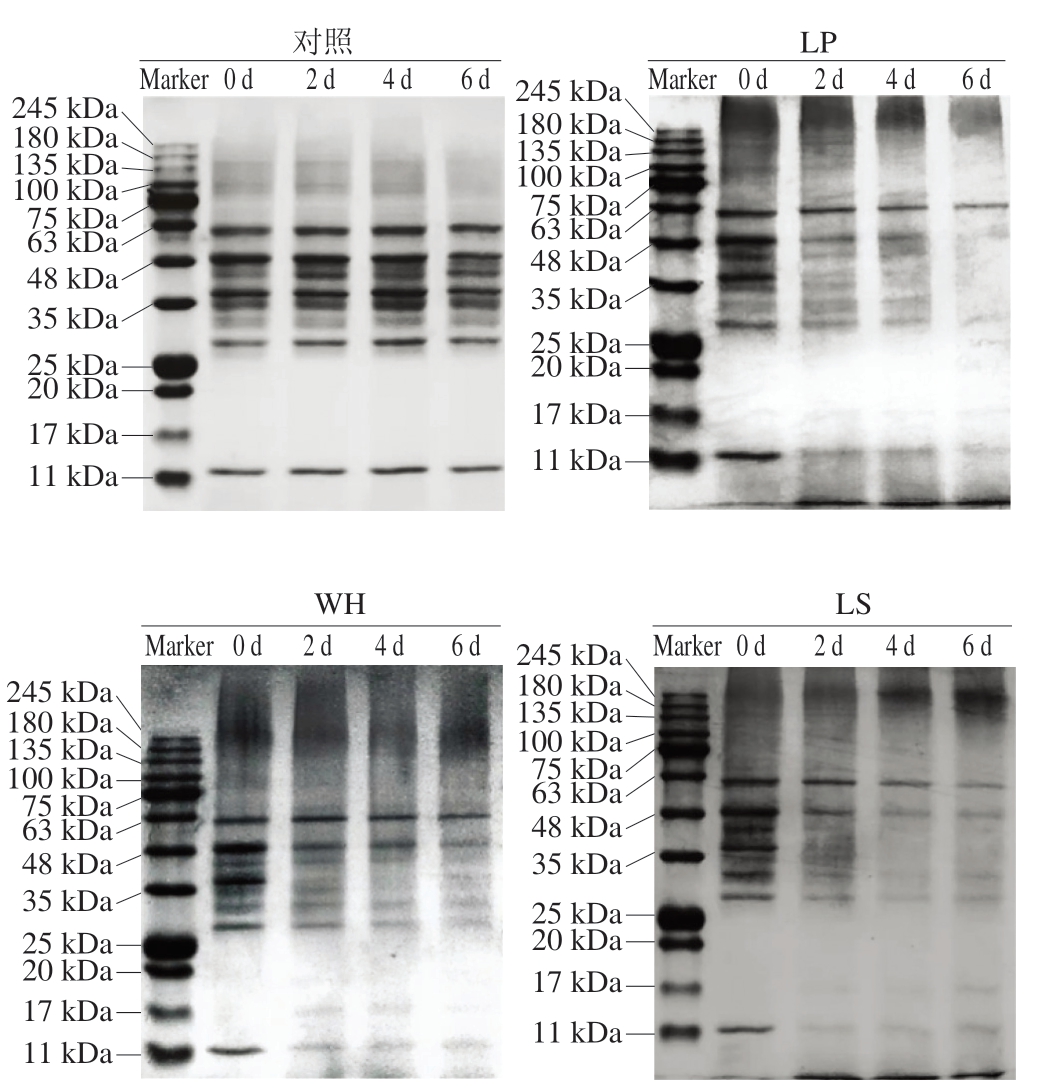
图2 接种不同乳酸菌的风干肠模拟体系发酵过程中SDS-PAGE图谱的变化
Fig.2 Changes in sodium dodecyl sulfate-polyacrylamide gel electrophoresis pattern of proteins in model air-dried sausage system inoculated with different lactic acid bacteria during fermentation
2.3 不同乳酸菌对风干肠模拟体系生物胺含量的影响
生物胺与多种生物学功能相关,包括调节血压、生长和神经状况、免疫发育和代谢活动,当其在体内大量蓄积会产生一定毒性作用甚至危及生命[25-26]。发酵肉制品中的生物胺少量来源于原料肉,大部分在发酵、加工和贮藏过程中生成[27]。接种发酵剂在促进蛋白水解产生风味的同时,也会对生物胺积累具有一定作用,因此进一步考察3 株乳酸菌对生物胺形成的影响。本研究选取发酵肉制品中最常见的腐胺、尸胺、组胺和酪胺进行测定。由图3可知,发酵6 d后,4 个实验组中组胺和酪胺的含量均在安全范围内(≤50 mg/kg)[27],LP和LS处理组未检出组胺。此外,LP处理组尸胺含量显著低于对照组,酪胺含量显著高于对照组;WH处理组尸胺含量显著高于对照组;LS处理组腐胺含量显著低于对照组、酪胺含量显著高于对照组(P<0.05)。以上结果表明,植物乳植杆菌能够有效抑制尸胺和组胺的积累,清酒广布乳杆菌能够有效抑制腐胺和组胺的积累。
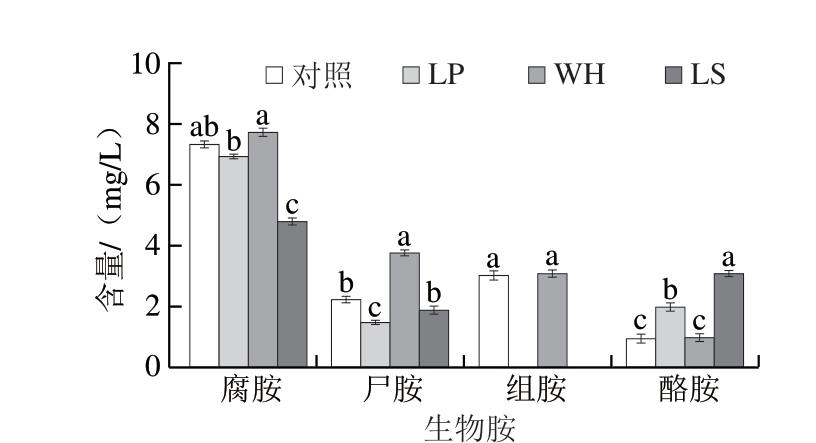
图3 接种不同乳酸菌的风干肠模拟体系发酵6 d后的生物胺含量
Fig.3 Biogenic amine contents in model air-dried sausage system inoculated with different lactic acid bacteria after 6 d of fermentation
小写字母不同表示组间差异显著(P<0.05)。
2.4 不同乳酸菌对风干肠模拟体系气味特征的影响
电子鼻是一种模拟嗅觉检测气味的仪器,具有多个可对相应气味产生响应的传感器[28]。电子鼻的灵敏度高且再现性好,与主观、模糊的人类感官相比,有着快速、准确和客观等优势,故广泛应用于气味特征的分析[29]。由图4A可知,发酵6 d后,与对照组相比,接种组W5S、W6S和W1S响应值较小,说明接种组氮氧化合物、氢化物和甲基类含量较少。由图4B可知,PC1和PC2的方差贡献率分别为59.7%和27.8%,累计方差贡献率为87.5%。发酵第0天的对照组和发酵6 d后的对照组相距较远,说明发酵前与发酵后气味差别较大;发酵6 d后的接种组与对照组相距较远,说明接种乳酸菌对气味特征影响较大;发酵6 d后的WH和LS处理组相距较近,说明WH和LS处理组气味特征相近。发酵第0天,对照组气味特征与W5S、W6S、W2W对应的氮氧化合物、氢化物、芳香成分和有机硫化物相关。发酵6 d后,对照组气味特征与W5S、W6S、W1S对应的氮氧化合物、氢化物、甲基类物质相关,LP处理组气味特征与W1C、W3C和W5C对应的芳香成分、苯类、氨类和短链烷烃相关,WH和LS处理组气味特征与W1W、W2S和W3S对应的硫化物、醇类、醛类、酮类和长链烷烃相关。
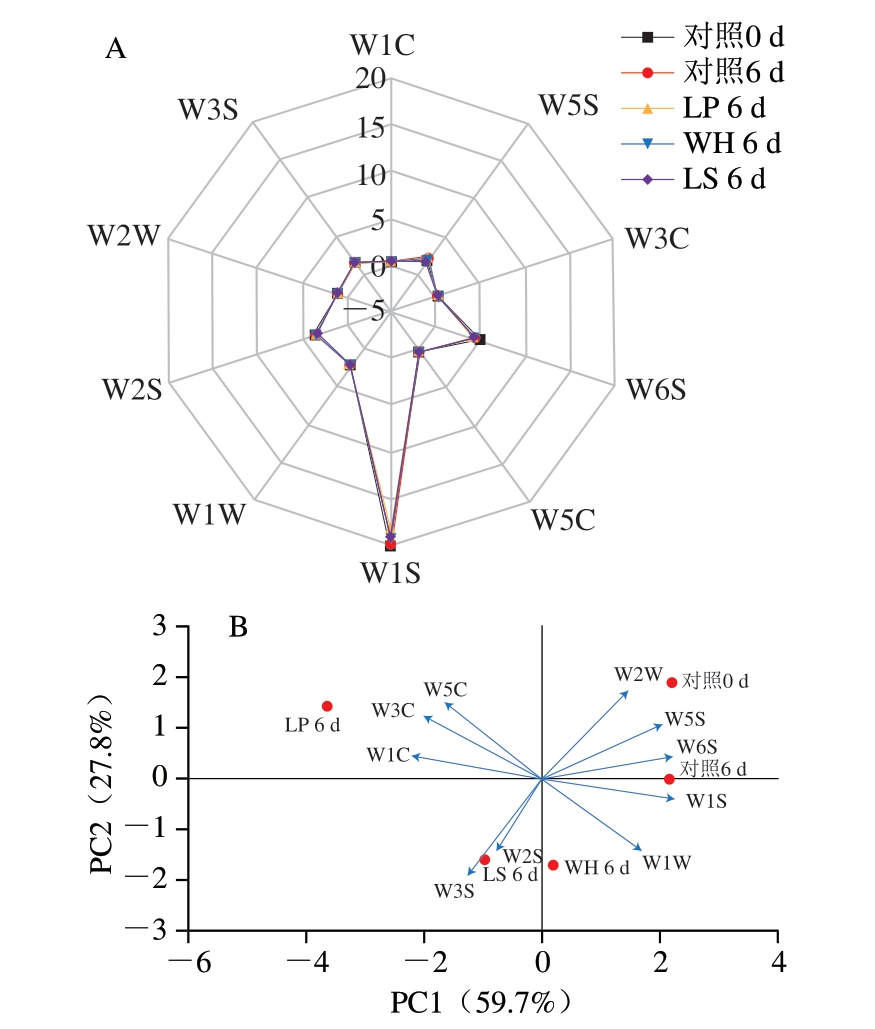
图4 接种不同乳酸菌的风干肠模拟体系发酵6 d后的电子鼻响应值雷达图(A)和PCA图(B)
Fig.4 Radar plot (A) and principal component analysis plot (B) of electronic nose sensor response for model air-dried sausage system inoculated with different lactic acid bacteria after 6 d of fermentation
2.5 不同乳酸菌对风干肠模拟体系挥发性化合物的影响
风干肠中的挥发性化合物主要由发酵过程中的化学和微生物代谢反应形成,主要包括脂肪酸自动氧化、美拉德反应、碳水化合物发酵和氨基酸降解等,特别是与微生物代谢相关的反应是赋予风干肠特征风味的主要途径[30]。由表2可知,风干肠模拟体系中共检出26 种挥发性化合物,醛类5 种、醇类5 种、酸类5 种、酯类7 种、烃类4 种。醛类和酯类物质的阈值较低,对发酵香肠风味的形成具有重要贡献;醇类、酸类和烃类的阈值较高,对风味形成贡献作用相对较小[31]。接种乳酸菌改变了风干肠模拟体系中挥发性化合物的组成与含量,发酵6 d后,LP处理组的挥发性化合物含量最高。其中醛类物质含量变化明显,LP(4.23 µg/kg)和WH处理组(4.30 µg/kg)醛类物质含量显著高于对照组(2.84 µg/kg)(P<0.05),醛类多源自氨基酸代谢和脂质氧化,大多数具有脂肪气味[32]。检出的醛类物质中壬醛的含量最高,壬醛源于n-9多不饱和脂肪酸的氧化[33],具有脂肪、柑橘和清新气味。接种组的醇类、酸类和酯类物质含量显著高于对照组(P<0.05),醇类多源自酒类添加和碳水化合物代谢,是酯类物质形成的前体[34]。检出的醇类物质中乙醇的含量最高,乙醇源于添加的曲酒和乳酸菌代谢碳水化合物,具有甘甜和酒气味。酸类多源自碳水化合物代谢和脂质氧化,是酯类物质形成的前体[35]。接种组检出的酸类物质含量显著高于对照组(P<0.05)。其中,乙酸主要来源于乳酸菌对发酵肉制品中碳水化合物的代谢,在所有处理组中均被检出,而酸类中己酸的含量最高,能够促进发酵肉制品风味的形成。接种组之间酯类物质含量差异显著(P<0.05),且LP处理组含量最高(25.95 µg/kg)。酯类多源自醇类和酸类物质的酯化,大多数具有水果气味,可对不良气味加以掩盖[36]。发酵6 d后,仅LP处理组检出烃类化合物,烃类多源自脂质氧化,主要由脂肪酸烷氧自由基均裂而成,在一定条件下能够生成醛类和醇类[37]。综上所述,植物乳植杆菌在促进体系中各类挥发性风味物质(如醛类、酯类和烃类等)的生成与累积方面表现出更显著的效果,从而在风味轮廓的形成中发挥了更为关键的作用,相较于希腊魏斯氏菌和清酒广布乳杆菌具有更突出的优势。
表2 接种不同乳酸菌发酵6 d后风干肠模拟体系中挥发性化合物含量的变化
Table 2 Changes in volatile compound contents in model air-dried sausage system inoculated with different lactic acid bacteria after 6 d of fermentation µg/kg
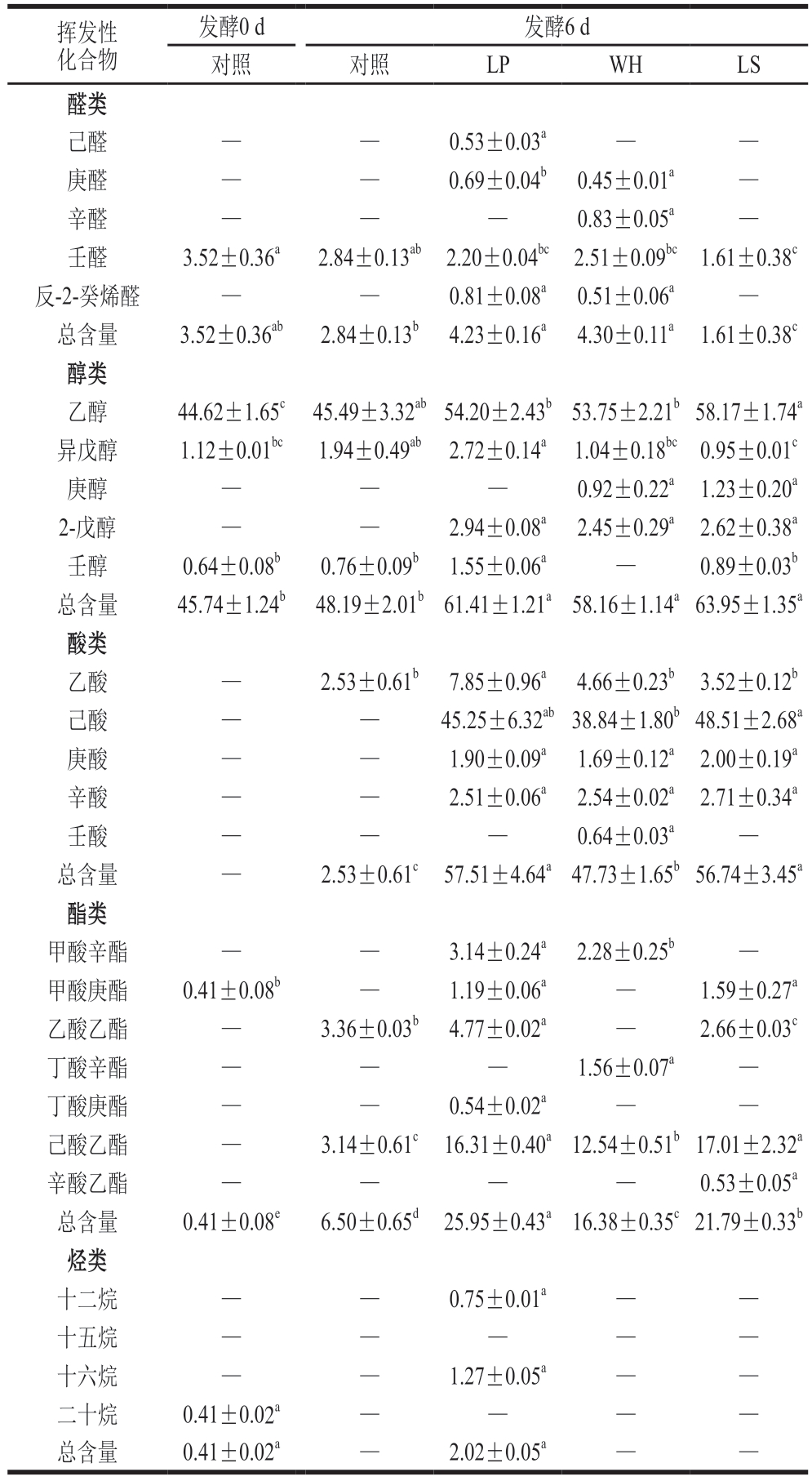
注:—.未检出;同行小写字母不同表示差异显著(P<0.05)。
挥发性化合物发酵0 d发酵6 d对照对照LPWHLS醛类己醛——0.53±0.03a——庚醛——0.69±0.04b 0.45±0.01a—辛醛——0.83±0.05a—壬醛3.52±0.36a2.84±0.13ab 2.20±0.04bc 2.51±0.09bc 1.61±0.38c反-2-癸烯醛——0.81±0.08a 0.51±0.06a—总含量3.52±0.36ab2.84±0.13b 4.23±0.16a 4.30±0.11a 1.61±0.38c醇类乙醇44.62±1.65c 45.49±3.32ab 54.20±2.43b 53.75±2.21b 58.17±1.74a异戊醇1.12±0.01bc1.94±0.49ab 2.72±0.14a 1.04±0.18bc 0.95±0.01c庚醇——0.92±0.22a 1.23±0.20a 2-戊醇——2.94±0.08a 2.45±0.29a 2.62±0.38a壬醇0.64±0.08b0.76±0.09b 1.55±0.06a—0.89±0.03b总含量45.74±1.24b 48.19±2.01b 61.41±1.21a 58.16±1.14a 63.95±1.35a酸类乙酸—2.53±0.61b 7.85±0.96a 4.66±0.23b 3.52±0.12b己酸——45.25±6.32ab 38.84±1.80b 48.51±2.68a庚酸——1.90±0.09a 1.69±0.12a 2.00±0.19a辛酸——2.51±0.06a 2.54±0.02a 2.71±0.34a壬酸——0.64±0.03a—总含量—2.53±0.61c 57.51±4.64a 47.73±1.65b 56.74±3.45a酯类甲酸辛酯——3.14±0.24a 2.28±0.25b—甲酸庚酯0.41±0.08b—1.19±0.06a—1.59±0.27a乙酸乙酯—3.36±0.03b 4.77±0.02a—2.66±0.03c丁酸辛酯——1.56±0.07a—丁酸庚酯——0.54±0.02a——己酸乙酯—3.14±0.61c 16.31±0.40a 12.54±0.51b 17.01±2.32a辛酸乙酯——0.53±0.05a总含量0.41±0.08e6.50±0.65d 25.95±0.43a 16.38±0.35c 21.79±0.33b烃类十二烷——0.75±0.01a——十五烷——十六烷——1.27±0.05a——二十烷0.41±0.02a——总含量0.41±0.02a—2.02±0.05a——
3 结 论
本研究探讨了植物乳植杆菌、希腊魏斯氏菌和清酒广布乳杆菌对风干肠模拟体系风味形成的影响。结果表明,在风干肠模拟体系接种乳酸菌可降低pH值、降解肌浆蛋白。其中,植物乳植杆菌降解肌浆蛋白的能力最强。此外,接种植物乳植杆菌能够有效抑制尸胺和组胺的积累,接种清酒广布乳杆菌能够有效抑制腐胺和组胺的积累。电子鼻气味特征响应和挥发性风味化合物的测定结果表明,乳酸菌的接种能够改变风干肠模拟体系的风味特征,增加醇类、酸类和酯类物质的含量,其中植物乳植杆菌能更好地促进酸类、酯类和烃类挥发性风味化合物生成。综上所述,植物乳植杆菌的接种对风干肠模拟体系的风味形成产生了明显的促进作用,可提升风干肠的安全性,作为优良的发酵剂用于其生产。
[1] HU Y Y, ZHANG L, LIU Q, et al.The potential correlation between bacterial diversity and the characteristic volatile flavour of traditional dry sausages from Northeast China[J].Food Microbiology, 2020, 91:103505.DOI:10.1016/j.fm.2020.103505.
[2] WEN R X, HU Y Y, ZHANG L, et al.Effect of NaCl substitutes on lipid and protein oxidation and flavor development of Harbin dry sausage[J].Meat Science, 2019, 156: 33-43.DOI:10.1016/j.meatsci.2019.05.011.
[3] 陈援援, 马凯华, 牛文秀, 等.微生物发酵剂对风干肠风味形成及变化的影响[J].食品科学, 2022, 43(14): 125-135.DOI:10.7506/spkx1002-6630-20210816-198.
[4] CHEN Q, LIU Q, SUN Q X, et al.Flavour formation from hydrolysis of pork sarcoplasmic protein extract by a unique LAB culture isolated from Harbin dry sausage[J].Meat Science, 2015, 100: 110-117.DOI:10.1016/j.meatsci.2014.10.001.
[5] WANG H, LIU J M, CHEN Q, et al.Biochemical properties of extracellular protease from Staphylococcus epidermidis isolated from Harbin dry sausages and its hydrolysis of meat protein[J].Food Bioscience, 2021, 42: 101130.DOI:10.1016/j.fbio.2021.101130.
[6] ZHU Y L, GUO L P, YANG Q L.Partial replacement of nitrite with a novel probiotic Lactobacillus plantarum on nitrate, color,biogenic amines and gel properties of Chinese fermented sausages[J].Food Research International, 2020, 137: 109351.DOI:10.1016/j.foodres.2020.109351.
[7] 高芳, 张开屏, 华晓青, 等.乳酸菌对发酵肉制品抑菌作用及风味特征的影响[J].食品科学, 2023, 44(9): 194-201.DOI:10.7506/spkx1002-6630-20220411-116.
[8] ASHAOLU T J, KHALIFA I, MESAK M A, et al.A comprehensive review of the role of microorganisms on texture change, flavor and biogenic amines formation in fermented meat with their action mechanisms and safety[J].Critical Reviews in Food Science and Nutrition, 2023, 63(19): 3538-3555.DOI:10.1080/10408398.2021.192 9059.
[9] SUI Y M, LU J S, ZHU Y G, et al.Effects of exogenous autoinducer-2 precursor on the ability of Lactiplantibacillus plantarum SH7 to degrade biogenic amines: in vitro and in a dry-sausage model[J].Food Bioscience, 2024, 60: 104263.DOI:10.1016/j.fbio.2024.104263.
[10] LU J S, SUI Y M, LIU X, et al.Effect of exogenous DPD on fermentation characteristics and flavour formation of Lactiplantibacillus plantarum HRB1 in vitro and in a dry sausage model: insights from the quorum sensing system[J].LWT-Food Science and Technology, 2025, 218: 117516.DOI:10.1016/j.lwt.2025.117516.
[11] HU Y Y, TIAN Y, ZHU J M, et al.Technological characterization and flavor-producing potential of lactic acid bacteria isolated from traditional dry fermented sausages in NorthEast China[J].Food Microbiology, 2022, 106: 104059.DOI:10.1016/j.fm.2022.104059.
[12] 刘保, 丁捷, 白婷, 等.植物乳杆菌对牦牛肌肉蛋白提取物的降解能力研究[J].中国测试, 2019, 45(10): 71-77.DOI:10.11857/j.issn.1674-5124.2019050047.
[13] 国家卫生和计划生育委员会, 国家食品药品监督管理总局.食品安全国家标准 食品微生物学检验 乳酸菌检验: GB 4789.35—2016[S].北京: 中国标准出版社, 2017.
[14] 李可, 孙立雪, 王琳梦, 等.超声波处理对类PSE鸡肉肌浆蛋白的结构性质和乳化性能影响[J].食品科学, 2024, 45(12): 220-228.DOI:10.7506/spkx1002-6630-20231003-008.
[15] 国家卫生和计划生育委员会, 国家食品药品监督管理总局.食品安全国家标准 食品中生物胺的测定: GB 5009.208—2016[S].北京: 中国标准出版社, 2017.
[16] YIN X Y, LÜ Y C, WEN R X, et al.Characterization of selected Harbin red sausages on the basis of their flavour profiles using HS-SPMEGC/MS combined with electronic nose and electronic tongue[J].Meat Science, 2021, 172: 108345.DOI:10.1016/j.meatsci.2020.108345.
[17] CHEN Q, HU Y Y, WEN R X, et al.Characterisation of the flavour profile of dry fermented sausages with different NaCl substitutes using HS-SPME-GC-MS combined with electronic nose and electronic tongue[J].Meat Science, 2021, 172: 108338.DOI:10.1016/j.meatsci.2020.108338.
[18] DE SOUZA E L, DE OLIVEIRA K Á, DE OLIVEIRA M E.Influence of lactic acid bacteria metabolites on physical and chemical food properties[J].Current Opinion in Food Science, 2023, 49: 100981.DOI:10.1016/j.cofs.2022.100981.
[19] 朱嘉敏, 么紫瑶, 李梦彤, 等.不同接种量的清酒乳杆菌对低钠盐风干肠品质的改善作用研究[J].食品工业科技, 2023, 44(7): 133-142.DOI:10.13386/j.issn1002-0306.2022060041.
[20] 李珊珊.传统发酵肉制品中发酵菌株的分离筛选及在牛肉发酵香肠中的应用初探[D].郑州: 河南农业大学, 2021.DOI:10.27117/d.cnki.ghenu.2021.000144.
[21] 李永杰, 唐月, 李慧瑶, 等.基于智能感官和气相色谱-质谱联用技术研究食盐添加量对风干肠风味特征的影响[J].食品科学, 2022,43(4): 1-7.DOI:10.7506/spkx1002-6630-20210221-221.
[22] 周超.酸肉中产一氧化氮乳酸菌的筛选及其对发酵香肠发色的影响[D].南京: 南京农业大学, 2010.DOI:10.7666/d.Y1763389.
[23] WANG D X, CHENG F, WANG Y, et al.The changes occurring in proteins during processing and storage of fermented meat products and their regulation by lactic acid bacteria[J].Foods, 2022, 11(16): 2427.DOI:10.3390/foods11162427.
[24] 王俊钢, 李宇辉, 岳建平, 等.不同产蛋白酶乳酸菌对风干牛肉蛋白质降解的影响[J].食品工业科技, 2022, 43(8): 117-123.DOI:10.13386/j.issn1002-0306.2021090189.
[25] SIVAMARUTHI B S, KESIKA P, CHAIYASUT C.A narrative review on biogenic amines in fermented fish and meat products[J].Journal of Food Science and Technology, 2021, 58(5): 1623-1639.DOI:10.1007/s13197-020-04686-x.
[26] 邓斯予, 曹立民, 隋建新.发酵食品加工与贮藏过程中生物胺的控制研究进展[J].食品安全质量检测学报, 2023, 14(1): 156-164.DOI:10.19812/j.cnki.jfsq11-5956/ts.2023.01.042.
[27] SCHIRONE M, ESPOSITO L, D’ONOFRIO F, et al.Biogenic amines in meat and meat products: a review of the science and future perspectives[J].Foods, 2022, 11(6): 788.DOI:10.3390/foods11060788.
[28] 廖美燕, 龙鸣, 洪晶, 等.电子鼻在乳及其制品检测中的应用研究进展[J].中国乳业, 2022(10): 57-64.DOI:10.12377/1671-4393.22.10.11.
[29] GÓRSKA-HORCZYCZAK E, GUZEK D, MOLĘDA Z, et al.Applications of electronic noses in meat analysis[J].Food Science and Technology, 2016, 36(3): 389-395.DOI:10.1590/1678-457x.03615.
[30] 刘英丽, 杨梓妍, 万真, 等.发酵剂对发酵香肠挥发性风味物质形成的作用及影响机制研究进展[J].食品科学, 2021, 42(11): 284-296.DOI:10.7506/spkx1002-6630-20201012-085.
[31] 王雍雍, 陈磊, 魏从娇, 等.功能菌株复配对发酵香肠抗氧化特性及风味的作用[J].食品科学, 2023, 44(22): 149-157.DOI:10.7506/spkx1002-6630-20221111-127.
[32] HU Y Y, LI Y J, LI X A, et al.Application of lactic acid bacteria for improving the quality of reduced-salt dry fermented sausage: texture,color, and flavor profiles[J].LWT-Food Science and Technology, 2022,154: 112723.DOI:10.1016/j.lwt.2021.112723.
[33] 曲乐天, 夏腾, 张晶晶, 等.SPME-GC-MS联用法测定鲤和草鱼肌肉挥发性腥味物质的条件优化[J].水产学杂志, 2023, 36(1): 53-58.DOI:10.3969/jissn.1005-3832.2023.01.008.
[34] 刘思婷, 刘馨屿, 王雯萱, 等.植物乳杆菌接种量对低盐风干肠品质特性及风味特征的影响[J].食品科学, 2022, 43(22): 97-104.DOI:10.7506/spkx1002-6630-20220306-077.
[35] 桂江平, 于化泓, 余勃, 等.基于GC-MS江西米酒风味物质的分析及品质比较[J].中国酿造, 2023, 42(1): 231-237.DOI:10.11882/j.issn.0254-5071.2023.01.039.
[36] HU Y Y, WANG J W, LIU Q, et al.Unraveling the difference in flavor characteristics of dry sausages inoculated with different autochthonous lactic acid bacteria[J].Food Bioscience, 2022, 47: 101778.DOI:10.1016/j.fbio.2022.101778.
[37] 张艳, 王圣开, 聂青玉, 等.原料对预制烤鱼挥发性成分的影响[J].食品工业科技, 2023, 44(5): 241-250.DOI:10.13386/j.issn1002-0306.2022040182.