肠道菌群是指寄居在人类及其他动物肠道内的所有微生物群落的总称,被认为是宿主体内最丰富、最复杂的微生态系统[1-2]。在人体肠道中,菌群结构在门水平上以厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria)为优势菌群,约占肠道微生物总量的90%。在属水平上,根据菌群对宿主的利害关系,可将其分为3 类:1)以双歧杆菌属(Bifidobacterium)、乳杆菌属(Lactobacillus)、阿克曼菌属(Akkermansia)为代表的益生菌;2)以梭菌属(Clostridium)、葡萄球菌属(Staphylococcus)、脱硫弧菌属(Desulfovibrio)为代表的致病菌;3)以埃希菌属(Escherichia)、肠球菌属(Enterococcus)为代表的机会致病菌[3]。肠道菌群通过参与宿主营养物质的消化吸收、能量代谢调控、免疫系统稳态维持等生理过程,对宿主体内稳态发挥重要调控作用。
肉类食品作为人体重要的营养物质来源,其与肠道菌群的互作关系是近年来食品科学领域的研究热点。在Web of Science核心合集中以“Meat”“Gut microbiota”为关键词、SCIE(Science Citation Index Expanded)收录和检索年限2021—2025年为过滤条件,共检索出944 篇相关文献。这些研究主要聚焦于各种肉类膳食干预对疾病模型动物的改善效应或治疗效果,以及肉类膳食对肠道微生物丰度的调控作用。不同肉类能够通过改变肠道微环境、上调或下调特定肠道微生物丰度改变肠道菌群组成和多样性,为系统阐明肉类膳食与肠道微生物的互作关系及肠道菌群对人体健康的影响,本文对肉类与肠道菌群互作关系研究进展进行总结,为肉类膳食与肠道菌群的进一步研究提供参考。
1 肠道菌群的功能
肠道菌群参与宿主营养物质代谢,产生具有生物活性的代谢物,如短链脂肪酸(short-chain fatty acids,SCFAs)、胆汁酸(bile acids,BAs),进而调控肠道微生态平衡和肠道微生物的活性,从而对宿主肥胖、免疫等产生影响。在肥胖调控方面,肠道菌群可通过脑-肠轴信号通路影响宿主的摄食行为及能量代谢平衡。肠道厚壁菌门、拟杆菌门丰度能够反映宿主肥胖状况,通过膳食干预降低厚壁菌门与拟杆菌门比值(F/B比值)可有效改善肥胖症状。SCFAs、BAs等肠道微生物代谢产物具有促进脂质分解或抑制脂质合成的作用,能够有效抑制或减缓肥胖症状发生;在免疫调节方面,肠道益生菌不仅能竞争病原菌的营养成分和生存空间,有效抑制病原菌的定植,还能减轻炎症反应和影响免疫器官发育。肠道菌群的代谢产物对防御基因的表达和免疫受体的激活也具有促进作用。此外,老年群体中常见的免疫力下降现象也与肠道菌群多样性降低和肠道益生菌减少高度相关。
1.1 肠道菌群与肥胖症
1.1.1 通过调节饮食行为影响肥胖症发生
肥胖症是一种复杂的多因素疾病,家族遗传、运动量减少及摄入食物过多等因素均有可能导致肥胖[4]。肠道菌群能通过改变宿主的饮食行为影响肥胖症的发生。一方面,肠道菌群能够通过免疫系统与内分泌系统作用于大脑,或经脑-肠轴神经通路,通过神经冲动信号传导直接作用于下丘脑食欲调节中枢,从而改变大脑对营养的感知并调控食欲。在此双向调控机制下,肠道菌群不仅能够影响宿主的饮食偏好和进食量,还能形成完整的“肠道-大脑”反馈调节环路[5],从而影响肥胖症的发生发展。
1.1.2 F/B比值与肥胖症发生呈正相关
肠道菌群中的F/B比值可能与肥胖呈正相关[6-7]。肥胖症患者的肠道菌群特征表现为厚壁菌门丰度显著增加而拟杆菌门丰度显著降低[8],同时伴随肠道菌群多样性下降。Hildebrandt等[9]通过动物实验进一步证实,高脂饮食可导致小鼠肠道拟杆菌门比例降低,厚壁菌门和变形菌门比例升高。由此可见,肠道菌群中的F/B比值增加与肥胖症的发生发展紧密相关,且高脂饮食可能是导致F/B比值升高的关键。通过合理规划饮食结构并动态监测F/B比值,可有效引导肥胖患者减少高脂食物摄入,从而维持厚壁菌门与拟杆菌门等关键微生物的丰度平衡与稳定,进而改善肥胖症状。
1.1.3 肠道代谢产物对肥胖的影响
肠道益生菌在参与食物消化与营养物质吸收过程中代谢产生的SCFAs、BAs等生物活性物质对改善肠胃功能、调控体重具有重要作用。SCFAs主要包括乙酸、丙酸和丁酸等,其中丁酸盐对调节体质量、改善脂肪分布及增强胰岛素敏感性具有显著影响。Den Besten等[10]研究表明,饮食中的丁酸盐能通过降低过氧化物酶体增殖物激活受体活性并抑制其表达,促进脂质从合成向利用转化,从而抑制脂肪积累并发挥减肥效应。梭菌属作为丁酸盐的主要产生菌之一,不仅参与维持肠道稳态[11],还在抑制肥胖和调节体质量方面发挥重要作用。
BAs来源于肝脏中胆固醇的分解,初级BAs储存于胆囊后进入肠道系统,约95%的BAs在回肠末端被吸收进入肠道上皮细胞,进而从基底外侧膜分泌,由肝门静脉重新吸收回肝脏,剩余的BAs则经肠道细菌的分解代谢作用产生次级BAs,由后肠吸收[12-13]。这种肝-肠循环机制对维持机体脂质能量代谢稳态具有重要意义。此外,BAs不仅能促进脂质的消化与吸收,其合成与分解还直接影响脂质合成。研究[14]显示,肠道微生物介导的BAs组成改变能够促进G蛋白偶联受体5(G protein-coupled receptor 5,TGR5)和法尼醇X受体(farnesoid X receptor,FXR)活化,进而促进脂质分解或抑制其合成。此外,非12α-羟基化胆汁酸可显著增强小鼠体内的能量消耗,使其在高脂饮食下不易发生肥胖[15]。
1.2 肠道菌群与免疫力
1.2.1 通过抑制病原菌提升宿主免疫力
肠道菌群通过抑制病原菌定植和调节免疫反应增强宿主免疫力[16-17]。具体机制:肠道益生菌通过竞争性排斥作用与病原菌争夺营养物质和生存空间,同时分泌抗菌物质直接抑制病原菌生长,从而有效降低其对肠道黏膜的侵袭风险。Wang Yuanyuan等[18]研究证实,口服植物乳植杆菌ZDY2013和双歧杆菌WBIN03可有效缓解溃疡性结肠炎小鼠模型的炎症反应,其机制与抑制炎症因子产生有关。此外,肠道菌群还能促进肠道黏膜相关淋巴组织发育、维持淋巴结大小,从而提高人体免疫力[19]。
1.2.2 通过代谢产物提升宿主免疫力
以拟杆菌属(Bacteroides)和双歧杆菌属为代表的益生菌通过生物转化食物成分生成活性代谢产物,进而调控宿主肠道免疫系统功能。其中,SCFAs通过被动运输、转运蛋白运输等方式进入肠上皮细胞,通过促进防御相关基因表达减轻肠道黏膜屏障损伤并维持其结构功能完整性;SCFAs还能够通过调节免疫细胞的基因表达、增殖分化与细胞凋亡以及特异性免疫和非特异性免疫,对宿主免疫力发挥重要作用[20-21]。BAs作为另一重要的活性代谢产物,在抑制炎症反应和维持肝、肠免疫稳态方面也发挥着重要作用。BAs通过激活FXR、TGR5调控免疫细胞活性,抑制炎症因子。FXR主要由初级BAs激活,而TGR5则主要由次级BAs激活,值得注意的是,这2 种受体在单核细胞、巨噬细胞、树突状细胞、自然杀伤细胞等先天免疫细胞中均呈现高表达[22]。
1.2.3 肠道菌群功能退化降低宿主免疫力
肠道菌群组成和多样性会随着人体的衰老发生动态演替,表现为生态失衡或功能退化,进而导致宿主免疫力下降。具体而言,老年个体肠胃中乳杆菌属、丁酸弧菌属(Butyrivibrio)等多种益生菌丰度显著降低[23],而大肠杆菌(Escherichia coli)、脱硫弧菌属、变形杆菌属(Proteus)等致病菌丰度则显著增加。这种肠道菌群结构失衡及多样性降低导致老年群体免疫功能下降,易出现肠道炎症及肠道黏膜屏障损伤[24],增加病原体易感性。值得注意的是,宿主遗传背景、饮食结构等因素也会影响肠道菌群组成、丰度和多样性,进而影响宿主免疫系统功能。
2 肉类膳食对肠道菌群的影响
在人类所消费的肉类中,畜肉、禽肉及鱼肉占据主要比重。其中,畜肉富含高质量的蛋白质、铁、锌、B族维生素等,可增强营养、刺激消化液分泌等,但过量摄入可能导致肠道微生物多样性降低,并增加心脏疾病、中风和某些癌症的发生风险[25]。禽肉和鱼肉通常含有较少的饱和脂肪和胆固醇,是蛋白质、B族维生素、铁、锌、硒及多不饱和脂肪酸的主要来源。
不同肉类对肠道微生物丰度影响存在显著差异。张广红[26]发现,摄食牛肉会显著降低肠道变形菌门丰度,而摄食鸡肉对肠道菌群丰度的影响较小。Almajed等[27]研究发现,放线菌门、拟杆菌门及珀氏解黄酮菌(Flavonifractor plautii)的丰度与红肉摄食量呈正相关,而普氏粪杆菌(Faecalibacterium prausnitzii)及拟杆菌门与白肉摄食量呈正相关。Zhu Yingying等[28]认为,相较于喂食猪肉和牛肉蛋白组,喂食鸡肉和鱼肉蛋白组大鼠厚壁菌门丰度升高,但拟杆菌门丰度降低;喂食鸡肉蛋白大鼠放线菌门丰度较高,而喂食牛肉蛋白大鼠变形菌门丰度较高。在属水平上,乳杆菌属在鸡肉和鱼肉蛋白组丰度更高,而震颤杆菌属(Oscillibacter)在猪肉和牛肉蛋白组丰度更高。
2.1 牛肉摄入对肠道菌群的影响
牛肉脂肪含量较低,且富含蛋白质、肌氨酸、肉毒碱、VB6、VB12及锌、镁、铁、钾等营养物质,是优质的肉类来源。牛肉对肠道菌群的影响研究见表1。在门水平上,小鼠摄食牛肉后,其肠道菌群中厚壁菌门和变形菌门丰度升高,拟杆菌门和放线菌门丰度降低。Schutkowski[29]、Williams[30]等关于牛肉对猪肠道微生物影响的研究中也观察到相似结果。然而,牛肉摄入导致人肠道菌群中厚壁菌门丰度升高、拟杆菌门和变形菌门丰度减少,这与小鼠和猪的研究结果存在一定差异,可能与不同物种肠道微生物组成和丰度差异有关。在属水平上,牛肉摄入能够改变小鼠肠道中双歧杆菌属、肠球菌属、普雷沃氏菌属(Prevotella)、链球菌属(Streptococcus)、经黏液真杆菌属(Blautia)、梭菌属、脱硫弧菌属、乳杆菌属、颤螺菌属(Oscillospira)、瘤胃球菌属(Ruminococcus)、埃希氏菌属、狭义梭菌属(Clostridium sensu stricto)、罗姆布茨菌属(Romboutsia)、粪杆菌属(Faecalibacterium)、毛梭菌属(Lachnoclostridium)、拟杆菌属、另枝菌属(Alistipes)丰度;在猪肠道中,瘤胃球菌属和梭菌属丰度升高、普雷沃氏菌属丰度降低;在人体肠道中,牛肉摄入可促进梭菌属、毛螺菌属(Lachnospira)、瘤胃球菌属丰度增加。相较于小鼠,人体肠道对牛肉的反应与猪更为相似。在受牛肉影响的微生物中,梭菌属、埃希氏菌属及脱硫弧菌属可能对人体有害;乳杆菌属通常被认为是对人体有益的微生物,但乳杆菌属作为肠道微生物多样性较低时的主要菌种,可能促进肥胖的发生[31];瘤胃球菌属是SCFAs的重要生产菌属,有助于维持肠道稳态并抵抗过敏、结肠炎、结肠癌等,但其丰度也与哮喘、湿疹及系统性红斑狼疮等疾病存在高度相关性;普雷沃氏菌属既能协助分解蛋白质和碳水化合物[32],也可作为条件致病菌引起肠道炎症、类风湿性关节炎等病症。
表1 牛肉摄入对肠道菌群的影响
Table 1 Influence of beef consumption on gut microbiota
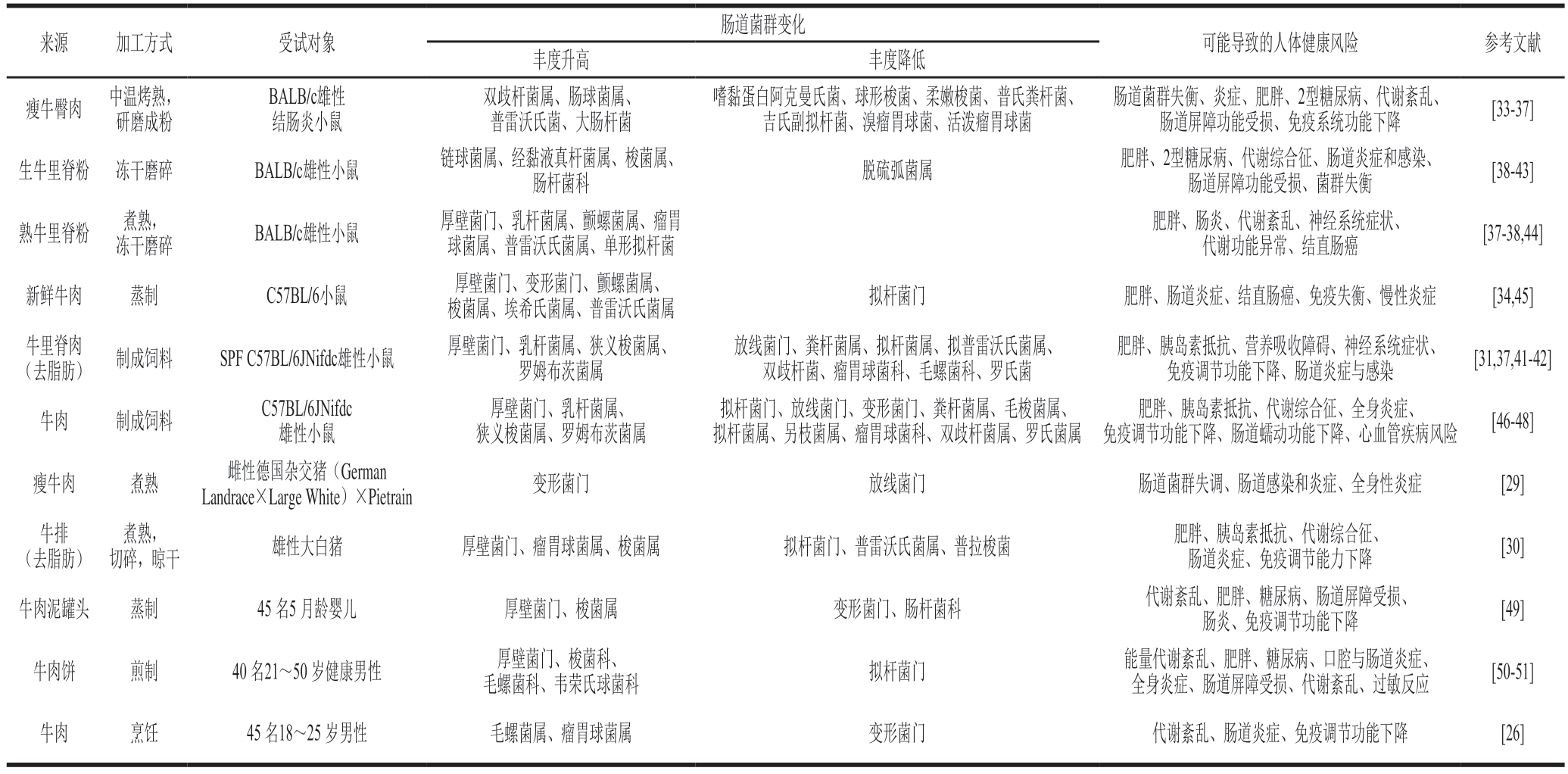
注:SFP.无特定病原体(specified-pathogens free)。
肠道菌群变化来源加工方式受试对象可能导致的人体健康风险参考文献丰度升高丰度降低瘦牛臀肉中温烤熟,研磨成粉BALB/c雄性结肠炎小鼠双歧杆菌属、肠球菌属、普雷沃氏菌、大肠杆菌嗜黏蛋白阿克曼氏菌、球形梭菌、柔嫩梭菌、普氏粪杆菌、吉氏副拟杆菌、溴瘤胃球菌、活泼瘤胃球菌肠道菌群失衡、炎症、肥胖、2型糖尿病、代谢紊乱、肠道屏障功能受损、免疫系统功能下降[33-37]生牛里脊粉冻干磨碎BALB/c雄性小鼠链球菌属、经黏液真杆菌属、梭菌属、肠杆菌科脱硫弧菌属肥胖、2型糖尿病、代谢综合征、肠道炎症和感染、肠道屏障功能受损、菌群失衡[38-43]熟牛里脊粉煮熟,冻干磨碎BALB/c雄性小鼠厚壁菌门、乳杆菌属、颤螺菌属、瘤胃球菌属、普雷沃氏菌属、单形拟杆菌肥胖、肠炎、代谢紊乱、神经系统症状、代谢功能异常、结直肠癌[37-38,44]新鲜牛肉蒸制C57BL/6小鼠厚壁菌门、变形菌门、颤螺菌属、梭菌属、埃希氏菌属、普雷沃氏菌属拟杆菌门肥胖、肠道炎症、结直肠癌、免疫失衡、慢性炎症[34,45](去脂肪)制成饲料SPF C57BL/6JNifdc雄性小鼠厚壁菌门、乳杆菌属、狭义梭菌属、罗姆布茨菌属牛里脊肉放线菌门、粪杆菌属、拟杆菌属、拟普雷沃氏菌属、双歧杆菌、瘤胃球菌科、毛螺菌科、罗氏菌肥胖、胰岛素抵抗、营养吸收障碍、神经系统症状、免疫调节功能下降、肠道炎症与感染[31,37,41-42]牛肉制成饲料C57BL/6JNifdc雄性小鼠厚壁菌门、乳杆菌属、狭义梭菌属、罗姆布茨菌属拟杆菌门、放线菌门、变形菌门、粪杆菌属、毛梭菌属、拟杆菌属、另枝菌属、瘤胃球菌科、双歧杆菌属、罗氏菌属肥胖、胰岛素抵抗、代谢综合征、全身炎症、免疫调节功能下降、肠道蠕动功能下降、心血管疾病风险[46-48]瘦牛肉煮熟雌性德国杂交猪(German Landrace×Large White)×Pietrain变形菌门放线菌门肠道菌群失调、肠道感染和炎症、全身性炎症[29]牛排(去脂肪)切碎,晾干雄性大白猪厚壁菌门、瘤胃球菌属、梭菌属拟杆菌门、普雷沃氏菌属、普拉梭菌肥胖、胰岛素抵抗、代谢综合征、肠道炎症、免疫调节能力下降[30]煮熟,牛肉泥罐头蒸制45 名5 月龄婴儿厚壁菌门、梭菌属变形菌门、肠杆菌科代谢紊乱、肥胖、糖尿病、肠道屏障受损、肠炎、免疫调节功能下降[49]牛肉饼煎制40 名21~50 岁健康男性厚壁菌门、梭菌科、毛螺菌科、韦荣氏球菌科拟杆菌门能量代谢紊乱、肥胖、糖尿病、口腔与肠道炎症、全身炎症、肠道屏障受损、代谢紊乱、过敏反应[50-51]牛肉烹饪45 名18~25 岁男性毛螺菌属、瘤胃球菌属变形菌门代谢紊乱、肠道炎症、免疫调节功能下降[26]
2.2 猪肉摄入对肠道菌群的影响
在畜肉中,猪肉的蛋白质含量较低、脂肪含量较高。猪肉味甘、成,具有滋阴润燥的功效,可提供血红素铁和促进铁吸收的半胱氨酸,能改善缺铁性贫血,还能提供人体所需的必需氨基酸、脂肪酸、VB等。猪肉对肠道菌群的影响研究见表2。在门水平上,摄食猪肉小鼠肠道厚壁菌门、拟杆菌门、变形菌门、脱铁杆菌门(Deferribacteres)丰度发生变化;大鼠肠道厚壁菌门与放线菌门丰度升高,而拟杆菌门丰度有所减少;在人体肠道中,仅厚壁菌门和拟杆菌门丰度受到影响。在属水平上,猪肉食物可改变小鼠肠道普雷沃氏菌属、埃希氏菌属、毛螺菌属、阿克曼菌属、脱硫弧菌属、乳杆菌属、双歧杆菌属、瘤胃球菌属、经黏液真杆菌属、另枝菌属、罗氏菌属(Roseburia)等微生物丰度;大鼠肠道普雷沃氏菌属、瘤胃球菌属、毛螺菌属、乳杆菌属、萨特氏菌属(Sutterella)丰度升高,而拟杆菌属和罗氏菌属丰度降低;在人体肠道中,猪肉摄食可改变梭菌属、毛螺菌属、罗氏菌属、瘤胃球菌属等微生物丰度。由此,猪肉对小鼠、大鼠及人体肠道菌群的影响存在一定相似性,特别是在厚壁菌门、拟杆菌门及瘤胃球菌属丰度变化上表现出一致规律,这可能与肥胖、肠道炎症和菌群失衡等健康问题相关。此外,对于同一类受试对象,不同研究间存在的差异可能源于个体肠道微生物组成差异,以及所食用猪肉的部位和加工方式差异。
表2 猪肉摄入对肠道菌群的影响
Table 2 Influence of pork consumption on gut microbiota
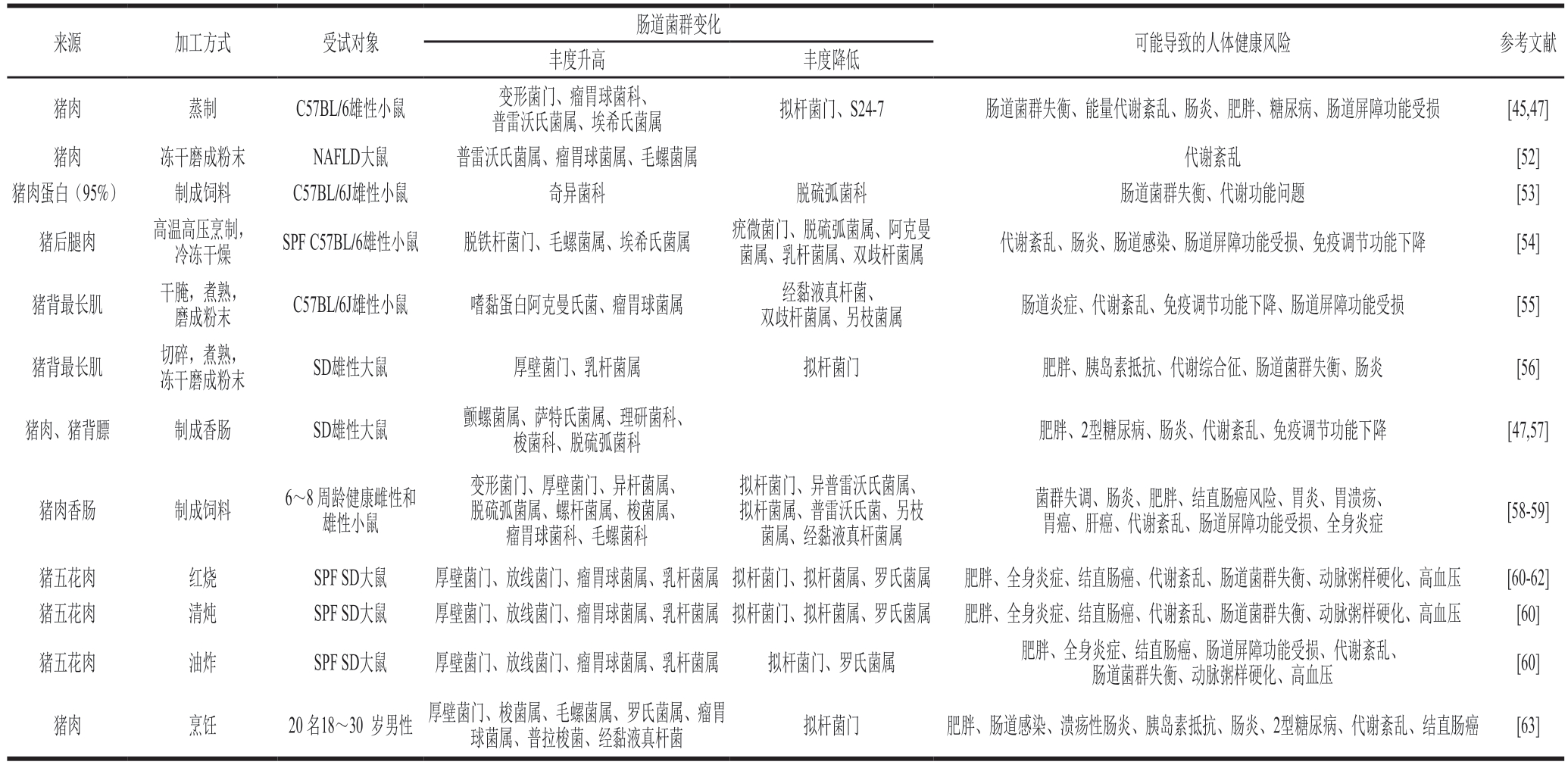
注:NAFLD.非酒精性脂肪肝病(non-alcoholic fatty liver disease)。
肠道菌群变化来源加工方式受试对象可能导致的人体健康风险参考文献丰度升高丰度降低猪肉蒸制C57BL/6雄性小鼠变形菌门、瘤胃球菌科、普雷沃氏菌属、埃希氏菌属拟杆菌门、S24-7肠道菌群失衡、能量代谢紊乱、肠炎、肥胖、糖尿病、肠道屏障功能受损[45,47]猪肉冻干磨成粉末NAFLD大鼠普雷沃氏菌属、瘤胃球菌属、毛螺菌属代谢紊乱[52]猪肉蛋白(95%)制成饲料C57BL/6J雄性小鼠奇异菌科脱硫弧菌科肠道菌群失衡、代谢功能问题[53]猪后腿肉高温高压烹制,冷冻干燥SPF C57BL/6雄性小鼠脱铁杆菌门、毛螺菌属、埃希氏菌属疣微菌门、脱硫弧菌属、阿克曼菌属、乳杆菌属、双歧杆菌属代谢紊乱、肠炎、肠道感染、肠道屏障功能受损、免疫调节功能下降[54]猪背最长肌干腌,煮熟,磨成粉末C57BL/6J雄性小鼠嗜黏蛋白阿克曼氏菌、瘤胃球菌属经黏液真杆菌、双歧杆菌属、另枝菌属肠道炎症、代谢紊乱、免疫调节功能下降、肠道屏障功能受损[55]猪背最长肌切碎,煮熟,冻干磨成粉末SD雄性大鼠厚壁菌门、乳杆菌属拟杆菌门肥胖、胰岛素抵抗、代谢综合征、肠道菌群失衡、肠炎[56]猪肉、猪背膘制成香肠SD雄性大鼠颤螺菌属、萨特氏菌属、理研菌科、梭菌科、脱硫弧菌科肥胖、2型糖尿病、肠炎、代谢紊乱、免疫调节功能下降[47,57]猪肉香肠制成饲料6~8 周龄健康雌性和雄性小鼠变形菌门、厚壁菌门、异杆菌属、脱硫弧菌属、螺杆菌属、梭菌属、瘤胃球菌科、毛螺菌科拟杆菌门、异普雷沃氏菌属、拟杆菌属、普雷沃氏菌、另枝菌属、经黏液真杆菌属菌群失调、肠炎、肥胖、结直肠癌风险、胃炎、胃溃疡、胃癌、肝癌、代谢紊乱、肠道屏障功能受损、全身炎症[58-59]猪五花肉红烧SPF SD大鼠厚壁菌门、放线菌门、瘤胃球菌属、乳杆菌属拟杆菌门、拟杆菌属、罗氏菌属肥胖、全身炎症、结直肠癌、代谢紊乱、肠道菌群失衡、动脉粥样硬化、高血压[60-62]猪五花肉清炖SPF SD大鼠厚壁菌门、放线菌门、瘤胃球菌属、乳杆菌属拟杆菌门、拟杆菌属、罗氏菌属肥胖、全身炎症、结直肠癌、代谢紊乱、肠道菌群失衡、动脉粥样硬化、高血压[60]猪五花肉油炸SPF SD大鼠厚壁菌门、放线菌门、瘤胃球菌属、乳杆菌属拟杆菌门、罗氏菌属肥胖、全身炎症、结直肠癌、肠道屏障功能受损、代谢紊乱、肠道菌群失衡、动脉粥样硬化、高血压[60]猪肉烹饪20 名18~30 岁男性厚壁菌门、梭菌属、毛螺菌属、罗氏菌属、瘤胃球菌属、普拉梭菌、经黏液真杆菌拟杆菌门肥胖、肠道感染、溃疡性肠炎、胰岛素抵抗、肠炎、2型糖尿病、代谢紊乱、结直肠癌[63]
综合以上结果,在门水平上,摄食牛肉和猪肉小鼠、大鼠、猪及人类肠道均呈现厚壁菌门丰度升高、拟杆菌门丰度降低的趋势,即F/B比值增大。在属水平上,牛肉和猪肉均影响小鼠肠道普雷沃氏菌属、埃希氏菌属、脱硫弧菌属、乳杆菌属、双歧杆菌属、瘤胃球菌属、经黏液真杆菌属、另枝菌属丰度。值得注意的是,牛肉能够特异性改变小鼠肠道肠球菌属、链球菌属、梭菌属、颤螺菌属、狭义梭菌属、罗姆布茨菌属、粪杆菌属、毛梭菌属、拟杆菌属丰度,而猪肉能够特异性影响小鼠肠道毛螺菌属、阿克曼菌属、罗氏菌属丰度;在人体肠道中,牛肉和猪肉均能增加梭菌属、毛螺菌属、瘤胃球菌属丰度,且猪肉还能增加罗氏菌属丰度,表明这2 种肉类对人体肠道菌群影响具有相似性,但由于相关人体研究有限,这一结论还需要进一步验证。
在健康风险方面,牛肉和猪肉导致的小鼠、大鼠、猪和人体肠道菌群F/B比值升高,以及拟杆菌属、另枝菌属、罗氏菌属等多种对肠道产生积极影响的微生物丰度的降低,可能与肥胖、胰岛素抵抗、代谢综合征、肠道炎症、免疫功能下降、肠道微生物多样性降低而导致的菌群失衡及动脉粥样硬化等健康问题相关。
2.3 鸡肉摄入对肠道菌群的影响
鸡肉营养价值高,富含多种维生素与优质蛋白,对增强体质和促进健康大有裨益。其丰富的磷脂含量对人体健康和生长发育具有重要作用。国内外关于食用鸡肉对肠道微生物影响的研究有限。鸡肉对肠道菌群的影响研究见表3。在门水平上,鸡肉能够影响大鼠和人肠道中厚壁菌门与拟杆菌门丰度,使F/B比值减小。在属水平上,鸡肉能够改变小鼠和大鼠乳杆菌属、瘤胃球菌属、阿克曼菌属、经黏液真杆菌属、考拉杆菌属(Phascolarctobacterium)、嗜胆菌属(Bilophila)丰度;在人体肠道中,鸡肉能够增加乳杆菌属、拟杆菌属及戴阿利斯特杆菌属(Dialister)丰度。综上,摄食鸡肉的小鼠、大鼠及人肠道中均存在乳杆菌属丰度显著增加现象。然而,Zhu Yingying等[64]研究发现,摄食鸡肉后,64 周龄大鼠肠道中乳杆菌属丰度呈现降低趋势,这与相同喂养条件下4 周龄大鼠肠道中乳杆菌属增加的结果相反,这可能是由老龄大鼠肠道微生物功能退化和多样性降低导致的菌群失衡等原因所引起的。
表3 鸡肉摄入对肠道菌群的影响
Table 3 Influence of chicken consumption on gut microbiota
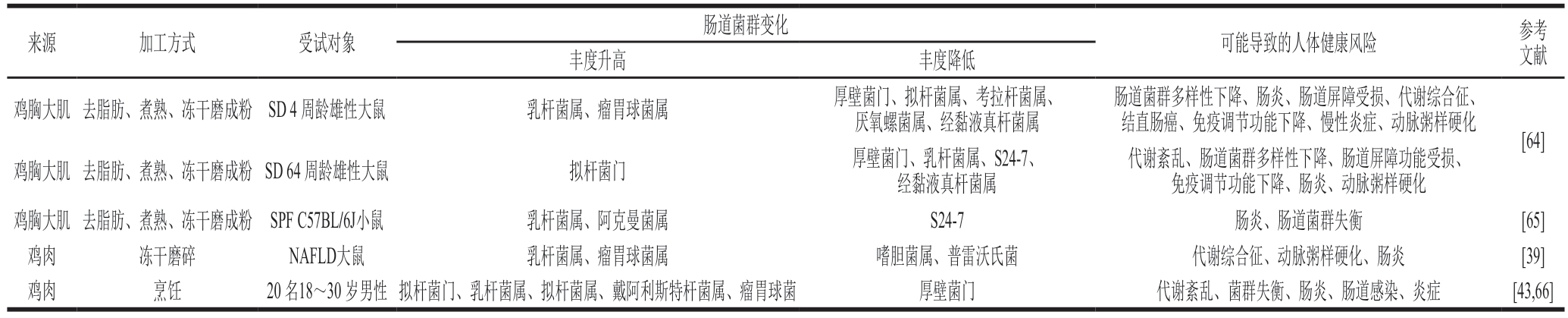
肠道菌群变化来源加工方式受试对象可能导致的人体健康风险参考文献丰度升高丰度降低肠道菌群多样性下降、肠炎、肠道屏障受损、代谢综合征、结直肠癌、免疫调节功能下降、慢性炎症、动脉粥样硬化[64]鸡胸大肌去脂肪、煮熟、冻干磨成粉SD 64 周龄雄性大鼠拟杆菌门厚壁菌门、乳杆菌属、S24-7、经黏液真杆菌属鸡胸大肌去脂肪、煮熟、冻干磨成粉SD 4 周龄雄性大鼠乳杆菌属、瘤胃球菌属厚壁菌门、拟杆菌属、考拉杆菌属、厌氧螺菌属、经黏液真杆菌属代谢紊乱、肠道菌群多样性下降、肠道屏障功能受损、免疫调节功能下降、肠炎、动脉粥样硬化鸡胸大肌去脂肪、煮熟、冻干磨成粉SPF C57BL/6J小鼠乳杆菌属、阿克曼菌属S24-7肠炎、肠道菌群失衡[65]鸡肉冻干磨碎NAFLD大鼠乳杆菌属、瘤胃球菌属嗜胆菌属、普雷沃氏菌代谢综合征、动脉粥样硬化、肠炎[39]鸡肉烹饪20 名18~30 岁男性拟杆菌门、乳杆菌属、拟杆菌属、戴阿利斯特杆菌属、瘤胃球菌厚壁菌门代谢紊乱、菌群失衡、肠炎、肠道感染、炎症[43,66]
2.4 鱼肉摄入对肠道菌群的影响
鱼肉也是人体蛋白质的重要来源之一,其营养丰富、易吸收。鱼肉中含有的多种脂肪酸能够防止血黏度升高,有效降低心脏病发生风险。鱼肉对肠道菌群的影响研究见表4。在门水平上,鱼肉能够改变小鼠和大鼠肠道中厚壁菌门、拟杆菌门、变形菌门、疣微菌门(Verrucomicrobia)和梭杆菌门(Fusobacteria)丰度;增加猪肠道中拟杆菌门、变形菌门丰度、降低螺旋体门(Spirochaetes)丰度;摄取鱼肉后,人肠道中拟杆菌门丰度升高,厚壁菌门与变形菌门丰度降低。在属水平上,鱼肉能够改变小鼠和大鼠肠道中梭菌属、颤螺菌属、埃希氏菌属、乳杆菌属、阿克曼菌属、考拉杆菌属、毛梭菌属、另枝菌属、嗜胆菌属、经黏液真杆菌属丰度;在猪肠道中,鱼肉能够增加普雷沃氏菌属、瘤胃球菌属、粪杆菌属、梭菌属、副拟杆菌属(Parabacteroides)、粪球菌属(Coprococcus)、颤螺菌属、乳杆菌属丰度,降低密螺旋体属(Treponema)、梭菌属、另枝菌属丰度;在人肠道中,鱼肉能够增加月形单胞菌属(Selenomonas)、普雷沃氏菌属、粪杆菌属丰度,降低拟杆菌属、梭菌属、普雷沃氏菌属与埃希氏菌属丰度。综上,鱼肉能够增加多种肠道微生物丰度,其中不乏拟杆菌门、乳杆菌属、粪杆菌属等对肠道有益的菌属,这对提高肠道微生物多样性,维持肠道稳态至关重要。
表4 鱼肉摄入对肠道菌群的影响
Table 4 Influence of fish consumption on gut microbiota

肠道菌群变化来源加工方式受试对象可能导致的人体健康风险参考文献丰度升高丰度降低鱼肉蒸制C57BL/6雄性小鼠变形菌门、厚壁菌门、梭菌属、颤螺菌属、埃希氏菌属拟杆菌门、S24-7肠炎、代谢紊乱、感染、肠道屏障受损、过敏反应[45]草鱼冻干磨成粉末NAFLD大鼠疣微菌门、梭杆菌门、乳杆菌属、阿克曼菌属、考拉杆菌属、瘤胃球菌科嗜胆菌属、普雷沃氏菌科、经黏液真杆菌属结直肠癌、肠道菌群失衡、代谢综合征、肠炎[52]巴沙鱼煮沸、均质、稀释注射BALB/c雌性哮喘小鼠理研菌科、毛梭菌属、另枝菌属乳杆菌属肠炎、代谢紊乱、2型糖尿病、过敏反应[67]金枪鱼深色肌肉煮熟雄性荷兰迷你仔猪拟杆菌门、变形菌门、普雷沃氏菌属、瘤胃球菌属、粪杆菌属、梭菌属、副拟杆菌属、粪球菌属、颤螺菌属、乳杆菌属螺旋体门、密螺旋体属、梭状芽孢杆菌属、另枝菌属肠道菌群失衡、肠炎、代谢紊乱、肠道感染、肠道菌群多样性下降[68]鳕鱼烹饪76 名18~69 岁挪威人月形单胞菌属拟杆菌属、梭菌属口腔炎症、肠道屏障功能受损、过敏反映、肠炎、肠道感染[67-70]鲑鱼烹饪76 名18~69 岁挪威人月形单胞菌属拟杆菌属、梭菌属口腔炎症、肠道屏障功能受损、过敏反映、肠炎、肠道感染[69]沙丁鱼罐头、沙丁鱼产品加热、烹饪16 名男性和19 名女性2型糖尿病患者拟杆菌门、普雷沃氏菌属、大肠杆菌厚壁菌门代谢紊乱、肠道炎症、肠道感染、肠道屏障功能受损[71]鳙鱼、草鱼烹饪34 名NAFLD患者粪杆菌属变形菌门、普雷沃氏菌属、埃希氏菌属代谢综合征、肠道感染[72]
综合鸡肉和鱼肉对小鼠、大鼠、猪及人体肠道微生物的影响规律,肠道菌群中的拟杆菌门、乳杆菌属、粪杆菌属丰度与这2 种肉类的摄入量呈正相关,该结果与Almajed[27]、Zhu Yingying[28]等的研究结果一致。通过摄入鸡肉和鱼肉增加肠道有益菌丰度,能够使有益菌充分发挥其健康促进作用。例如,拟杆菌门微生物有助于食物消化,且能够调节能量代谢和免疫功能;乳杆菌属能够产生乳酸,通过降低肠道pH值抑制有害微生物,部分乳杆菌属菌株还能刺激免疫系统,增强机体免疫力,同时还能合成部分维生素(如VK和VB);粪杆菌属能够通过调节细胞因子分泌改善炎症,作为主要丁酸产生菌能有效增强肠道屏障功能,还能够与其他有益菌协同抑制有害菌,防止肠道菌群失调;阿克曼菌属具有改善体质量[73]、减轻炎症的作用,对2型糖尿病的治疗也有帮助[74]。
3 结语
肠道菌群与健康密切相关,并在治疗肥胖与调节免疫方面发挥重要作用。在改善肥胖方面,通过调节肥胖症患者肠道中F/B比值可有效减轻相关症状;肠道微生物代谢产物SCFAs、BAs等可通过促进脂质的利用和转化或抑制脂质合成调节体质量。此外,肠道微生物群通过脑-肠轴相互作用能够控制宿主食欲并改变其饮食习惯,从而改善肥胖。在免疫调节方面,肠道微生物群通过竞争性抑制抵御病原体侵袭,其代谢产物也能通过促进特定基因表达和激活相关受体调控免疫反应。值得注意的是,随着年龄的增长,宿主肠道微生物群丰度和多样性降低会对免疫功能产生不利影响。
不同肉类和肠道菌群的互作关系研究中,牛肉和猪肉导致小鼠、大鼠、猪和人肠道菌群中F/B比值增大。在属水平上,2 种肉类均可改变小鼠肠道中普雷沃氏菌属、埃希氏菌属、脱硫弧菌属、乳杆菌属、双歧杆菌属、瘤胃球菌属、经黏液真杆菌属、另枝菌属丰度,在猪和人肠道中则表现出梭菌属、毛螺菌属、瘤胃球菌属丰度增加;鸡肉和鱼肉能够使小鼠、大鼠、猪及人体肠道中F/B比值减小,同时,乳杆菌属、粪杆菌属丰度增加也在这些实验对象中具有显著代表性。
尽管国内外关于肉类食物对肠道菌群影响的研究已取得一定的进展,但肠道菌群组成复杂且肉类食物种类繁多,二者互作关系的探索仍处于基础阶段。此外,不同菌群间的相互作用、肉类食物的加工方式以及宿主年龄、生活方式等因素对肠道菌群的具体影响尚不明确,未来仍需持续研究以厘清二者的互作关系,这对优化饮食结构、改善代谢健康、增强免疫、治疗困难病症等方面具有重要意义。
[1] 庄海宁, 向情儒, 冯涛. 猴头菇β-葡聚糖促进人肠道菌群产丁酸的研究进展[J]. 食品与生物技术学报, 2023, 42(2): 18-24. DOI:10.3969/j.issn.1673-1689.2023.02.003.
[2] 孙玄, 陈玲. 新生儿肠道微生态研究进展[J]. 中华新生儿科杂志(中英文), 2018(3): 229-233.
[3] 杨金岳, 李扬淳, 郭丽双. 肠道菌群对肥胖及其治疗的研究进展[J].牡丹江医学院学报, 2024, 45(4): 150-153. DOI:10.13799/j.cnki.mdjyxyxb.2024.04.003.
[4] 康飘, 张盈, 李华婷. 食物偏好机制及其对肥胖影响的研究进展[J].上海交通大学学报(医学版), 2024, 44(9): 1190-1196. DOI:10.3969/j.issn.1674-8115.2024.09.014.
[5] 张梦珂, 舒妍妍, 杨静楠, 等. 肠道微生物群对肥胖症的影响及机制研究[J]. 河南大学学报(医学版), 2024, 43(5): 330-340.DOI:10.15991/j.cnki.41-1361/r.2024.05.010.
[6] ARMOUGOM F, HENRY M, VIALETTES B, et al. Monitoring bacterial community of human gut microbiota reveals an increase in Lactobacillus in obese patients and Methanogens in anorexic patients[J]. PLoS ONE, 2009, 4(9): e7125. DOI:10.1371/journal.pone.0007125.
[7] PALMAS V, PISANU S, MADAU V, et al. Gut microbiota markers associated with obesity and overweight in Italian adults[J]. Scientific Reports, 2021, 11: 5532. DOI:10.1038/s41598-021-84928-w.
[8] BERVOETS L, VAN HOORENBEECK K, KORTLEVEN I, et al.Differences in gut microbiota composition between obese and lean children: a cross-sectional study[J]. Gut Pathogens, 2013, 5(1): 10.DOI:10.1186/1757-4749-5-10.
[9] HILDEBRANDT M A, HOFFMANN C, SHERRILL-MIX S A,et al. High-fat diet determines the composition of the murine gut microbiome independently of obesity[J]. Gastroenterology, 2009,137(5): 1716-1724.e2. DOI:10.1053/j.gastro.2009.08.042.
[10] DEN BESTEN G, BLEEKER A, GERDING A, et al. Short-chain fatty acids protect against high-fat diet-induced obesity via a PPARγdependent switch from lipogenesis to fat oxidation[J]. Diabetes, 2015,64(7): 2398-2408. DOI:10.2337/db14-1213.
[11] LOPETUSO L R, SCALDAFERRI F, PETITO V, et al. Commensal Clostridia: leading players in the maintenance of gut homeostasis[J].Gut Pathogens, 2013, 5(1): 23. DOI:10.1186/1757-4749-5-23.
[12] 吴茂兰, 翁家俊, 崔粲, 等. 中药基于肠道菌群实现免疫调节的研究进展[J]. 中药材, 2022, 45(8): 2012-2018. DOI:10.13863/j.issn1001-4454.2022.08.043.
[13] 吴维达, 尹畅, 张宏福. 胆汁酸对机体糖脂代谢的影响机制[J].动物营养学报, 2020, 32(10): 4565-4576. DOI:10.3969/j.issn.1006-267x.2020.10.010.
[14] 杨启航, 蒲锐, 陈子扬, 等. 肠道菌群代谢物在肥胖调控中的作用与机制[J]. 中国组织工程研究, 2024, 28(2): 308-314.DOI:10.12307/2023.875.
[15] WEI M L, HUANG F J, ZHAO L, et al. A dysregulated bile acid-gut microbiota axis contributes to obesity susceptibility[J]. eBioMedicine,2020, 55: 102766. DOI:10.1016/j.ebiom.2020.102766.
[16] LIU L Y, ZHU S J, ZHANG Y C, et al. Hovenia dulcis fruit peduncle polysaccharides reduce intestinal dysbiosis and hepatic fatty acid metabolism disorders in alcohol-exposed mice[J]. Foods, 2024, 13(8):1145. DOI:10.3390/foods13081145.
[17] BADGELEY A, ANWAR H, MODI K, et al. Effect of probiotics and gut microbiota on anti-cancer drugs: mechanistic perspectives[J].Biochimica et Biophysica Acta (BBA)-Reviews on Cancer, 2021,1875(1): 188494. DOI:10.1016/j.bbcan.2020.188494.
[18] WANG Y Y, GUO Y L, CHEN H, et al. Potential of Lactobacillus plantarum ZDY2013 and Bifidobacterium bifidum WBIN03 in relieving colitis by gut microbiota, immune, and anti-oxidative stress[J]. Canadian Journal of Microbiology, 2018, 64(5): 327-337.DOI:10.1139/cjm-2017-0716.
[19] 杨雪菲, 漆艳娥, 太珍珍, 等. 肠道菌群在机体免疫调节功能中的作用[J]. 中国微生态学杂志, 2016, 28(8): 979-983. DOI:10.13381/j.cnki.cjm.201608027.
[20] LIU L Y, FAN Y N, PI H Y. Effect of gut microbiota intervention on inflammatory responses and cellular immune function in hepatocellular carcinoma patients undergoing radiotherapy[J]. Journal of Radiation Research and Applied Sciences, 2024, 17(4): 101131. DOI:10.1016/j.jrras.2024.101131.
[21] 郑倩婷, 孟立娜. 肠道菌群代谢产物对肠道免疫影响的研究进展[J].国际消化病杂志, 2021, 41(3): 164-167. DOI:10.3969/j.issn.1673-534X.2021.03.004.
[22] BIAGIOLI M, MARCHIANÒ S, CARINO A, et al. Bile acids activated receptors in inflammatory bowel disease[J]. Cells, 2021, 10(6): 1281.DOI:10.3390/cells10061281.
[23] XU C M, ZHU H Q, QIU P. Aging progression of human gut microbiota[J]. BMC Microbiology, 2019, 19(1): 236. DOI:10.1186/s12866-019-1616-2.
[24] 郭文文, 齐莉莉, 王梦婷, 等. 肠道菌群与肠黏膜免疫衰老的关系[J].生物化学与生物物理进展, 2025, 52(3): 626-639. DOI:10.16476/j.pibb.2024.0250.
[25] 关成芳. 红肉、白肉、植物肉: 谁是最健康的选择?[N]. 医药养生保健报, 2024-03-23(32).
[26] 张广红. 牛肉和鸡肉膳食对人肠道微生物及代谢的影响研究[D].南京: 南京农业大学, 2020. DOI:10.27244/d.cnki.gnjnu.2020.001055.
[27] ALMAJED J, AL-MUSHARAF S, ABUDAWOOD M, et al. Red and white meat intake in relation to gut flora in obese and non-obese Arab females[J]. Foods, 2023, 12(2): 245. DOI:10.3390/foods12020245.
[28] ZHU Y Y, LIN X S, ZHAO F, et al. Meat, dairy and plant proteins alter bacterial composition of rat gut bacteria[J]. Scientific Reports, 2015, 5:15220. DOI:10.1038/srep15220.
[29] SCHUTKOWSKI A, KÖNIG B, KLUGE H, et al. Metabolic footprint and intestinal microbial changes in response to dietary proteins in a pig model[J]. The Journal of Nutritional Biochemistry, 2019, 67: 149-160.DOI:10.1016/j.jnutbio.2019.02.004.
[30] WILLIAMS B A, ZHANG D G, LISLE A T, et al. Soluble arabinoxylan enhances large intestinal microbial health biomarkers in pigs fed a red meat-containing diet[J]. Nutrition, 2016, 32(4): 491-497.DOI:10.1016/j.nut.2015.10.008.
[31] 武明月, 孔祥丽, 张天阳, 等. 菊粉和大豆膳食纤维对牛肉饮食的小鼠肠道菌群及其代谢产物的改善作用[J]. 食品科学, 2022, 43(5):158-167. DOI:10.7506/spkx1002-6630-20201205-062.
[32] 赵欣雅, 田雨佳, 陈星星, 等. 普雷沃氏菌在瘤胃内的作用与代谢机制研究进展[J]. 饲料研究, 2023, 46(14): 151-153. DOI:10.13557/j.cnki.issn1002-2813.2023.14.029.
[33] LE LEU R K, YOUNG G P, HU Y, et al. Dietary red meat aggravates dextran sulfate sodium-induced colitis in mice whereas resistant starch attenuates inflammation[J]. Digestive Diseases and Sciences, 2013,58(12): 3475-3482. DOI:10.1007/s10620-013-2844-1.
[34] LARSEN J M. The immune response to Prevotella bacteria in chronic inflammatory disease[J]. Immunology, 2017, 151(4): 363-374.DOI:10.1111/imm.12760.
[35] DAO M C, EVERARD A, ARON-WISNEWSKY J, et al. Akkermansia muciniphilaand improved metabolic health during a dietary intervention in obesity: relationship with gut microbiome richness and ecology[J]. Gut,2016, 65(3): 426-436. DOI:10.1136/gutjnl-2014-308778.
[36] MIQUEL S, MARTÍN R, ROSSI O, et al. Faecalibacterium prausnitzii and human intestinal health[J]. Current Opinion in Microbiology,2013, 16(3): 255-261. DOI:10.1016/j.mib.2013.06.003.
[37] KOH A, DE VADDER F, KOVATCHEVA-DATCHARY P, et al.From dietary fiber to host physiology: short-chain fatty acids as key bacterial metabolites[J]. Cell, 2016, 165(6): 1332-1345. DOI:10.1016/j.cell.2016.05.041.
[38] KIM H J, KIM D, KIM K W, et al. Comparative analysis of the gut microbiota of mice fed a diet supplemented with raw and cooked beef loin powder[J]. Scientific Reports, 2021, 11: 11489. DOI:10.1038/s41598-021-90461-7.
[39] LIU R X, HONG J, XU X Q, et al. Gut microbiome and serum metabolome alterations in obesity and after weight-loss intervention[J].Nature Medicine, 2017, 23(7): 859-868. DOI:10.1038/nm.4358.
[40] WANG K, LIAO M F, ZHOU N, et al. Parabacteroides distasonis alleviates obesity and metabolic dysfunctions via production of succinate and secondary bile acids[J]. Cell Reports, 2019, 26(1): 222-235.e5. DOI:10.1016/j.celrep.2018.12.028.
[41] 刘双江, 刘宏伟, 汪锴, 等. 狄氏副拟杆菌通过产生琥珀酸和次级胆汁酸减轻肥胖和代谢功能障碍[J]. 科学新闻, 2020, 22(2): 106.
[42] MAIER L, PRUTEANU M, KUHN M, et al. Extensive impact of nonantibiotic drugs on human gut bacteria[J]. Nature, 2018, 555: 623-628.DOI:10.1038/nature25979.
[43] 卢歌雪. 肝硬化患者肠道脱硫弧菌分离鉴定及其比较研究[D].无锡: 江南大学, 2023. DOI:10.27169/d.cnki.gwqgu.2023.000629.
[44] WIRBEL J, PYL P T, KARTAL E, et al. Meta-analysis of fecal metagenomes reveals global microbial signatures that are specific for colorectal cancer[J]. Nature Medicine, 2019, 25(4): 679-689.DOI:10.1038/s41591-019-0406-6.
[45] ZHANG Z M, LI D P, TANG R. Changes in mouse gut microbial community in response to the different types of commonly consumed meat[J]. Microorganisms, 2019, 7(3): 76. DOI:10.3390/microorganisms7030076.
[46] 武明月. 不同来源膳食纤维对牛肉饮食的小鼠肠屏障的调控作用[D]. 哈尔滨: 东北农业大学, 2021. DOI:10.27010/d.cnki.gdbnu.2021.000294.
[47] TANES C, BITTINGER K, GAO Y, et al. Role of dietary fiber in the recovery of the human gut microbiome and its metabolome[J].Cell Host & Microbe, 2021, 29(3): 394-407.e5. DOI:10.1016/j.chom.2020.12.012.
[48] WEIS M. Impact of the gut microbiome in cardiovascular and autoimmune diseases[J]. Clinical Science, 2018, 132(22): 2387-2389.DOI:10.1042/cs20180410.
[49] KREBS N F, SHERLOCK L G, WESTCOTT J, et al. Effects of different complementary feeding regimens on iron status and enteric microbiota in breastfed infants[J]. The Journal of Pediatrics, 2013,163(2): 416-423.e4. DOI:10.1016/j.jpeds.2013.01.024.
[50] CHO C E, TAESUWAN S, MALYSHEVA O V, et al. Trimethylamine-N-oxide (TMAO) response to animal source foods varies among healthy young men and is influenced by their gut microbiota composition: a randomized controlled trial[J]. Molecular Nutrition &Food Research, 2017, 61(1): 1600324. DOI:10.1002/mnfr.201600324.
[51] MASHIMA I, NAKAZAWA F. Interaction between Streptococcus spp. and Veillonella tobetsuensis in the early stages of oral biofilm formation[J]. Journal of Bacteriology, 2015, 197(13): 2104-2111.DOI:10.1128/jb.02512-14.
[52] LI J, LI Y T, FENG S F, et al. Differential effects of dietary white meat and red meat on NAFLD progression by modulating gut microbiota and metabolites in rats[J]. Oxidative Medicine and Cellular Longevity,2022, 2022: 6908934. DOI:10.1155/2022/6908934.
[53] 王涛, 季珊珊, 汤鑫磊, 等. 大豆和猪肉来源的高蛋白饮食对小鼠肥胖及肠道菌群的影响[J]. 食品科学技术学报, 2024, 42(2): 120-130.DOI:10.12301/spxb202200980.
[54] GE Y T, LIN S M, LI B W, et al. Oxidized pork induces oxidative stress and inflammation by altering gut microbiota in mice[J].Molecular Nutrition & Food Research, 2020, 64(2): 1901012.DOI:10.1002/mnfr.201901012.
[55] ZHANG M, ZOU X Y, ZHAO D, et al. Front cover: pork meat proteins alter gut microbiota and lipid metabolism genes in the colon of adaptive immune-deficient mice[J]. Molecular Nutrition & Food Research, 2020, 64(9): 2070021. DOI:10.1002/mnfr.202070021.
[56] ZHU Y Y, LIN X S, LI H, et al. Intake of meat proteins substantially increased the relative abundance of genus Lactobacillus in rat feces[J]. PLoS ONE, 2016, 11(4): e0152678. DOI:10.1371/journal.pone.0152678.
[57] THØGERSEN R, CASTRO-MEJÍA J L, KRÆMER SUNDEKILDE U,et al. Inulin and milk mineral fortification of a pork sausage exhibits distinct effects on the microbiome and biochemical activity in the gut of healthy rats[J]. Food Chemistry, 2020, 331: 127291. DOI:10.1016/j.foodchem.2020.127291.
[58] XIAO H L, YIN D H, DU L D, et al. Effects of pork sausage on intestinal microecology and metabolism in mice[J]. Journal of the Science of Food and Agriculture, 2024, 104(6): 3413-3427.DOI:10.1002/jsfa.13227.
[59] 石小康, 丁佑铭. 螺杆菌属与原发性肝癌关系的研究进展[J].实用肿瘤学杂志, 2018, 32(3): 271-274. DOI:10.11904/j.issn.1002-3070.2018.03.017.
[60] 朱文政. 烹饪模式下猪五花肉营养品质变化及对大鼠生理和肠道菌群的影响[D]. 扬州: 扬州大学, 2022. DOI:10.27441/d.cnki.gyzdu.2022.000022.
[61] 艾方彬, 岳备, 高瑞阳, 等. 具有新一代益生菌潜能的罗氏菌在各类疾病中调节作用的研究进展[J]. 中国微生态学杂志, 2024, 36(6):728-732. DOI:10.13381/j.cnki.cjm.202406017.
[62] 欧阳雨欣, 胡密, 张杨恺, 等. 肠道菌群及其代谢产物在动脉粥样硬化发展中的作用[J]. 生命的化学, 2025, 45(1): 43-54. DOI:10.13488/j.smhx.20240558.
[63] SHI J, ZHAO D, ZHAO F, et al. Chicken-eaters and pork-eaters have different gut microbiota and tryptophan metabolites[J]. Scientific Reports, 2021, 11: 11934. DOI:10.1038/s41598-021-91429-3.
[64] ZHU Y Y, LI H, XU X L, et al. The gut microbiota in young and middle-aged rats showed different responses to chicken protein in their diet[J]. BMC Microbiology, 2016, 16(1): 281. DOI:10.1186/s12866-016-0895-0.
[65] 赵凡. 短期摄入不同膳食蛋白对肠道微生物及肠道黏液屏障的调控作用[D]. 南京: 南京农业大学, 2019. DOI:10.27244/d.cnki.gnjnu.2019.001833.
[66] 葛阳, 岳晓蕾, 王恩行, 等. 从与肠道菌群关联性探讨非酒精性脂肪肝病研究进展[J]. 辽宁中医药大学学报, 2024, 26(12): 103-107.DOI:10.13194/j.issn.1673-842X.2024.12.019.
[67] ZHENG H C, WANG Y A, LIU Z R, et al. Consumption of lamb meat or basa fish shapes the gut microbiota and aggravates pulmonary inflammation in asthmatic mice[J]. Journal of Asthma and Allergy,2020, 13: 509-520. DOI:10.2147/JAA.S266584.
[68] LU C Y, ZHANG Y M, QIN Y, et al. Tuna dark muscle feeding improved the meat quality of Holland mini-piglets and modulated the gut microbiota[J]. Foods, 2024, 13(10): 1577. DOI:10.3390/foods13101577.
[69] BRATLIE M, HAGEN I V, HELLAND A, et al. Effects of high intake of cod or salmon on gut microbiota profile, faecal output and serum concentrations of lipids and bile acids in overweight adults:a randomised clinical trial[J]. European Journal of Nutrition, 2021,60(4): 2231-2248. DOI:10.1007/s00394-020-02417-8.
[70] HAWKES C G, HINSON A N, VASHISHTA A, et al. Selenomonas sputigena interactions with gingival epithelial cells that promote inflammation[J]. Infection and Immunity, 2023, 91(2): e00319-22.DOI:10.1128/iai.00319-22.
[71] BALFEGÓ M, CANIVELL S, HANZU F A, et al. Effects of sardineenriched diet on metabolic control, inflammation and gut microbiota in drug-naïve patients with type 2 diabetes: a pilot randomized trial[J].Lipids in Health and Disease, 2016, 15(1): 78. DOI:10.1186/s12944-016-0245-0.
[72] HE K Y, GUO L L, TANG H J, et al. A freshwater fish-based diet alleviates liver steatosis by modulating gut microbiota and metabolites: a clinical randomized controlled trial in Chinese participants with nonalcoholic fatty liver disease[J]. American Journal of Gastroenterology, 2022, 117(10): 1621-1631. DOI:10.14309/ajg.0000000000001885.
[73] 朱贝贝, 吴昊, 朱小琴, 等. 嗜黏蛋白阿克曼菌在肠道稳态及肠道相关疾病中作用的研究进展[J]. 安徽医学, 2024, 45(2): 244-248.DOI:10.3969/j.issn.1000-0399.2024.02.023.
[74] 王颖, 郭鹏娜, 牛晓红. 二甲双胍通过调节黏蛋白菌改善2型糖尿病肠道通透性的研究进展[J]. 中国糖尿病杂志, 2024, 32(4): 314-316.DOI:10.3969/j.issn.1006-6187.2024.04.015.