组胺作为一种重要的生物活性物质,在人体内发挥着重要的生理功能,但人体摄入组胺含量过高的食品可能引发食源性组胺中毒,其典型症状包括头痛、恶心、呕吐、腹泻、皮疹及低血压等,严重时甚至可能危及生命[1-3]。组胺主要来源于蛋白中的组氨酸,组氨酸可在组氨酸脱羧酶作用下转化为组胺[4-5]。微生物的存在与贮藏条件是影响组胺生成的关键因素,尤其是当鱼类未在低温条件下妥善运输和存放时,组胺含量可能急剧升高。各国及组织对食品中的组胺均制定有严格的限量标准。例如,美国食品药品监督管理局[6]和欧洲食品安全局[7]分别规定水产品和食品中组胺限值为50 mg/kg,我国GB 2733—2015《食品安全国家标准 鲜、冻动物性水产品》[8]明确规定高组胺鱼类(如鲐鱼、金枪鱼等)的组胺限值为400 mg/kg,其他海水鱼类的组胺限值为200 mg/kg。准确、快速地检测食品中的组胺对于食品安全监测至关重要。
常见的组胺检测方法主要包括高效液相色谱法[9-11]、酶联免疫吸附法[12]、气相色谱法[13-14]、离子色谱法[15-16]及电化学方法[17-19]等。液相色谱法是GB 5009.208—2016《食品安全国家标准 食品中生物胺的测定》[20]规定的检测方法之一,在组胺检测中发挥重要作用。然而,由于组胺是小分子物质,在紫外-可见光区无明显吸收,且不具有荧光特性,通常需要使用衍生化试剂(如丹磺酰氯、邻苯二甲醛等)增强其检测信号[21-22]。衍生化步骤不仅会增加检测复杂性,还可能影响分析精度。因此,简化提取和净化步骤、提高检测效率成为组胺检测方法发展的重要方向。
液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)作为一种高灵敏度、高选择性的检测技术,已被广泛应用于组胺的定量检测中[23-25]。已有研究[26-27]采用固相萃取或液-液萃取进行净化,可实现鱼肉中组胺的非衍生化检测,但这些方法往往存在操作复杂、溶剂消耗量大、环境污染风险高等问题。为简化样品前处理步骤并提高检测效率,本研究提出一种基于酸化有机溶剂提取、超低温冷冻净化的前处理方法,并采用LC-MS/MS检测组胺,为鱼类安全监测提供更高效且环保的检测方法。
1 材料与方法
1.1 材料与试剂
鱼类样品 市购。
组胺标准品(1 000 mg/L,纯度≥99%,CAS号:51-45-6) 上海安谱璀世标准技术服务有限公司;甲醇、乙腈(均为色谱纯) 美国赛默飞世尔科技有限公司;甲酸(色谱纯) 天津科密欧化学试剂有限公司;甲酸铵(分析纯) 生工生物工程(上海)股份有限公司;纯水 杭州娃哈哈集团有限公司;ACQUITY UPLC BEH C18柱(2.1 mm×100 mm,1.7 μm) 美国Waters公司;Shim-pack XR-ODSII柱(1.5 mm×75 mm,2.2 μm)、Shim-pack Scepter Diol-HILIC-120柱(2.1 mm×100 mm,1.9 μm)、0.22 μm聚四氟乙烯(polytetrafluoroethylene,PTFE)疏水性滤膜日本岛津公司。
1.2 设备与仪器
LC-20AD高效液相色谱串联8050三重四极杆质谱仪(配备LabSolutions数据处理系统) 日本岛津公司;H2050R离心机 湖南湘仪实验室仪器开发有限公司;5430R离心机 德国艾本德公司;DT-200电子天平北京天平物华医疗仪器有限责任公司;Multi Reax涡旋振荡器 德国海道尔夫公司;MM-LC1820绞肉机 长虹美菱股份有限公司。
1.3 方法
1.3.1 标准溶液配制
用纯水将质量浓度1 000 mg/L的组胺标准品稀释至1 mg/L,作为标准中间液,现用现配。分别移取2、5、10、20、50、100、250 μL标准中间液于LC进样瓶中,使用空白基质溶液(取新鲜鱼类样品进行前处理,所得样品溶液经测定无组胺信号或组胺信号低于检出限的则为空白基质溶液)定容至1 mL,配制成质量浓度2、5、10、20、50、100、250 μg/L的组胺标准工作液,现用现配。
1.3.2 提取溶液选择
组胺提取通常采用甲醇、乙腈等极性溶剂,水的加入有助于提高组胺溶解度,进而提高提取效率,因此,本研究选择甲醇-乙腈-水(70∶20∶10,V/V)作为提取溶液。组胺(pKa≈9.4)作为碱性化合物,其溶解度及质子化状态与溶液pH值密切相关,本研究进一步探究提取溶液中甲酸的体积分数(0.1%、0.2%、0.5%、1.0%)对组胺提取效率的影响。
1.3.3 样品前处理
取鱼类样品,去头、去骨、去内脏后,使用绞肉机加工成糜状。称取2 g(精确至0.01 g)样品于50 mL离心管内,加入10 mL提取溶液,涡旋振荡30 min,4 ℃、10 000 r/min离心10 min。取上清液于15 mL离心管中,将离心管放入液氮罐中冷冻2 min,室温解冻后以7 830 r/min离心8 min,取上清液1 mL过0.22 μm PTFE滤膜后上机测定。
1.3.4 LC条件
色谱柱:Shim-pack Scepter Diol-HILIC-120(2.1 mm×100 mm,1.9 μm);柱温40 ℃;进样量5 μL;流速0.4 mL/min;流动相:A为0.5%(V/V)甲酸溶液(含10 mmol/L甲酸铵),B为90%(V/V)乙腈溶液(含10 mmol/L甲酸铵与0.5%(V/V)甲酸),梯度洗脱程序见表1。
表1 梯度洗脱程序
Table 1 Gradient elution conditions
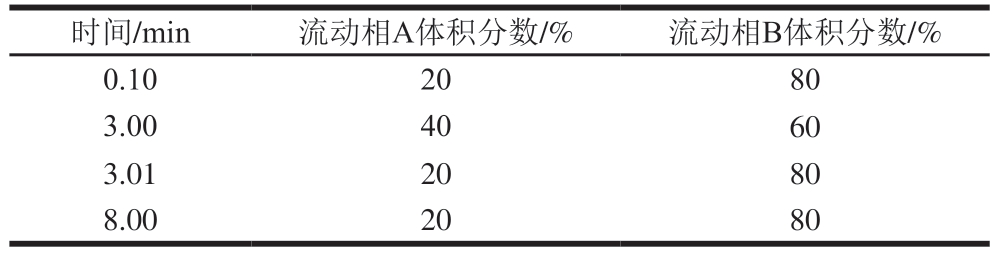
时间/min流动相A体积分数/%流动相B体积分数/%0.102080 3.004060 3.012080 8.002080
1.3.5 MS/MS条件
电离模式:电喷雾电离(electrospray ionization,ESI)正离子模式;扫描方式:多反应监测模式;接口电压0.5 kV、雾化气流量2.0 L/min、加热气流量15 L/min;接口温度200 ℃、脱溶剂线温度100 ℃、加热块温度200 ℃,干燥气流量5 L/min,其余参数见表2。
表2 组胺MS/MS测定参数
Table 2 MS/MS parameters for histamine

注:*.定量离子。
Q3偏转电压/V 112.1095.05*-12.00-16.00-17.00 112.1068.05-16.00-25.00-29.00母离子(m/z)子离子(m/z)Q1偏转电压/V碰撞能量/V
1.3.6 结果计算
采用LabSolutions软件处理LC-MS/MS定量检测结果。样品组胺含量按下式计算:
式中:X为样品中组胺含量/(μg/kg);ρ为从空白基质标准曲线中得到的组胺质量浓度/(μg/L);V为定容体积/L;m为样品质量/g。
1.4 数据处理
使用LabSolutions软件进行原始数据处理和图谱采集;数据表示为平均值±标准差,使用Origin 2025软件进行实验数据处理及图谱绘制。
2 结果与分析
2.1 LC条件优化
2.1.1 色谱柱选择
本研究比较ACQUITY UPLC BEH C18柱(2.1 mm×100 mm,1.7 μm)、Shim-pack XR-ODSII柱(1.5 mm×75 mm,2.2 μm)和Shim-pack Scepter Diol-HILIC-120柱(2.1 mm×100 mm,1.9 μm)对组胺的分离效果,由图1可知,BEH C18柱对组胺分离效果较差,色谱峰信号响应强度较低;XR-ODSII柱对组胺无保留,峰形拖尾;而Diol-HILIC-120柱对组胺具有良好的分离度,峰形尖锐对称,Diol-HILIC-120柱的固定相覆盖有一层水膜,组胺作为强极性小分子物质,可与水膜发生强烈的相互作用,从而增强其保留。其次,Diol-HILIC-120柱采用的二醇基修饰的硅胶基质能够提供较强的极性相互作用,与组胺分子中的胺基形成氢键,从而提高组胺的保留能力并优化其峰形。
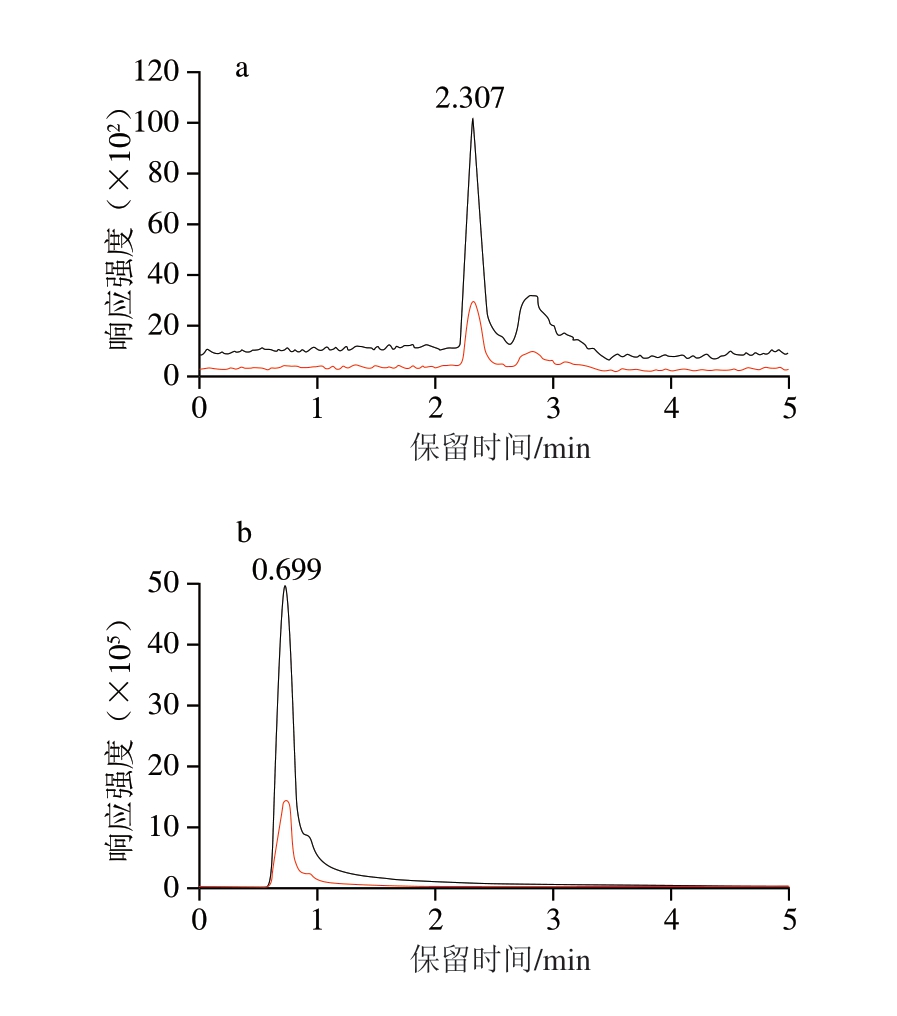
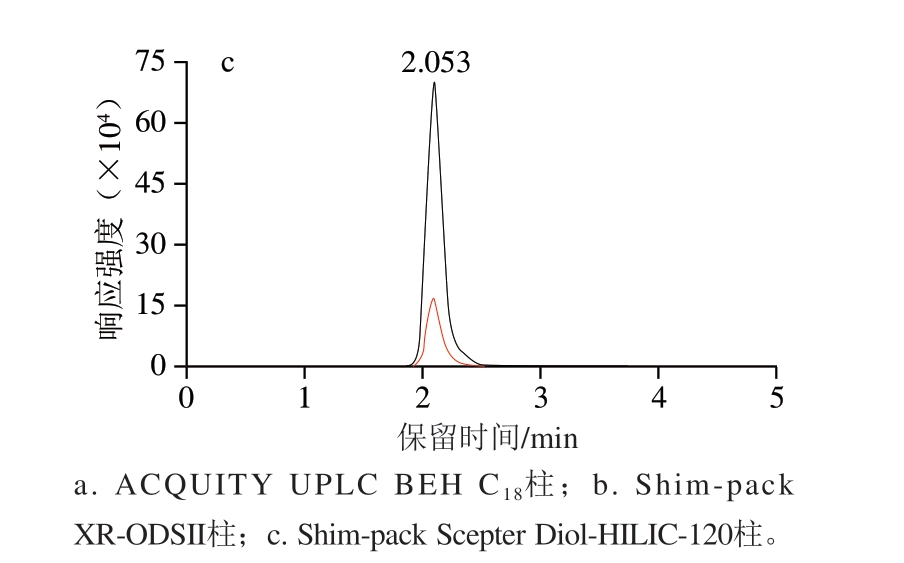
图1 不同色谱柱条件下组胺标准溶液(20 μg/L)的色谱图
Fig. 1 Chromatograms of histamine standard solution (20 μg/L) on different columns
2.1.2 流动相选择
在Diol-HILIC-120柱模式下,采用乙腈-水体系作为流动相有助于维持色谱柱上的水膜,从而促进组胺的分配和保留。此外,结合文献[28-29]可知,在流动相中加入适量的酸和缓冲盐可增强流动相的缓冲能力,维持pH值稳定,减少峰拖尾,从而提高检测灵敏度。为进一步优化方法检测性能,本研究考察流动相中甲酸体积分数(0.1%、0.2%、0.5%)对检测灵敏度的影响。由图2可知,与0.1%、0.2%甲酸相比,0.5%甲酸能够明显提高组胺的色谱峰信号响应强度,表明0.5%甲酸有助于提高组胺的离子化效率,增强质谱检测灵敏度。然而,过高的酸含量可能反而降低目标物的离子化效率,增加基线噪声,甚至影响质谱仪的长期稳定性。综合考虑色谱分离效果、检测灵敏度和仪器稳定性,最终选择流动相中甲酸体积分数为0.5%。
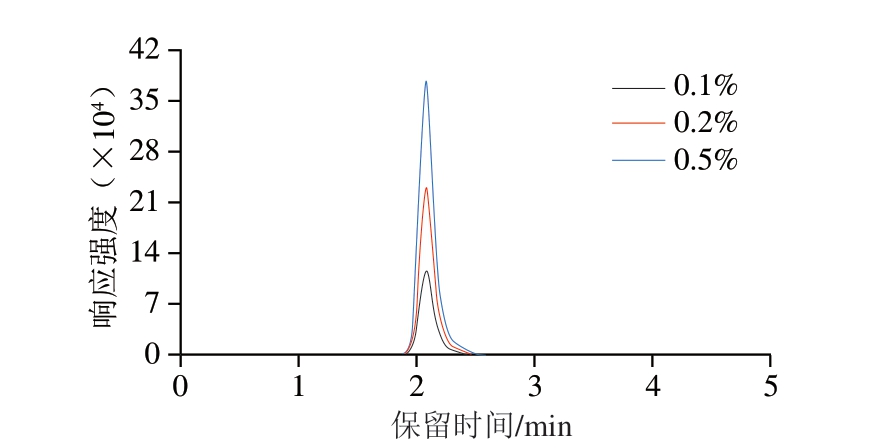
图2 流动相中甲酸体积分数对组胺标准溶液(10 μg/L)响应强度的影响
Fig. 2 Effect of formic acid concentration in the mobile phase on the response intensity for histamine standard solution (10 μg/L)
综上,最终确定的最佳色谱条件为:Diol-HILIC-120色谱柱,流动相A为0.5%(V/V)甲酸溶液(含10 mmol/L甲酸铵),B为90%(V/V)乙腈溶液(含10 mmol/L甲酸铵与0.5%(V/V)甲酸)。
2.2 MS/MS条件优化
在ESI正离子模式下对组胺进行一级MS扫描,确定其母离子为m/z 112.10,进一步对该母离子进行二级MS扫描,以获得其碎片离子信息,结果表明,m/z 95.05和m/z 68.05具有较高的信号响应强度,因此选定这2 个碎片离子作为子离子。基于此,组胺的2 对特征离子对确定为m/z 112.10/95.05和m/z 112.10/68.05。
为优化仪器检测性能,进一步对Q1偏转电压、碰撞能量及Q3偏转电压进行优化,以最大化2 对特征离子对的信号强度。为提高检测灵敏度,对离子源参数(接口电压、雾化气流量、加热气流量、接口温度、脱溶剂线温度、加热块温度及干燥气流量)进行系统优化。如图3所示,优化后,质谱信号的稳定性和灵敏度均得到显著提升,确保LC-MS/MS在最优条件下运行,实现对组胺的高效、准确检测。最终优化所得MS/MS参数见表2。
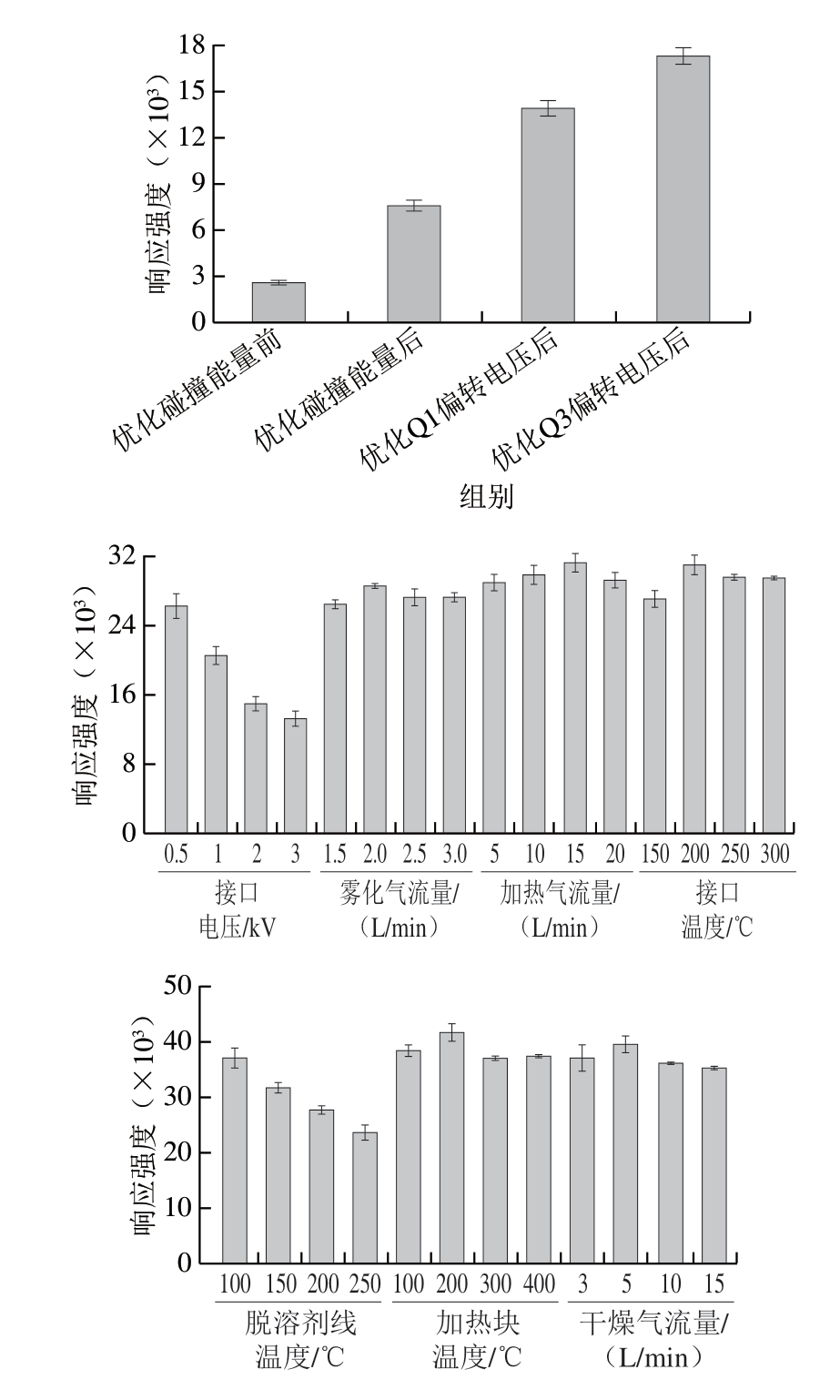
图3 不同MS/MS参数对组胺标准溶液(2 μg/L)响应强度的影响
Fig. 3 Effect of different MS/MS parameters on the response intensity for histamine standard solution (2 μg/L)
2.3 样品前处理条件优化
2.3.1 提取溶液选择
由图4可知,随着甲酸体积分数的升高,组胺加标回收率呈先升高后下降的变化趋势,以体积分数0.2%甲酸条件下的加标回收率最高。究其原因,当甲酸体积分数较低(0.1%)时,体系酸度不足,组胺以非质子化形式为主,其在极性提取体系中的溶解度不高;而当甲酸体积分数较高(≥0.5%)时,组胺可能发生过度质子化,反而削弱其在有机溶剂中的分配能力,更易保留在水相中,导致提取效率下降[30]。值得注意的是,适量甲酸还能协助沉淀蛋白质并部分乳化脂肪,降低基质干扰,促进组胺的释放。但若甲酸含量过高,过度沉淀的蛋白可能导致提取液均一性变差,进而影响提取效果。综上所述,0.2%甲酸在提高组胺溶解性、优化其离子化状态及降低基质干扰方面表现较优,因此提取溶液中甲酸体积分数为0.2%。
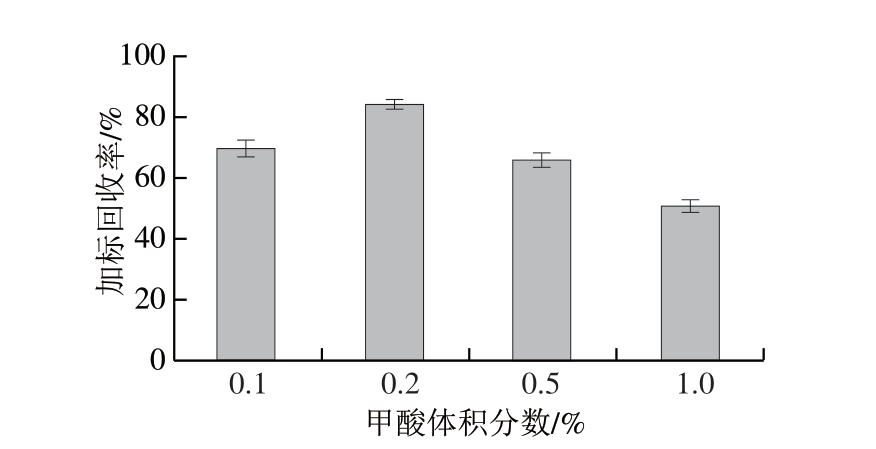
图4 提取液中甲酸体积分数对组胺加标回收率的影响
Fig. 4 Effect of concentration of formic acid in the extraction solvent on the recovery rate of spiked samples
2.3.2 净化方式选择
研究[31]显示,-60 ℃冷冻处理1 h可有效去除肉类样品中的脂肪和蛋白质等杂质。基于此,本研究进一步比较-60 ℃冷冻1、2 h与液氮冷冻2、4 min处理条件下的组胺平均加标回收率。由表3可知,相较于-60 ℃冷冻处理,液氮冷冻能够略微提高组胺的平均加标回收率,并能显著缩短样品处理时间。此外,通过对比液氮冷冻处理2 min前后的样品溶液(图5)可知,液氮冷冻后脂肪等杂质明显析出,进一步验证了其净化效果。液氮冷冻净化方法无需额外的复杂操作,可有效降低操作复杂度,提高样品处理效率,并可减少溶剂污染和试剂消耗。同时,低温条件能够有效抑制细菌活性和生化反应,避免分析物降解。

图5 液氮冷冻前后样品溶液的变化
Fig. 5 Change in sample solution before and after liquid nitrogen freezing
表3 -60 ℃和液氮冷冻方式下组胺平均加标回收率对比(n=6)Table 3 Comparison of average spiked recoveries of histamine under
freezing at-60 ℃ and liquid nitrogen freezing (n = 6)
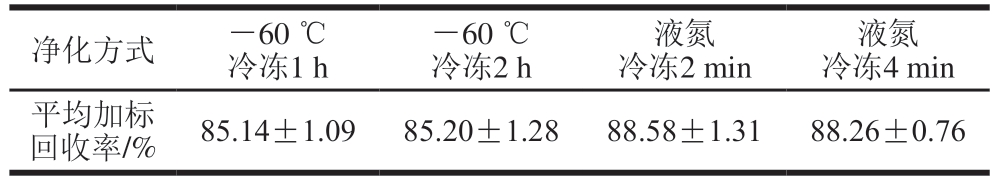
液氮冷冻4 min平均加标回收率/%85.14±1.0985.20±1.2888.58±1.3188.26±0.76净化方式-60 ℃冷冻1 h-60 ℃冷冻2 h液氮冷冻2 min
2.4 方法学验证
2.4.1 标准曲线、检出限(limit of detection,LOD)与定量限(limit of quantitation,LOQ)
由于鱼类样品基质复杂,为消除基质效应干扰,本研究选取空白鱼肉样品制备空白基质标准溶液,通过空白基质标准曲线进行定量分析。标准曲线以峰面积为纵坐标,组胺质量浓度(μg/L)为横坐标,采用外标法进行定量。结果表明,组胺在2~250 μg/L范围内线性关系良好,空白基质标准曲线方程为y=360 679x-355 695(R2=0.999 98);通过在空白基质溶液中添加低质量浓度组胺标准溶液获取的方法LOD(信噪比(RSN)=3)和LOQ(RSN=10)分别为0.5 μg/kg与1.6 μg/kg,均远低于国家标准要求[20],表明该方法具有较高的灵敏度,能够有效地检测鱼类样品中的组胺。
2.4.2 准确度与精密度
基于本研究的线性范围在空白鱼肉样品中分别加入低、中、高3 个水平的组胺标准溶液,按照1.3.3节方法进行处理,每个水平平行测定6 次。由表4可知,组胺的平均加标回收率为84.36%~109.43%,相对标准偏差(relative standard deviations,RSD)均小于5%,表明该方法在组胺测定中的准确度和精密度均良好。
表4 组胺的加标回收率和RSD(n=6)
Table 4 Recovery and RSD of histamine in spiked samples (n = 6)
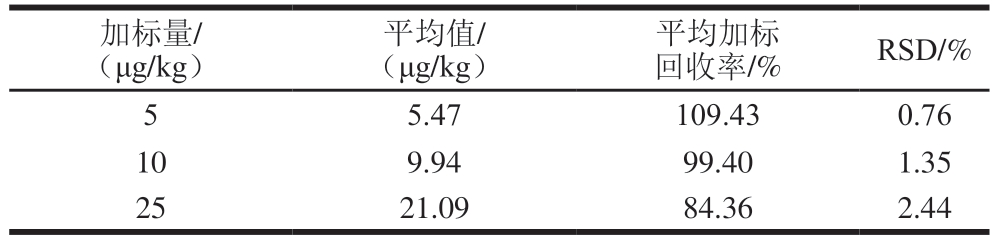
加标量/(μg/kg)平均值/(μg/kg)平均加标回收率/%RSD/%5.47109.430.76 109.9499.401.35 2521.0984.362.44 5
2.5 样品测定
采用本方法检测20 条市售鱼样(10 条来自菜市场、10 条来自超市)。所有样品购买后均存放于低温转运箱中,立即运送至实验室后立即进行预处理和LC-MS/MS检测。由表5可知,仅1 条鱼样未检出组胺,检出率达95%。组胺检出值为ND~264.935 μg/kg,且所有样品的组胺检出值均未超过GB 2733—2015[8]规定限值(200 mg/kg)。总体而言,超市样品组胺检出值高于菜市场样品,这与北京的报道数据[32]相一致,该现象可能与超市中鱼类贮藏时间较长有关,长时间贮藏可促进微生物繁殖,进而促进组胺生成。建议监管部门加强对超市水产品冷链贮藏条件及组胺含量的监测,以确保水产品质量安全。
表5 鄂尔多斯市常见鱼类组胺检出值
Table 5 Histamine contents in common fish species in Ordos City μg/kg
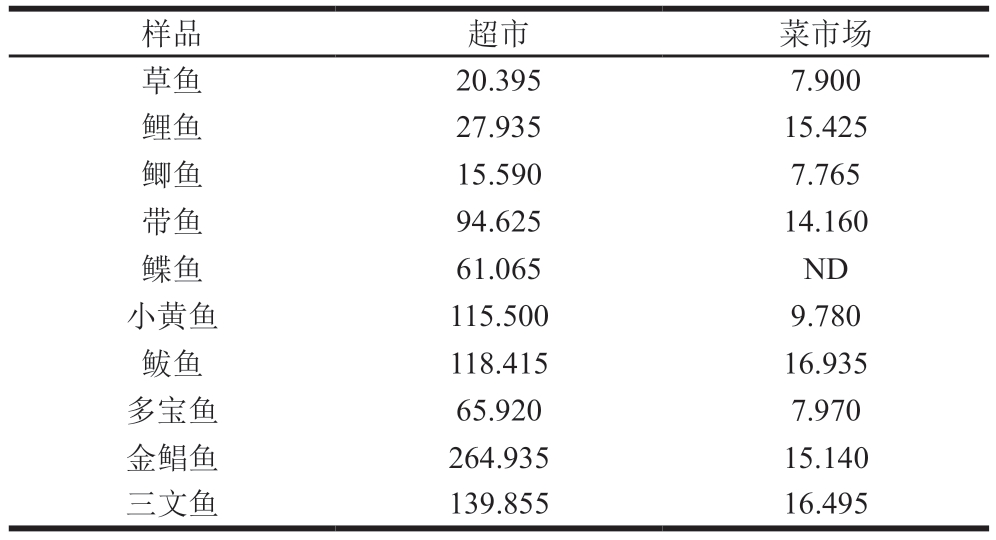
注:ND.未检出。
样品超市菜市场草鱼20.3957.900鲤鱼27.93515.425鲫鱼15.5907.765带鱼94.62514.160鲽鱼61.065ND小黄鱼115.5009.780鲅鱼118.41516.935多宝鱼65.9207.970金鲳鱼264.93515.140三文鱼139.85516.495
3 结论
本研究基于LC-MS/MS建立了一种针对鱼肉中组胺简便、快速的检测方法。通过优化仪器条件、选择提取溶液中的甲酸含量、筛选净化步骤等,有效提高组胺的提取效率和检测灵敏度。经过方法学验证表明,该方法具有良好的线性关系、较高的准确度和精密度。总体而言,该方法具有高效、环保、简便等优势,可为鱼类安全监测提供有力的技术支撑。
[1] VISCIANO P, SCHIRONE M, PAPARELLA A. An overview of histamine and other biogenic amines in fish and fish products[J].Foods, 2020, 9(12): 1795. DOI:10.3390/foods9121795.
[2] 陶鑫, 王章成, 马成章. HPLC法测定食品中组胺的研究[J]. 安徽化工, 2024, 50(4): 119-124. DOI:10.3969/j.issn.1008-553X.2024.04.029.
[3] BARIK B, MOHAPATRA S. Selective visual detection of histamine and ascorbic acid through the rapid gel-sol transition of luminescent alginate hydrogel[J]. Sensors and Actuators B: Chemical, 2022, 367:132128. DOI:10.1016/j.snb.2022.132128.
[4] ABUHLEGA T A, ALI M R. Biogenic amines in fish: prevention and reduction[J]. Journal of Food Processing and Preservation, 2022,46(10): e16883. DOI:10.1111/jfpp.16883.
[5] 张立飞, 孙明浩, 华成黎 ,等. 发酵食品中生物胺的形成、检测及其防控策略的研究进展[J]. 食品与发酵工业, 2023, 49(3): 329-339.DOI:10.13995/j.cnki.11-1802/ts.030365.
[6] FDA. Fish and fishery products: hazards and controls guidance[M].Darby: DIANE publishing, 2011.
[7] BIOHAZ. Scientific opinion on risk based control of biogenic amine formation in fermented foods[J]. EFSA Journal, 2011, 9(10): 2393.DOI:10.2903/j.efsa.2011.2393.
[8] 国家卫生和计划生育委员会. 食品安全国家标准 鲜、冻动物性水产品: GB 2733—2015[S]. 北京: 中国标准出版社, 2015.
[9] KOUNNOUN A, LOUAJRI A, CACCIOLA F, et al. Development of a new HPLC method for rapid histamine quantification in fish and fishery products without sample clean-up[J]. European Food Research and Technology, 2022, 248(6): 1679-1689. DOI:10.1007/s00217-022-03995-z.
[10] FU Q Y, ZHENG H W, HAN X N, et al. Development of a highly sensitive HPLC method for the simultaneous determination of eight biogenic amines in aquatic products[J]. Acta Chromatographica, 2021,33(4): 378-386. DOI:10.1556/1326.2020.00824.
[11] 郭新颖, 戴志英, 陈峰, 等. 水产品及其罐头制品中组胺污染分析与健康风险[J]. 医学动物防制, 2024, 40(9): 926-930. DOI:10.7629/yxdwfz202409021.
[12] LI Y F, LIN Z Z, HONG C Y, et al. Histamine detection in fish samples based on indirect competitive ELISA method using iron-cobalt co-doped carbon dots labeled histamine antibody[J]. Food Chemistry,2021, 345: 128812. DOI:10.1016/j.foodchem.2020.128812.
[13] KAMANKESH M, MOHAMMADI A, MOLLAHOSSEINI A, et al.Application of a novel electromembrane extraction and microextraction method followed by gas chromatography-mass spectrometry to determine biogenic amines in canned fish[J]. Analytical Methods,2019, 11(14): 1898-1907. DOI:10.1039/C9ay00224c.
[14] WOJNOWSKI W, NAMIEŚNIK J, PŁOTKA-WASYLKA J.Dispersive liquid-liquid microextraction combined with gas chromatography-mass spectrometry for in situ determination of biogenic amines in meat: estimation of meat’s freshness[J].Microchemical Journal, 2019, 145: 130-138. DOI:10.1016/j.microc.2018.10.034.
[15] KOČAR D, KÖSE S, TUFAN B, et al. Determination of biogenic amines in fresh fish and processed fish products using IC-MS/MS[J].Foods, 2021, 10(8): 1746. DOI:10.3390/foods10081746.
[16] KOUTI E, TSIASIOTI A, ZACHARIS C K, et al. Specific determination of histamine in cheese and cured meat products by ion chromatography coupled to fluorimetric detection[J]. Microchemical Journal, 2021, 168: 106513. DOI:10.1016/j.microc.2021.106513.
[17] LIU J, CAO Y H. An electrochemical sensor based on an anti-fouling membrane for the determination of histamine in fish samples[J].Analytical Methods, 2021, 13(5): 685-694. DOI:10.1039/D0AY01901A.
[18] PUTHIYOTTIL N, KANAKKAYIL S, PILLAI N P, et al. In situ engineering of Au-Ag alloy embedded PEDOT nanohybrids at a solvent/non-solvent interface for the electrochemical enzyme-free detection of histamine[J]. Journal of Materials Chemistry B, 2023,11(5): 1144-1158. DOI:10.1039/d2tb02637f.
[19] MUNIR M A, RAHMAWATI F, JAMAL J A, et al. Inspecting histamine isolated from fish through a highly selective molecularly imprinted electrochemical sensor approach[J]. ACS Omega, 2023,8(14): 13352-13361. DOI:10.1021/acsomega.3c00768.
[20] 国家食品药品监督管理总局, 国家卫生和计划生育委员会. 食品安全国家标准 食品中生物胺的测定: GB 5009.208—2016[S]. 北京: 中国标准出版社, 2016.
[21] 周朗君, 陈钦, 李秀英. 丹磺酰氯柱前衍生-反相高效液相色谱法同时测定水产品中9 种生物胺[J]. 食品安全质量检测学报, 2025,16(5): 24-31. DOI:10.19812/j.cnki.jfsq11-5956/ts.20241018004.
[22] 郭新颖. 柱前衍生-高效液相色谱法测定鱼类中组胺[J]. 化学分析计量, 2024, 33(1): 12-16. DOI:10.3969/j.issn.1008-6145.2024.01.003.
[23] 刘洋帆, 李绪鹏, 冯阳, 等. 超高效液相色谱-串联质谱法测定鲣鱼中的生物胺[J]. 食品与发酵工业, 2022, 48(20): 225-230.DOI:10.13995/j.cnki.11-1802/ts.029408.
[24] ZHANG X, FANG C L, LOU X Y, et al. Survey of the biogenic amines in typical foods commonly consumed from the Chinese market[J]. Food Control, 2024, 157: 110130. DOI:10.1016/j.foodcont.2023.110130.
[25] PAIS G L, MELONI D, MUDADU A G, et al. Colorimetric analysis and determination of histamine in samples of yellowfin tuna (Thunnus albacares) marketed in Sardinia (Italy) by a combination of rapid screening methods and LC-MS/MS[J]. Foods, 2022, 11(5): 639.DOI:10.3390/foods11050639.
[26] 王璐, 孙小杰, 耿岳, 等. 非衍生化-QuEChERS-超高效液相色谱-串联质谱法快速测定鱼肉中9 种生物胺[J]. 食品安全质量检测学报, 2023, 14(3): 269-276. DOI:10.19812/j.cnki.jfsq11-5956/ts.2023.03.034.
[27] HARMOKO H, KARTASASMITA R E, MUNAWAR H, et al.Determination of histamine in different compositions of commercially canned fish in Indonesia by modified QuEChERS and LC-MS/MS[J].Journal of Food Composition and Analysis, 2022, 105: 104256.DOI:10.1016/j.jfca.2021.104256.
[28] 吴玉田, 王颖怡, 张权, 等. 超高效液相色谱-串联质谱法测定冷冻水产品中生物胺[J]. 分析科学学报, 2023, 39(6): 737-742.DOI:10.13526/j.issn.1006-6144.2023.06.018.
[29] LIOUPI A, PAPAIOANNOU A, IAKOVAKIS A, et al. Development and validation of a rapid and simple HILIC-MS/MS method for the determination of biogenic amines in tuna fish[J]. Journal of Chromatography B, 2024, 1243: 124204. DOI:10.1016/j.jchromb.2024.124204.
[30] CAI Q, LI X, RAN Z, et al. Simultaneous determination of 13 biogenic amines and their metabolites in liquid fermented food by HPLCQTRAP-MS without derivatization[J]. Microchemical Journal, 2024,206: 111659. DOI:10.1016/j.microc.2024.111659.
[31] MOLOGNONI L, DAGUER H, DE SÁ PLOÊNCIO L A, et al.A multi-purpose tool for food inspection: simultaneous determination of various classes of preservatives and biogenic amines in meat and fish products by LC-MS[J]. Talanta, 2018, 178: 1053-1066.DOI:10.1016/j.talanta.2017.08.081.
[32] LI T, WANG R, WANG P. The development of an ultra-performance liquid chromatography-tandem mass spectrometry method for biogenic amines in fish samples[J]. Molecules, 2022, 28(1): 184. DOI:10.3390/molecules28010184.