白鲢鱼(Hypophthalmichthys molitrix)是我国淡水养殖体系中产量最高的鱼种之一,作为鱼糜加工原料具有重要经济价值。然而,腥味浓重、肌间刺分布密集及凝胶强度不足等问题制约了其在鱼糜制品加工中的应用[1]。漂洗作为鱼糜生产的关键工艺环节,可通过选择性去除脂肪、水溶性蛋白及残余血液等组分改善鱼糜色泽、风味特征及凝胶性能等[2-4]。目前,常用的漂洗液(包括清水、盐溶液、金属离子溶液及臭氧水等)在提升凝胶强度与降低能耗方面仍存在技术瓶颈,因此探索新型高效漂洗技术具有重要应用价值。
等离子体活化水(plasma-activated water,PAW)是通过等离子体射流在蒸馏水中或表面放电制备的水溶液[5],其含有大量短寿命活性氧(reactive oxygen species,ROS)、活性氮(reactive nitrogen species,RNS)等活性成分,这些物质在水相中可转化为硝酸根(NO3-)、亚硝酸根(NO2-)、过氧化氢(H2O2)和臭氧(O3)等次级反应产物[6-7],其反应物种类型和浓度主要取决于工艺参数,包括等离子体源类型、水源性质、处理时间、输入电压、气体流量及放置时间等[8-10]。近年来,PAW因具有制备简便、成本低廉、环境友好及功能活性持久等优势,在水产品加工领域备受关注。PAW可通过调控肌原纤维蛋白热聚集行为改善鲢鱼鱼糜的凝胶性能[11]。基于PAW制备的肌原纤维蛋白凝胶可显著提升淡水鱼鱼糜产品的品质和蛋白含量[12],为淡水鱼加工提供品质改良新途径。
本研究以白鲢鱼为原料,使用PAW对其进行漂洗,采用响应面法考察放电时间、放电功率、空气流量对白鲢鱼糜凝胶特性的影响,并优化PAW漂洗工艺参数,通过对比不同漂洗方式下的凝胶品质,筛选最佳PAW漂洗工艺,为白鲢鱼糜节水漂洗工艺提供理论参考。
1 材料与方法
1.1 材料与试剂
鲜活白鲢鱼(1.5~2.0 kg/条)、蔗糖、食盐、塑料肠衣(均为食品级) 市购。
山梨糖醇、焦磷酸钠、三聚磷酸钠、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、考马斯亮蓝R250、尿素、磷酸二氢钠、磷酸氢二钠、戊二醛、无水乙醇(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
PG-1000 ZD等离子体发生器 南京苏曼等离子体科技有限公司;SPR-150鱼肉采肉机 上海华晨运达机械有限公司;FA104N电子分析天平 上海民桥精密科学仪器有限公司;HH-2数显水浴锅 江苏金坛环宇科学仪器厂;TA.XT Plus物性测试仪 英国Stable Micro System公司;PowerPac Basic电泳仪 美国Bio-Rad公司;3500凝胶成像仪 上海天能科技有限公司;CT15RT台式高速冷冻离心机 上海天美生化仪器设备工程有限公司;T8均质机 德国IKA公司;EPOCH全波长酶标仪 美国BioTek Instruments公司;EM30扫描电子显微镜 韩国COXEM公司。
1.3 方法
1.3.1 PAW制备
参照Li Qiang等[13]的方法,本研究采用大气压等离子体射流设备制备PAW,将等离子体射流置于1 000 mL超纯水液面下方约5 mm处。制备完成的PAW保存于4 ℃环境中,用于后续漂洗实验。
1.3.2 白鲢鱼糜制备
鲜活白鲢鱼去鳞、头、尾和内脏后切成两半,立即冰覆并运至实验室,清洗去除黑膜、血污后放入采肉机,滚揉分离鱼皮、鱼刺后得到粗鱼糜。采用不同漂洗方式处理鱼糜,漂洗过程中严格控制漂洗液温度在10 ℃以下,使用玻璃棒搅拌3 min后静置5 min,经80 目尼龙滤网过滤后1 400 r/min离心2 min脱水,加入复合抗冻剂(4%(m/m)蔗糖、4%(m/m)山梨糖醇、0.1%(m/m)焦磷酸钠、0.1%(m/m)三聚磷酸钠),置于-18 ℃冷冻保存备用。
1.3.3 鱼糜凝胶样品制备
冷冻鱼糜于4 ℃条件下解冻后,准确称取一定量,斩拌3 min,加入2.5%(m/m)食盐继续斩拌5 min。将斩拌均匀的鱼糜灌入直径25 mm的塑料肠衣中,封口。采用两段式水浴加热法制备鱼糜凝胶:40 ℃加热1 h,90 ℃加热30 min,立即冰水浴冷却20 min,4 ℃保存待测。
1.3.4 PAW漂洗工艺单因素试验
固定放电功率650 W、空气流量27 L/min条件下,分别在放电时间1、3、5、7、9 min条件下制备PAW,取400 g白鲢鱼糜,加入2 000 mL PAW,按1.3.2节步骤漂洗鱼糜,依据鱼糜凝胶强度与持水性(water-holding capacity,WHC)确定放电时间;固定放电时间7 min、空气流量27 L/min条件下,分别在放电功率350、450、550、650、750 W条件下制备PAW,按1.3.2节步骤漂洗鱼糜,依据凝胶强度及WHC确定放电功率;固定放电时间7 min、放电功率650 W条件下,分别在空气流量9、18、27、36、45 L/min条件下制备PAW,按1.3.2节步骤漂洗鱼糜,依据凝胶强度及WHC确定空气流量。
1.3.5 PAW漂洗工艺响应面优化试验
根据单因素试验结果,选取放电时间、放电功率及空气流量的最优参数范围,以凝胶强度与WHC为响应值,采用响应面法进行工艺优化。
1.3.6 凝胶强度测定
取出鱼糜凝胶样品,室温平衡1 h,切成20 mm高的圆柱体。用物性测试仪测定样品的破断力和破断距离,每个样品重复测定6 次。测试条件:P/5S探头,测前速率、测试速率均为1.0 mm/s,测后速率1.5 mm/s,下压距离15 mm。按式(1)计算凝胶强度:
1.3.7 WHC测定
称取4~5 g鱼糜凝胶薄片,包裹在3 层滤纸中,置于50 mL离心管中,25 ℃、6 000×g离心15 min[14]。每个样品重复测定6 次。m1/g和m2/g分别为离心前后样品质量,按式(2)计算WHC:
1.3.8 不同漂洗方式下鱼糜凝胶品质对比
以响应面优化后的最佳工艺参数制备PAW,比较清水+盐水+盐水、PAW+盐水+盐水、清水+盐水和PAW+盐水4 种漂洗方式下鱼糜凝胶的质构特性、SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)结果、化学作用力及微观结构。其中,PAW+盐水+盐水组:首先用5 倍鱼糜质量的PAW漂洗3 min,静置5 min,1 400 r/min离心2 min脱水后,再用5 倍鱼糜质量的0.15%盐水(即0.15%(m/m)食盐溶液)漂洗3 min,静置5 min,离心脱水,再重复1 次0.15%盐水漂洗,即得漂洗后鱼糜凝胶样品,其他3 组依此类推。
1.3.8.1 质构特性测定
将鱼糜凝胶样品切分成20 mm高的圆柱体,用物性测试仪测定样品的硬度、内聚性、黏性和回复性。测定参数:全质构分析模式,P/36R探头,测前、测试、测后速率均为1 mm/s,压缩比25%,触发力5.0 g,每个样品平行测定6 次。
1.3.8.2 SDS-PAGE测定
参考Liang Feng等[15]的方法并略作修改。称取3 g鱼糜凝胶与27 mL 5 g/100 mL SDS溶液混合,12 000 r/min均质1 min,85 ℃水浴加热1 h,冷却后8 000×g离心15 min,取上清液。使用Lowry法调节上清液蛋白质量浓度至1 mg/mL。取上清液与样品缓冲液按体积比4∶1混合,沸水浴10 min后冷却。取8 µL样品装载到电泳预制胶中,80 V恒压电泳。电泳结束后用考马斯亮蓝R250染色,用蒸馏水于摇床上脱色至背景基本无色,最后在凝胶成像仪上成像。
1.3.8.3 化学作用力测定
参考Wang Xuejiao等[16]的方法并略作修改。取4 g鱼糜凝胶,切碎后分别与20 mL 4 种溶液(SA:0.05 mol/L NaCl;SB:0.6 mol/L NaCl;SC:0.6 mol/L NaCl+1.5 mol/L尿素;SD:0.6 mol/L NaCl+8 mol/L尿素)混合并均质1 min,4 ℃静置1 h,8 000×g离心15 min。为避免β-巯基乙醇干扰,采用Bradford法测定上清液蛋白含量。以相应溶液蛋白含量差值表征溶液体系中的离子键(SB-SA)、氢键(SC-SB)、疏水相互作用(SD-SC)含量。每次测定均重复3 次。
1.3.8.4 微观结构观察
参考戴慧敏[17]的方法并略作修改。将凝胶样品切成约5 mm×5 mm×1 mm的小块,在0.1 mol/L磷酸盐缓冲液(pH 7.2)中浸泡30 min;随后在4 ℃条件下,用2.5%(V/V)戊二醛溶液固定过夜;然后使用相同的磷酸盐缓冲液冲洗5 次;再依次用体积分数30%、50%、60%、70%、80%、90%乙醇溶液和无水乙醇脱水15 min;将样品冷冻干燥24 h,真空离子溅射仪喷金后在扫描电子显微镜下观察。
1.4 数据处理
所有实验均至少重复3 次。使用Excel 2021和SPSS 27.0软件进行数据处理和方差分析;结果以平均值±标准差表示,P<0.05表示差异显著;使用Design-Expert 13.0软件对响应面优化试验结果进行二次回归拟合。
2 结果与分析
2.1 PAW漂洗工艺单因素试验结果
2.1.1 放电时间对鱼糜凝胶强度和WHC的影响
凝胶强度作为评价鱼糜凝胶特性的关键指标之一,是凝胶遭受破坏时单位面积截面所承受的最大力[18]。由图1A可知,随着放电时间的延长,鱼糜凝胶强度呈先显著增加后显著降低的变化趋势(P<0.05),在放电7 min达到最大值,说明经适宜放电时间制备的PAW漂洗可有效提升白鲢鱼糜的凝胶强度,但放电时间过长时,制备的PAW反而不利于凝胶强度的增强。PAW含有的H2O2通过Fenton反应产成的羟自由基可特异性攻击肌原纤维蛋白的巯基,促使其转化为二硫键,引发肌原纤维蛋白氧化,增加蛋白质分子间的共价交联,从而形成更加致密的网络结构[6,19],进而提高鱼糜凝胶强度。李梦哲[20]研究表明,放电时间120 s时制备的PAW处理鲢鱼肌原纤维蛋白效果最佳,超过此时间后,PAW的酸性增强会导致蛋白结构被破坏,凝胶强度降低,从而导致鱼糜凝胶品质降低。
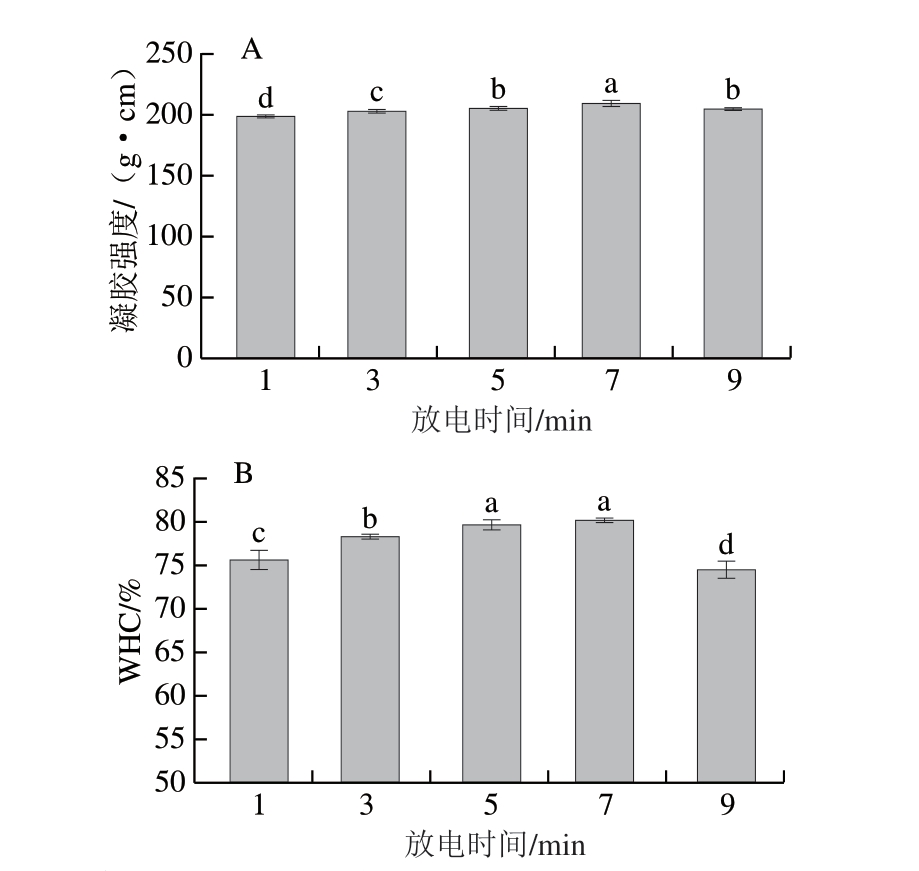
图1 放电时间对白鲢鱼糜凝胶强度(A)和WHC(B)的影响
Fig. 1 Effect of discharge time on the gel strength (A) and WHC (B) of silver carp surimi gels
小写字母不同表示组间差异显著(P<0.05)。图2、3、7同。
WHC是表征凝胶网络结构水分保持能力的关键指标,对凝胶特性具有显著影响[21]。PAW处理可诱导肌原纤维蛋白二级结构从α-螺旋向β-折叠及无规卷曲构象转化,导致蛋白分子内部疏水区域暴露,进而促进非共价键网络形成[22],非共价键网络的稳定性直接决定鱼糜凝胶的WHC。由图1B可知,随着放电时间的延长,鱼糜WHC呈先显著增加后显著降低的变化趋势(P<0.05),放电7 min时WHC最大,说明适宜放电时间制备的PAW漂洗可有效提高鱼糜凝胶的WHC,继续延长放电时间所制备的PAW甚至可能降低鱼糜凝胶的WHC,一方面,这可能是因为过量累积的ROS与RNS等活性物质诱导肌原纤维蛋白氧化,造成凝胶网络结构被破坏;另一方面,还可能与PAW的强酸性和高离子强度促使蛋白质聚集有关。因此,当放电时间超过临界阈值时,所制备的PAW会导致鱼糜凝胶WHC降低。
2.1.2 放电功率对鱼糜凝胶强度和WHC的影响
由图2A可知,白鲢鱼糜凝胶强度随放电功率的增加呈现先显著上升后显著下降的变化趋势(P<0.05),在放电功率650 W时,凝胶强度达到最大值。李平等[23]研究发现,最佳放电功率条件下制备的PAW处理能显著改善马铃薯生长特性及产量。放电功率越高,PAW电离程度越高,溶液中氢离子、酸根离子等越多,pH值越低[24],凝胶强度增加可能与蛋白微环境改变有关,蛋白微环境改变过大将不利于凝胶强度的进一步提高。
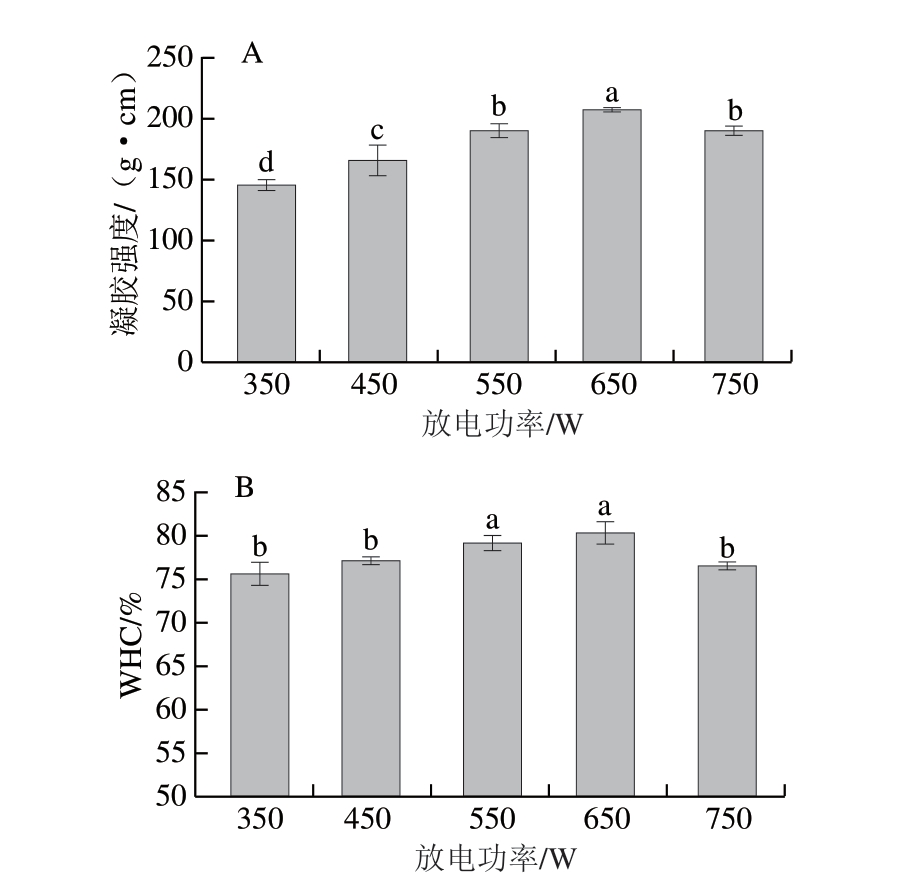
图2 放电功率对白鲢鱼糜凝胶强度(A)和WHC(B)的影响
Fig. 2 Effect of discharge power on the gel strength (A) and WHC (B) of silver carp surimi gels
由图2B可知,鱼糜凝胶WHC随放电功率增加呈先显著上升后显著下降的变化趋势(P<0.05),在放电功率650 W时WHC达到最大值,与凝胶强度变化趋势相同。凝胶强度的增强促使蛋白质分子间发生交联,形成更为致密的三维网络结构,该结构可通过增强水分子与蛋白质极性基团的相互作用,有效提高鱼糜凝胶的WHC。然而,PAW中的活性成分可诱导蛋白分子过度展开,导致维持水合作用的关键功能基团暴露或破坏,从而降低其持水能力[25-26]。
2.1.3 空气流量对鱼糜凝胶强度和WHC的影响
由图3A可知,空气流量从9 L/min升至27 L/min时,鱼糜凝胶强度显著增加(P<0.05),空气流量继续升高时,凝胶强度显著下降(P<0.05),空气流量过高不利于凝胶强度改善。PAW含有大量活性物质,推测空气流量越大,溶液中活性物质浓度越高,诱导蛋白质氧化的程度越高,一定程度的蛋白氧化有助于形成稳定的凝胶网络,提高凝胶强度[27-28],而过度氧化会破坏蛋白质结构,进而降低凝胶强度。因此,空气流量并非越高越好,适宜的空气流量制备的PAW处理才能有效改善鱼糜凝胶强度。
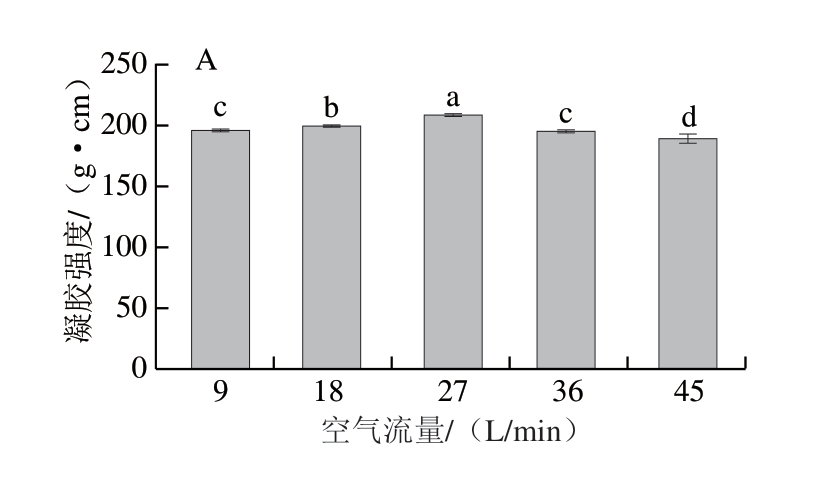
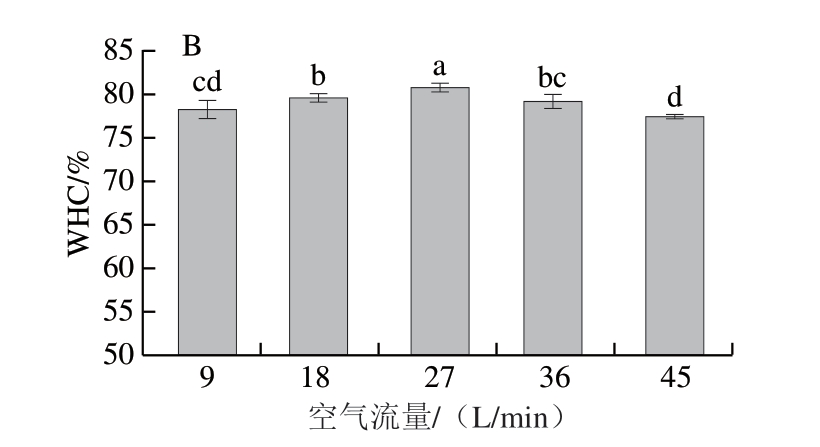
图3 空气流量对白鲢鱼糜凝胶强度(A)和WHC(B)的影响
Fig. 3 Effect of airflow rate on the gel strength (A) and WHC (B) of silver carp surimi gels
同样地,空气流量过高时,制备的PAW处理也不利于鱼糜凝胶WHC改善。由图3B可知,随着空气流量升高,白鲢鱼糜凝胶WHC呈现先升高后降低的变化趋势,空气流量超过27 L/min后,WHC出现显著下降(P<0.05)。适宜的空气流量可促使蛋白质凝胶网络结构致密化,有效提高其水分截留能力,WHC提高。然而,空气流量过高时,制备的PAW会导致蛋白质凝胶网络结构被破坏,引发水分流失,WHC降低[29]。
2.2 PAW漂洗工艺响应面优化试验结果
2.2.1 响应面试验设计与结果
根据单因素试验结果,以放电时间(A)、放电功率(B)和空气流量(C)为自变量,凝胶强度和WHC为响应值,采用Box-Behnken设计试验,试验因素水平见表1,试验设计与结果见表2。
表1 Box-Behnken试验因素及水平
Table 1 Code and level of independent variables used for Box-Behnken design
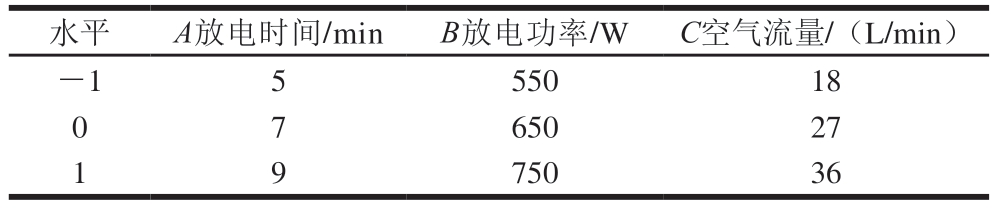
水平A放电时间/minB放电功率/WC空气流量/(L/min)-1555018 0 7 65027 1 9 75036
表2 Box-Behnken试验设计及结果
Table 2 Box-Behnken design and results
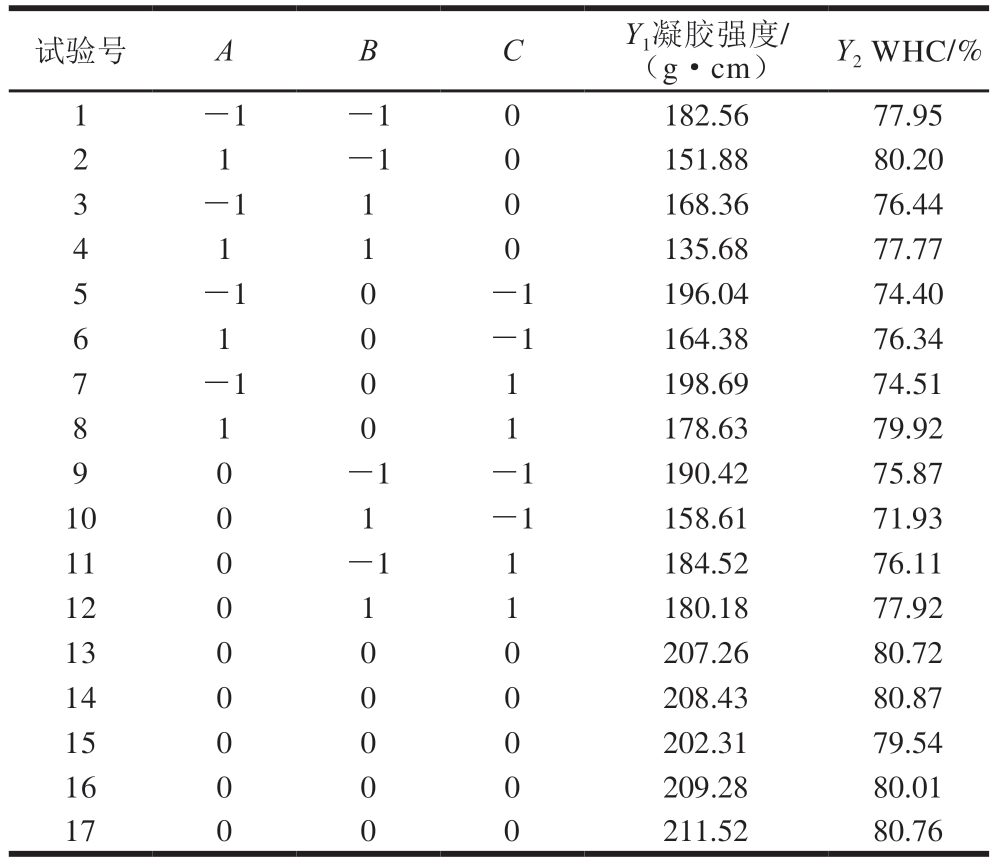
试验号ABCY1凝胶强度/(g・cm)Y2 WHC/%1-1-10182.5677.95 21-10151.8880.20 3-110168.3676.44 4110135.6877.77 5-10-1196.0474.40 610-1164.3876.34 7-101198.6974.51 8101178.6379.92 90-1-1190.4275.87 1001-1158.6171.93 110-11184.5276.11 12011180.1877.92 13000207.2680.72 14000208.4380.87 15000202.3179.54 16000209.2880.01 17000211.5280.76
2.2.2 凝胶强度回归模型的方差分析和显著性检验
经二次回归拟合得到凝胶强度对放电时间、放电功率、空气流量的回归方程为Y1=207.76-14.38A-8.32B+4.07C-0.50AB+2.90AC+6.87BC-21.07A2-27.07B2-2.26C2。由表3可知,回归模型P<0.01,模型极显著,失拟项不显著(P=0.645 7>0.05),表明该回归模型可用;决定系数R2=0.991 4、变异系数为1.69%(<10%),表明此回归模型可靠;由各项P值可知,一次项A、B、C,交互项BC及二次项A2、B2均对鱼糜凝胶强度影响极显著(P<0.01);由F值可知,各因素对鱼糜凝胶强度的影响大小依次为放电时间>放电功率>空气流量。
表3 凝胶强度的方差分析和显著性检验
Table 3 Analysis of variance (ANOVA) and significance test for gel strength
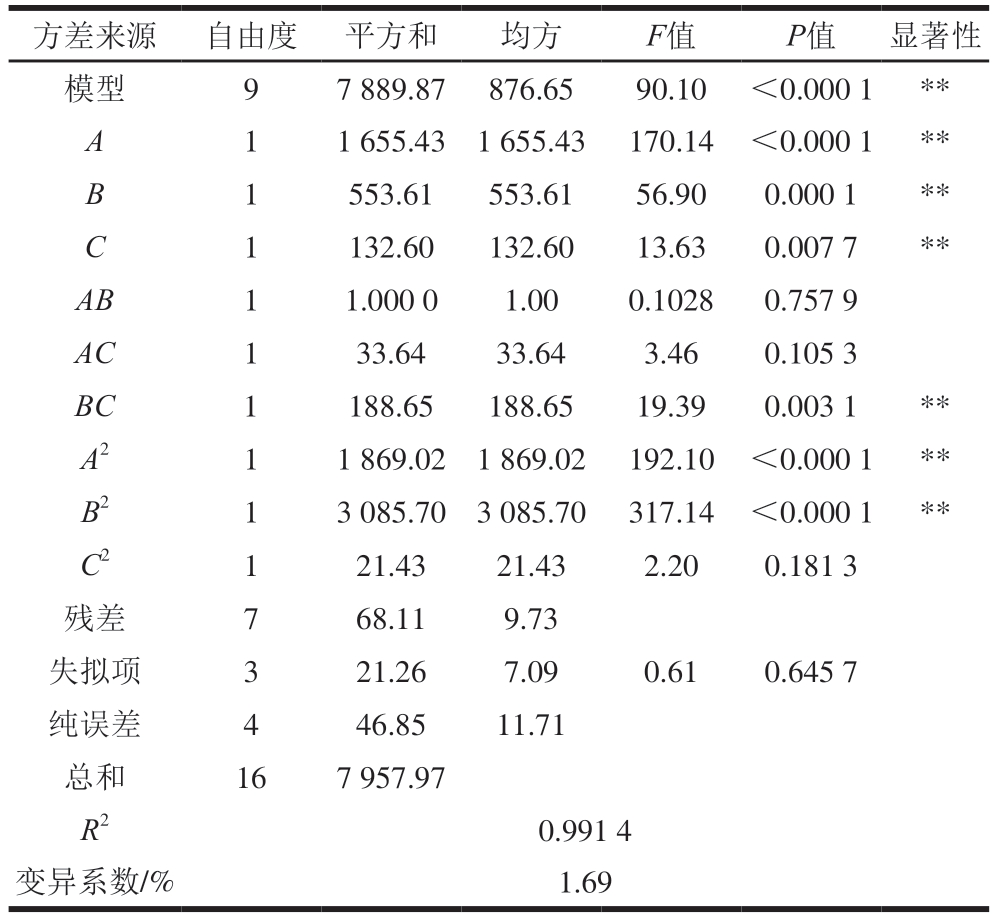
注:*.显著(P<0.05);**.极显著(P<0.01)。表4同。
方差来源自由度平方和均方F值P值显著性模型97 889.87876.6590.10<0.000 1**A11 655.431 655.43170.14<0.000 1**B1553.61553.6156.900.000 1**C1132.60132.6013.630.007 7**AB11.000 01.000.10280.757 9 AC133.6433.643.460.105 3 BC1188.65188.6519.390.003 1**A211 869.021 869.02192.10<0.000 1**B213 085.703 085.70317.14<0.000 1**C2121.4321.432.200.181 3残差768.119.73失拟项321.267.090.610.645 7纯误差446.8511.71总和167 957.97 R20.991 4变异系数/%1.69
等高线图能够反映两个因素之间交互作用显著性,等高线趋向于椭圆形时,表明两个因素交互作用显著。曲线的弯曲程度代表对应因素对响应值的响应程度。由图4A1可知,当空气流量恒定时,凝胶强度随放电时间和放电功率的增加呈先增大后减小的趋势,表明放电时间和放电功率的增加会使鱼糜凝胶强度增加,但过高的放电时间和放电功率会降低鱼糜凝胶强度。图4B1、C1变化趋势与图4A1类似。值得注意的是,图4C1变化趋势比较陡峭,图4A1、B1变化趋势平缓,表明放电功率和空气流量交互作用显著,放电时间和放电功率交互作用、放电时间和空气流量交互作用不显著,这与方差分析结果一致。
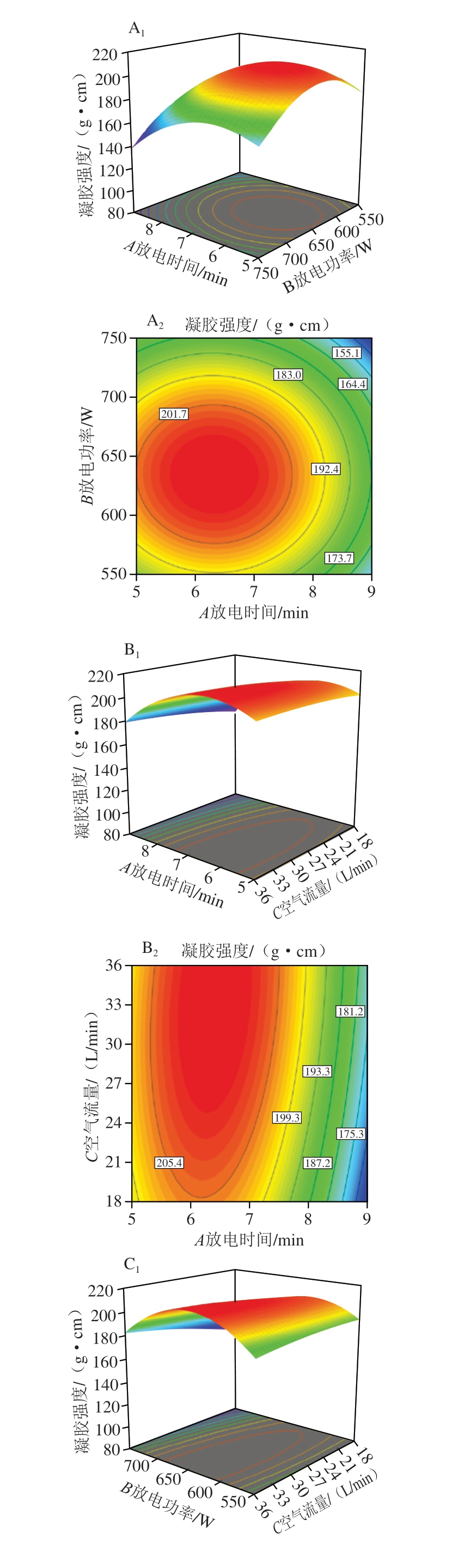
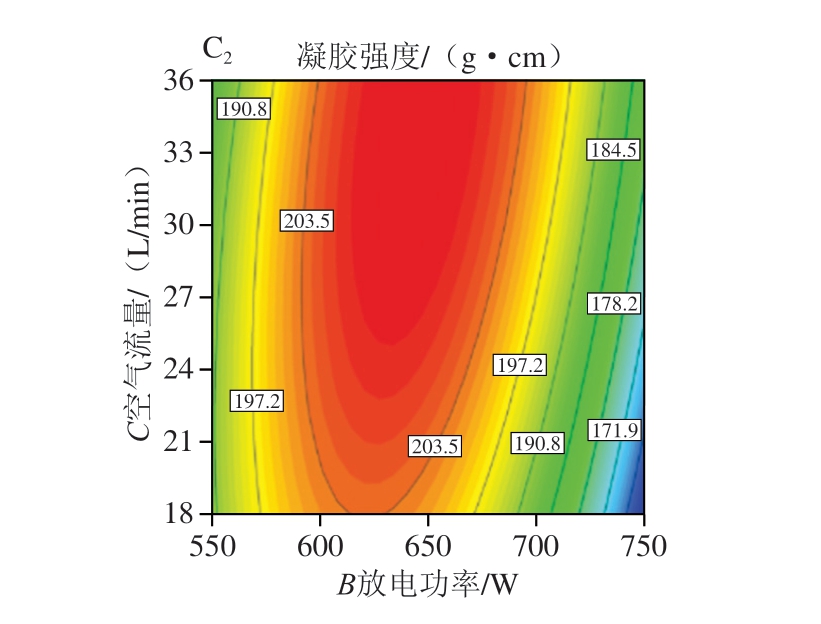
图4 放电时间、放电功率和空气流量的交互作用对白鲢鱼糜凝胶强度影响的响应面图和等高线图
Fig. 4 Response surface and contour plots showing the interactive effects of discharge time, discharge power and airflow rate on the gel strength of silver carp surimi gels
A1、B1、C1.响应面图;A2、B2、C2.等高线图。图5同。
2.2.3 WHC回归模型的方差分析和显著性检验
经二次回归拟合得到WHC对放电时间、放电功率、空气流量的回归方程为Y2=80.38+1.37A-0.76B+1.24C-0.23AB+0.87AC+1.44BC-0.73A2-1.56B2-3.36C2。由表4可知,回归模型P<0.01,模型极显著,失拟项不显著(P=0.160 0>0.05),表明该回归模型可用;决定系数R2=0.961 4、变异系数为1.01%(<10%),表明此回归模型可靠;由各项P值可知,一次项A、C,交互项BC及二次项B2、C2均对鱼糜WHC影响极显著(P<0.01),B影响显著(P<0.05);由F值可知,各因素对鱼糜WHC的影响大小依次为放电时间>空气流量>放电功率。
表4 WHC的方差分析和显著性检验
Table 4 ANOVA and significance test for WHC
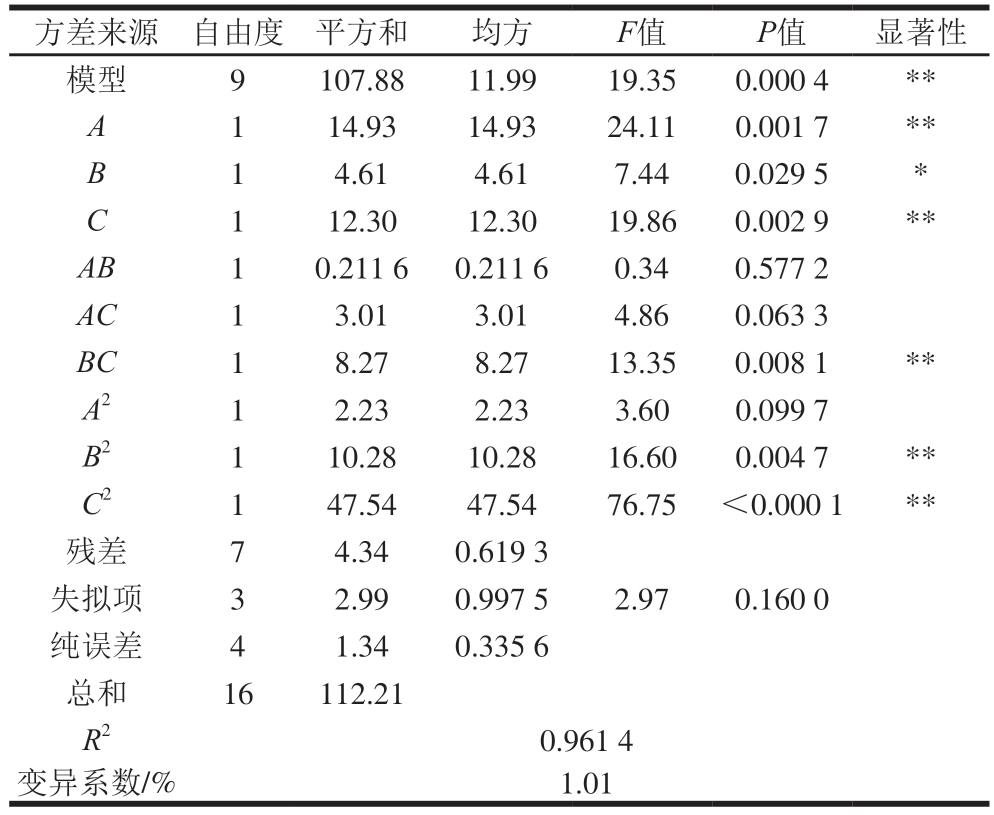
方差来源自由度平方和均方F值P值显著性模型9107.8811.9919.350.000 4**A114.9314.9324.110.001 7**B14.614.617.440.029 5*C112.3012.3019.860.002 9**AB10.211 60.211 60.340.577 2 AC13.013.014.860.063 3 BC18.278.2713.350.008 1**A212.232.233.600.099 7 B2110.2810.2816.600.004 7**C2147.5447.5476.75<0.000 1**残差74.340.619 3失拟项32.990.997 52.970.160 0纯误差41.340.335 6总和16112.21 R20.961 4变异系数/%1.01
由图5A1可知,当空气流量恒定时,WHC随放电时间和放电功率的增加呈先增大后减小的趋势,表明放电时间和放电功率的增加可促使WHC增大,但过高的放电时间和放电功率会导致WHC降低。图5B1、C1变化趋势与图5A类似。值得注意的是,图5C1变化趋势比较陡峭,图5A1、B1变化趋势相对平缓,说明放电功率和空气流量的交互作用对WHC影响显著。
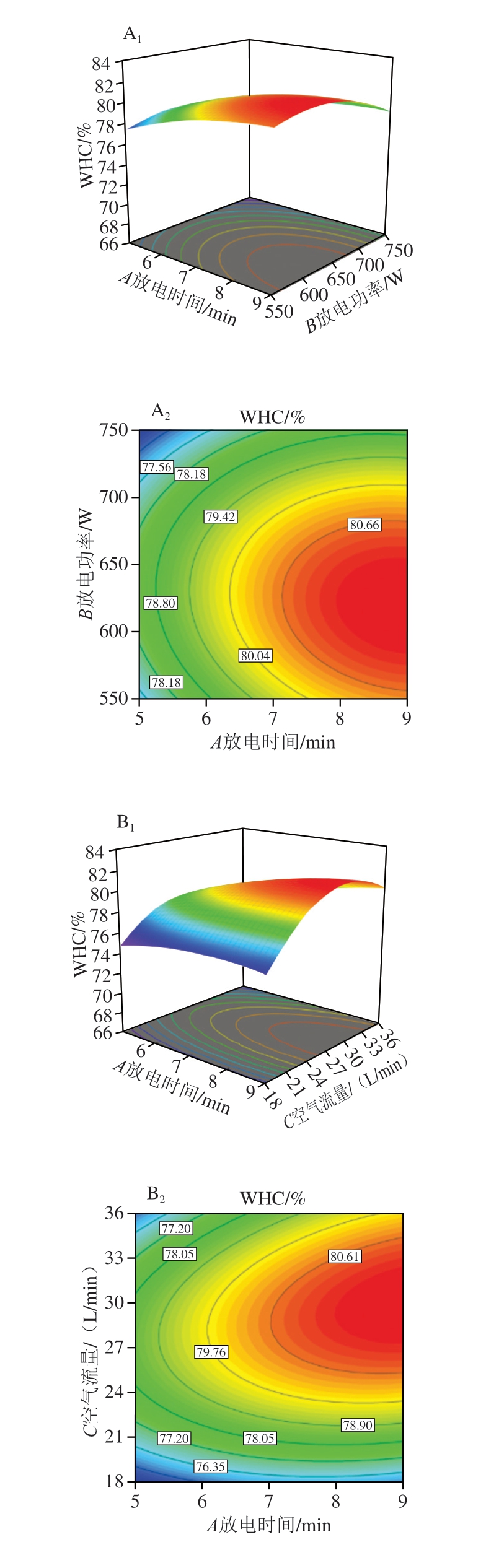
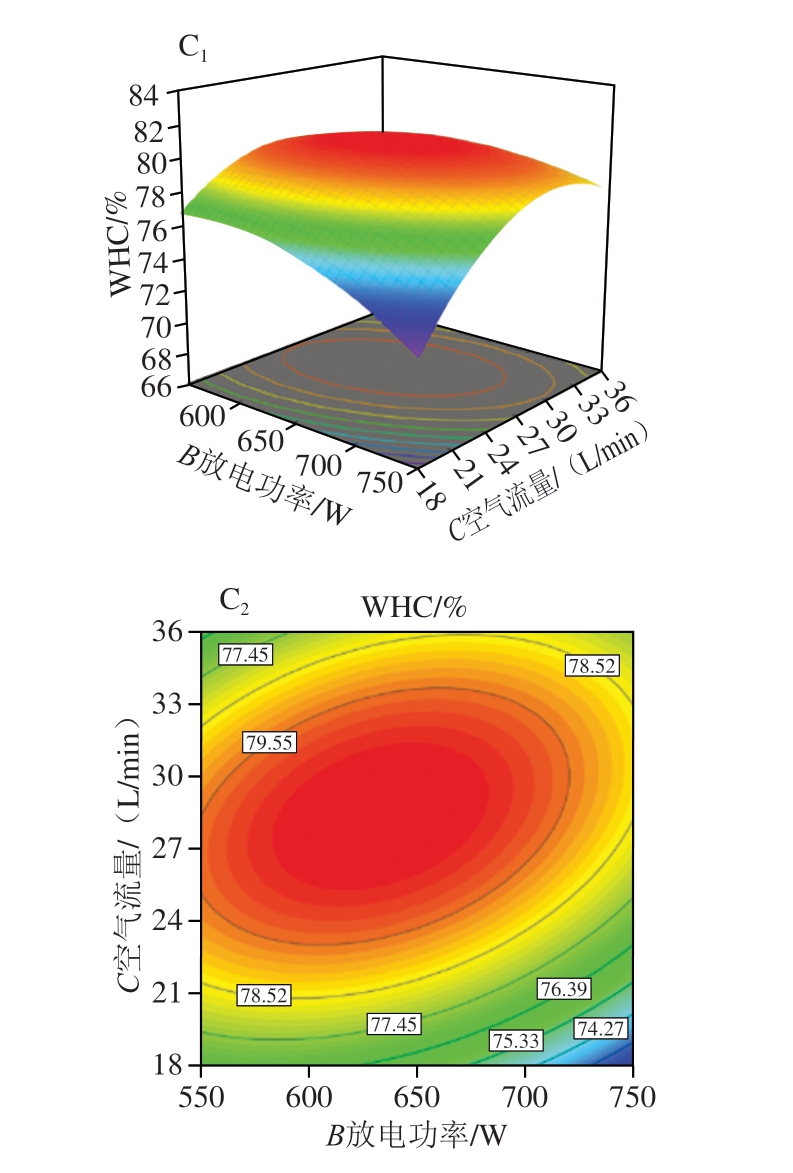
图5 放电时间、放电功率和空气流量的交互作用对白鲢鱼糜WHC影响的响应面图和等高线图
Fig. 5 Response surface and contour plots showing the interactive effects of discharge time, discharge power and airflow rate interaction on the WHC of silver carp surimi gels
2.2.4 响应面优化试验结果验证
基于Design-Expert 13.0软件分析,以凝胶强度和WHC为响应值,获得最佳漂洗工艺参数:放电时间6.99 min、放电功率636.36 W、空气流量28.74 L/min,预测凝胶强度209.01 g・cm、WHC为80.52%。考虑到实际操作可行性,以放电时间7 min、放电功率640 W、空气流量27 L/min为条件进行验证实验,测得实际凝胶强度为207.52 g・cm、WHC为80.20%,与预测值接近。因此,后续将在此漂洗工艺条件下探究不同漂洗方式对鱼糜凝胶品质的影响。
2.3 不同漂洗方式下鱼糜凝胶品质比较分析
2.3.1 凝胶特性
由表5可知,经PAW漂洗的白鲢鱼糜凝胶强度、WHC均显著大于清水漂洗(P<0.05),这可能与PAW能够促进肌原纤维蛋白构象展开,进而促进更致密的凝胶网络结构形成有关[6]。杨菁等[30]研究表明,低温常压等离子体(cold atmospheric plasma,CAP)处理可诱导蛋白质分子间发生交联,形成更致密的蛋白网络结构,同时促进水分子与蛋白质分子间的相互作用,增强鱿鱼糜凝胶强度和WHC。值得注意的是,PAW+盐水组和PAW+盐水+盐水组凝胶强度、WHC均无显著差异(P>0.05),表明漂洗2 次与漂洗3 次对鱼糜凝胶强度与WHC改善作用相当。
表5 不同漂洗方式下鱼糜凝胶特性
Table 5 Gel properties of surimi under different rinsing methods
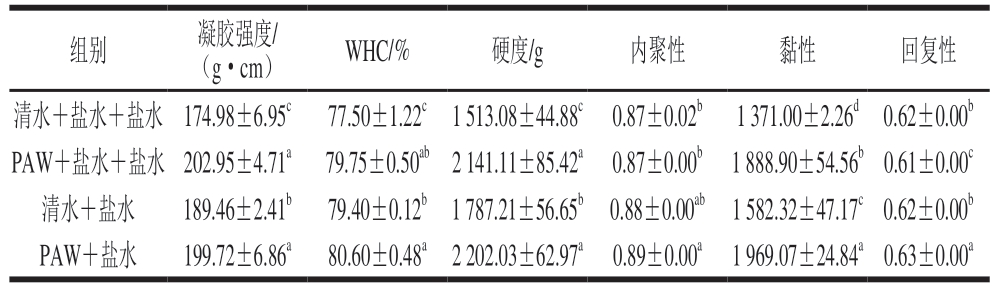
注:同列小写字母不同表示差异显著(P<0.05)。
组别凝胶强度/(g・cm)WHC/%硬度/g内聚性黏性回复性清水+盐水+盐水174.98±6.95c77.50±1.22c1 513.08±44.88c0.87±0.02b1 371.00±2.26d0.62±0.00b PAW+盐水+盐水202.95±4.71a79.75±0.50ab2 141.11±85.42a0.87±0.00b1 888.90±54.56b0.61±0.00c清水+盐水189.46±2.41b79.40±0.12b1 787.21±56.65b0.88±0.00ab1 582.32±47.17c0.62±0.00b PAW+盐水199.72±6.86a80.60±0.48a2 202.03±62.97a0.89±0.00a1 969.07±24.84a0.63±0.00a
与清水漂洗相比,PAW漂洗能显著提高鱼糜凝胶的硬度和黏性(P<0.05),对内聚性和回复性影响相对较小。这可能是由于PAW中的活性物质能通过氧化作用增强蛋白质共价交联,有利于形成更致密的凝胶结构,进而改善凝胶质构特性[31]。此外,PAW+盐水组内聚性、黏性和回复性均显著高于PAW+盐水+盐水组(P<0.05),而两组硬度无显著差异(P>0.05)。由此可见,PAW+盐水漂洗能够在减少一次漂洗工序的基础上,有效提升鱼糜凝胶强度、WHC及质构特性。
2.3.2 SDS-PAGE分析
肌球蛋白重链(myosin heavy chain,MHC)和肌动蛋白是鱼糜凝胶蛋白的主要组成成分,其中MHC含量与凝胶形成能力相关[32]。由图6可知,4 组鱼糜凝胶的MHC条带亮度存在较大差异,而肌动蛋白条带无明显差异。与清水漂洗组相比,PAW漂洗组MHC条带亮度明显减弱,可能是因为PAW诱导肌原纤维蛋白发生分子间聚集和交联[33]。研究[30]表明,CAP处理通过促进蛋白质分子间碳-碳共价键相互作用诱导鱿鱼肌原纤维蛋白发生氧化聚集。因此,PAW漂洗能通过诱导肌球蛋白变性改善鱼糜凝胶品质。
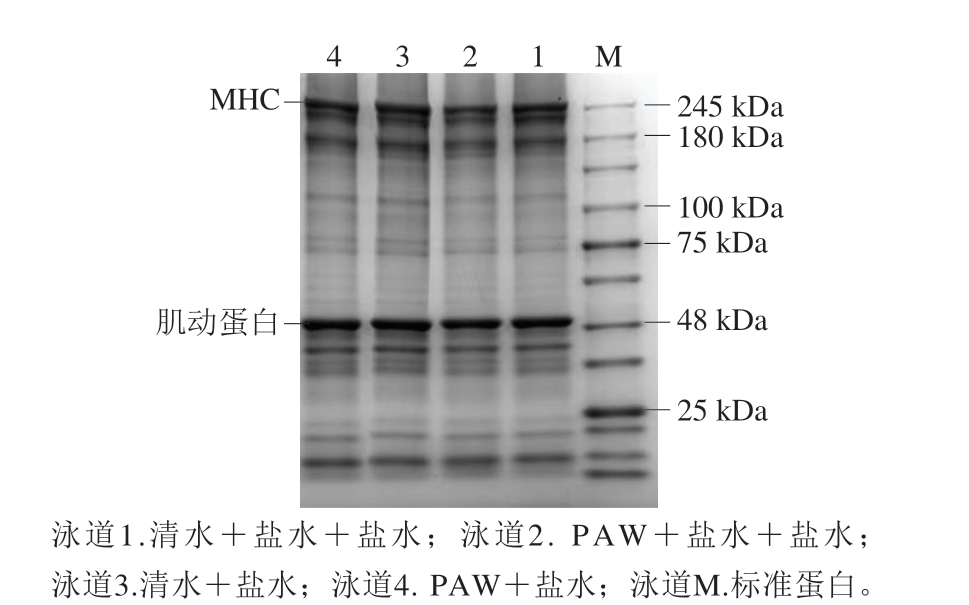
图6 鱼糜凝胶SDS-PAGE图
Fig. 6 Sodium dodecyl sulfate-polyacrylamide gelelectrophoresis pattern of surimi gels
2.3.3 化学作用力
由图7可知,与清水漂洗组相比,PAW漂洗组离子键含量显著下降(P<0.05),Cao Hongwei等[34]研究表明,蛋白凝胶中离子键作用越弱时,越有助于增强凝胶形成能力。因此,PAW可能通过削弱离子键作用提高鱼糜凝胶强度。经PAW漂洗后,氢键含量和疏水相互作用含量相较清水漂洗组均显著提高(P<0.05),且疏水相互作用含量升高可能是鱼糜凝胶强度提高的主要因素之一。Li Zhiyu等[35]研究表明,肌原纤维蛋白凝胶化过程中,氢键含量与凝胶WHC呈正相关,这与本研究结果相一致。值得注意的是,PAW+盐水组与PAW+盐水+盐水组离子键含量和疏水相互作用含量均无显著差异(P>0.05)。因此,PAW漂洗可通过减少离子键含量、增加氢键含量和疏水相互作用含量稳定蛋白结构,进而改善凝胶品质。
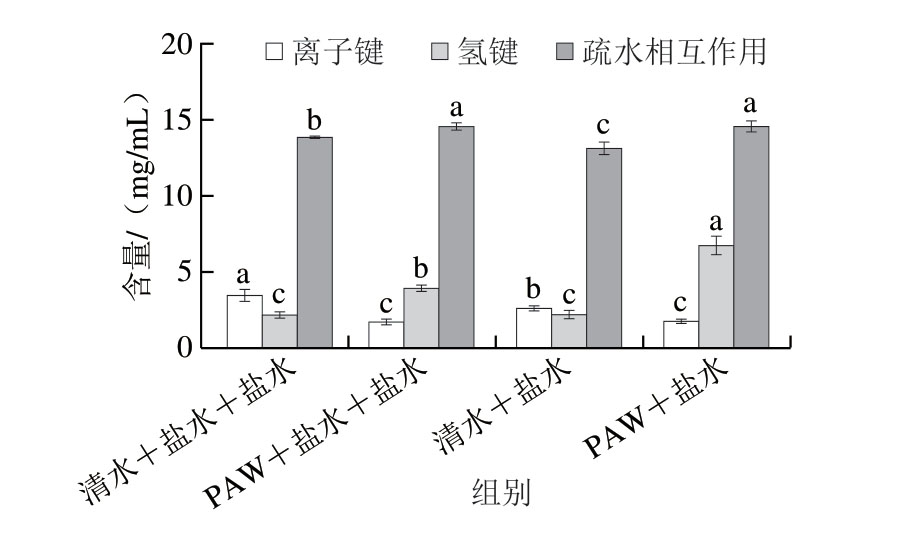
图7 鱼糜凝胶化学键含量
Fig. 7 Contents of chemical bonds in surimi gels
2.3.4 微观结构
由图8可知,PAW漂洗组鱼糜凝胶网络结构与清水漂洗组存在明显区别。清水漂洗组凝胶表面纹理结构相对松散粗糙,排列不整齐,蛋白质交联状态杂乱无序,呈现为无序堆积的聚集体。而PAW漂洗组凝胶表面相对光滑连续,结构均匀平整且趋于致密,微观形貌的改善与凝胶强度和WHC的提升结果一致。值得注意的是,与PAW+盐水+盐水组相比,PAW+盐水组凝胶网络中孔隙直径明显变小且更加均一、紧密有序。由此可见,PAW漂洗可通过诱导肌原纤维蛋白氧化交联等形成更加致密有序的凝胶网络结构。
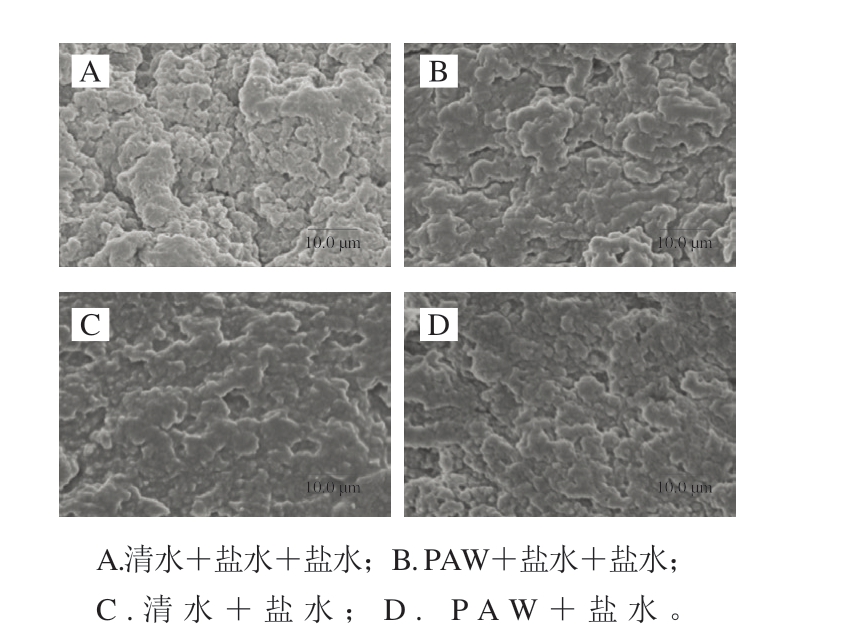
图8 鱼糜凝胶扫描电子显微镜图(×3 000)
Fig. 8 Micrographs of surimi gels (×3 000)
3 结论
本研究发现PAW漂洗工艺不仅能够改善白鲢鱼糜的凝胶品质,还可节约鱼糜漂洗用水。单因素试验表明,放电时间、放电功率和空气流量均会显著影响白鲢鱼糜凝胶强度和WHC(P<0.05),通过响应面优化试验得到最佳PAW制备工艺参数为:放电时间7 min、放电功率640 W、空气流量27 L/min。在此基础上进行组合漂洗,无论是漂洗2 次还是漂洗3 次,与清水漂洗相比,PAW漂洗均能显著提高鱼糜凝胶强度、WHC、硬度、黏性、氢键含量和疏水相互作用含量(P<0.05);MHC条带亮度明显减弱、离子键含量显著减少(P<0.05),凝胶网络结构更加致密、均匀;PAW+盐水组与PAW+盐水+盐水组凝胶强度、WHC、硬度、离子键含量和疏水相互作用含量差异不显著(P>0.05),因此,最终选择减少1 次漂洗,与传统的3 次漂洗相比,能实现33%的节水效益。
[1] 姜鹏飞, 于文静, 朱凯悦, 等. 漂洗对罗非鱼鱼糜凝胶特性的影响[J]. 食品研究与开发, 2022, 43(2): 10-18. DOI:10.12161/j.issn.1005-6521.2022.02.002.
[2] 徐祖东, 陈康, 涂丹, 等. 藜麦对鲷鱼鱼糜凝胶性能及挥发性风味的影响[J]. 中国食品学报, 2020, 20(2): 212-220. DOI:10.16429/j.1009-7848.2020.02.026.
[3] 刘芳芳, 林婉玲, 李来好, 等. 海鲈鱼糜加工及凝胶形成过程中蛋白质的变化机理[J]. 食品科学, 2020, 41(14): 15-22. DOI:10.7506/spkx1002-6630-20190620-232.
[4] LIU C K, LI W X, LIN B Y, et al. Effects of ozone water rinsing on protein oxidation, color, and aroma characteristics of grass carp(Ctenopharyngodon idellus) surimi[J]. Journal of Food Processing and Preservation, 2021, 45(10): 15811. DOI:10.1111/jfpp.15811.
[5] ZHAO Y M, OJHA S, BURGESS C M, et al. Influence of various fish constituents on inactivation efficacy of plasma-activated water[J].International Journal of Food Science and Technology, 2020, 55(6):2630-2640. DOI:10.1111/ijfs.14516.
[6] QIAN J, W Y Y, ZHUANG H, et al. Plasma activated water induced formation of compact chicken myofibrillar protein gel structures with intrinsically antibacterial activity[J]. Food Chemistry, 2021, 351:129278. DOI:10.1016/j.foodchem.2021.129278.
[7] 应可沁, 李子言, 程序, 等. 等离子体活化水作为解冻介质对牛肉杀菌效能及品质的影响[J]. 食品工业科技, 2022, 43(2): 338-345.DOI:10.13386/j.issn1002-0306.2021060219.
[8] LIM J Y, BYEON Y S, HONG E J, et al. Effect of post-discharge time of plasma-treated water (PTW) on microbial inactivation and quality of fresh-cut potatoes[J]. Journal of Food Processing and Preservation,2021, 45(5): 15387. DOI:10.1111/jfpp.15387.
[9] MA R N, YU S, TIAN Y, et al. Effect of non-thermal plasmaactivated water on fruit decay and quality in postharvest Chinese bayberries[J]. Food and Bioprocess Technology, 2016, 9(11): 1825-1834. DOI:10.1007/s11947-016-1761-7.
[10] VAKA M R, SONE I, ALVAREZ R G, et al. Towards the nextgeneration disinfectant: composition, storability and preservation potential of plasma-activated water on baby spinach leaves[J]. Foods,2019, 8(12): 692. DOI:10.3390/foods8120692.
[11] LI M Z, WANG X, SHI T. et al. Mechanism of plasma-activated water promoting the heat-induced aggregation of myofibrillar protein from silver carp (Aristichthys nobilis)[J]. Innovative Food Science and Emerging Technologies, 2024, 91: 103555. DOI:10.1016/j.ifset.2023.103555.
[12] 江苏大学. 一种基于等离子体活化水制备高强度肌原纤维蛋白凝胶的方法: 202211083648.0[P]. 2022-12-02.
[13] LI Q, YE T, ZHU Y Q, et al. Sustainable development of fishery resources: precipitation of protein from surimi rinsing wastewater by low-temperature plasma[J]. Food Chemistry, 2024, 463(Part 2):141286. DOI:10.1016/j.foodchem.2024.141286.
[14] 鲁玉凤. 基于磁场和超声辅助加热对鱼糜凝胶特性及其肌原纤维蛋白热聚集行为的研究[D]. 合肥: 合肥工业大学, 2023.DOI:10.27101/d.cnki.ghfgu.2023.001858.
[15] LIANG F, ZHU Y J, YE T, et al. Effect of ultrasound assisted treatment and microwave combined with water bath heating on gel properties of surimi-crabmeat mixed gels[J]. LWT-Food Science and Technology,2020, 133: 110098. DOI:10.1016/j.lwt.2020.110098.
[16] WANG X J, WANG X W, FENG T T, et al. Saltiness perception enhancement of fish meat treated by microwave: the significance of conformational characteristics, water and sodium mobility[J]. Food Chemistry, 2021, 347: 129033. DOI:10.1016/j.foodchem.2021.129033.
[17] 戴慧敏. 超高压、卡拉胶对低钠盐白鲢鱼糜凝胶特性的影响[D].合肥: 合肥工业大学, 2018. DOI:10.7666/d.Y3397521.
[18] 张小燕, 张娜, 宋志强, 等. 猪肉盐溶蛋白质超高压诱导凝胶品质研究[J]. 食品与发酵科技, 2012, 48(6): 32-36. DOI:10.3969/j.issn.1674-506X.2012.06-008.
[19] GAO X, YOU J, YIN T, et al. Simultaneous effect of high intensity ultrasound power, time, and salt contents on gelling properties of silver carp surimi[J]. Food Chemistry, 2023, 403: 134478. DOI:10.1016/j.foodchem.2022.134478.
[20] 李梦哲. 等离子体活化水对鲢肌原纤维蛋白热聚集行为的影响及机制研究[D]. 镇江: 江苏大学, 2023. DOI:10.27170/d.cnki.gjsuu.2023.001387.
[21] 林晗, 董诗琴, 张贞炜, 等. 亲水胶体对大豆、花生双蛋白凝胶持水性的影响及机制探究[J]. 食品科技, 2021, 46(10): 142-148.DOI:10.13684/j.cnki.spkj.2021.10.023.
[22] NYAISABA B M, MIAO W H, HATAB S, et al. Effects of cold atmospheric plasma on squid proteases and gel properties of protein concentrate from squid (Argentinus ilex) mantle[J]. Food Chemistry,2019, 291: 68-76. DOI:10.1016/j.foodchem.2019.04.012.
[23] 李平, 陶华杨, 彭超, 等. DBD等离子体与活化水对马铃薯生长特性及产量的影响[J]. 高电压技术, 2024, 50(4): 1742-1751.DOI:10.13336/j.1003-6520.hve.20230969.
[24] 刘舒彦, 李海蓝, 李湃, 等. 等离子体活化水对希瓦氏菌及鲈鱼品质的影响[J]. 肉类研究, 2020, 34(9): 25-30. DOI:10.7506/rlyj1001-8123-20200805-186.
[25] JI H, DONG S, HAN F, et al. Effects of dielectric barrier discharge(DBD) cold plasma treatment on physicochemical and functional properties of peanut protein[J]. Food and Bioprocess Technology,2018, 11(2): 344-354. DOI:10.1016/j.foodchem.2019.04.012.
[26] JI H, HAN F, PENG S L, et al. Behavioral solubilization of peanut protein isolate by atmospheric pressure cold plasma (ACP)treatment[J]. Food and Bioprocess Technology: An International Journal, 2019, 12(4): 2018-2027. DOI:10.1007/s11947-019-02357-0.
[27] XIONG Y L, BLANCHARD S P, OOIZUMI T, et al. Hydroxyl radical and ferryl-generating systems promote gel network formation of myofibrillar protein[J]. Journal of Food Science, 2010, 75(2): 215-221.DOI:10.1111/j.1750-3841.2009.01511.x.
[28] 李学鹏, 刘慈坤, 周明言, 等. 羟自由基氧化对草鱼肌原纤维蛋白结构和凝胶性质的影响[J]. 食品科学, 2017, 38(21): 30-37.DOI:10.7506/spkx1002-6630-201721005.
[29] ZHOU F B, ZHAO M M, SU G W, et al. Gelation of salted myofibrillar protein under malondialdehyde-induced oxidative stress[J]. Food Hydrocolloids, 2014, 40: 153-162. DOI:10.1016/j.foodhyd.2014.03.001.
[30] 杨菁, 陈仪, 徐艺, 等. 低温等离子体对秘鲁鱿鱼糜凝胶特性的影响[J]. 核农学报, 2024, 38(9): 1743-1750. DOI:10.11869/j.issn.1000-8551.2024.09.1743.
[31] 李文协, 李学鹏, 刘慈坤, 等. 臭氧水漂洗对鲅鱼鱼糜品质及肌原纤维蛋白氧化的影响[J]. 食品工业科技, 2020, 41(16): 7-15.DOI:10.13386/j.issn1002-0306.2020.16.002.
[32] THIRUMDAS R, KOTHAKOTA A, ANNAPURE U, et al. Plasma activated water (PAW): chemistry, physico-chemical properties,applications in food and agriculture[J]. Trends in Food Science &Technology, 2018, 77: 21-31. DOI:10.1016/j.tifs.2018.05.007.
[33] ZHANG B, FANG C D, HAO G J, et al. Effect of κ-carrageenan oligosaccharides on myofibrillar protein oxidation in peeled shrimp (Litopenaeus vannamei) during long-term frozen storage[J]. Food Chemistry, 2018, 245: 254-261. DOI:10.1016/j.foodchem.2017.10.112.
[34] CAO H W, FAN D M, JIAO X D, et al. Effects of microwave combined with conduction heating on surimi quality and morphology[J].Journal of Food Engineering, 2018, 228: 1-11. DOI:10.1016/j.jfoodeng.2018.01.021.
[35] LI Z Y, WANG J Y, ZHENG B D, et al. Effects of high pressure processing on gelation properties and molecular forces of myosin containing deacetylated konjac glucomannan[J]. Food Chemistry,2019, 291: 117-125. DOI:10.1016/j.foodchem.2019.03.146.