内蒙古自治区作为我国重要的畜牧业基地,其羊肉产量常年位居全国第1,据统计,2023年内蒙古自治区的羊肉产量达108.8万 t,占全国羊肉总产量的1/5,这一庞大的生产规模直接伴随产生大量的屠宰副产物,其中羊骨是主要副产物之一,占羊胴体质量的8%~17%[1]。长期以来,对于羊骨的利用主要局限于将其作为饲料、肥料或直接废弃,造成严重的资源浪费和环境污染[2-4]。事实上,羊骨中含有丰富的蛋白质、脂肪、矿物质等营养组分,是一种宝贵的生物资源。近年来,从羊骨中提取生物活性物质的研究引起广泛关注,特别是羊骨蛋白作为一种优质蛋白质来源,经过酶解等手段可以得到具有多种生物活性的小分子肽。随着现代食品工业的不断发展,羊骨资源可以转化为具有高附加值的功能性产品,如生物活性肽、骨钙粉、矿物质补充剂等,从而实现资源的高效利用。例如,张靖[5]从羊骨中提取出的多肽表现出抗氧化活性;胡冠华[3]通过双酶分步酶解制备的羊骨钙结合肽则在促进钙吸收、预防骨质疏松方面表现出一定的潜力。此外,国外也有研究证实了羊骨蛋白在食品工业中的应用前景,如da Silva等[6]发现,山羊骨的酶解产物具有类似熟肉的芳香特征,显示出开发为天然调味剂的潜力。
生物活性肽可以定义为由蛋白质衍生而来的生物分子,由2~20 个氨基酸组成[7]。生物活性肽在亲本蛋白质中是惰性的,当通过一定手段将其从亲本蛋白质中分离出来后,会产生许多具有生物活性的多肽,如血管紧张素转换酶(angiotensin-converting enzyme,ACE)抑制肽、抗菌肽、抗氧化肽、二肽基肽酶-IV(dipeptidyl peptidase-IV,DPP-IV)抑制肽等[8]。其中,DPP-IV抑制肽可以通过抑制DPP-IV的活性延长胰高血糖素样肽-1和葡萄糖依赖性促胰岛素释放多肽的作用时间,达到调节血糖的目的,在糖尿病防治中具有重要意义[9]。与传统化学合成的DPP-IV抑制剂相比,生物来源的DPP-IV抑制肽具有天然、安全、无毒等优势。动物副产物如骨、皮、血液等含有丰富的蛋白质,被视为高价值的生物资源,许多研究表明,动物副产物中的蛋白质在经过酶解处理后能够释放出具有DPP-IV抑制活性的多肽[10]。例如,Wang Beibei等[11]从羊皮中制备并鉴定出的2 条多肽(GPAGPIGPV和GPAGPOGFPG)表现出较高的DPP-IV抑制活性,可能成为糖尿病膳食中的潜在功能性成分;Jin Ritian等[12]从鲑鱼皮胶原蛋白水解物中筛选出1 条新型多肽LDKVFR,该肽在体外实验中表现出良好的DPP-IV抑制效果。然而,目前针对羊骨副产物制备DPP-IV抑制肽的研究较少,如何高效利用这一优质蛋白来源开发高附加值产品是亟待解决的问题。
目前制备生物活性肽常用的方法为酶解法,酶解是一种在温和控制条件下进行的过程,具有显著的区域选择性和良好的立体选择性,可有效分解蛋白质生成小分子多肽[13],但传统的酶解法存在反应时间长、酶解效率低等问题。如果将酶解法与预处理技术相结合,可以在一定程度上克服这些不足。超声被认为是一种安全、绿色、有效的预处理技术,使用超声辅助酶解法可以结合超声的高效物理作用和酶的生物催化特性,超声波产生的高温、高压和剪切力等作用可以改变蛋白质的结构,提高酶与底物之间的亲和力,此外,超声处理还可以促使蛋白的功能基团暴露,增强多肽的活性,在制备生物活性肽方面显示出巨大潜力[14]。已有研究表明,超声辅助酶解可以有效提高动物源蛋白如牡蛎蛋白[15]、牛皮蛋白[16]、猪脑蛋白[17]等的酶解程度,并提高其所得肽的抗氧化、抗肿瘤活性。
为实现羊骨副产物的高值化利用,本研究以羊骨为研究对象,采用超声辅助酶解法制备羊骨中具有DPP-IV抑制活性的产物,并通过紫外光谱、荧光光谱、傅里叶变换红外光谱和扫描电子显微镜对其进行结构表征,对比分析超声预处理与未预处理条件下酶解产物在化学结构和微观形貌方面的差异,旨在揭示超声对产物构象变化的影响,为羊骨资源的功能化开发与利用提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜羊肩胛骨由内蒙古草原鑫河食品有限公司提供,采集后运输至实验室于-20 ℃保存。
碱性蛋白酶(200 000 U/g)、中性蛋白酶(60 000 U/g)、胰蛋白酶(250 000 U/g)、木瓜蛋白酶(1 200 000 U/g)、风味蛋白酶(30 000 U/g)北京索莱宝生物科技有限公司;DPP-IV 艾美捷科技有限公司;甘氨酰-脯氨酸对硝基苯胺(glycine-proline p-nitroanilide hydrochloride,GPP) 上海源叶生物科技有限公司;甲醛、无水乙醇 国药集团化学试剂有限公司;以上试剂均为分析纯。
1.2 仪器与设备
LCJ-25C冷冻干燥机 北京四环科学仪器厂有限公司;SYNERGY H1全自动酶标仪 雷康恒泰(北京)商贸有限公司;RF-5301荧光分光光度计 日本岛津有限公司;Nicolet iS20傅里叶变换红外光谱仪 美国Thermo Fisher公司;SB25-12DTD数控超声波清洗器 宁波新芝生物科技股份有限公司;TV-1810紫外-可见分光光度计郑州南北仪器设备有限公司;Phenom ProX G6扫描电子显微镜 复纳科学仪器(上海)有限公司;LA8080超高速全自动氨基酸分析仪 日本日立公司。
1.3 方法
1.3.1 羊骨预处理
将新鲜羊肩胛骨表面残留的肉和脂肪剔除,置于反压高温蒸煮锅中,在0.1 MPa压力下蒸煮40 min后冲洗干净,于75 ℃烘箱中烘干后,使用粉碎机将其粉碎(1 000 W、27 000 r/min),过80 目筛,得到羊骨粉。
1.3.2 羊骨粉基本营养成分测定
蛋白质含量测定按照GB 5009.5—2016《食品中蛋白质的测定》中的凯氏定氮法进行;脂肪含量测定按照GB 5009.6—2016《食品中脂肪的测定》中的索氏抽提法进行;水分含量测定按照GB 5009.3—2016《食品中水分的测定》中的105 ℃高温烘干法进行;灰分含量测定按照GB 5009.4—2016《食品中灰分的测定》中的马弗炉灼烧法进行。
1.3.3 羊骨粉中氨基酸测定
采用酸水解法测定羊骨中的氨基酸含量。准确称取0.5 g样品于消解管中,加入10 mL 6 mol/L盐酸溶液混匀,混匀后置于105 ℃烘箱中水解21 h,在水解进行至10 h时,取出放气后再次拧紧,放入烘箱中直至水解完成。取出消解管冷却至室温,将水解液转移到50 mL容量瓶中,用0.02 mol/L盐酸溶液定容。吸取1 mL定容后样品溶液置于10 mL离心管中,在50 ℃下氮吹蒸发至干,在干燥的样品中加入1 mL 0.02 mol/L盐酸溶液,振荡2 min使其充分溶解,通过0.22 μm滤膜后转移至仪器进样瓶,使用全自动氨基酸分析仪进行测定。
1.3.4 脱脂羊骨粉制备
将羊骨粉与无水乙醇以质量比1∶10混匀,置于磁力搅拌器上搅拌24 h,以除去骨粉中的脂肪。搅拌过程中,每12 h更换1 次无水乙醇:先将混合液通过离心(8 000 r/min、15 min)分离,弃上清液,向沉淀中加入等质量的无水乙醇继续搅拌,直至脱脂完成。搅拌结束后用蒸馏水反复清洗,8 000 r/min离心15 min,弃上清液,置于80 ℃烘箱烘干,得到脱脂羊骨粉。
1.3.5 蛋白酶的筛选
使用蒸馏水将脱脂羊骨粉配制成质量分数8%的溶液,选用碱性蛋白酶(pH 9.0)、木瓜蛋白酶(pH 7.0)、胰蛋白酶(pH 8.0)、风味蛋白酶(pH 7.0)、中性蛋白酶(pH 7.5),酶添加量均为8 000 U/g,在50 ℃条件下酶解4 h。酶解过程中,使用1.0 mol/L NaOH和HCl溶液调节相应蛋白酶的pH值。酶解结束后,加热至100 ℃维持15 min使蛋白酶失活,冷却至室温,8 000 r/min离心15 min,取上清液,冷冻干燥并保存于-20 ℃冰箱,以备后续使用。根据DPP-IV抑制率和水解度筛选出效果最好的蛋白酶。
1.3.6 酶解条件的确定
使用筛选出的最佳蛋白酶对脱脂羊骨粉进行酶解,以DPP-IV抑制率和水解度为指标进行单因素试验设计,评价蛋白酶添加量(4 000、6 000、8 000、10 000、12 000 U/g)、酶解pH值(5.0、5.5、6.0、6.5、7.0)、酶解时间(2、3、4、5、6 h)、酶解温度(40、45、50、55、60 ℃)对脱脂羊骨粉酶解效果的影响。改变蛋白酶添加量时,酶解pH值为6.0,酶解温度为50 ℃,酶解时间为4 h;改变酶解pH值时,蛋白酶添加量为8 000 U/g,酶解温度为50 ℃,酶解时间为4 h;改变酶解温度时,蛋白酶添加量为8 000 U/g,酶解pH值为6.0,酶解时间为4 h;改变酶解时间时,蛋白酶添加量为8 000 U/g,酶解pH值为6.0,酶解温度为55 ℃。
1.3.7 酶解前的超声预处理条件确定
使用蒸馏水将脱脂羊骨粉配制成质量分数8%的溶液,用超声波进行预处理。评价超声功率(280、360、440、520、600 W)和超声时间(10、20、30、40、50、60 min)对脱脂羊骨粉制备DPP-IV抑制活性产物的影响,改变超声时间时,超声功率为440 W;改变超声功率时,超声时间为30 min。在上述处理之后,向其中加入蛋白酶进行酶解以制备羊骨酶解物。以DPP-IV抑制率和水解度为指标,确定最佳超声预处理条件。
1.3.8 DPP-IV抑制率测定
参考王贝贝[18]的方法并稍作修改,用pH 8.0的100 mol/L Tris-HCl缓冲液将DPP-IV和GPP分别配制成0.025 U/mL和2 mmol/L的溶液。移取25 μL GPP溶液和25 μL酶解物溶液(20 mg/mL)于96 孔酶标板中,充分混匀,在37 ℃下孵育10 min,然后加入50 μL DPP-IV溶液开始反应,37 ℃条件下充分反应60 min,测定其于405 nm波长下的吸光度。每个样品进行3 次平行测定,DPP-IV抑制率按式(1)计算:
式中:A样品为加入DPP-IV、酶解物样品和GPP的吸光度;A样品对照为以Tris-HCl缓冲液代替DPP-IV的吸光度;A酶为加入Tris-HCl缓冲液、DPP-IV和GPP的吸光度;A酶空白为以Tris-HCl缓冲液代替DPP-IV的吸光度。
1.3.9 水解度测定
参考胡冠华[3]的方法,将5 mL酶解液和25 mL蒸馏水加入烧杯中,用0.1 mol/L NaOH标准溶液滴定至pH 8.2。之后加入10 mL甲醛,搅拌均匀后,继续用0.1 mol/L NaOH标准溶液滴定至pH 9.2。水解度按式(2)计算:
式中:V1为滴定过程所消耗的NaOH溶液体积/mL;V为酶水解液总体积/mL;V0为以去离子水进行空白实验所消耗的NaOH溶液体积/mL;c为NaOH标准溶液浓度/(mol/L);m为样品的总氮质量/g。
1.3.10 响应面试验设计
在单因素试验基础上,选取超声功率(A)、酶解温度(B)、酶解pH值(C)为因素,以DPP-IV抑制率为响应值,依据Box-Behnken试验设计原理,使用Design Expert软件对羊骨DPP-IV抑制活性产物制备工艺参数进行优化。每个因素均采用3 个水平(-1、0、1),因素及水平如表1所示。
表1 响应面试验设计因素及水平
Table 1 Code and level of independent variables used for response surface design

水平A超声功率/WB酶解温度/℃C酶解pH-1280505.5 0 360556.0 1 440606.5
1.3.11 羊骨DPP-IV抑制活性产物的结构表征
将酶解制备羊骨DPP-IV抑制活性产物命名为E-SBPH,将超声辅助酶解制备羊骨DPP-IV抑制活性产物命名为UE-SBPH,通过荧光光谱、紫外-可见吸收光谱、傅里叶变换红外光谱和扫描电子显微镜表征其结构。
1.3.11.1 荧光光谱测定
参照Hu Guanhua等[19]的方法并略作修改,在室温下使用荧光分光光度计记录荧光光谱。将冻干后的样品用去离子水配制成1 mg/mL的溶液,进行荧光光谱扫描。扫描条件:激发波长280 nm,发射波长300~500 nm,狭缝宽度5 nm。
1.3.11.2 紫外-可见吸收光谱测定
配制1 mg/mL的羊骨酶解物溶液,将样品放置在10 mm的石英比色皿中进行测定,通过紫外-可见分光光度仪测定羊骨酶解物在190~400 nm波长范围的紫外-可见吸收光谱。
1.3.11.3 傅里叶变换红外光谱测定
将2 mg羊骨酶解物样品与200 mg干燥的KBr在玛瑙研钵内混合研磨,压成薄片,放入傅里叶变换红外光谱仪,测定其在4 000~400 cm-1波数范围的红外光谱。
1.3.11.4 扫描电子显微镜观察
参照Yang Lihua等[20]的方法,使用扫描电子显微镜观察木瓜蛋白酶酶解和超声辅助木瓜蛋白酶酶解获得的样品微观结构。将样品粉末用双面胶带粘在金属载体台上,用真空喷金装置对样品进行表面处理,用扫描电子显微镜观察其微观结构。
1.4 数据处理
使用SPSS Statistics 26、Design Expert 10软件对实验数据进行统计分析;使用GraphPad Prism 9.5、Origin 2022软件绘图。所有实验均重复3 次,实验数据以平均值±标准差表示。数据之间的差异显著性通过单因素方差分析检验,显著性水平设定为P<0.05。
2 结果与分析
2.1 羊骨粉基本营养成分及氨基酸组成分析
如表2所示,羊骨粉的蛋白质量分数为(25.33±0.29)%、灰分质量分数为(41.99±0.33)%、脂肪质量分数为(13.70±0.45)%、水分质量分数为(16.61±0.27)%。其他动物骨蛋白如牛骨蛋白质量分数为16.67%~24.85%[21],相比之下,羊骨粉中蛋白质含量相对较高,显示出羊骨在蛋白质资源利用方面具备的潜在优势,是开发生物活性肽的优质蛋白来源,为制备DPP-IV抑制活性产物提供了理论依据。
表2 羊骨粉基本营养组成
Table 2 Nutritional composition of ovine bones
基础成分水分脂肪灰分蛋白质质量分数/%16.61±0.2713.70±0.4541.99±0.3325.33±0.29
如表3所示,羊骨中共检出17 种氨基酸,总氨基酸质量分数为(16.48±0.52)%,其中含有8 种必需氨基酸,分别为异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、苏氨酸、缬氨酸和组氨酸,占总氨基酸的28.34%。羊骨中脯氨酸质量分数为(1.65±0.05)%,丙氨酸质量分数为(1.45±0.02)%,占总氨基酸的18.81%。有研究[22]表明,富含脯氨酸或丙氨酸的生物活性肽通常在DPP-IV抑制方面具有更高的潜力,说明羊骨可以作为一种制备DPP-IV抑制肽的优质来源。
表3 羊骨粉氨基酸组成
Table 3 Amino acid composition of ovine bones
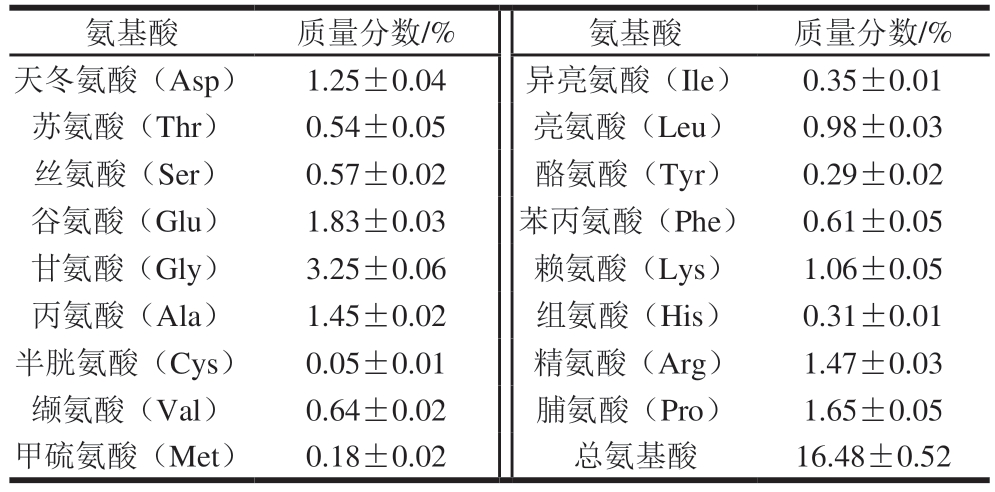
氨基酸质量分数/%氨基酸质量分数/%天冬氨酸(Asp)1.25±0.04异亮氨酸(Ile)0.35±0.01苏氨酸(Thr)0.54±0.05亮氨酸(Leu)0.98±0.03丝氨酸(Ser)0.57±0.02酪氨酸(Tyr)0.29±0.02谷氨酸(Glu)1.83±0.03苯丙氨酸(Phe)0.61±0.05甘氨酸(Gly)3.25±0.06赖氨酸(Lys)1.06±0.05丙氨酸(Ala)1.45±0.02组氨酸(His)0.31±0.01半胱氨酸(Cys)0.05±0.01精氨酸(Arg)1.47±0.03缬氨酸(Val)0.64±0.02脯氨酸(Pro)1.65±0.05甲硫氨酸(Met)0.18±0.02总氨基酸16.48±0.52
2.2 蛋白酶的筛选结果
蛋白酶种类与所制备多肽的活性密切相关,如图1所示,木瓜蛋白酶水解产物的DPP-IV抑制率最高,达(50.82±1.57)%,显著高于其他蛋白酶酶解产物(P<0.05),但其水解度最低,说明酶解产物的水解度与DPP-IV抑制活性之间并无直接关系,Xu Feiran等[23]的研究也得出类似的结论。木瓜蛋白酶所体现的优势可能与其特定的酶切位点有关,木瓜蛋白酶对疏水性氨基酸和芳香族氨基酸附近的肽键具有较强的切割能力,能优先产生N末端含脯氨酸、丙氨酸残基的肽段[24],这些含肽段的组分更符合DPP-IV抑制产物活性的结构特点,易与DPP-IV的活性位点结合,从而发挥其抑制作用[25]。其他蛋白酶的水解产物虽然具有较高的水解度,但可能包含大量无活性的分子或游离氨基酸,降低了其整体的DPP-IV抑制能力。综上所述,木瓜蛋白酶在制备高活性DPP-IV抑制活性产物方面表现出较大的优势,这一结果与He Long等[26]的研究结果一致。因此选用木瓜蛋白酶作为制备羊骨DPP-IV抑制活性产物的最佳蛋白酶。
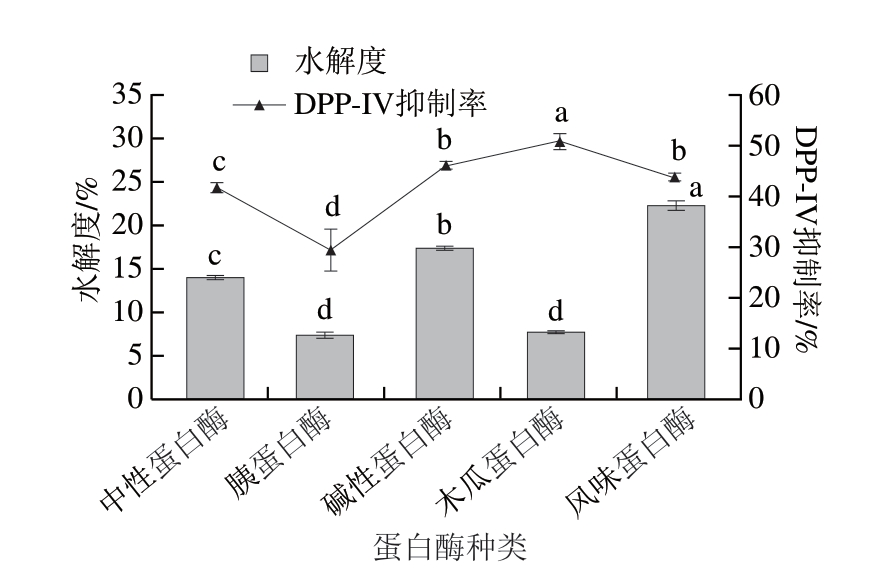
图1 不同蛋白酶对酶解产物DPP-IV抑制率和水解度的影响
Fig. 1 Effect of different proteases on the DPP-IV inhibition rate and degree of hydrolysis of hydrolysates
小写字母不同表示差异显著(P<0.05)。图2、3同。
2.3 酶解条件的优化
如图2A所示,随着酶添加量的提高,水解度不断增加,但酶解产物的DPP-IV抑制率在酶添加量为8 000 U/g时达到最大值,为(52.16±0.82)%。当酶添加量进一步增加,产物DPP-IV抑制率反而降低,这可能是由于酶添加量较低时,反应体系中酶分子数量有限,限制了酶切反应发生的频率,从而导致蛋白质水解程度较低,仅产生少量具有DPP-IV抑制活性的产物;而过高的酶添加量会引起羊骨蛋白的过度酶解,导致原本具有DPP-IV抑制活性的肽段继续降解为无活性的小分子肽或氨基酸,因此,结合酶解产物水解度和DPP-IV抑制率,应选择酶添加量为8 000 U/g。
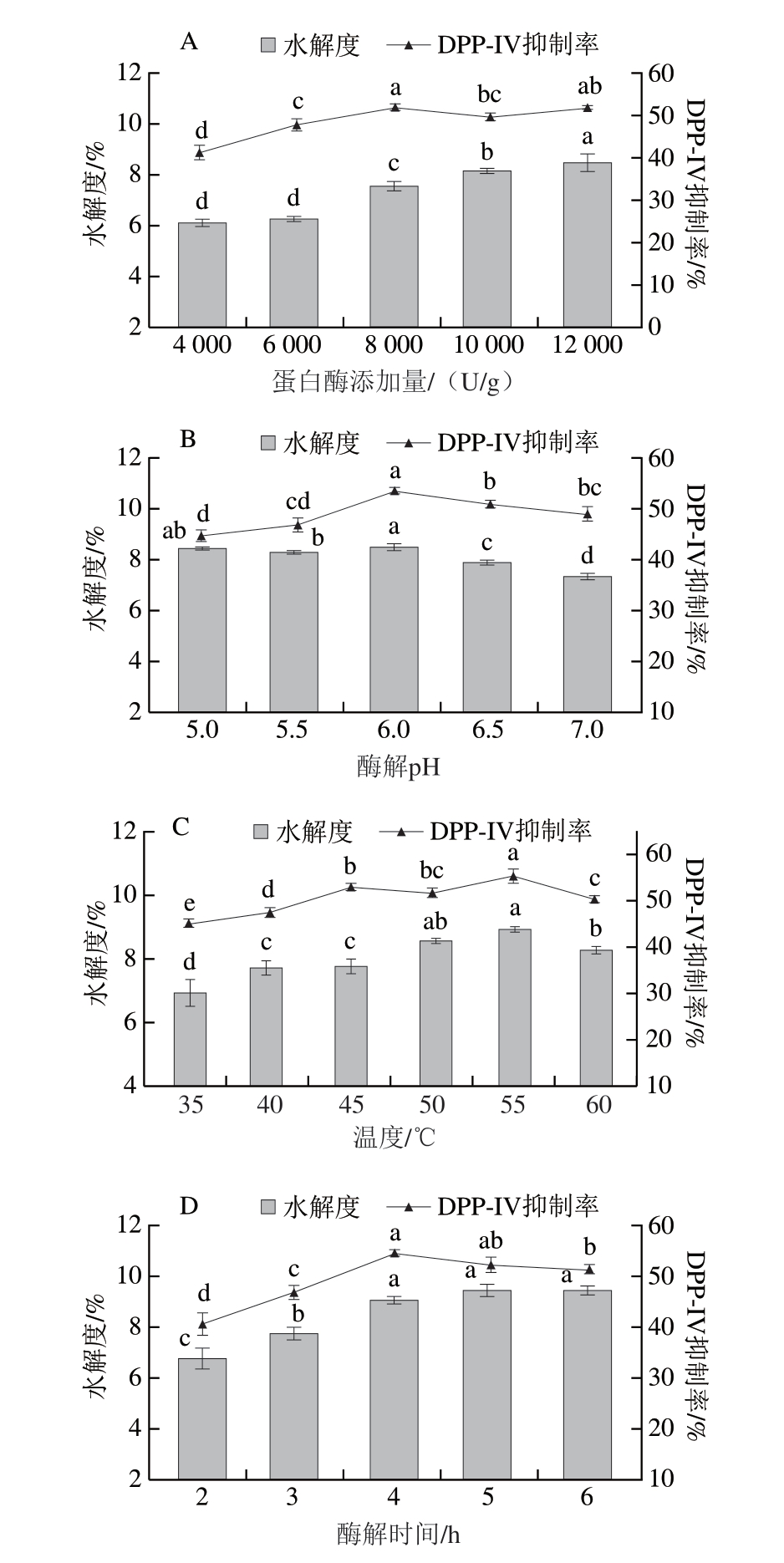
图2 酶解条件对酶解产物DPP-IV抑制率和水解度的影响
Fig. 2 Effect of enzymatic hydrolysis conditions on the DPP-IV inhibition rate and hydrolysis degree of hydrolysates
A.蛋白酶添加量;B. 酶解pH值;C.酶解温度;D.酶解时间。
溶液酸碱度是影响蛋白酶活性和催化效率的重要因素,每种蛋白酶都有其最佳的酶解pH值范围,在合适的pH值条件下,底物才能最大程度转化为酶解产物,完成水解[27]。如图2B所示,随着溶液pH值的提高,产物水解度和DPP-IV抑制率均呈先增大后减小的趋势,在pH 6.0时,木瓜蛋白酶的活性达到峰值,此时蛋白水解效率最高,可以生成较多具有DPP-IV抑制活性的组分,因此酶解产物DPP-IV抑制率和水解度均达到最大值,分别为(53.71±0.61)%和(8.54±0.09)%。当pH值进一步升高,可能超过了木瓜蛋白酶的最适pH值范围,导致酶的构象发生改变,甚至部分失活,从而影响酶解效果,导致DPP-IV抑制率和水解度的降低[28]。因此选择木瓜蛋白酶的最适pH值(6.0)作为后续制备条件。
如图2C所示,随着酶解温度的上升,酶解产物DPP-IV抑制率逐渐提高,在55 ℃时达到最大值((55.39±1.52)%),显著高于其他组(P<0.05)。酶解温度较低时,酶分子和底物的热运动不足,酶活性较低,水解速率慢,导致其水解度和DPP-IV抑制率较低。当酶解温度升高时,酶和底物的热运动加快,酶活性逐渐提高,与底物结合更加紧密,水解速率加快,产物水解程度和DPP-IV抑制率提高;而当酶解温度进一步升高,酶分子可能发生热变性,导致酶分子部分失活,水解速率变慢,具有DPP-IV抑制活性的产物释放减少,产物水解度和DPP-IV抑制率开始降低,因此,综合考虑选择55 ℃作为制备羊骨DPP-IV抑制活性产物的酶解温度。
如图2D所示,由于酶分子需要识别和水解蛋白质中的特定位点,当酶解时间小于4 h时,蛋白酶无法对蛋白质进行充分剪切,生成的多肽片段可能较大且活性不高,随着酶解时间的延长,酶解反应进行充分,逐步释放更多具有DPP-IV抑制活性的组分,因此产物DPP-IV抑制率和水解度随着时间的延长而提高,DPP-IV抑制率在酶解4 h时达到最大值,而当酶解时间大于4 h时,酶促反应逐渐接近饱和,底物浓度不断降低,无法继续产生具有活性的多肽[29],此时抑制率和水解度趋于平稳,因此,选择4 h作为最佳酶解时间。
2.4 超声预处理条件的优化
如图3A所示,随着超声时间的延长,酶解产物的DPP-IV抑制率先上升后下降,当超声时间为30 min时达最大值,为(59.62±0.96)%,显著高于其他组(P<0.05)。当超声时间较短时,由于超声的空化作用能够增强底物蛋白的溶解性并舒展蛋白结构,使蛋白质易被蛋白酶识别和水解[30]。这一结果与Rivero-Pino等[31]的结果一致,他们的研究表明,短时间的超声能够促进具有生物活性的组分释放。而当超声时间进一步延长,可能会导致蛋白质分子的聚集,从而减少酶与底物之间的相互作用[32],在Wang Yang等[33]的研究中也观察到类似的现象。因此,适当的超声预处理时间对酶解效果和生物活性物质的生成具有重要意义,选择超声时间30 min为最佳的超声预处理时间。
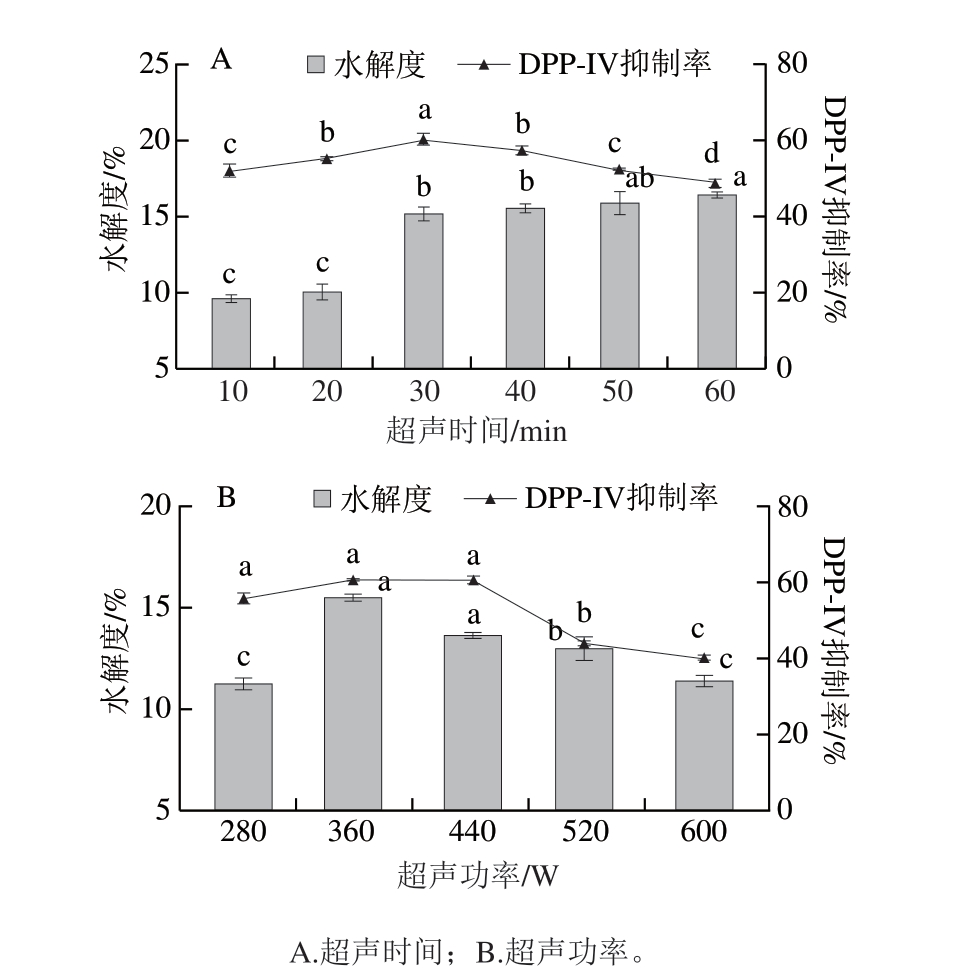
图3 超声预处理条件对酶解产物DPP-IV抑制率和水解度的影响
Fig. 3 Effect of ultrasound pretreatment conditions on the DPP-IV inhibition rate and degree of hydrolysis of hydrolysates
如图3B所示,随着超声功率的提高,蛋白质结构被破坏,使更多酶切位点暴露,酶与底物结合更加充分[34],水解度和DPP-IV抑制率逐渐增大,当超声功率达360 W时,酶解产物DPP-IV抑制率和水解度达最大值,分别为(60.61±0.78)%和(15.55±0.12)%,当功率大于360 W时,DPP-IV抑制率和水解度开始下降,可能是因为高强度超声可能会引起蛋白质分子之间非共价相互作用的增强,使蛋白质分子聚集,减少其与蛋白酶的接触机会,蛋白酶无法充分与底物结合,使酶解不充分[15],导致DPP-IV抑制率和水解度降低,因此选择360 W作为最优的超声预处理功率。
综上所述,在进行酶解前结合超声预处理技术可以有效提高所制备产物的DPP-IV抑制活性。与未采用超声预处理的传统工艺相比,酶解产物的DPP-IV抑制率由(54.70±0.42)%(图2D)显著提升至(60.61±0.78)%(P<0.05)。这一结果表明,超声辅助酶解技术能够通过改善酶与底物的结合效率促进多肽的生成,在制备高效DPP-IV抑制活性产物方面具有明显优势。
2.5 基于响应面试验的超声辅助酶解条件工艺优化
根据单因素试验结果,确定超声预处理时间为30 min,酶添加量为8 000 U/g,酶解时间为4 h。在此基础上进行响应面试验,并对试验结果进行模型拟合与方差分析,如表4、5所示。
表4 响应面试验设计方案和结果
Table 4 Experimental design with response variable for response surface analysis
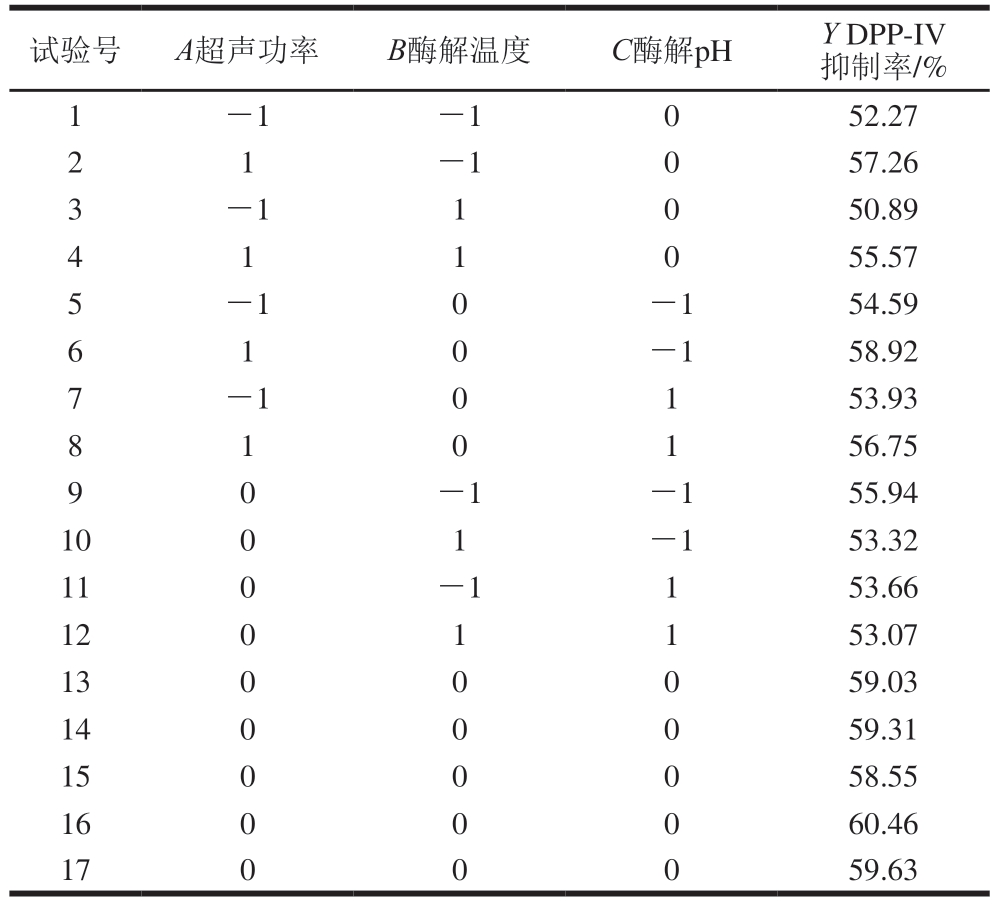
试验号A超声功率B酶解温度C酶解pHY DPP-IV抑制率/%1-1-1052.27 2 1-1057.26 3-11050.89 4 1 1 0 55.57-10-154.59 6 1 0-158.92 5 7-10153.93 8 1 0 1 56.75-1-155.94 1001-153.32 110-1153.66 1201153.07 1300059.03 1400059.31 1500058.55 1600060.46 1700059.63 9 0
二次回归模拟方程为:Y=59.396+2.102 5A-0.785B-0.67C-0.077 5AB-0.377 5AC+0.507 5BC-1.674 25A2-3.724 25B2-1.674 25C2。
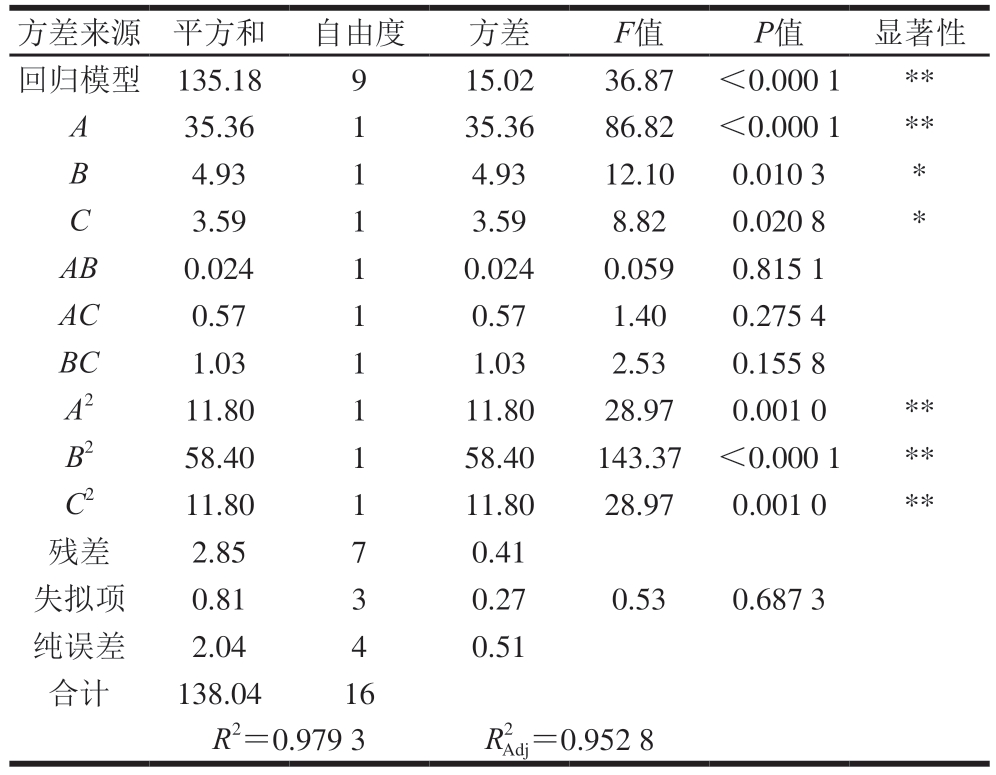
如表5所示,模型的决定系数R2=0.979 3,调整决定系数![]() =0.952 8,模型显著(P<0.05),失拟项不显著(P>0.05),因此该回归模型可用于预测DPP-IV抑制率。回归分析显示,以F值为指标,各因素对DPP-IV抑制率的影响程度顺序为A(超声功率)>B(酶解温度)>C(酶解pH值),说明超声功率是影响制备条件的关键因素。各因素交互作用的响应面图及等高线图如图4所示,直观反映了各因素对DPP-IV抑制率的影响趋势。
=0.952 8,模型显著(P<0.05),失拟项不显著(P>0.05),因此该回归模型可用于预测DPP-IV抑制率。回归分析显示,以F值为指标,各因素对DPP-IV抑制率的影响程度顺序为A(超声功率)>B(酶解温度)>C(酶解pH值),说明超声功率是影响制备条件的关键因素。各因素交互作用的响应面图及等高线图如图4所示,直观反映了各因素对DPP-IV抑制率的影响趋势。
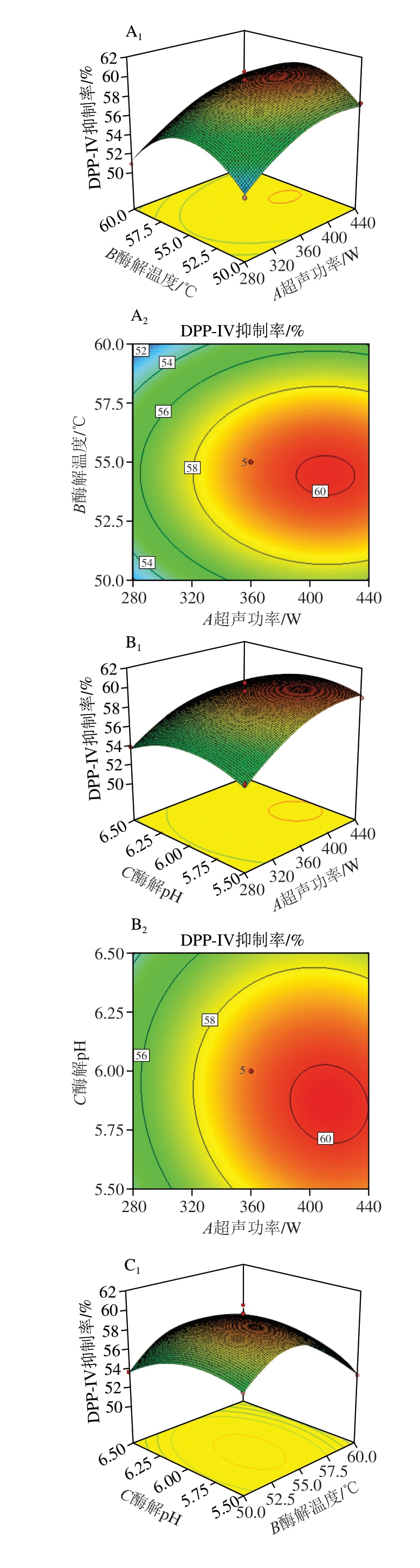
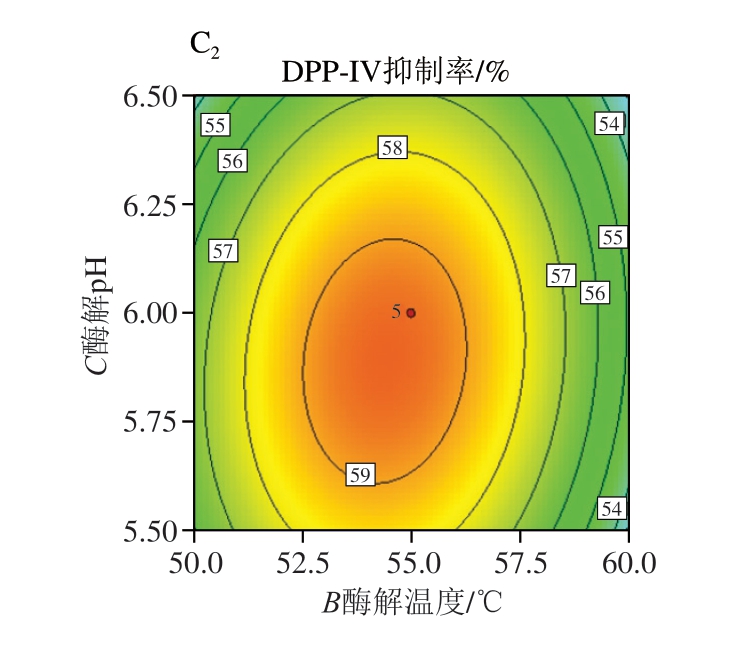
图4 双因素交互影响DPP-IV抑制率的响应面图及等高线图
Fig. 4 Response surface and contour plots showing the interactive effects of variables on DPP-IV inhibition rate
A.酶解温度与超声功率;B. 酶解pH值和超声功率;C.酶解pH值和酶解温度;下标1.响应面图;下标2.等高线图。
表5 模型回归方程方差分析
Table 5 Analysis of variance of regression equation
注:*.显著(P<0.05);**.极显著(P<0.01)。
方差来源平方和自由度方差F值P值显著性回归模型135.18915.0236.87<0.000 1**A35.36135.3686.82<0.000 1**B4.9314.9312.100.010 3*C3.5913.598.820.020 8*AB0.02410.0240.0590.815 1 AC0.5710.571.400.275 4 BC1.0311.032.530.155 8 A211.80111.8028.970.001 0**B258.40158.40143.37<0.000 1**C211.80111.8028.970.001 0**残差2.8570.41失拟项0.8130.270.530.687 3纯误差2.0440.51合计138.0416 R2=0.979 3R2 Adj=0.952 8
响应面法预测的最佳制备条件为:超声预处理功率413.147 W、酶解温度54.340 ℃、酶解pH 5.853,其预测的DPP-IV抑制率为60.245%。为方便实验操作,确定验证试验的工艺条件为:超声功率410 W、酶解温度54 ℃、酶解pH 5.8。在此条件下进行3 组重复验证实验,结果表明,DPP-IV抑制率为(61.52±0.37)%,与模型预测值60.245%基本相符,表明此条件下超声辅助酶解羊骨能高效制备DPP-IV抑制活性产物。
2.6 羊骨DPP-IV抑制肽的结构表征
2.6.1 荧光光谱
多肽中含有色氨酸、酪氨酸、苯丙氨酸等芳香族氨基酸,在280 nm的波长激发下会产生内源性荧光。其中,色氨酸残基侧链的内源荧光信号对微环境的变化非常敏感,因此经常被认为是一种内源性荧光探针,用于研究蛋白质溶液的三级结构构象和内环境的极性变化[35]。如图5所示,酶解制备、超声辅助酶解制备样品均在307、332 nm波长附近产生吸收峰,其中UE-SBPH的荧光强度高于E-SBPH且吸收峰未发生明显偏移,这与熊喆等[36]对草鱼鳞胶原肽和Zhou Cunshan等[37]对小麦胚芽ACE抑制肽的研究结果相似。荧光强度增强是由于蛋白质内部的疏水区域暴露到更为极性的水相环境中,但并未造成色氨酸残基所在极性环境的明显变化。这表明超声预处理可能导致蛋白质三级结构的受损或部分展开,进而改变芳香族残基周围的微环境,促进其荧光信号的释放[34,38-39]。
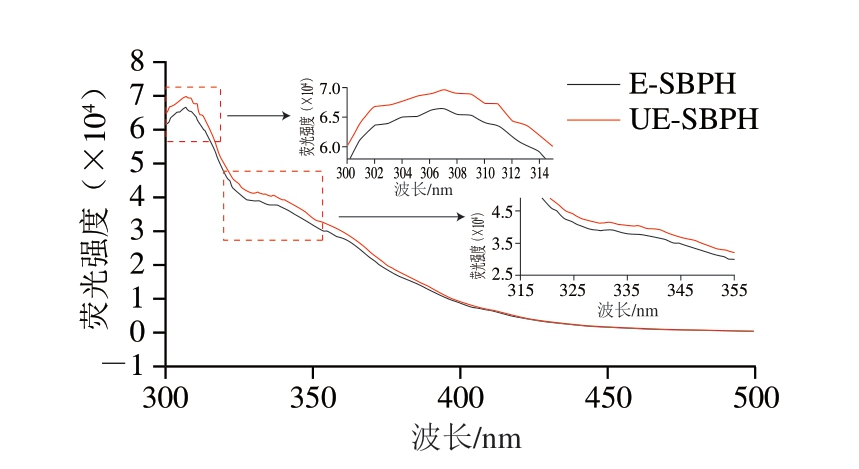
图5 E-SBPH和UE-SBPH的荧光光谱图
Fig. 5 Fluorescence spectra of hydrolysates prepared with (UE-SBPH) and without (E-SBPH) ultrasonic assistance
2.6.2 紫外-可见吸收光谱
蛋白质的紫外吸收主要来自于酪氨酸、色氨酸、苯丙氨酸、组氨酸和半胱氨酸残基侧链的特征吸收,同时肽键也在紫外区表现出强烈吸收[40]。如图6所示,主要强吸收峰位于210 nm附近,这是由酶解产物中的羰基、羧基和酰胺键的π→π*跃迁引起的[41]。在270 nm附近存在的微弱吸收峰可能是由组氨酸、苯丙氨酸、酪氨酸等发色氨基酸引起的,这些氨基酸在250~288 nm波长处存在吸收,表明羊骨酶解产物中含有少量的芳香族氨基酸。超声预处理后,样品在210 nm波长附近的紫外吸收峰并未出现明显偏移,但吸收强度有所增加,说明超声处理可能舒展了羊骨蛋白结构,但不会对蛋白侧链基团的分布造成改变,这与荧光光谱结果一致。超声处理对蛋白质结构的影响可能是通过微环境极性变化实现的,超声的空化作用具有较强的剪切力,能破坏相邻蛋白质分子的相互作用,引发蛋白质的部分去折叠,可能使原本隐藏于蛋白质分子内部的具有紫外吸收的疏水基团暴露于外部,这些疏水基团吸收紫外光的能力较强,因此紫外吸收强度增加[42-43]。
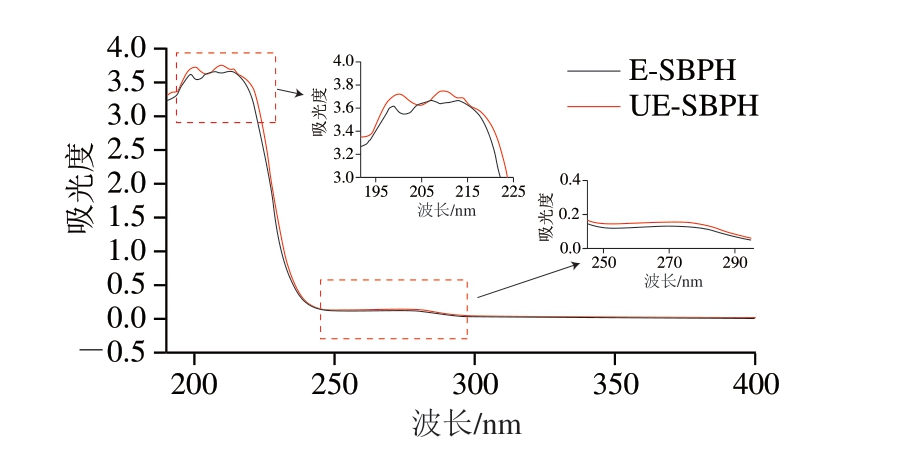
图6 E-SBPH和UE-SBPH的紫外-可见吸收光谱
Fig. 6 Ultraviolet-visible absorption spectra of E-SBPH and UE-SBPH
2.6.3 傅里叶变换红外光谱
傅里叶变换红外光谱可以用于反映蛋白质的官能团和二级结构的变化[44]。光谱中的酰胺A带(3 500~3 300 cm-1)、酰胺I带(1 600~1 700 cm-1)和酰胺II带(1 500~1 600 cm-1)是分析蛋白质、多肽类物质的重要区域。酰胺A带主要与N—H的伸缩振动有关,分子间或分子内氢键的强弱会影响酰胺A带的出峰位置[45],而酰胺I带和酰胺II带是了解蛋白质二级结构的重要区域,酰胺I带是由C=O的伸缩振动产生的,酰胺II带一般与C—N的伸缩振动和N—H变形振动相关[16]。如图7所示,与E-SBPH相比,UE-SBPH在酰胺A带处的峰由3 261.42 cm-1移动到3 276.20 cm-1处,说明超声作用可能破坏了分子间或分子内的氢键作用,扰乱了原有的二级结构,结合图8可知,E-SBPH样品中仍保留一定的α-螺旋结构,而UE-SBPH中α-螺旋相对含量下降,且β-转角、β-折叠和无规卷曲相对含量提高,说明超声辅助酶解促进了肽链构象由有序向无序的转变,导致分子构象趋于松散,有助于暴露更多活性位点,从而提升生物活性。同时,氢键的破坏使N—H从原有的氢键网络中释放,自由度增加,导致N—H的伸缩振动能量增加,表现为酰胺A带的蓝移。UE-SBPH在酰胺I带和酰胺II带的峰分别由1 641.14、1 538.92 cm-1移动到1 637.50、1 535.85 cm-1处,说明C=O和N—H可能在新的氢键环境中受到约束,其伸缩振动的能量降低,因此表现为酰胺I带和酰胺II带的红移。
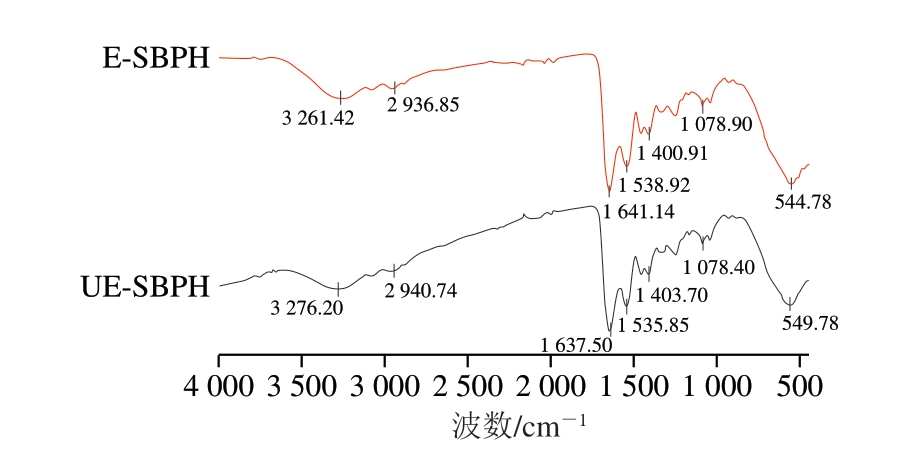
图7 E-SBPH和UE-SBPH的傅里叶变换红外光谱图
Fig. 7 Fourier transform infrared spectra of E-SBPH and UE-SBPH
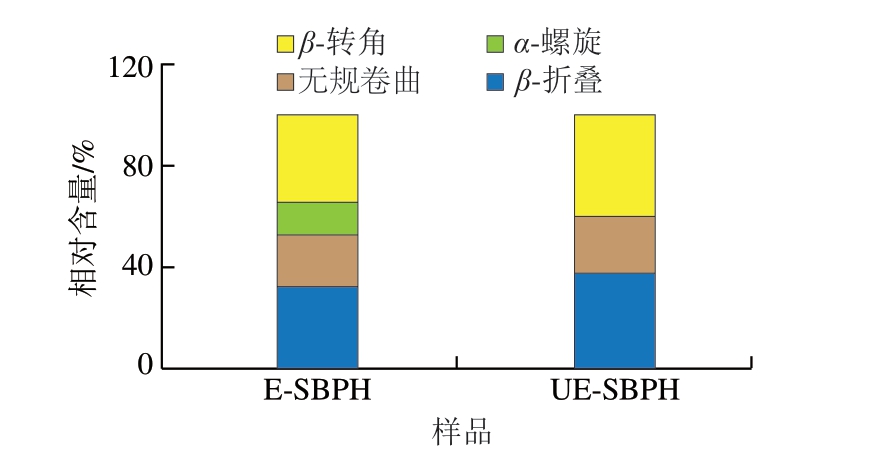
图8 E-SBPH和UE-SBPH的二级结构相对含量
Fig. 8 Relative content of secondary structure of E-SBPH and UE-SBPH
2.6.4 扫描电子显微镜图
如图9所示,相较于未经过超声处理的羊骨酶解产物,经过超声处理后酶解产物颗粒更小,表面更加粗糙,出现更细小、致密、均匀的孔洞,表明超声处理的空化效应产生的微射流能够破坏蛋白表面结构,可能使更多的酶作用位点暴露出来,说明超声预处理对酶促反应有积极作用,有利于酶与底物之间的结合作用,提高酶解效率[20,46-47]。这与Peng Zeyu等[48]的研究结果类似,该研究探讨了超声对小米麸皮水解物结构的影响,结果表明,超声处理的空化作用可以使样品表面变得多孔,片层结构变成松散的碎片、尺寸变小。

图9 不同酶解方式制备羊骨DPP-IV抑制活性产物表观结构的扫描电子显微镜图
Fig. 9 Scanning electron microscope images of E-SBPH and UE-SBPH
A. E-SBPH(×1 000);B. E-SBPH(×5 000);C. UE-SBPH(×1 000);D. UE-SBPH(×5 000)。
综上,超声预处理可以对蛋白二级、三级结构产生一定影响,能够使更多芳香族氨基酸残基从疏水核心暴露,使酶解产物局部氢键发生减弱或断裂,导致α-螺旋向无规卷曲或β-折叠转变,此外,超声预处理可以使样品表面更加松散多孔,暴露更多酶作用位点,为酶与底物结合提供更有利的条件,促进DPP-IV抑制活性物质的释放与产物生物活性的提高。
3 结论
本研究使用超声辅助酶解法制备羊骨中DPP-IV抑制活性产物,并探究超声预处理对DPP-IV抑制活性产物结构特性的影响。结果表明,木瓜蛋白酶是制备羊骨DPP-IV抑制活性产物的最佳蛋白酶,超声预处理能够使酶解产物的DPP-IV抑制率由(54.70±0.42)%显著提升至(60.61±0.78)%(P<0.05),优化酶解过程并促进活性肽的释放。通过响应面法优化得到的最佳制备工艺为:超声功率410 W、超声时间30 min、酶解温度54 ℃、酶解pH 5.8、酶解时间4 h。在此工艺条件下,羊骨酶解产物的DPP-IV抑制率为(61.52±0.37)%。此外,超声预处理能够使蛋白质结构发生变化,导致α-螺旋向无规卷曲或β-折叠转变,且通过微观结构观察,发现超声辅助酶解得到的产物颗粒更小,表面更加粗糙。本研究为羊骨的高值化利用提供了理论依据,并展示了超声辅助酶解在功能性物质制备中的应用潜力。由于本研究未对酶解产物进行分离纯化,无法明确DPP-IV抑制活性与特定多肽的关系,因此,未来研究应进一步分离纯化酶解产物,鉴定具有DPP-IV抑制活性的关键多肽,并探讨其结构特征与活性之间的关系,全面揭示羊骨酶解产物的功能机制。
[1] 张露娟. 畜禽骨的综合利用研究现状与发展趋势[J]. 现代食品, 2021, 27(3): 86-90; 94. DOI:10.16736/j.cnki.cn41-1434/ts.2021.03.028.
[2] AZEEM M, ALI A, AROCKIAM JEYASUNDAR P G S, et al.Effects of sheep bone biochar on soil quality, maize growth, and fractionation and phytoavailability of Cd and Zn in a miningcontaminated soil[J]. Chemosphere, 2021, 282: 131016. DOI:10.1016/j.chemosphere.2021.131016.
[3] 胡冠华. 羊骨肽钙螯合物的制备及其预防骨质疏松的作用机制研究[D]. 呼和浩特: 内蒙古农业大学, 2024. DOI:10.27229/d.cnki.gnmnu.2024.000039.
[4] WANG C L, ZHAO S Y, WANG X L, et al. Preparation and impact of fermented sheep bone powder on sausage quality[J]. Fermentation,2023, 9(9): 842. DOI:10.3390/fermentation9090842.
[5] 张靖. 羊骨多肽的制备及其抗氧化能力研究[D]. 呼和浩特: 内蒙古农业大学, 2021. DOI:10.27229/d.cnki.gnmnu.2021.000763.
[6] DA SILVA L R, DE FARIAS MARQUES A D J, ABREU T L, et al.Effect of thermal processing and enzymatic hydrolysis on the formation of a new industrial flavoring agent from goat bones[J].LWT-Food Science and Technology, 2024, 191: 115613. DOI:10.1016/j.lwt.2023.115613.
[7] ÖZTÜRK H İ, ORAÇ A. Harvesting bioactive peptides from sustainable protein sources: unveiling technological and functional properties through in silico analyses[J]. Food and Humanity, 2024, 2:100294. DOI:10.1016/j.foohum.2024.100294.
[8] MAO Z J, JIANG H, SUN J N, et al. Research progress in the preparation and structure-activity relationship of bioactive peptides derived from aquatic foods[J]. Trends in Food Science & Technology,2024, 147: 104443. DOI:10.1016/j.tifs.2024.104443.
[9] 张楚涵, 陈寅格, 马婷, 等. 珍珠蚌肉DPP-IV抑制肽的制备与分离[J].食品科学, 2024, 45(17): 63-70. DOI:10.7506/spkx1002-6630-20240125-233.
[10] HAQ M, ALI M S, PARK J S, et al. Atlantic salmon (Salmo salar)waste as a unique source of biofunctional protein hydrolysates:emerging productions, promising applications, and challenges mitigation[J]. Food Chemistry, 2025, 462: 141017. DOI:10.1016/j.foodchem.2024.141017.
[11] WANG B B, YU Z, YOKOYAMA W, et al. Collagen peptides with DPP-IV inhibitory activity from sheep skin and their stability to in vitro gastrointestinal digestion[J]. Food Bioscience, 2021, 42:101161. DOI:10.1016/j.fbio.2021.101161.
[12] JIN R T, TENG X Y, SHANG J Q, et al. Identification of novel DPP-IV inhibitory peptides from Atlantic salmon (Salmo salar) skin[J].Food Research International, 2020, 133: 109161. DOI:10.1016/j.foodres.2020.109161.
[13] WANG S G, ZHAO M M, FAN H B, et al. Emerging proteins as precursors of bioactive peptides/hydrolysates with health benefits[J].Current Opinion in Food Science, 2022, 48: 100914. DOI:10.1016/j.cofs.2022.100914.
[14] UMEGO E C, HE R H, REN W B, et al. Ultrasonic-assisted enzymolysis: principle and applications[J]. Process Biochemistry,2021, 100: 59-68. DOI:10.1016/j.procbio.2020.09.033.
[15] QUAN Z Z, WANG Z H, WANG Z X, et al. Study on the antioxidant and antiosteoporotic activities of the oyster peptides prepared by ultrasound-assisted enzymatic hydrolysis[J].Ultrasonics Sonochemistry, 2025, 112: 107211. DOI:10.1016/j.ultsonch.2024.107211.
[16] HE L, GAO Y F, WANG X Y, et al. Ultrasonication promotes extraction of antioxidant peptides from oxhide gelatin by modifying collagen molecule structure[J]. Ultrasonics Sonochemistry, 2021, 78:105738. DOI:10.1016/j.ultsonch.2021.105738.
[17] ZOU Y, WANG W, LI Q, et al. Physicochemical, functional properties and antioxidant activities of porcine cerebral hydrolysate peptides produced by ultrasound processing[J]. Process Biochemistry, 2016,51(3): 431-443. DOI:10.1016/j.procbio.2015.12.011.
[18] 王贝贝. 羊皮胶原基DPP-IV抑制活性肽的制备及活性机制分析[D].无锡: 江南大学, 2021. DOI:10.27169/d.cnki.gwqgu.2021.000993.
[19] HU G H, LI X T, SU R N, et al. Effects of ultrasound on the structural and functional properties of sheep bone collagen[J].Ultrasonics Sonochemistry, 2023, 95: 106366. DOI:10.1016/j.ultsonch.2023.106366.
[20] YANG L H, GUO Z L, WEI J Q, et al. Extraction of low molecular weight peptides from bovine bone using ultrasound-assisted double enzyme hydrolysis: impact on the antioxidant activities of the extracted peptides[J]. LWT-Food Science and Technology, 2021, 146: 111470.DOI:10.1016/j.lwt.2021.111470.
[21] 吴婷, 贾伟, 管声, 等. 5 个品种牛骨的营养组成及其含量差异分析[J]. 食品工业科技, 2017, 38(2): 342-348. DOI:10.13386/j.issn1002-0306.2017.02.058.
[22] STOLLEWERK K, JOFRÉ A, COMAPOSADA J, et al. Food safety and microbiological quality aspects of QDS process® and high pressure treatment of fermented fish sausages[J]. Food Control, 2014, 38: 130-135. DOI:10.1016/j.foodcont.2013.10.009.
[23] XU F R, YAO Y J, XU X Y, et al. Identification and quantification of DPP-IV-inhibitory peptides from hydrolyzed-rapeseed-protein-derived napin with analysis of the interactions between key residues and protein domains[J]. Journal of Agricultural and Food Chemistry, 2019,67(13): 3679-3690. DOI:10.1021/acs.jafc.9b01069.
[24] CHOUDHARY R, KAUSHIK R, CHAWLA P, et al. Exploring the extraction, functional properties, and industrial applications of papain from Carica papaya[J]. Journal of the Science of Food and Agriculture, 2025, 105(3): 1533-1545. DOI:10.1002/jsfa.13776.
[25] XIANG X, LANG M, LI Y, et al. Purification, identification and molecular mechanism of dipeptidyl peptidase IV inhibitory peptides from discarded shrimp (Penaeus vannamei) head[J].Journal of Chromatography B, 2021, 1186: 122990. DOI:10.1016/j.jchromb.2021.122990.
[26] HE L, WANG X Y, WANG Y R, et al. Production and identification of dipeptidyl peptidase IV (DPP-IV) inhibitory peptides from discarded cowhide collagen[J]. Food Chemistry, 2023, 405: 134793.DOI:10.1016/j.foodchem.2022.134793.
[27] 代雯, 黄业传, 韩佳钰, 等. 不同pH值对木瓜蛋白酶活性的影响及分子机制[J]. 肉类研究, 2024, 38(10): 9-14. DOI:10.7506/rlyj1001-8123-20240618-151.
[28] 张薇, 李爱琳, 李书国. 超声辅助酶解制备大米蛋白黄嘌呤氧化酶活性抑制肽的工艺条件优化[J]. 中国粮油学报, 2024, 39(6): 51-58.DOI:10.20048/j.cnki.issn.1003-0174.000827.
[29] ZHANG Y, GUI M, FAN W, et al. Response surface methodology optimization on extraction and antioxidant activity evaluation of antioxidant peptide from enzymatic hydrolysates of sturgeon bone[J].LWT-Food Science and Technology, 2024, 198: 116042. DOI:10.1016/j.lwt.2024.116042.
[30] FADIMU G J, LE T T, GILL H, et al. Enhancing the biological activities of food protein-derived peptides using non-thermal technologies: a review[J]. Foods, 2022, 11(13): 1823. DOI:10.3390/foods11131823.
[31] RIVERO-PINO F, ESPEJO-CARPIO F J, GUADIX E M.Identification of dipeptidyl peptidase IV (DPP-IV) inhibitory peptides from vegetable protein sources[J]. Food Chemistry, 2021, 354: 129473.DOI:10.1016/j.foodchem.2021.129473.
[32] QIAN J Y, CHEN D, ZHANG Y Z, et al. Ultrasound-assisted enzymatic protein hydrolysis in food processing: mechanism and parameters[J].Foods, 2023, 12(21): 4027. DOI:10.3390/foods12214027.
[33] WANG Y, ZHANG Z L, HE R H, et al. Improvement in enzymolysis efficiency and changes in conformational attributes of corn gluten meal by dual-frequency slit ultrasonication action[J]. Ultrasonics Sonochemistry,2020, 64: 105038. DOI:10.1016/j.ultsonch.2020.105038.
[34] ASHRAF Z U, GANI A, SHAH A, et al. Ultrasonication assisted enzymatic hydrolysis for generation of pulses protein hydrolysate having antioxidant and ACE-inhibitory activity[J]. International Journal of Biological Macromolecules, 2024, 278: 134647. DOI:10.1016/j.ijbiomac.2024.134647.
[35] TIAN S Q, MENG F H, DU K. Physicochemical properties and structure characteristics of different molecular weight peptides from ultrasonic assisted papain hydrolysate of wheat germ albumin[J].Industrial Crops and Products, 2024, 211: 118254. DOI:10.1016/j.indcrop.2024.118254.
[36] 熊喆, 赵钰, 秦子波, 等. 超声辅助酶解促进草鱼鳞胶原肽水解进程的内在机制解析[J]. 农业工程学报, 2022, 38(16): 313-321.
[37] ZHOU C S, MA H L, YU X J, et al. Pretreatment of defatted wheat germ proteins (by-products of flour mill industry) using ultrasonic horn and bath reactors: effect on structure and preparation of ACEinhibitory peptides[J]. Ultrasonics Sonochemistry, 2013, 20(6): 1390-1400. DOI:10.1016/j.ultsonch.2013.04.005.
[38] 刘爱成, 杨惠仪, 王奕雯, 等. 超声处理对乳清蛋白致敏性及结构的影响[J]. 中国乳品工业, 2024, 52(6): 17-22. DOI:10.19827/j.issn1001-2230.2024.06.002.
[39] LI X T, LUO T, WANG L F, et al. Emulsifying properties of wheat germ protein: effect of different ultrasonic treatment[J].Ultrasonics Sonochemistry, 2023, 98: 106479. DOI:10.1016/j.ultsonch.2023.106479.
[40] ZHOU C S, MA H L, DING Q Z, et al. Ultrasonic pretreatment of corn gluten meal proteins and neutrase: effect on protein conformation and preparation of ACE (angiotensin converting enzyme) inhibitory peptides[J]. Food and Bioproducts Processing, 2013, 91(4): 665-671.DOI:10.1016/j.fbp.2013.06.003.
[41] GAO J J, NING C, WANG M X, et al. Structural, antioxidant activity, and stability studies of jellyfish collagen peptide-calcium chelates[J]. Food Chemistry: X, 2024, 23: 101706. DOI:10.1016/j.fochx.2024.101706.
[42] 许晶, 韩东, 王昱婷, 等. 超声预处理对大豆蛋白酶解物结构及抗氧化活性的影响[J]. 食品科学, 2018, 39(19): 78-84. DOI:10.7506/spkx1002-6630-201819013.
[43] DING Q Z, ZHANG T, NIU S, et al. Impact of ultrasound pretreatment on hydrolysate and digestion products of grape seed protein[J].Ultrasonics Sonochemistry, 2018, 42: 704-713. DOI:10.1016/j.ultsonch.2017.11.027.
[44] PANG L D, ZHANG W, CHEN C, et al. Effect of enzymatic hydrolysis and ultrasound pretreatment on allergenicity, functional properties and bioactivity of whey protein isolates[J]. LWT-Food Science and Technology, 2024, 210: 116891. DOI:10.1016/j.lwt.2024.116891.
[45] CARDAMONE J M. Investigating the microstructure of keratin extracted from wool: peptide sequence (MALDI-TOF/TOF) and protein conformation (FTIR)[J]. Journal of Molecular Structure, 2010,969(1/2/3): 97-105. DOI:10.1016/j.molstruc.2010.01.048.
[46] 李海静, 王松, 刘红玉, 等. 超声预处理对海参性腺蛋白酶解物结构特性的影响[J]. 食品科学, 2023, 44(3): 98-104. DOI:10.7506/spkx1002-6630-20220111-107.
[47] ZHANG S, XU Z Q, ZHENG W B, et al. Effect of multi-mode sweep frequency ultrasound pretreatment on properties of the zeins and ACE inhibitory peptides activity of the hydrolysates[J]. Food Chemistry,2023, 407: 135126. DOI:10.1016/j.foodchem.2022.135126.
[48] PENG Z Y, WANG F, YU L M, et al. Effect of ultrasound on the characterization and peptidomics of foxtail millet bran protein hydrolysates[J]. Ultrasonics Sonochemistry, 2024, 110: 107044.DOI:10.1016/j.ultsonch.2024.107044.