传统发酵肉制品因其独特风味和贮藏特性成为食品科学领域的重要研究对象。湘西侗族酸肉作为我国武陵山区特色发酵食品,经自然厌氧发酵形成酸香浓郁、口感柔韧的独特品质[1-2]。其风味形成过程与微生物群落演替密切相关,其中乳酸菌作为发酵体系的核心功能菌群,通过产酸、抑菌及代谢调控作用主导蛋白质分解、脂质转化与风味物质生成,同时发挥抗氧化作用,可减少机体摄入肉制品过程中肠道活性氧积累,从而减轻氧化应激对机体的影响[3],直接影响产品的感官特性与安全性[4]。然而,传统家庭制作的湘西侗族酸肉长期依赖自然环境微生物发酵,存在菌群结构不稳定、发酵周期不可控等问题,且其地域性乳酸菌资源尚未得到系统性挖掘,制约了工业化生产和标准化推广。相比于自然发酵肉制品,人工接种发酵肉制品的质量和安全品质更高[5]。在酸肉生产中引入外源发酵剂可有效提高生产可控性,抑制杂菌和有害菌生长,缩短发酵周期[6]。因此,筛选具有优良发酵特性的本土菌株,对传承民族饮食文化、优化发酵工艺及开发功能性发酵剂具有重要意义。
近年来,针对传统发酵食品中乳酸菌的研究已取得显著进展。针对传统发酵肉制品中乳酸菌的筛选,现有研究多聚焦于产酸能力、亚硝酸盐降解能力及风味调控特性。杜斌等[7]以降解亚硝酸盐能力为核心指标,从侗族传统酸鱼中筛选出植物乳植杆菌(Lactiplantibacillus plantarum)和发酵乳杆菌(Lactobacillus fermentum),将其应用于香肠发酵可显著降低产品亚硝酸盐残留(9.81 mg/kg);湛剑龙[8]以1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率为指标,从贵州侗族酸鱼、酸肉中筛选出7 株乳酸菌菌株;张新斌等[9]综述植物乳植杆菌对发酵肉制品风味的影响,对酸肉研究具有指导意义;娄利娇[10]、张玉龙[11]等对7 株乳酸菌的耐酸性、耐渗透压、产酸和胆固醇清除能力进行系统性研究;Liu Jingui等[12]从高盐发酵酸鱼中筛选出植物乳植杆菌B7;马彩霞[13]从甘肃传统牦牛发酵乳中筛选出11 株具有优良定植和黏附能力的乳酸菌;Chen Xi等[14]从侗族酸肉中分离出2 株高产亚硝酸盐的乳杆菌发酵剂。然而,现有研究多局限于菌群多样性描述和微生物对酸肉风味、安全性的影响[15-16],缺乏结合安全性评估与生长性能评价的综合筛选体系,对特定功能菌株的系统性筛选与工业化适应性评价仍显不足。
乳酸菌的产酸能力、耐盐耐酸性、蛋白酶活性及抑菌活性是评价其发酵适应性的关键指标[17]。本研究在前人菌种筛选方法的基础上,通过构建包含安全性评估、环境耐受性测定与代谢功能分析的多维度评价体系,开展地域特异性菌株的筛选、开发及工业化适配性验证。通过系统筛选具有应用潜力的本土菌种资源,实现从基础研究到产业应用的转化,为提升特色发酵产品品质、开发地域特色发酵剂提供理论依据,同时助力民族传统食品的微生物资源保护与可持续利用。
1 材料与方法
1.1 材料与试剂
样品(15 份)采集自湖南湘西古丈传统家庭发酵酸肉;沙门氏菌(Salmonella)ATCC 13311、大肠杆菌(Escherichia coli)ATCC 25922、金黄色葡萄球菌(Staphylococcus aureus)ATCC 25923、金黄色葡萄球菌ATCC 29213均由四川农业大学食品微生物实验室提供。
细菌药敏纸片 湖南比克曼生物科技有限公司;蛋白胨水(色氨酸肉汤)、明胶生化管、哥伦比亚血琼脂平板、氨基酸脱羧酶生化鉴定管 青岛高科技工业园海博生物技术有限公司。
实验中用到的主要培养基及配制方法见表1。
表1 主要培养基及配制方法
Table 1 Preparation methods of the main culture media used in this study

培养基配制方法MRS液体培养基蛋白胨10 g、牛肉膏10 g、酵母粉5 g、磷酸氢二钾2 g、柠檬酸二铵2 g、乙酸钠5 g、葡萄糖20 g、吐温-80 1 mL、硫酸镁0.58 g、硫酸锰0.25 g、蒸馏水1 000 mL,121 ℃灭菌20 min MRS固体培养基MRS液体培养基中加入2 g/100 mL琼脂MRS碳酸钙培养基MRS固体培养基中加入0.75 g/100 mL碳酸钙豆芽汁葡萄糖培养基称取新鲜黄豆芽10 g置于烧杯中,加入100 mL蒸馏水,小火煮沸30 min,用4 层纱布过滤,补足失水,即制成10%豆芽汁,取100 mL 10%豆芽汁,加入5 g葡萄糖,121 ℃灭菌20 min营养琼脂培养基蛋白胨10 g、牛肉膏3 g、氯化钠5 g、琼脂20 g、蒸馏水1 000 mL,pH 7.2,121 ℃灭菌20 min产黏培养基在MRS固体培养基中,以5 g/100 mL蔗糖代替葡萄糖耐盐培养基在MRS和酵母提取物蛋白胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基的基础上添加6%(m/m)氯化钠耐亚硝酸盐培养基在MRS和YPD液体培养基的基础上添加150 mg/kg亚硝酸钠糖、醇类发酵基础培养基蛋白胨5 g、牛肉膏5 g、酵母膏5 g、吐温-80 0.5 mL、糖或醇10 g、琼脂5 g、蒸馏水1 000 mL、1.6%(m/m)溴甲酚紫溶液1.4 mL,pH 6.8~7.0,112 ℃灭菌20 min产氨培养基脱脂牛奶100 mL、氯化钠0.5 g、精氨酸0.5 g,112 ℃灭菌20 min硝酸盐培养基蛋白胨5 g、硝酸钾0.2 g、蒸馏水1 000 mL,pH 7.4,121 ℃灭菌20 min下层培养基:蛋白陈10 g、牛肉膏10 g、酵母提取物5 g、葡萄糖10 g、吐温-80 1 mL、硫酸锰0.25 g、琼脂8 g、蒸馏水1 000 mL,pH 6.2~6.4,121 ℃灭菌15 min;上层培养基:在下层培养基的基础上添加4%(m/m)MnO2 LB液体培养基蛋白胨10 g、酵母膏5 g、氯化钠10 g、蒸馏水1 000 mL,pH 7.0,121 ℃灭菌20 min LB固体培养基在液体培养基的基础上添加2 g/100 mL琼脂三糖铁琼脂培养基蛋白胨20 g、牛肉膏5 g、乳糖10 g、蔗糖10 g、葡萄糖1 g、氯化钠5 g、硫酸亚铁铵0.2 g、硫代硫酸钠0.2 g、琼脂20 g、酚红0.025 g,pH 7.4±0.2,115 ℃灭菌15 min甲基红培养基蛋白胨7 g、葡萄糖5 g、磷酸氢二钾5 g、蒸馏水1 000 mL,pH 7.0~7.2,115 ℃灭菌15 min产H2O2培养基生物胺检测双层培养基下层培养基:蛋白胨5 g、酵母浸粉5 g、牛肉膏5 g、氯化钠2.5 g、葡萄糖0.5 g、吐温-80 1.0 mL、硫酸镁0.4 g、硫酸锰0.03 g、硫酸氢二钾2 g、柠檬酸三铵2 g、碳酸钙0.1 g、硫酸铁0.04 g、5-磷酸吡哆醛0.05 g、VB1 0.01 g、琼脂20 g、色氨酸、精氨酸、赖氨酸、酪氨酸、苯丙氨酸、组氨酸各5 g,蒸馏水1 000 mL,pH 5.2;上层培养基:溴甲酚紫0.06 g、琼脂20 g、蒸馏水1 000 mL,pH 5.2,121 ℃灭菌15 min
1.2 仪器与设备
C1000 Thermal Cycler聚合酶链式反应(polymerase chain reaction,PCR)仪、Gel Doc XR+凝胶成像系统美国Bio-Rad公司;LDZF-75L-I立式制动压力蒸汽灭菌器上海申安医疗器械厂;D-37520台式多功能高速冷冻离心机、1386生物安全柜、994超低温冰箱 美国赛默飞世尔科技公司;Scientz-12N冷冻干燥机 宁波新芝生物科技股份有限公司;NR20XE大口径色差仪 深圳三恩时科技有限公司;DHP-9162电热恒温培养箱 上海一恒科技有限公司;ZWY-2102C恒温培养振荡器、ZWY-110X30超级恒温水浴振荡器 上海智城分析仪器制造有限公司;FA1104精密电子天平 上海舜宇恒平科学仪器有限公司;PHSJ-3F实验室pH计 上海仪电科学仪器股份有限公司;UV-1800PC紫外-可见分光光度计 上海美谱达仪器有限公司;Milli-Q超纯水仪 美国Millipore公司。
1.3 方法
1.3.1 菌株筛选
参照GB/T 9695.19—2008《肉与肉制品 取样方法》[18],无菌环境下用无菌剪及无菌镊子从酸肉中取25 g样品,剪碎后加入225 mL无菌生理盐水,摇匀,制备样品处理液,备用。
筛选步骤:1)产酸细菌初筛:基于产酸菌的溶钙特性,取15 份酸肉样品处理液,用无菌生理盐水进行10 倍梯度稀释,均匀涂布于MRS碳酸钙培养基(pH 5.5)平板上,37 ℃培养24~48 h,以菌落周围形成直径≥2 mm的透明溶钙圈作为产酸标志,对溶钙圈明显且菌落形态差异显著的单菌落进行2~3 代划线纯化,挑取纯化菌落进行革兰氏染色和触酶实验,选取革兰氏阳性且触酶阴性菌株用于后续实验;2)发酵特性复筛:将初筛菌株接种于MRS液体培养基中,37 ℃静置培养18 h后进行发酵特性评价,包括产酸能力、产黏性、耐盐性、耐亚硝酸盐能力、葡萄糖产酸产气特性及H2S、H2O2、氨的生成能力,并检测氨基酸脱羧酶与硝酸盐还原酶活性和色氨酸分解能力(吲哚实验)[19],筛选符合以下标准的菌株:产酸能力强、不产黏、耐受6%(m/m)NaCl和150 mg/kg NaNO2、发酵葡萄糖不产气、不产H2S和H2O2、不产氨,无氨基酸脱羧酶和硝酸盐还原酶活性、不能分解色氨酸[20],用于后续实验。
1.3.2 安全性测定
1.3.2.1 溶血性测定
参照孟丹等[21]的方法,以金黄色葡萄球菌ATCC 25923作为阳性对照。将筛选出的菌株活化后划线于血琼脂平板上,37 ℃培养24 h后,观察溶血情况。
1.3.2.2 血浆凝固酶活性测定
采用试管法对待测菌株进行血浆凝固酶活性评估。根据冻干血浆使用说明书,向装有冻干兔血浆的西林瓶中加入0.5 mL无菌生理盐水,完全溶解后加入0.3 mL培养24 h的菌液,混匀后(36±1)℃培养,在2~6 h内观察是否有凝固现象,当凝固块体积大于原体积的一半时,为血浆凝固酶阳性。
1.3.2.3 产生物胺能力测定
参考Bover-Cid等[22]的生物胺显色法并进行改动。将待测菌株接种于双层显色培养基下层,37 ℃恒温培养48 h后,在超净工作台内覆盖预热至50 ℃的上层显色培养基,显色反应完成后(5 min内)立即进行结果判读。以未接种菌株的培养基作为空白对照组,显紫色判定为生物胺阳性菌株,保持黄色则判定为阴性菌株。
1.3.2.4 抗生素敏感性测定
依据Turchi等[23]的Kirby-Bauer纸片扩散法测定待测菌株对抗生素的敏感程度。据美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)标准(2021版)进行敏感性判定。质控菌株分别为大肠杆菌ATCC 25922和金黄色葡萄球菌ATCC 25923,测定筛选出的菌株对17 种常见细菌抗生素(表2)的敏感程度,按照CLSI M100中的纸片法标准[24]进行判定,敏感等级分为敏感(S)、中间敏感(I)和耐药(R)。实验重复3 次,取平均值。
表2 抗生素药敏纸片种类及含量
Table 2 Types and antibiotic loads of antibiotic susceptibility test discs
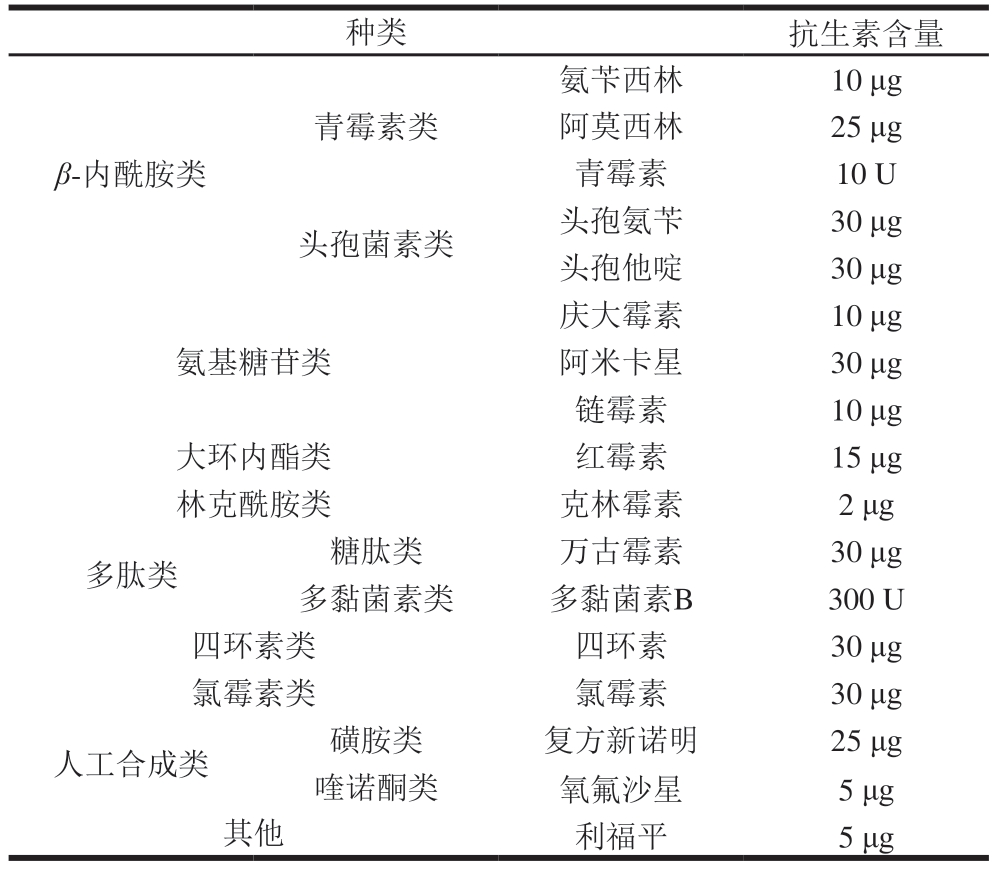
种类抗生素含量氨苄西林10 μg阿莫西林25 μg青霉素10 U头孢菌素类头孢氨苄30 μg头孢他啶30 μg青霉素类β-内酰胺类庆大霉素10 μg阿米卡星30 μg链霉素10 μg大环内酯类红霉素15 μg林克酰胺类克林霉素2 μg多肽类糖肽类万古霉素30 μg多黏菌素类多黏菌素B300 U四环素类四环素30 μg氯霉素类氯霉素30 μg人工合成类磺胺类复方新诺明25 μg喹诺酮类氧氟沙星5 μg其他利福平5 μg氨基糖苷类
筛选产酸性能良好、肉制品发酵核心指标优良、安全可控的目标菌株用于后续鉴定。
1.3.3 菌株生长性能测定
1.3.3.1 菌株生长曲线测定
将1.3.2节筛选出的符合安全性标准的菌株活化,以1%接种量转接至MRS液体培养基,37 ℃恒温静置培养,以等体积无菌MRS液体培养基作为对照,自接种起始,前24 h内每隔2 h取样监测培养液在600 nm波长下的光密度(OD600 nm),24 h后每隔4 h取样监测OD600 nm至总培养时长达48 h,通过OD600 nm变化动态评估菌体在液体环境中的增殖特征。
1.3.3.2 菌株耐酸特性评估
将1.3.2节筛选出的菌株分别接种于pH 2.0、3.0、4.0、5.0、6.0的MRS培养基中,37 ℃恒温静置培养24 h后,采用分光光度法检测菌液OD600 nm,以未接种菌体的同批次MRS培养基作为空白对照。
1.3.3.3 抑菌活性测定
基于牛津杯扩散法[25]对目标菌株进行3 株指示菌(金黄色葡萄球菌ATCC 29213、大肠杆菌ATCC 25922、沙门氏菌ATCC 13311)的拮抗作用分析。将活化至第3代的对数后期菌悬液低温离心(4 ℃、8 000 r/min、10 min),取上清液,经0.22 μm无菌滤膜过滤制备无细胞代谢产物;将指示菌悬液浓度调整为108 CFU/mL后涂布于平板,加入0.2 mL无细胞上清液,以空白LB培养基为阴性对照,37 ℃培养24 h,采用游标卡尺十字交叉法测量抑菌圈直径,实验重复3 次。
1.3.3.4 香辛料耐受性分析
参考曾雪峰[26]的方法并作部分修改。分别称取40 g生姜、20 g辣椒、20 g花椒,加入100 mL水并煮沸,60~70 ℃恒温水浴保持5~6 h后冷却,纱布过滤(花椒还需滤纸过滤),滤液分别为0.4 g/mL生姜提取液、0.2 g/mL辣椒提取液和0.2 g/mL花椒提取液,过滤除菌后4 ℃贮藏备用,将筛选出的菌株分别接种至添加有辣椒提取液(7.5%、10%,V/V)、生姜提取液(2.5%、5%,V/V)、花椒提取液(1%、2%,V/V)的MRS液体培养基,37 ℃培养24 h后检测OD600 nm,以未添加香辛料的MRS培养基为对照。实验重复3 次,取平均值。
综上,筛选产酸性能良好、发酵特性优良、安全、生长性能良好、能耐受香辛料的目标菌株用于后续鉴定。
1.3.5 目标菌株鉴定
1.3.5.1 形态学与生理生化鉴定
将目标菌株划线于MRS琼脂平板上,37 ℃培养24~48 h后,依据《伯杰细菌鉴定手册》[27]与《常见细菌系统鉴定手册》[28]进行形态学和生理生化鉴定。
1.3.5.2 分子生物学鉴定
以从目标菌株的过夜培养物中提取的菌株DNA作为PCR模板,以细菌16S rDNA保守区通用引物27F/1492R(5’-AGAGTTTGATCCTGGCTCAG-3’;5’-GGTTACCTTGTTACGACTT-3’)对待测菌株的靶序列进行PCR扩增(95 ℃预变性8 min,95 ℃变性0.75 min,55 ℃退火0.75 min,72 ℃延伸2 min,25 个循环,72 ℃补充延伸5 min,12 ℃保温5 min)。通过1.0%琼脂糖凝胶电泳验证扩增后DNA片段的特异性并测定片段长度,符合要求后委托生工生物工程(上海)股份有限公司完成双向测序。将16S rDNA测序结果上传至NCBI数据库,利用BLAST工具进行多序列比对,筛选GenBank中同源性最高的已知菌种序列,并通过MEGA软件构建系统发育树,以明确菌株分类地位。
1.4 数据处理
采用SPSS 26.0和Excel 2019软件对数据进行处理与统计分析,结果以平均值±标准差表示,组间比较采用独立样本t检验;以P<0.05表示差异有统计学意义。采用Origin 2021软件绘图。
2 结果与分析
2.1 菌株筛选结果
2.1.1 产酸能力初筛
从湘西侗族传统酸肉样品中成功筛选出48 株符合乳酸菌典型特征(革兰氏阳性、无芽孢、无运动性)的候选菌株,编号为M1~M48。该结果揭示侗族酸肉中蕴含丰富的产酸微生物资源,这些菌株对酸肉特有的发酵环境(盐质量分数6%~8%、pH 4.0~4.5、低氧条件)表现出较强的适应性。
2.1.2 发酵特性复筛
菌株产酸能力是影响酸肉发酵品质与安全性的关键指标,作为肉制品发酵菌,要求乳酸菌在24 h内迅速产酸,培养液pH值降至5.0以下[29]。如表3所示,初筛出的48 株乳酸菌均表现出良好的产酸特性:培养24 h时培养液pH值均低于培养12 h时,且培养24 h时培养液pH值均降至5.0以下。48 株乳酸菌均满足产酸能力要求。这一结果充分证实初筛菌株具备作为发酵剂的功能基础,为后续基于多维度评价指标的筛选工作提供可靠保障。
表3 候选菌株培养12、24 h时培养液pH值
Table 3 pH values of culture medium inoculated with each candidate strain after 12 and 24 h of cultivation
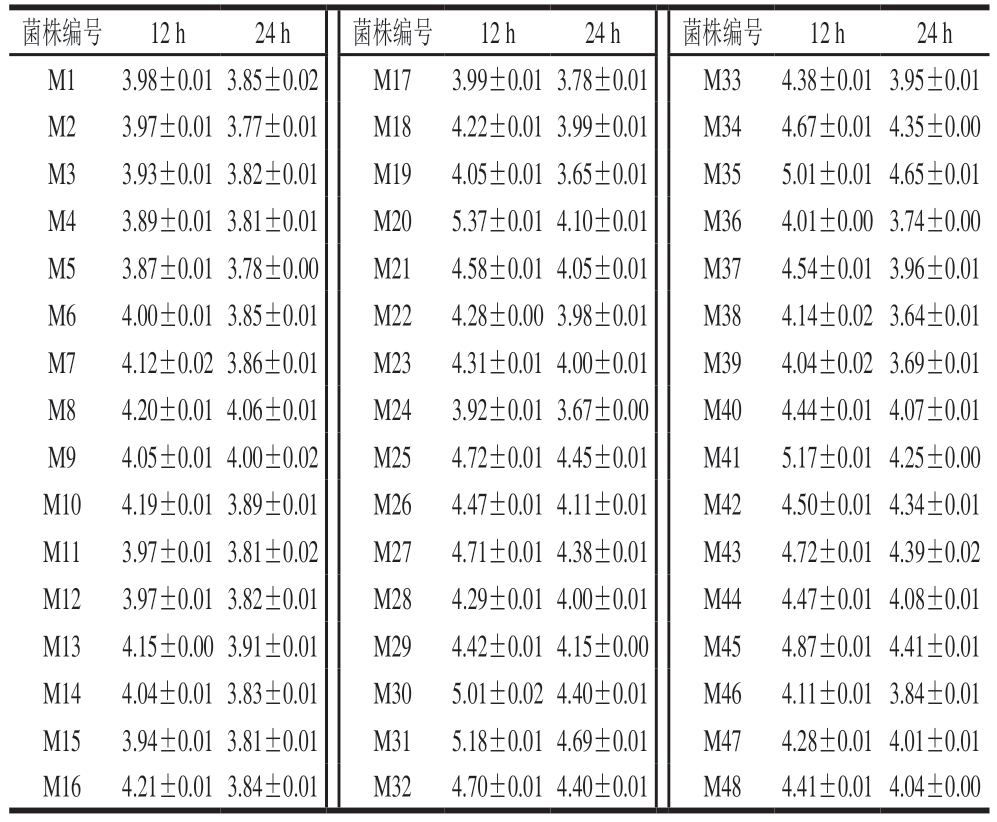
菌株编号12 h24 h菌株编号12 h24 h菌株编号12 h24 h M13.98±0.013.85±0.02 M173.99±0.013.78±0.01 M334.38±0.013.95±0.01 M23.97±0.013.77±0.01 M184.22±0.013.99±0.01 M344.67±0.014.35±0.00 M33.93±0.013.82±0.01 M194.05±0.013.65±0.01 M355.01±0.014.65±0.01 M43.89±0.013.81±0.01 M205.37±0.014.10±0.01 M364.01±0.003.74±0.00 M53.87±0.013.78±0.00 M214.58±0.014.05±0.01 M374.54±0.013.96±0.01 M64.00±0.013.85±0.01 M224.28±0.003.98±0.01 M384.14±0.023.64±0.01 M74.12±0.023.86±0.01 M234.31±0.014.00±0.01 M394.04±0.023.69±0.01 M84.20±0.014.06±0.01 M243.92±0.013.67±0.00 M404.44±0.014.07±0.01 M94.05±0.014.00±0.02 M254.72±0.014.45±0.01 M415.17±0.014.25±0.00 M104.19±0.013.89±0.01 M264.47±0.014.11±0.01 M424.50±0.014.34±0.01 M113.97±0.013.81±0.02 M274.71±0.014.38±0.01 M434.72±0.014.39±0.02 M123.97±0.013.82±0.01 M284.29±0.014.00±0.01 M444.47±0.014.08±0.01 M134.15±0.003.91±0.01 M294.42±0.014.15±0.00 M454.87±0.014.41±0.01 M144.04±0.013.83±0.01 M305.01±0.024.40±0.01 M464.11±0.013.84±0.01 M153.94±0.013.81±0.01 M315.18±0.014.69±0.01 M474.28±0.014.01±0.01 M164.21±0.013.84±0.01 M324.70±0.014.40±0.01 M484.41±0.014.04±0.00
由表4可知,48 株乳酸菌均表现出对高盐环境(6% NaCl)的适应性,符合发酵肉制品生产过程中盐质量分数动态变化(3%~5%)的工艺需求。在亚硝酸盐耐受性方面,除M4、M19、M25、M36、M41、M45外,其余42 株乳酸菌均可在150 mg/kg NaNO2环境中存活,表现出对150 mg/kg NaNO2的耐受能力,该耐受亚硝酸盐能力高于GB 2760—2024《食品安全国家标准 食品添加剂使用标准》[30]对肉制品中亚硝酸盐残留的限量标准(≤30 mg/kg),可确保筛选菌株在实际应用中的具有正常生长能力。这一结果证实多数候选菌株具备适应发酵肉制品生产环境的关键特性。
表4 候选菌株的发酵性能
Table 4 Fermentation performance of candidate strains
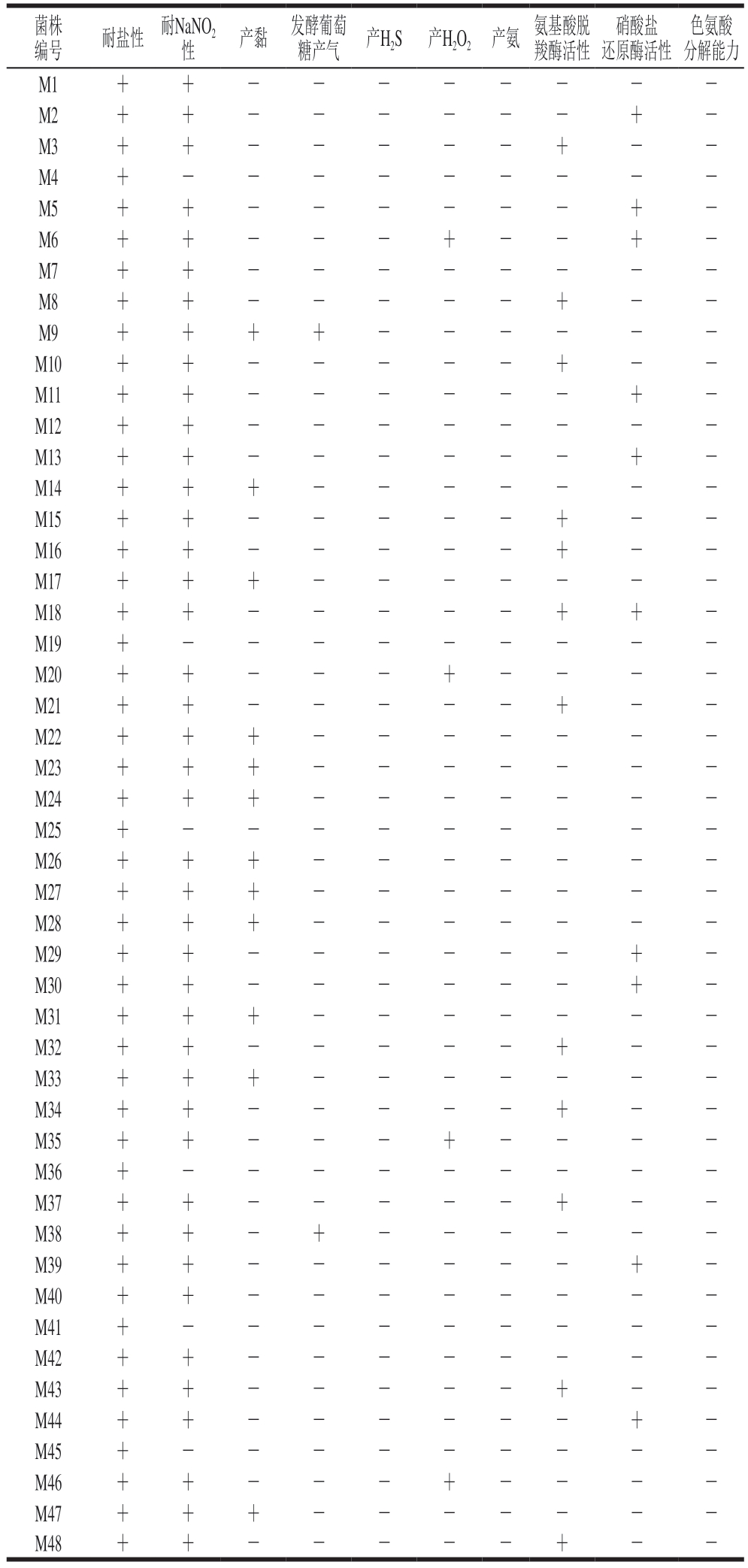
注:+.阳性;-.阴性。表5、9同。
色氨酸分解能力M1++--------M2++------+-M3++-----+--M4+---------M5++------+-M6++---+--+-M7++--------M8++-----+--M9++++------M10++-----+--M11++------+-M12++--------M13++------+-M14+++-------M15++-----+--M16++-----+--M17+++-------M18++-----++-M19+---------M20++---+----M21++-----+--M22+++-------M23+++-------M24+++-------M25+---------M26+++-------M27+++-------M28+++-------M29++------+-M30++------+-M31+++-------M32++-----+--M33+++-------M34++-----+--M35++---+----M36+---------M37++-----+--M38++-+------M39++------+-M40++--------M41+---------M42++--------M43++-----+--M44++------+-M45+---------M46++---+----M47+++-------M48++-----+--编号耐盐性耐NaNO2菌株性 产黏发酵葡萄糖产气产H2S产H2O2产氨氨基酸脱羧酶活性硝酸盐还原酶活性
值得注意的是,48 株乳酸菌均不产H2S与吲哚类物质,也不能发酵精氨酸产氨,这符合优质发酵剂对食品安全性与产品稳定性的核心要求;在葡萄糖发酵特性方面,除菌株M9、M38外,其余46 株乳酸菌在葡萄糖发酵过程中不产气,无气体生成是有效避免发酵产品质地疏松的重要条件之一。值得注意的是,除M6、M20、M35和M46外,其余44 株乳酸菌均不产H2O2;除菌株M9、M14、M17、M22、M23、M24、M26、M27、M28、M31、M33、M47外,其余36 株乳酸菌均表现出不产黏性特性,这与肉制品发酵剂对风味稳定性的要求相契合;在氨基酸脱羧酶活性方面,12 株乳酸菌(M3、M8、M10、M15、M16、M18、M21、M32、M34、M37、M43、M48)表现出氨基酸脱羧酶活性,可能引发生物胺积累风险,其余36 株无氨基酸脱羧酶活性,为安全候选菌株。此外,10 株乳酸菌(M2、M5、M6、M11、M13、M18、M29、M30、M39、M44)具有硝酸盐还原酶活性,其余38 株乳酸菌无硝酸盐还原酶活性,可有效控制亚硝酸盐残留。
基于肉制品发酵核心指标(耐盐性[31]、亚硝酸盐耐受性[30]、非产气特性、无有害代谢物及相关酶活性),最终筛选出M1、M7、M12、M40、M42 5 株乳酸菌。这些菌株不仅满足发酵剂功能特性要求,其低生物胺风险(无氨基酸脱羧酶活性)与无氧化应激产物(不产H2O2)特性可确保应用安全性,为后续发酵剂开发、复配及工艺优化提供优质资源。
2.2 复筛菌株安全性
2.2.1 溶血性
在产酸菌生物安全性评估体系中,红细胞溶血活性检测是衡量潜在风险的关键指标。携带溶血相关功能遗传因子或具备相关生物合成途径的微生物可能通过破坏红细胞膜结构完整性引发溶血症候群,严重时可导致全身性感染并发症(如败血症)[32-34]。由图1可知,阳性对照金黄色葡萄球菌ATCC 25923在37 ℃培养24 h后形成透明溶血环(β-溶血),复筛出的M1、M7、M12、M40、M42 5 株乳酸菌菌落周围均未出现α-溶血(草绿色环)或β-溶血(透明圈)现象,表现为γ-溶血(无溶血活性)。根据联合国粮食及农业组织/世界卫生组织(Food and Agriculture Organization of the United Nations/World Health Organization,FAO/WHO)食品级微生物的安全规范,γ-溶血特性表明菌株无红细胞裂解能力与血栓形成风险,符合益生菌制剂和发酵食品的安全性要求。
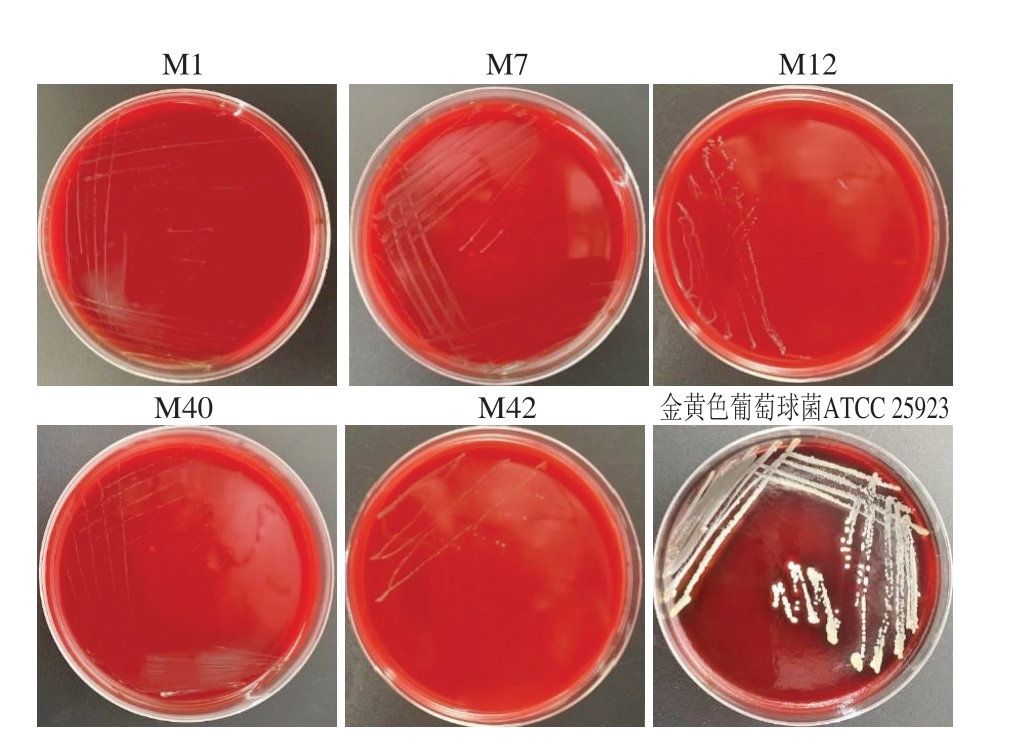
图1 菌株M1、M7、M12、M40和M42的溶血实验结果
Fig. 1 Hemolysis test results of strains M1, M7, M12, M40 and M42
2.2.2 血浆凝固酶活性
对5 株候选菌株血浆凝固酶活性测定结果显示,M1、M7、M12、M40和M42 5 株乳酸菌均未出现血浆凝固现象,表明其不具备结合型或游离型凝固酶活性,符合食品级微生物安全性要求,可排除溶血毒素或感染性血栓风险。
2.2.3 产生物胺能力
由表5可知,M1、M7、M12、M40和M42 5 株乳酸菌均未表现出产生物胺能力,可有效避免组胺、酪胺等生物胺的积累风险。
表5 菌株M1、M7、M12、M40和M42产生物胺实验结果
Table 5 Experimental results of amine production by strains M1, M7,M12, M40 and M42
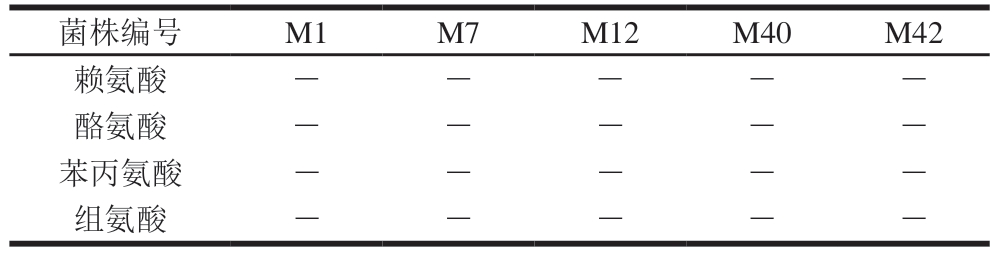
菌株编号M1M7M12M40M42赖氨酸-----酪氨酸-----苯丙氨酸-----组氨酸-----
2.2.4 抗生素敏感性
由表6可知,M7、M12、M42 3 株乳酸菌对四环素表现出耐药性(抑菌圈直径<14 mm),这种耐药性可能与tet基因介导的主动外排机制相关[35-36],存在潜在基因水平转移风险,不能作为目的菌株。相比之下,M1仅对克林霉素表现出耐药性,M40对万古霉素和多黏菌素B表现出耐药性,不存在普遍耐药性,且对四环素敏感,符合食品发酵菌株对抗生素敏感的要求。综合耐药性与代谢安全性评估结果,确定M1与M40作为后续发酵特性研究的目的菌株。
表6 菌株M1、M7、M12、M40和M42的抗生素敏感性
Table 6 Antibiotic susceptibility of strains M1, M7, M12, M40 and M42
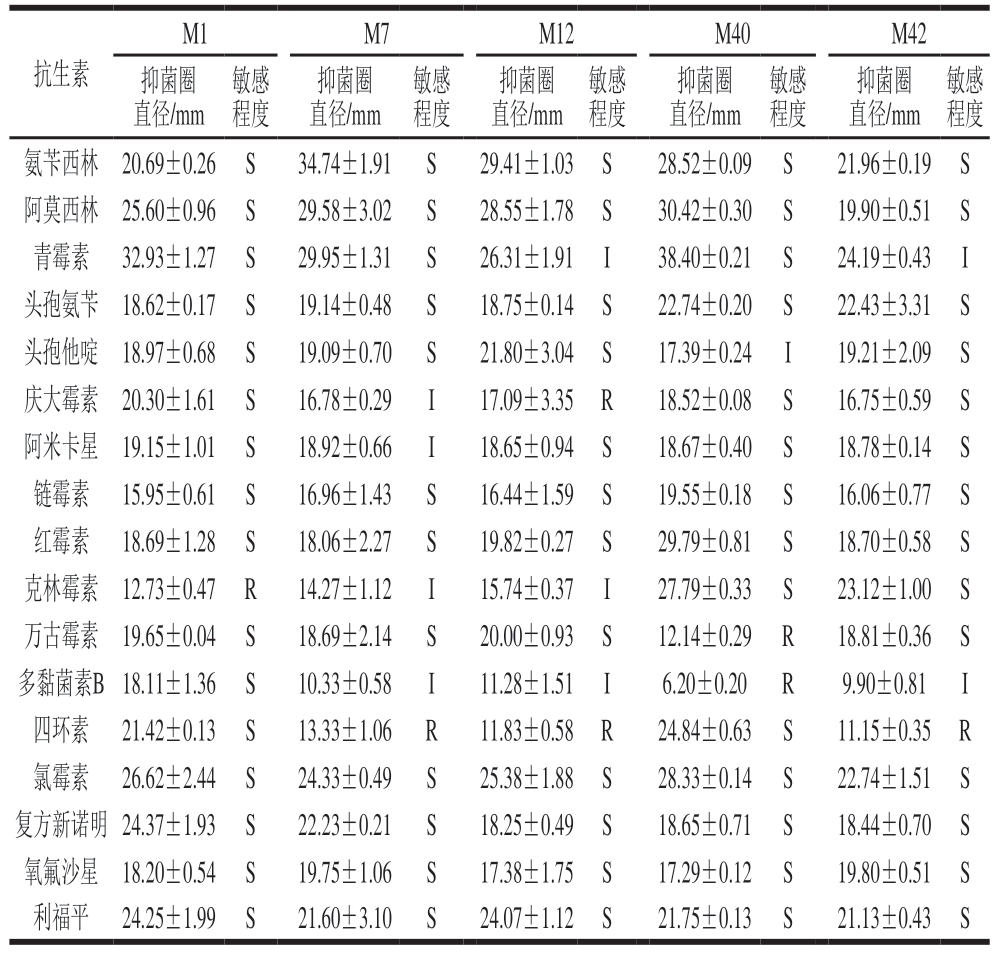
M1M7M12M40M42抑菌圈直径/mm抗生素敏感程度氨苄西林20.69±0.26S34.74±1.91S29.41±1.03S28.52±0.09S21.96±0.19S阿莫西林25.60±0.96S29.58±3.02S28.55±1.78S30.42±0.30S19.90±0.51S青霉素32.93±1.27S29.95±1.31S26.31±1.91I38.40±0.21S24.19±0.43I头孢氨苄18.62±0.17S19.14±0.48S18.75±0.14S22.74±0.20S22.43±3.31S头孢他啶18.97±0.68S19.09±0.70S21.80±3.04S17.39±0.24I19.21±2.09S庆大霉素20.30±1.61S16.78±0.29I17.09±3.35R18.52±0.08S16.75±0.59S阿米卡星19.15±1.01S18.92±0.66I18.65±0.94S18.67±0.40S18.78±0.14S链霉素15.95±0.61S16.96±1.43S16.44±1.59S19.55±0.18S16.06±0.77S红霉素18.69±1.28S18.06±2.27S19.82±0.27S29.79±0.81S18.70±0.58S克林霉素12.73±0.47R14.27±1.12I15.74±0.37I27.79±0.33S23.12±1.00S万古霉素19.65±0.04S18.69±2.14S20.00±0.93S12.14±0.29R18.81±0.36S多黏菌素B18.11±1.36S10.33±0.58I11.28±1.51I6.20±0.20R9.90±0.81I四环素21.42±0.13S13.33±1.06R11.83±0.58R24.84±0.63S11.15±0.35R氯霉素26.62±2.44S24.33±0.49S25.38±1.88S28.33±0.14S22.74±1.51S复方新诺明24.37±1.93S22.23±0.21S18.25±0.49S18.65±0.71S18.44±0.70S氧氟沙星18.20±0.54S19.75±1.06S17.38±1.75S17.29±0.12S19.80±0.51S利福平24.25±1.99S21.60±3.10S24.07±1.12S21.75±0.13S21.13±0.43S敏感程度抑菌圈直径/mm敏感程度抑菌圈直径/mm敏感程度抑菌圈直径/mm敏感程度抑菌圈直径/mm
2.3 菌株生长性能
2.3.1 菌株生长曲线
由图2可知,菌株M1与M40均呈现典型的三阶段生长模式:延滞期(0~4 h):菌株快速完成环境适应性调整与代谢激活,表明其具备高效的环境响应机制(如pH值调节、营养摄取系统启动)。较短的延滞期(<5 h)提示菌株可快速进入增殖状态,为缩短发酵周期提供生物学基础。对数生长期(M1:4~12 h、M40:4~14 h):M1生长速率明显快于M40,推测与菌株能量代谢通路(如糖酵解效率)或关键酶(如ATP酶、乳酸脱氢酶)活性差异有关;而M40的延长对数期(14 h)可能与其碳源偏好性(如优先分解复杂碳水化合物)或次级代谢产物(如胞外多糖)合成需求有关,具体机制还需进一步验证。稳定期(M1:>12 h、M40:>14 h):生物量达到峰值时,菌体进入代谢产物合成活跃期。此阶段,由于营养物质消耗(如碳源、氮源不足)、代谢产物(如乳酸、乙酸等有机酸)积累,环境pH值显著下降,菌株开始合成细菌素、抗氧化分子等应激物质或糖原等储存性物质,以应对环境压力,12~14 h对应发酵过程中菌株功能活性的关键作用时间窗口[37]。比较分析显示,M1因其快速产酸特性(对数期短、酸度提升快),更适用于短周期发酵食品(如泡菜、酸乳)的生产优化,具备工业化适配性,而M40的代谢特性可能更适合需要延长发酵周期以提升风味复杂度的发酵肉制品开发。
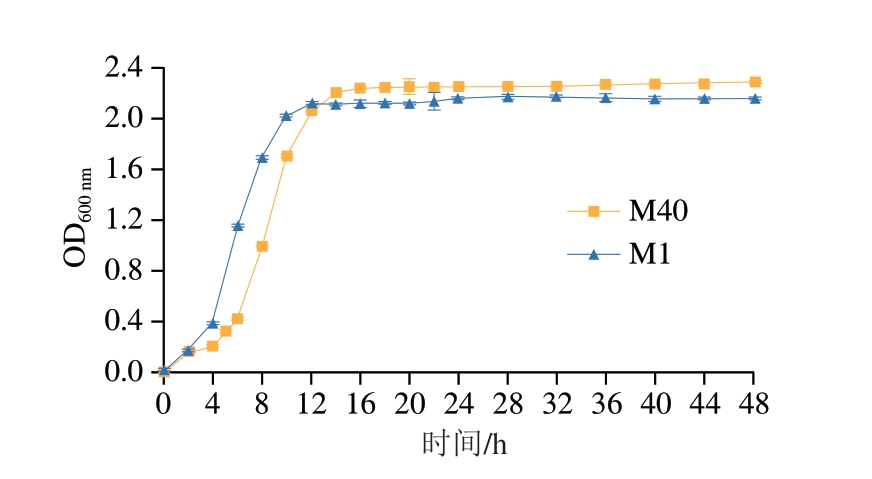
图2 菌株M1与M40的生长曲线
Fig. 2 Growth curves of strains M1 and M40
2.3.2 不同pH值下菌株的生长能力
在传统发酵肉制品(如酸肉、发酵香肠)的成熟过程中,乳酸菌主导的产酸代谢活动会使体系pH值从初始6.0左右逐步降至4.5~5.5,此动态酸化过程对发酵剂菌株的耐酸性能提出双重要求[38]:一方面,需在低pH值环境中保持代谢活性[13],另一方面,需通过持续产酸抑制腐败菌和致病菌生长与增殖。乳酸菌的耐酸性与其细胞膜完整性、质子泵活性[39]及应激蛋白合成能力[40]密切相关,这些特性直接影响菌株在终产品中的功能稳定性。如图3所示,菌株M1和M40在pH 2~6范围内均表现出一定的环境适应能力。当pH值降至3时,2 株乳酸菌的OD600 nm仍稳定在1.0以上。即使在pH 2的极端酸性条件下,菌株M1与M40仍具有较好的耐酸性,表明其具备对抗酸胁迫的生理基础。
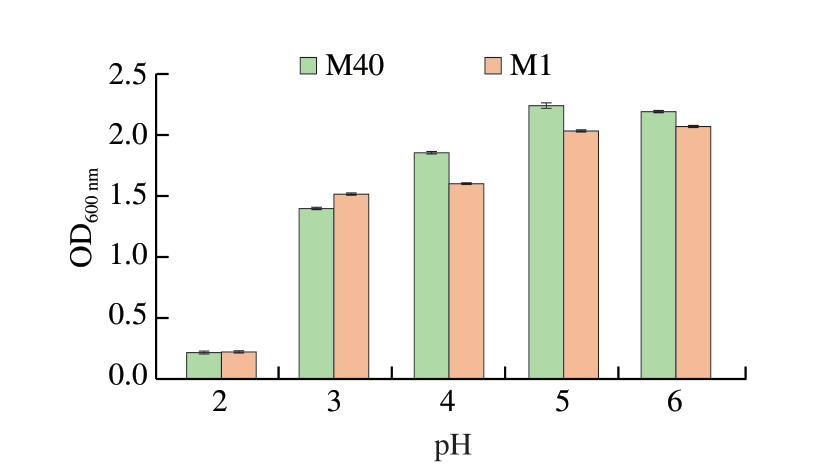
图3 菌株M1与M40在不同pH值下的生长情况
Fig. 3 Growth status of strains M1 and M40 under different pHs
基于上述特性,菌株M1与M40均符合肉制品发酵剂的核心筛选标准:具有耐盐性(6% NaCl)、亚硝酸盐耐受性(150 mg/kg)及耐酸性(pH 3),无溶血活性、凝固酶阴性及多重抗生素敏感性,符合FAO/WHO食品安全规范,适用于酸肉发酵产品开发。
2.3.3 菌株抑菌活性
在肉制品发酵剂筛选中,菌株对食源性致病菌的抑制能力是保障发酵肉制品生物安全性的关键指标。如表7所示,菌株M1和M40对3 种指示菌均具有抑制作用,其中M1无细胞上清液对金黄色葡萄球菌ATCC 29213的抑制圈直径显著大于M40(P<0.05),而两者对2 种革兰氏阴性菌(大肠杆菌ATCC 25922、沙门氏菌ATCC 13311)的抑制效果无显著差异(P>0.05)。从作用机制分析,虽然多数乳酸菌属可通过分泌有机酸抑制革兰氏阳性菌生长,但菌株M1和M40对革兰氏阴性菌的抑制活性提示两者可能具备合成其他抗菌活性成分(如细菌素等)的代谢特性,具体作用物质还需通过蛋白组学或代谢组学技术深入解析。
表7 菌株M1与M40对3 种指示菌的抑菌效果
Table 7 Bacteriostatic effects of strains M1 and M40 on three indicator bacteria
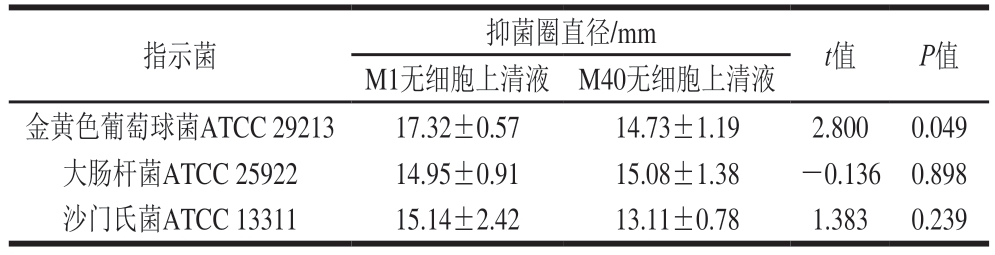
指示菌抑菌圈直径/mmt值P值M1无细胞上清液M40无细胞上清液金黄色葡萄球菌ATCC 2921317.32±0.5714.73±1.192.8000.049大肠杆菌ATCC 2592214.95±0.9115.08±1.38-0.1360.898沙门氏菌ATCC 1331115.14±2.4213.11±0.781.3830.239
2.3.4 香辛料耐受性
在肉类发酵加工过程中,香辛料作为关键辅料不仅具有风味修饰功能,还能有效抑制有害微生物生长[24,27]。针对后续牦牛肉等特色发酵肉制品的开发需求(常规添加量:辣椒7.5%~10%、生姜2.5%~5%、花椒1%~2%,V/V),本研究着重筛选对香辛料成分具有较强适应性的菌株。由表8可知,菌株M1在香辛料提取液最大添加量(辣椒10%、生姜5%、花椒2%)的培养基中仍能保持稳定的生长活性,而M40菌株对辣椒和花椒提取液表现出明显的敏感性。这种耐受性差异可能与菌株M1独特的细胞膜结构特性(如脂质组成)及其应激相关基因(外排泵系统、抗氧化酶合成等)活跃程度有关[41]。鉴于传统肉制品加工工艺中辣椒和花椒的普遍应用,菌株M1因其优良的香辛料抗性,更适合作为肉制品发酵剂应用于后续目的菌研究。
表8 菌株M1与M40在不同香辛料提取液下的生长情况(OD600 nm)
Table 8 Growth status (OD600 nm) of strains M1 and M40 in the presence of different spice extracts

编号0%辣椒提取液生姜提取液花椒提取液7.5%10%2.5%5%1%2%菌株M402.265±0.001.404±0.000.818±0.002.023±0.011.981±0.011.777±0.081.443±0.02 M12.178±0.071.972±0.011.944±0.002.100±0.101.943±0.022.153±0.052.093±0.00
2.4 目标菌株鉴定结果
2.4.1 形态学鉴定结果
如图4所示,菌株M1形成直径约1.0 mm的圆形菌落,呈现乳白色,菌落形态凸起且表面光滑,正反面颜色均一,质地不透明,挑取时未呈现黏丝现象。革兰氏染色结果显示,菌体呈现典型紫色染色反应,确认为革兰氏阳性菌。显微镜下观察可见其细胞形态为两端圆钝的直杆状,以单细胞形式存在,未观察到芽孢结构。
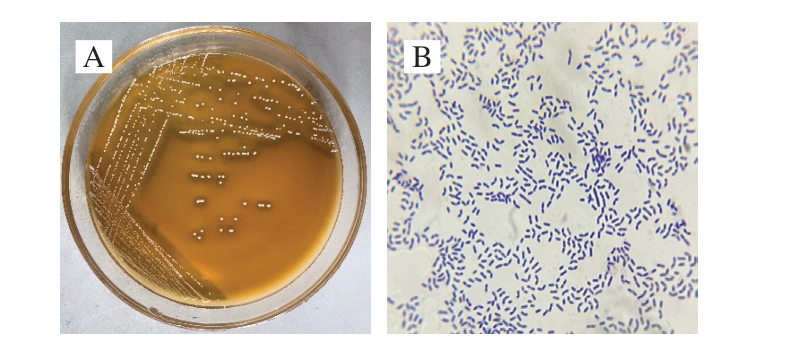
图4 菌落M1形态特征(A)及革兰氏染色结果(B)
Fig. 4 Colony morphology (A) and Gram staining results (B) of strain M1
2.4.2 生理生化鉴定结果
如表9所示,菌株M1在碳水化合物发酵模式、细胞壁组成及代谢产物等关键指标中均呈现出乳杆菌属微生物的典型性状特征。基于形态学与生理生化双验证原则,可判定菌株M1在属级分类单元中归属于乳杆菌属。
表9 菌株M1的生理生化特征
Table 9 Physiological and biochemical characteristics of strain M1
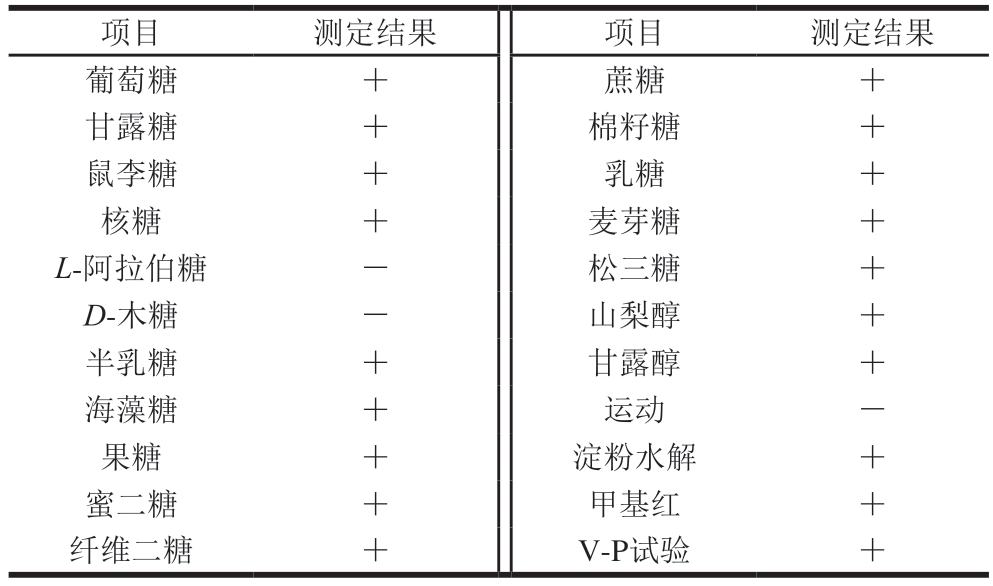
项目测定结果项目测定结果葡萄糖+蔗糖+甘露糖+棉籽糖+鼠李糖+乳糖+核糖+麦芽糖+L-阿拉伯糖-松三糖+D-木糖-山梨醇+半乳糖+甘露醇+海藻糖+运动-果糖+淀粉水解+蜜二糖+甲基红+纤维二糖+V-P试验+
2.4.3 分子生物学鉴定结果
如图5所示,菌株M1的16S rDNA PCR扩增产物在1 500 bp呈现单一特异性条带,其片段大小与理论预期值吻合,表明纯化结果良好,片段大小与乳杆菌属菌株基本一致。
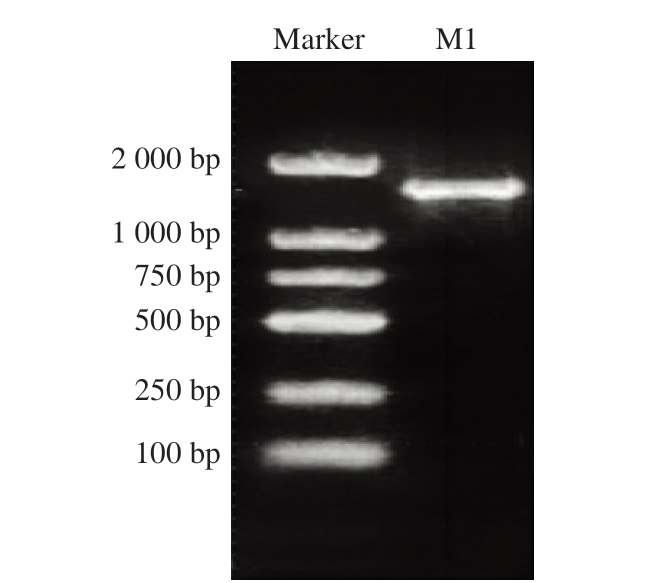
图5 菌株M1的16S rDNA PCR扩增产物琼脂糖凝胶电泳图
Fig. 5 Agarose gel electropherogram of polymerase chain reaction amplified 16S rDNA from strain M1
由图6可知,菌株M1的16S rDNA测序结果与植物乳植杆菌LAB-12、植物乳植杆菌7071序列呈现100%一致性。结合菌体形态观察与生理生化结果,最终鉴定M1为植物乳植杆菌。
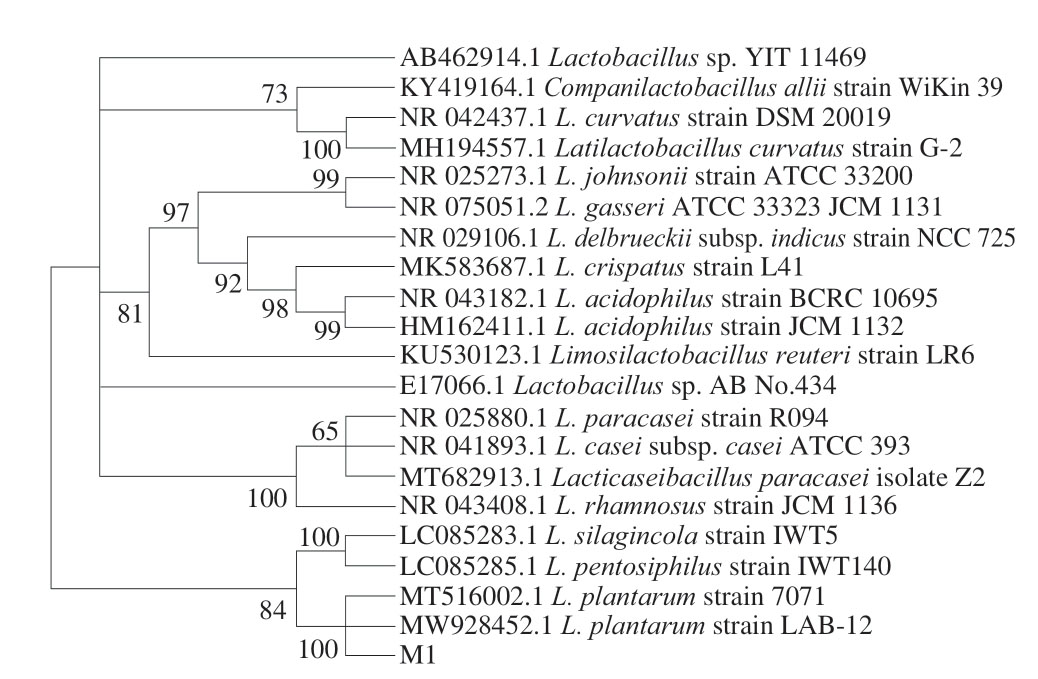
图6 菌株M1系统发育树
Fig. 6 Phylogenetic tree of strain M1
3 结论
本研究以湘西侗族传统家庭发酵酸肉为研究对象,通过产酸能力、发酵特性、安全性、生长性能多维度筛选,从48 株初筛菌株中成功分离获得性能优良的乳酸菌株M1。该菌株展现出显著的产酸优势(发酵24 h培养液pH值降至3.85±0.02)、环境适应性(耐受6% NaCl、150 mg/kg亚硝酸盐及香辛料)和安全性(无溶血活性、凝固酶阴性、无生物胺生成及抗生素敏感谱符合食品级标准)。通过形态学与分子生物学鉴定证实M1为植物乳植杆菌,该菌株的优异性能不仅为传统发酵肉制品的标准化生产提供了优质发酵剂候选,也为民族特色微生物资源的保护与可持续利用提供了理论依据,可推动传统食品从经验型工艺向科学化生产转型。
[1] 高熳熳, 焦新雅, 张志胜, 等. 侗族传统发酵酸肉中乳酸菌的筛选、发酵特性及安全性分析[J]. 食品工业科技, 2020, 41(12): 94-99; 105.DOI:10.13386/j.issn1002-0306.2020.12.015.
[2] MI R F, CHEN X, XIONG S Y, et al. Predominant yeasts in Chinese Dong fermented pork (Nanx Wudl) and their aroma-producing properties in fermented sausage condition[J]. Food Science and Human Wellness, 2021, 10(2): 231-240. DOI:10.1016/J.FSHW.2021.02.013.
[3] 孔保华, 李悦欣, 张欢, 等. 乳酸菌抗氧化活性及其在发酵肉制品中的应用研究进展[J]. 肉类研究, 2022, 36(10): 35-42. DOI:10.7506/rlyj1001-8123-20220801-089.
[4] ZHONG A A, CHEN W, DUAN Y F, et al. The potential correlation between microbial communities and flavors in traditional fermented sour meat[J]. LWT-Food Science and Technology, 2021, 149: 111873.DOI:10.1016/j.lwt.2021.111873.
[5] 陈援援, 刘文秀, 马凯华, 等. 接种乳酸菌发酵剂对风干肠成熟过程中微生物群落动态变化及感官品质的影响[J]. 肉类研究, 2022,36(2): 1-8. DOI:10.7506/rlyj1001-8123-20210827-208.
[6] 韩竞旭, 邢路娟, 张万刚. 贵州侗族酸肉中优质发酵菌株的筛选及鉴定[J]. 食品与发酵工业, 2023, 49(10): 85-90. DOI:10.13995/j.cnki.11-1802/ts.033010.
[7] 杜斌, 韦曾传, 汪肖, 等. 侗族传统酸鱼中降亚硝酸盐乳酸菌的筛选、鉴定及其在发酵香肠中的应用[J]. 食品科技, 2020, 45(1): 23-28. DOI:10.13684/j.cnki.spkj.2020.01.005.
[8] 湛剑龙. 贵州侗族酸鱼、酸肉中抗氧化乳酸菌的筛选与优化[D].贵阳: 贵州大学, 2015.
[9] 张新斌, 胡炜东, 李君冉, 等. 植物乳杆菌对发酵肉制品风味影响研究进展[J]. 肉类研究, 2023, 37(9): 70-75. DOI:10.7506/rlyj1001-8123-20230529-052.
[10] 娄利娇, 胡萍, 湛剑龙, 等. 分离自贵州侗族苗族发酵肉中两株乳酸菌的耐受特性分析[J]. 中国酿造, 2015, 34(11): 126-130.DOI:10.11882/j.issn.0254-5071.2015.11.029.
[11] 张玉龙, 胡萍, 王晓宇, 等. 侗族酸肉中抗氧化乳酸菌的耐受性及功能特性[J]. 生物加工过程, 2016, 14(6): 35-40. DOI:10.3969/j.issn.1672-3678.2016.06.007.
[12] LIU J G, LIN C X, ZHANG W, et al. Exploring the bacterial community for starters in traditional high-salt fermented Chinese fish (Suanyu)[J]. Food Chemistry, 2021, 358: 129863. DOI:10.1016/j.foodchem.2021.129863.
[13] 马彩霞. 牦牛发酵乳细菌菌群多样性及益生性乳酸菌筛选应用研究[D]. 兰州: 甘肃农业大学, 2022: 21-34. DOI:10.27025/d.cnki.ggsnu.2022.000219
[14] CHEN X, LI J P, ZHOU T, et al. Two efficient nitrite-reducing Lactobacillus strains isolated from traditional fermented pork(Nanx Wudl) as competitive starter cultures for Chinese fermented dry sausage[J]. Meat Science, 2016, 121: 302-309. DOI:10.1016/j.meatsci.2016.06.007.
[15] ZHAO X, FENG J Y, LAGHI L, et al. Characterization of flavor profile of “Nanx Wudl” sour meat fermented from goose and pork using gas chromatography-ion mobility spectrometry (GC-IMS) combined with electronic nose and tongue[J]. Foods, 2023, 12(11): 2194.DOI:10.3390/foods12112194.
[16] HAO M, WANG W, ZHANG J M, et al. Flavour characteristics of fermented meat products in China: a review[J]. Fermentation, 2023,9(9): 830. DOI:10.3390/fermentation9090830.
[17] 钟嫒嫒, 陈伟, 段雨帆, 等. 固相微萃取-气相色谱-质谱联用法测定传统酸肉发酵过程中特征挥发性成分[J]. 肉类研究, 2021, 35(9):20-26. DOI:10.7506/rlyj1001-8123-20210514-132.
[18] 国家质量监督检验检疫总局. 肉与肉制品 取样方法: GB/T 9695.19—2008[S]. 北京: 中国标准出版社, 2008.
[19] 凌代文. 乳酸细菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 199: 6-16; 85.
[20] 高芳, 包亚莉, 华晓青, 等. 乳酸菌对发酵肉制品抑菌作用及风味特征的影响研究进展[J]. 食品科学, 2023, 44(9): 194-201.DOI:10.7506/spkx1002-6630-20220411-116.
[21] 孟丹, 王丽群, 谢国梁, 等. 一株乳酸乳球菌产γ-氨基丁酸能力及其安全性评价[J]. 中国酿造, 2017, 36(4): 72-77. DOI:10.11882/j.issn.0254-5071.2017.04.016.
[22] BOVER-CID S, HOLZAPFEL W H. Improved screening procedure for biogenic amine production by lactic acid bacteria[J]. International Journal of Food Microbiology, 1999, 53(1): 33-41. DOI:10.1016/s0168-1605(99)00152-x.
[23] TURCHI B, MANCINI S, FRATINI F, et al. Preliminary evaluation of probiotic potential of Lactobacillus plantarum strains isolated from Italian food products[J]. World Journal of Microbiology and Biotechnology, 2013, 29(10): 1913-1922. DOI:10.1007/s11274-013-1356-7.
[24] Clinical and Laboratory Standards Institute. CLSI M100 performance standards for antimicrobial susceptibility testing[S]. 2025. https://clsi.org/shop/standards/m100/.
[25] 黄仁慧. 植物乳杆菌ZDY2013的益生性、酸应激机制和对小鼠肠道菌群影响的研究[D]. 南昌: 南昌大学, 2016. DOI:10.7666/d.D01054561.
[26] 曾雪峰. 淡水鱼发酵对酸鱼品质影响的研究[D]. 无锡: 江南大学,2013.
[27] 布坎南 R E. 伯杰细菌鉴定手册[M]. 北京: 科学出版社, 1984.
[28] 东秀珠. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 419.
[29] NEDIANI M, GARCÍA L, SAAVEDRA L, et al. Adding value to goat meat: biochemical and technological characterization of autochthonous lactic acid bacteria to achieve high-quality fermented sausages[J]. Microorganisms, 2017, 5(2): 26. DOI:10.3390/microorganisms5020026.
[30] 国家市场监督管理总局, 国家卫生健康委员会. 食品安全国家标准食品添加剂使用标准: GB 2760—2024[S]. 北京: 中国标准出版社,2024.
[31] LEROY F, VUYST D L. Lactic acid bacteria as functional starter cultures for the food fermentation industry[J]. Trends in Food Science &Technology, 2004, 15(2): 67-78. DOI:10.1016/j.tifs.2003.09.004.
[32] 罗强, 张明, 刘巧, 等. 产细菌素屎肠球菌SC-Y112的体外益生性及安全性评价[J]. 食品科学, 2021, 42(11): 154-160. DOI:10.7506/spkx1002-6630-20200602-025.
[33] GÖK CHARYYEV M, ÖZDEN TUNCER B, AKPINAR KANKAYA D,et al. Bacteriocinogenic properties and safety evaluation of Enterococcus faecium YT52 isolated from boza, a traditional cereal based fermented beverage[J]. Journal of Consumer Protection and Food Safety, 2019, 14(1): 41-53. DOI:10.1007/s00003-019-01213-9.
[34] PERES C M, ALVES M, HERNANDEZ-MENDOZA A, et al. Novel isolates of lactobacilli from fermented Portuguese olive as potential probiotics[J]. LWT-Food Science and Technology, 2014, 59(1): 234-246. DOI:10.1016/j.lwt.2014.03.003.
[35] COMUNIAN R, DAGA E, DUPRÉ I, et al. Susceptibility to tetracycline and erythromycin of Lactobacillus paracasei strains isolated from traditional Italian fermented foods[J]. International Journal of Food Microbiology, 2009, 138(1/2): 151-156. DOI:10.1016/j.ijfoodmicro.2009.11.018.
[36] THUMU S C R, HALAMI P M. Presence of erythromycin and tetracycline resistance genes in lactic acid bacteria from fermented foods of Indian origin[J]. Antonie van Leeuwenhoek, 2012, 102(4):541-551. DOI:10.1007/s10482-012-9749-4.
[37] FRÉDÉRIC LEROY, VERLUYTEN J, VUYST L D. Functional meat starter cultures for improved sausage fermentation[J]. International Journal of Food Microbiology, 2006, 106(3): 270-285. DOI:10.1016/j.ijfoodmicro.2005.06.027.
[38] 褚福娟, 孔保华, 黄永. 发酵肉制品常见乳酸菌的发酵性能研究[J].肉类研究, 2009, 23(6): 16-20. DOI:10.7506/rlyj1001-8123-200906003.
[39] 赵小茜, 魏旭丹, 陈戴玲, 等. 乳酸菌耐酸耐胆盐机制研究进展[J].乳业科学与技术, 2017, 40(3): 33-36. DOI:10.15922/j.cnki.jdst.2017.03.008.
[40] HAMON E, HORVATOVICH P, MARCHIONI E, et al. Investigation of potential markers of acid resistance in Lactobacillus plantarum by comparative proteomics[J]. Journal of Applied Microbiology, 2014,116(1): 134-144. DOI:10.1111/jam.12339.
[41] 张婷, 李晓, 许航, 等. 天然复合香辛料对低盐四川泡菜内微生物菌系的影响研究[J]. 中国调味品, 2018, 43(8): 17-21. DOI:10.3969/j.issn.1000-9973.2018.08.005.