动物屠宰后,骨骼肌细胞经历多种程序性死亡过程,包括坏死、凋亡、焦亡和自噬等[1]。铁死亡作为一种新型细胞死亡模式,在形态学和生物化学特征上区别于其他细胞死亡模式[2]。形态学上,铁死亡细胞表现为线粒体体积缩小、膜密度增加及嵴减少或消失;生物化学特征上,还原型谷胱甘肽(glutathione,GSH)耗竭、谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)4活性下降,导致脂质氧化物无法通过GPX4介导的GSH还原反应代谢消除[3]。过载的亚铁离子通过芬顿反应催化脂质氧化,生成大量脂质活性氧(lipid reactive oxygen species,L-ROS),驱动细胞铁死亡发生。此外,过量ROS与机体抗氧化能力失衡通过引发机体氧化应激[4]导致细胞膜和细胞器膜上的多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)等脂质组分发生过度氧化,进一步促进自由基链式反应,加剧脂质氧化作用,影响宰后肉品质[5]。
生产环节中,肉鸡饲料选择对宰后肉品质形成具有重要影响。发酵技术作为一种经济、有效的方法,能够有效提升非常规饲料成分的营养价值[6]、减少贮藏过程中干物质和营养成分损失,进而改善动物生长性能和饲料利用率[7]。生物发酵饲料是通过乳酸菌、芽孢杆菌、酵母菌等有益微生物与酶制剂单独或联合作用于饲料原料,经充分发酵处理制成的创新、环保且安全的饲料产品[8]。发酵过程中,益生菌在饲料中占据主导地位,其代谢产物能够降低饲料pH值、抑制有害微生物生长、消除过敏原和抗营养因子,从而提升饲料的适口性与安全性[7,9-10]。李龙等[11]利用混合菌株发酵肉鸡全价饲料时发现,添加10%和15%发酵全价料能提高肉鸡生长性能和养分利用率,并能改善肉鸡肠道微生态。此外,发酵饲料还能提高肉鸡屠宰率、降低腹脂率,改善鸡肉色泽与保水性等品质指标[12]。
前期研究[8]显示,添加5.0%生物发酵饲料能改善肉鸡肠道菌群结构,有助于产短链脂肪酸细菌富集。特别是添加2.5%生物发酵饲料能显著提升21 日龄和42 日龄肉鸡的生长性能和肉品质[13]。铁死亡过程中,铁稳态失衡、氧化还原失调及脂质过氧化均可能对肉品色泽、持水能力、嫩度等品质造成影响[14]。然而,目前关于发酵饲料对宰后骨骼肌细胞铁死亡的调控机制尚未明确。张艾珈等[15]发现,向基础日粮中添加7.5%益生菌混合发酵饲料可显著影响宰后鸭肉成熟过程中的pH值和肉色变化;张露露等[16]证实在基础日粮中添加10%元宝枫叶富硒发酵物能提高鸡肉保水能力、蛋白质和脂肪含量。然而,更高比例生物发酵饲料的添加对黄羽肉鸡胸肉品质的影响尚不明确。因此,本研究拟解析基础饲料中添加7.5%生物发酵饲料对黄羽肉鸡宰后成熟过程中骨骼肌铁死亡及肉品质的影响,以期为构建基于铁死亡调控的肉质改良新策略提供理论支撑,同时为开发和拓展改善鸡肉品质的饲料添加剂提供理论依据和实践指导。
1 材料与方法
1.1 材料与试剂
60 只41 日龄雄性黄羽肉鸡(体质量1.1~1.3 kg)由宣城木子禽业专业合作社提供。
乳酸菌、酵母菌、芽孢杆菌 株洲智荟生物科技有限公司;甘氨酸(glycine,Gly) 上海阿拉丁生化科技股份有限公司;吐温-20、十二水合磷酸氢二钠、氯化钠、氢氧化钠 广东光华科技股份有限公司;盐酸、甲醇 国药集团化学试剂有限公司;磷酸二氢钾、磷酸氢二钾 天津科密欧化学试剂有限公司;聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜(孔径0.45 μm)德国Millipore公司;氯化钾 西陇科学股份有限公司;三羟甲基氨基甲烷(tris(hydroxymethyl)aminomethane,Tris)、十二烷基磺酸钠(sodium dodecyl sulfate,SDS)上海科雅生物科技有限公司;BODIPY 581/591 C11荧光染料 美国Thermo Fisher Scientific公司;亚铁离子比色法检测试剂盒 北京绿源伯德生物科技有限公司;GSH含量检测试剂盒 北京索莱宝科技有限公司;2.5%戊二醛固定液(电镜专用) 上海源叶生物科技有限公司;脂质氧化(丙二醛(malondialdehyde,MDA))检测试剂盒、Western及IP细胞裂解液、BCA蛋白浓度测定试剂盒、特超敏ECL化学发光试剂盒(BeyoECL Star)上海碧云天生物技术股份有限公司;CD71(H68.4)抗体 圣克鲁斯生物技术(上海)有限公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记亲和山羊抗小鼠IgG(H+L)、HRP标记亲和山羊抗兔IgG(H+L)武汉三鹰生物技术有限公司;GPX4兔多克隆抗体成都正能生物技术有限责任公司;环保型GD肌肉固定液、抗TfR1小鼠单克隆抗体、HRP标记山羊抗小鼠IgG武汉赛维尔生物科技有限公司。
1.2 仪器与设备
Biofugestratos高速离心机 德国Heraeus公司;T25高速匀浆机 德国IKA公司;VE-186转移电泳槽、VE-180微型垂直电泳槽、Tanon-1600全自动凝胶成像分析仪 上海天能科技有限公司; Synergy 2多功能酶标仪 美国BioTek公司;UniCenMR台式冷冻离心机 英国Herolab公司;CR400色差仪 日本Minolta公司;206-pH2-pH酸碱度/温度测量仪 德国Testo公司;C-LM3B数显式肌肉嫩度仪 东北农业大学工程学院;Eclipse C1正置荧光显微镜 日本尼康公司;HT78003透射电子显微镜 日本Hitachi公司。
1.3 方法
1.3.1 实验设计
60 只黄羽肉鸡随机分为基础饲料组和发酵饲料组(基础饲料+7.5%生物发酵饲料),2 组实验均设置5 组重复,每个重复6 只,肉鸡采用网上平养模式,自由饮水和采食,实验期31 d。生物发酵饲料由发酵菌种与发酵底物均匀混合发酵制成,发酵底物由30%(m/m,下同)玉米+20%麸皮+20%豆粕+30%水组成,发酵菌种由乳酸菌、酵母菌和芽孢杆菌按照1∶1∶1(m/m)混合而成[8]。基础饲料和发酵饲料原料组成与营养水平见表1、2。
表1 基础饲料原料组成与营养水平(风干基础)
Table 1 Composition and nutrient levels of basal diet (on an air-dry basis)
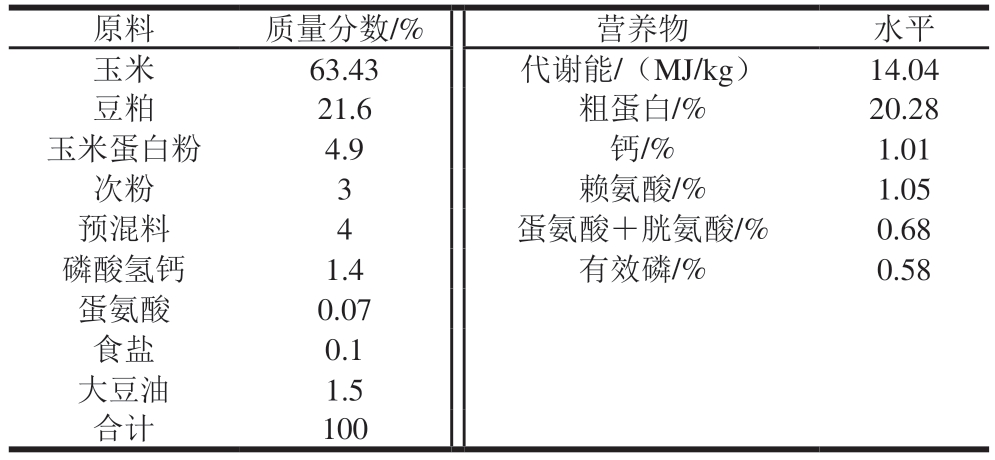
注:代谢能、赖氨酸、蛋氨酸+胱氨酸为计算值,其他为测定值;预混料每千克提供VD 8 500 IU、VA 11 000 IU、VE 18 IU、VK3 140 mg、VB1 100 mg、VB2 700 mg、VB6 320 mg、VB12 10 mg、烟酸3 g、泛酸钙16 mg、叶酸55 mg、生物素4 mg、铁(FeSO4)60 mg、铜(CuSO4)5 mg、锌(ZnSO4)65 mg、锰(MnSO4)110 mg、碘(KI)1.1 mg、硒(Na2SeO3)0.15 mg。
原料质量分数/%营养物水平玉米63.43代谢能/(MJ/kg)14.04豆粕21.6粗蛋白/%20.28玉米蛋白粉4.9钙/%1.01次粉3赖氨酸/%1.05预混料4蛋氨酸+胱氨酸/%0.68磷酸氢钙1.4有效磷/%0.58蛋氨酸0.07食盐0.1大豆油1.5合计100
表2 饲料发酵前后微生物菌落数和营养水平
Table 2 Microbial counts and nutrient levels of feed before and after fermentation
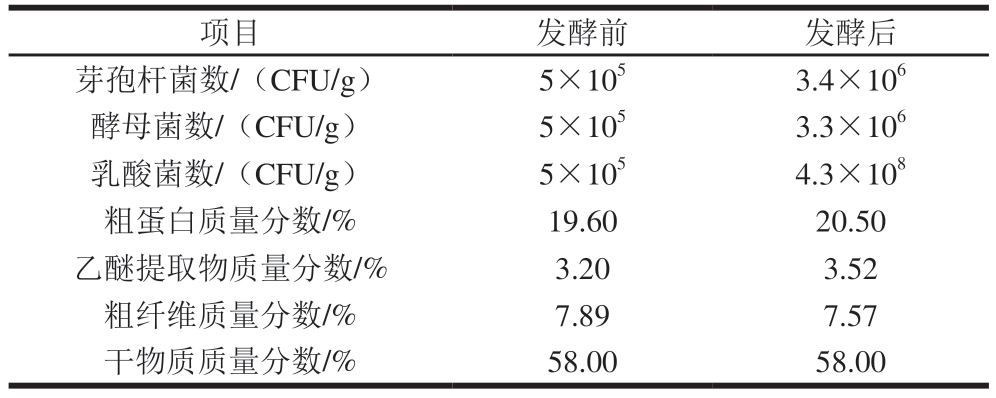
项目发酵前发酵后芽孢杆菌数/(CFU/g)5×1053.4×106酵母菌数/(CFU/g)5×1053.3×106乳酸菌数/(CFU/g)5×1054.3×108粗蛋白质量分数/%19.6020.50乙醚提取物质量分数/%3.203.52粗纤维质量分数/%7.897.57干物质质量分数/%58.0058.00
1.3.2 样品处理
每组重复随机选取1 只健康黄羽肉鸡宰杀放血后取新鲜鸡胸肉,剔除表面筋膜、脂肪和结缔组织,置于保鲜盒内于4 ℃成熟,于成熟6、12、18、24、32 h取样并测定相应指标,用于免疫荧光染色、蛋白免疫印迹实验的样品液氮速冻后贮藏于-80 ℃,待测。
1.3.3 鸡肉品质指标测定
1.3.3.1 pH值和色泽测定
使用插入式pH计测定肉块不同部位pH值,重复测定3 次,取平均值。使用校正后的色差仪测定肉块亮度值(L*)、红度值(a*)和黄度值(b*)[17],重复测定3 次,取平均值。
1.3.3.2 蒸煮损失率测定
将在4 ℃成熟的鸡肉块取出并擦干表面汁液,称质量(m1/g),85 ℃水浴加热至肉块中心温度达75 ℃,待冷却至室温后擦干表面汁液,称质量(m2/g)。蒸煮损失率按式(1)计算[18]:
1.3.3.3 剪切力测定
将熟肉块切成1.5 cm×1.5 cm×3 cm纤维方向一致、大小均匀的条状,采用嫩度仪测定肉块的剪切力[19],每个样品重复测定3 次,取平均值。
1.3.4 亚铁离子含量测定
采用亚铁离子比色法检测试剂盒测定鸡胸肉样品中的亚铁离子含量,参照试剂盒说明书并作适当修改。按匀浆液质量的9%加入鸡胸肉组织,4 ℃、12 000×g离心10 min,取上清。以标准品为空白对照,分别向300 µL样品、标准品中加入150 µL工作液,37 ℃孵育10 min,再次离心并取300 µL上清液,593 nm波长处测定光密度(optical density,OD)。亚铁离子含量(以组织湿质量计算)按式(2)计算:
式中:a与b分别为标准曲线斜率与截距;∆OD=OD测定-OD空白;V为样品匀浆液加入体积/mL;f为样品稀释倍数;m为鸡胸肉组织湿质量/g。
1.3.5 免疫荧光染色
取0.8 cm×0.8 cm×1.2 cm的长方体鸡胸肉样品,采用环保型GD肌肉固定液固定24 h以上。固定完成后,修剪平整,依次脱水、浸蜡、石蜡包埋,制作切片。石蜡切片脱蜡漂洗后,采用乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)抗原修复缓冲液(pH 8.0)进行抗原修复,随后以磷酸盐缓冲液(phosphate buffer saline,PBS)(pH 7.4)漂洗。使用组化笔标记目标区域,向标记目标区域内滴加牛血清白蛋白封闭30 min。一抗为抗TfR1小鼠单克隆抗体,以1∶500稀释,4 ℃孵育过夜;二抗为HRP标记山羊抗小鼠IgG,以1∶500稀释,室温孵育50 min。PBS漂洗后,以4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)复染细胞核,猝灭组织自发荧光。最后,采用抗荧光猝灭封片剂封片,荧光显微镜拍照,阳性信号呈红色荧光。
1.3.6 蛋白免疫印迹
加入鸡胸肉样品10 倍体积的裂解液(Western及IP细胞裂解液、1 mmol/L苯甲磺酰氟(phenylmethanesulfonyl fluoride,PMSF)、0.1%(V/V)SDS),冰浴匀浆后4 ℃、12 000×g离心10 min取上清液。BCA蛋白浓度测定试剂盒测定并调整至统一浓度。配制12%分离胶和5%浓缩胶,进行SDS-聚丙烯酰胺凝胶电泳(SDSpolyacrylamide gel electrophoresis,SDS-PAGE)实验。电泳结束后,采用湿法转印蛋白(2.93 g Gly、5.82 g Tris、0.37 g SDS,加ddH2O至800 mL,再加入200 mL甲醇),转印电流400 mA、转印时间4 h。转印结束后,将PVDF膜浸没在封闭液中,室温封闭2 h,封闭液为1×Tris缓冲盐Tween洗涤缓冲液(Tris buffered saline tween,TBST)配制的5 g/100 mL脱脂奶粉。1×TBST(2.42 g Tris、8 g NaCl,加ddH2O至1 L,pH 7.6,加入1 mL吐温-20)漂洗3 次后,进行一抗孵育。在孵育盒内分别加入一抗CD71(H68.4)(按1∶500稀释)、GPX4兔多克隆抗体(按1∶500稀释)、GAPDH单克隆抗体(按1∶20 000稀释),4 ℃孵育过夜。1×TBST漂洗后,向孵育盒内分别加入二抗HRP标记亲和山羊抗小鼠IgG(H+L)、HRP标记亲和山羊抗兔IgG(H+L),均按1∶5 000稀释,室温孵育2 h(1×TBST配制的0.5 g/100 mL脱脂奶粉),1×TBST漂洗。使用BeyoECL Star处理后,于成像仪中曝光拍照。
1.3.7 L-ROS含量测定
将-80 ℃保存鸡胸肉样品剪修平整,用冷冻切片包埋剂(又称最佳切割温度化合物(optimal cutting temperature compound,OCT))进行速冻包埋。待OCT固化(呈白色、变硬化状态)后,切成8~10 μm的薄片并粘贴在载玻片上,-80 ℃保存备用。冰冻切片室温下复温后,控干水分,用组化笔标记目标区域。向标记目标区域加入5 µmol/L BODIPY 581/591 C11荧光染料[20],室温孵育20 min。PBS(pH 7.4)漂洗后以DAPI复染细胞核,采用抗荧光猝灭封片剂封片。处理好的玻片通过荧光显微镜进行图像采集。DAPI染色细胞核在紫外光激发下呈现蓝色荧光,而阳性信号显示为绿色荧光,采用ImageJ软件对绿色荧光强度进行半定量分析,L-ROS含量以相对荧光强度表示。
1.3.8 GSH含量测定
采用GSH含量检测试剂盒测定GSH含量。鸡胸肉样品与试剂1按1∶10(g/mL)混合,冰浴匀浆后,4 ℃、12 000×g离心10 min,取上清液。向样品、空白、标准品中分别加入试剂2和试剂3,混匀后常温静置2 min,再次离心并取200 µL上清液,于412 nm波长处测定吸光度,分别为A测定与A空白。GSH含量按式(3)计算,以组织质量(μg/g)计:
式中:ΔA=A测定-A空白;a与b分别为标准曲线的斜率与截距;m为样品质量/g。
1.3.9 MDA含量测定
参照脂质氧化(MDA)检测试剂盒说明书并作适当修改。按0.01 mol/L PBS的15%加入鸡胸肉样品,冰浴匀浆后,4 ℃、12 000×g离心10 min,取上清液0.1 mL,加入0.2 mL MDA检测工作液,100 ℃金属浴加热15 min,冷却至室温后再次离心,取200 µL上清液,532 nm波长处测定吸光度。结果以单位样品中MDA含量(nmol/g,湿基)表示。
1.3.10 线粒体形态观察
将鸡胸肉切成0.8 cm×0.8 cm×1.2 cm的长方体,经2.5%戊二醛(4 ℃预固定24 h)和1%(V/V)锇酸(室温避光后固定2 h)固定后,用0.1 mol/L磷酸缓冲液(pH 7.4)漂洗后依次采用30%、50%、70%、80%、95%、100%乙醇梯度脱水,使用丙酮和812包埋剂将样品包埋、聚合,用超薄切片机切成60~80 nm的薄片,染色后于透射电子显微镜下采集图像。
1.4 数据处理
结果以平均值±标准差表示。采用SPSS 26软件进行统计分析,P<0.05表示差异显著。组内比较采用单因素方差分析,多重比较采用Duncan检验;组间比较采用独立样本t检验,在95%置信区间内按具体分析排除个案。免疫荧光分析和蛋白免疫印迹灰度值均采用ImageJ软件进行定量分析。采用Origin 2021软件作图。
2 结果与分析
2.1 添加7.5%生物发酵饲料对鸡肉品质的影响
如表3所示,与基础饲料组相比,发酵饲料组鸡胸肉pH值降低(P>0.05),蒸煮损失率升高(P>0.05)。在肉胸肉色泽方面,发酵饲料组鸡胸肉表现出更高的L*(P>0.05),但a*(P<0.05)和b*(P<0.01)显著降低。此外,发酵饲料组鸡胸肉剪切力极显著降低(P<0.01),嫩度得到有效改善。
表3 添加7.5%生物发酵饲料对鸡胸肉品质的影响
Table 3 Effect of adding 7.5% bio-fermented feed on chicken meat quality
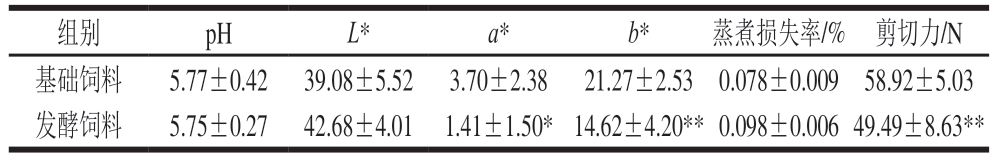
注:*.组间差异显著(P<0.05);**.组间差异极显著(P<0.01)。
组别pHL*a*b*蒸煮损失率/%剪切力/N基础饲料5.77±0.4239.08±5.523.70±2.3821.27±2.530.078±0.00958.92±5.03发酵饲料5.75±0.2742.68±4.011.41±1.50*14.62±4.20**0.098±0.00649.49±8.63**
2.2 添加7.5%生物发酵饲料对TfR1蛋白水平和亚铁离子含量的影响
TfR1作为铁死亡的特异性标志物,在调控细胞铁摄取和维持细胞内铁平衡方面发挥着关键作用[21]。由图1A~D可知,随着成熟时间的延长,基础饲料组TfR1蛋白水平呈现先减少后增加的趋势,且成熟后期蛋白水平显著高于前期(P<0.05)。相反,发酵饲料组TfR1蛋白水平呈先增加后减少的趋势,成熟32 h时蛋白水平仍显著高于成熟6 h(P<0.05)。值得注意的是,成熟初期,基础饲料组TfR1蛋白水平高于发酵饲料组,但随着成熟时间的延长,2 组TfR1蛋白水平交替上调,并在成熟末期趋于一致(P>0.05)。Feng Huizhong等[21]提出,铁死亡过程中质膜TfR1水平的上调可能是铁摄取停滞的正反馈机制。作为广泛表达于各种组织与器官的跨膜糖蛋白,TfR1通过促进铁摄取增加细胞内氧化还原活性铁库[22],进而促进铁死亡。由图1E可知,随着成熟时间的延长,2 组亚铁离子含量均呈逐渐升高趋势(P<0.05),这可能与TfR1介导的铁摄取持续进行有关。但2 组铁离子动态变化存在差异:基础饲料组的亚铁离子含量呈现先上升后下降的趋势(P<0.05),并于成熟18 h达到峰值;而发酵饲料组亚铁离子含量则持续增加,且在成熟6 h后显著高于基础饲料组(P<0.05、P<0.01、P<0.001)。这一差异可能源于发酵饲料中特定成分对TfR1活性的持续激活作用。
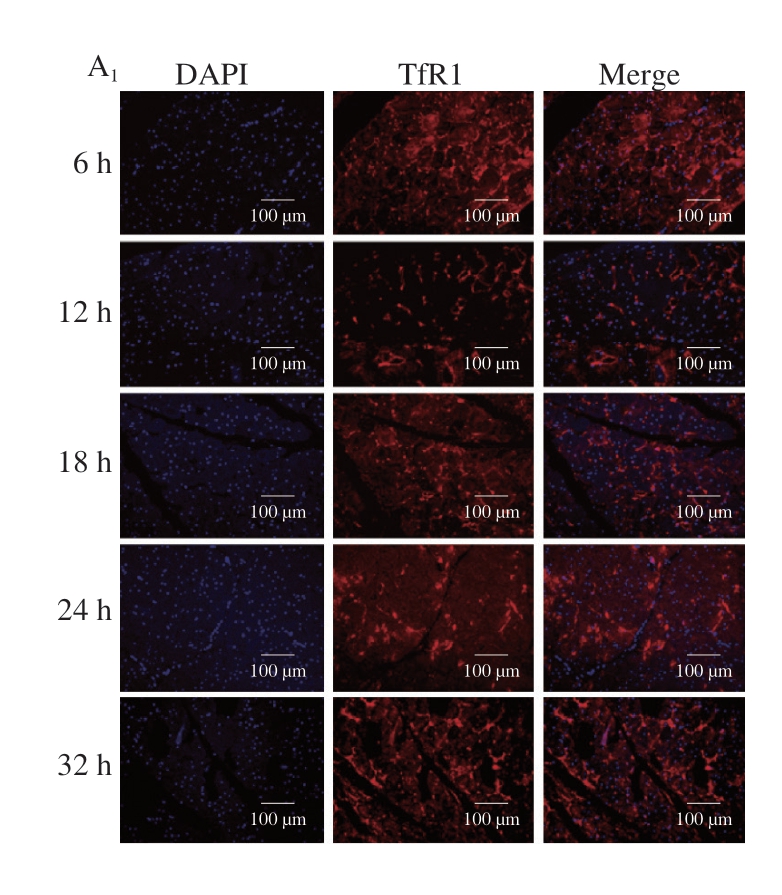
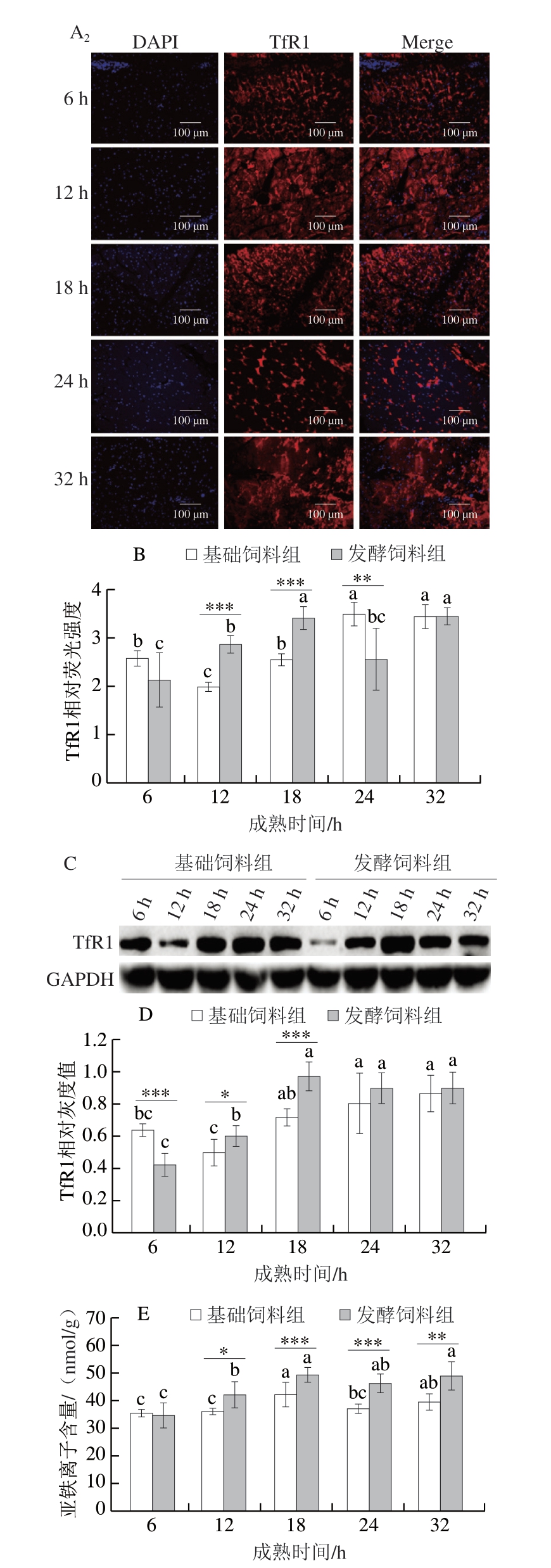
图1 添加7.5%生物发酵饲料对鸡胸肉TfR1蛋白水平与亚铁离子含量的影响
Fig. 1 Effect of supplementation of 7.5% bio-fermented feed on TfR1 expression and ferrous ion content in chicken breast meat
A.TfR1免疫荧光染色图;下标1.基础饲料组,下标2.发酵饲料组,图2A同;B. TfR1免疫荧光染色图荧光强度分析;C、D.分别为TfR1蛋白免疫印迹图及其灰度值分析;E.亚铁离子含量。小写字母不同表示不同成熟时间之间差异显著(P<0.05);*.组间差异显著(P<0.05);**.组间差异极显著(P<0.01);***.组间差异高度显著(P<0.001);图2~4同。
2.3 添加7.5%生物发酵饲料对L-ROS含量的影响
荧光探针C11-BODIPY 581/591作为铁死亡研究中脂质过氧化的特异性检测工具,其原理是基于与脂质过氧自由基反应时发生的荧光发射波长偏移,即从红色荧光(598 nm)转变为绿色荧光(520 nm)[23]。由图2可知,基础饲料组和发酵饲料组L-ROS含量在宰后成熟32 h内整体均呈现上升趋势。其中,基础饲料组L-ROS含量在整个成熟期内持续显著增加(P<0.05),这可能是由于内源性抗氧化系统的逐渐耗竭所致。而发酵饲料组则表现出先下降后上升的变化趋势(P<0.05)。具体而言,在成熟初期(6、12 h),发酵饲料组L-ROS含量高度显著高于基础饲料组(P<0.001),这可能是因为发酵饲料富含促氧化成分(如PUFA),其饲喂的鸡肌肉组织中PUFA含量更高;然而,在成熟18 h时,发酵饲料组L-ROS含量出现显著下降(P<0.05),甚至低于基础饲料组,提示鸡胸肉组织内源性抗氧化系统(如GSH/GPX4途径)可能被激活,从而短暂抑制了脂质过氧化进程;随着成熟时间的进一步延长,虽然基础饲料组L-ROS含量持续积累,但发酵饲料组L-ROS含量再次显著高于基础饲料组(P<0.05、P<0.01),这可能是因为抗氧化物质耗竭使氧化反应重新占据主导地位。
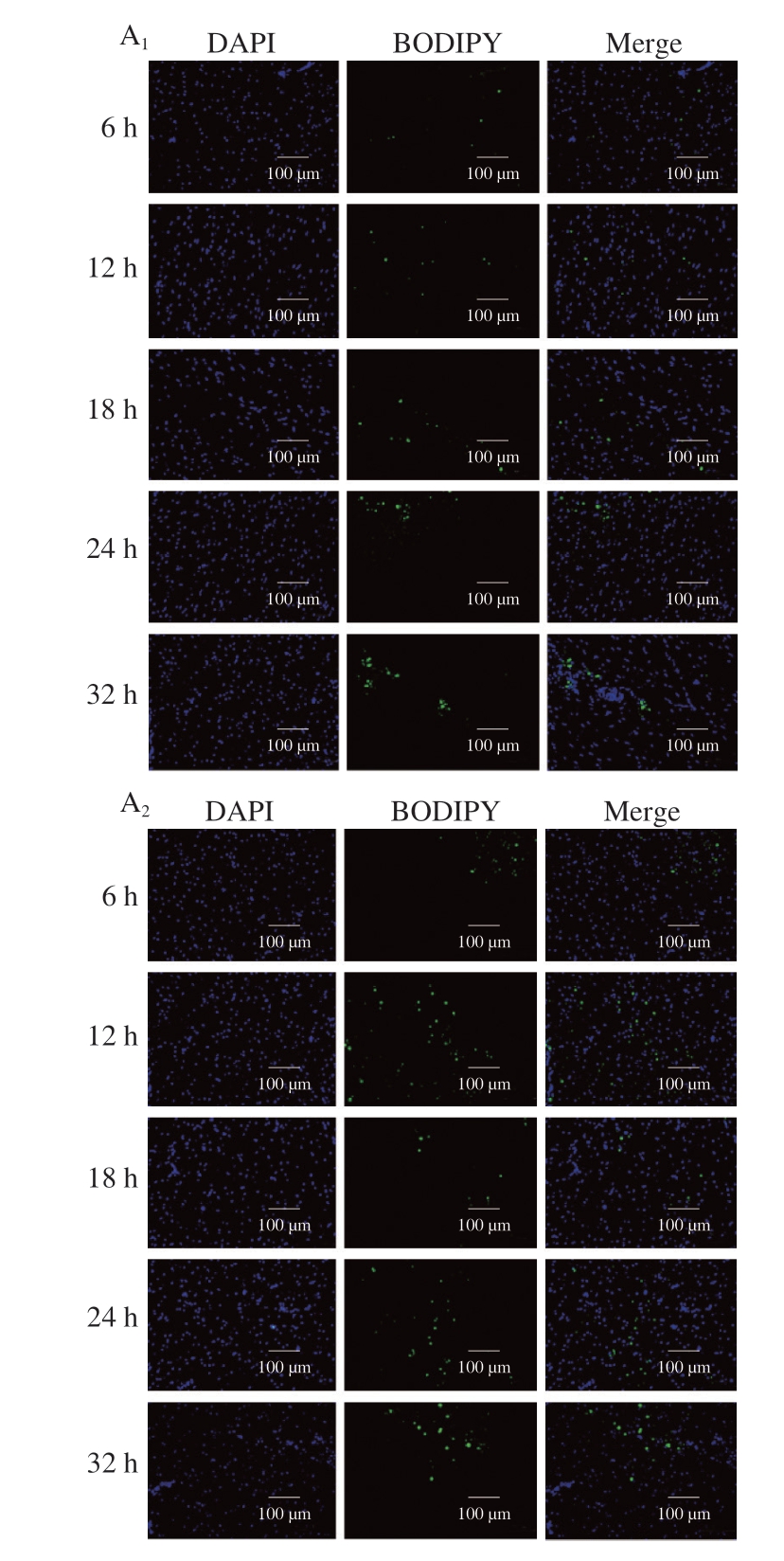
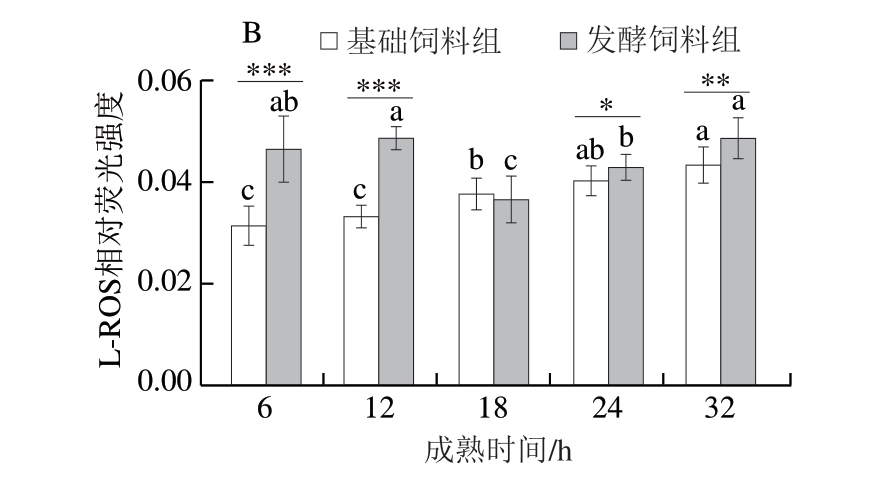
图2 添加7.5%生物发酵饲料对L-ROS含量的影响
Fig. 2 Effect of supplementation of 7.5% bio-fermented feed on L-ROS content
A. L-ROS荧光染色图;B. L-ROS荧光染色图荧光强度分析。
2.4 添加7.5%生物发酵饲料对GPX4/GSH轴的影响
GSH代谢途径的抑制已被证实是诱发铁死亡的关键机制,而GSH/GPX4信号轴作为该途径的核心调控环节发挥着重要作用[24]。由图3A可知,基础饲料组GSH含量随成熟时间的延长呈现显著下降趋势(P<0.05),相反,发酵饲料组GSH含量呈显著上升趋势(P<0.05),但在成熟32 h前,其GSH含量始终显著低于基础饲料组(P<0.01、P<0.001)。这可能源于发酵饲料中特定成分对GSH合成酶系的抑制作用,导致细胞内GSH的生物利用度受限,间接产生类似GPX4功能抑制的效果。
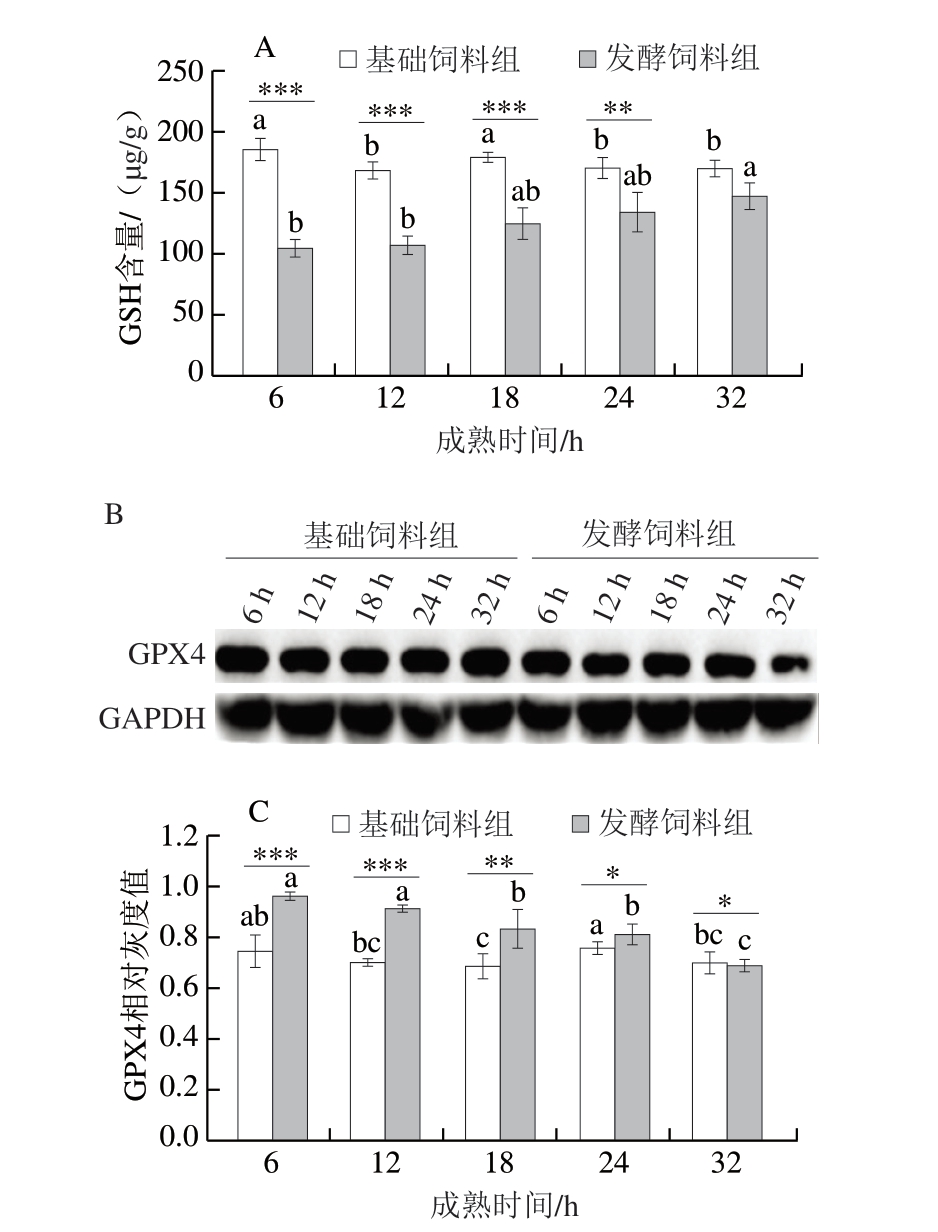
图3 添加7.5%生物发酵饲料对GPX4/GSH轴相关物质的影响
Fig. 3 Effects of supplementation of 7.5% bio-fermented feed on the substances related to the glutathione peroxidase 4/glutathione axis
A.GSH含量;B、C.分别为GPX4免疫荧光染色图及其灰度值分析。
作为铁死亡的关键调控因子,GPX4是GPX家族中唯一能够将脂质过氧化物还原为脂质醇的硒蛋白[25]。由图3B、C可知,基础饲料组和发酵饲料组GPX4蛋白表达水平均随成熟时间的延长而显著下降(P<0.05),且在宰后成熟32 h内,发酵饲料组GPX4蛋白表达水平均显著低于基础饲料组(P<0.05、P<0.01、P<0.001)。GPX4抑制或下调均会引发脂质过氧化物积累,从而增加细胞对铁死亡的敏感性。
2.5 添加7.5%生物发酵饲料对脂质氧化的影响
脂质过氧化水平是评估铁死亡进程的重要生物学指标[26]。其核心机制在于:L-ROS与细胞脂质膜PUFA相互作用时,经初级氧化和次级氧化产生MDA等多种氧化产物[27]。由图4可知,随着成熟时间的延长,基础饲料组和发酵饲料组MDA含量均呈现显著上升趋势(P<0.05)。其中,发酵饲料组MDA含量在整个成熟期内始终高于基础饲料组,且在24 h时表现出显著水平(P<0.05)。这与L-ROS含量结果较为一致。
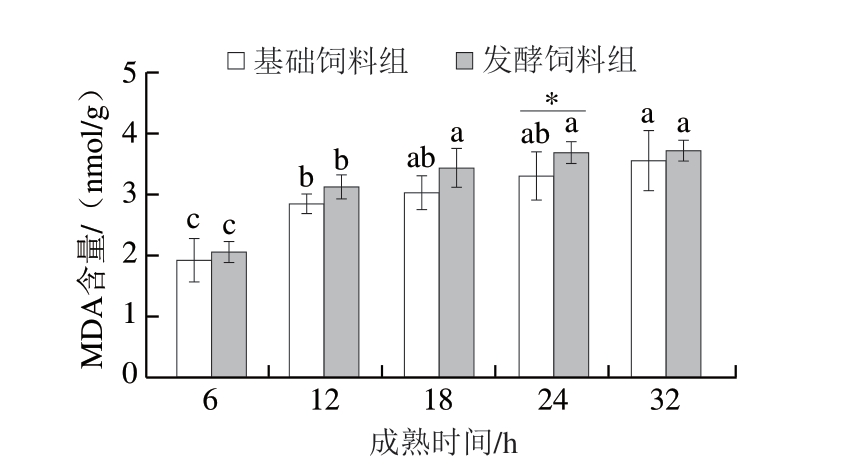
图4 添加7.5%生物发酵饲料对MDA含量的影响
Fig. 4 Effect of supplementation of 7.5% bio-fermented feed on malondialdehyde content
2.6 添加7.5%生物发酵饲料对线粒体损伤的影响
线粒体作为细胞死亡信号的关键调控细胞器,在宰后骨骼肌经历缺血缺氧状态时,其状态与功能最先受到影响[28]。在铁死亡过程中,线粒体通常表现出形态学异常,包括凝结或肿胀、膜密度增加、嵴减少及外膜破裂等特征性变化[3]。由图5可知,随着成熟时间的延长,基础饲料组和发酵饲料组鸡胸肉样品中线粒体损伤程度均逐渐加重。具体而言,成熟0 h时,基础饲料组线粒体呈现典型的短棒状结构,外膜圆润饱满、内膜完整且向内折叠形成排列紧密、数量众多的嵴;然而,成熟24 h时,线粒体体积明显缩小并出现皱缩现象,膜密度明显增加,同时伴随嵴缺失现象。相比之下,发酵饲料组线粒体在成熟0 h时虽也呈短棒状,但体积相对较小,内膜结构已表现出一定程度的松散,部分嵴缺失,膜密度较高;成熟24 h时,线粒体皱缩程度进一步加重,嵴数量急剧减少,膜密度进一步增加,部分线粒体甚至出现内部空泡化的严重损伤。
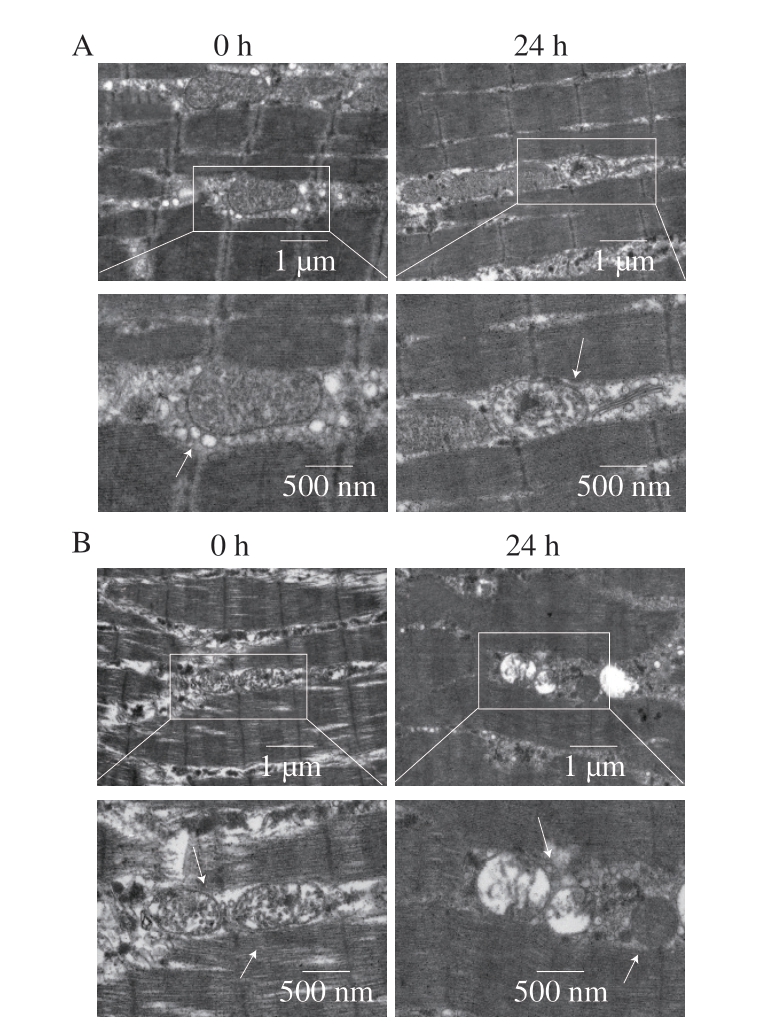
图5 添加7.5%生物发酵饲料对线粒体损伤的影响
Fig. 5 Effects of supplementation of 7.5% bio-fermented feed on mitochondrial damage
A.基础饲料组;B.发酵饲料组。
3 讨论
3.1 宰后鸡胸肉成熟过程中骨骼肌细胞铁死亡
铁死亡的一个关键特征是细胞膜PUFA的氧化修饰[2]。磷脂(phospholipid,PL)-PUFA在铁离子和含铁酶催化下发生过氧化反应,生成的PL氢过氧化物(PLPUFA-OOH)通过氧化链反应在细胞膜中迅速扩散[29]。根据铁死亡的评估标准[3],本研究综合采用脂质过氧化(L-ROS、MDA)、线粒体损伤和TfR1蛋白水平中的3 种指标进行系统分析。TfR1作为II型跨膜糖蛋白,通过结合转铁蛋白(TfR1-Fe3+)介导铁离子摄取,TfR1-Fe3+复合物经内吞作用被细胞内化,进而实现铁摄取与转运。Park等[30]在铁死亡诱导剂Erastin处理的成纤维细胞中观察到TfR1表达上调和细胞内总铁水平增加。宰后成熟过程中,食用基础饲料的黄羽肉鸡鸡胸肉TfR1蛋白水平显著上调(P<0.05),并伴随亚铁离子含量的显著增加(P<0.05)。这种铁超载状态可通过双重途径促进铁死亡:通过芬顿反应促进ROS生成,引起细胞毒性;激活各种铁依赖性酶(如脂氧合酶、细胞色素P450)激活PL-PUFA过氧化反应[31]。GSH作为细胞中最丰富的抗氧化剂,既可直接清除ROS[32],又可作为GPX4的辅助因子解毒PL-PUFA-OOH[33]。然而本研究发现,宰后成熟过程中,鸡胸肉组织中GSH含量与GPX4蛋白表达量均呈显著降低趋势(P<0.05),导致L-ROS含量和MDA含量显著增加(P<0.05)。MDA进一步通过促进铁基肌红蛋白形成和非血红素铁积累影响ROS生成[34]。非血红素铁累积同样会促进L-ROS含量增加,进一步影响MDA含量。总之,铁积累产生的特定PL-PUFA-OOH无法通过系统Xc-/GSH/GPX4抗氧化通路被内源性消除,导致细胞内过氧化物积累,促进铁死亡发生[35]。
3.2 添加7.5%生物发酵饲料对骨骼肌细胞铁死亡的影响
本研究证实,添加7.5%生物发酵饲料可通过多重途径促进黄羽肉鸡骨骼肌细胞铁死亡进程:提高亚铁离子含量和L-ROS含量;降低GPX4蛋白表达水平和GSH含量;导致MDA积累及线粒体结构损伤加剧。发酵过程中微生物代谢促进饲料中的结合态铁(如Fe3+)释放。安靖卿等[36]在研究复合益生菌发酵饲料对海兰灰蛋鸡钙、磷代谢的影响时发现,添加1.25%复合益生菌发酵饲料可显著提高蛋鸡对矿物质的消化率。此外,发酵饲料中的粗纤维质量分数由7.89%降至7.57%,这可能有助于提升黄羽肉鸡对饲料中微量元素与矿物质的吸收效率,从而提升铁的生物利用率。此外,发酵饲料中乙酸、丙酸等短链脂肪酸[8]及乳酸菌发酵产生的乳酸[37]等含量增加,可能通过降低细胞内pH值进一步促进铁离子释放(Fe3+→Fe2+),增加不稳定铁池,导致细胞内铁超载,进而引发芬顿反应。对于脂质过氧化而言,PUFA和PL水平十分重要。Liu Shiqi等[38]发现添加10%生物发酵饲料可显著提高猪背最长肌n-3 PUFA与n-6 PUFA含量、总PUFA含量及PUFA与饱和脂肪酸比值。结合表2可知,发酵饲料中乙醚提取物质量分数由3.20%升至3.52%。该增量主要源于微生物对原料基质的脂质释放,而非大量新生PUFA。粗脂肪水平提高显著增加了黄羽肉鸡胸、腿肌的肌内脂肪含量[39],增加了PL的绝对数量。然而,PL含量及其水解与氧化对脂质过氧化水平具有重要调控作用[40]。PL富含PUFA,其氧化敏感性远高于甘油三酯[41],在宰后缺血缺氧及游离铁催化下更易发生过氧化形成PLPUFA-OOH,从而成为触发铁死亡的关键脂质信号[42]。此外,发酵饲料粗蛋白质量分数由19.6%升至20.5%,这可能通过增加半胱氨酸、谷氨酸等前体氨基酸的供应[43]影响GSH生物合成及其参与的氧化还原平衡调节,从而增加细胞内ROS水平,加剧氧化应激,削弱细胞抗氧化能力,导最终致脂质过氧化物难以及时清除[44]。关于线粒体的损伤,可能是因为发酵饲料能够提升肌肉游离铁含量,催化氧化线粒体膜脂质,进一步导致膜密度骤增与嵴溶解。同时,高活性铁抑制谷胱甘肽过氧化物酶通路,ROS清除能力骤降,脂质过氧化链式反应放大,表现为线粒体空泡化。此外,宰后早期线粒体电子传递链异常激活,可能与发酵饲料诱导的氧化应激形成协同效应,导致线粒体膜电位崩溃。同时,乳酸堆积降低pH值,激活铁依赖性脂氧合酶,进一步促进脂质自由基生成,导致嵴结构解体,放大线粒体损伤。总之,发酵饲料中微生物代谢产物可能通过改变线粒体膜通透性进一步加剧氧化损伤和ROS爆发性积累[45]。综上,7.5%生物发酵饲料的添加通过增加肌内脂肪和PUFA含量、引发铁超载和氧化应激、加剧线粒体损伤和脂质过氧化反应等促进铁死亡进程。
3.3 添加7.5%生物发酵饲料对鸡肉品质的影响
屠宰后,肌肉通过一系列复杂的生化反应完成向食用肉的转化过程,其中色泽、pH值、蒸煮损失率和剪切力作为关键品质参数,对禽肉产品生产管理与质量控制至关重要[46]。发酵饲料有降低鸡胸肉pH值、增加蒸煮损失率和增加L*的潜力,还可有效降低鸡胸肉a*、b*和剪切力。这一发现与前人研究结果较为一致:张艾珈等[15]使用芽孢杆菌、乳酸杆菌和酵母3 种益生菌混合发酵饲料,基础日粮中添加7.5%发酵饲料能够降低樱桃谷鸭胸肌pH值;肖长峰等[43]在乳鸽基础饲料中添加2%地衣芽孢杆菌发酵日粮发现,乳鸽胸肉L*升高,a*、b*和剪切力均下降。肌肉组织由肌纤维组成,发酵饲料组黄羽肉鸡胸肉品质变化可能与肌纤维类型与组成有关。其中,氧化型肌纤维(I型)因其有氧代谢特性导致乳酸积累较少,通常与较深的肉色、较高的pH值有关[47];酵解代谢型肌纤维(如IIb型)则以无氧糖酵解为主,肌糖原快速分解生成大量乳酸,外观一般呈白色且体积较大[48]。本研究中,发酵饲料所含短链脂肪酸(如乙酸、丙酸)和乳酸菌代谢产生的大量乳酸均可能降低肠道pH值,激活腺苷酸活化蛋白激酶信号通路,抑制氧化代谢相关基因(如过氧化物酶体增殖物激活受体γ共激活因子1α)表达,促进肌纤维由I型向IIb型转化[49],这可能是导致鸡胸肉pH值降低和色泽变浅。值得注意的是,黄志朝等[50]在金陵花鸡日粮中添加8%复合益生菌发酵象草后,鸡肉保水力提高、剪切力降低。通常认为,肌肉持水能力越强,相应剪切力越低[46]。这与本研究观察到的发酵饲料可导致黄羽肉鸡鸡胸肉蒸煮损失率提高和剪切力降低的结果存在差异。这可能与肌原纤维蛋白降解程度、结缔组织成熟程度及黄羽肉鸡特有的生长特性(如相对较低的体质量或日增质量)导致的肌原纤维直径较小有关,这些因素共同作用导致黄羽肉鸡鸡胸肉呈现嫩度改善但持水力略微下降的品质特征[51-52]。
4 结论
宰后鸡肉成熟过程中,骨骼肌细胞因亚铁离子过载和脂质过氧化反应而诱发铁死亡。结果表明,与基础饲料相比,添加7.5%生物发酵饲料饲喂黄羽肉鸡可促进鸡肉宰后成熟过程中骨骼肌细胞的铁死亡进程。该过程具体表现为亚铁离子含量增加、L-ROS水平上调、内源抗氧化能力降低、线粒体损伤和脂质过氧化反应加剧。这一系列生理生化改变最终影响了鸡肉色泽与嫩度等品质特征。然而,本研究仅初步揭示了生物发酵饲料调控宰后鸡肉成熟过程中铁死亡及肉质形成的关联性。未来可进一步探究不同比例生物发酵饲料对不同品种鸡、不同肌肉部位或不同种类动物骨骼肌细胞铁死亡的影响,在探究铁死亡发生普适性的基础上阐明生物发酵饲料阈值与铁死亡程度的剂量-效应关系,为改善生物发酵饲料对肉鸡品质形成及其在畜禽产业中的具体应用提供理论参考。
[1] LIU J, LIU D, HU Z, et al. TMT quantitative proteomics analysis reveals molecular mechanism of ferroptosis during beef refrigeration[J]. Food Chemistry, 2024, 435: 137596. DOI:10.1016/j.foodchem.2023.137596.
[2] DIXON S J, LEMBERG K M, LAMPRECHT M R, et al. Ferroptosis:an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012,149(5): 1060-1072. DOI:10.1016/j.cell.2012.03.042.
[3] STOCKWELL B R. Ferroptosis turns 10: emerging mechanisms,physiological functions, and therapeutic applications[J]. Cell, 2022,185(14): 2401-2421. DOI:10.1016/j.cell.2022.06.003.
[4] CHEN Z D, XING T, LI J L, et al. Oxidative stress impairs the meat quality of broiler by damaging mitochondrial function, affecting calcium metabolism and leading to ferroptosis[J]. Animal Bioscience,2022, 35(10): 1616-1627. DOI:10.5713/ab.22.0019.
[5] 王波, 罗海玲. 氧化反应对肌肉滴水损失的影响及抗氧化剂对其调控机制的研究进展[J]. 中国畜牧杂志, 2019, 55(6): 1-5.DOI:10.19556/j.0258-7033.2019-06-001.
[6] SUGIHARTO S, RANJITKAR S. Recent advances in fermented feeds towards improved broiler chicken performance, gastrointestinal tract microecology and immune responses: a review[J]. Animal Nutrition,2019, 5(1): 1-10. DOI:10.1016/j.aninu.2018.11.001.
[7] ZHU X, TAO L J, LIU H Y, et al. Effects of fermented feed on growth performance, immune organ indices, serum biochemical parameters,cecal odorous compound production, and the microbiota community in broilers[J]. Poultry Science, 2023, 102(6): 102629. DOI:10.1016/j.psj.2023.102629.
[8] 王媛媛, 闫俊书, 宦海琳, 等. 生物发酵饲料对蛋鸡生产性能、蛋品质及肠道微生物菌群的影响[J]. 饲料工业, 2024, 45(5): 23-31.DOI:10.13302/j.cnki.fi.2024.05.004.
[9] SHI C Y, ZHANG Y, LU Z Q, et al. Solid-state fermentation of cornsoybean meal mixed feed with Bacillus subtilis and Enterococcus faecium for degrading antinutritional factors and enhancing nutritional value[J]. Journal of Animal Science and Biotechnology, 2017, 8(1): 50.DOI:10.1186/s40104-017-0184-2.
[10] YANG A S, ZUO L L, CHENG Y F, et al. Degradation of major allergens and allergenicity reduction of soybean meal through solidstate fermentation with microorganisms[J]. Food & Function, 2018,9(3): 1899-1909. DOI:10.1039/c7fo01824j.
[11] 李龙, 仇薪鑫, 闫红军. 肉鸡全价饲料发酵条件优化及其应用效果研究[J]. 饲料研究, 2019, 42(4): 12-15. DOI:10.13557/j.cnki.issn1002-2813.2019.04.004.
[12] 张建胜, 黄新育, 朱元芳, 等. 发酵饲料在鸡生产中的应用[J].当代畜禽养殖业, 2024, 44(1): 32-35. DOI:10.14070/j.cnki.15-1150.2024.01.004.
[13] 叶成智, 宦海琳, 周维仁, 等. 发酵饲料对肉鸡生长性能、肌肉理化特性及风味的影响[J]. 饲料工业, 2021, 42(11): 7-13. DOI:10.13302/j.cnki.fi.2021.11.002.
[14] 郝丹妮, 屠晓航, 郭诗雨, 等. 宰后肌肉成熟过程中铁死亡的发生及其与生鲜肉品质关系的研究进展[J]. 食品科学, 2024, 45(21): 331-343. DOI:10.7506/spkx1002-6630-20240125-230.
[15] 张艾珈, 严敏, 张延延, 等. 日粮添加混合发酵饲料对樱桃谷肉鸭生长性能、胴体品质和肌肉脂肪代谢的影响[J]. 畜牧与兽医, 2022,54(4): 17-24.
[16] 张露露, 赵文星, 柴学军, 等. 元宝枫叶富硒发酵饲料对剑门土鸡生长性能与肉品质及肠道菌群的影响[J]. 动物医学进展, 2025, 46(4):66-71. DOI:10.16437/j.cnki.1007-5038.2025.04.004.
[17] SONG D H, HAM Y K, HA J H, et al. Impacts of pre-rigor salting with KCl on technological properties of ground chicken breast[J].Poultry Science, 2020, 99(1): 597-603. DOI:10.3382/ps/pez527.
[18] SHI H B, ZHANG X X, CHEN X, et al. How ultrasound combined with potassium alginate marination tenderizes old chicken breast meat:possible mechanisms from tissue to protein[J]. Food Chemistry, 2020,328: 127144. DOI:10.1016/j.foodchem.2020.127144.
[19] LIU Y Q, MAO Y W, LIANG R R, et al. Effect of suspension method on meat quality and ultra-structure of Chinese yellow cattle under 12–18 ℃ pre-rigor temperature controlled chilling[J]. Meat Science,2016, 115: 45-49. DOI:10.1016/j.meatsci.2016.01.007.
[20] DRUMMEN G P C, VAN LIEBERGEN L C M, OP DEN KAMP J A F,et al. C11-BODIPY581/591, an oxidation-sensitive fluorescent lipid peroxidation probe: (micro)spectroscopic characterization and validation of methodology[J]. Free Radical Biology and Medicine,2002, 33(4): 473-490. DOI:10.1016/S0891-5849(02)00848-1.
[21] FENG H Z, SCHORPP K, JIN J, et al. Transferrin receptor is a specific ferroptosis marker[J]. Cell Reports, 2020, 30(10): 3411-3423.e7.DOI:10.1016/j.celrep.2020.02.049.
[22] QIAN Z M. Targeted drug delivery via the transferrin receptormediated endocytosis pathway[J]. Pharmacological Reviews, 2002,54(4): 561-587. DOI:10.1124/pr.54.4.561.
[23] ZENG F T, NIJIATI S, TANG L G, et al. Ferroptosis detection: from approaches to applications[J]. Angewandte Chemie-International Edition, 2023, 62(35): e202300379. DOI:10.1002/anie.202300379.
[24] LAI Y F, DONG J, WU Y, et al. Lipid peroxides mediated ferroptosis in electromagnetic pulse-induced hippocampal neuronal damage via inhibition of GSH/GPX4 axis[J]. International Journal of Molecular Sciences, 2022, 23(16): 9277. DOI:10.3390/ijms23169277.
[25] YANG W S, SRIRAMARATNAM R, WELSCH M E, et al. Regulation of ferroptotic cancer cell death by GPX4[J]. Cell, 2014, 156(1/2): 317-331. DOI:10.1016/j.cell.2013.12.010.
[26] MA T L, CHEN J X, ZHU P, et al. Focus on ferroptosis regulation:exploring novel mechanisms and applications of ferroptosis regulator[J].Life Science, 2022, 307: 120868. DOI:10.1016/j.lfs.2022.120868.
[27] WANG B Q, WANG Y, ZHANG J, et al. ROS-induced lipid peroxidation modulates cell death outcome: mechanisms behind apoptosis, autophagy, and ferroptosis[J]. Archives of Toxicology, 2023,97(6): 1439-1451. DOI:10.1007/s00204-023-03476-6.
[28] PEOPLES J N R, SARAF A P, GHAZAL N, et al. Mitochondrial dysfunction and oxidative stress in heart disease[J]. Experimental and Molecular Medicine, 2019, 51(12): 1-13. DOI:10.1038/s12276-019-0355-7.
[29] DO Q, XU L B. How do different lipid peroxidation mechanisms contribute to ferroptosis?[J]. Cell Reports Physical Science, 2023,4(12): 101683. DOI:10.1016/j.xcrp.2023.101683.
[30] PARK E, CHUNG S W. ROS-mediated autophagy increases intracellular iron levels and ferroptosis by ferritin and transferrin receptor regulation[J]. 2019, 10(11): 822. DOI:10.1038/s41419-019-2064-5.
[31] DOLL S, PRONETH B, TYURINA Y Y, et al. ACSL4 dictates ferroptosis sensitivity by shaping cellular lipid composition[J]. Nature Chemical Biology, 2017, 13(1): 91-98. DOI:10.1038/nchembio.2239.
[32] XIA C Y, XING X Y, ZHANG W X, et al. Cysteine and homocysteine can be exploited by GPX4 in ferroptosis inhibition independent of GSH synthesis[J]. Redox Biology, 2024, 69: 102999. DOI:10.1016/j.redox.2023.102999.
[33] LI B R, CHENG K G, WANG T, et al. Research progress on GPX4 targeted compounds[J]. European Journal of Medicinal Chemistry,2024, 274: 116548. DOI:10.1016/j.ejmech.2024.116548.
[34] WANG Z M, HE Z F, EMARA A M, et al. Effects of malondialdehyde as a byproduct of lipid oxidation on protein oxidation in rabbit meat[J]. Food Chemistry, 2019, 288: 405-412. DOI:10.1016/j.foodchem.2019.02.126.
[35] MA T Y, DU J T, ZHANG Y F, et al. GPX4-independent ferroptosis:a new strategy in disease’s therapy[J]. Cell Death Discovery, 2022,8(1): 434. DOI:10.1038/s41420-022-01212-0.
[36] 安靖卿, 赵浩健, 刘韬虞, 等. 复合益生菌发酵饲料对海兰灰蛋鸡营养代谢的影响[J]. 江西畜牧兽医杂志, 2024(6): 23-26. DOI:10.3969/j.issn.1004-2342.2024.06.008.
[37] WANG J Y, YAO L, SU J, et al. Effects of Lactobacillus plantarum and its fermentation products on growth performance, immune function, intestinal pH, and cecal microorganisms of Lingnan yellow chicken[J]. Poultry Science, 2023, 102(6): 102610. DOI:10.1016/j.psj.2023.102610.
[38] LIU S Q, DU M, TU Y A, et al. Fermented mixed feed alters growth performance, carcass traits, meat quality and muscle fatty acid and amino acid profiles in finishing pigs[J]. Animal Nutrition, 2023, 12:87-95. DOI:10.1016/j.aninu.2022.09.003.
[39] 梁天柱, 梁光哲, 梁志东, 等. 发酵饲料对广西三黄鸡生长性能、屠宰性能和肉品质的影响[J]. 饲料研究, 2021, 44(4): 26-30.DOI:10.13557/j.cnki.issn1002-2813.2021.04.007.
[40] 张凯华, 臧明伍, 王守伟, 等. 磷脂分子调控畜禽肉品质研究进展[J].食品科学, 2024, 45(8): 303-311. DOI:10.7506/spkx1002-6630-20231225-207.
[41] 黄攀, 陆燕, 茆达干, 等. 日粮多不饱和脂肪酸对畜禽肉品质的影响[J].畜牧与兽医, 2008, 40(12): 93-95.
[42] MAGTANONG L, KO P J, TO M, et al. Exogenous monounsaturated fatty acids promote a ferroptosis-resistant cell state[J]. Cell Chemical Biology, 2019, 26(3): 420-432.e9. DOI:10.1016/j.chembiol.2018.11.016.
[43] 肖长峰, 丁梓钊, 吕文纬, 等. 发酵饲料对乳鸽屠宰性能、器官发育及肌肉品质的影响[J]. 中国饲料, 2024(15): 131-136. DOI:10.15906/j.cnki.cn11-2975/s.2023070042-07.
[44] FAN G H, LIU M L, LIU J, et al. The initiator of neuroexcitotoxicity and ferroptosis in ischemic stroke: glutamate accumulation[J].Frontiers in Molecular Neuroscience, 2023, 16: 1113081.DOI:10.3389/fnmol.2023.1113081.
[45] 袁铜, 黄靓, 杨琳, 等. 肠道菌群及其代谢产物调节动物线粒体功能的研究进展[J]. 畜牧兽医学报, 2023, 54(1): 48-57. DOI:10.11843/j.issn.0366-6964.2023.01.005.
[46] WEBB E C, AGBENIGA B. Timing and duration of low voltage electrical stimulation on selected meat quality characteristics of light and heavy cattle carcasses[J]. Animal Production Science, 2020, 60(7):967. DOI:10.1071/an18161.
[47] BEECROFT S, VAN DE LOCHT M, DE WINTER J, et al.P.108Recessive MYH7-related myopathy in two families[J].Neuromuscular Disorders, 2019, 29: S80. DOI:10.1016/j.nmd.2019.06.164.
[48] SCHIAFFINO S, REGGIANI C. Fiber types in mammalian skeletal muscles[J]. Physiological Reviews, 2011, 91(4): 1447-1531.DOI:10.1152/physrev.00031.2010.
[49] 姬正伟, 路宏朝, 马海东, 等. 肉用家畜骨骼肌肌纤维类型转化的研究进展[J]. 家畜生态学报, 2023, 44(11): 1-9. DOI:10.3969/j.issn.1673-1182.2023.11.001.
[50] 黄志朝, 杨莹博, 易显菊, 等. 饲粮添加发酵桂闽引象草对金陵花鸡屠宰性能、肌肉品质和肌肉氨基酸含量的影响[J]. 饲料研究, 2024,47(11): 56-60. DOI:10.13557/j.cnki.issn1002-2813.2024.11.011.
[51] DING Y, JIANG X, YAO X, et al. Effects of feeding fermented mulberry leaf powder on growth performance, slaughter performance,and meat quality in chicken broilers[J]. Animals, 2021, 11(11): 3294.DOI:10.3390/ani11113294.
[52] MIR N A, RAFIQ A, KUMAR F, et al. Determinants of broiler chicken meat quality and factors affecting them: a review[J]. Journal of Food Science and Technology, 2017, 54(10): 2997-3009. DOI:10.1007/s13197-017-2789-z.