近年来,国内外生物肽产业市场保持高速增长,市场发展潜力巨大[1]。随着我国步入老龄化社会,老年人群的健康问题引起了广泛关注。据贾小芳等[2]的统计,高达75%的65 岁及以上老年人蛋白摄入量不足。肠胃消化功能减弱、饮食习惯不良等因素均会导致蛋白质缺乏,长期如此会增加骨质疏松[3]、肌肉减弱(肌少症)[4]、免疫功能减弱[5]等相关疾病的发生率,老年人缺乏蛋白质摄入的问题亟待解决,蛋白质摄入量的增加能够保护老年人的身体健康[6]。相较于蛋白质,多肽分子质量低,营养价值丰富,具有抗氧化[7]、抑菌[8]、降压[9]、降血脂[10]和降血糖[11]等功能,可用于预防、控制、治疗慢性疾病。微量元素是人类生命活动中不可缺少的一部分,多肽可以通过配位共价结合或吸附的方式与Ca2+、Zn2+、Fe2+、Se2+等金属离子螯合,肽螯合物能够有效结合多肽和金属离子的营养价值与功能特性,且Ca2+与多肽螯合后结构稳定[12],可提高其生物利用率,汪婧瑜[13]、Fang Zheng[14]、Hua Pengpeng[15]等发现,肽与Ca2+、Zn2+、Fe2+结合后形成的螯合物与未螯合的肽相比具有较好的生物活性。
新疆地区因其富饶的天然草场和适宜马匹生长的气候,成为我国主要养马地区,同时也是国内马种资源较为丰富的省份之一[16]。据2024年末的数据显示,新疆的马匹存栏数量达115.15万 匹,约占全国总数的30%,在全国各省份中排名第1[16]。据联合国粮食及农业组织发布的数据[17],全球每年约500万 匹马被屠宰,2020年,全球马肉产量总计77.56万 t,年屠宰量和消费量有所提升。新疆各民族长期以来有食用马肉、马肠的习惯,消费量较大,但副产物马皮、骨、血液等利用程度低,其中骨骼约占动物体质量的20%~30%,可利用资源十分丰富[18],有研究[19-20]表明,马骨含有丰富的蛋白质、脂肪、钙、锌、铁元素等成分,其营养价值不亚于马肉。目前,牛骨、猪骨、羊骨、鹿骨、驴骨等畜产骨源蛋白的提取、活性肽制备、钙、锌螯合物的评价等资源化开发利用均取得较好的进展,但马骨,尤其是骨髓资源的功能挖掘、产品研发进展较慢,阻碍了马肉产业链下游产业的发展。马骨髓的蛋白质含量较高,但营养成分和生物活性尚未被系统性评价,动物骨髓胶原肽及螯合物在增强免疫力、改善骨质疏松症[21]等方面具有较好的功效,因此增强对马骨及其骨髓的加工利用能减少资源浪费、推动马产业发展。
课题组前期相关研究[22]表明,马骨髓的蛋白质及微量元素含量均高于马骨。因此,本研究以马骨髓为原料,制备经碱性蛋白酶、中性蛋白酶、木瓜蛋白酶及胃蛋白酶酶解后的马骨髓胶原肽,以葡萄糖酸钙为钙源,制备4 种马骨髓胶原肽-钙螯合物,比较分析马骨髓胶原肽及其钙螯合物的结构、理化特性及生物活性,对马骨髓胶原肽-钙螯合物制备工艺的优化、应用价值的提升、基础研究的深入具有现实意义。
1 材料与方法
1.1 材料与试剂
新鲜马骨为市购,将马骨冷冻6~8 h,切为两半,取出马骨髓,按体积比1∶5加入液氮,在研钵中捣碎成粉末状,将马骨髓粉末保存于-40 ℃冰箱内冷冻备用。
BCA蛋白定量检测试剂盒 美国赛默飞世尔科技公司;2,2’-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 上海麦克林生化科技公司;碱性蛋白酶(400 U/mg)、中性蛋白酶(100 U/mg) 北京华迈科生物技术有限责任公司;牛血清蛋白、木瓜蛋白酶(1 000 U/mg)、胃蛋白酶(3 000 U/mg) 上海蓝季生物有限公司;以上试剂均为分析纯。
1.2 仪器与设备
DF-101S集热式恒温磁力搅拌器 上海兴创科学仪器设备有限公司;D-8紫外分光光度计 上海仪器科技有限公司;Nicolet Is5傅里叶变换红外(Fourier transform infrared,FTIR)光谱仪 美国Thermo Fisher公司;TGL-16M高速冷冻离心机 湖南湘鑫仪表有限公司;RE-52旋转式蒸发仪 上海亚荣生物化工仪表有限公司;LGJ-12冷冻干燥机 上海腾方仪器设备有限公司;X-MARK酶标仪 上海新领生物科技发展有限公司;BCD-208JDE冷藏冷冻柜 浙江星星冷链整合有限公司;JSM-7610F Plus热场发射扫描电子显微镜 日本电子株式会社;D8 ADVANCE能量色散X射线(energy dispersive X-ray,EDX)光谱仪 德国布鲁克AXS有限公司。
1.3 方法
1.3.1 不同马骨髓胶原肽及其钙螯合物的制备
1.3.1.1 马骨髓蛋白的制备
将马骨髓粉末用少量蒸馏水清洗2~3 次,在45 ℃条件下,采用恒温磁力搅拌器进行3 次回流提取,马骨髓与蒸馏水比例依次为1∶15、1∶10、1∶7(g/mL),提取时间依次为2.0、1.5、1.0 h。使用分液漏斗进行油水分离,对油层再次进行提取,收集水层,用石油醚脱脂2~3 次,使用旋转蒸发仪将其体积浓缩至1/5,用1 mol/L NaOH溶液和1 mol/L HCl溶液将pH值调整至7,透析(3 500 Da、24 h),冷冻干燥,得到马骨髓蛋白[23]。
1.3.1.2 不同马骨髓胶原肽的制备
采用恒温磁力搅拌器对马骨髓蛋白进行4 h酶解处理,酶添加量为1%(以马骨髓蛋白质量计),反应条件均为4 种酶的最适温度与最适pH值(碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、胃蛋白酶最适温度分别为50、45、55、37 ℃,最适pH值分别为9.5、7.0、6.5、2.8),酶解结束后,90 ℃灭酶10~15 min,将pH值调整至7,3 500 r/min离心10 min,收集上清液,透析(3 500 Da、48 h),冷冻干燥,得到碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、胃蛋白酶马骨髓胶原肽。马骨髓胶原肽得率按式(1)计算[24]:
式中:m1为马骨髓蛋白质量/g;m2为马骨髓胶原肽质量/g。
1.3.1.3 不同马骨髓胶原肽-钙螯合物的制备
将不同马骨髓胶原肽制备为质量浓度为10 mg/mL的溶液,肽钙比为3∶1(m/m),温度为60 ℃,pH值为9,在恒温磁力搅拌器中低速搅拌40 min,加入5 倍体积无水乙醇,于-4 ℃放置4 h,使肽-钙螯合物沉降,8 500 r/min离心10 min,弃去上清液,用蒸馏水将沉淀溶解,将溶液pH值调整至7,透析(3 500 Da、24 h),冷冻干燥,得到碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、胃蛋白酶马骨髓胶原肽-钙螯合物[25]。马骨髓胶原肽-钙螯合物得率按式(2)计算:
式中:m3为马骨髓胶原肽质量/g;m4为马骨髓胶原肽-钙螯合物质量/g。
1.3.2 蛋白质含量测定
制备质量浓度为1 mg/mL的牛血清蛋白标准溶液,并稀释成质量浓度分别为0、0.025、0.05、0.1、0.2、0.3、0.4、0.5、0.75、1.0 mg/mL的系列标准溶液,利用BCA法对蛋白质含量进行测定。将20 μL蛋白标准溶液加入至96 孔板中,并加入200 μL BCA试剂,充分混合,37 ℃孵育30 min,于562 nm处测定吸光度,以蛋白质量浓度为横坐标,吸光度为纵坐标绘制标准曲线[26]。标准曲线回归方程为y=0.985 8x+0.108(R2=0.999)。取质量浓度为0.5 mg/mL的样品溶液,按照上述方法,得到样品的蛋白质量浓度。样品蛋白质含量按式(3)计算:
式中:ρ1为样品蛋白质量浓度/(mg/mL);ρ2为样品质量浓度(0.5 mg/mL)。
1.3.3 钙结合能力测定
参考张春芝等[27]的方法,将10 mg马骨髓肽-钙螯合物溶于去离子水中,定容至25 mL,加入1 mL掩蔽剂三乙醇胺,并用1.25 mol/L KOH溶液调节pH值至12.0,加入3 滴钙红指示剂,摇匀后用0.001 mol/L乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTA-2Na)标准溶液滴定,直至指示剂由紫红色变蓝色。记录消耗体积,马骨髓肽的钙结合能力按式(4)计算:
式中:c为EDTA-2Na标准溶液浓度/(mol/L);V为滴定马骨髓肽-钙螯合物所消耗的EDTA-2Na标准溶液体积/L;V0为滴定空白所消耗的EDTA-2Na标准溶液体积/L;M为钙的摩尔质量/(g/mol);m为肽-钙螯合物的质量/g。
1.3.4 结构表征
1.3.4.1 紫外光谱分析
将不同马骨髓胶原肽及其钙螯合物配制成质量浓度为1 mg/mL的溶液,以蒸馏水作空白,采用紫外分光光度计,在室温下扫描,波长区间190~400 nm[28]。
1.3.4.2 FTIR光谱分析
取少量不同马骨髓胶原肽及其钙螯合物,混合适量溴化钾,采用压片法分析其在4 000~400 cm-1区间的FTIR吸收情况[29]。
1.3.4.3 扫描电子显微镜观察及EDX分析
将适量的不同马骨髓胶原肽及其钙螯合物放置于样品台上,使用离子溅射仪在表面镀一层导电膜。在5.0 kV的电压下,分别放大1 000、2 000 倍观察其表面形态。同时,采用EDX光谱仪测定样品表面的元素组成[30]。
1.3.5 抗氧化活性测定
1.3.5.1 DPPH自由基清除率测定
分别配制2 mL质量浓度为0.1、0.2、0.4、0.6、0.8、1.0 mg/mL的样品溶液,对照组用相应质量浓度VC代替样品,空白组用等体积蒸馏水代替样品,各加入2 mL 0.2 mmol/L DPPH溶液,混匀,室温下将样品置于避光环境中反应30 min,于517 nm处测定吸光度[31],DPPH自由基清除率按式(5)计算:
式中:A0为空白组吸光度;A1为样品组吸光度;A2为对照组吸光度。
1.3.5.2 2,2’-联氮-双(3-乙基苯并噻唑啉-6-磺酸)(2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除率测定
于96 孔板内加入20 μL质量浓度为0.05、0.1、0.2、0.3、0.4 mg/mL的样品溶液,对照组用相应质量浓度VC代替样品,空白组用等体积蒸馏水代替样品,各加入180 μL 7 mmol/L ABTS溶液,混匀,室温下将样品置于避光环境中反应5 min,于734 nm处测定吸光度[32],ABTS阳离子自由基清除率按式(5)计算。
1.3.5.3 亚铁离子螯合能力测定
于96 孔板内加入200 μL质量浓度为0.1、0.2、0.4、0.6、0.8、1.0 mg/mL的样品溶液,对照组以相应质量浓度EDTA溶液代替样品,空白组用等体积蒸馏水代替样品,先加入20 μL 2 mmol/L氯化亚铁溶液,再加入40 μL 5 mmol/L菲洛嗪溶液,混匀,室温下反应5 min,于562 nm处测定吸光度[33],亚铁离子螯合率按式(5)计算。
1.3.6 理化性质测定
1.3.6.1 持油性测定
参考古丽米热·阿巴拜克日等[31]的方法,准确称取10 mg样品(m0/g),置于离心管中称质量(m5/g),加入10 mL葵花籽油,漩涡混合5 min,室温下放置30 min,4 000 r/min离心20 min,弃去液体后,记录离心管的质量(m6/g),样品持油性按式(6)计算:
1.3.6.2 吸水性测定
参考迪娜拉·海拉提等[34]的方法并稍作改动,称取10 mg样品置于10 mL离心管内,加入4 mL蒸馏水,充分混合后室温静置1 h,4 000 r/min离心30 min,准确记录上清液体积。样品吸水性按式(7)计算:
式中:m7为样品质量/g;V1为蒸馏水体积/mL;V2为离心后上清液体积/mL。
1.3.6.3 乳化活性指数(emulsification activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)测定
参考李响等[35]的方法并稍作改动,称取10 mg样品,溶于10 mL 0.1 mol/L磷酸盐缓冲溶液(pH 7),加入5 mL葵花籽油,10 000 r/min高速均质2 min,分别从静置0、10 min的乳液样品底部取50 μL,加入5 mL 1 g/100 mL十二烷基硫酸钠溶液,于500 nm处测定吸光度,EAI和ESI分别按式(8)、(9)计算:

式中:ρ3为样品质量浓度/(mg/mL);N为稀释倍数(1);φ为光程(1 cm);θ为油相体积分数(0.25);A3为乳液样品静置0 min测得的吸光度;A4为乳液样品静置10 min时测得的吸光度。
1.4 数据处理
每组实验至少重复3 次,实验结果以平均值±标准差表示,采用Origin 2021、SPSS 26、PeakFitver 4.04软件进行数据分析,其中,半抑制浓度(half maximal inhibitory concentration,IC50)通过SPSS 26软件数据分析获得。采用Origin 2021软件绘图。
2 结果与分析
2.1 不同马骨髓胶原肽及其钙螯合物的蛋白质含量、得率和钙结合能力分析
由图1A可知,部分马骨髓胶原肽及其钙螯合物的蛋白质含量高于本课题团队前期研究[22]的马骨髓蛋白质含量(36.12%),此外,马骨髓胶原肽的蛋白质含量明显高于其钙螯合物,可能是与钙螯合后,胶原肽与钙大量结合引起的,其中胃蛋白酶马骨髓胶原肽及其钙螯合物的蛋白质量分数较高,分别为49.97%、39.97%。本课题团队前期对马骨髓蛋白质的提取进行优化,蛋白质得率为17.24%[29],由图1B可知,胃蛋白酶、碱性蛋白酶马骨髓胶原肽、碱性蛋白酶、木瓜蛋白酶马骨髓胶原肽-钙螯合物的得率较高,分别为27.16%、22.87%、36.36%、33.67%。由图1C可知,蛋白酶种类对马骨髓胶原肽的钙结合能力影响较大,马骨髓胶原肽-钙螯合物的钙结合能力由高到低依次为胃蛋白酶(52.19 mg/g)、碱性蛋白酶(37.42 mg/g)、木瓜蛋白酶(29.87 mg/g)、中性蛋白酶马骨髓胶原肽-钙螯合物(18.55 mg/g)。Yang Xuan等[36]以白鲢鱼皮为原料,经过肠道模拟消化及超滤膜纯化,制备出分子质量≤3 kDa的肽后,将其与钙螯合,钙螯合能力为22.16 mg/g,说明马骨髓胶原肽-钙螯合物的钙结合能力具有明显优势。
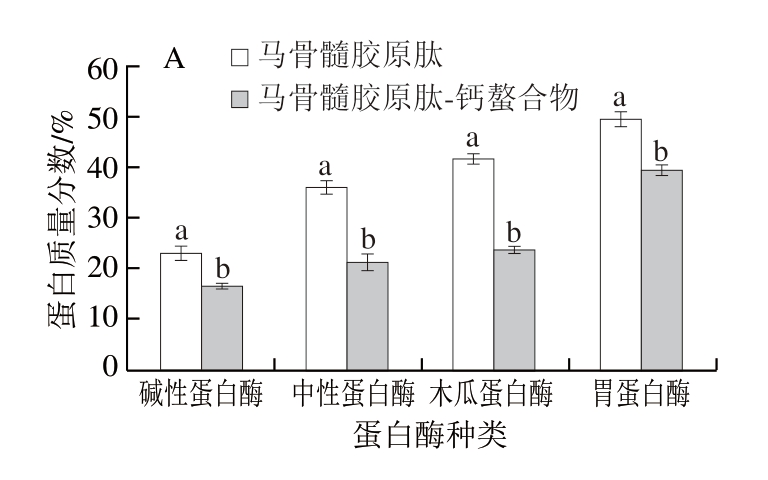
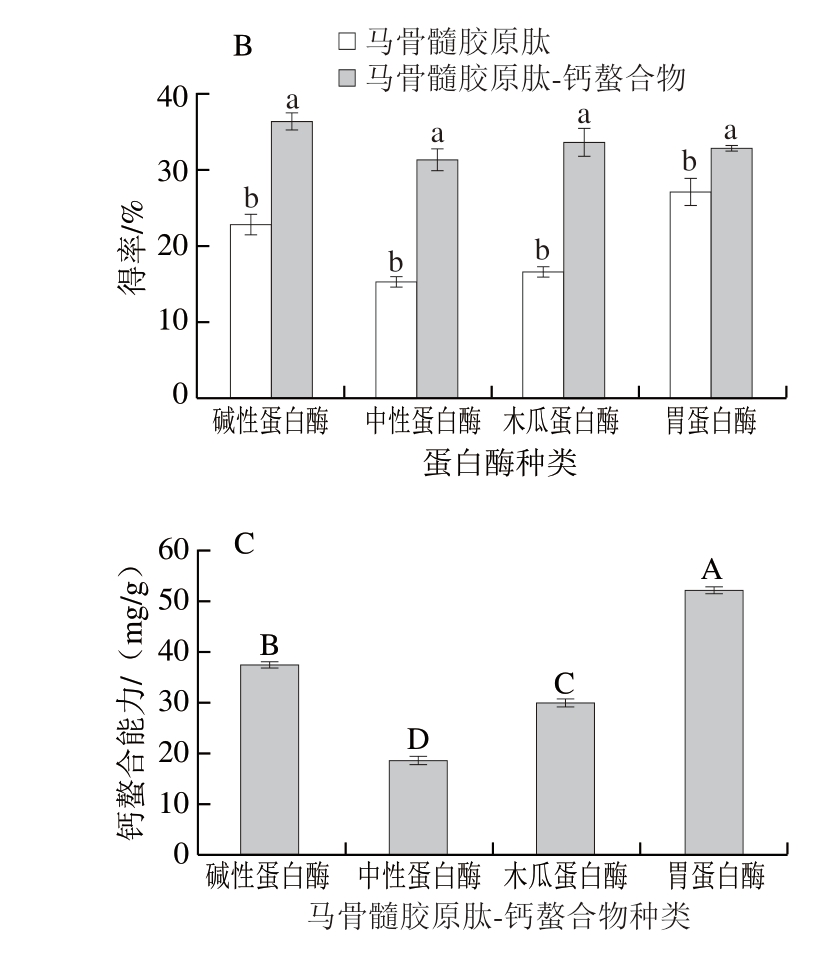
图1 不同马骨髓胶原肽及其钙螯合物的蛋白质含量(A)、得率(B)及钙螯合能力(C)
Fig. 1 Protein content (A), yield (B), and calcium-chelating capacity (C) of different horse bone marrow collagen-derived peptides and their calcium chelates
小写字母不同表示马骨髓胶原肽及其钙螯合物间差异显著(P<0.05),图7同;大写字母不同表示组间差异显著(P<0.05)。
2.2 不同马骨髓胶原肽及其钙螯合物结构表征
2.2.1 不同马骨髓胶原肽及其钙螯合物紫外光谱分析
紫外光谱是一种测定样品中是否出现新物质的分析方法[37-38]。如图2A所示,与钙螯合后,样品特征吸收峰的位置有明显变化。不同马骨髓胶原肽在218~223 nm处有较强吸收峰,因为胶原肽中存在羰基、羧基和酰胺基显色基团等[39],与钙螯合后,其特征吸收峰均发生蓝移,可能是肽中的显色基团与钙离子配位结合,电子发生跃迁,导致特征吸收峰蓝移[40]。波长280 nm左右处也观察到微弱的吸收峰,可能是胶原肽中的芳香族氨基酸引起的[41],胶原肽与钙螯合后,吸收峰发生红移;也可能是钙离子自身或钙离子与胶原肽配位结合所致[39],影响了电子的跃迁,使吸收峰位置发生改变。综上可知,肽与钙离子发生配位结合,形成新物质马骨髓胶原肽-钙螯合物。
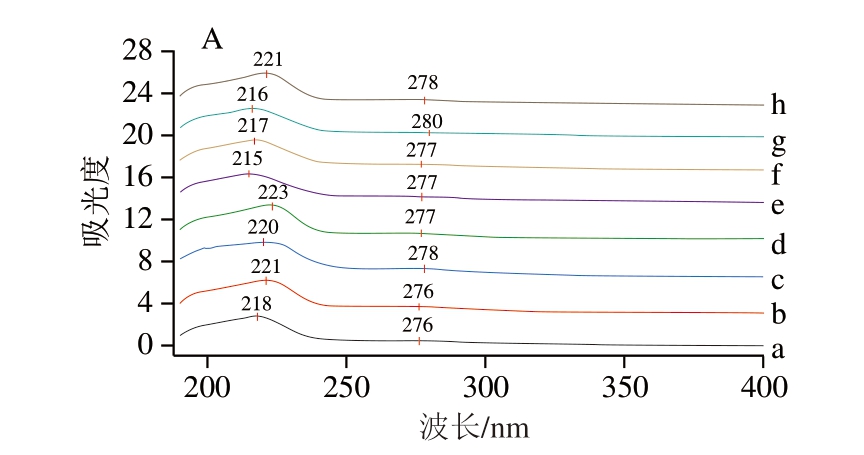
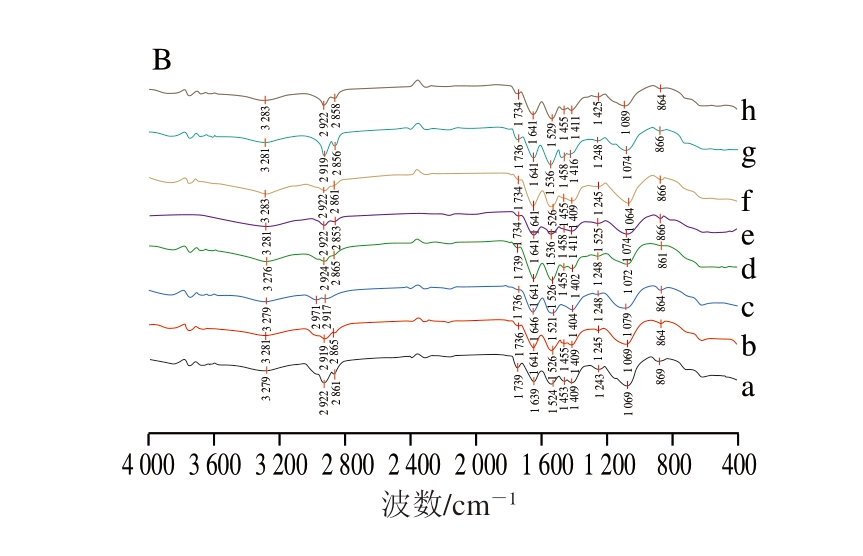
图2 不同马骨髓胶原肽及其钙螯合物的紫外光谱图(A)及
FTIR光谱图(B)
Fig. 2 UV (A) and FTIR spectra (B) of different horse bone marrow collagen-derived peptides and their calcium chelates
a~h.分别为碱性蛋白酶马骨髓胶原肽、中性蛋白酶马骨髓胶原肽、木瓜蛋白酶马骨髓胶原肽、胃蛋白酶马骨髓胶原肽、碱性蛋白酶马骨髓胶原肽-钙螯合物、中性蛋白酶马骨髓胶原肽-钙螯合物、木瓜蛋白酶马骨髓胶原肽-钙螯合物、胃蛋白酶马骨髓胶原肽-钙螯合物。
2.2.2 不同马骨髓胶原肽及其钙螯合物FTIR光谱分析
如图2b、表1所示,相较于不同马骨髓胶原肽,其钙螯合物的FTIR光谱发生显著变化。3 300~3 200 cm-1区域的吸收峰属于酰胺A带,由N—H的伸缩振动引起,碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、胃蛋白酶马骨髓胶原肽分别在3 279、3 281、3 279、3 276 cm-1附近有特征吸收峰,与钙离子结合后,其吸收峰的位置和强度发生改变,表明不同马骨髓胶原肽肽段上的N—H可能与钙离子结合[42]。2 950~2 900 cm-1附近的吸收峰属于酰胺B带,由C—N的伸缩振动引起,不同马骨髓胶原肽分别在2 922、2 919、2 917、2 924 cm-1附近均有明显吸收峰,与钙螯合后,该吸收峰的位置和强度发生变化。1 540 cm-1附近的吸收峰是酰胺II带的特征吸收峰[43],由N—H面内弯曲振动、C—N伸缩振动引起,不同马骨髓胶原肽分别在1 524、1 526、1 521、1 526 cm-1附近均有明显吸收峰,与钙离子螯合后,该吸收峰的位置发生改变,表明不同马骨髓胶原肽肽段上的C—N可能与钙离子结合。酰胺I带是主要由C=O的伸缩振动产生的特征吸收峰,通常在1 700~1 600 cm-1范围内,不同马骨髓胶原肽分别在1 639、1 641、1 646、1 641 cm-1附近均有明显吸收峰,与钙螯合后,该吸收峰的位置发生变化,表明C=O可能与钙离子结合[44]。1 400 cm-1附近为—COOH的吸收峰[45],除中性蛋白酶马骨髓胶原肽外,其他马骨髓胶原肽与钙离子结合后,该吸收峰均红移,表明—COOH可能与钙离子结合形成—COO-Ca。
表1 不同马骨髓胶原肽及其钙螯合物的FTIR光谱吸收峰及产生原因
Table 1 FTIR spectroscopy absorption peaks of different horse bone marrow collagen-derived peptides and their calcium chelates and reasons for their formation
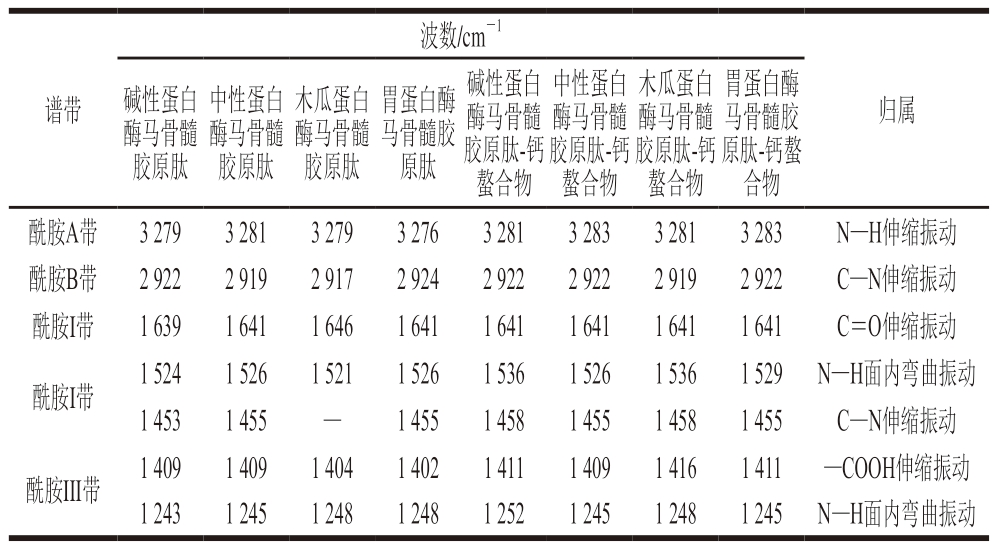
注:—.未检出。
?
如图3所示,酶解及螯合对胶原蛋白二级结构的影响较为明显。4 种马骨髓蛋白酶解物之间及与其对应的钙螯合物之间的α-螺旋、β-折叠、β-转角及无规卷曲相对含量均有一定的差异。碱性蛋白酶、胃蛋白酶马骨髓胶原肽-钙螯合物蛋白质二级结构中的α-螺旋和β-折叠的相对含量均增加,其中胃蛋白酶马骨髓胶原肽-钙螯合物的蛋白质二级结构变化最明显。Sun Na等[46]以南极磷虾为原料,发现亚铁离子与多肽结合后,能够减少多肽的无规卷曲结构,增加其α-螺旋和β-折叠比例,从而增强螯合物的稳定性,这与不同马骨髓胶原肽及其钙螯合物的二级结构变化趋势相似。
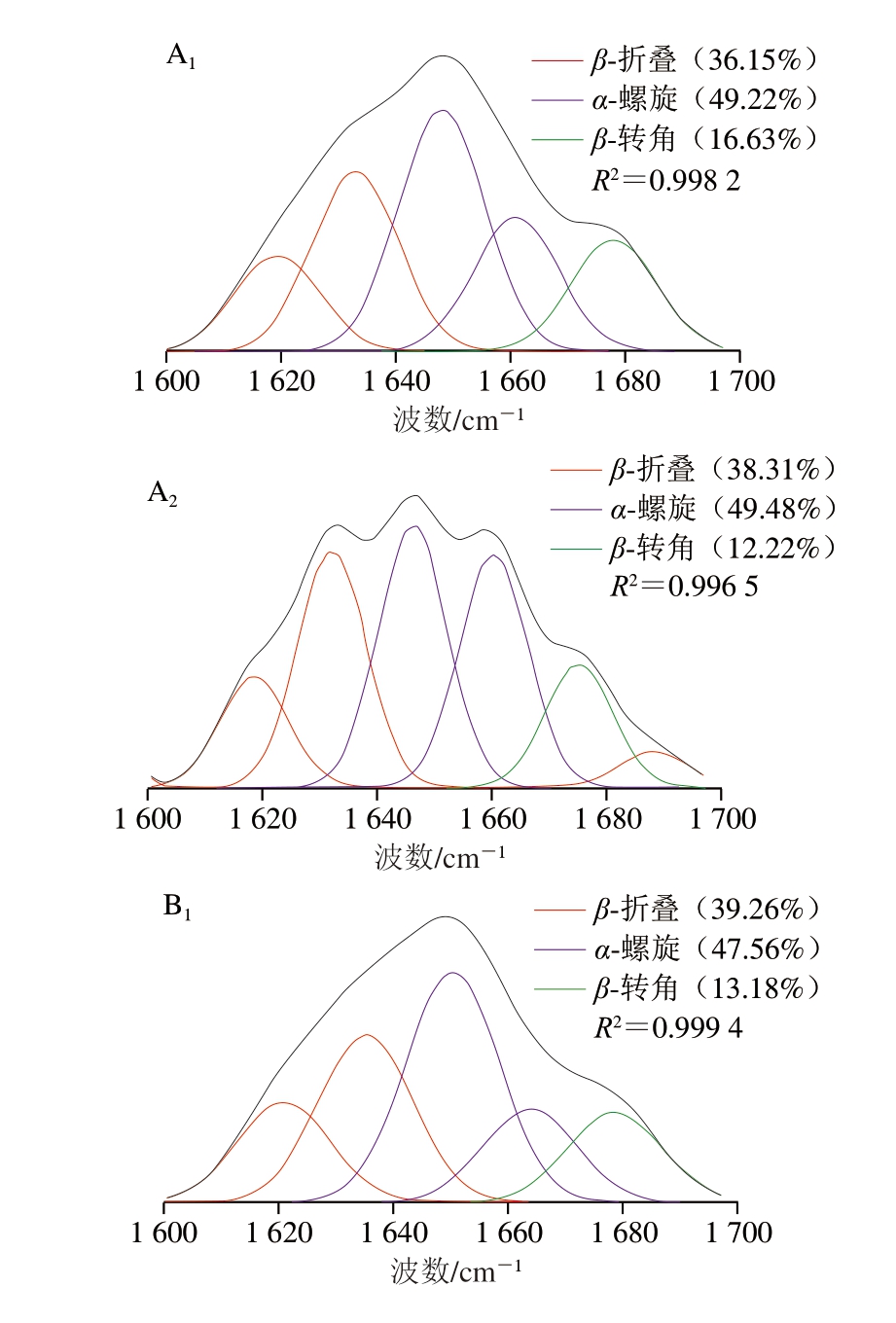
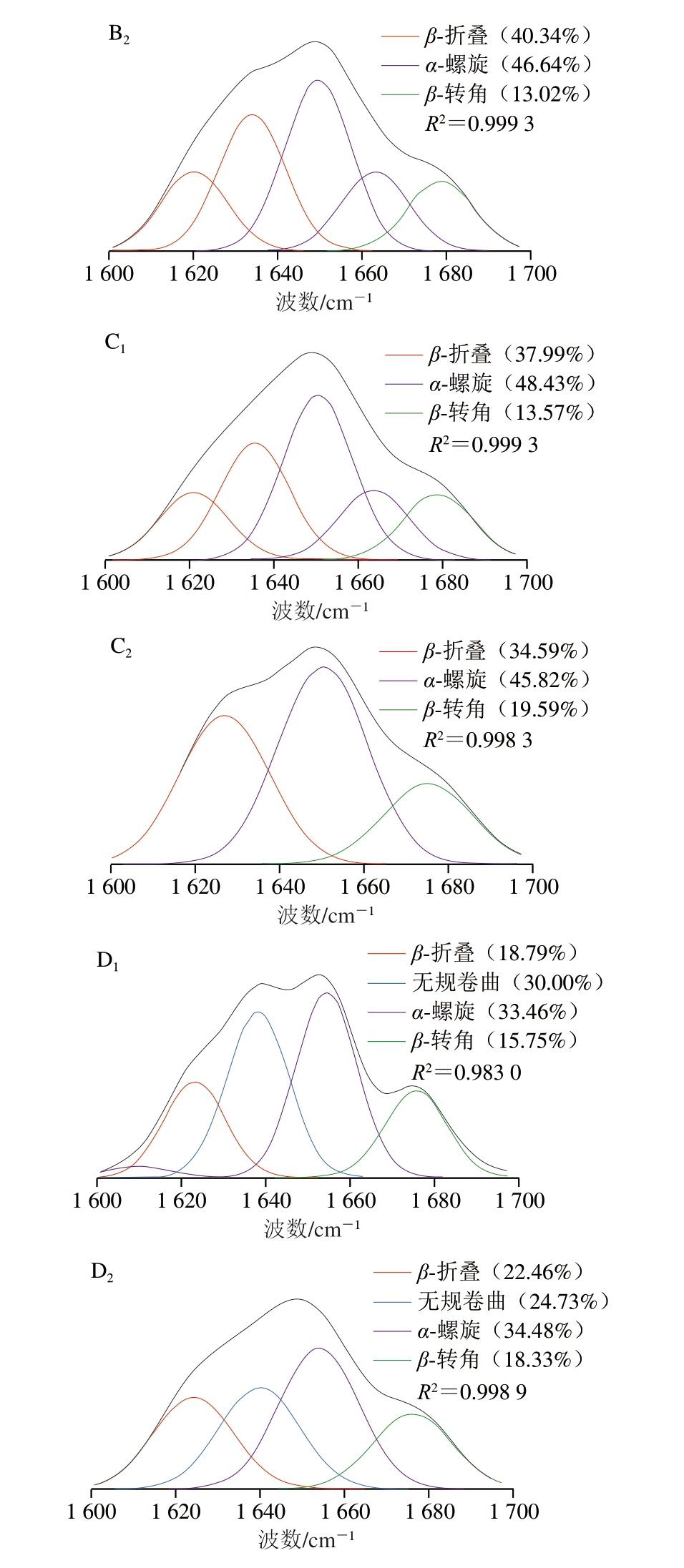
图3 不同马骨髓胶原肽及其钙螯合物的二级结构曲线拟合图
Fig. 3 Secondary structure curve fitting of different horse bone marrow collagen-derived peptides and their calcium chelates
A1.碱性蛋白酶马骨髓胶原肽;A2.碱性蛋白酶马骨髓胶原肽-钙螯合物;B1.中性蛋白酶马骨髓胶原肽;B2.中性蛋白酶马骨髓胶原肽-钙螯合物;C1.木瓜蛋白酶马骨髓胶原肽;C2.木瓜蛋白酶马骨髓胶原肽-钙螯合物;D1.胃蛋白酶马骨髓胶原肽;D2.胃蛋白酶马骨髓胶原肽-钙螯合物。
2.2.3 不同马骨髓胶原肽及其钙螯合物微观结构及表面元素组成分析
如图4所示,马骨髓原蛋白表面整体较为光滑,呈较为完整的片状结构。经酶解处理后,其表面结构发生明显变化。碱性蛋白酶、木瓜蛋白酶、胃蛋白酶马骨髓胶原肽表现为疏松且不规则的片状、球状和条状结构,与马骨髓原蛋白相比,表面形态略微粗糙,中性蛋白酶马骨髓胶原肽表现为规则的球状和椭球状结构,并且穿插棒状结构,表面较为光滑。结构改变的原因或许是马骨髓蛋白在酶的作用下被分解成小肽段,其二级结构遭到破坏,进而导致分子排列方式改变,形成不同于马骨髓蛋白的结构形态[47]。马骨髓胶原肽与钙结合后形成致密的结构,表面粗糙,与盐类似,并呈现出小颗粒的聚集体。结构的改变可能是由于多肽与钙离子形成的配位键导致分子内部结构折叠,进而形成细小颗粒并相互吸引,造成聚集现象[12]。其中,中性蛋白酶马骨髓胶原肽-钙螯合物与其他钙螯合物相比,结构较为疏松,呈网状结构,因其螯合前的肽与其他肽相比颗粒较小且空间结构疏松;胃蛋白酶马骨髓胶原肽-钙螯合物与其他钙螯合物相比,小颗粒的聚集体分布范围较小。在同一螯合条件下,不同蛋白酶酶解物对马骨髓多肽螯合物的表面结构可产生不同的影响。

图4 不同马骨髓胶原肽及其钙螯合物微观结构图
Fig. 4 SEM images of different horse bone marrow collagen-derived peptides and their calcium chelates
A1.原蛋白(×1 000);A2.原蛋白(×2 000);B1.碱性蛋白酶马骨髓胶原肽(×2 000);B2.碱性蛋白酶马骨髓胶原肽-钙螯合物(×2 000);C1.中性蛋白酶马骨髓胶原肽(×2 000);C2.中性蛋白酶马骨髓胶原肽-钙螯合物(×2 000);D1.木瓜蛋白酶马骨髓胶原肽(×2 000);D2.木瓜蛋白酶马骨髓胶原肽-钙螯合物(×2 000);E1.胃蛋白酶马骨髓胶原肽(×2 000);E2.胃蛋白酶马骨髓胶原肽-钙螯合物(×2 000)。
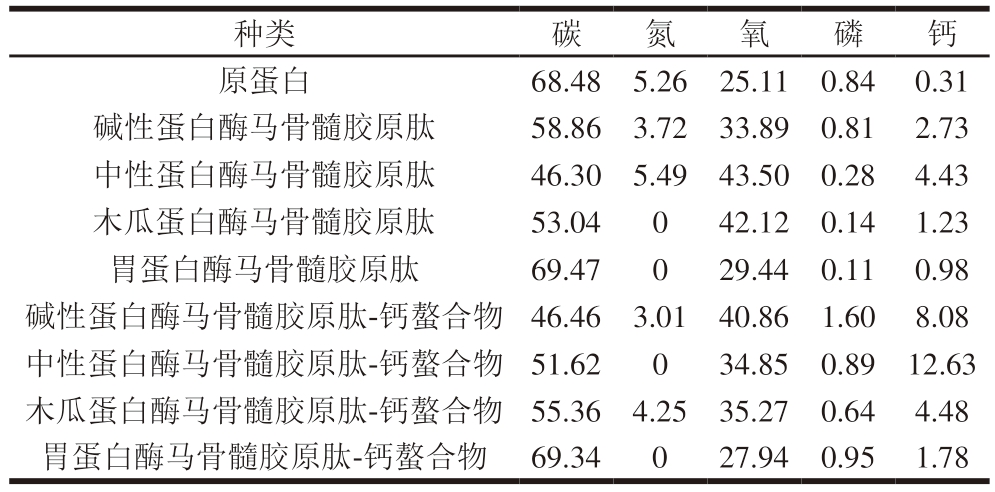
对不同马骨髓胶原肽及其钙螯合物的元素组成进行分析,如图5和表2所示,马骨髓蛋白经酶解后,钙元素的质量分数增加,与其他马骨髓胶原肽相比,中性蛋白酶马骨髓胶原肽中钙质量分数最高,达4.43%,螯合后增至12.63%,碱性蛋白酶马骨髓胶原肽由2.73%增至8.08%,木瓜蛋白酶马骨髓胶原肽由1.23%增至4.48%,胃蛋白酶马骨髓胶原肽由原来的0.98%增至1.78%。用于观察的肽-钙螯合物是经5 倍体积无水乙醇沉降并透析24 h后获得的样品,此过程排除了游离钙的干扰。元素分析结果表明,在螯合反应中,多肽与钙离子大量结合。
表2 不同马骨髓胶原肽及其钙螯合物的元素质量分数
Table 2 Element composition of different horse bone marrow collagen-derived peptides and their calcium chelates%
?
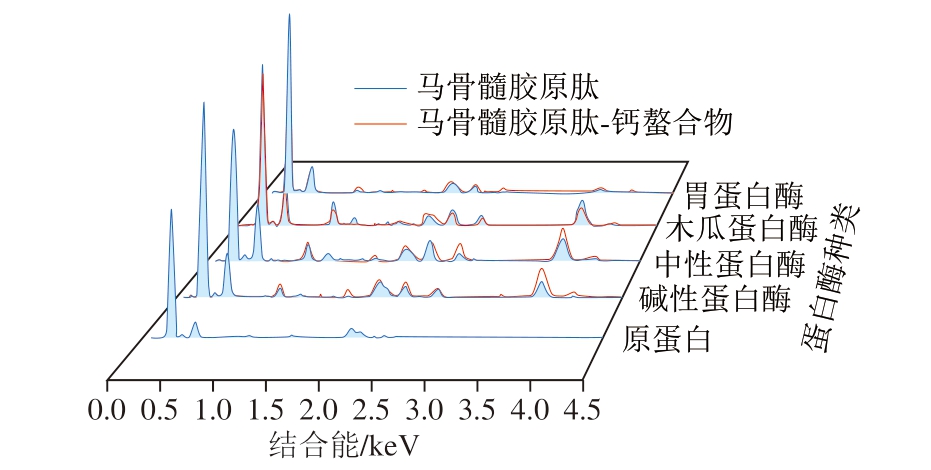
图5 不同马骨髓胶原肽及其钙螯合物的EDX光谱图
Fig. 5 Energy dispersive X-ray spectrometry profiles of different horse bone marrow collagen-derived peptides and their calcium chelates
2.3 不同马骨髓胶原肽及其钙螯合物抗氧化活性分析
2.3.1 不同马骨髓胶原肽及其钙螯合物DPPH自由基清除率
如图6A所示,在质量浓度0.1~1.0 mg/mL范围内,样品的DPPH自由基清除能力与质量浓度成正比,不同蛋白酶制备的样品DPPH自由基清除效果存在明显差异。当质量浓度达1.0 mg/mL时,马骨髓胶原肽的DPPH自由基清除率由大到小依次为木瓜蛋白酶(46.04%)、中性蛋白酶(23.73%)、胃蛋白酶(19.98%)、碱性蛋白酶马骨髓胶原肽(19.75%);其钙螯合物的DPPH自由基清除率依次为碱性蛋白酶(25.93%)、胃蛋白酶(24.28%)、中性蛋白酶(20.57%)、木瓜蛋白酶马骨髓胶原肽-钙螯合物(19.49%)。其中碱性蛋白酶与胃蛋白酶马骨髓胶原肽-钙螯合物的DPPH自由基清除能力强于螯合前的胶原肽。焦玉晗[48]以狭鳕鱼骨为原料制备胶原肽-钙螯合物,发现其DPPH自由基清除率高于胶原肽,与本研究结果相似。
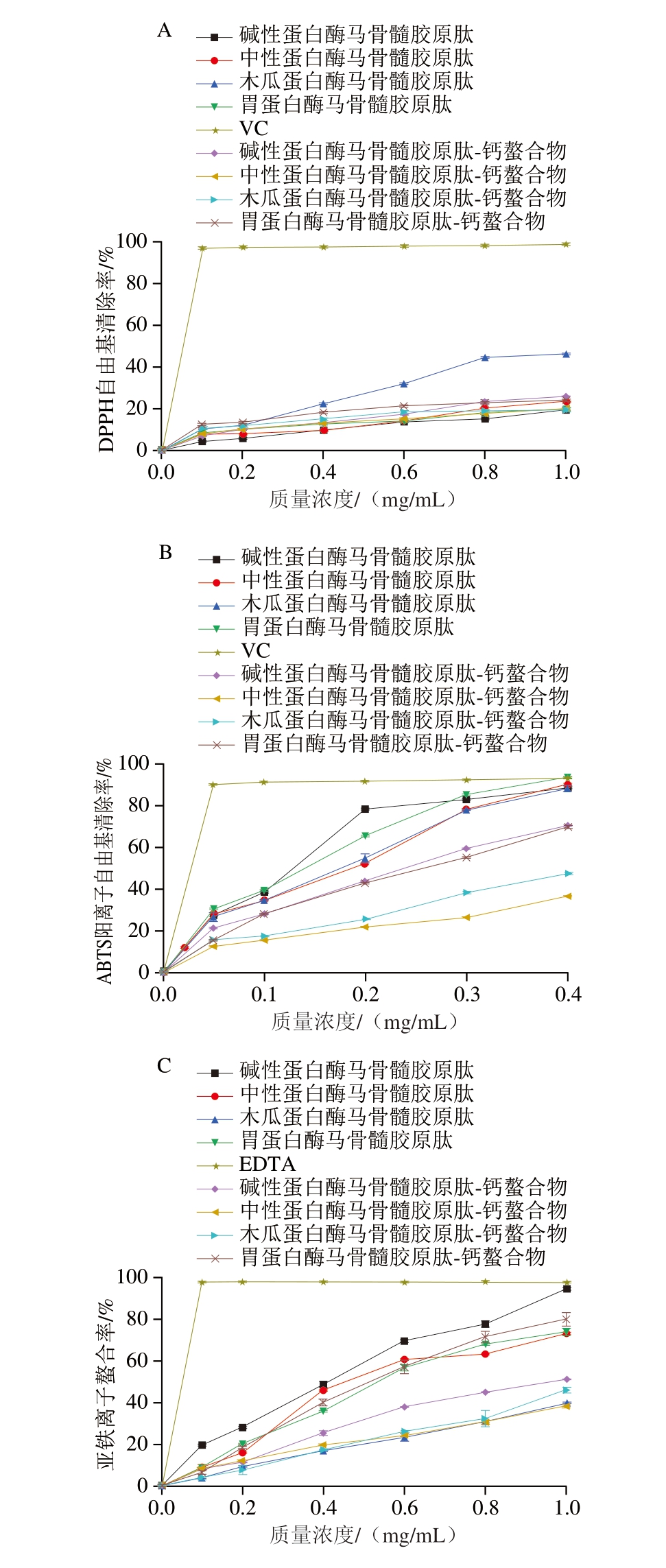
图6 马骨髓胶原肽及其钙螯合物抗氧化活性
Fig. 6 Antioxidant activity of horse bone marrow collagen-derived peptides and their calcium chelates
A. DPPH自由基清除率;B. ABTS阳离子自由基清除率;C.亚铁离子螯合率。
2.3.2 不同马骨髓胶原肽及其钙螯合物ABTS阳离子自由基清除率
如图6B所示,在质量浓度0.05~0.40 mg/mL范围内,样品的ABTS阳离子自由基清除能力与质量浓度成正比,不同蛋白酶制备的样品ABTS阳离子自由基清除效果存在明显差异。当质量浓度达0.4 mg/mL时,马骨髓胶原肽的ABTS阳离子自由基清除率由大到小依次为胃蛋白酶(93.42%)、中性蛋白酶(89.89%)、碱性蛋白酶(88.29%)、木瓜蛋白酶马骨髓胶原肽(87.96%);其钙螯合物的ABTS阳离子自由基清除率依次为碱性蛋白酶(70.17%)、胃蛋白酶(69.67%)、木瓜蛋白酶(47.25%)、中性蛋白酶马骨髓胶原肽-钙螯合物(36.49%)。肽-钙螯合物中,碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、胃蛋白酶马骨髓胶原肽-钙螯合物的ABTS阳离子自由基清除能力的IC50分别为0.21、1.20、0.56、0.23 mg/mL,明显优于澳洲牛骨蛋白肽的ABTS阳离子自由基清除能力(IC50为1.56 mg/mL)[49]。不同马骨髓胶原肽-钙螯合物的ABTS阳离子自由基清除率均低于多肽,可能是由于该螯合条件不是最优,对其活性影响较大[50],需要进一步优化螯合条件。
2.3.3 不同马骨髓胶原肽及其钙螯合物亚铁离子螯合能力
如图6C所示,在质量浓度0.1~1.0 mg/mL范围内,样品的亚铁离子螯合能力与质量浓度成正比,不同蛋白酶制备的样品的亚铁离子螯合能力存在明显差异。当质量浓度达1.0 mg/mL时,马骨髓胶原肽的亚铁离子螯合率由大到小依次为碱性蛋白酶(94.58%)、胃蛋白酶(73.74%)、中性蛋白酶(73.27%)、木瓜蛋白酶马骨髓胶原肽(39.30%);其钙螯合物对亚铁离子螯合率依次为胃蛋白酶(79.94%)、碱性蛋白酶(51.24%)、木瓜蛋白酶(46.09%)、中性蛋白酶马骨髓胶原肽-钙螯合物(38.44%)。其中碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、胃蛋白酶马骨髓胶原肽-钙螯合物的亚铁离子螯合能力的IC50分别为0.96、2.04、1.27、0.48 mg/mL,其中木瓜蛋白酶、胃蛋白酶马骨髓胶原肽-钙螯合物的亚铁离子螯合能力IC50优于螯合前(1.54、0.51 mg/mL)。邓梅等[33]研究发现,鱼多肽的亚铁离子螯合能力较强,与马骨髓胶原肽-钙螯合物的IC50相近,以上结果表明,马骨髓胶原肽是金属离子螯合剂的优质来源。
2.4 不同马骨髓胶原肽及其钙螯合物理化性质
2.4.1 不同马骨髓胶原肽及其钙螯合物持油性
持油性的提高有利于改善和提升产品的风味[51]。如图7A所示,马骨髓胶原肽持油性由高到低依次为中性蛋白酶(35.92 g/g)、木瓜蛋白酶(32.29 g/g)、碱性蛋白酶(31.32 g/g)、胃蛋白酶马骨髓胶原肽(27.82 g/g),马骨髓胶原肽-钙螯合物依次为胃蛋白酶(38.07 g/g)、中性蛋白酶(37.90 g/g)、木瓜蛋白酶(33.39 g/g)、碱性蛋白酶马骨髓胶原肽-钙螯合物(32.95 g/g),螯合物的持油性均高于胶原肽,可能是由于马骨髓胶原肽与钙螯合后,表面变得粗糙且出现小颗粒聚集体,更易于油脂的吸附,其中胃蛋白酶马骨髓胶原肽-钙螯合物的变化幅度最大。
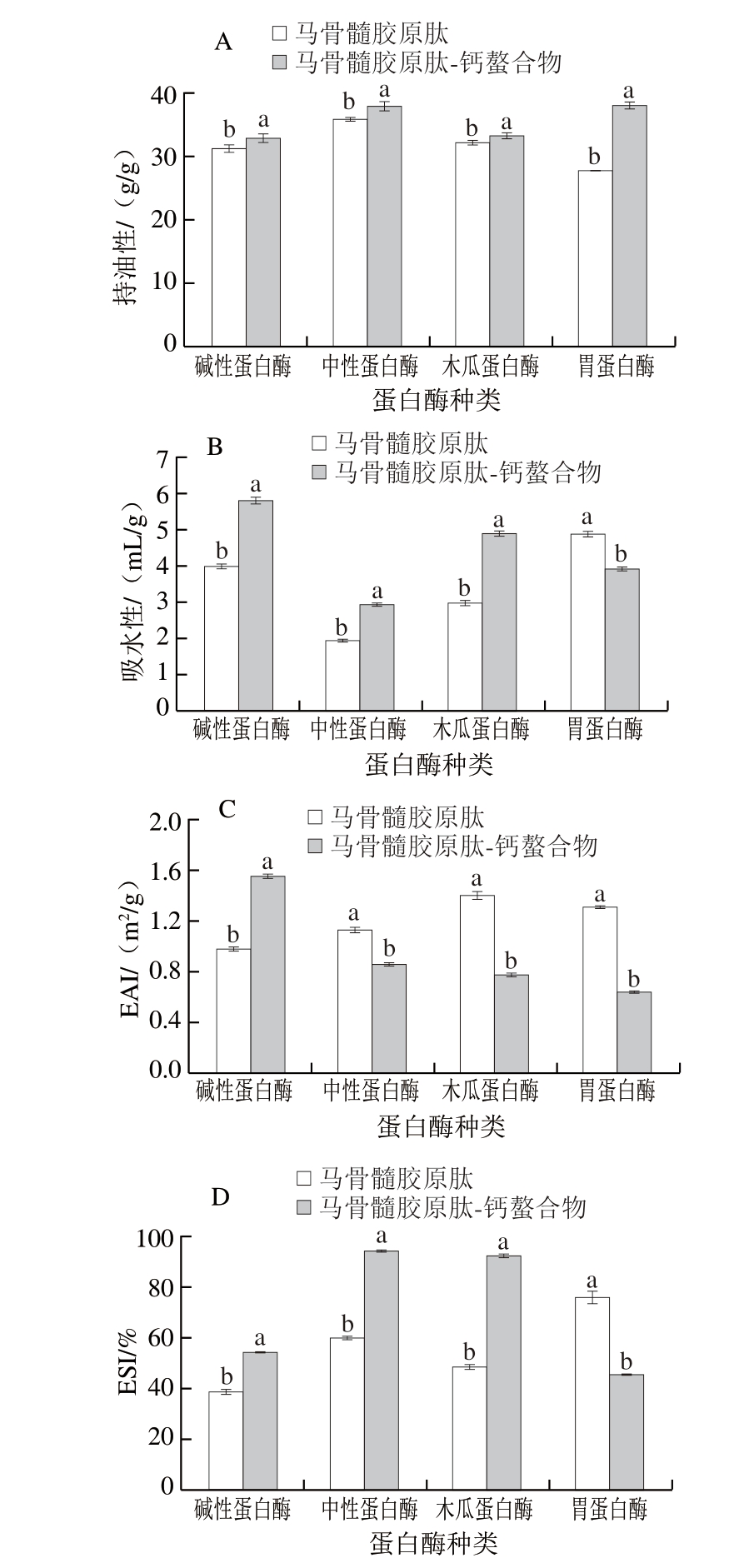
图7 马骨髓胶原肽及其钙螯合物的功能特性
Fig. 7 Functional properties of horse bone marrow collagen-derived peptide and their calcium chelate
A.持油性;B.吸水性;C. EAI;D. ESI。
2.4.2 不同马骨髓胶原肽及其钙螯合物吸水性
如图7B所示,马骨髓胶原肽吸水性由高到低依次为胃蛋白酶(4.90 mL/g)、碱性蛋白酶(4.00 mL/g)、木瓜蛋白酶(2.98 mL/g)、中性蛋白酶马骨髓胶原肽(1.94 mL/g),螯合物的吸水性依次为碱性蛋白酶(5.82 mL/g)、木瓜蛋白酶(4.90 mL/g)、胃蛋白酶(3.92 mL/g)、中性蛋白酶马骨髓胶原肽-钙螯合物(2.94 mL/g),除胃蛋白酶马骨髓胶原肽-钙螯合物外,其余螯合物的吸水性明显高于胶原肽,可能是由于螯合后肽的空间结构变得疏松,使保留的水分子增多[1],或螯合提高了肽的溶解度[48]。
2.4.3 不同马骨髓胶原肽及其钙螯合物EAI和ESI
由图7C、D可知,碱性蛋白酶马骨髓胶原肽-钙螯合物的EAI为1.56 m2/g,显著高于碱性蛋白酶马骨髓胶原肽(P<0.05);除胃蛋白酶马骨髓胶原肽-钙螯合物外,其他肽-钙螯合物的ESI明显高于螯合前的肽。其中,碱性蛋白酶马骨髓胶原肽-钙螯合物的EAI最佳,中性蛋白酶和木瓜蛋白酶马骨髓胶原肽-钙螯合物的ESI最佳。
3 讨 论
本研究探讨了马骨髓胶原肽及其钙螯合物的理化特性,为进一步优化马骨髓胶原肽及其钙螯合物的制备方法提供了理论依据。结果显示,不同马骨髓胶原肽的蛋白质含量高于其钙螯合物,祝超智等[50]对牛血红蛋白肽-亚铁离子螯合物的制备工艺进行优化,发现加酶量对螯合物的蛋白质含量影响较大,随着加酶量的增加,螯合物的蛋白质含量先增大后减小。本研究中,酶解后马骨髓胶原肽的蛋白质含量高于其钙螯合物,原因可能与马骨髓蛋白的酶解条件相关。因此,后期研究可对酶解条件进一步优化,从而提高马骨髓肽-钙螯合物的蛋白质含量。
对不同马骨髓胶原肽及其钙螯合物结构表征分析,发现形成了新的化合物。钙离子与多肽结合后,能够减少多肽的无规卷曲结构,增加其α-螺旋和β-折叠的相对含量,从而增强螯合物的稳定性[46],这与不同马骨髓胶原肽及其钙螯合物的二级结构变化趋势相似。元素分析结果表明,不同马骨髓胶原肽与钙螯合后,钙含量增加,碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、胃蛋白酶马骨髓胶原肽-钙螯合物的钙质量分数分别为8.08%、12.63%、4.48%、1.78%,其中碱性蛋白酶、中性蛋白酶马骨髓胶原肽对钙离子的亲和力较强。韩克光等[52]对比分析羊骨胶原多肽螯合前后的元素含量,发现羊骨胶原多肽螯合后,碳、氧元素的质量分数下降,钙元素的质量分数由1.76%增加至6.84%。齐立伟等[25]以牛骨肽、氯化钙为原料制备牛骨肽-钙螯合物,螯合量为55.65 μg/mg,扫描电子显微镜观察结果显示,螯合后的牛骨肽表面形成颗粒聚集的致密结构,与本研究结果相似。
抗氧化活性分析结果表明,碱性蛋白酶和胃蛋白酶马骨髓胶原肽-钙螯合物的DPPH自由基清除能力比胶原肽更具优势,而不同马骨髓胶原肽-钙螯合物对ABTS阳离子自由基的清除能力和亚铁离子的螯合能力较螯合前降低,这可能是由于肽与钙离子螯合后,结构发生改变,进而导致氧化还原电势小于蛋白酶酶解物[12]。厉荣玉等[53]对酪蛋白源抗氧化肽GYLEQ与钙离子螯合作用的反应条件进行优化,结果表明,螯合物的抗氧化活性均强于肽。胶原肽的结构与其生物活性紧密相关,上述研究发现,不同酶酶解后的马骨髓胶原肽及胶原肽-钙螯合物均显出不同的抗氧化活性,除亚铁离子螯合能力外,碱性蛋白酶马骨髓胶原肽-钙螯合物的抗氧化活性强于其他钙螯合物;胃蛋白酶马骨髓胶原肽-钙螯合物的亚铁离子螯合能力强于其他钙螯合物,此结果表明,不同酶对同一种胶原蛋白的作用位点不同,从而导致酶解产生的胶原肽不同。马骨髓胶原蛋白经胃蛋白酶酶解后的胶原肽及其钙螯合物结构的供电子能力更强,从而展现出更好的抗氧化活性。因此,在后续研究中进一步优化马骨髓胶原蛋白的胃蛋白酶酶解工艺及钙离子螯合工艺可得到活性更高的肽-钙螯合物。不同马骨髓胶原肽及其钙螯合物的理化性质良好,且螯合后的胶原肽中钙含量明显提高,后期应进一步优化螯合物的制备条件,以提高其抗氧化活性,且其具有潜在的抗氧化功效和促进成骨细胞成骨活性,在食品和医药领域发展前景广阔。
4 结 论
本研究对比分析马骨髓胶原肽及其钙螯合物的得率、蛋白质含量、结构、抗氧化活性、持油性、吸水性、EAI及ESI。马骨髓胶原肽及其钙螯合物的FTIR光谱图中均出现特征吸收峰,且螯合后的马骨髓胶原肽形成表面粗糙的致密小颗粒聚集体,元素分析结果表明,螯合物中的钙含量明显提高。马骨髓胶原肽及其钙螯合物的抗氧化能力较好,其中碱性蛋白酶、胃蛋白酶马骨髓胶原肽-钙螯合物的DPPH自由基清除能力和木瓜蛋白酶、胃蛋白酶马骨髓胶原肽-钙螯合物的亚铁离子螯合能力比胶原肽更具优势。肽与钙螯合后,持油性均有所提高,碱性蛋白酶马骨髓胶原肽与钙螯合后吸水性显著升高至5.82 mL/g(P<0.05),胃蛋白酶马骨髓胶原肽-钙螯合物蛋白质量分数较高,为39.97%,碱性蛋白酶马骨髓胶原肽-钙螯合物的EAI最高,为1.56 m2/g,中性蛋白酶马骨髓胶原肽-钙螯合物的ESI最高,为94.39%,且除胃蛋白酶马骨髓胶原肽-钙螯合物外,钙螯合物的ESI与胶原肽相比均有所提高。结果表明,与钙离子螯合可提高马骨髓胶原肽中钙元素的含量,从而增强其抗氧化活性及理化特性。因此,其在肽-钙补充剂方面具有潜在开发价值。后期研究将对马骨髓胶原肽-钙螯合物进一步分离纯化,鉴定相关活性肽序列,并深入探究其在体内的吸收效率和促进钙吸收的机理,为新资源食品开发提供基础。
[1] HAMDI M, KILARI B P, MUDGIL P, et al. Bioactive peptides with potential anticancer properties from various food protein sources:status of recent research, production technologies, and developments[J]. Critical Reviews in Biotechnology, 2025, 45(5):2435965. DOI:10.1080/07388551.2024.2435965.
[2] 贾小芳, 苏畅, 何宇纳, 等. 2022—2023年中国十省(自治区)成年居民宏量营养素摄入现状及食物来源[J]. 卫生研究, 2024, 53(6):862-869; 879. DOI:10.19813/j.cnki.weishengyanjiu.
[3] SIDDIQUE N, O’DONOGHUE M, CASEY M C, et al. Malnutrition in the elderly and its effects on bone health:a review[J]. Clinical Nutrition ESPEN, 2017, 21:31-39. DOI:10.1016/j.clnesp.2017.06.001.
[4] 杨玲, 杜娟, 刘荣雁, 等. 肌肉减少症病因学研究现状与展望[J].中国骨质疏松杂志, 2020, 26(11):1689-1693. DOI:10.3969/j.issn.1006-7108.2020.11.024.
[5] BOIRIE Y, MORIO B, CAUMON E, et al. Nutrition and protein energy homeostasis in elderly[J]. Mechanisms of Ageing and Development, 2014, 136:76-84. DOI:10.1016/j.mad.2014.01.008.
[6] CRUZ-JENTOFT A J, BAHAT G, BAUER J, et al. Sarcopenia:revised European consensus on definition and diagnosis[J]. Age and Ageing,2019, 48(1):16-31. DOI:10.1093/ageing/afy169.
[7] ZAKY A A, CHEN Z, LIU Y L, et al. Preparation and assessment of bioactive extracts having antioxidant activity from rice bran protein hydrolysates[J]. Journal of Food Measurement and Characterization,2019, 13(4):2542-2548. DOI:10.1007/s11694-019-00174-9.
[8] GARZÓN A G, VERAS F F, BRANDELLI A, et al. Purification,identification and in silico studies of antioxidant, antidiabetogenic and antibacterial peptides obtained from Sorghum spent grain hydrolysate[J]. LWT-Food Science and Technology, 2022, 153:112414. DOI:10.1016/j.lwt.2021.112414.
[9] AONDONA M M, IKYA J K, UKEYIMA M T, et al. In vitro antioxidant and antihypertensive properties of sesame seed enzymatic protein hydrolysate and ultrafiltration peptide fractions[J]. Journal of Food Biochemistry, 2021, 45(1):e13587. DOI:10.1111/jfbc.13587.
[10] YANG X Y, ZHONG D Y, WANG G L, et al. Effect of walnut meal peptides on hyperlipidemia and hepatic lipid metabolism in rats fed a high-fat diet[J]. Nutrients, 2021, 13(5):1410. DOI:10.3390/nu13051410.
[11] WANG J, DU K Y, FANG L, et al. Evaluation of the antidiabetic activity of hydrolyzed peptides derived from Juglans mandshurica Maxim. fruits in insulin-resistant HepG2 cells and type 2 diabetic mice[J]. Journal of Food Biochemistry, 2018, 42(3):e12518. DOI:10.1111/jfbc.12518.
[12] 周小翠, 靳国锋, 金永国, 等. 畜禽骨蛋白水解及多肽螯合钙研究进展[J]. 肉类研究, 2015, 29(8):31-36. DOI:10.7506/rlyj1001-8123-201508008.
[13] 汪婧瑜, 张业辉, 张友胜, 等. 不同结构的乌鳢螯合肽对抗氧化活性的影响[J]. 中国食品学报, 2019, 19(10):93-99. DOI:10.16429/j.1009-7848.2019.10.011.
[14] FANG Z, XU L Z, LIN Y L, et al. The preservative potential of Octopus scraps peptides-zinc chelate against Staphylococcus aureus:its fabrication, antibacterial activity and action mode[J]. Food Control,2019, 98:24-33. DOI:10.1016/j.foodcont.2018.11.015.
[15] HUA P P, XIONG Y, YU Z Y, et al. Effect of Chlorella pyrenoidosa protein hydrolysate-calcium chelate on calcium absorption metabolism and gut microbiota composition in low-calcium diet-fed rats[J]. Marine Drugs, 2019, 17(6):348. DOI:10.3390/md17060348.
[16] 江斌伟. 一匹伊犁马身价何以飙升至30 万元?[N]. 乌鲁木齐晚报(汉), 2025-04-06(2). DOI:10.28830/n.cnki.nwlwb.2025.000938.
[17] Food and Agriculture Organization of the United Nations. FAOSTAT Database:2023[R]. Rome:FAO, 2023.
[18] 帕尔哈提·柔孜, 杨晓君, 木合布力·阿布力孜, 等. 4 种动物骨骼的化学成分与生物活性研究进展[J]. 现代食品科技, 2020, 36(5):337-346. DOI:10.13982/j.mfst.1673-9078.2020.5.044.
[19] 秦娜娜. 马骨胶原蛋白肽粉及苹果酸钙制备工艺研究[D]. 乌鲁木齐:新疆农业大学, 2013.
[20] 帕尔哈提·柔孜, 艾合米丁·外力, 陈志慧, 等. 新疆4 种动物骨质和骨髓中蛋白、常量及微量元素比较分析[J]. 中国实验方剂学杂志,2018, 24(12):39-46. DOI:10.13422/j.cnki.syfjx.20181208.
[21] 金淑秀, 王钰慧, 霍乃蕊, 等. 羊骨髓肽及其钙螯合物对成骨细胞增殖和活性的影响[J]. 畜牧兽医学报, 2018, 49(12):2745-2752.DOI:10.11843/j.issn.0366-6964.2018.12.024.
[22] 帕尔哈提·柔孜, 帕丽达·买买提, 高彦华, 等. 4 种动物骨骼氨基酸组成及其营养价值评价[J]. 食品研究与开发, 2018, 39(11):144-151.DOI:10.3969/j.issn.1005-6521.2018.11.028.
[23] 古丽米热·阿巴拜克日, 帕尔哈提·柔孜, 则拉莱·司玛依, 等. 牛骨髓蛋白的酶解工艺优化及其理化性质和抗氧化特性[J].食品工业科技, 2023, 44(20):171-181. DOI:10.13386/j.issn1002-0306.2022100246.
[24] 黄潘钿, 陈冰冰, 沈金鹏, 等. 珍珠贝肉抗氧化肽制备工艺优化及其对酪氨酸酶的抑制活性[J]. 现代食品科技, 2022, 38(4):52-61.DOI:10.13982/j.mfst.1673-9078.2022.4.0468.
[25] 齐立伟, 张鸿儒, 郭玉杰, 等. 牛骨肽钙螯合物制备、表征及其促MC3T3-E1细胞成骨活性[J]. 食品科学, 2023, 44(6):107-115.DOI:10.7506/spkx1002-6630-20220319-226.
[26] 吾哈丽妮萨·麦麦提托合提, 帕尔哈提·柔孜, 杨晓君, 等. 响应面优化马骨髓蛋白的提取工艺及其抗氧化活性研究[J]. 食品工业科技,2021, 42(12):151-159. DOI:10.13386/j.issn1002-0306.2020080151.
[27] 张春芝, 王明清, 黄国清, 等. 花生蛋白钙螯合肽的制备、富集及表征[J]. 中国粮油学报, 2023, 38(11):83-91. DOI:10.20048/j.cnki.issn.1003-0174.000623.
[28] 赵熙成. 延边黄牛骨胶原蛋白肽的制备、结构表征及体外功效作用[D]. 延吉:延边大学, 2021. DOI:10.27439/d.cnki.gybdu.2021.001224.
[29] 吾哈丽妮萨·麦麦提托合提, 帕尔哈提·柔孜, 则拉莱·司玛依, 等. 不同提取方法的马骨髓蛋白结构及活性比较研究[J]. 现代食品科技,2022, 38(9):264-274. DOI:10.13982/j.mfst.1673-9078.2022.9.1078.
[30] 则拉莱·司玛依, 帕尔哈提·柔孜, 吾哈丽妮萨·麦麦提托合提, 等. 三种甘草种子蛋白的提取方法、结构及抗氧化活性比较研究[J]. 食品与发酵工业, 2022, 48(18):227-234. DOI:10.13995/j.cnki.11-1802/ts.029069.
[31] 古丽米热·阿巴拜克日, 帕尔哈提·柔孜, 刘源, 等. 骆驼骨髓蛋白的提取工艺优化及功能特性[J]. 食品研究与开发, 2024, 45(4):134-142; 171. DOI:10.12161/j.issn.1005-6521.2024.04.018.
[32] 孟晓, 张坤生, 张彦青, 等. 响应面法优化红胞藻中藻红蛋白提取工艺及体外抗氧化性研究[J]. 食品工业科技, 2017, 38(4):288-292;310. DOI:10.13386/j.issn1002-0306.2017.04.046.
[33] 邓梅, 梅强根, 谢星, 等. 七种大宗淡水鱼酶解物抗氧化活性比较及其肽组成鉴定[J]. 食品与发酵工业, 2024, 50(16):110-117.DOI:10.13995/j.cnki.11-1802/ts.037525.
[34] 迪娜拉·海拉提, 杨尚霖, 任秀梅, 等. 牛筋膜胶原蛋白的提取及功能特性与结构分析[J]. 现代食品科技, 2024, 40(9):307-315.DOI:10.13982/j.mfst.1673-9078.2024.9.0883.
[35] 李响, 张焕丽, 郭世龙, 等. 不同改性方法对花生蛋白理化特性影响研究[J]. 中国粮油学报, 2021, 36(9):101-108; 193.
[36] YANG X, YU X J, YAGOUB A G, et al. Structure and stability of low molecular weight collagen peptide (prepared from white carp skin)-calcium complex[J]. LWT-Food Science and Technology, 2021, 136:110335. DOI:10.1016/j.lwt.2020.110335.
[37] 帕尔哈提·柔孜, 古丽米热·阿巴拜克日, 刘源, 等. 牛骨髓蛋白及其碱性蛋白酶酶解物的功能特性比较[J]. 现代食品科技, 2024, 40(5):43-52. DOI:10.13982/j.mfst.1673-9078.2024.5.0614.
[38] WU W M, HE L C, LIANG Y H, et al. Preparation process optimization of pig bone collagen peptide-calcium chelate using response surface methodology and its structural characterization and stability analysis[J]. Food Chemistry, 2019, 284:80-89. DOI:10.1016/j.foodchem.2019.01.103.
[39] 宋丽, 朱临娴, 宋璐杉, 等. 钙结合卵黄高磷蛋白磷酸肽的制备及其肽钙螯合物的结构表征[J]. 食品科学, 2023, 44(6):125-133.DOI:10.7506/spkx1002-6630-20220414-167.
[40] 王孟丽, 布冠好, 陈复生, 等. 花生肽-钙螯合物的制备及其结构表征[J]. 河南工业大学学报(自然科学版), 2021, 42(5):47-54; 76.DOI:10.16433/j.1673-2383.2021.05.006.
[41] LUO J Q, YAO X T, SOLADOYE O P, et al. Phosphorylation modification of collagen peptides from fish bone enhances their calcium-chelating and antioxidant activity[J]. LWT-Food Science and Technology, 2022, 155:112978. DOI:10.1016/j.lwt.2021.112978.
[42] MALISON A, ARPANUTUD P, KEERATIPIBUL S. Chicken foot broth byproduct:a new source for highly effective peptide-calcium chelate[J]. Food Chemistry, 2021, 345:128713. DOI:10.1016/j.foodchem.2020.128713.
[43] 赵欣, 成晓瑜, 张顺亮, 等. 不同脱苦处理对骨胶原蛋白肽品质及抗氧化特性的影响[J]. 肉类研究, 2023, 37(11):13-20. DOI:10.7506/rlyj1001-8123-20231108-098.
[44] 鲍彤彤, 崔海燕, 段然, 等. 大豆蛋白肽-微量元素螯合物的制备及结构表征[J]. 食品与发酵工业, 2024, 50(21):170-174. DOI:10.13995/j.cnki.11-1802/ts.037763.
[45] 苑贤伟, 石梦园, 颜如玉, 等. 胶束酪蛋白复酶水解肽与钙形成螯合物的制备、表征及螯合机制[J]. 食品科学, 2024, 45(20):57-64.DOI:10.7506/spkx1002-6630-20231120-143.
[46] SUN N, WANG T T, WANG D, et al. Antarctic krill derived nonapeptide as an effective iron-binding ligand for facilitating iron absorption via the small intestine[J]. Journal of Agricultural and Food Chemistry, 2020, 68(40):11290-11300. DOI:10.1021/acs.jafc.0c03223.
[47] 宫瑞林, 刘伯业, 陈复生, 等. 小麦蛋白肽钙螯合物的制备工艺及结构表征[J]. 河南工业大学学报(自然科学版), 2023, 44(6):1-8; 43.DOI:10.16433/j.1673-2383.2023.06.001.
[48] 焦玉晗. 狭鳕鱼骨粉胶原多肽螯合钙的制备及性质测定[D]. 沈阳:辽宁大学, 2022. DOI:10.27209/d.cnki.glniu.2022.001983.
[49] 祝雅雯. 澳洲牛骨肽的性质分析及生物学功能研究[D]. 厦门:厦门大学, 2021. DOI:10.27424/d.cnki.gxmdu.2021.002166.
[50] 祝超智, 温耀涵, 许龙, 等. 牛血红蛋白肽的酶解工艺优化及其亚铁螯合物结构、稳定性研究[J]. 食品工业科技, 2024, 45(8):75-87.DOI:10.13386/j.issn1002-0306.2023040048.
[51] 张涵, 黄意情, 王海东, 等. 五味子蛋白酶解前后抗氧化活性和功能特性[J]. 食品研究与开发, 2024, 45(15):42-52. DOI:10.12161/j.issn.1005-6521.2024.15.006.
[52] 韩克光, 甄守艳, 范华, 等. 钙螯合羊骨胶原多肽的制备及表征分析[J]. 农业工程学报, 2015, 31(21):301-307. DOI:10.11975/j.issn.1002-6819.2015.21.040.
[53] 厉荣玉, 厉红, 郑鹏, 等. 酪蛋白GYLEQ抗氧化肽:钙螯合物的制备、表征及功能特性[J]. 食品与机械, 2023, 39(2):37-44.DOI:10.13652/j.spjx.1003.5788.2022.80453.