微生物污染导致的食品腐败变质和安全隐患一直是食品行业亟待解决的问题,如何抑制微生物生长繁殖已成为食品贮运保鲜研究的重点,其中针对食品抗菌包装材料的研究是当前全球关注的焦点。
作为一种天然食品添加剂,姜黄素具有多种生物活性,如抗炎、抗癌、抗菌和降血糖等[1]。然而,姜黄素的水溶性及稳定性差,限制了其在保持食品质量方面的应用[2]。有研究[3]表明,将姜黄素封装于纳米颗粒中可以克服上述缺陷并扩大其适用性。近年来,一些研究[3]尝试将姜黄素作为抗菌包装中的抗氧化剂和抗菌剂,但其中大部分只是考察了姜黄素在无光照条件下的灭菌效果,而忽略了姜黄素可以通过光照激发产生大量活性氧,从而增强其抗菌效果[4]。
在天然的生物聚合物中,壳聚糖具有良好的气体选择透过性、抗菌活性和优异的成膜能力[5],高分子质量的壳聚糖往往具有较强的力学性能,因此常被选作成膜材料[6]。聚乙烯醇由于其具有生物降解性、无毒性、良好的成膜能力和低成本的特点,被广泛用于食品包装[7],然而聚乙烯醇膜的拉伸强度低、水溶性高且吸水能力强,限制了其在食品包装中的应用,因此可以通过与性能优异且相容性较好的材料共混克服以上缺点。明胶具有可用性强、成本低和成膜能力优良等特点[8],且明胶基薄膜具有良好的氧气阻隔性、机械性能和高弹性[9],然而明胶膜较差的水蒸气阻隔性能是限制其应用的主要缺点,可以通过多种方式优化,如与其他材料共混、组装多层膜和填充纳米材料等。
因此,本研究拟将高分子质量壳聚糖作为外层膜材料,明胶与聚乙烯醇的共混物作为内层膜材料,同时将姜黄素与壳聚糖制成的纳米颗粒填充至内层膜,通过优化明胶、聚乙烯醇、壳聚糖及纳米颗粒的配比,构建具有良好力学性能和抗菌性能的双层膜,并将其应用于猪肉保鲜,以期为新型抗菌包装的开发及生鲜食品的保鲜提供理论基础及技术支持。
1 材料与方法
1.1 材料与试剂
猪里脊肉、大豆油、聚乙烯保鲜膜 市购。
丙三醇、冰乙酸、异辛烷、无水乙醇、三氯乙酸、溴化钠、氯化钠、氢氧化钠(均为分析纯) 天津市永大化学试剂有限公司;姜黄素(纯度99%)、碘化钾(分析纯)、三聚磷酸钠(分析纯)、壳聚糖(脱乙酰度80%)、硫代硫酸钠标准溶液、2-硫代巴比妥酸(纯度98%)、1,1,3,3-四甲氧基丙烷(纯度98%) 上海易恩化学技术有限公司;明胶(250 g Bloom)、聚乙烯醇(纯度95%)、磷酸盐缓冲液(pH 6.8) 上海麦克林生化科技股份有限公司;平板计数琼脂(生物试剂)北京奥博星生物技术有限责任公司。
1.2 仪器与设备
ST3100型pH计 奥豪斯仪器(常州)有限公司;BT100-2J型恒流泵 保定兰格恒流泵有限公司;JXDG-12B型冷冻干燥机 拓赫机电(上海)有限公司;TS-600型拉力试验机 济南思博科学仪器有限公司;FA25型高剪切分散乳化机 上海弗鲁克科技发展有限公司;MX-S型涡旋振荡器 上海易汇生物科技有限公司;TA.XT PlusC型质构仪 厦门超技仪器设备有限公司;HG400VW型拍打式均质器 维根技术(北京)有限公司。
1.3 方法
1.3.1 姜黄素-壳聚糖纳米颗粒(curcumin-chitosan nanoparticle,CCN)的制备
根据Xin Songlin等[10]的方法并稍作修改,采用离子胶凝法制备。在体积分数1%的乙酸中制备质量分数0.4%的壳聚糖溶液,并用4 mol/L NaOH溶液调节调节pH值至5.0。在无水乙醇中制备1 mg/mL姜黄素溶液,并将12 mL上述溶液添加至500 mL壳聚糖溶液中。搅拌均匀后,通过恒流泵将0.001 33 g/mL三聚磷酸钠溶液以恒定速率逐滴加入至上述混合溶液中,使壳聚糖和三聚磷酸钠的质量比为9∶2,继续搅拌30 min,获得包含CCN的溶液。将其10 000 r/min离心20 min,并用蒸馏水洗涤2 次,冷冻干燥,于4 ℃下避光保存,备用。
1.3.2 明胶/聚乙烯醇-壳聚糖双层膜的制备
采用溶液浇铸法制备生物基活性纳米复合膜,探究明胶与聚乙烯醇的比例、明胶/聚乙烯醇与壳聚糖的比例、明胶/聚乙烯醇膜中CCN的添加量对膜性能的影响。将1.5 g明胶溶于98.5 mL超纯水中,在室温下溶胀30 min,逐渐加热至60 ℃,搅拌溶解。将1.5 g聚乙烯醇溶于98.5 mL超纯水中,90 ℃加热,搅拌溶解。将1.5 g壳聚糖溶于98.5 mL质量分数1%乙酸中,搅拌溶解,将25%(m/m,以壳聚糖质量计)甘油添加到溶液中,搅拌30 min,超声(60 kHz、300 W)10 min去除气泡。
1.3.2.1 不同明胶、聚乙烯醇比例膜样品的制备
明胶和聚乙烯醇成膜液分别按体积比1∶1(G1P1)、1∶2(G1P2)、2∶1(G2P1)、2∶3(G2P3)、3∶2(G3P2)、1∶3(G1P3)、3∶1(G3P1)、1∶4(G1P4)、4∶1(G4P1)、1∶5(G1P5)、5∶1(G5P1)混合,加入25%(以聚合物质量计)甘油搅拌30 min,超声(60 kHz、300 W)10 min去除气泡。搅拌均匀后,向成膜液中添加质量分数1% CCN,继续超声10 min去除气泡,最后将24 mL成膜液浇铸在培养皿中。
1.3.2.2 不同明胶/聚乙烯醇与壳聚糖比例双层膜样品的制备
将明胶和聚乙烯醇的成膜液以1∶1体积比混合,加入25%甘油搅拌30 min,超声(60 kHz、300 W)10 min去除气泡。搅拌均匀后,向成膜液中添加1% CCN,继续超声10 min去除气泡,最后将成膜液浇铸在培养皿中进行干燥,干燥完成后,将壳聚糖成膜液倒入培养皿中均匀展开。明胶、聚乙烯醇混合成膜液与壳聚糖成膜液的体积比分别为1∶1(GP1C1)、1∶2(GP1C2)、2∶1(GP2C1)、2∶3(GP2C3)、3∶2(GP3C2)、1∶3(GP1C3)、3∶1(GP3C1)、1∶4(GP1C4)、4∶1(GP4C1)、1∶5(GP1C5)、5∶1(GP5C1)。
1.3.2.3 不同CCN含量双层膜样品的制备
将明胶和聚乙烯醇的成膜液以1∶1体积比混合,加入25%甘油搅拌30 min,超声(60 kHz、300 W)10 min去除气泡。搅拌均匀后,将CCN(质量分数0%、0.5%、1.0%、1.5%、2.0%、2.5%)添加至二元聚合物溶液中,继续超声10 min去除气泡,最后将12 mL成膜液浇铸在培养皿中进行干燥,干燥完成后,将12 mL壳聚糖成膜液倒入培养皿中均匀展开。
1.3.3 明胶/聚乙烯醇-壳聚糖双层膜性能测定
1.3.3.1 拉伸强度和断裂伸长率
将薄膜样品切割成矩形条(50 mm×10 mm),并使用外径千分尺在每个样品的5 个随机位置测定厚度,计算平均值,随后使用拉力试验机测定膜的拉伸强度和断裂伸长率。夹具初始距离为25 mm,拉伸速率为5 mm/min,直至其断裂。每组膜平行测定5 次,拉伸强度和断裂伸长率分别按式(1)、(2)计算:
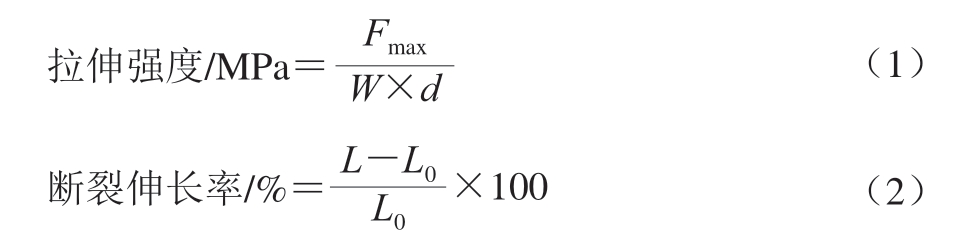
式中:Fmax为膜最大载荷/N;W为膜宽度/mm;d为膜厚度/mm;L为膜断裂长度/mm;L0为膜原始长度/mm。
1.3.3.2 水蒸气透过率
将无水氯化钙置于由薄膜样品密封的试管中,然后将试管置于含有饱和氯化钠溶液的干燥器中,平衡2 h后,每隔2 h记录试管质量,持续12 h。水蒸气透过率按式(3)计算:
式中:Δm为膜质量变化/g;L为膜平均厚度/m;A为膜面积/m2;Δt为时间变化/s;∆P为膜两侧蒸气压差/Pa。
1.3.3.3 氧气阻隔能力
以油脂的过氧化值反映膜材料的氧气阻隔能力,用薄膜密封盛有50 mL新鲜大豆油的锥形瓶,将其置于60 ℃下15 d,并将未密封的样品作为对照组,其余步骤参考李福杰等[11]的方法进行。
1.3.4 复合膜在猪肉保鲜中的应用
在无菌操作条件下将猪肉样品切分成2 cm×2 cm×0.5 cm的片状。分别用聚乙烯膜(PE组)、不含CCN的明胶/聚乙烯醇-壳聚糖膜的对照膜(GP-C组)和含2.5% CCN的明胶/聚乙烯醇-壳聚糖膜(GP2.5-C组)包装猪肉样品,将未包装的样品设为空白组。包装完成后,将所有样品置于实验室自制光动力灭活装置中光照90 min(波长460 nm、光功率密度200 mW/cm2)。光照结束后,于4 ℃下避光贮藏,并于贮藏第0、3、6、9天进行理化指标和菌落总数的测定。贮藏期间猪肉的质量损失率、pH值及硬度[12]的变化分别采用质量法、pH计、质构仪进行测定。参考GB 5009.181—2016《食品安全国家标准 食品中丙二醛的测定》的方法,采用分光光度法测定硫代巴比妥酸反应物(thiobarbituric acid reactive sub stances,TBARS)值。菌落总数的测定参考GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》的方法进行。
1.4 数据处理
所有实验结果均以至少3 个独立实验的平均值±标准差表示。使用SPSS 24.0软件对实验数据进行单因素方差分析,通过5%(LSD)的Duncan检验比较不同处理的平均值,显著性水平设定为P<0.05。采用Origin 2018软件绘图。
2 结果与分析
2.1 明胶/聚乙烯醇的比例对膜性能的影响
拉伸强度和断裂伸长率是膜机械性能的2 个重要指标,其中拉伸强度反映膜的断裂抗力,而断裂伸长率则代表膜的柔软度[13]。如图1所示,随着聚乙烯醇占比的增加,膜的拉伸强度上升趋势较缓,当聚乙烯醇的占比最高时(G1P5),膜的拉伸强度达21.387 MPa。相较于聚乙烯醇,较高比例的明胶对膜的拉伸强度影响显著(P<0.05),当聚乙烯醇与明胶成膜液的体积比为1∶4时,膜的拉伸强度显著高于其他组样品(P<0.05)。孔德金等[14]采用流延法制备不同比例壳聚糖/聚乙烯醇/明胶复合薄膜并进行表征,发现聚乙烯醇与明胶的质量比为3∶7时,复合薄膜中各组分比例适当,表现出较强的力学性能。对于断裂伸长率,聚乙烯醇占比的增加会明显提高薄膜的断裂伸长率。Dey等[15]在研究明胶含量对聚乙烯醇/明胶共混膜的影响时也得出类似的结论,当聚乙烯醇和明胶的质量比为1∶4时,膜的断裂伸长率最低。明胶或聚乙烯醇占比的增加对膜的水蒸气渗透性有显著影响(P<0.05),一方面可能是由于明胶链的交联减少了聚合物基质内的自由空间并形成致密的膜结构,从而阻止水分子的扩散,导致水蒸气透过率降低[16]。另一方面,可能是由于聚乙烯醇的羟基通过氢键等分子间作用力与明胶链相互作用,减少了亲水基团的数量,从而降低了水蒸气透过率[17]。Lin Bing等[18]在考察明胶/聚乙烯醇薄膜在小黄鱼保鲜中的应用时也得到类似的结论,水蒸气透过率随着明胶和聚乙烯醇添加比例的增加而降低,这可能归因于聚乙烯醇的高阻隔性能,它与明胶混合后会产生分子间作用力,导致薄膜的结构变得更加紧凑。综合来看,当聚乙烯醇和明胶成膜液体积比为1∶4时,膜的综合性能最佳,且柔韧性较好。
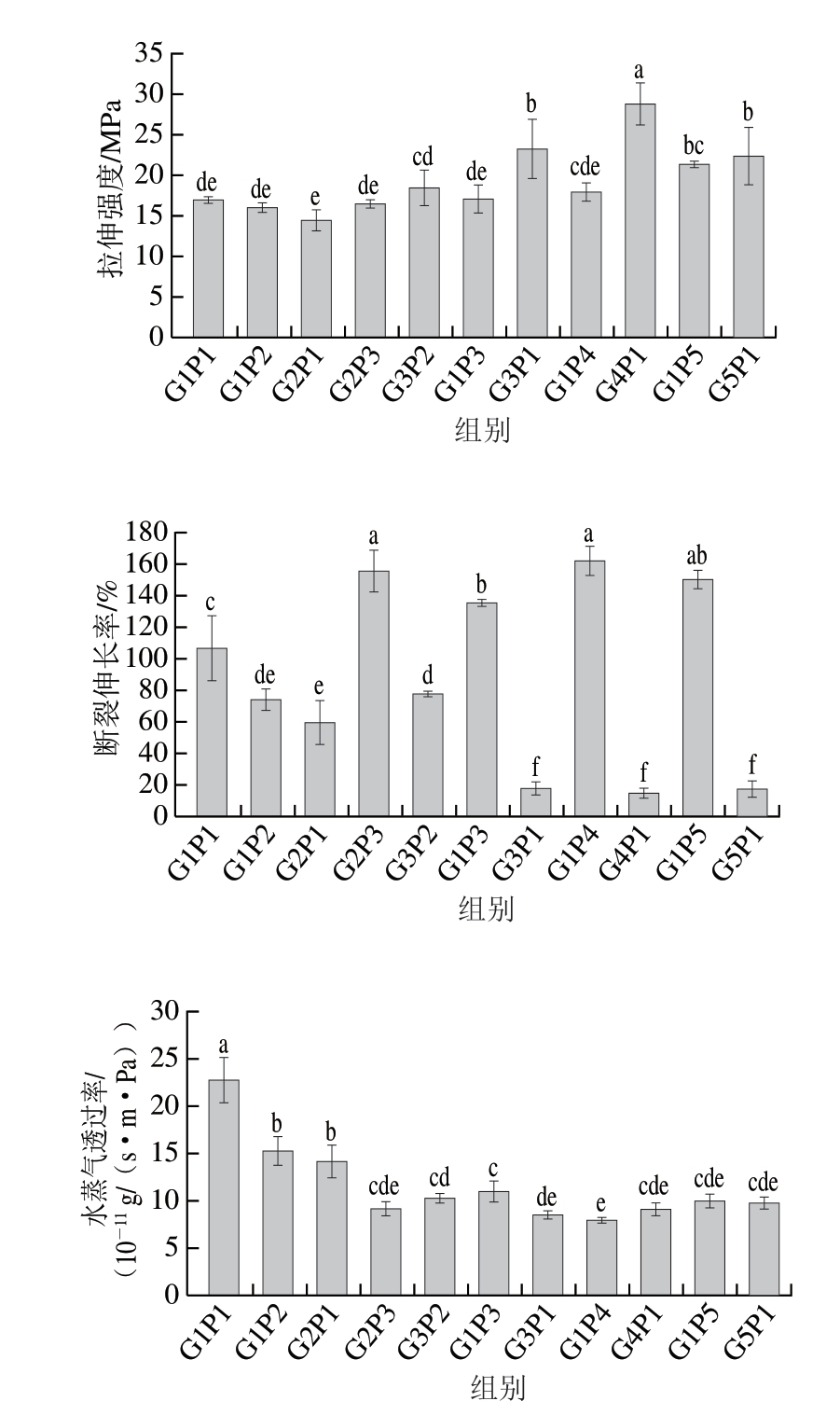
图1 明胶、聚乙烯醇成膜液体积比对膜性能的影响
Fig. 1 Effect of gelatin to PVA ratio on film performance
小写不同字母表示差异显著(P<0.05)。图2~4同。
2.2 明胶/聚乙烯醇与壳聚糖的比例对膜性能的影响
如图2所示,当明胶/聚乙烯醇与壳聚糖成膜液的体积比为1∶5时,膜的拉伸强度最高,达29.31 MPa,显著高于其他组样品(P<0.05),这可能与壳聚糖膜的高拉伸强度有关[6]。对于断裂伸长率,壳聚糖比例的提高可以降低膜的断裂伸长率。Ebrahimi等[19]发现,将壳聚糖掺入木质纤维素降低了薄膜的断裂伸长率,同时壳聚糖的引入也降低了复合膜水蒸气透过率。当明胶/聚乙烯醇与壳聚糖成膜液的体积比为1∶5时,膜的水蒸气透过率较低,且与水蒸气透过率最低的膜之间无显著差异。因此,体积比1∶5的明胶/聚乙烯醇-壳聚糖成膜液形成的膜性能最佳,且柔韧性较好。
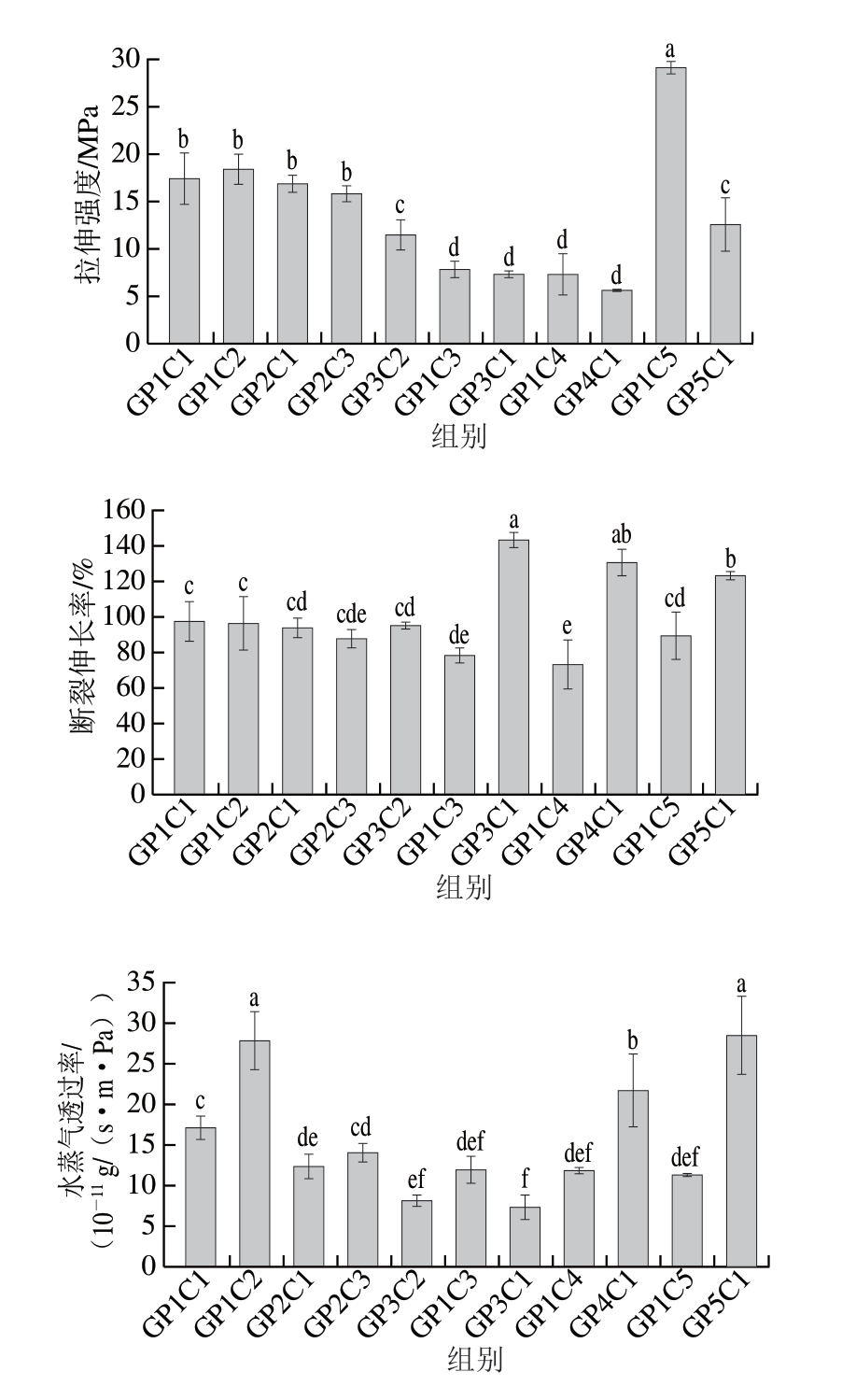
图2 明胶/聚乙烯醇与壳聚糖成膜液体积比对膜性能的影响
Fig. 2 Effect of gelatin/PVA to chitosan ratio on film performance
2.3 明胶/聚乙烯醇膜中的CCN含量对膜性能的影响
2.3.1 CCN含量对拉伸强度和断裂伸长率的影响
如图3所示,与纯明胶/聚乙烯醇-壳聚糖膜相比,添加0.5% CCN的膜拉伸强度显著提高(P<0.05),这与Chang等[20]的研究结果一致,该研究发现,将壳聚糖纳米颗粒添加到甘油增塑的淀粉基质中可以提高薄膜的拉伸强度。CCN的添加显著降低了膜的断裂伸长率(P<0.05),且CCN添加量的提高对膜的断裂伸长率无显著影响。CCN对膜力学性能的增强可能是由于其与明胶和聚乙烯醇产生新的相互作用,降低聚合物链之间的自由体积,从而获得高密度且渗透性较差的聚合物网络。此外,CCN在聚合物基质中起到机械强化作用,降低了聚合物的柔韧性[21]。
图3 CCN含量对膜机械性能的影响
Fig. 3 Effect of CCN content on the mechanical properties of films
2.3.2 CCN含量对水蒸气透过率及氧气阻隔能力的影响
优良的包装膜应具有合适的水蒸气透过率和氧气阻隔性能[22]。如图4所示,2%及以上的CCN添加显著降低了膜的水蒸气透过率(P<0.05),这可能是CCN对膜网络结构的影响造成的。随着CCN在溶剂蒸发过程中的扩散和对薄膜基质内部空间的填充,CCN与成膜材料相互作用,薄膜的亲水性和扩散系数降低,复合膜表面变得致密,从而导致膜的水蒸气透过率降低[23]。与对照组相比,薄膜的覆盖显著降低了油脂的过氧化值(P<0.05),说明薄膜具有优异的氧气阻隔能力,且随着CCN添加量的增加,油脂的过氧化值逐渐降低。这可能是由于在基质中分散良好的CCN限制或延长了氧气的穿透路径,进而导致氧气透过率降低。膜的阻氧能力与孔隙率有较强的相关性,孔隙率越低,膜的氧阻隔能力越强[24]。
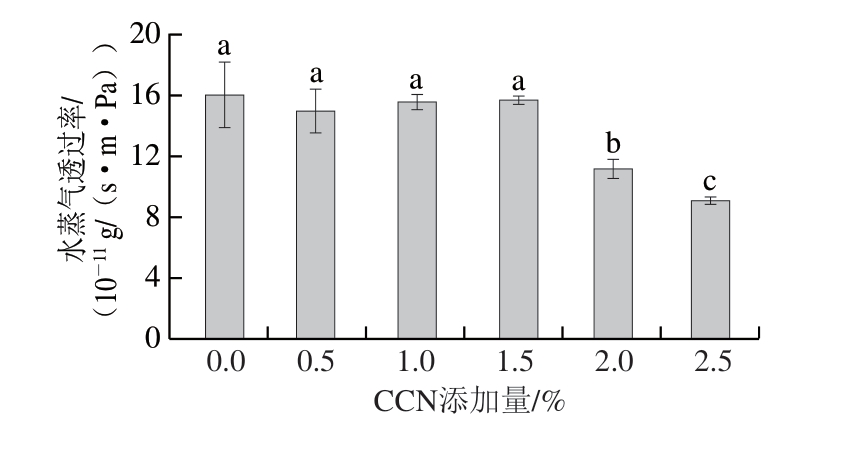
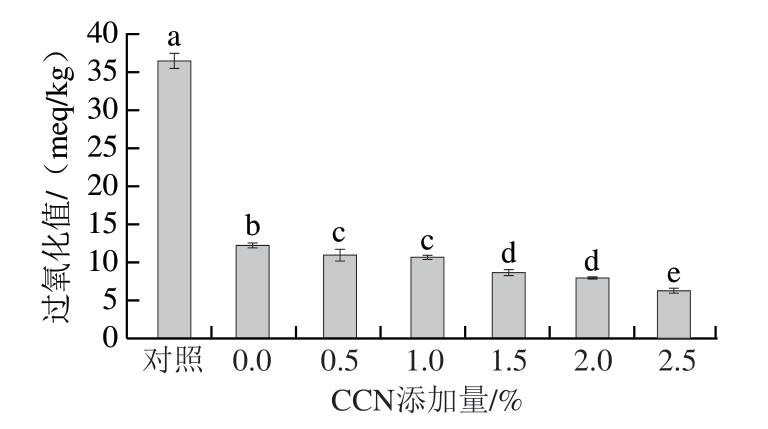
图4 CCN含量对膜水蒸气透过率及氧气阻隔能力的影响
Fig. 4 Effect of CCN content on the water vapor permeability and oxygen barrier ability of films
2.4 明胶/聚乙烯醇-壳聚糖双层膜的应用
2.4.1 猪肉贮藏期间质量损失率、硬度和pH值变化
如图5a所示,光照处理后空白组的猪肉质量损失率明显高于其他3 组,可能是由于光照过程中产生热量,使空白组猪肉表面水分蒸发所致。随着贮藏时间的延长,各组猪肉的质量损失率逐渐增加,主要是由于在贮藏过程中,细菌对肌肉组织的破坏削弱了肌纤维蛋白的结合,进而降低了肌肉的持水能力[25]。
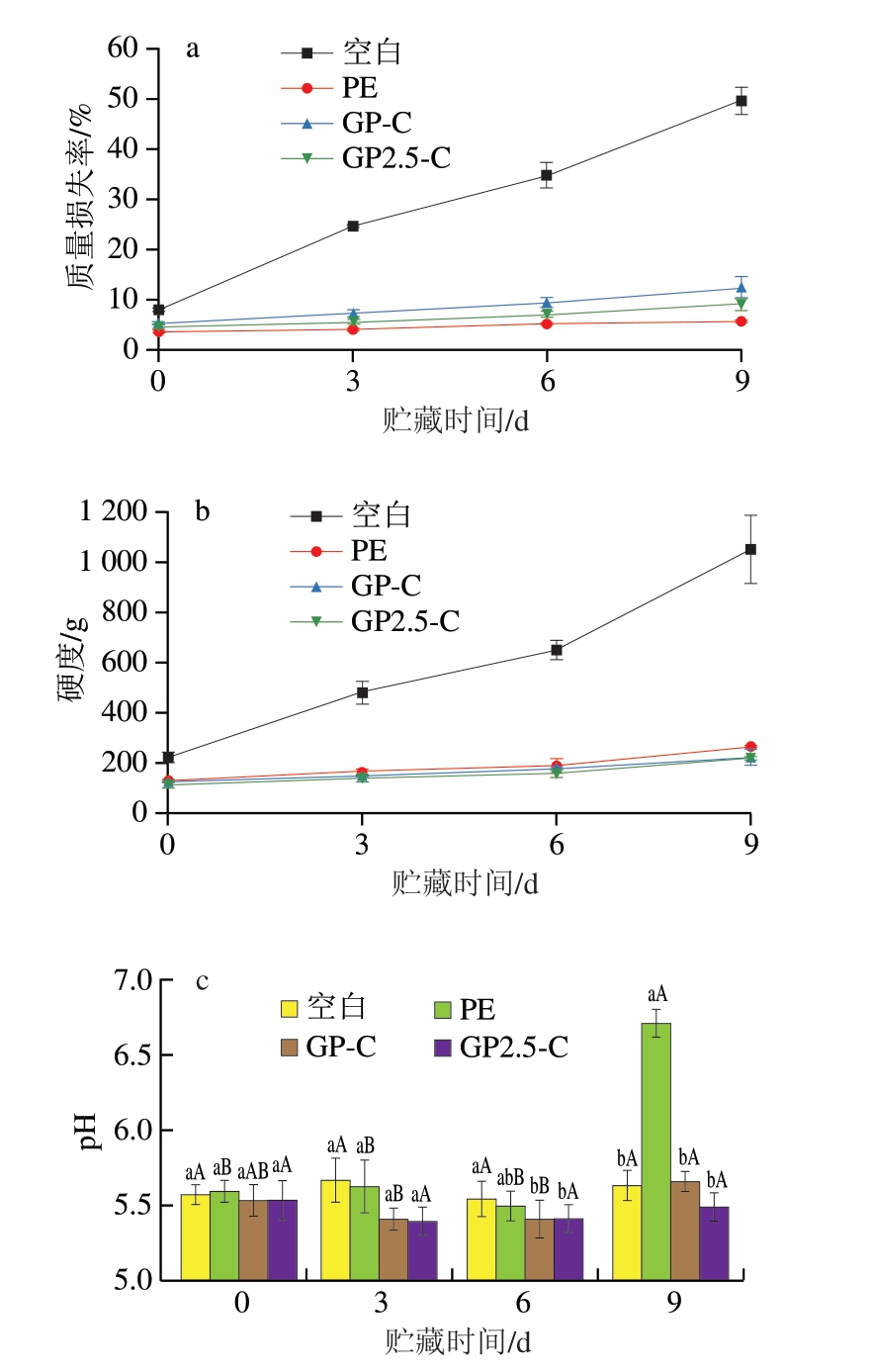
图5 猪肉贮藏期间质量损失率(a)、硬度(b)、pH值(c)的变化
Fig. 5 Changes in mass loss percentage (a), hardness (b) and pH (c) of pork wrapped with bilayered films during storage
小写字母不同表示同一贮藏时间不同样品间差异显著(P<0.05);大写字母不同表示同一样品不同贮藏时间差异显著(P<0.05)。图6、7同。
如图5b所示,除空白组外,其他3 组猪肉的硬度均随着贮藏时间的延长整体呈缓慢增加趋势,而空白组猪肉的硬度上升幅度较大,且贮藏期间空白组猪肉的硬度明显高于其他3 组,这是由于缺乏保护性包装膜,导致猪肉水分迅速流失,同时蛋白质网络被快速增殖的微生物破坏[26]。
pH值的变化主要是由腐败细菌活动引起的[27]。如图5c所示,各组猪肉样品的pH值随着贮藏时间的延长整体呈现先下降后上升的趋势。pH值的降低是由于肌糖原无氧酵解产生乳酸导致的,但随着贮藏时间的进一步延长,猪肉中的各种酶和微生物作用会产生碱性含氮化合物,导致pH值上升[28]。贮藏9 d时,GP2.5-C组的pH值略低于GP-C组和空白组,但无显著差异;聚乙烯组猪肉的pH值显著升高(P<0.05),达6.71,超过新鲜猪肉的标准[29]。这可能是由于聚乙烯膜的渗透性差,导致水蒸气和氨等挥发性碱性物质积累所致[26]。
2.4.2 猪肉贮藏期间TBARS值变化
如图6所示,随着贮藏时间的延长,各组的TBARS值也随之增加。贮藏9 d时,除GP2.5-C组外,空白、PE、和GP-C组猪肉TBARS值均超过1 mg /kg,分别为1.83、1.71、1.36 mg/kg。Zhou Zhimin等[29]在对负载肉桂醛的抗菌垫用于猪肉保鲜的研究中发现,当TBARS值达到1 mg/kg以上时,冷鲜猪肉已经氧化酸败。总体而言,在相同贮藏时间下,GP2.5-C组TBARS值均为最低,表明含有CCN的双层膜可以有效抑制猪肉在贮藏过程中的脂质氧化。
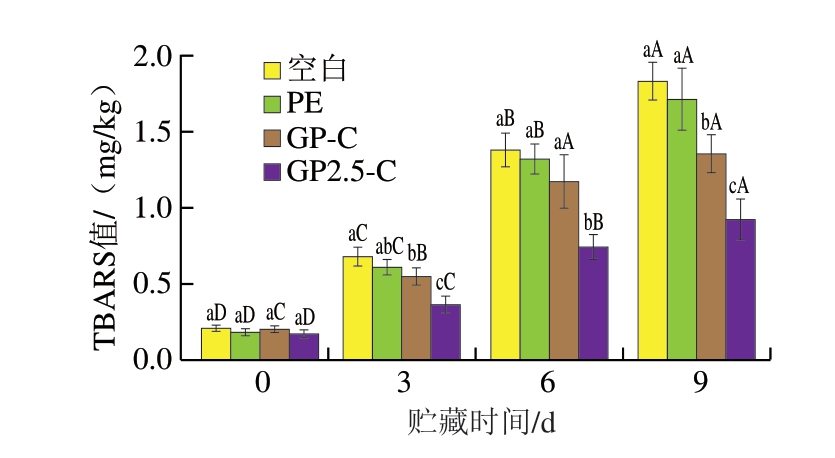
图6 猪肉贮藏期间TBARS值的变化
Fig. 6 Changes in TBARS value of pork wrapped with bilayered films during storage
2.4.3 猪肉贮藏期间菌落总数变化
如图7所示,新鲜猪肉的初始菌落总数在3.63(lg(CFU/g))左右,经光照后,GP2.5-C组的样品菌落总数显著减少(P<0.05),其他3 组样品的菌落总数无显著变化。随着贮藏时间的延长,各组猪肉样品的菌落总数也逐渐增加。贮藏3 d时,GP-C组猪肉菌落总数为3.97(lg(CFU/g)),接近新鲜肉与次新鲜肉的临界值(4(lg(CFU/g)))[30],此时GP2.5-C组猪肉菌落总数为1.19(lg(CFU/g)),显著低于其他3 组(P<0.05)。贮藏9 d时,GP2.5-C组猪肉菌落总数较GP-C组低3(lg(CFU/g))以上。可以看出,含CCN双层膜包装的猪肉经光动力处理后,表面细菌数量于短时间内显著降低(P<0.05),且随着贮藏时间的延长,表面细菌数量维持在较低水平。有研究[31]报道,姜黄素在460 nm波长光照下的光动力作用对猪肉表面荧光假单胞菌有显著抑制作用,有效延长了猪肉的保鲜期。张宇婷[4]、Zhou Zhenlong[32]等报道,姜黄素对鲜猪肉及橙汁的保鲜主要是基于姜黄素光敏作用产生的活性氧的抗菌作用。
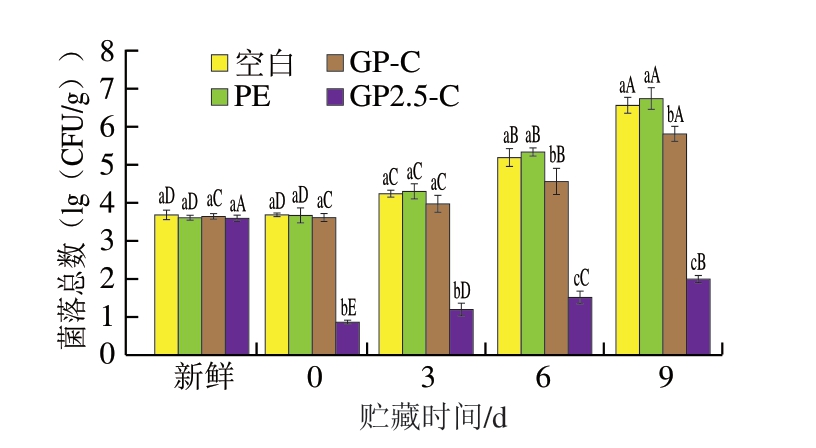
图7 猪肉贮藏期间菌落总数的变化
Fig. 7 Changes in TVC of pork wrapped with bilayered films during storage
3 结论
通过对明胶/聚乙烯醇-壳聚糖双层膜的优化发现,当明胶与聚乙烯醇成膜液体积比为4∶1、明胶/聚乙烯醇与壳聚糖成膜液的体积比为1∶5、CCN质量分数为2.5%时,得到的膜性能最佳。且CCN的添加对膜的机械性能、阻隔性能和抗菌活性等特性具有显著的改善作用。将该双层膜应用于生鲜猪肉包装,发现其在保持猪肉硬度和pH值、延缓氧化酸败和抑制微生物生长方面效果显著,展现出良好的应用前景。然而,该双层膜也显示出一些不足,如机械强度仍有待提高、膜亲水性和水蒸气透过率有待改善等。未来拟在如下方面开展研究,以更好地提升膜的性能:1)引入改性淀粉、环氧树脂、纳米黏土等材料填充壳聚糖外层,进一步降低薄膜的水蒸气透过率及亲水性,同时保持薄膜的透明度,以保证光动力灭活效率;2)尝试使用静电纺丝工艺制备纳米纤维包装材料,同时以强疏水性的聚己内酯等材料部分替代聚乙烯醇,增强膜的机械强度,同时提高膜的疏水性,以期为开发新型绿色食品包装材料提供理论基础和研究思路。
[1] WEN F Z, LI P Y, YAN H J, et al. Turmeric carbon quantum dots enhanced chitosan nanocomposite films based on photodynamic inactivation technology for antibacterial food packaging[J].Carbohydrate Polymers, 2023, 311: 120784. DOI:10.1016/j.carbpol.2023.120784.
[2] PRAMANA A, FIRMANDA A, ARNATA I W, et al. Reduction of biofilm and pathogenic microorganisms using curcumin-mediated photodynamic inactivation to prolong food shelf-life[J]. International Journal of Food Microbiology, 2024, 425: 110866. DOI:10.1016/j.ijfoodmicro.2024.110866.
[3] HUANG W N, WANG L H, WEI Y Q, et al. Fabrication of lysozyme/κ-carrageenan complex nanoparticles as a novel carrier to enhance the stability and in vitro release of curcumin[J]. International Journal of Biological Macromolecules, 2020, 146: 444-452. DOI:10.1016/j.ijbiomac.2020.01.004.
[4] 张宇婷, 陈岩, 智秀娟, 等. 姜黄素增强的纤维素光敏抗菌膜制备及其对鲜猪肉的保鲜性能[J]. 食品科学, 2024, 45(13): 239-246.DOI:10.7506/spkx1002-6630-20231208-071.
[5] ZHANG X D, XIAO G, WANG Y Q, et al. Preparation of chitosan-TiO2 composite film with efficient antimicrobial activities under visible light for food packaging applications[J]. Carbohydrate Polymers, 2017,169: 101-107. DOI:10.1016/j.carbpol.2017.03.073.
[6] BOF M J, BORDAGARAY V C, LOCASO D E, et al. Chitosan molecular weight effect on starch-composite film properties[J]. Food Hydrocolloids,2015, 51: 281-294. DOI:10.1016/j.foodhyd.2015.05.018.
[7] SUGANTHI S, VIGNESH S, JEYAPERUMAL K S, et al. Fabrication of PVA polymer films with improved antibacterial activity by finetuning via organic acids for food packaging applications[J]. Applied Water Science, 2020, 10(4): 100. DOI:10.1007/s13201-020-1162-y.
[8] AHMAD A A, SARBON N M. A comparative study: physical,mechanical and antibacterial properties of bio-composite gelatin films as influenced by chitosan and zinc oxide nanoparticles incorporation[J]. Food Bioscience, 2021, 43: 101250. DOI:10.1016/j.fbio.2021.101250.
[9] NUR HANANI Z A, BEATTY E, ROOS Y H, et al. Manufacture and characterization of gelatin films derived from beef, pork and fish sources using twin screw extrusion[J]. Journal of Food Engineering,2012, 113(4): 606-614. DOI:10.1016/j.jfoodeng.2012.07.002.
[10] XIN S L, XIAO L, DONG X P, et al. Preparation of chitosan/curcumin nanoparticles based zein and potato starch composite films for Schizothorax prenati fillet preservation[J]. International Journal of Biological Macromolecules, 2020, 164: 211-221. DOI:10.1016/j.ijbiomac.2020.07.082.
[11] 李福杰, 齐斌, 徐华亭, 等. 交联壳聚糖/聚乙烯醇/蜗牛黏液复合膜的制备及性能研究[J]. 中国塑料, 2022, 36(5): 53-61. DOI:10.19491/j.issn.1001-9278.2022.05.010.
[12] 王可心, 王华丽, 单艳琴, 等. 生姜对烘烤猪肉饼品质及杂环胺形成的影响[J]. 食品研究与开发, 2023, 44(5): 9-14.
[13] 陈启杰, 张朋, 游娜, 等. 基于纤维素纳米晶乳化陈皮精油的淀粉基抗菌膜的制备与性能[J]. 食品科学, 2024, 45(3): 134-141.DOI:10.7506/spkx1002-6630-20230514-123.
[14] 孔德金, 廖旭, 李南希, 等. 壳聚糖/聚乙烯醇/明胶复合薄膜的阻隔和阻燃性能研究[J]. 中国塑料, 2024, 38(5): 28-32. DOI:10.19491/j.issn.1001-9278.2024.05.006.
[15] DEY K, GANGULI S, GHOSHAL S, et al. Study of the effect of gamma irradiation on the mechanical properties of polyvinyl alcohol based gelatin blend film[J]. OALib, 2014, 1(5): 1-10. DOI:10.4236/oalib.1100639.
[16] RASHID N, KHALID S H, ULLAH KHAN I, et al. Curcuminloaded bioactive polymer composite film of PVA/gelatin/tannic acid downregulates the pro-inflammatory cytokines to expedite healing of full-thickness wounds[J]. ACS Omega, 2023, 8(8): 7575-7586.DOI:10.1021/acsomega.2c07018.
[17] FERNANDES G J C, CAMPELO P H, DE ABREU FIGUEIREDO J,et al. Effect of polyvinyl alcohol and carboxymethylcellulose on the technological properties of fish gelatin films[J]. Scientific Reports,2022, 12(1): 10497. DOI:10.1038/s41598-022-14258-y.
[18] LIN B, ZHANG X J, OU D P, et al. Characterization of anglerfish gelatin/polyvinyl alcohol film and its application in preservation of small yellow croaker (Larimichthys polyactis)[J].Journal of Food Engineering, 2023, 357: 111641. DOI:10.1016/j.jfoodeng.2023.111641.
[19] EBRAHIMI S S, HAMZEH Y, ASHORI A, et al. Ozoneactivated lignocellulose films blended with chitosan for edible film production[J]. International Journal of Biological Macromolecules,2024, 270: 132285. DOI:10.1016/j.ijbiomac.2024.132285.
[20] CHANG P R, JIAN R J, YU J G, et al. Fabrication and characterisation of chitosan nanoparticles/plasticised-starch composites[J]. Food Chemistry,2010, 120(3): 736-740. DOI:10.1016/j.foodchem.2009.11.002.
[21] AMJADI S, EMAMINIA S, HEYAT DAVUDIAN S, et al. Preparation and characterization of gelatin-based nanocomposite containing chitosan nanofiber and ZnO nanoparticles[J]. Carbohydrate Polymers,2019, 216: 376-384. DOI:10.1016/j.carbpol.2019.03.062.
[22] ZHU H M, QIN X L, WANG Q, et al. Improved barrier, mechanical and antioxidant properties of pH-responsive film by incorporating dialdehyde starch and anthocyanins into rice protein/sodium alginate[J]. International Journal of Biological Macromolecules, 2024,281: 136131. DOI:10.1016/j.ijbiomac.2024.136131.
[23] HAKKE V S, LANDGE V K, SONAWANE S H, et al. The physical,mechanical, thermal and barrier properties of starch nanoparticle(SNP)/polyurethane (PU) nanocomposite films synthesised by an ultrasound-assisted process[J]. Ultrasonics Sonochemistry, 2022, 88:106069. DOI:10.1016/j.ultsonch.2022.106069.
[24] JI M C, LI J Y, LI F Y, et al. A biodegradable chitosan-based composite film reinforced by ramie fibre and lignin for food packaging[J].Carbohydrate Polymers, 2022, 281: 119078. DOI:10.1016/j.carbpol.2021.119078.
[25] LIANG C, ZHANG D Q, ZHENG X C, et al. Effects of different storage temperatures on the physicochemical properties and bacterial community structure of fresh lamb meat[J]. Food Science of Animal Resources, 2021, 41(3): 509-526. DOI:10.5851/kosfa.2021.e15.
[26] WANG W Z, ZHANG L, HU P Y, et al. Multifunctional packaging film with sustained release behavior triggered by pH microenvironment for efficient preservation of pork[J]. Food Chemistry, 2024, 438: 138007.DOI:10.1016/j.foodchem.2023.138007.
[27] GUI N N, ZHANG X X, YANG C, et al. A high-strength collagen-based antimicrobial film grafted with ε-polylysine fabrication by riboflavin-mediated ultraviolet irradiation for pork preservation[J]. Food Chemistry, 2024, 461: 140889. DOI:10.1016/j.foodchem.2024.140889.
[28] ZHENG K W, ZHANG J B, YANG F, et al. Properties and biological activity of chitosan-coix seed starch films incorporated with nano zinc oxide and Artemisia annua essential oil for pork preservation[J].LWT-Food Science and Technology, 2022, 164: 113665. DOI:10.1016/j.lwt.2022.113665.
[29] ZHOU Z M, LIU Y L, LIU Z J, et al. Sustained-release antibacterial pads based on nonwovens polyethylene terephthalate modified by β-cyclodextrin embedded with cinnamaldehyde for cold fresh pork preservation[J]. Food Packaging and Shelf Life, 2020, 26: 100554.DOI:10.1016/j.fpsl.2020.100554.
[30] 曾丽萍, 孟金明, 徐世娟, 等. 聚乳酸纳米抗菌复合膜对冷却猪肉保鲜效果的研究[J]. 包装工程, 2018, 39(21): 96-101. DOI:10.19554/j.cnki.1001-3563.2018.21.018.
[31] 王洋, 赵瑜玲, 陈孟涵, 等. 姜黄素联合乙二胺四乙酸对荧光假单胞菌的光动力灭活作用[J]. 食品科学, 2022, 43(21): 8-15.DOI:10.7506/spkx1002-6630-20211127-335.
[32] ZHOU Z L, CHEN R X, LI P Z, et al. Natural borneol improves cellular uptake of curcumin to enhance its photodynamic bactericidal activity against Escherichia coli ATCC 8739[J]. Food Microbiology,2025, 127: 104686. DOI:10.1016/j.fm.2024.104686.