斑点叉尾鮰(Ictalurus punctatus)又称鮰鱼,原产于北美洲,于1984年引入中国[1],以其优异的感观品质和营养特性(富含优质蛋白、不饱和脂肪酸及矿物质等)而备受消费者欢迎。然而,即使是在冷藏条件下,微生物增殖与代谢活动导致的鱼肉品质劣变仍难以避免[2]。例如,从鲑鱼中分离的腐败菌变形斑沙雷氏菌(Serratia proteamaculans)能够高效水解肌原纤维蛋白,导致鱼肉质地急剧软化、汁液大量流失[3]。希瓦氏菌属(Shewanella)则通过分泌胰蛋白酶样酶、丝氨酸蛋白酶和金属蛋白酶等加速蛋白水解[4-5]。因此,阐明细菌介导的蛋白降解机制并开发有效抑制策略具有重要的现实意义。
近年来,高压静电场(high-voltage electostatic field,HVEF)、脉冲电场、超高压、辐照等非热处理技术已应用于水产品保鲜。HVEF技术可有效杀灭香肠、三文鱼和猪肉等肉制品表面的细菌,是一种绿色、安全的保鲜技术[6]。Huang Han等[7]研究30 kV-15 min HVEF处理对鮰鱼片微生物群落和品质特性的影响,发现HVEF处理鮰鱼片的总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量和菌落总数(total viable count,TVC)分别较对照组减少11.90 mg/100 g和1.78(lg(CFU/g))。Liu Jiao等[8]研究发现,15 kV/m HVEF处理能够有效抑制虾肉在冷藏过程中的脂质氧化、ATP和蛋白质降解。然而,电场电离作用可诱导自由基生成,进而加速脂质氧化和蛋白质氧化进程;同时,长时间高压电场处理不仅显著增加能耗,还可能引发鱼肉细胞破裂,导致汁液流失[9]。
天然植物来源的多酚类物质具有较强的抗氧化能力和抗菌活性,在水产品保鲜领域展现出重要潜力。为协同抑制氧化变质与汁液流失,脉冲电场联合天然抗氧化剂的复合处理技术已成为水产品保鲜的新策略[10]。然而,HVEF联合天然抗氧化剂应用于水产品保鲜的研究鲜见报道。莲房原花青素(lotus seedpod procyanidins,LSPC)是从莲藕副产物中提取的多酚类物质,主要成分为儿茶素和表儿茶素。研究[11-12]发现,LSPC具有显著的抗氧化与抑菌活性,可有效清除自由基并抑制丙二醛生成,可通过破坏细菌细胞膜完整性抑制其生长与增殖。当前研究主要集中在鱼肉品质变化,而对鱼肉中腐败菌介导的氨基酸代谢机制尚未系统阐明。综上,为深入探究新鲜鱼肉腐败机制,本研究将实验室前期从腐败鮰鱼片中分离鉴定的3 株优势腐败菌接种于(未)经HVEFLSPC处理的无菌鮰鱼片中,测定其在4 ℃贮藏过程中的TVC、TVB-N含量、可溶性肽含量以及贮藏末期的游离氨基酸(free amino acids,FAAs)、生物胺(biogenic amines,BAs)含量,系统评估这3 种腐败菌对鮰鱼片冷藏期品质的影响及HVEF-LSPC处理对3 种细菌致腐能力的抑制作用;进一步对腐胺代谢途径基因转录水平进行测定,以期从分子水平阐释HVEF-LSPC处理对腐胺代谢通路的调控机制,为开发冷鲜鱼片靶向保鲜技术提供理论支撑和实践指导。
1 材料与方法
1.1 材料与试剂
鲜活斑点叉尾鮰为市购,30 min内用水箱充氧运输至实验室;腐败希瓦氏菌(Shewanella putrefaciens)、哈弗尼希瓦氏菌(Shewanella havnia)、沙雷氏菌(Serratia sp.)为本实验室从斑点叉尾鮰中筛选出的生长优良的菌株,于湖北省农业科学院农产品加工与核农技术研究所、农业农村部农产品冷链物流技术重点实验室保藏;LSPC(纯度93%)为本实验室从莲房中提取纯化,于华中农业大学食品科学技术学院实验室保藏。
氯化钠、甘油、三氯乙酸(trichloroacetic acid,TCA)(均为分析纯) 国药集团化学试剂有限公司;Luria-Bertani(LB)琼脂培养基、胰蛋白胨大豆肉汤(tryptic soy broth,TSB) 青岛海博生物技术有限公司;BAs混合标准品、FAAs混合标准品、L-亮氨酸、甲醇、乙腈(均为色谱纯) 美国Sigma-Aldrich公司;RNA-easy Isolation Reagent试剂盒、SYBR Green qPCR Master Mix试剂盒 美国Thermo Fisher Scientific公司;酪氨酸(纯度98%) 上海源叶生物科技有限公司。
1.2 仪器与设备
DL-CJ-2NDII洁净工作台 北京科誉兴业科技发展有限公司;LRH-250生化培养箱 上海博迅医疗生物仪器股份有限公司;HZ150L多功能培养摇床武汉瑞华仪器设备有限责任公司;Spark酶标仪 瑞士Tecan Mannedorf公司;UltiMate 3000高效液相色谱仪、PikoReal 96实时荧光定量聚合酶链式反应(realtime fluorescence quantitative polymerase chain reaction,real-time PCR)仪、NanoDrop 2000超微量分光光度计美国Thermo Fisher Scientific公司;K9860自动凯氏定氮仪山东海能科学仪器有限公司;HVEF设备为实验室自主研发装配。
1.3 方法
1.3.1 菌悬液制备
分别挑取S. putrefaciens、S. havnia和Serratia sp.单菌落于LB肉汤培养基,划线活化,于30 ℃培养箱中培养至对数期。采用连续两代平板划线法进行单菌落纯化培养以获得纯菌落,随后使用无菌接种环挑取单菌落菌苔,接种于20 mL TSB培养基(50 mL锥形瓶),30 ℃、150 r/min摇床培养24 h,使菌液浓度达到109 CFU/mL,8 000 r/min离心10 min后收集菌体,采用生理盐水重悬备用。
1.3.2 样品制备
将鲜活斑点叉尾鮰敲击致死,去皮、去内脏,取背部鱼肉切成0.5 cm×3 cm×3 cm大小(质量5 g)的鱼片,分单片放入无菌封口袋,送至湖北省农业科学院农产品加工与核农技术研究所辐照实验中心进行60Co-γ辐照(6 kGy)灭菌。辐照灭菌后,将鱼片随机分为2 份,1 份加入0.1%(m/m)LSPC,并采用6 kV/cm HVEF处理20 min,1 份不作处理。每份鱼片分为3 组,分别将0.5 mL S. putrefaciens、S. havnia和Serratia sp.菌液(将1.3.1节制备的菌体重悬于无菌生理盐水,使其浓度为104 CFU/mL)加入装有鮰鱼片的无菌封口袋中,初始菌量约为3(lg(CFU/g)),HVEF-LSPC处理的为实验组(LH-SP、LH-SH、LH-S),未进行HVEF-LSPC处理的为对照组(SP、SH、S)。空白对照组(CK)以0.5 mL生理盐水替代菌液,所有样品密封后于4 ℃贮藏,0、2、4、6、8、10 d取样并测定相关指标。
1.3.3 TVC测定
根据高天麒等[13]的平板计数法测定鱼肉样品的TVC。
1.3.4 TCA可溶性肽含量测定
根据Zhuang Shuai等[14]的方法,将3.0 g鱼肉切碎后与27.0 mL 5 g/100 mL TCA溶液混匀,冰浴30 min,4 ℃、10 000 r/min离心5 min,以酪氨酸为标准品(y=0.807 1x+0.019(R2=0.992 9)),通过Lowry法测定上清液中TCA可溶性肽含量,以酪氨酸含量计。
1.3.5 TVB-N含量测定
利用凯氏定氮仪测定鱼肉TVB-N含量。称取5.0 g切碎鱼肉,参考高天麒等[13]的方法测定TVB-N含量,结果表示为mg/100 g。
1.3.6 FAAs含量测定
参考Wu Yiwen等[15]的方法。取10 g切碎鱼肉(贮藏10 d),加入40 mL 0.1 mol/L HCl溶液,匀浆,4 ℃、6 000 r/min离心,取上清液,再加入20 mL 0.1 mol/L HCl溶液重复提取2 次,合并上清液,采用0.45 μm滤膜过滤。分别取200 µL上清液及氨基酸标准品于1.5 mL离心管中,各加入50 μL 1 mg/mL L-亮氨酸(内标),然后各加入100 μL三乙胺乙腈、100 μL异硫氰酸苯酯乙腈,混合均匀,室温放置1 h后,各加入500 μL正己烷进行萃取,取下层溶液200 μL,用水稀释至1 mL,采用0.45 μm滤膜过滤,采用高效液相色谱测定,结果表示为mg/100 g。
1.3.7 BAs含量测定
取5 g切碎鱼肉,加入10 mL 5 g/100 mL TCA溶液,匀浆,10 000 r/min离心10 min,收集上清液,洗涤沉淀并离心,合并上清液,用5 g/100 mL TCA溶液调至25 mL,取10 mL并加入等体积正己烷,涡旋3 min,静置分层并弃去上层溶液,重复2 次,所制BAs提取液于-20 ℃保存备用。
参照Zhuang Shuai等[16]的高效液相色谱法进行BAs衍生化和分析。取1 mL BAs提取液,加入300 μL饱和NaHCO3溶液和120 μL 2 mol/L NaOH溶液,再加入由2 mL丙酮溶解的10 mg/mL丹磺酰氯,60 ℃暗反应15 min,加入100 μL 250 g/L氨水终止反应。在45 ℃下放置15 min后,用乙腈稀释至5 mL。然后,采用Venusil C18 Plus色谱柱(4.6 mm×150 mm,5 μm)分离,在254 nm处对BAs进行定量。
1.3.8 real-time PCR测定腐胺生成途径基因转录水平
采用RNA-easy Isolation Reagent试剂盒提取细菌总RNA,采用逆转录试剂盒去除基因组DNA后,将总RNA逆转录为cDNA,然后采用分光光度计测定cDNA纯度。使用SYBR Green qPCR Master Mix试剂盒配制PCR体系,用real-time PCR仪进行扩增。引物信息见表1。基因相对转录水平采用2-ΔΔCt法进行计算。
表1 引物序列
Table 1 Primer sequences

基因菌株序列(5’→3’)aguA Shewanella sp.F:TGCCGAATGTTTGCTCAACG R:TCGGTCCAGTGCAGAATGAC Serratia sp.F:TTGTTCGTCCCGGAGAAGTG R:GCTTGTAAGCAGCTTGAGCC aguB Shewanella sp.F:ATCTGGGCATCTACCGCAAG R:CGATTTTCGCGTAACGGGTC Serratia sp.F:TCTACCGCAAGAGCCACATC R:AACGGGTCTGCCATACCTTG speA Shewanella sp.F:AGACATGGTTAAAGCGGGGG R:CTCGCGAGGATCTCTTCCAC Serratia sp.F:ATTGTGCTGGAAGAAGCCGA R:AGTTGCAGACTGTCCAGACG speB Shewanella sp.F:GCAAGTTTGACCATGGCACC R:ATCCCCACCTGCACAGAATG Serratia sp.F:CTATTAAACTGGTGCGCGGC R:TCGCCGCCTGGATATACAAC speC Shewanella sp.F:AAGACGGCATCGTCCTGAAG R:GGTTTCCAGGTCGTTGGTCT Serratia sp.F:ACTGTTACTGACCACGCCAG R:CGCAGATAGTGGGCGAGAAT rocF Shewanella sp.F:CGCATTCGGACTTCAACACC R:CGGATACCGATCTGGTGCAT Serratia sp.F:GACCTGCATACCCTCCACAC R:CTCTTCCGGATCGACTGAGC
1.4 数据处理
所有实验均设置3 次重复,数据以平均值±标准差表示。采用SPSS 20.0软件进行显著性分析,P<0.05表示差异显著。使用GraphPad Prism 9.5软件绘制图表。
2 结果与分析
2.1 HVEF-LSPC处理对鮰鱼片TVC的影响
如图1所示,贮藏期间,CK组TVC始终低于国际食品微生物规范委员会规定的淡水鱼TVC限值(7.0(lg(CFU/g)))。对照组和实验组初始TVC均为3(lg(CFU/g))左右,且各组间差异较小。这表明鮰鱼片初始为无菌,反接种操作过程严格可控,由此可判定后续贮藏期间鮰鱼片品质变化主要源于接种的3 种腐败菌。贮藏2~8 d,鱼片TVC迅速增加,但实验组TVC增长明显滞后于对照组。贮藏4 d时,接种3 种腐败菌的鮰鱼片TVC均超过7.0(lg(CFU/g))。随着贮藏时间的延长,对照组和实验组TVC差异逐渐增大。贮藏末期,与对照组相比,实验组接种S. putrefaciens、S. havnia、Serratia sp.鮰鱼片TVC分别下降3.08、2.67、2.58(lg(CFU/g))。吴越[17]采用变频电场联合丁香酚处理贻贝时也得出相似结果,说明HVEF-LSPC处理能够有效抑制S. putrefaciens、S. havnia和Serratia sp.在低温贮藏鮰鱼片中的生长。
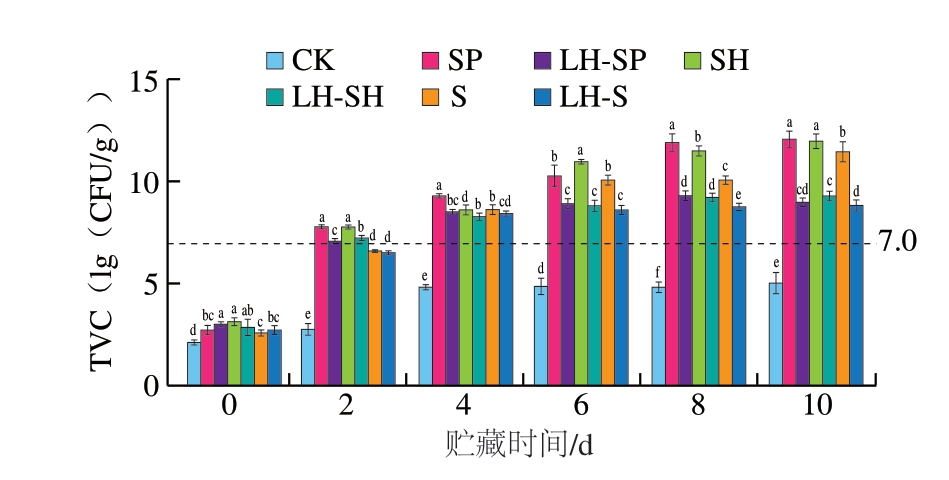
图1 不同处理组鮰鱼片TVC随贮藏时间的变化
Fig. 1 Changes in TVC of channel catfish fillets from different treatment groups during storage
小写字母不同表示组间差异显著(P<0.05)。图2、3同。
2.2 HVEF-LSPC处理对鮰鱼片TCA可溶性肽含量的影响
TCA可溶性肽含量已被广泛采纳为评估鱼肉蛋白质降解程度的关键指标[16]。如图2所示,贮藏0~2 d,各组TCA可溶性肽含量均为1 μmol/g左右。随着贮藏时间的延长,对照组TCA可溶性肽含量迅速增加,贮藏结束时,对照组接种S. putrefaciens、S. havnia和Serratia sp.鮰鱼片TCA可溶性肽含量分别升至5.06、3.71、3.81 μmol/g。与之相比,HVEF-LSPC处理鮰鱼片TCA可溶性肽含量上升较为缓慢,分别低0.33、0.60、0.59 μmol/g。值得注意的是,无论是对照组还是实验组,接种S. putrefaciens鮰鱼片的TCA可溶性肽含量均较高,这与TVC结果相吻合。鱼肉中的可溶性肽含量变化主要由内源酶和微生物作用引起,腐败菌在贮藏过程中产生的蛋白酶和肽酶可促进鱼肉蛋白降解[18]。因此,HVEF-LSPC处理鮰鱼片TCA可溶性肽含量较低可能主要归因于HVEF与LSPC的协同抑菌作用。
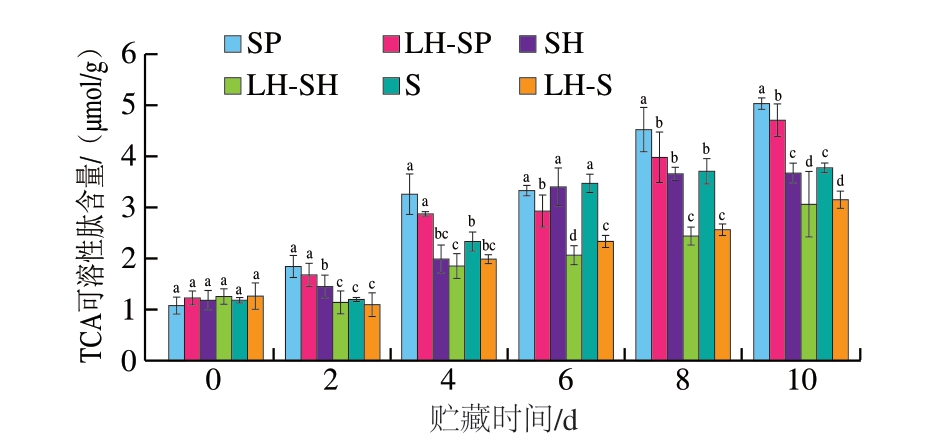
图2 不同处理组鮰鱼片TCA可溶性肽含量随贮藏时间的变化
Fig. 2 Changes in TCA soluble peptide content in channel catfish fillets from different treatment groups during storage
2.3 HVEF-LSPC处理对鮰鱼片TVB-N含量的影响
如图3所示,贮藏0~2 d,各组TVB-N含量均为10 mg/100 g左右。贮藏4 d,对照组TVB-N含量明显开始升高,贮藏6 d时均超过淡水鱼的可接受限值(20 mg/100 g)。贮藏结束时,接种S. putrefaciens、S. havnia和Serratia sp.鮰鱼片TVB-N含量分别升至47.51、36.12、32.90 mg/100 g。由于HVEF与LSPC的协同抑菌作用,实验组TVB-N含量上升较为缓慢,贮藏8 d时,TVB-N含量仅升至20 mg/100 g左右。贮藏结束时,接种S. putrefaciens、S. havnia和Serratia sp.鮰鱼片TVB-N含量分别为31.92、27.02、25.34 mg/100 g。贮藏结束时,与对照组相比,HVEF-LSPC处理鮰鱼片TVB-N含量分别下降33.81%(S. putrefaciens)、25.19%(S. havnia)、22.98%(Serratia sp.)。值得注意的是,贮藏末期,对照组接种S. putrefaciens鮰鱼片TVB-N含量显著高于其他组(P<0.05),由此推测,S. putrefaciens的致腐能力强于S. havnia和Serratia sp.。在鱼类腐败过程中,TVB-N主要来源于微生物对FAAs和肽类等含氮化合物的分解作用。这一机制也可以部分解释TVB-N含量变化与TCA可溶性肽含量变化呈相似趋势的现象。Shewanella sp.和Serratia sp.是导致鱼肉TVB-N含量升高的主要腐败菌,而植物多酚已被证实能够有效抑制或杀灭水产品中的Shewanella sp.、假单胞菌和Serratia sp.等[19],方旭波等[20]也发现电场处理能够杀灭鱿鱼中的部分腐败菌,从而延长其保质期。因此,HVEF-LSPC处理鮰鱼片TVB-N含量较低也可归因于HVEF与LSPC的协同抑菌作用。
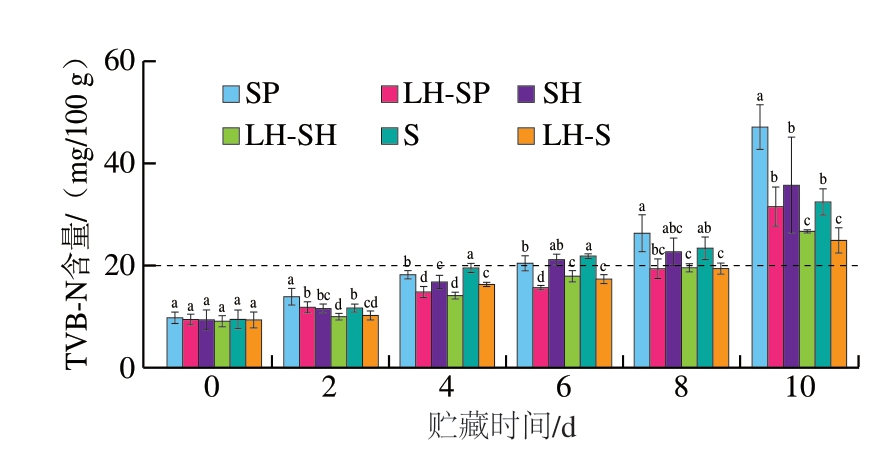
图3 不同处理组鮰鱼片TVB-N含量随贮藏时间的变化
Fig. 3 Changes in TVB-N content of channel catfish fillets from different treatment groups during storage
2.4 HVEF-LSPC处理对鮰鱼片FAAs含量的影响
FAAs由蛋白质降解产生,是多种BAs的前体物。如表2所示,从鮰鱼片中共检出17 种FAAs,其中,谷氨酸、组氨酸、精氨酸、酪氨酸、鸟氨酸和赖氨酸均为BAs的前体物质。与CK组相比,接种S. putrefaciens鮰鱼片中的谷氨酸、组氨酸、酪氨酸、赖氨酸含量均显著上升(P<0.05);接种S. havnia鮰鱼片中的谷氨酸、组氨酸含量均显著下降(P<0.05);接种Serratia sp.鮰鱼片中的谷氨酸、组氨酸含量均显著下降(P<0.05)。接种3 种腐败菌鮰鱼片中的各种氨基酸含量存在差异,接种同种腐败菌的鮰鱼片中各种氨基酸含量在实验组与对照组之间也存在差异,这可能由不同菌株分泌酶的能力不同以及HVEF联合LSPC处理对腐败菌的抑制作用导致。FAAs的生成与细菌分泌酶的催化作用密切相关,其中,谷氨酸通过谷氨酸脱氢酶或转氨酶催化生成;精氨酸、鸟氨酸的生成涉及尿素循环相关酶[21];组氨酸的合成途径相对复杂,需多步酶促反应[22];酪氨酸由苯丙氨酸羟化酶催化苯丙氨酸羟化生成[23]。浑球红假单胞菌、大肠杆菌等革兰氏阴性菌能够通过谷氨酰胺合成酶和谷氨酸合成酶催化合成谷氨酸[24-25]。刘晨临等[26]发现深海希瓦氏菌能够分泌谷氨酸合成酶,由此推测接种S. putrefaciens鮰鱼片中的谷氨酸含量较高可能与其分泌的谷氨酸合成酶相有关。
表2 贮藏10 d鮰鱼片FAAs含量
Table 2 Free amino acid contents of channel catfish fillets after storage for 10 d mg/100 g

注:同行小写字母不同表示组间差异显著(P<0.05)。表2同。
FAAsCKSPLH-SPSHLH-SHSLH-S天冬氨酸11.14±0.46a10.53±0.21ab10.72±0.45ab10.32±0.36ab10.58±0.25ab10.28±0.22b10.57±0.27ab谷氨酸4.58±0.13c24.06±1.25a18.52±1.74b3.22±0.14e2.57±0.01g3.70±0.11d2.77±0.05f丝氨酸7.64±0.69a4.98±0.14b4.72±0.35bc4.29±0.17c4.16±0.14c4.22±0.20c4.15±0.12c甘氨酸10.61±0.73c20.2±0.44a16.77±1.10b8.67±0.09d7.95±0.31e8.88±0.60d8.28±0.36de组氨酸4.99±0.61c15.70±0.65a10.15±0.58b1.92±0.11e1.90±0.27ef2.66±0.40d1.67±0.10f精氨酸517.17±37.97b512.92±18.46b537.6±36.94ab519.17±11.29b597.34±29.14a539.29±27.04b391.39±13.74c苏氨酸28.99±2.83c46.45±11.42b56.51±6.14a13.87±±0.05d11.43±1.21e15.38±2.06d6.11±0.98f丙氨酸16.58±1.58c37.35±9.61a28.47±1.90b5.83±5.10d1.70±0.04e脯氨酸232.62±40.29d605.63±30.64a382.62±49.15b293.72±14.99c285.88±17.71cd280.94±26.08cd224.74±23.54d酪氨酸7.07±1.44c34.34±2.37a23.76±2.30b3.01±1.63d4.28±3.58cd5.36±2.67cd2.13±0.95d缬氨酸43.29±2.48a38.45±4.87ab37.31±4.24ab36.10±1.23b28.12±0.42c25.62±1.10d37.22±1.06b甲硫氨酸1.31±0.61c11.99±10.54a0.45±0.35cd1.59±0.51c2.26±0.85bc1.84±1.24bc4.21±1.56b半胱氨酸6.57±1.37a6.36±0.79a3.82±0.47d5.12±0.46ab4.28±1.96bcd4.25±0.35c5.37±0.21ab异亮氨酸4.02±0.50c14.80±0.77a11.47±0.75b0.95±0.34e0.97±0.12e2.85±4.16d0.25±0.11f苯丙氨酸2.25±0.43c13.59±1.31a7.57±0.88b0.89±0.45de0.91±0.07d1.81±0.89cd0.48±0.19e鸟氨酸2.89±0.32d5.20±0.35b6.16±0.29a4.25±0.19c赖氨酸8.06±0.38f40.26±3.56a23.28±2.53b8.41±0.35f13.42±0.46d18.24±1.16c9.67±0.41e
2.5 HVEF-LSPC处理对鮰鱼片BAs含量的影响
如表3所示,从鮰鱼片中共检出8 种BAs,未检出组胺。与CK组相比,多种BAs含量显著升高(P<0.05)。接种S. putrefaciens鮰鱼片BAs总含量明显高于其他组,SP组和LH-SP组BAs总含量分别为59.33、42.76 mg/100 g。其中SP组腐胺和尸胺含量均为最高,分别为23.69、14.66 mg/100 g,HVEF-LSPC处理后,2 种BAs含量显著下降(P<0.05)。接种其他2 种腐败菌鮰鱼片中,腐胺和尸胺占比及变化相似。综上,与对照组相比,HVEF-LSPC处理后,鮰鱼片腐胺和尸胺含量均显著下降(P<0.05),说明HVEF联合LSPC能有效抑制3 种腐败菌参与的BAs合成过程。
表3 贮藏10 d鮰鱼片BAs含量
Table 3 BAs contents of channel catfish fillets after storage for 10 d mg/100 g
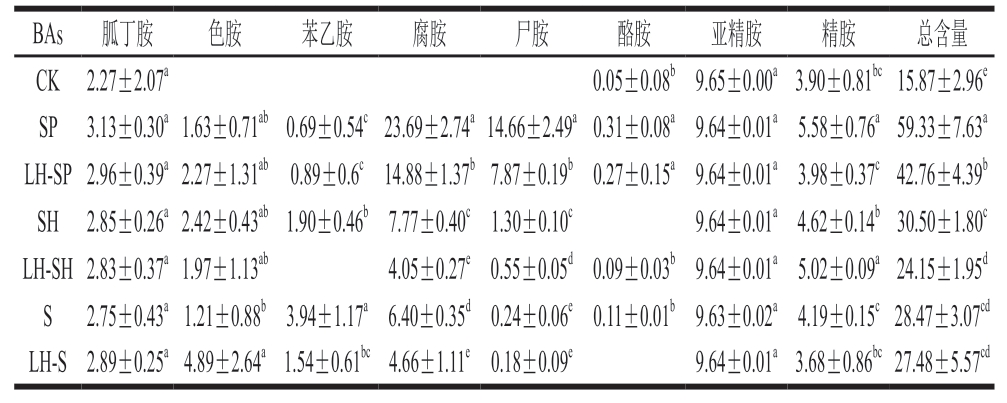
BAs胍丁胺色胺苯乙胺腐胺尸胺酪胺亚精胺精胺总含量CK2.27±2.07a0.05±0.08b9.65±0.00a3.90±0.81bc15.87±2.96e SP3.13±0.30a1.63±0.71ab0.69±0.54c23.69±2.74a14.66±2.49a0.31±0.08a9.64±0.01a5.58±0.76a59.33±7.63a LH-SP2.96±0.39a2.27±1.31ab0.89±0.6c14.88±1.37b7.87±0.19b0.27±0.15a9.64±0.01a3.98±0.37c42.76±4.39b SH2.85±0.26a2.42±0.43ab1.90±0.46b7.77±0.40c1.30±0.10c9.64±0.01a4.62±0.14b30.50±1.80c LH-SH2.83±0.37a1.97±1.13ab4.05±0.27e0.55±0.05d0.09±0.03b9.64±0.01a5.02±0.09a24.15±1.95d S2.75±0.43a1.21±0.88b3.94±1.17a6.40±0.35d0.24±0.06e0.11±0.01b9.63±0.02a4.19±0.15c28.47±3.07cd LH-S2.89±0.25a4.89±2.64a1.54±0.61bc4.66±1.11e0.18±0.09e9.64±0.01a3.68±0.86bc27.48±5.57cd
腐胺作为淡水鱼腐败臭味的主要来源,贮藏过程中,可通过阻碍优势腐败菌的腐胺生成途径抑制鱼肉臭味的产生,腐胺生成途径表现出显著的微生物种属差异,从不同鱼类中分离的S. putrefaciens、Serratia sp.和莓实假单胞菌(Pseudomonas fragi)均能有产生腐胺[27]。腐胺主要由精氨酸、瓜氨酸、谷氨酸和鸟氨酸脱羧生成。Zhuang Shuai等[4]发现鱼肉中的S. putrefaciens能够将包括精氨酸在内的所有前体物质降解成腐胺。从草鱼中分离鉴定的恶臭假单胞菌(Pseudomonas putida)也能够将谷氨酸、瓜氨酸和鸟氨酸降解为腐胺[28]。然而,Remenant等[29]分析发现,从土壤中分离的2 种Shewanella菌株不能通过精氨酸途径生成腐胺。由此可见,不同种属细菌生成腐胺的途径有所不同,源自不同环境的同属细菌在腐胺生成途径方面也可能不同。另外,尸胺作为冷藏鱼肉中含量仅次于腐胺的BAs,其臭味比腐胺更加浓烈[30]。赖氨酸脱羧是其主要产生途径,Shewanella sp.和Serratia sp.已被证实具有强赖氨酸脱羧酶活性[31-32]。
2.6 HVEF-LSPC处理对3 种腐败菌腐胺生成相关通路基因转录水平的影响
腐胺是冷藏鮰鱼片中最主要的BAs。如图4所示,在S. putrefaciens定植的鮰鱼片中,aguA、aguB、speA、speB、speC、rocF均发生转录。经HVEF-LSPC处理后,aguA、aguB、speA、speB基因转录水平显著下调(P<0.001、P<0.000 1)。在S. havnia定植的鮰鱼片中,aguB和rocF未发生转录,speA、speB、speC转录水平显著下调(P<0.000 1)。在Serratia sp.定植的鮰鱼片中,rocF未发生转录,speA、speB转录水平显著下调(P<0.001)。
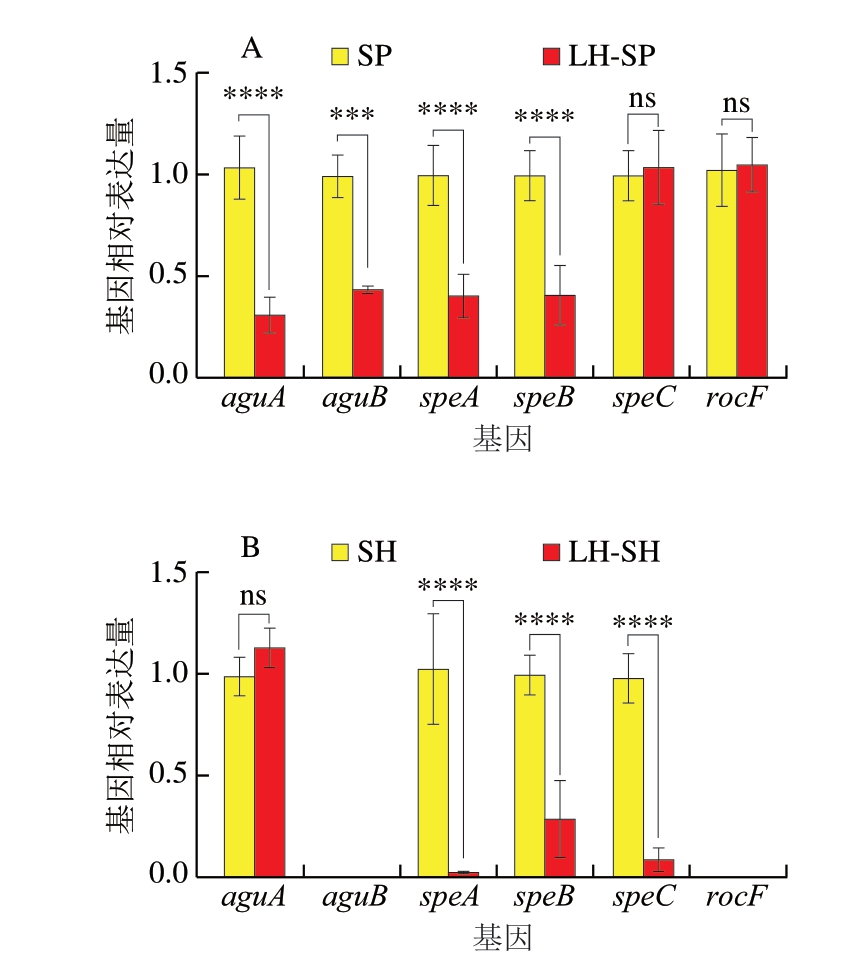
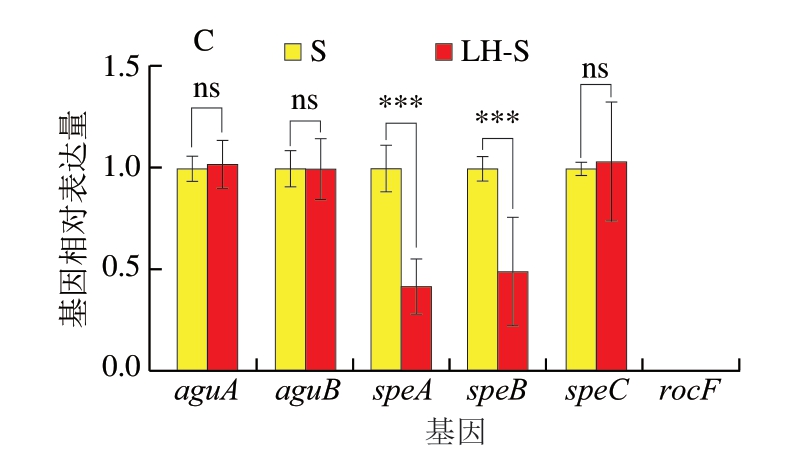
图4 腐胺生成途径基因转录水平
Fig. 4 Transcription levels of putrescine production pathway genes
A. S. putrefaciens;B. S. havnia;C. Serratia sp.;***. P<0.001、****. P<0.000 1。
水产品中的腐胺主要由微生物活动产生,Shewanella sp.和Serratia sp.是常见的腐胺生产者[33]。与通过相应氨基酸直接脱羧形成的其他BAs相比,腐胺可以通过3 种不同的代谢途径生成,由aguA、aguB、speA、speB、speC、rocF控制的代谢途径如图5所示[34]。aguA和aguB构成胍丁胺合成途径,可将胍丁胺分解为腐胺[35]。speA、speB调控精氨酸生成腐胺的代谢途径[36]。rocF、speC调控精氨酸/鸟氨酸生成腐胺的代谢途径[37]。
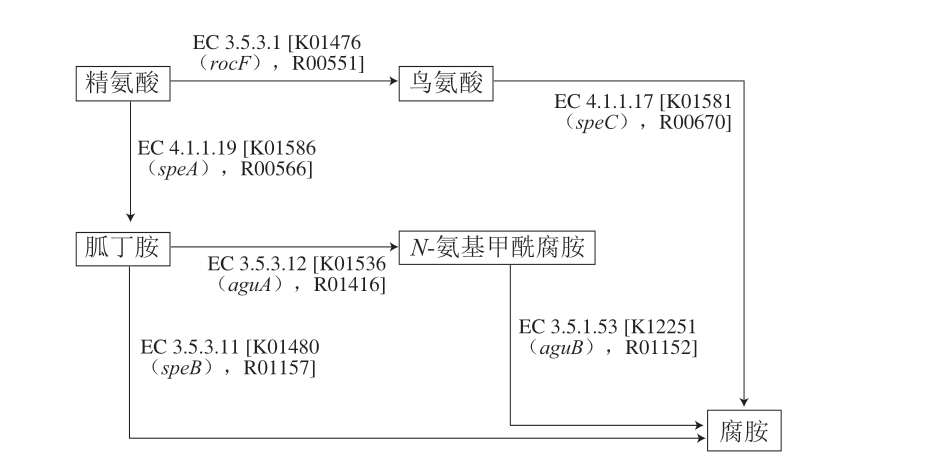
图5 腐胺生成的基因调控途径
Fig. 5 Gene control pathways for putrescine production
3 结 论
本研究探讨HVEF联合LSPC处理对冷藏鮰鱼片中常见腐败菌致腐能力的抑制效果。结果表明,贮藏结束时,HVEF-LSPC处理鮰鱼片TVC、TCA可溶性肽含量和TVB-N含量均显著低于未处理组(P<0.05);BAs(如腐胺、尸胺)总含量显著下降(P<0.05);speA、speB等腐胺生成基因转录水平显著下调(P<0.05)。HVEF联合LSPC处理鮰鱼片能有效降低腐败菌的致腐能力,进而有效抑制蛋白质降解,为水产品保鲜提供了新策略。
[1] CHEN J H, WEI W Y, LIANG C, et al. Protective effect of cinnamaldehyde on channel catfish infected by drug-resistant Aeromonas hydrophila[J]. Microbial Pathogenesis, 2022, 167: 105572.DOI:10.1016/j.micpath.2022.105572.
[2] 李娜, 谢晶, 梅俊. 水产品优势腐败菌及致腐潜能综述[J]. 中国食品学报, 2024, 24(1): 407-417. DOI:10.16429/j.1009-7848.2024.01.038.
[3] 励建荣, 杨兵, 李婷婷. 水产品优势腐败菌及其群体感应系统研究进展[J]. 食品科学, 2015, 36(19): 255-259. DOI:10.7506/spkx1002-6630-201519046.
[4] ZHUANG S, LIU Y Y, GAO S, et al. Mechanisms of fish protein degradation caused by grass carp spoilage bacteria: a bottom-up exploration from the molecular level, muscle microstructure level,to related quality changes[J]. Food Chemistry, 2022, 403: 134309.DOI:10.1016/j.foodchem.2022.134309.
[5] LOU X W, HAI Y W, LE Y, et al. Metabolic and enzymatic changes of Shewanella baltica in golden pomfret broths during spoilage[J]. Food Control, 2022, 144: 109341. DOI:10.1016/j.foodcont.2022.109341.
[6] QI M Y, ZHAO R Q, LIU Q Y, et al. Antibacterial activity and mechanism of high voltage electrostatic field (HVEF) against Staphylococcus aureus in medium plates and food systems[J]. Food Control, 2021, 120: 107566. DOI:10.1016/j.foodcont.2020.107566.
[7] HUANG H, SUN W, XIONG G, et al. Effects of HVEF treatment on microbial communities and physicochemical properties of catfish fillets during chilled storage[J]. LWT-Food Science and Technology,2020, 131: 109667. DOI:10.1016/j.lwt.2020.109667.
[8] LIU J, ZHU F, YANG J, et al. Effects of high-voltage electrostatic field(HVEF) on frozen shrimp (Solenocera melantho) based on UPLCMS untargeted metabolism[J]. Food Chemistry, 2023, 411: 135499.DOI:10.1016/j.foodchem.2023.135499.
[9] BEKHIT A E D A, SUWANDY V, CARNE A, et al. Effect of repeated pulsed electric field treatment on the quality of hot-boned beef loins and topsides[J]. Meat Science, 2016, 111: 139-146. DOI:10.1016/j.meatsci.2015.09.001.
[10] SHIEKH K A, BENJAKUL S, QI H, et al. Combined hurdle effects of pulsed electric field and vacuum impregnation of Chamuang leaf extract on quality and shelf-life of Pacific white shrimp subjected to high voltage cold atmospheric plasma[J]. Food Packaging and Shelf Life, 2021, 28: 100660. DOI:10.1016/j.fpsl.2021.100660.
[11] LI X, WANG J, GAO X Q, et al. Inhibitory effects of lotus seedpod procyanidins against lipid and protein oxidation and spoilage organisms in chilled-storage beef[J]. LWT-Food Science and Technology, 2022, 160: 113247. DOI:10.1016/j.lwt.2022.113247.
[12] TANG C E, XIE B J, ZONG Q, et al. Proanthocyanidins and probiotics combination supplementation ameliorated intestinal injury in enterotoxigenic Escherichia coli infected diarrhea mice[J]. Journal of Functional Foods, 2019, 62: 103521. DOI:10.1016/J.JFF.2019.103521.
[13] 高天麒, 汪超, 汪兰, 等. 冷藏鮰鱼中腐败菌的分离鉴定及腐败能力测定[J]. 肉类研究, 2023, 37(3): 1-6. DOI:10.7506/rlyj1001-8123-20230110-005.
[14] ZHUANG S, TAN Y Q, HONG H, et al. Exploration of the roles of spoilage bacteria in degrading grass carp proteins during chilled storage: a combined metagenomic and metabolomic approach[J].Food Research International, 2021, 152: 110926. DOI:10.1016/j.foodres.2021.110926.
[15] WU Y W, ZHAO M M, XIA Y T, et al. Deterioration of muscle quality caused by ammonia exposure in rainbow trout (Oncorhynchus mykiss)[J].SSRN Electronic Journal, 2023, 53: 102609. DOI:10.1016/j.fbio.2023.102609..
[16] ZHUANG S, LI Y, JIA S L, et al. Effects of pomegranate peel extract on quality and microbiota composition of bighead carp (Aristichthys nobilis) fillets during chilled storage[J]. Food Microbiology, 2019, 82:445-454. DOI:10.1016/J.FM.2019.03.019.
[17] 吴越. 低压变频电场集成复合保鲜剂对蒸煮贻贝冰温保鲜的影响[D]. 舟山: 浙江海洋大学, 2022. DOI:10.27747/d.cnki.gzjhy.2022.000448.
[18] 郭培培. 四种不同鳊鱼冷藏运输过程中品质的变化[J]. 中国调味品,2024, 49(11): 164-167. DOI:10.3969/j.issn.1000-9973.2024.11.027.
[19] 张亚美, 池帅, 李颖畅, 等. 生物保鲜剂在水产品保鲜中的应用及研究进展[J]. 中国食品添加剂, 2023, 34(11): 36-44. DOI:10.19804/j.issn1006-2513.2023.11.006.
[20] 方旭波, 刘淑集, 曹蓉露, 等. 低压静电场处理对鱿鱼保鲜效果的影响[J]. 食品研究与开发, 2024, 45(18): 99-105. DOI:10.12161/j.issn.1005-6521.2024.18.014.
[21] 朱华伟, 李寅. 合成生物制造2025[J]. 生物工程学报, 2025, 41(1):1-78. DOI:10.13345/j.cjb.241014.
[22] 李镠. pgi基因调控对L-组氨酸发酵的影响[D]. 天津: 天津科技大学,2022. DOI:10.27359/d.cnki.gtqgu.2022.000789.
[23] 解彬, 任晓红, 李泽璇, 等. 氨基酸代谢组学技术在肾脏疾病的研究进展[J]. 临床肾脏病杂志, 2024, 24(10): 870-874. DOI:10.3969/j.issn.1671-2390.2024.10.012.
[24] 张一维, 崔文璟, 周哲敏, 等. 大肠杆菌胞质非特异性二肽酶对γ-氨基丁酸的催化作用研究[J]. 食品与发酵工业, 2025, 51(4): 139-144.DOI:10.13995/j.cnki.11-1802/ts.038615.
[25] 邹小鲁, 宋鸿遇, SHANGHAI. 浑球红假单胞菌(Rhodobacter sphaeroides)谷氨酸合酶的纯化及性质[J]. 植物生理学报, 1989(3):313-319.
[26] 刘晨临, 黄晓航, 刘建国. 长心卡帕藻(Kappaphycus alvarezii)表达序列标记分析[J]. 海洋与湖沼, 2011, 42(6): 804-810.
[27] 冉春霞, 陈光静. 我国传统发酵肉制品中生物胺的研究进展[J]. 食品与发酵工业, 2017, 43(3): 285-294. DOI:10.13995/j.cnki.11-1802/ts.201703048.
[28] ZHUANG S, TIAN L, LIU Y Y, et al. Amino acid degradation and related quality changes caused by common spoilage bacteria in chillstored grass carp (Ctenopharyngodon idella)[J]. Food Chemistry,2022, 399: 133989. DOI:10.1016/j.foodchem.2022.133989.
[29] REMENANT B, JAFFRÈS E, DOUSSET X, et al. Bacterial spoilers of food: behavior, fitness and functional properties[J]. Food Microbiology, 2015, 45: 45-53. DOI:10.1016/j.fm.2014.03.009.
[30] 罗辑, 戴照琪, 赵航, 等. 等离子体活性水腌制对风干里脊中生物胺含量及感官品质的影响[J]. 食品科学, 2022, 43(22): 361-368.DOI:10.7506/spkx1002-6630-20220107-052.
[31] 蒋继志, 王游游, 王雪宁, 等. 致病疫霉拮抗细菌SR13-2菌株的鉴定及对马铃薯离体组织的防病作用[J]. 作物杂志, 2017(3): 146-150.DOI:10.16035/j.issn.1001-7283.2017.03.026.
[32] 牛茵, 吴双慧, 何济坤, 等. 基于宏基因组技术分析自然发酵羊肉香肠中微生物多样性及挥发性风味功能基因[J]. 食品科学, 2024,45(2): 139-148. DOI:10.7506/spkx1002-6630-20230409-076.
[33] GANJEH A M, MOREIRA N, PINTO C A, et al. The effects of highpressure processing on biogenic amines in food: a review[J] Food and Humanity, 2024, 2: 100252. DOI:10.1016/j.foohum.2024.100252.
[34] WUNDERLICHOVÁ L, BUŇKOVÁ L, KOUTNÝ M, et al. Novel touchdown-PCR method for the detection of putrescine producing Gram-negative bacteria in food products[J]. Food Microbiology, 2013,34(2): 268-276. DOI:10.1016/j.fm.2012.09.024.
[35] LINARES D M, RIO B D, REDRUELLO B, et al. AguR,a transmembrane transcription activator of the putrescine biosynthesis operon in Lactococcus lactis, acts in response to the agmatine concentration[J]. Applied and Environmental Microbiology, 2015,81(18): 6145-6157. DOI:10.1128/AEM.00959-15.
[36] KOBAYASHI T, SAKAMOTO A, KASHIWAGI K, et al. Putrescine biosynthesis from agmatine by arginase (TtARG) in Thermus thermophilus[J]. The Journal of Biochemistry, 2023, 174(1): 81-88.DOI:10.1093/jb/mvad026.
[37] BAO X Y, WANG F F, YANG R D, et al. Ornithine decarboxylation system of Shewanella baltica regulates putrescine production and acid resistance[J]. Journal of Food Protection, 2021, 84(2): 303-309.DOI:10.4315/jfp-20-227.