随着食品加工技术的飞速发展,许多传统菜肴已商业化生产,水产品预制菜作为其中的重要分支,近年来发展态势大好[1]。预制调理鱼是水产品预制菜的重要产品类别,主要通过宰杀、预处理、原料腌制、包装等环节制成[2],消费者在购买后对其进行简单加工即可食用,目前因其操作简便、食用美味而广受市场青睐。斑点叉尾鮰(Letalurus punetaus)是目前我国主要淡水养殖鱼类之一,食用价值高,基于鮰鱼开发的冷冻或即食预制调理菜正在逐步开发。
预制调理鱼在腌制过程中通常加入糖类物质以达到调味增鲜等目的。但由于鱼肉蛋白含量高,且在贮藏过程中不可避免会发生蛋白质氧化,这往往伴随着肽链上基团的暴露或一些聚集现象的发生,不仅会使肌肉品质下降,而且会促进或抑制组织内有关蛋白质的化学反应[3]。这可能导致预制调理鱼贮藏及后续热加工过程中蛋白质与自身还原糖及外源添加的糖类发生糖基化反应产物晚期糖基化终末产物(advanced glycation end products,AGEs)含量的增加,AGEs主要分为荧光性AGEs及非荧光性AGEs,其中非荧光性AGEs(Nε-羧甲基赖氨酸(Nε-carboxymethyllysine,CML)和Nε-羧乙基赖氨酸(Nε-carboxyethyllysine,CEL))通常作为标志性产物,评价食品体系内AGEs的生成量。食源性AGEs在人体内大量蓄积可能会引发糖尿病及其并发症、心脑血管疾病等[4]。目前已有研究表明,对生鱼肉进行冷藏后热处理,随着冻藏时间的延长,热处理后鱼肉中AGEs含量呈上升趋势[5]。Zhao Mengna等[6]在对鸡肉丸进行冻藏处理后也得到了相似的结论。这可能是由于肉类制品在贮藏过程中自身发生了复杂的生理变化,如蛋白质氧化降解、脂质氧化及肉类腐败过程中糖原分解产生还原糖等,都可能通过影响整个美拉德反应,从而对AGEs含量产生影响[7]。Zhu Zongshuai等[8]利用Fenton体系对鸡肉肌原纤维蛋白进行糖基化氧化反应,体系内CML、CEL含量随着·OH含量的增加而增加,推测可能由于其蛋白质结构变化影响其中间产物的生成,从而导致AGEs含量的增加。
基于上述研究结果,本研究选择聚焦于斑点叉尾鮰氧化肌球蛋白、糖类对AGEs生成的影响,并分析肌球蛋白氧化程度及糖类结构对AGEs生成量的影响途径。建立低、中、高3 种氧化程度肌球蛋白结合单糖、二糖及多糖体系,随后对体系内糖基化中间产物活性α-二羰基化合物(乙二醛(glyoxal,GO)、甲基乙二醛(methylglyoxal,MGO))以及荧光性和非荧光性AGEs含量进行测定,并通过相关性分析反映肌球蛋白氧化程度对不同糖类体系内中间产物、末端产物的影响,为明确AGEs生成影响因素及预制调理鱼的腌制、贮藏、加工提供一定的理论支持。
1 材料与方法
1.1 材料与试剂
鲜活斑点叉尾鮰,每尾体质量(3.0±0.2)kg,市购。
氯化钠、Tris、乙二醇-双(2-氨基乙基醚)四乙酸(glycol-bis(2-aminoethylether)-N,N,N’,N’-tetraacetic acid,EGTA)、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、盐酸、2-硫代巴比妥酸(2-thiobarbituric acid,TBA) 国药集团化学试剂有限公司;ATP-Na2、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)、8-苯胺-1-萘磺酸(8-anilino-1-naphtha lenesulfonic acid,ANS) 上海源叶生物科技有限公司;以上试剂均为分析纯;鱼CML酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)检测试剂盒 上海科艾博生物技术有限公司;CEL ELISA检测试剂盒 上海瑞番生物科技有限公司。
1.2 仪器与设备
CF15R高速低温离心机、UH500紫外分光光度计日本日立公司;LE2002E电子分析天平 瑞士Mettle Toledo公司;T18 basic高速分散均质机 德国IKA公司;F-4700荧光分光光度计 日本Hitachi公司。
1.3 方法
1.3.1 肌球蛋白的提取及氧化
参照Park等[7]的方法并稍加修改。将鮰鱼肉用去离子水浸泡冲洗,取背脊肉。加入10 倍体积的溶液A(0.1 mol/L KCl、20 mmol/L Tris-HCl缓冲液),10 000 r/min均质1 min,均质液于4 ℃下放置15 min后离心(4 ℃、8 000 r/min、10 min),沉淀于5 倍体积溶液B(含0.45 mol/L KCl、5 mmol/L β-巯基乙醇、0.2 mol/L醋酸镁、1 mmol/L EGTA的20 mmol/L Tris-HCl缓冲液)中悬浮,同时加入ATP-Na2至终浓度为5 mmol/L,于5 ℃下放置1 h,离心(4 ℃、10 000 r/min、10 min)取上清液,用5 倍体积1 mmol/L KHCO3溶液稀释,于4 ℃下放置15 min,离心(4 ℃、12 000 r/min、10 min)取沉淀,重新用2.5 倍体积溶液C(含0.5 mol/L KCl和5 mmol/L β-巯基乙醇的20 mmol/L Tris-HCl缓冲液)悬浮,于4 ℃下放置10 min,再用2.5 倍体积的1 mmol/L KHCO3溶液稀释并加MgCl2至终浓度为10 mmol/L,于4 ℃下放置过夜,离心(4 ℃、10 000 r/min、20 min),沉淀于1 倍体积溶液D(含0.5 mol/L NaCl的20 mmol/L Tris-HCl缓冲液)中溶解,即为肌球蛋白溶液。
肌球蛋白的氧化按Zhu Zongshuai等[8]的方法进行,并稍作修改。将一定体积肌球蛋白溶液与Fenton溶液混合,使最终溶液中肌球蛋白质量浓度为10 mg/mL、FeCl3浓度为0.01 mmol/L,H2O2浓度别为0、1、5、10、20 mmol/L(H1、H2、H3、H4、H5组),4 ℃下孵育24 h。未氧化的组为对照组(CK),氧化组分为低氧化程度组(H1、H2)、中氧化程度组(H3)、高氧化程度组(H4、H5),所有实验指标均在4 ℃条件下测定,重复3 次。
1.3.2 羰基含量测定
参照石钢鹏等[9]的方法并稍加修改,取2 mL 1 mg/mL肌球蛋白溶液与等体积10 mmol/L DNPH溶液(0.5 mol/L H3PO4溶解)混合,室温反应10 min后加入1 mL 6 mol/L NaOH溶液,继续室温下反应10 min。反应液在450 nm处测定吸光度(A),每组样品平行测定3 次。羰基含量按式(1)计算:
式中:ε为摩尔消光系数(22 308 L/(mol·cm));ρ为肌球蛋白质量浓度/(mg/mL);D为稀释倍数。
1.3.3 总巯基含量测定
参照高可安等[10]的方法并稍加修改,将1 mg/mL肌球蛋白溶液与0.2 mol/L Tris-HCl缓冲液(含8 mol/L尿素、10 mmol/L EDTA、2 g/100 mL SDS,pH 7.0)以体积比1∶9混合,混匀室温反应30 min,再加入与肌球蛋白溶液体积相同的含0.1 g/100 mL DTNB的Tris-HCl缓冲液(pH 8.0),混匀,40 ℃反应25 min后,在412 nm处测定吸光度(A)。总巯基含量按式(2)计算:
式中:ε为摩尔消光系数(13 600 L/(mol·cm));ρ为肌球蛋白质量浓度/(mg/mL);D为稀释倍数。
1.3.4 内源荧光光谱测定
参考Zhao Zirui等[11]的方法并稍加修改。用荧光分光光度计测定,在激发波长295 nm、发射光谱范围300~400 nm、激发和发射狭缝宽度均为5 nm条件下测定1 mg/mL肌球蛋白溶液的内源荧光光谱。
1.3.5 表面疏水性测定
参考Chen Guanyi等[12]的方法并稍加修改。用ANS做荧光探针,分别取3 mL质量浓度调节为0.1、0.2、0.3、0.5 mg/mL的肌球蛋白溶液,加入15 μL含8 mmol/L ANS的0.1 mol/L磷酸盐缓冲液(pH 7.4),在激发波长390 nm、发射波长470 nm、狭缝宽度均为5 nm的参数下用荧光分光光度计进行测定。用荧光强度对肌球蛋白质量浓度的斜率(H0)表示肌球蛋白表面疏水性。
1.3.6 氧化蛋白糖基化体系建立
参考逄格雨等[13]的方法并稍加修改。取不同氧化程度肌球蛋白溶液,测定蛋白浓度,向蛋白溶液中加入葡聚糖、葡萄糖、蔗糖,使糖浓度与蛋白浓度相同,对照组为未氧化蛋白组。将溶液充分混匀后,置于140 ℃下加热15 min,得到糖基化样品。
1.3.7 不同反应体系中GO含量测定
采用Bai Xue等[14]的方法并稍加修改。将40 g/100 mL乙二醛溶液梯度稀释,随后加入0.5 mL 15 g/L乙酸钠溶液、1 mL 12 g/L盐酸羟胺溶液。将试管置于50 ℃水浴中20 min,冷却后定容至25 mL。在233 nm处测定吸光度,得到标准曲线y=0.000 07x+0.051 7(R2=0.997 3)。在试管中加入0.5 mL糖基化样品,同样加入0.5 mL 15 g/L乙酸钠溶液、1 mL 12 g/L盐酸羟胺溶液进行显色反应,在233 nm处测定吸光度,随后根据标准曲线计算GO含量。
1.3.8 不同反应体系中MGO含量测定
参照Bai Xue等[14]的方法并稍加修改。取1 mL糖基化样品与5 mL TBA溶液(5 g/L)混合,沸水浴10 min,3 000 r/min离心15 min,取上清液,测定450、532、600 nm处的吸光度(A450 nm、A532 nm、A600 nm),MGO含量以吸光度表示,按式(3)计算:
1.3.9 不同反应体系中荧光AGEs含量测定
参照刘秀英等[15]的方法并稍加修改。取反应后溶液,激发和发射狭缝宽度分别为5.0、5.0 nm,分别在370 nm和300~400 nm激发和发射波长下测定荧光AGEs的荧光强度,荧光AGEs含量以荧光强度表示。
1.3.10 不同反应体系中CML、CEL含量测定
CML含量和CEL含量均参照试剂盒说明书测定。
1.4 数据处理
所有数据均采用Microsoft Excel 2019、Origin Pro 2020及SPSS软件进行统计处理及绘图。所有实验重复3 次。
2 结果与分析
2.1 H2O2浓度对肌球蛋白氧化程度的影响
2.1.1 羰基含量
蛋白质羰基化是一种不可逆、非酶促蛋白质修饰,被用于反映体系内蛋白质的氧化程度[16]。如图1所示,体系内羰基含量随H2O2浓度增加不断增加,未氧化肌球蛋白溶液羰基含量为0.32 nmol/mg,在H2O2浓度达到20 mmol/L时,羰基含量为0.81 nmol/mg。在H2O2浓度由5 mmol/L增加至10 mmol/L时,羰基含量快速增加,说明肌球蛋白溶液在中等浓度H2O2条件下羰基生成速率最快,这可能是由于自由基会与肌球蛋白快速反应,造成羰基含量上升,在高浓度H2O2作用下,羰基生成可能被轻微抑制,这可能是由于氧化过程中生成的羰基衍生物导致蛋白质发生交联[17],轻度抑制了蛋白质氧化羰基的生成,这与Zhu Zongshuai等[8]的研究结果相似,在低浓度和高浓度H2O2作用下,在鸡肌原纤维蛋白体系内分别观察到羰基化合物的促进和抑制。
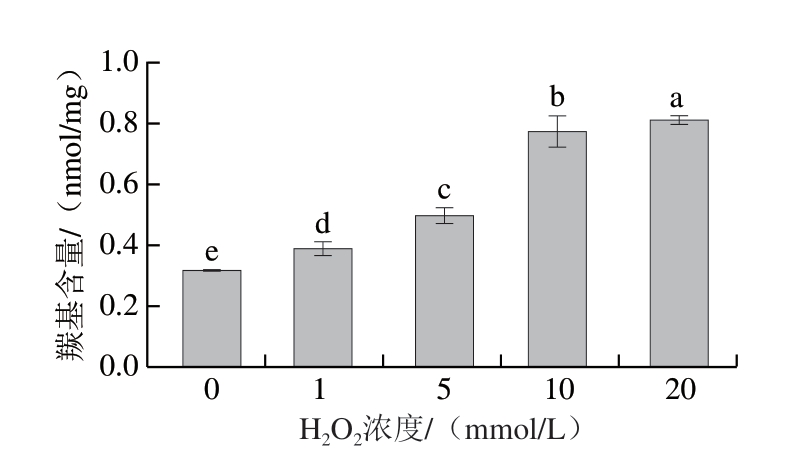
图1 不同H2O2浓度诱导下肌球蛋白氧化体系内羰基含量
Fig. 1 Carbonyl content in the myosin oxidation system induced by different H2O2 concentrations
小写字母不同表示差异显著(P<0.05)。图2、4同。
2.1.2 总巯基含量
巯基是蛋白质发挥功能和蛋白-蛋白交联的重要结构,对氧化变化敏感。通常,二硫键(S—S)在蛋白聚集和去折叠过程中起着关键作用[18]。在•OH的作用下,巯基基团被暴露氧化生成二硫键或亲电自由基,优先从半胱氨酸的巯基中吸出氢原子,导致体系内总巯基含量降低[19]。如图2所示,加入H2O2后,随H2O2浓度的上升,总巯基含量降低,并在H2O2浓度由5 mmol/L增加至10 mmol/L时快速下降,随后下降速率减慢,这一现象与羰基含量变化相似。总巯基含量在H2O2高浓度时下降缓慢可能是由于蛋白质结构变化导致巯基被包埋,氧化生成二硫键的进程被抑制。Wang Youjun等[20]用3 种不饱和脂肪酸处理肌原纤维蛋白,也得到随蛋白氧化程度的加深,巯基含量不断下降的结论。
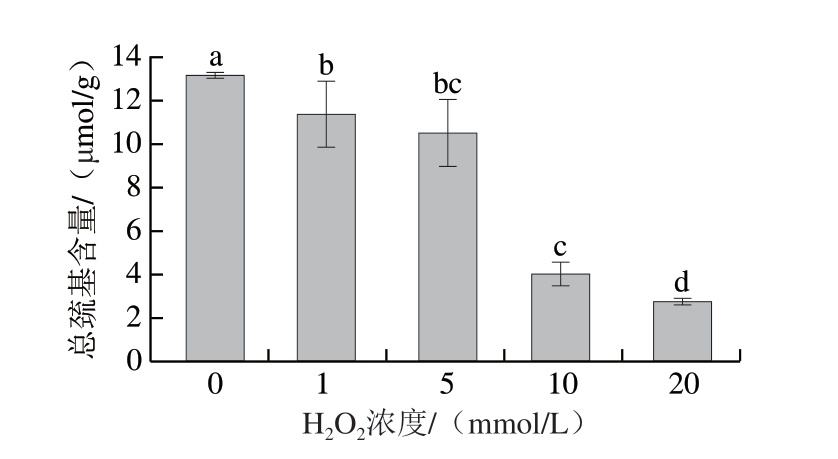
图2 不同浓度H2O2诱导下肌球蛋白氧化体系内总巯基含量
Fig. 2 Total sulfhydryl content in the myosin oxidation system induced by different H2O2 concentrations
2.1.3 内源荧光光谱
蛋白质的荧光特性主要来源于分子中的色氨酸残基,如图3所示,氧化处理后的肌球蛋白溶液荧光强度峰值由4 315下降至1 463,内源荧光强度的降低表明蛋白质三级结构发生变化。色氨酸荧光强度的衰减是由于自由基从荧光基团的吲哚环中夺取氢原子,导致色氨酸残基发生氧化猝灭[20],荧光强度降低。经过氧化处理后的肌球蛋白溶液吸收峰从336 nm移至333 nm处,表明发色团微环境发生变化,色氨酸微环境的变化和暴露于极性水相也会导致荧光强度的衰减[21]。本研究证明,随着模拟体系中H2O2浓度的不断升高,体系内肌球蛋白的氧化程度随之升高。
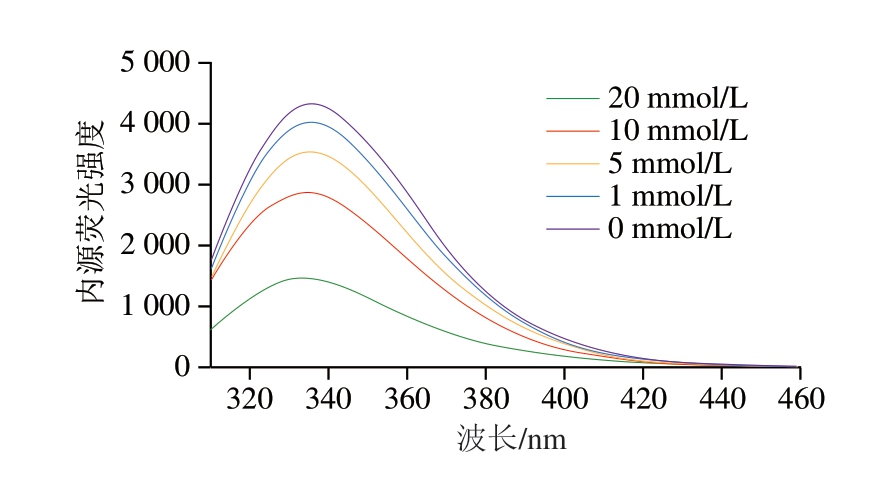
图3 不同浓度H2O2诱导下肌球蛋白氧化体系内源荧光光谱
Fig. 3 Endogenous fluorescence spectra of the myosin oxidation system induced by different H2O2 concentrations
2.1.4 表面疏水性
表面疏水性反映蛋白质中暴露的疏水氨基酸残基含量[22-23],用以反映蛋白质的氧化程度。如图4所示,随着H2O2浓度的增加,表面疏水性由1 869.4显著升高至2 326.53(P<0.05),与Pan Deyin等[24]研究结果相似,这是由于·OH氧化触发了蛋白质结构的展开,使得更多埋藏在蛋白质内部的疏水性氨基酸残基暴露,导致蛋白质表面疏水性升高,并与肌球蛋白氧化程度呈正相关。这一结果也与上述羰基含量、总巯基含量、内源荧光光谱结果相一致,证实在Fenton氧化体系中通过调节H2O2浓度控制了肌球蛋白的氧化程度。在此基础上,以氧化肌球蛋白为实验原料,通过高温下与单糖、二糖和多糖的糖基化反应,分析蛋白质氧化程度对后续糖基化中间产物和AGEs生成的影响。
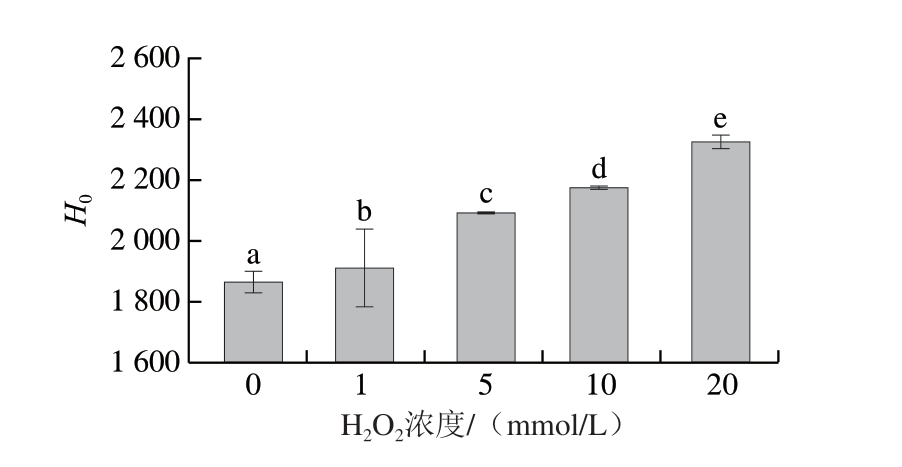
图4 不同浓度H2O2诱导下肌球蛋白氧化体系表面疏水性
Fig. 4 Surface hydrophobicity of the myosin oxidation system induced by different H2O2 concentrations
2.2 肌球蛋白氧化程度对糖基化反应中间产物生成的影响
GO、MGO是AGEs的前体物质,可通过美拉德反应途径和脂质氧化途径形成。MGO、GO的含量越高,越容易与胺类物质反应生成AGEs。
2.2.1 不同体系糖基化中间产物GO含量
活性α-二羰基化合物GO是糖基化反应的重要中间产物之一,是末端产物CML的前体物质。如图5所示,在肌球蛋白处于相同氧化程度时,蔗糖体系内GO含量均显著低于葡聚糖与葡萄糖体系(P<0.05),糖基化反应主要发生于还原糖与蛋白质之间,蔗糖属于非还原性二糖,参与反应时需要先高温裂解为葡萄糖与果糖,过程中需要断裂糖苷键,从而导致反应速率低于葡聚糖与葡萄糖体系[25]。
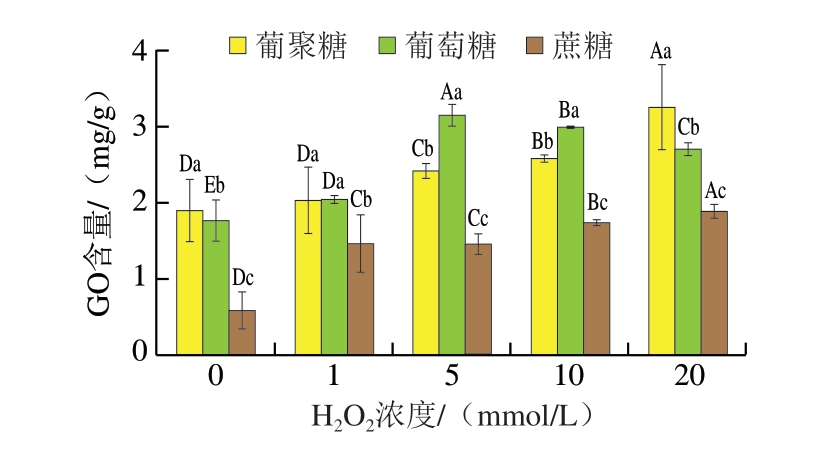
图5 不同氧化肌球蛋白-糖类体系内GO含量
Fig. 5 GO contents in reaction systems of oxidized myosin with different saccharides
大写字母不同表示同一体系、不同H2O2浓度间差异显著(P<0.05);小写字母不同表示相同H2O2浓度、不同体系间差异显著(P<0.05)。图5、6、8同。
随着氧化程度的上升,葡聚糖体系与蔗糖体系中GO含量不断上升,蛋白氧化加速了糖基化反应进程。GO主要由氨基酸与还原糖缩合形成席夫碱,在经Amadori重排后氧化脱水裂解生成,体系内GO含量随着肌球蛋白氧化程度的不断增加而增加,这可能是由于肌球蛋白在·OH的作用下优先攻击肌球蛋白氨基酸残基的侧链,导致羰基含量增加和巯基氧化,在这个过程中隐藏在肌球蛋白内部的赖氨酸、甘氨酸、异亮氨酸等氨基酸残基逐渐暴露,与还原糖结合的位点增加。或者由于肌球蛋白在氧化过程中结构展开及片段化,导致其空间结构对反应过程中产生的位阻降低,促进反应的发生。朱泓颖[5]对鱼肉新鲜度与中间产物生成分析也得到相似的结论,通过对蛋白及脂类氧化指标的测定,GO含量的上升可能由于生鱼肉在冷藏期间蛋白质被氧化,为美拉德反应提供了更多的反应位点,进而促进GO的形成以及脂类直接发生过氧化反应生成GO。在此过程中GO生成量>消耗量,导致GO不断累积,这可能由于葡聚糖属于多糖,分子质量大,空间结构复杂,导致其反应速率低于葡萄糖体系。葡萄糖体系内GO含量呈先上升后下降的趋势,在低氧化程度下,GO生成量>消耗量,且随着氧化程度上升,生成速率加快。在高浓度条件下,GO生成量<消耗量。GO含量的降低主要原因是由于GO是一种相对不稳定的缺电子分子,属于亲电子化合物,在适宜条件下易与氨基酸和蛋白质上的游离氨基及核苷酸发生交联,形成多类稳定加合物,GO含量的增加促进了反应的快速进行,从而导致GO的消耗速率>GO的生成速率。
2.2.2 不同体系糖基化中间产物MGO含量
MGO是糖基化反应的重要中间体,与GO类似,它具有高反应活性,可以迅速与食品中的其他化合物如半胱氨酸和赖氨酸反应,生成更稳定的糖基化产物。MGO是CEL的前体,其生成量与CEL的水平密切相关。
如图6所示,与GO含量变化趋势不同的是,各体系内MGO含量均随着肌球蛋白氧化程度的升高而升高,葡聚糖、葡萄糖和蔗糖体系内MGO含量从0.763 0、0.603 8、0.413 9增长至3.574 1、5.5760 3、1.701 5,其中在高氧化程度下上升显著(P<0.05),在中低氧化程度下,MGO含量为葡聚糖体系>葡萄糖体系>蔗糖体系,这可能是由于葡萄糖体系内反应发生速率更快,生成更多的MGO,前体物质的大量积累导致快速进入下一阶段反应[26],生成更稳定的CEL,在高氧化程度下,MGO含量为葡萄糖体系>葡聚糖体系>蔗糖体系,这是因为反应条件相同,后续反应速率趋于稳定,但由于氧化程度的升高,生成MGO速率不断加快,导致大量MGO的积累[27]。MGO的形成过程与GO有相同之处,均可以由体系内氨基酸与糖类发生糖基化反应生成,不同的是,MGO也可以通过体系内糖类发生焦糖化反应而来。·OH氧化造成的蛋白质解聚、去折叠及片段化所暴露出的更多赖氨酸与半胱氨酸残基同样会导致MGO含量的上升,在热加工过程中蛋白质也持续进行氧化反应。焦糖化反应使糖类,尤其是单糖在高温条件下极易氧化裂解,从而生成MGO,这也是葡萄糖体系内MGO含量高于蔗糖体系及葡聚糖体系的原因之一[28]。Chen Le等[29]对皮蛋清蛋白进行氧化诱导,与本研究相似的是,在含有Cu2+和·OH的体系内均观察到随着金属离子及自由基的增加,体系内皮蛋清蛋白的氧化程度增加,MGO含量也呈上升趋势,而且通过对MGO的影响进而促进了CEL的含量升高。
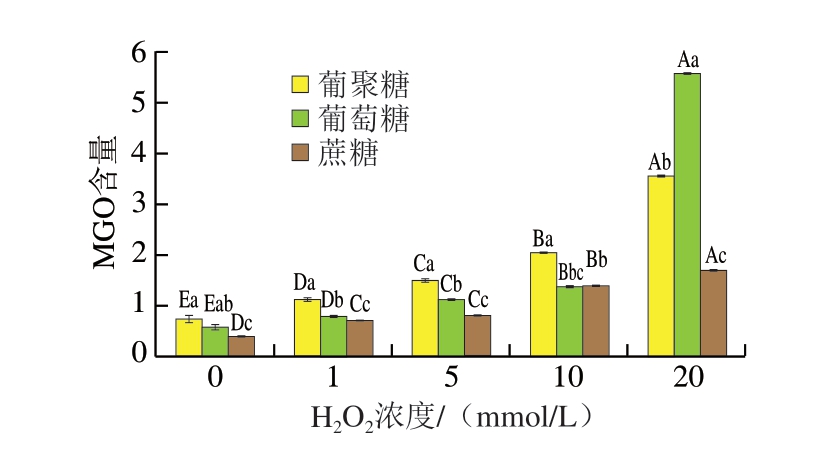
图6 不同氧化肌球蛋白-糖类体系MGO含量
Fig. 6 MGO contents in reaction systems of oxidized myosin with different saccharides
2.3 肌球蛋白氧化程度对AGEs生成的影响
2.3.1 不同体系荧光AGEs的生成
如图7所示,体系内荧光强度均随肌球蛋白氧化程度升高而升高,在低氧化程度下,荧光AGEs含量明显增加,样品在440 nm处的荧光强度分别由158.36、190.47、158.87增加至372.80、429.90、332.67,且荧光AGEs含量葡萄糖体系>葡聚糖体系>蔗糖体系,与中间产物趋势相符。在中高氧化程度下,荧光AGEs含量上升趋势缓慢,这可能是因为反应后期荧光AGEs会进一步生成不具有荧光性的类黑精[30],导致模拟体系中荧光强度上升趋势缓慢。本实验结果表明,肌球蛋白氧化程度的加深显著增加了体系内荧光AGEs含量的上升。Yu Ligang[31]、申广[32]等分别利用Fenton体系对猪肉肌原纤维蛋白、鸡肉肌原纤维蛋白-葡萄糖体系进行氧化处理,并测定不同氧化时间后蛋白质氧化程度及荧光AGEs含量,也观察到与本研究相似的结果,随肌原纤维蛋白氧化程度的上升,荧光AGEs含量总体呈上升趋势,这可能也是由于中间产物的增加促进了美拉德反应的继续进行,使后续AGEs不断生成。
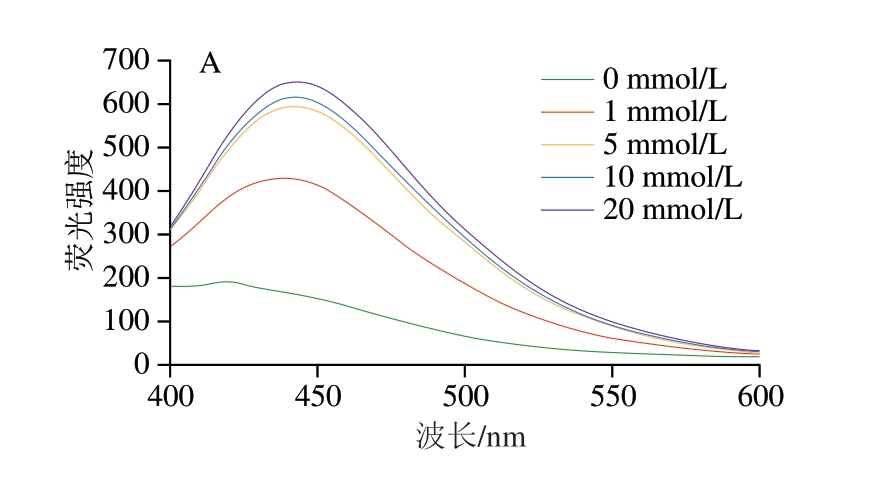
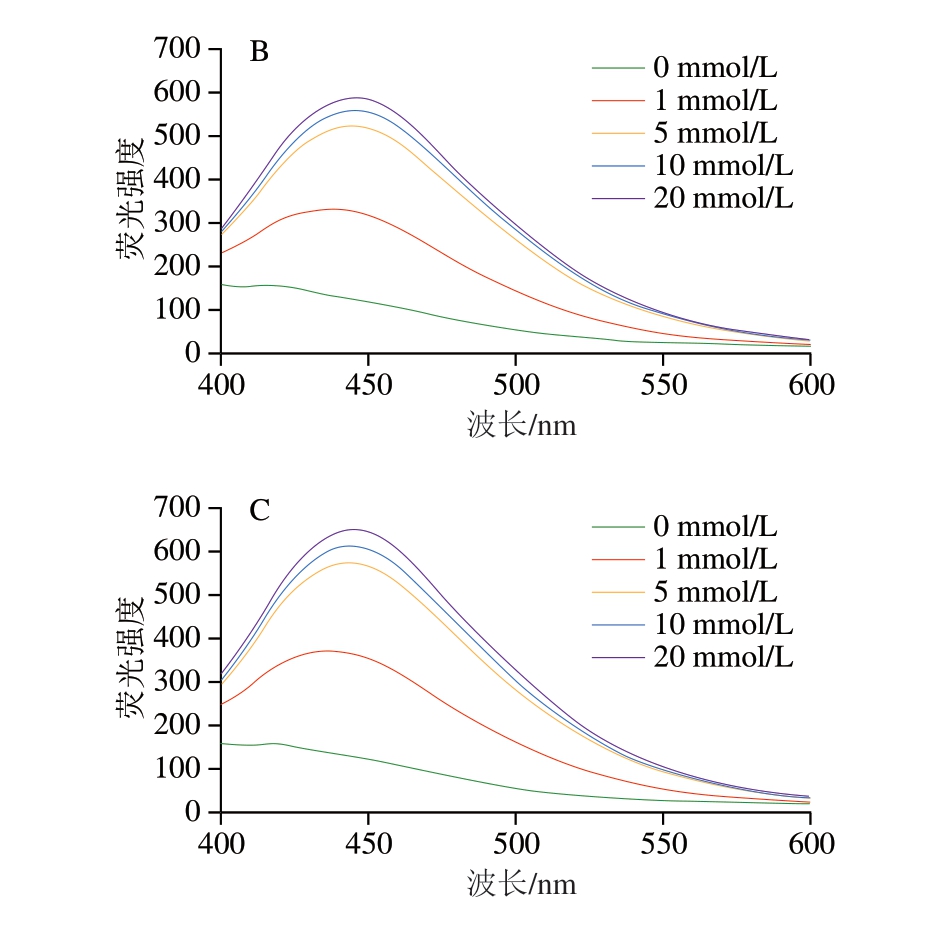
图7 不同氧化肌球蛋白-糖类体系荧光AGEs含量
Fig. 7 Fluorescence spectra showing the production of fluorescent AGEs from reaction systems of oxidized myosin with different saccharides
A.葡萄糖体系;B.蔗糖体系;C.葡聚糖体系。图9同。
2.3.2 不同体系CML、CEL的生成
食品热加工过程中会产生2 种典型的非荧光性AGEs,分别为CML、CEL,通常作为评价AGEs生成的标志产物[33]。
如图8A所示,随着肌球蛋白氧化程度的加深,CML含量逐渐升高,在低氧化程度时,含量升高不显著,中氧化程度时逐渐升高,高氧化程度时含量快速上升。这可能是由于氧化程度较低时,蛋白质结构变化较小,对蛋白质与糖类反应的影响较小,随着氧化程度的提高,蛋白质结构展开,更多易发生糖基化反应的氨基酸残基暴露,如赖氨酸残基、精氨酸残基等,与α-二羰基化合物结合生成AGEs[26]。GO作为CML的前体物质在高氧化程度时被快速消耗,含量降低,与上述实验结果相符。在各氧化浓度中CML生成量均为葡萄糖体系>葡聚糖体系>蔗糖体系,单糖体系内CML的生成速率高于多糖体系与二糖体系。
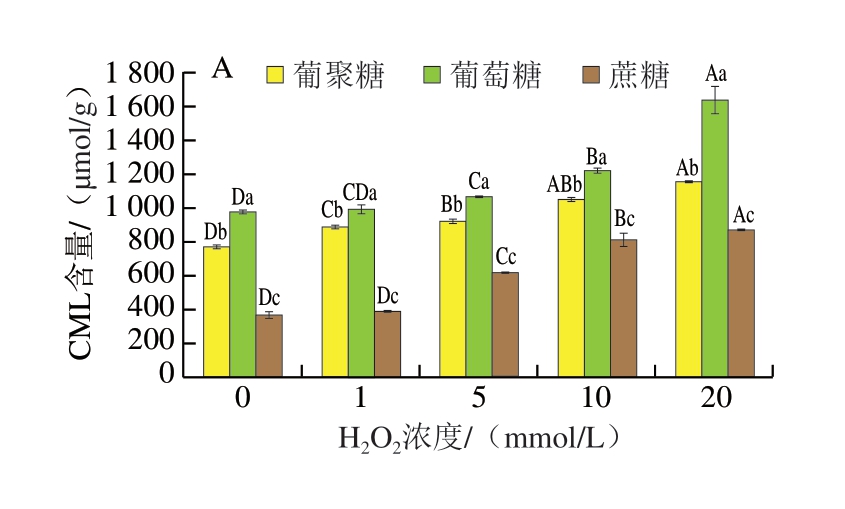
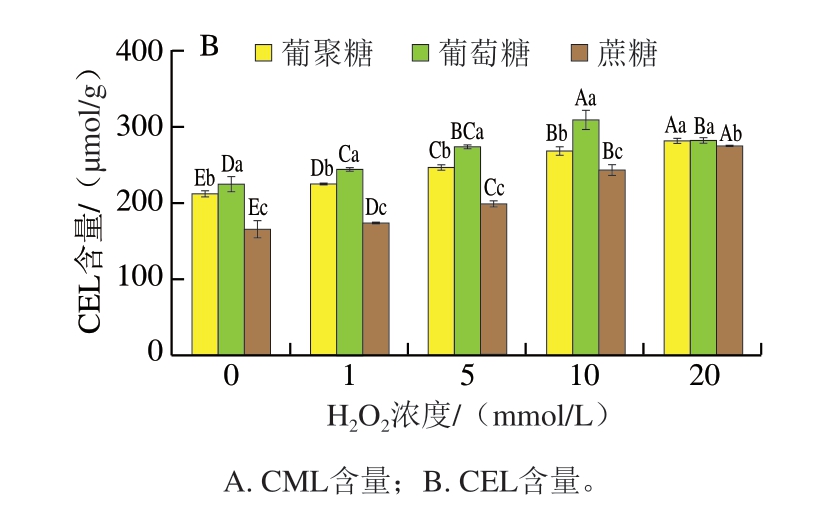
图8 不同氧化肌球蛋白-糖类体系非荧光AGEs含量
Fig. 8 Amounts of non-fluorescent AGEs produced from reaction systems of oxidized myosin with different saccharides
如图8B所示,CEL含量随着肌球蛋白氧化程度的加深呈上升趋势,葡萄糖体系内CEL含量在高氧化程度时出现下降趋势,结合CEL前体物质MGO含量分析,可能生成的大量MGO受反应速率或结合位点的影响,没有转化为CEL。CEL含量总体上升趋势较为平稳,受蛋白质氧化程度影响小于CML。在中低氧化程度体系内,CEL生成量均为葡萄糖体系>葡聚糖体系>蔗糖体系,单糖体系内CEL的生成速率高于多糖体系与二糖体系。在高氧化程度体系内,CEL生成量差异较小,可能由于蛋白质浓度影响了MGO与后续氨基酸残基反应[27]。
CML与CEL含量的变化反映了不同氧化程度的肌球蛋白及不同糖类对热加工过程中AGEs生成的影响,Niu Lihong[33]、Shen Xiaolei[34]、张昆[35]等分别对猪肉、鲢鱼肉及牛肉贮藏不同时间后蛋白质氧化情况及热加工生成的CML、CEL进行测定,结论均表明肉类蛋白在经过贮藏后随着时间的延长,蛋白质氧化程度也在不断增强,且程度越高,AGEs含量越高,与本研究模拟体系内AGEs含量的上升趋势相符,蛋白质氧化导致其二级、三级结构发生变化,更多的氨基酸残基暴露、氧化,为后续与糖类发生美拉德反应提供了便利,结合GO、MGO分析,蛋白质氧化主要通过促进糖基化反应中间产物的大量生成,从而促进AGEs的生成。
2.4 相关性分析
由图9可知,葡萄糖体系内总巯基含量与CML和CEL含量呈极显著负相关(P<0.01),葡聚糖体系内总巯基含量与CML含量呈显著负相关(P<0.05),与CEL含量呈极显著负相关(P<0.01),蔗糖体系内总巯基含量与CML含量呈显著负相关(P<0.05)。葡萄糖体系内内源荧光强度与GO、CEL含量呈显著负相关(P<0.05),与MGO、CML含量呈极显著负相关(P<0.01),蔗糖体系内内源荧光强度与GO含量呈显著负相关(P<0.05),与MGO和CML含量呈极显著负相关(P<0.01),葡聚糖体系内内源荧光强度与CML含量呈显著负相关(P<0.05),与MGO、CEL含量呈极显著负相关(P<0.05)。这可能是由于在Fenton体系氧化作用下,肌球蛋白表面巯基被氧化形成二硫键等其他氧化衍生物,半胱氨酸残基是蛋白质中最敏感的氨基酸残基,在自由基的作用下,半胱氨酸中的游离巯基在不同的氧化环境中可以被氧化成可逆形式或不可逆形式[36]。内源荧光强度的下降代表了体系内色氨酸的猝灭及其周围微环境的改变。然而,半胱氨酸是肌球蛋白分子上主要发生糖基化反应的氨基酸残基之一,所以半胱氨酸残基与色氨酸残基的氧化反应可能在一定程度上抑制了肌球蛋白的糖基化反应生成更多AGEs[35]。各体系内源荧光强度的变化均通过影响AGEs前体物质的生成,从而对AGEs生成产生影响。各体系内AGEs与羰基含量及表面疏水性呈显著正相关(P<0.05),葡萄糖、葡聚糖体系内羰基含量及表面疏水性与CML、CEL含量均呈极显著正相关(P<0.01),蔗糖体系内羰基含量与表面疏水性、GO、CEL含量呈显著正相关(P<0.05),表面疏水性与荧光AGEs、CML含量呈显著正相关(P<0.05)。说明肌球蛋白在·OH的氧化作用下形成醛、酮等羰基化合物,导致羰基含量增加。表面疏水性的增加则是由于·OH的氧化诱导促使氨基酸残基的疏水基团展开、伸展并暴露在肌球蛋白表面。AGEs的增加可能说明蛋白质羰基化以及疏水性氨基酸或某些疏水基团可能更有利于糖基化反应的进行[36]。糖基化中间产物GO、MGO含量也影响了CML及CEL的生成量。GO、MGO为CML、CEL的前体物质,前体物质的增加促进了糖基化反应的继续,从而导致AGEs的生成量增加。由于AGEs含量随着氧化程度的升高不断上升,故蛋白质羰基化以及疏水性氨基酸或某些疏水基团的暴露对于糖基化反应的影响可能大于半胱氨酸残基与色氨酸残基被氧化。
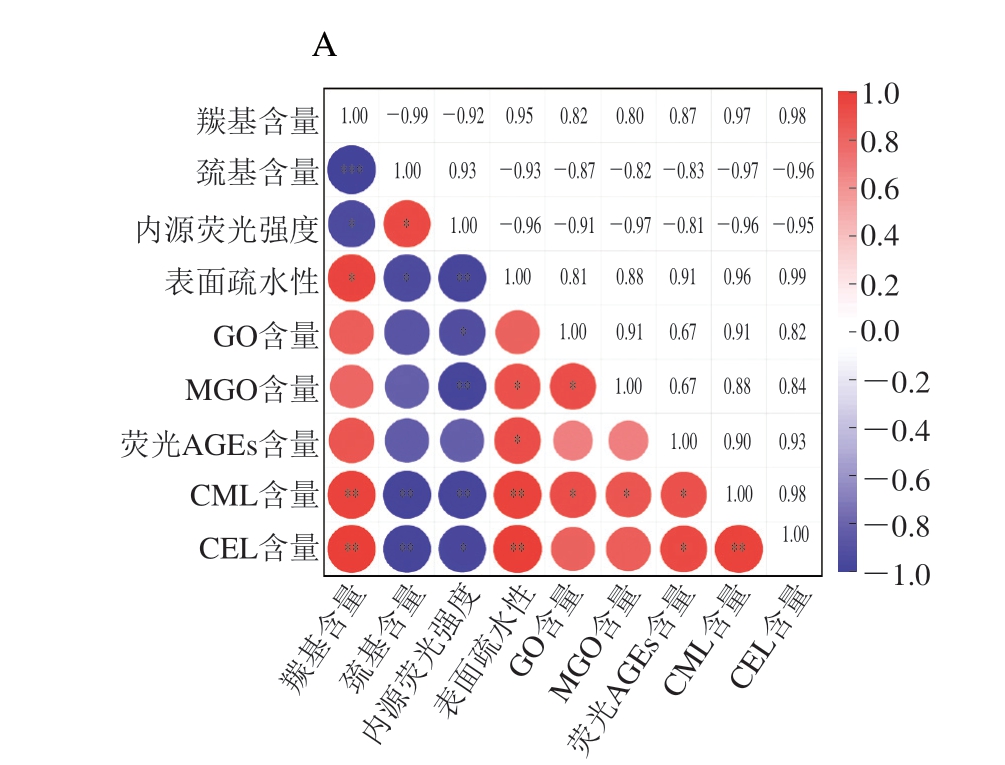
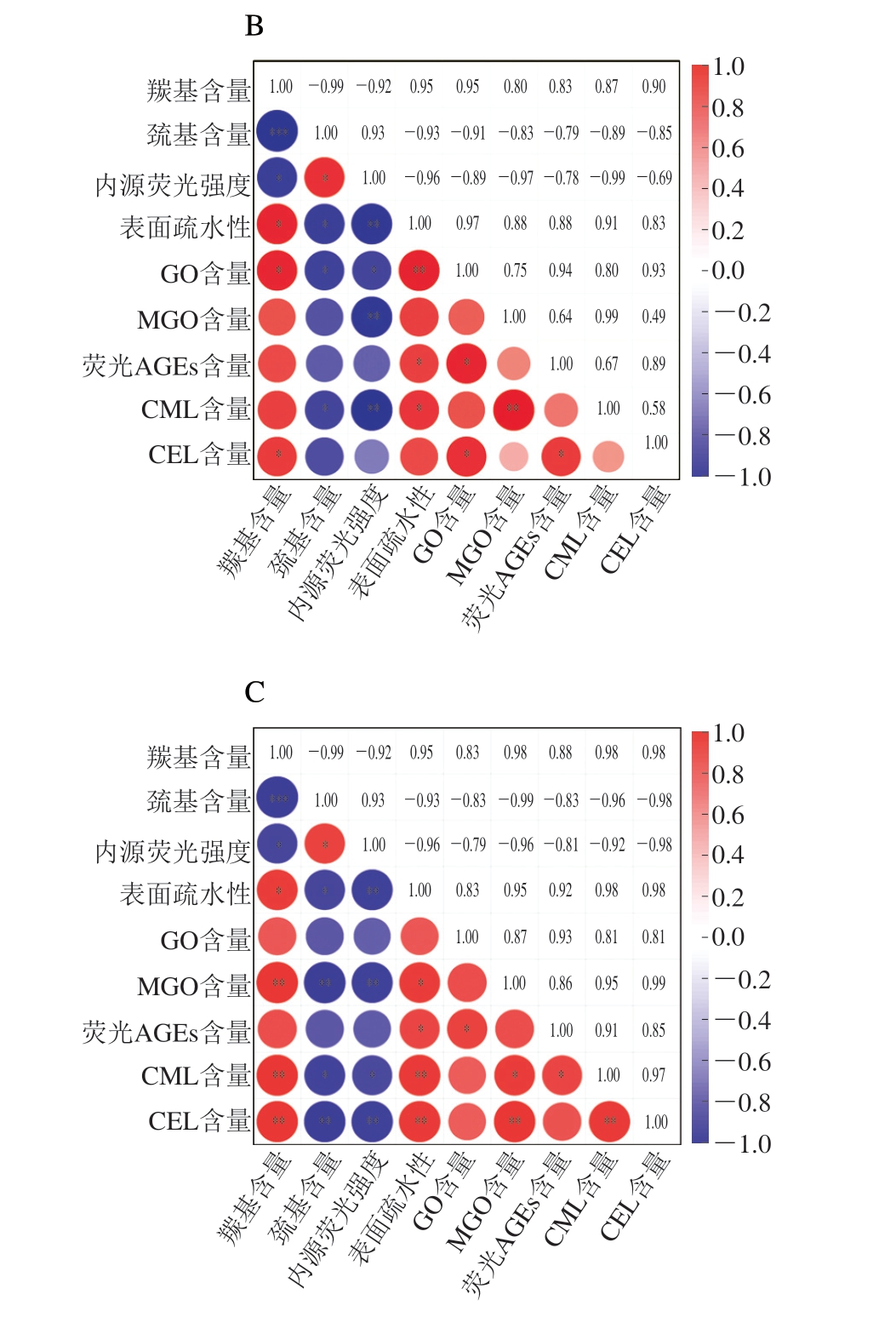
图9 肌球蛋白氧化与AGEs生成相关性分析
Fig. 9 Correlation analysis between protein oxidation and AGEs production
*.显著相关(P<0.05);**.极显著相关(P<0.01);***.高度显著相关(P<0.001)。
3 结 论
本研究以Fenton体系为氧化模型,对比低、中、高不同氧化程度肌球蛋白羰基、总巯基含量、内源荧光光谱及表面疏水性的差异,并建立氧化肌球蛋白结合单糖、二糖及多糖糖基化体系模拟鮰鱼片贮藏不同时间后蛋白质氧化程度对后续热加工过程中通过糖基化反应生成AGEs的影响。结果表明:随着体系内H2O2浓度的不断上升,羰基含量及表面疏水性不断上升、总巯基含量及内源荧光强度不断下降,表明氧化体系成功建立。分别与单糖、二糖及多糖糖基化反应后体系内GO与MGO含量显著增高,且葡萄糖体系>葡聚糖体系>蔗糖体系,荧光AGEs、CEL、CEL含量也随着肌球蛋白氧化程度的增加而增加,且不同体系内含量也与GO、MGO含量变化趋势相同。相关性分析显示,肌球蛋白糖基化体系内AGEs含量与蛋白质氧化程度显著相关,且GO、MGO含量的增加也正向促进了CML和CEL的生成。因此,蛋白质氧化显著促进了体系内AGEs的生成,且单糖对于糖基化反应速率最高。本研究结论为预制水产品贮藏对后续加工过程中AGEs产生的影响提供了理论依据。
[1] 章建设, 田迎新, 谢燕, 等. 水产品预制菜全产业链标准体系构建研究: 以湛江国联水产开发股份有限公司烤鱼产品为例[J]. 中国标准化, 2024(22): 107-112; 117. DOI:10.3969/j.issn.1002-5944.2024.22.015.
[2] 张晗玮, 武燕霓, 杨文豪, 等. 不同产地紫苏水提物对调理鲢鱼片气味品质的影响[J]. 食品工业科技, 2025, 46(9): 102-113.DOI:10.13386/j.issn1002-0306.2024050167.
[3] 高天麒, 汪超, 汪兰, 等. 冷藏鮰鱼中腐败菌的分离鉴定及腐败能力测定[J]. 肉类研究, 2023, 37(3): 1-6. DOI:10.7506/rlyj1001-8123-20230110-005.
[4] 李想. 调理鱼“蒜瓣肉”结构形成与工艺优化[D]. 武汉: 华中农业大学, 2022. DOI:10.27158/d.cnki.ghznu.2022.000768.
[5] 朱泓颖. 鱼新鲜度对烤鱼片中晚期糖基化终末产物(AGEs)形成的影响研究[D]. 锦州: 渤海大学, 2020. DOI:10.27190/d.cnki.gjzsc.2020.000531.
[6] ZHAO M G, LI Y, BAI X, et al. Inhibitory effect of guava leaf polyphenols on advanced glycation end products of frozen chicken meatballs (-18 ℃) and its mechanism analysis[J]. Foods, 2022, 11:2509. DOI:10.3390/foods11162509.
[7] PARK J, LANIER T. Scanning calorimetric behavior of tilapia myosin and actin due to processing of muscle and protein purification[J].Journal of Food Science, 1989, 54: 49-51. DOI:10.1111/j.1365-2621.1989.tb08564.x.
[8] ZHU Z S, BASSEY A P, HUANG M, et al. The effect of protein oxidation on the formation of advanced glycation end products after chicken myofibrillar protein glycation[J]. Food Science and Human Wellness, 2023, 12: 1571-1579. DOI:10.1016/j.fshw.2023.02.013.
[9] 石钢鹏, 阙凤, 高天麒, 等. 速冻方式对冷冻贮藏中大口黑鲈鱼肉蛋白质特性的影响[J]. 食品工业科技, 2021, 42(20): 309-319.DOI:10.13386/j.issn1002-0306.2021020051.
[10] 高可安, 钟湘, 蓝曼宁, 等. 冻藏对鱼糜熟化过程中品质变化的影响[J]. 食品科技, 2023, 48(12): 104-112. DOI:10.13684/j.cnki.spkj.2023.12.026.
[11] ZHAO Z R, WANG S J, LI D Y, et al. Effect of xanthan gum on the quality of low sodium salted beef and property of myofibril proteins[J]. Food Science and Human Wellness, 2021, 10(1): 112-118.DOI:10.1016/j.fshw.2020.09.003.
[12] CHEN G Y, XU C C, WANG Z F, et al. Effect of MDA-mediated oxidation on the protein structure and digestive properties of golden pomfret[J]. Food Chemistry, 2024, 443: 138563. DOI:10.1016/j.foodchem.2024.138563.
[13] 逄格雨, 徐硕, 张子豪, 等. 昆仑雪菊醇提物对不同模拟体系晚期糖基化终产物生成活性的影响[J]. 山东理工大学学报(自然科学版),2024, 38(1): 54-60. DOI:10.13367/j.cnki.sdgc.2024.01.006.
[14] BAI X, LI Y, LIANG W W, et al. Formation of advanced glycation end products of chicken breast meat induced by freezethaw cycles and subsequent cooking[J]. International Journal of Biological Macromolecules, 2023, 244: 125387. DOI:10.1016/j.ijbiomac.2023.125387.
[15] 刘秀英, 朱泓颖, 李学鹏, 等. 鱼新鲜度对其烤鱼片中晚期糖基化终末产物形成的影响[J]. 食品工业科技, 2020, 41(17): 13-18; 31.DOI:10.13386/j.issn1002-0306.2020.17.003.
[16] 陈紫婷, 陈梦婷, 孙智达. 芬顿反应诱导的肉类蛋白质氧化及干预研究进展[J]. 肉类研究, 2023, 37(5): 72-80. DOI:10.7506/rlyj1001-8123-20230209-012.
[17] GE H, LI Y X, LIU Q, et al. Improved water solubility of myofibrillar proteins by ultrasound combined with glycation: a study of myosin molecular behavior[J]. Ultrasonics Sonochemistry, 2022, 89: 106140.DOI:10.1016/j.ultsonch.2022.106140.
[18] CHEN X, XIONG Y L, XU X L. High-pressure homogenization combined with sulfhydryl blockage by hydrogen peroxide enhance the thermal stability of chicken breast myofibrillar protein aqueous solution[J]. Food Chemistry, 2019, 285: 31-38. DOI:10.1016/j.foodchem.2019.01.131.
[19] 林建城, 吕田星, 朱湘. 植酸对冷藏黄鳍鲷鱼肉品质及其蛋白质特性的影响[J]. 食品科技, 2024, 49(10): 146-154. DOI:10.13684/j.cnki.spkj.2024.10.016.
[20] WANG Y J, ZHAO Y M J, HE Y X, et al. Effect of three unsaturated fatty acids on the protein oxidation and structure of myofibrillar proteins from rainbow trout (Oncorhynchus mykiss)[J]. Food Chemistry, 2024, 451: 139403. DOI:10.1016/j.foodchem.2024.139403.
[21] ZHAO J X, LAN W Q, XIE J. Carvacrol-loaded nanoemulsions stabilized by soy protein isolate/chitooligosaccharide conjugates inhibited the oxidation and conformational variations of myofibrillar proteins in refrigerated sea bass (Lateolabrax maculatus)[J].Food Chemistry, 2024, 460(Part 1): 140442. DOI:10.1016/j.foodchem.2024.140442.
[22] 李可, 张怡雪, 王艳秋, 等. 超声波处理对低盐条件下鸡肉肌原纤维蛋白结构和氧化性质的影响[J]. 食品科学, 2024, 45(16): 177-187.DOI:10.7506/spkx1002-6630-20230725-280.
[23] WEN P P, ZHANG L, KANG Y W, et al. Effect of baking temperature and time on advanced glycation end products and polycyclic aromatic hydrocarbons in beef[J]. Journal of Food Protection, 2022, 85(12):1726-1736. DOI:10.4315/JFP-22-139.
[24] PAN D Y, MA J M, DIAO J J, et al. Effects of eugenol on the structure and gelling properties of myofibrillar proteins under hydroxyl radicalinduced oxidative stress[J]. Food Chemistry: X, 2023, 29(20): 100946.DOI:10.1016/j.fochx.2023.100946.
[25] 施振华. 糖结构对模拟体系中晚期糖基化终末产物形成的影响[D].无锡: 江南大学, 2019. DOI:10.13386/j.issn1002-0306.2019.15.009.
[26] LI T, NIU L H, LI X H, et al. Formation of advanced glycation endproducts in silver carp (Hypophthalmichthys molitrix) surimi products during heat treatment as affected by freezing-thawing cycles[J]. Food Chemistry, 2022, 395: 133612. DOI:10.1016/j.foodchem.2022.133612.
[27] CHENG Y T, KAI W L, SHI M H, et al. Key factors influencing the formation of α-dicarbonyls and dietary advanced glycation end products in bread and commercial bakery products: impacts of sugar,lipid and gluten protein[J]. Food Chemistry: X, 2025, 26: 102286.DOI:10.1016/j.fochx.2025.102286.
[28] ZHAO W B, CAI P J, ZHANG N, et al. Inhibitory effects of polyphenols from black chokeberry on advanced glycation endproducts (AGEs) formation[J]. Food Chemistry, 2022, 392: 133295.DOI:10.1016/j.foodchem.2022.133295.
[29] CHEN L, YU Z S, DONG S Q, et al. Differential contribution of Cu2+ and OH- to the formation of Nɛ-carboxymethyllysine and Nɛ-carboxyethyllysine in preserved egg white during pickling[J]. Food Chemistry, 2025, 465(1): 141837. DOI:10.1016/j.foodchem.2024.141837.
[30] 刘慧琳, 陈晓默, 吴春玲, 等. 不同加工条件对模拟体系中晚期糖基化终产物生成的影响[J]. 食品工业科技, 2017, 38(7): 96-100; 110.DOI:10.13386/j.issn1002-0306.2017.07.010.
[31] YU L G, ZHANG X Y, SUN W Y, et al. The influence of piperine on oxidation-induced porcine myofibrillar protein gelation behavior and fluorescent advanced glycation end products formation in model systems[J]. Food Chemistry, 2023, 420: 136119. DOI:10.1016/j.foodchem.2023.136119.
[32] 申广, 庞英, 张晓悦, 等. 绿原酸对肌原纤维蛋白-葡萄糖模拟体系中荧光性晚期糖基化终末产物生成的影响[J]. 现代食品科技, 2025(2):357-365. DOI:10.13982/j.mfst.1673-9078.2025.2.0061.
[33] NIU L H, SUN X H, TANG J M, et al. Combination effects of salts and cold storage on the formation of protein-bound Nɛ-(carboxymethyl)lysine and Nɛ-(carboxyethyl)lysine in raw and subsequently commercially sterilized ground pork[J]. Food Chemistry, 2018, 264:455-461. DOI:10.1016/j.foodchem.2018.05.054.
[34] SHEN X L, LI T, LI X H, et al. Dual cryoprotective and antioxidant effects of silver carp (Hypophthalmichthys molitrix) protein hydrolysates on unwashed surimi stored at conventional and ultra-low frozen temperatures[J]. LWT-Food Science and Technology, 2022,153: 112563. DOI:10.1016/j.lwt.2021.112563.
[35] 张昆. 原料肉冻藏时间对烤肉饼中杂环胺和晚期糖基化终末产物形成的影响[D]. 无锡: 江南大学, 2019.
[36] CHENG Y, CHI Y, GENG X H, et al. Effect of 2,2’-azobis(2-amidinopropane) dihydrochloride (AAPH) induced oxidation on the physicochemical properties, in vitro digestibility, and nutritional value of egg white protein[J]. LWT-Food Science and Technology, 2021,143: 111103. DOI:10.1016/j.lwt.2021.111103.