虾青素是一种非VA源的脂溶性酮式类胡萝卜素,它在多种微生物和海洋生物中广泛存在[1],其化学名称为3,3’-二羟基-4,4’-二酮基-β,β’-胡萝卜素,化学式为C40H52O4,结构如图1所示。虾青素的化学结构由一条长链共轭烯烃和2 个末端的酮羟基异戊二烯六元环组成[2],这种独特的结构赋予虾青素活泼的电子效应,从而使其能够有效地猝灭单线态氧和清除自由基,展现出显著的抗氧化活性[3]。众多研究已证实,虾青素具有显著的抗炎[4]、抗肿瘤[5]、改善代谢综合征[6]、增强耐力[7]及防治神经退行性疾病[8]等多种健康功效,使其在食品和医疗领域备受关注[9]。虾青素在肉制品加工领域的应用主要体现在其抗氧化和保鲜性能上[10],也有研究[11]表明,虾青素能促进热风干制虾的香气产生,抑制腥味物质的产生。
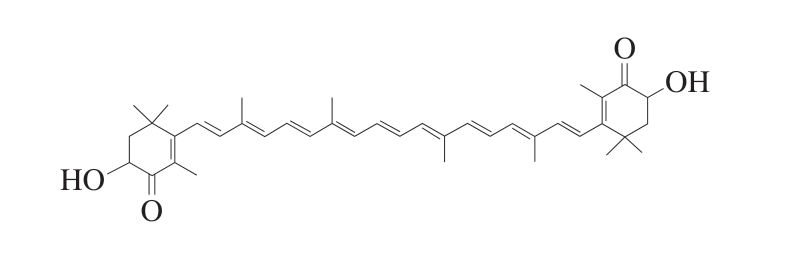
图1 游离态虾青素的分子结构图
Fig. 1 Molecular structure of astaxanthin
然而,虾青素在水中的溶解性较差,且在光照(特别是紫外线)和高温等条件下极易发生氧化降解,这导致其在被吸收前稳定性不足,进而影响了虾青素的生物利用度,严重限制了其在终端产品中的应用潜力[12]。因此,研究如何提高虾青素的生物利用度是发挥其功效的关键。本文聚焦于提升虾青素生物利用度的研究,全面评述虾青素在体内的消化吸收过程及其影响生物利用度的因素。基于这些分析,本文总结目前研究中提出的提高虾青素生物利用度的方法,旨在为富含虾青素的终端产品设计和开发提供理论支持和创新思路。
1 虾青素的消化吸收过程
虾青素在人体内无法自行合成,需要通过膳食摄取。其在人体内能否发挥预期的生理功能,取决于吸收和利用的比例及组织蓄积情况。目前,国内外研究者已对虾青素的吸收代谢机制进行了初步探究。Ambati等[1]指出,虾青素与载体食用油一同摄入可有效提高其吸收率。Østerlie等[13]研究人体口服虾青素及其酯后,虾青素在血清中的存在形态。研究结果表明,游离态虾青素在摄入后会与脂蛋白结合存在于血液中;而摄入虾青素酯后,血液中仅检测到游离态虾青素,未发现酯化态虾青素,并且其在血液中的浓度比摄入相同当量的游离虾青素低4~5 倍。这表明游离态虾青素可被人体直接吸收利用,而酯化态虾青素则需要在消化道内先经过水解过程,转化为游离态虾青素后才能被吸收。周庆新等[14]研究小鼠口服虾青素酯后的消化吸收过程,发现虾青素酯在胃内不发生水解,而是在小肠内被消化酶水解成游离态虾青素;虾青素的主要吸收部位位于小肠,尤其是空肠,同时也有少量在大肠被吸收。Ranga等[15]通过灌胃方式给予大鼠雨生红球藻源虾青素后,虾青素在血浆、肝脏和眼睛中的水平分别在2、4、6 h达到峰值。
基于上述研究成果,可以推测虾青素在体内的消化吸收过程如下:食品中的虾青素经过牙齿咀嚼、胃的蠕动及消化酶的作用逐步释放。释放出的虾青素(无论是游离态还是酯化态)在胃中与脂质混合,并被包裹在脂滴中。进入小肠后,在胰脂肪酶、异构酶等消化酶的作用下,虾青素从脂滴中释放,并且酯化态虾青素同时被水解为游离态。随后,游离态虾青素与体系中的脂肪酸、单酰基甘油酯、磷脂、胆盐等成分共同乳化形成混合胶束;这些混合胶束通过简单扩散、被动扩散或胆固醇转运等方式被小肠上皮细胞吸收。在小肠细胞内,虾青素被包裹在乳糜微粒中进入淋巴系统,随后通过血液循环最终到达肝脏、心脏、脾等靶器官,发挥其生理作用。上述关于虾青素消化吸收过程的示意图如图2所示。
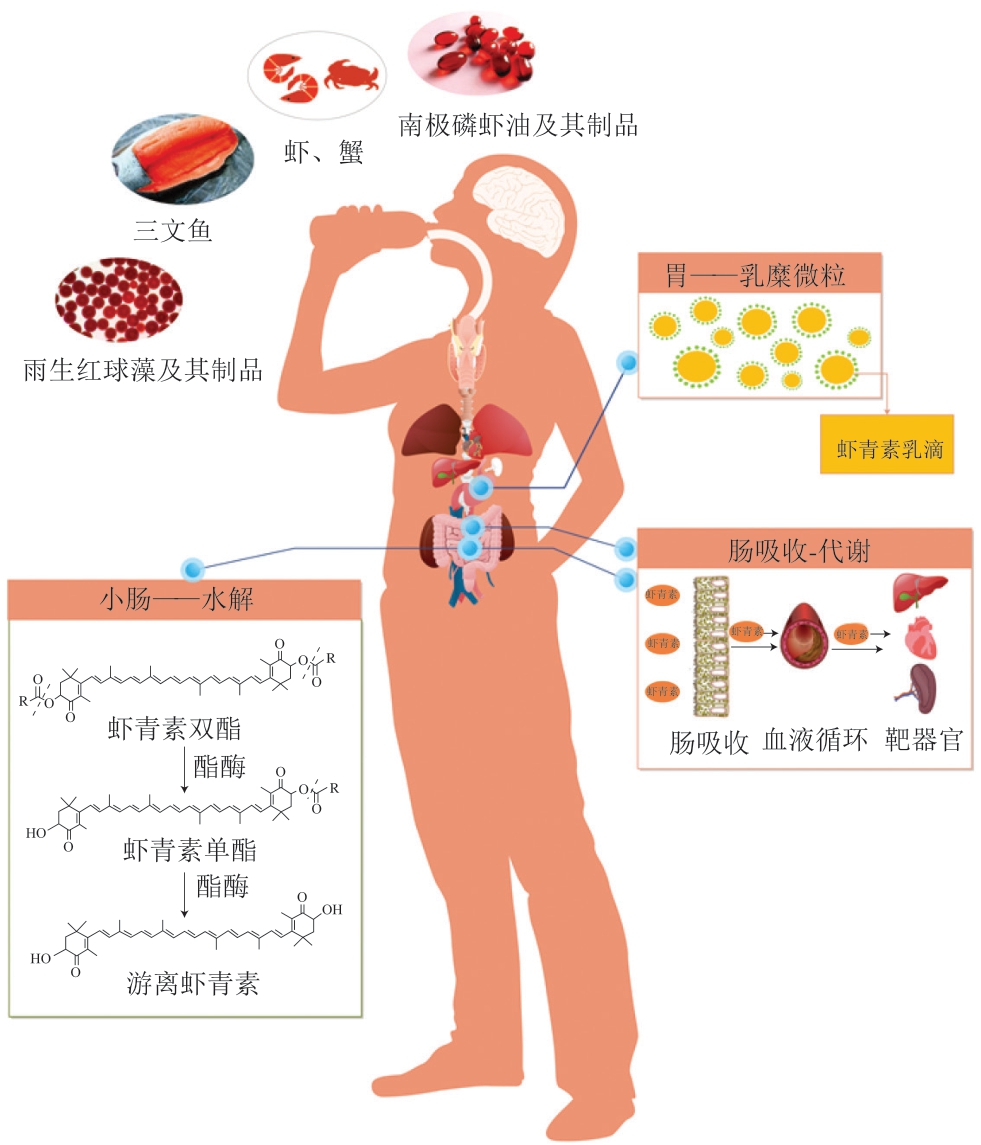
图2 虾青素在体内的消化吸收过程示意图
Fig. 2 Schematic drawing of digestion and absorption process of astaxanthin in vivo
2 影响虾青素生物利用度的因素
2.1 虾青素分子种类的影响
虾青素的分子结构包含11 个共轭双键和2 个β-紫罗兰酮环,赋予其多种几何异构体和旋光异构体,目前发现的主要虾青素异构体如图3所示。研究[16]发现,自然界中虾青素主要以全反式构型存在。然而,在食品加工或贮藏过程中(如加热、高压、光照等)以及受到环境因素(如有机溶剂、金属离子等)的影响,虾青素可能会发生异构化,形成顺式异构体,其中9-顺式和13-顺式异构体较为普遍[17]。进一步研究发现,当人体摄入富含反式虾青素的食物后,血浆中顺式虾青素的比例会增加,而顺式虾青素在生物利用度和细胞分泌率方面表现更佳,这有助于其在人体内的吸收[18]。刘涵等[19]采用体内和体外结合的研究方法,探讨全反式、9-顺式和13-顺式虾青素的抗氧化作用及其对氧化应激损伤的影响。研究结果表明,这3 种几何构型的虾青素均表现出体外抗氧化活性,并对氧化应激损伤具有保护作用,尤其是9-顺式虾青素的活性显著优于全反式和13-顺式虾青素。
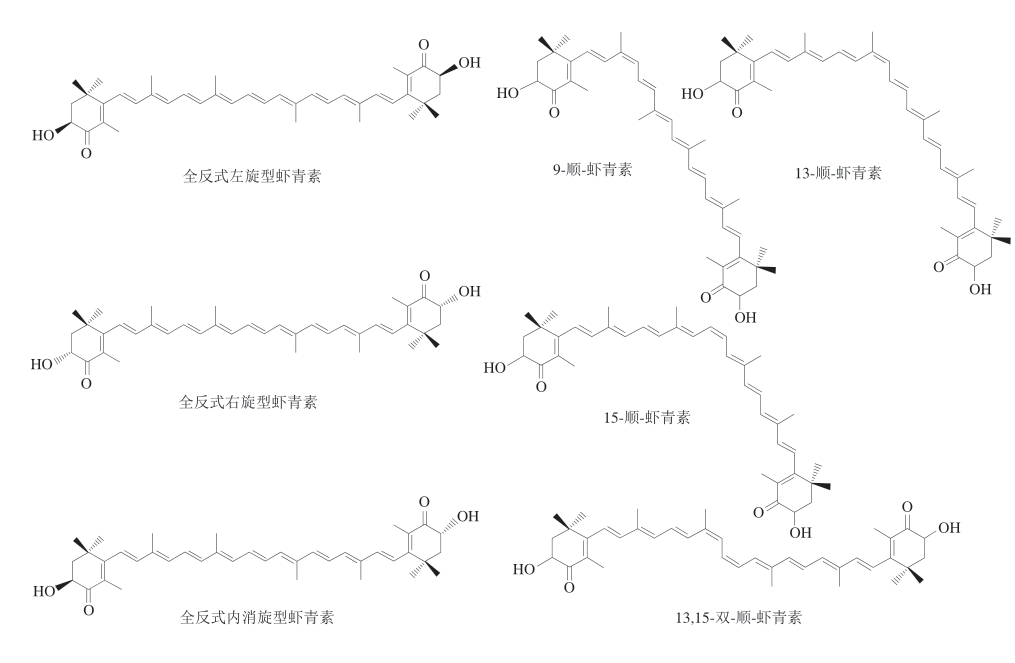
图3 虾青素同分异构体结构图
Fig. 3 Structures of astaxanthin isomers
此外,虾青素两端的环状结构均含有羟基,能够与多种脂肪酸发生酯化反应,形成虾青素单酯或双酯,结构图如图4所示。在自然界中,虾青素主要以酯化态形式存在[20]。Zhou Qingxin等[21]从雨生红球藻中鉴定出20 种不同结构形式的虾青素,包括8 种虾青素单酯(约占总虾青素的85%)和12 种虾青素双酯(约占总虾青素的15%)。与虾青素相连接的脂肪酸多为16 个碳原子及以上的长链不饱和脂肪酸,如C18:1、C18:2、C18:3、C18:4、C16:0、C16:1。周庆新等[22]报道,在南极磷虾油中,酯化态虾青素约占虾青素总量的98.38%,而游离态虾青素仅占1.62%。其中虾青素双酯共鉴定出12 种,总相对含量高达73.5%,虾青素单酯共鉴定出5 种,相对含量为24.88%。从虾青素酯的分子组成来看,在南极磷虾油中与虾青素相连接的脂肪酸主要为C14:0、C16:0、C16:1、C18:1、C20:0、C20:5和C22:6。Zhou Qingxin等[23]研究表明,虾青素酯在Balb/c小鼠体内的生物利用率高于游离虾青素。Yang Lu等[24]研究则显示,虾青素单酯的生物利用度优于虾青素双酯,且虾青素酯的生物利用度与连接的脂肪酸链长度呈负相关,与脂肪酸链的不饱和程度呈正相关。
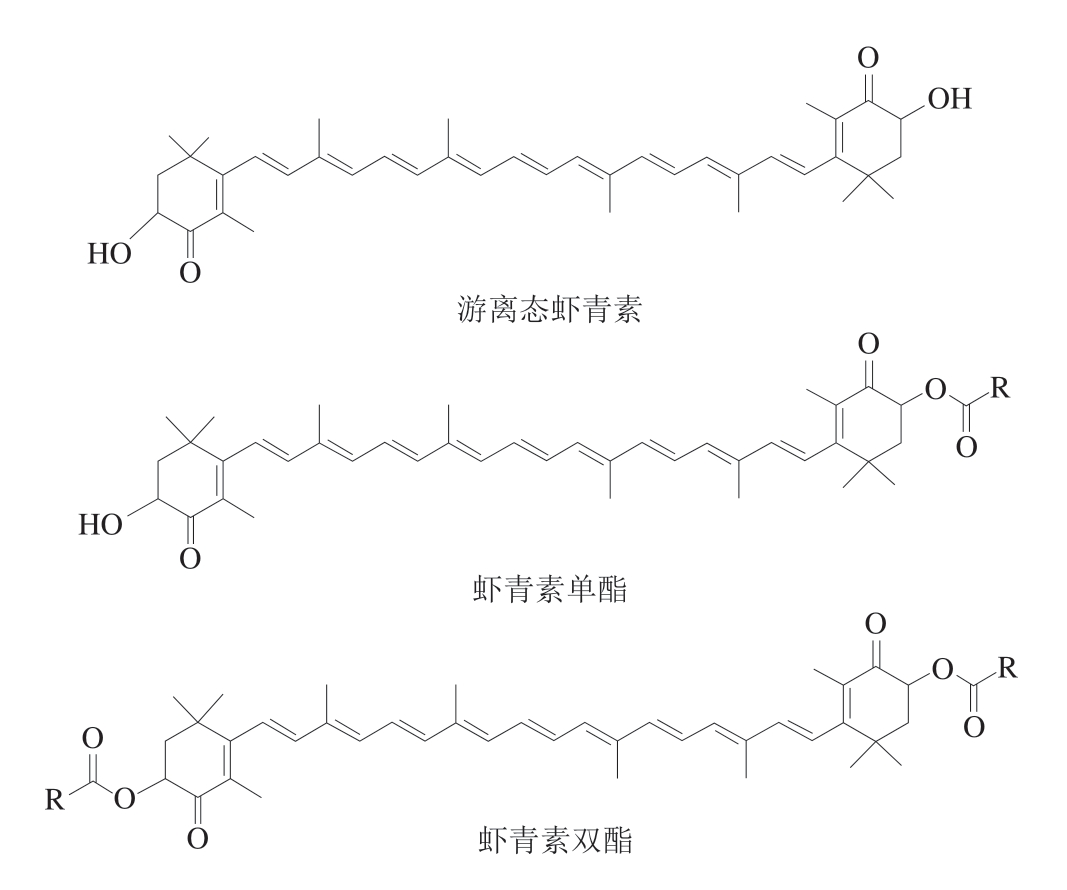
图4 游离态虾青素、虾青素单酯和虾青素双酯的结构图
Fig. 4 Structures of astaxanthin, astaxanthin monoester and astaxanthin diester
2.2 食品组分的影响
虾青素的生物利用度受其所在食品基质及共摄入营养素的影响。Chitchumroonchokchai等[25]利用胃肠消化模型,对野生和养殖鲑鱼的生鱼片与熟鱼片、3 种市售补充剂及磷虾油中的虾青素生物可及性进行研究。研究发现,磷虾油中的虾青素生物可及性最高,达到68%;市售补充剂中虾青素的生物可及性介于41%~67%之间;野生和养殖鲑鱼的生鱼片中,虾青素的生物可及性分别为43%和12%,而烹饪后的熟鱼片中虾青素的生物可及性明显下降。Mimoun-Benarroch等[26]对比研究酵母、藻类、细菌及合成虾青素在Caco-2/TC7结肠细胞中的吸收情况。研究指出,酵母和合成虾青素通过基底外侧膜的转移表现出时间依赖性,培养3、6 h后转移到基底外侧的虾青素量分别为1.10%、2.20%和1.00%、2.54%;细菌来源的虾青素在3、6 h后的转移量分别为1.19%、0.75%;而藻源虾青素在6 h后未被吸收,这可能与不同食品基质来源的虾青素分子结构差异有关。李春君等[27]在小鼠的饮食中加入菊粉、低聚果糖、壳聚糖这3 种不同的益生元,以研究它们对虾青素消化吸收的影响。研究结果表明,菊粉的摄入显著提升了小鼠肝脏中虾青素代谢曲线下面积及粪便中游离虾青素的含量。因此,在饮食中添加菊粉可以适度提高藻源虾青素的生物利用度。Anarjan等[28]以去离子水作为对照组,研究虾青素纳米分散液在橙汁和脱脂牛乳中的稳定性及生物利用度,以评估不同食品体系对虾青素生物利用度的影响。研究结果显示,虾青素纳米分散体在去离子水中的降解率最高,而在橙汁和脱脂牛乳中相对稳定。体外细胞摄取实验表明,脱脂牛乳中虾青素的细胞摄取量远高于橙汁和去离子水,而在橙汁中虾青素的细胞摄取量有所降低。蛋白质和脂肪的摄入对类胡萝卜素的生物利用度有正面影响,而橙汁较低的pH值会导致纳米分散体的粒径略有增加,这可能是这些系统中虾青素生物利用度降低的原因。
2.3 受试者的影响
类胡萝卜素的生物利用度在很大程度上受受试者相关因素的影响,这些因素包括受试者的生理因素、肠道菌群、肥胖、吸烟和饮酒等[29]。Okada等[30]对吸烟者与非吸烟者进行研究,旨在探讨饭前与饭后服用红球藻提取物后,虾青素药代动力学的差异。血清分析结果显示,给药时间对虾青素的生物利用度有显著影响,餐后给药组显示出更高的生物利用度。此外,吸烟同样会影响药代动力学参数,并显著缩短虾青素的消除半衰期。Gao Yuan等[31]通过小鼠喂养实验研究正常体脂与肥胖状态下虾青素吸收的差异。研究结果表明,肥胖状态显著降低了血液和肝脏中虾青素的浓度,减少了其在组织和器官中的积累,降低了生物利用度。这一现象可能与过量摄入蔗糖、脂肪酸和胆固醇、胃肠道动力的增强及肥胖个体肠道微生物群的紊乱有关。Li Chunjun等[32]为探究受试小鼠肠道微生物群与虾青素吸收之间的关系,使用抗生素干预小鼠以减少肠道菌数量。与未干预组相比,抗生素干预组的小鼠粪便中虾青素的排出时间明显延长,粪便中游离虾青素的含量降低,这表明结肠和肠道微生物群在很大程度上影响了小鼠对虾青素的吸收。肠道微生物群可能通过上调B族I型清道夫受体基因SR-BI的表达,促进虾青素转化为游离虾青素和Z-虾青素,从而增加虾青素的吸收。
2.4 加工方式的影响
热处理、光照、酸度等因素均可导致类胡萝卜素物质分子的降解和损失[33],因此传统的食品加工方法可能会显著影响虾青素的生物利用度。Choubert等[34]的研究表明,虹鳟鱼片在干燥加热过程中,虾青素的损失率相较于湿热加热更为严重。Chitchumroonchokchai等[25]进一步研究不同食品加工方式对虾青素生物利用度的影响,分别采用煎(350~375 ℃、7 min)、蒸(212 ℃、10 min)、烤(350 ℃、45 min和375 ℃、10 min)的方式对鲑鱼进行处理。研究结果显示,野生鲑鱼经烹饪后,虾青素的生物利用度明显降低,而养殖鲑鱼中虾青素的生物利用度变化较小。在野生鲑鱼中,采用煎的烹饪方式能够保持较高的虾青素生物利用度,而使用350 ℃烘烤45 min处理时,虾青素的生物利用度明显降低。
雨生红球藻作为一种优质的天然虾青素来源,其细胞壁的刚性结构限制了虾青素的释放。张晔[35]采用高压均质、离子液体、酶处理及盐酸浸泡4 种破壁技术,对雨生红球藻中的虾青素进行有效提取。通过CCK-8实验评估这些方法提取的虾青素对HepG2肝癌细胞增殖的抑制效果。结果表明,这4 种处理方法提取的虾青素均展现出显著的抗癌细胞增殖活性,其抑制效果由高到低依次为离子液体处理、酶处理、盐酸浸泡处理、高压均质处理。此外,薄层色谱分析显示,不同破壁技术提取的虾青素在组成和比例上存在差异,这可能是导致其生物活性差异的重要原因。
3 提高虾青素生物利用度的方法
虾青素分子的高不饱和性及共轭双键结构使其对温度、光照和氧气极为敏感,容易在加工过程中降解并产生不良气味[36-37]。同时,虾青素的高亲脂性导致其水溶性差,这进一步影响了其生物利用度。这些特性极大限制了虾青素在以水为主要分散介质的食品系统中的应用[38-39]。因此,为了确保虾青素在食品中的应用效果,必须采取有效的保护措施,以防止其在加工和贮藏过程中遭受破坏。
3.1 构建虾青素运载体系
虾青素运载体系是近年来备受关注的高新技术领域之一。该技术通过将虾青素嵌入运载体系的结构中,例如乳液、纳米乳液、非水乳液、微胶囊、纳米粒子、微球和脂质体等,能够显著提升虾青素的稳定性,并精确调控其释放速率及在生物体内的特定释放位置[40-41]。这不仅影响了虾青素的生物利用度,还为虾青素终端产品的开发与应用提供了多样化选择[42]。表1概述了目前关于典型运载体系对虾青素生物利用度影响的研究情况。
表1 不同运载体系对虾青素生物利用度的影响
Table 1 Effects of different delivery systems on astaxanthin bioavailability

运载体系制备工艺对虾青素生物利用度的影响参考文献乳清分离蛋白-黄原胶乳液体系在体外消化过程中,与单独使用乳清分离蛋白的乳液相比,虾青素的消化率降低12.6%[43]乳液大豆油-虾青素油剂、大豆油-虾青素乳液虾青素乳剂表现出比油剂更好的抗肥胖特性[44]淀粉基虾青素双乳液显著提高了虾青素的稳定性及生物利用度,同时实现了虾青素的可控释[45]虾青素-壳聚糖-银耳多糖乳液壳聚糖和银耳多糖的添加提高了虾青素乳液的释放效率和生物利用度[46]非水乳液大豆磷脂-辛,癸酸甘油酯-虾青素非水纳米乳液非水纳米乳液中虾青素进入和通过皮肤的渗透效率均高于虾青素乙醇溶液[47]明胶-海藻酸钠-乳化剂(大豆磷脂)-虾青素油微胶囊生物利用度约为虾青素油的1.29 倍[48]微胶囊海藻酸钠-乳酸钙凝-虾青素微胶囊虾青素微胶囊对脂肪干细胞表现出明显的抑制作用,而游离虾青素没有抑制活性[49]5 种蛋白质为壁材的虾青素微胶囊5 种微胶囊均提高了虾青素的生物利用度[50]以酪蛋白酸钠和κ-卡拉胶为壁材的虾青素微胶囊虾青素在肠道溶出率达90%以上,生物可及性提高约1 倍[51]马铃薯-虾青素纳米颗粒经模拟胃肠道消化后,纳米颗粒的生物可及性达80%,未封装的虾青素仅为7%[52]纳米颗粒花椰菜胞外囊泡包裹的聚乳酸-羟基乙酸虾青素纳米颗粒体外抗癌活性比虾青素更显著[53]β-环糊精-虾青素纳米颗粒细胞摄取效率比游离态虾青素高35 倍[54]VC-VE-虾青素纳米颗粒显著提高了虾青素的口服生物利用度,相比结晶态虾青素,其在大鼠血浆中的浓度显著升高[55]
续表1

运载体系制备工艺对虾青素生物利用度的影响参考文献海藻酸钙微球在碱性溶液中释放率(接近50%)显著高于酸性溶液(小于10%)[56]微球羧甲基壳聚糖微球微球在胃液中3 h释放率为10%,而在肠液中1.5 h释放率为85%[57]海藻酸钠微球减轻右旋糖酐硫酸钠诱导的结肠炎,且效果优于乳清蛋白虾青素乳液[58]大豆磷脂酰胆碱-虾青素脂质体虾青素的热稳定性、水溶性明显提高,体外释放明显减慢[59]脂质体乳清分离蛋白包被虾青素脂质体生物利用度为(58.88±2.10)%,未被包被的虾青素脂质体生物利用度为(33.91±1.50)%[60]磷脂胆酰碱-虾青素脂质体比游离虾青素具有更好的抗皮炎作用[61]植物甾醇油酸酯-虾青素磷脂脂质体在肠液中的累计释放率高于游离态虾青素,口服生物利用度更好[62]
3.2 构建共消化体系
虾青素在胃肠道液体中的溶解度有限,且在高剂量下,胆汁胶束的吸收能力易达到饱和状态,这限制了其生物利用度[63]。然而,油脂作为食品体系的关键成分,能够通过多种机制促进虾青素的吸收[29]:首先,油脂提供了一个疏水环境,有助于虾青素从食物基质中释放出来;其次,油脂能刺激胆汁分泌,促进胶束的形成,从而增加虾青素的溶解度;第三,油脂还能促进乳糜微粒的分泌,甘油三酯有助于增加肠细胞外类胡萝卜素物质的分泌,防止其在细胞内积聚,并提高其吸收效率。因此,虾青素与油脂共消化可显著提高其生物利用度。
在构建虾青素与油脂共消化体系的研究中发现,虾青素的摄入量和油脂的种类及添加量对其生物利用度有显著影响。Liu Xiaojuan等[64]利用模拟胃肠道模型评估3 种长链甘油三酯油(亚麻籽油、橄榄油和玉米油)对水包油纳米乳剂中虾青素生物利用情况的影响。结果显示,这3 种纳米乳剂均可显著改善虾青素的生物利用度,且不同油脂对虾青素生物利用度的影响存在差异,具体表现为橄榄油>亚麻籽油>玉米油。Yang Lu等[65]探讨具有不同饱和度(玉米油、鱼油、橄榄油)和不同链长(丁酸甘油三酯、辛酸甘油三酯、油酸甘油三酯)的载体油对虾青素稳定性、抗氧化活性、生物可及性及生物利用度的影响。研究发现,随着载体油脂肪酸链长度的增加(油酸甘油三酯>辛酸甘油三酯>丁酸甘油三酯)及不饱和度的降低(橄榄油>玉米油>鱼油),虾青素酯的生物利用度也随之提高。油脂添加量也影响到虾青素的生物利用度,Xu Yuan等[66]研究发现,随着虾青素乳液中油相比例的增加,虾青素的生物可及性降低。其中,含10%油相的乳液稳定性最佳,虾青素保留率较高,生物可及性达到11.66%。Odeberg等[67]进一步通过人体试验证实油脂的加入对虾青素生物利用度的促进作用。在这项针对32 名健康男性的研究中,比较单独服用40 mg虾青素商业食品补充剂与不同脂基配方(配方A:长链甘油三酯、吐温-80;配方B:单/双油酸甘油酯和吐温-80;配方C:单/双油酸甘油酯、吐温-80、山梨醇单油酸酯)对虾青素生物利用度的影响。结果显示,3 种基于脂质的制剂均显著提高了虾青素的生物利用度,其中配方B中使用的2 种表面活性剂(单/双油酸甘油酯、吐温-80)的协同作用使得生物利用度提高3.7 倍。上述研究的相关情况总结如表2所示。
表2 不同油脂种类对虾青素生物利用度的影响
Table 2 Effect of different oil types on the bioavailability of astaxanthin

注:生物可及性是指食物中的虾青素或其他营养成分在通过消化过程后能够从食物基质中释放出来的程度,并且能够达到小肠吸收部位的能力。生物利用度是指虾青素被小肠吸收进入血液循环,并输送到身体其他部位被利用的程度。生物可及性是生物利用度的前提,只有当虾青素从食物中释放出来,才有可能被进一步吸收和利用。高生物可及性通常意味着有更高的潜在生物利用度,两者均旨在评估虾青素在人体内的有效性和营养价值。
油脂种类虾青素剂量评价模型生物利用情况参考文献评估指标对照组添加油脂后橄榄油亚麻籽油玉米油质量分数0.005%体外消化模型生物可及性6.5%68.4%53.2%47.9%[64]玉米油鱼油橄榄油丁酸甘油三酯辛酸甘油三酯油酸甘油三酯质量分数0.2%体外消化模型生物可及性(19.10±2.34)%(41.5±4.1)%(37.6±3.8)%(54.3±4.2)%(56.98±4.1)%(62.57±5.1)%(74.39±6.8)%[65]10 mg/kg mb Balb/c小鼠实验生物利用度该研究考察了不同油脂对虾青素生物利用度的影响,未设虾青素制剂的实验组(1.96±0.11)h·μg/mL(0.76±0.06)h·μg/mL(2.36±0.14)h·μg/mL(0.52±0.06)h·μg/mL(0.66±0.08)h·μg/mL(1.97±0.11)h·μg/mL 10%油相20%油相30%油相40%油相0.5 mg/mL体外消化模型生物可及性该研究考察了不同油相含量对虾青素乳液生物利用度的影响,未设虾青素制剂的实验组11.66%8.23%5.14%3.25%[66]长链甘油三酯+吐温-80单/双油酸甘油酯+吐温-80单/双油酸甘油酯+吐温-80+山梨醇单油酸酯(单剂量)人体试验生物利用度40 mg (1.35±0.50)h·μg/mL(2.22±0.57)h·μg/mL(4.96±0.15)h·μg/mL(2.58±0.85)h·μg/mL[67]
4 结语
虾青素作为一种功能强大的营养补充剂,受到消费者的广泛喜爱。为了提升其稳定性和生物利用度,并实现有效的控释与转运,构建一个合适的运载体系显得尤为关键。然而,目前的运载体系存在不少问题:例如,乳液体系的液态形式在实际生产中受到限制;纳米分散体系在制备过程中使用的有机溶剂可能对人体健康造成负面影响;脂质体运载体系对于高血脂和肥胖人群并不适宜;并且,现有体系难以有效解决虾青素的不良气味问题。此外,制备虾青素运载体系通常需要借助外力,如高压均质、超声波、喷雾干燥、冷冻干燥等技术,这不仅提高了生产成本,还可能对虾青素的质量产生不良影响。因此,未来的研究方向应聚焦于不同运载系统的协同作用,开发载量高、稳定性强的虾青素运载体系,这对拓宽虾青素的产品应用领域和产业的发展意义重大。
[1] AMBATI R R, PHANG S M, RAVI S, et al. Astaxanthin: sources,extraction, stability, biological activities and its commercial applications: a review[J]. Marine Drugs, 2014, 12(1): 128-152.DOI:10.3390/md12010128.
[2] WANG Y Y, CHEN L P, ZHAO J R, et al. Astaxanthin esters as functional food: a review of their nutrition, phytochemical structure, biological features, and food industry prospects[J]. Journal of Agricultural and Food Chemistry, 2024, 72: 13467-13475.DOI:10.1021/acs.jafc.4c00765.
[3] SHIVANI, NISHANT T, GOPAL V L, et al. Natural origins,bioavailability, and therapeutic potential of astaxanthin: a systematic review across diverse health applications[J]. African Journal of Biomedical Research, 2024, 27(3s): 5929-5939. DOI:10.53555/ajbr.v27i3s.3453.
[4] WU Y H, BASHIR M A, SHAO C S, et al. Astaxanthin targets IL-6 and alleviates the LPS-induced adverse inflammatory response of macrophages[J]. Food & Function, 2024, 15(8): 4207-4222.DOI:10.1039/d4fo00610k.
[5] SAFAHI S E, LOTFABADI N N. Astaxanthin and cancer: a comprehensive review of research[J]. International Journal of New Findings in Health and Educational Sciences, 2024, 2(2): 154-167.DOI:10.63053/ijhes.82.
[6] GAO C H, GONG N Y, CHEN F T, et al. The effects of astaxanthin on metabolic syndrome: a comprehensive review[J]. Marine Drugs, 2024,23(1): 9. DOI:10.3390/md23010009.
[7] WALDMAN H. Astaxanthin supplementation as a potential strategy for enhancing mitochondrial adaptations in the endurance athlete:an invited review[J]. Nutrients, 2024, 16(11): 1750. DOI:10.3390/nu16111750.
[8] ADIGÜZEL E, ÜLGER T G. A marine-derived antioxidant astaxanthin as a potential neuroprotective and neurotherapeutic agent: a review of its efficacy on neurodegenerative conditions[J].European Journal of Pharmacology, 2024, 977: 176706. DOI:10.1016/j.ejphar.2024.176706.
[9] DANG Y M, LI Z X, YU F Q H. Recent advances in astaxanthin as an antioxidant in food applications[J]. Antioxidants, 2024, 13(7): 879.DOI:10.3390/antiox13070879.
[10] 孟庆, 孙亚楠. 生姜提取物/虾青素复配液对冷鲜牛肉保鲜效果的影响[J]. 中国食品添加剂, 2022, 33(6): 115-121. DOI:10.19804/j.issn1006-2513.2022.06.016.
[11] 周莹. 虾青素提取纯化及其形成热风干制凡纳滨对虾挥发性成分的特性[D]. 湛江: 广东海洋大学, 2023: 28-53. DOI:10.27788/d.cnki.ggdhy.2023.000055.
[12] MARTINEZ-DELGADO A A, KHANDUAL S, VILLANUEVARODRIGUEZ S J. Chemical stability of astaxanthin integrated into a food matrix: effects of food processing and methods for preservation[J]. Food Chemistry, 2017, 225: 23-30. DOI:10.1016/j.foodchem.2016.11.092.
[13] ØSTERLIE M, BJERKENG B, LIAAEN-JENSEN S. Plasma appearance and distribution of astaxanthin E/Z and R/S isomers in plasma lipoproteins of men after single dose administration of astaxanthin[J]. The Journal of Nutritional Biochemistry, 2000, 11(10):482-490. DOI:10.1016/S0955-2863(00)00104-2.
[14] 周庆新, 杨鲁, 徐杰. 雨生红球藻源虾青素酯的消化吸收特性研究[J]. 中国食品学报, 2019, 19(4): 125-132. DOI:10.16429/j.1009-7848.2019.04.015.
[15] RANGA R A, RAGHUNATH REDDY R L, BASKARAN V, et al.Characterization of microalgal carotenoids by mass spectrometry and their bioavailability and antioxidant properties elucidated in rat model[J]. Journal of Agricultural and Food Chemistry, 2010, 58(15):8553-8559. DOI:10.1021/jf101187k.
[16] LIU X J, XIE J T, ZHOU L, et al. Recent advances in health benefits and bioavailability of dietary astaxanthin and its isomers[J]. Food Chemistry, 2023, 404: 134605. DOI:10.1016/j.foodchem.2022.134605
[17] DE BRUIJN W J C, WEESEPOEL Y, VINCKEN J P, et al.Fatty acids attached to all-trans-astaxanthin alter its cis-trans equilibrium, and consequently its stability, upon light-accelerated autoxidation[J]. Food Chemistry, 2016, 194: 1108-1115. DOI:10.1016/j.foodchem.2015.08.077.
[18] 杨成. 含氧类胡萝卜素异构体的制备纯化,吸收代谢及对肠道功能的影响[D]. 无锡: 江南大学, 2018: 31-56.
[19] 刘涵, 陈晓枫, 刘晓娟, 等. 不同几何构型虾青素的体外抗氧化作用及对秀丽隐杆线虫氧化应激的保护作用[J]. 食品科学, 2019, 40(3):178-185. DOI:10.7506/spkx1002-6630-20171010-056.
[20] ANEESH P A, AJEESHKUMAR K K, LEKSHMI R G K, et al.Bioactivities of astaxanthin from natural sources, augmenting its biomedical potential: a review[J]. Trends in Food Science &Technology, 2022, 125: 81-90. DOI:10.1016/j.tifs.2022.05.004.
[21] ZHOU Q X, XU J, YANG S, et al. The effect of various antioxidants on the degradation of O/W microemulsions containing esterified astaxanthins from Haematococcus pluvialis[J]. Journal of Oleo Science, 2015, 64(5): 515-525. DOI:10.5650/jos.ess14264.
[22] 周庆新, 黄子倩, 谷彩霞, 等. 南极磷虾油中虾青素分子种组成及其消化吸收特性研究[J]. 食品工业科技, 2021, 42(12): 347-353.DOI:10.13386/j.issn1002-0306.2020090089.
[23] ZHOU Q X, XU J, YANG L, et al. Thermal stability and oral absorbability of astaxanthin esters from Haematococcus pluvialis in Balb/c mice[J]. Journal of the Science of Food & Agriculture, 2019,99(7): 3662-3671. DOI:10.1002/jsfa.9588.
[24] YANG L, QIAO X, GU J Y, et al. Influence of molecular structure of astaxanthin esters on their stability and bioavailability[J]. Food Chemistry, 2020, 343(3): 128497. DOI:10.1002/jsfa.9588.
[25] CHITCHUMROONCHOKCHAI C, FAILLA M L. Bioaccessibility and intestinal cell uptake of astaxanthin from salmon and commercial supplements[J]. Food Research International, 2017, 99: 936-943.DOI:10.1016/j.foodres.2016.10.010.
[26] MIMOUN-BENARROCH M, HUGOT C, RHAZI L, et al. The bioavailability of astaxanthin is dependent on both the source and the isomeric variants of the molecule[J]. Bulletin of University of Agricultural Sciences and Veterinary Medicine Cluj-Napoca:Food Science and Technology, 2016, 73(2): 61-69. DOI:10.15835/buasvmcn-fst:12350.
[27] 李春君, 高远, 郇宇晨, 等. 添加菊粉改善藻源虾青素在机体的生物利用度[J]. 现代食品科技, 2022, 38(9): 18-26. DOI:10.13982/j.mfst.1673-9078.2022.9.1254.
[28] ANARJAN N, TAN C P. Chemical stability of astaxanthin nanodispersions in orange juice and skimmed milk as model food systems[J]. Food Chemistry, 2013, 139(1/4): 527-531. DOI:10.1016/j.foodchem.2013.01.012.
[29] DESMARCHELIER C, BOREL P. Overview of carotenoid bioavailability determinants: from dietary factors to host genetic variations[J]. Trends in Food Science & Technology, 2017, 69: 270-280. DOI:10.1016/j.tifs.2017.03.002.
[30] OKADA Y, ISHIKURA M, MAOKA T. Bioavailability of astaxanthin in Haematococcus algal extract: the effects of timing of diet and smoking habits[J]. Bioscience, Biotechnology, and Biochemistry,2009, 73(9): 1928-1932. DOI:10.1271/bbb.90078.
[31] GAO Y, YUAN S H, ZHANG L R, et al. Absorbability of astaxanthin was much lower in obese mice than in normal mice[J]. Journal of Agricultural and Food Chemistry, 2020, 68(40): 11161-11169.DOI:10.1021/acs.jafc.0c03486.
[32] LI C J, GAO Y, HUAN Y C, et al. Colon and gut microbiota greatly affect the absorption and utilization of astaxanthin derived from Haematococcus pluvialis[J]. Food Research International, 2022, 156:111324. DOI:10.1016/j.foodres.2022.111324.
[33] 易建勇, 侯春辉, 毕金峰, 等. 果蔬食品中类胡萝卜素生物利用度研究进展[J]. 中国食品学报, 2019, 19(9): 286-297. DOI:10.16429/j.1009-7848.2019.09.034.
[34] CHOUBERT G, BACCAUNAUD M. Effect of moist or dry heat cooking procedures on carotenoid retention and colour of fillets of rainbow trout (Oncorhynchus mykiss) fed astaxanthin or canthaxanthin[J]. Food Chemistry, 2010, 119(1): 265-269.DOI:10.1016/j.foodchem.2009.06.023.
[35] 张晔. 不同破壁方法对雨生红球藻虾青素的提取及活性的影响[D]. 长沙: 湖南农业大学, 2020: 44-57. DOI:10.27136/d.cnki.ghunu.2020.000457.
[36] SHRESTHA S, SADIQ M B, ANAL A K. Culled banana resistant starch-soy protein isolate conjugate based emulsion enriched with astaxanthin to enhance its stability[J]. International Journal of Biological Macromolecules, 2018, 120: 449-459. DOI:10.1016/j.ijbiomac.2018.08.066.
[37] FAKHRI S, ABBASZADEH F, DARGAHI L, et al. Astaxanthin:a mechanistic review on its biological activities and health benefits[J]. Pharmacological Research: the Official Journal of the Italian Pharmacological Society, 2018, 136: 1-20. DOI:10.1016/j.phrs.2018.08.012.
[38] KHALID N, SHU G, HOLLAND B J, et al. Formulation and characterization of O/W nanoemulsions encapsulating high concentration of astaxanthin[J]. Food Research International, 2017,102: 364-371. DOI:10.1016/j.foodres.2017.06.019.
[39] XIA Z Y, HAN Y H, DU H J, et al. Exploring the effects of carrier oil type on in vitro bioavailability of β-carotene: a cell culture study of carotenoid-enriched nanoemulsions[J]. LWT-Food Science and Technology, 2020, 134(4): 110224. DOI:10.1016/j.lwt.2020.110224.
[40] ZHANG J, LIU M Z, HAN T T, et al. Advance toward function,production, and delivery of natural astaxanthin: a promising candidate for food ingredients with future perspectives[J]. Food Chemistry, 2024,463: 141428. DOI:10.1016/j.foodchem.2024.141428.
[41] RIVERA-HERNÁNDEZ G, ROETHER J A, AQUINO C, et al.Delivery systems for astaxanthin: a review on approaches for in situ dosage in the treatment of inflammation associated diseases[J].International Journal of Pharmaceutics, 2025, 669: 125017.DOI:10.1016/j.ijpharm.2024.125017.
[42] WANG F Q J, ZENG J H, LIN L L, et al. Co-delivery of astaxanthin using positive synergistic effect from biomaterials: from structural design to functional regulation[J]. Food Chemistry, 2024, 470: 142731.DOI:10.1016/j.foodchem.2024.142731.
[43] BOONLAO N, SHRESTHA S, SADIQ M B, et al. Influence of whey protein-xanthan gum stabilized emulsion on stability and in vitro digestibility of encapsulated astaxanthin[J]. Journal of Food Engineering, 2020, 272: 109859. DOI:10.1016/j.jfoodeng.2019.109859.
[44] GAO Y, YUAN S Y, CHEN Y Z, et al. The improvement effect of astaxanthin-loaded emulsions on obesity is better than that of astaxanthin in the oil phase[J]. Food & Function, 2022, 13(6): 3720-3731. DOI:10.1039/D1FO03185F.
[45] YANG J, ZHOU Q W, HUANG Z H, et al. Mechanisms of in vitro controlled release of astaxanthin from starch-based double emulsion carriers[J]. Food Hydrocolloids, 2021, 119: 106837. DOI:10.1016/j.foodhyd.2021.106837.
[46] GE Y B, JIANG X J, PENG W B, et al. Preparation, characterization,and stability of chitosan-tremella polysaccharide layer-bylayer encapsulated astaxanthin nanoemulsion delivery system[J].International Journal of Biological Macromolecules, 2024, 282:136741. DOI:10.1016/j.ijbiomac.2024.136741.
[47] SUN R, XIA N, XIA Q. Non-aqueous nanoemulsions as a new strategy for topical application of astaxanthin[J]. Journal of Dispersion Science and Technology, 2019, 41: 1-12. DOI:10.1080/01932691.2019.1635027.
[48] LI R L, CHEN R C, LIU W W, et al. Preparation of enteric-coated microcapsules of astaxanthin oleoresin by complex coacervation[J].Pharmaceutical Development and Technology, 2018, 23(7): 674-681.DOI:10.1080/10837450.2016.1238483.
[49] ZHANG X, YIN W, QI Y, et al. Microencapsulation of astaxanthin in alginate using modified emulsion technology: preparation,characterization, and cytostatic activity[J]. The Canadian Journal of Chemical Engineering, 2017, 95(3): 412-419. DOI:10.1002/cjce.22712.
[50] YANG L, LI F, CAO X Y, et al. Stability and bioavailability of protein matrix-encapsulated astaxanthin ester microcapsules[J]. Journal of the Science of Food and Agriculture, 2022, 102(5): 2144-2152.DOI:10.1002/jsfa.11556.
[51] HUNG J, FENG X, ZHANG S, et al. Preparation and characterization of astaxanthin-loaded microcapsules and its application in effervescent tablets[J]. Journal of the Science of Food and Agriculture, 2023,103(3): 1421-1431. DOI:10.1002/jsfa.12237.
[52] EDELMAN R, ENGELBERG S, FAHOUM L, et al. Potato proteinbased carriers for enhancing bioavailability of astaxanthin[J]. Food Hydrocolloids, 2019, 96: 72-80. DOI:10.1016/j.foodhyd.2019.04.058.
[53] LI C M, SONG Q, YIN X L, et al. Preparation, characterization, and in vitro anticancer activity evaluation of broccoli-derived extracellular vesicle-coated astaxanthin nanoparticles[J]. Molecules, 2022, 27(12):3955. DOI:10.3390/molecules27123955.
[54] OANH H T, HIEN H T M, VAN TRU N, et al. Fabrication of astaxanthin-loaded nanoparticles and their neuroprotective effects on C6 cell lines[J]. Vietnam Journal of Chemistry, 2024, 62(S1): 130-138.DOI:10.1002/vjch.202300299.
[55] GHOSH A, BANIK S, YAMADA K, et al. Stabilized astaxanthin nanoparticles developed using flash nanoprecipitation to improve oral bioavailability and hepatoprotective effects[J]. Pharmaceutics, 2023,15(11): 2562. DOI:10.3390/pharmaceutics15112562
[56] ZHANG X J, LI W J, DOU X, et al. Astaxanthin encapsulated in biodegradable calcium alginate microspheres for the treatment of hepatocellular carcinoma in vitro[J]. Applied Biochemistry and Biotechnology, 2020, 191(2): 511-527. DOI:10.1007/s12010-019-03174-z.
[57] 窦翔, 王政武, 贺高红, 等. pH响应虾青素羧甲基壳聚糖微球的制备与应用[J]. 精细化工, 2021, 38(8): 1559-1563. DOI:10.13550/j.jxhg.20210188.
[58] ZHANG C X, XU Y X, WU S, et al. Fabrication of astaxanthinenriched colon-targeted alginate microspheres and its beneficial effect on dextran sulfate sodium-induced ulcerative colitis in mice[J].International Journal of Biological Macromolecules, 2022, 205: 396-409. DOI:10.1016/S0141-8130(22)00293-8.
[59] PAN L, WANG H Y, GU K R. Nanoliposomes as vehicles for astaxanthin: characterization, in vitro release evaluation and structure[J]. Molecules, 2018, 23(11): 2822. DOI:10.3390/molecules23112822.
[60] PAN L, LI H, HOU L F, et al. Gastrointestinal digestive fate of whey protein isolate coated liposomes loading astaxanthin: lipolysis,release, and bioaccessibility[J]. Food Bioscience, 2022, 45: 101464.DOI:10.2139/ssrn.3932093.
[61] LEE Y S, JEONS H, HQM H J, et al. Improved anti-inflammatory effects of liposomal astaxanthin on a phthalic anhydride-induced atopic dermatitis model[J]. Frontiers in Immunology, 2020, 11: 565285.DOI:10.3389/fimmu.2020.565285.
[62] ZHONG C, LIU T H, DIAO J, et al. Preparation and characterization of astaxanthin-loaded liposomes by phytosterol oleate instead of cholesterol[J]. Food Chemistry, 2025, 462: 141008. DOI:10.1016/j.foodchem.2024.141008.
[63] PARKER R S. Absorption, metabolism, and transport of carotenoids[J].The FASEB Journal, 1996, 10(5): 542-551. DOI:10.1096/fasebj.10.5.8621054.
[64] LIU X J, ZHANG R J, MCLEMENTS D J, et al. Nanoemulsion-based delivery systems for nutraceuticals: influence of long-chain triglyceride(LCT) type on in vitro digestion and astaxanthin bioaccessibility[J].Food Biophysics, 2018, 13(4): 412-421. DOI:10.1007/s11483-018-9547-2.
[65] YANG L, GU J Y, LUAN T L, et al. Influence of oil matrixes on stability, antioxidant activity, bioaccessibility and bioavailability of astaxanthin ester[J]. Journal of the Science of Food and Agriculture,2021, 101(4): 1609-1617. DOI:10.1002/jsfa.10780.
[66] XU Y, GU Y, SUN L P, et al. Stability and in vitro digestion behavior of astaxanthin-loaded Pickering emulsions stabilized by OSAmodified starch: influence of oil phase content[J]. International Journal of Biological Macromolecules, 2025, 288: 138770. DOI:10.1016/j.ijbiomac.2024.138770.
[67] ODEBERG J M, LIGNELL A, PETTERSSON A, et al. Oral bioavailability of the antioxidant astaxanthin in humans is enhanced by incorporation of lipid based formulations[J]. European Journal of Pharmaceutical Sciences, 2003, 19(4): 299-304. DOI:10.1016/S0928-0987(03)00135-0.