肉糜制品因其营养均衡、口感独特深受消费者喜爱[1-3]。但在贮藏期间易受到氧化影响,导致其品质难以保持[4-6]。氧化对肉制品的品质具有直接影响,特别是肌原纤维蛋白(myofibrillar protein,MP)的氧化[7-8]。MP结构的变化与肉质的硬度、弹性、咀嚼性和内聚性密切相关[9],Zhao Shengming等[10]研究表明,当蛋白质受到氧化时,巯基和羰基的含量发生显著变化,并伴随肽链断裂、氨基酸残基的氧化,导致蛋白质的交联聚集,蛋白的氧化直接影响口感,使肉糜制品嫰度下降,弹性减弱。
发酵乳杆菌(Lactobacillus fermentum)是一种常见的益生菌,广泛应用于食品发酵,具有良好的益生特性和安全性。后生元是指无生命的益生菌及其代谢产物[11],通常通过热处理、高压或超声等手段灭活益生菌,使细胞裂解并释放内容物,如短链脂肪酸、胞外多糖、磷壁酸、多肽等活性成分[12]。与益生菌相比,后生元更具稳定性,不受贮藏和加工条件的影响,同时也避免了活菌在体内定植的风险[13]。后生元中的多种活性成分具有显著的抗氧化和调节蛋白质结构的作用,其通过抑制自由基生成、螯合金属离子等机制减少蛋白质氧化损伤,在肉制品中发挥重要作用[14-15]。Jalali等[16]研究表明,乳杆菌后生元产生的多肽和多糖能够有效清除自由基,降低氧化应激对MP的损伤。此外,后生元中某些组分还可以调控蛋白质结构,保持其功能稳定性[17]。在猪肉糜中添加发酵乳杆菌后生元(postbiotics derived from Lactobacillus fermentum,PLF)的研究为理解后生元对肉制品中蛋白质结构和功能特性的影响提供了依据,显示出其在改善肉制品品质中的潜力。
本研究以猪背最长肌MP为研究对象,首先通过添加不同质量浓度PLF探究其对猪肉糜品质(如质构、保水性等)的宏观影响。由于MP是肉糜凝胶形成和功能特性的核心组分,其氧化程度与肉制品品质劣变密切相关,为进一步揭示PLF的作用机制,本研究构建Fenton体系模拟MP的氧化过程,研究不同质量浓度PLF对MP理化性质(包括羰基含量、巯基含量和表面疏水性)的影响。最后,通过紫外吸收光谱、傅里叶变换红外光谱和拉曼光谱研究PLF对MP结构的影响,以揭示PLF在改善MP结构特性方面的作用。
1 材料与方法
1.1 材料与试剂
猪背最长肌为市购,在4 ℃条件下运回实验室(约1 h),贮藏在-20 ℃的环境中。
发酵乳杆菌TQ-1、MRS液体培养基 杭州微生物试剂有限公司;双缩脲法蛋白含量检测试剂盒 北京索莱宝科技有限公司;乙二醇双(2-氨基乙醚)四乙酸(ethylene glycol-bis(2-aminoethylether)-N,N,N’,N’-tetraacetic acid,EGTA)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、2,4-二硝基苯肼、三氯乙酸(trichloroacetic acid,TCA)、5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithio bis-(2-nitrobenzoic acid,DTNB)、7-氨基-4-甲基香豆素(7-amino-4-methylcoumarin,AMC)、溴酚蓝、柠檬酸三钠、抗坏血酸 上海阿拉丁生化科技股份有限公司;Z-Arg-Arg-AMC、Z-Phe-Arg-AMC、Suc-Leu-Leu-Val-Tyr-AMC 美国Sigma-Aldrich公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)生工生物工程(上海)股份有限公司;三(羟甲基)氨基甲烷(tris(hydroxymethyl)aminomethane,Tris)、盐酸胍、硝酸银 国药集团化学试剂有限公司;以上试剂均为分析纯。
1.2 仪器与设备
Thermo Vanquish超高效液相色谱系统、Thermo Orbitrap Exploris 120质谱检测器、Nicolet iS50傅里叶变换红外光谱仪 美国Thermo Fisher Scientific公司;Z-10N冷冻干燥机 宁波新芝生物科技股份有限公司;TMS-TOUCH质构仪 美国FTC公司;5810R高速冷冻离心机 德国Eppendorf公司;UV-6100B紫外-可见分光光度计 上海美谱达仪器有限公司;F-280荧光分光光度计 天津港东科技发展股份有限公司;XploRA PLUS共聚焦显微拉曼光谱仪 法国HORIBA France SAS公司;ACQUITY UPLC® HSS T3色谱柱(2.1 mm×100 mm,1.8 μm) 美国Waters公司。
1.3 方法
1.3.1 PLF的制备
参照Sun Zhe等[15]的方法,并稍作修改。将发酵乳杆菌TQ-1按2%的接种量在MRS肉汤中37 ℃培养18~20 h,70 ℃水浴加热30 min灭活,离心(4 ℃、6 000×g、15 min)后取上清液,使用0.22 μm水系混合纤维素滤膜过滤,对上清液进行冷冻干燥。将冷冻干燥后的PLF贮藏在-80 ℃以备进一步使用。
1.3.2 PLF成分测定
精确称量50 mg样本于2 mL离心管中,加入600 μL甲醇(含0.02 mg/mL 2-氯-L-苯丙氨酸),涡旋振荡30 s;加入钢珠,放入组织研磨器中,55 Hz研磨60 s;室温超声15 min;12 000 r/min、4 ℃离心10 min,取上清液过0.22 μm滤膜,滤液加入到检测瓶中,用于超高效液相色谱-质谱检测。
色谱条件:ACQUITY UPLC® HSS T3色谱柱(2.1 mm×100 mm,1.8 μm),流速0.3 mL/min,柱温40 ℃,进样量2 μL。正离子模式,流动相为0.1%甲酸-乙腈(B2)和0.1%甲酸溶液(A2),梯度洗脱程序为:0~1 min,10% B2;1~5 min,10%~98% B2;5~6.5 min,98% B2;6.5~6.6 min,98%~10% B2;6.6~8 min,10% B2。负离子模式,流动相为乙腈(B3)和5 mmol/L甲酸铵溶液(A3),梯度洗脱程序为:0~1 min,10% B3;1~5 min,10%~98% B3;5~6.5 min,98% B3;6.5~6.6 min,98%~10% B3;6.6~8 min,10% B3[18]。
质谱条件:电喷雾离子源,正负离子模式分别采集数据。正离子喷雾电压3.50 kV,负离子喷雾电压-2.50 kV,鞘气压力40 arb,辅助气压力10 arb。毛细管温度325 ℃,以分辨率60 000进行一级全扫描,一级离子扫描范围m/z 100~1 000,并采用高能碰撞解离进行二级裂解,碰撞能量为30%,二级分辨率为15 000,采集信号前4离子进行碎裂,同时采用动态排除去除无必要的串联质谱信息[19]。
1.3.3 猪肉糜样品制备
参照吴颖等[20]的方法,并稍作修改。剔除原料肉的可见筋膜与结缔组织,切分后放入筛孔直径4 mm绞肉机中绞制均匀,每100 g肉糜中加入4 mL PLF溶液(0、250、500、1 000 μg/mL),将斩拌均匀的肉糜压制为直径为4.5 cm、厚度为1.6 cm的肉饼,放于4 ℃冷库中贮藏。
1.3.4 猪肉糜质构特性测定
参考Xu Zhifeng等[21]的方法,并稍作修改。探头型号MS-100 mm,设置检测速率60 mm/min,起始力最小0.1 N,形变量70%,每个试样进行3 次平行测定。
1.3.5 猪肉糜pH值测定
参照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》测定猪肉糜的pH值。
1.3.6 猪肉糜持水性测定
参考任丽琨等[22]的方法,并稍作修改。称取猪肉糜质量记为m1,用滤纸包裹后放入离心管中。离心(4 ℃、3 000×g、10 min)后除去包裹的滤纸,再次称取猪肉糜质量,记为m2。持水性按式(1)计算:
1.3.7 猪肉糜内源酶活性测定
参照Zhang Zhesheng等[23]的方法,并稍作修改。将1 g肉糜与5 mL 20 mmol/L Tris-HCl溶液混合,冰浴匀浆1 min,离心(4 ℃、12 000×g、20 min)收集上清液作为粗酶溶液。将100 μL 0.1 mmol/L特异性荧光底物Z-Arg-Arg-AMC、Z-Phe-Arg-AMC和Suc-Leu-Leu-Val-Tyr-AMC添加到100 μL粗酶溶液中。底物与溶液中的蛋白酶反应,释放AMC。使用荧光分光光度计测定荧光物质AMG的强度,激发和发射波长分别为380、485 nm。以AMC制作标准曲线,酶活性定义为在37 ℃下1 min内释放1 μmol/L AMC所需的酶量。
1.3.8 MP提取
参照Han Ping等[24]的方法,并稍作修改。向1 g肉糜中加入5 mL缓冲液(0.1 mol/L NaCl、2 mmol/L MgCl2、50 mmol/L磷酸盐缓冲液(phosphate buffered saline,PBS)、1 mmol/L EGTA,pH 7.0),12 000 r/min匀浆30 s后3 000×g离心20 min,取沉淀重复洗涤3 次,再加入5 倍体积0.1 mol/L NaCl溶液洗涤,用4 层纱布过滤,取滤液3 000×g离心20 min。所得沉淀为MP。将MP在含0.6 mol/L NaCl的50 mmol/L PBS中重悬,并用双缩脲法测定蛋白质量浓度,4 ℃保存,并在48 h内使用。
1.3.9 MP氧化
参考李国昊等[25]的方法,并稍作修改。将MP溶液(10 mg/mL)与羟自由基体系溶液(20 μmol/L FeCl3、200 μmol/L抗坏血酸、2 mmol/L H2O2)等体积混合,添加PLF至终质量浓度分别为0、125、250、500、1 000 μg/mL,涡旋1 min,在4 ℃下避光放置12 h,添加1 mmol/L EDTA-2Na溶液终止氧化反应,未作氧化处理的MP溶液作为对照。
1.3.10 MP羰基含量测定
采用2,4-二硝基苯肼法测定羰基含量[26]。取0.5 mL 5 mg/mL氧化/非氧化MP悬浮液加入2 mL 20 mmol/L 2,4-二硝基苯肼溶液,避光反应30 min,再加入2 mL 200 mg/mL TCA溶液,离心(4 ℃、4 000×g、20 min)取沉淀,加入乙醇-乙酸乙酯混合液(1∶1,V/V)清洗沉淀,重复3 次。取沉淀加入5 mL 6 mol/L盐酸胍溶液,37 ℃反应15 min后4 000×g离心20 min,取上清液于370 nm处测定吸光度,羰基含量按式(2)计算:
式中:A为样品吸光度;ρ为样品质量浓度/(mg/mL);ε为摩尔消光系数(22 000 L/(mol·cm));n为稀释倍数。
1.3.11 MP巯基含量测定
1.3.11.1 巯基含量
依据常海军等[27]方法测定巯基含量,并稍作修改。向1 mL 5 mg/mL氧化/非氧化MP悬浮液中加入9 mL 20 mmol/L Tris-HCl缓冲溶液(含20 mg/mL SDS、8 mol/L尿素、10 mmol/L EDTA,pH 6.8)以及1 mL Ellman试剂(含0.2 mol/L PBS、1 mg/mL DTNB,pH 8.0)混匀后,40 ℃水浴30 min。测定其在412 nm波长处的吸光度,巯基含量按式(3)计算:
式中:A为样品吸光度;ρ为样品质量浓度/(mg/mL);ε为摩尔消光系数(13 600 L/(mol·cm));n为稀释倍数。
1.3.11.2 活性巯基含量
测定方法同1.3.11.1节,但Tris-HCl缓冲溶液中不含尿素。
1.3.12 MP表面疏水性测定
参考Chelh等[28]的方法,并稍作修改。取2 mL 5 mg/mL氧化/非氧化MP悬浮液加入0.4 mL 1 mg/mL溴酚蓝(bromophenol blue,BPB)溶液,涡旋振荡使其混合均匀。在4 ℃条件下以3 000×g离心25 min取上清液,测定其在595 nm处的吸光度,同条件下以50 mmol/L PBS(含0.6 mol/L NaCl)代替MP溶液作为对照,表面疏水性按式(4)计算:
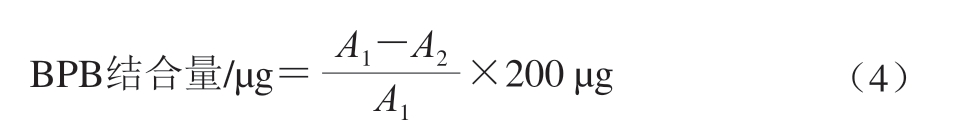
式中:A1为对照组吸光度;A2为样品组吸光度。
1.3.13 MP紫外吸收光谱测定
参考韦诚[29]的方法并适当修改。取1.3.8节所得MP溶液,添加PLF,使MP和PLF质量浓度分别为5 mg/mL和0~1 000 μg/mL,扫描波长范围为230~350 nm,测定样品的紫外吸收光谱及二阶导数光谱。
1.3.14 MP傅里叶变换红外光谱测定
参照吴黎明等[30]的方法,并稍做修改。将1.3.8节提取所得MP冷冻干燥成粉,与溴化钾粉末研磨均匀后压片。采用傅里叶变换红外光谱仪测量,光谱分辨率4 cm-1,扫描次数16 次,扫描波段500~4 000 cm-1。使用PeakFit v4.12软件对酰胺I带(1 600~1 700 cm-1)进行光谱分析,用峰面积比值表示二级结构的相对含量。
1.3.15 MP拉曼光谱测定
根据Su Liuyu等[31]的方法,并稍做修改。取1.3.8节所得MP溶液,添加PLF,使MP和PLF质量浓度分别为5 mg/mL和0~1 000 μg/mL,与银纳米颗粒(AgNPs)溶液等体积混合,以增强拉曼散射信号。AgNPs根据Liu Jia等[32]的方法合成。所得AgNPs使用前用纯水洗涤3 次,然后将激光束聚焦在石英比色皿上,扫描石英比色皿上的3 个随机位置进行重复测定。实验过程中记录400~2 000 cm-1的发射光谱,功率衰减25%,光栅1 200 g/mm,积分时间30 s,激发波长532 nm。
1.4 数据处理
对不同批次制备的样品分别重复3 次实验,数据以平均值±标准差表示。用SPSS 27.0软件进行方差分析,以考虑平均值之间的显著性水平(P<0.05),Origin 2021软件绘图。
2 结果与分析
2.1 PLF组分
采用人类代谢组数据库、MassBank、LipidMaps、mzCloud、京都基因与基因组百科全书等公共数据库对所获谱图数据进行物质鉴定,得到PLF组分定性结果。共鉴定出1 343 种组分,如表1所示,其中,羧酸及其衍生物相对含量16.62%,其中氨基酸、肽和类似物是主要成分(14.64%)。此外,还发现PLF中含有异戊烯醇脂类(11.79%)、类固醇及其衍生物(6.07%)、异黄酮类化合物(1.88%)、黄酮类化合物(1.51%)等生物活性成分。
表1 PLF组分
Table 1 Components of PLF

主分类相对含量/%子分类羧酸及其衍生物16.62氨基酸、肽和类似物羧酸衍生物二羧酸及其衍生物三羧酸及其衍生物异戊烯醇脂类11.79倍半萜类化合物单萜类化合物二萜类化合物萜类化合物
续表1
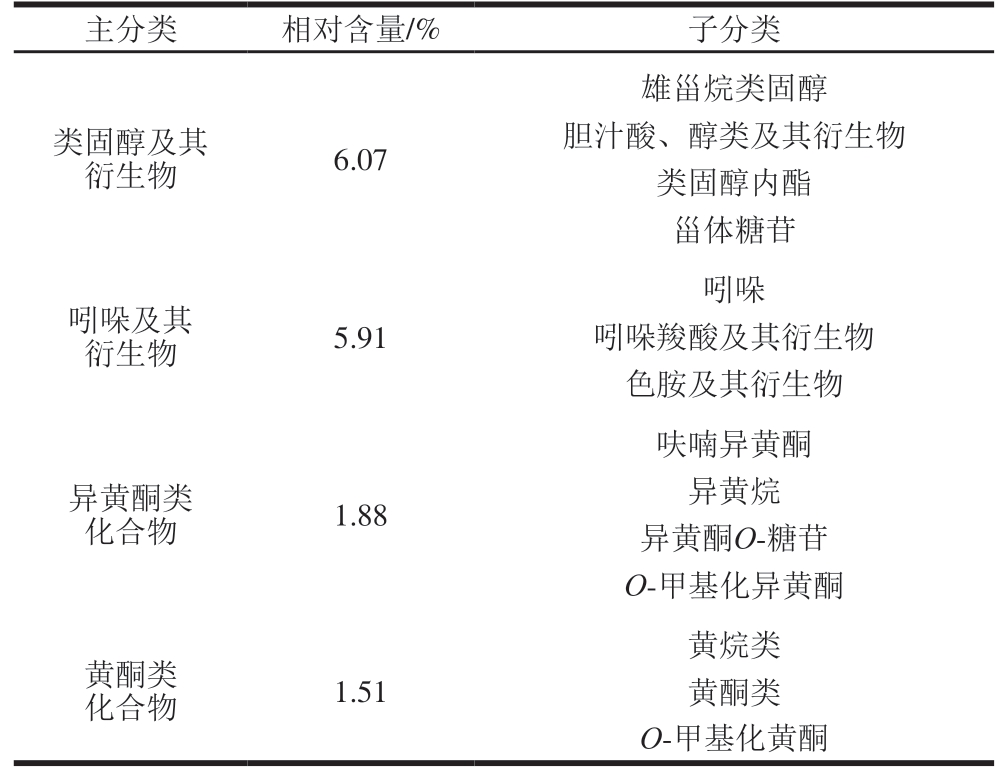
主分类相对含量/%子分类类固醇及其衍生物6.07雄甾烷类固醇胆汁酸、醇类及其衍生物类固醇内酯甾体糖苷吲哚及其衍生物5.91吲哚吲哚羧酸及其衍生物色胺及其衍生物异黄酮类化合物1.88呋喃异黄酮异黄烷异黄酮O-糖苷O-甲基化异黄酮黄酮类化合物1.51黄烷类黄酮类O-甲基化黄酮
2.2 PLF对肉糜质构特性、pH值和持水性的影响
如图1A~C所示,随着贮藏时间延长,对照组和后生元组肉糜的弹性、咀嚼性逐渐升高,硬度呈现先升高后降低的趋势。这可能是由于PLF(如有机酸、黄酮、多糖等)通过改变MP的微环境,促进蛋白质交联,从而增强蛋白质网络结构的稳定性[12,33-34]。如图1D所示,随着PLF质量浓度的升高,肉糜内聚性明显提升,这说明蛋白质分子之间的连接更加紧密,进一步提高了肉糜内部的稳定性。
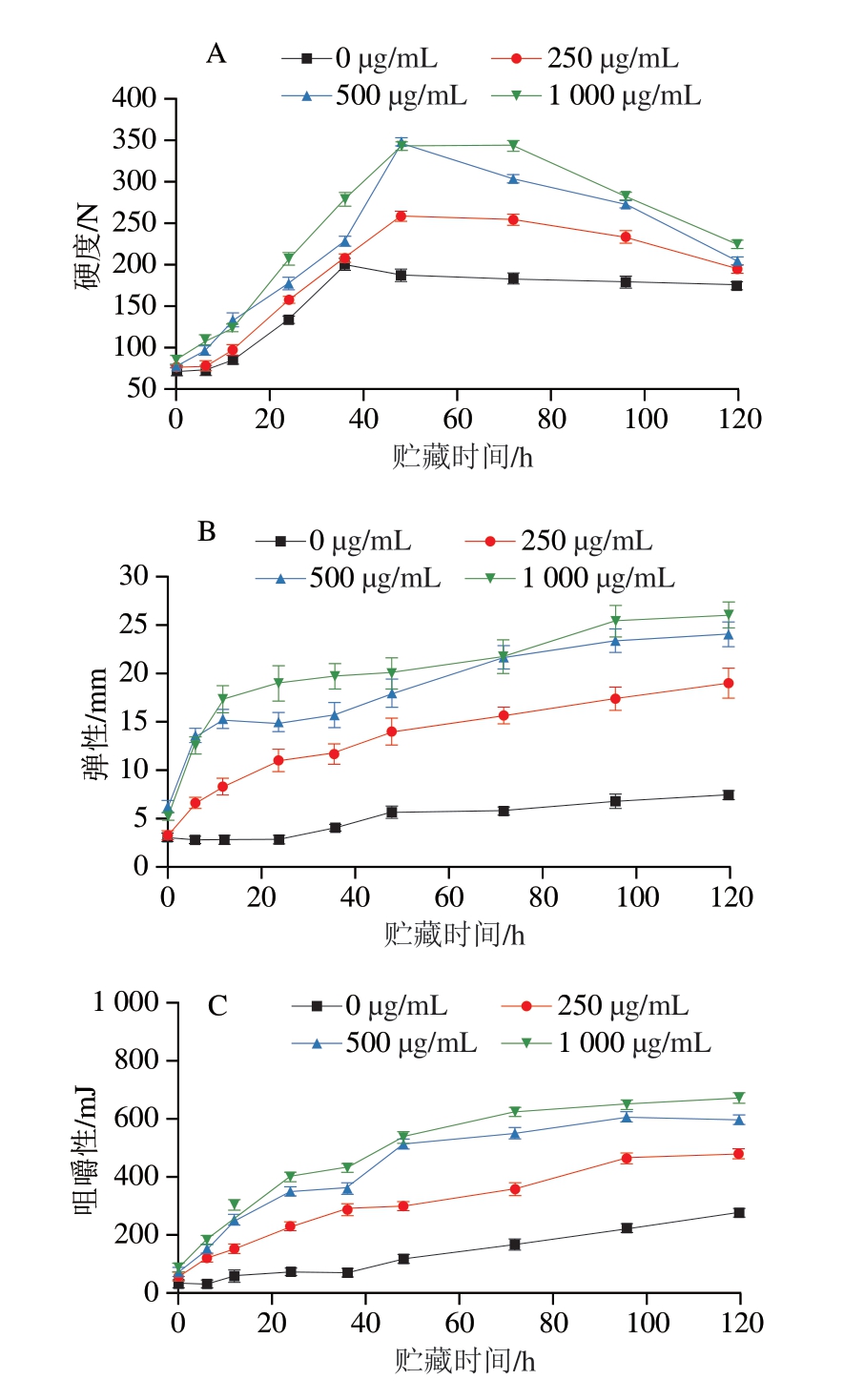
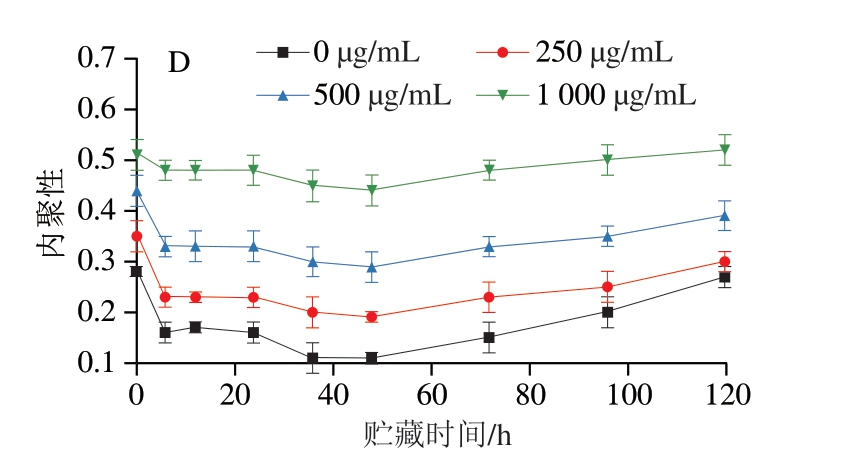
图1 PLF添加量对猪肉糜硬度(A)、弹性(B)、咀嚼性(C)和内聚性(D)的影响
Fig. 1 Effects of PLF addition on the hardness (A), springiness (B),chewiness (C) and cohesiveness (D) of minced pork meat
如图2所示,对照组和后生元组肉糜的pH值随贮藏时间延长呈缓慢上升趋势,持水性随PLF质量浓度增高而明显提升。pH值升高可能是由于蛋白水解产生的挥发性碱所致[35],未添加PLF的对照组pH值在96 h达到6.75,pH值超过6.4说明肉糜已经开始变质[35],而后生元组均低于6。结果表明,PLF延长了肉糜的保质期并改善其整体品质。
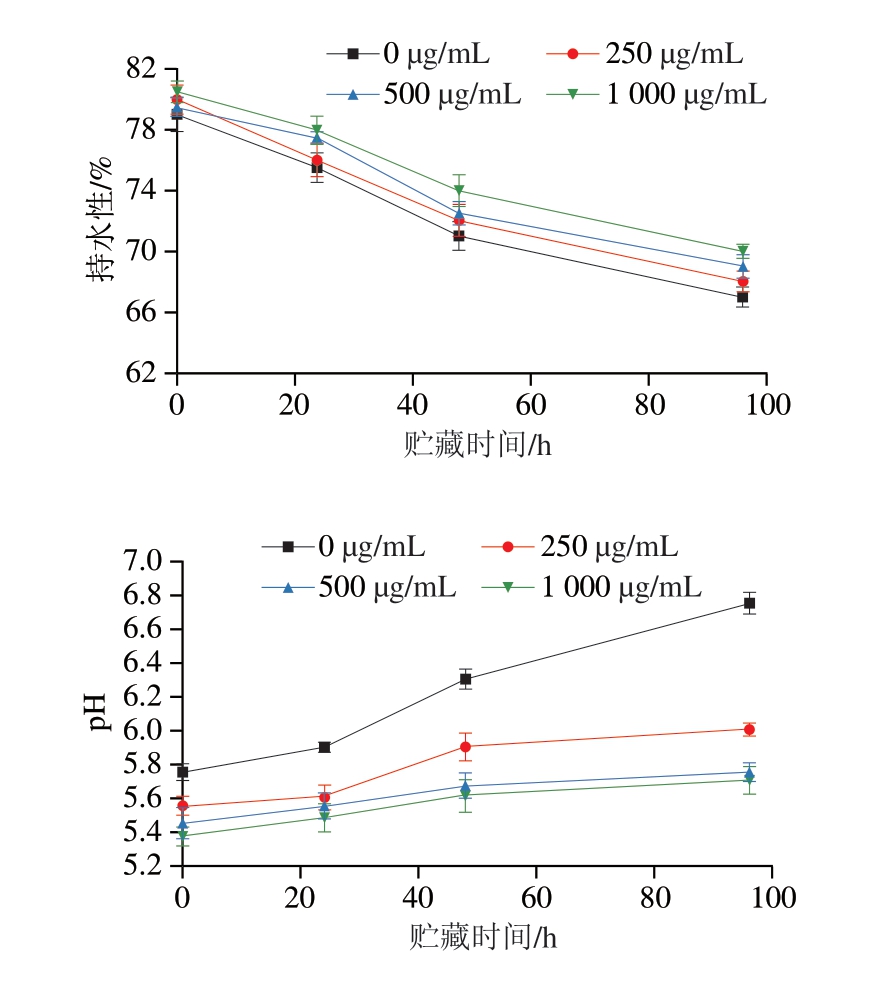
图2 PLF添加量对猪肉糜持水性和pH值的影响
Fig. 2 Effects of PLF addition on the water-holding capacity and pH of minced pork meat
2.3 PLF对肉糜内源酶活性的影响
如图3所示,冷藏期间肉糜中钙蛋白酶活性呈初期增加、后期下降的趋势,组织蛋白酶B活性呈下降趋势。对照组钙蛋白酶活性达到0.981 mU/g的高水平,而添加250 μg/mL PLF组在相同时间仅为对照组钙蛋白酶活性的76.1%。此外,所有后生元组的组织蛋白酶B活性均低于对照组。基于上述结果,后生元组能够更有效地抑制钙蛋白酶活性,抑制机制可能是由于钙蛋白酶的半胱氨酸巯基与后生元的羰基相互作用,导致钙蛋白酶的抑制,最终导致钙蛋白酶活性减弱[23]。因此,钙蛋白酶活性的降低进一步解释了后生元组能更好地维持质地,尤其是在第20~60小时。后生元可能通过渗透到组织中与肌肉中的酶发生反应,从而抑制酶活性。
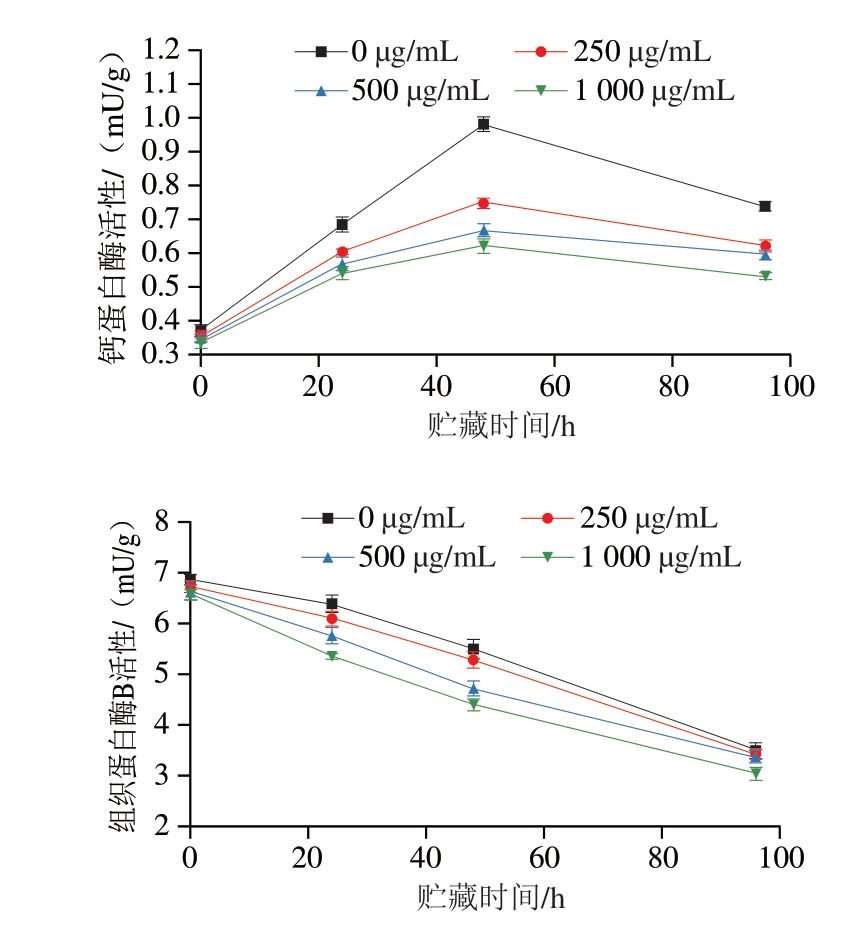
图3 PLF添加量对猪肉糜内源酶活性的影响
Fig. 3 Effects of PLF addition on the activities of endogenous enzymes in minced pork meat
2.4 PLF对MP羰基含量的影响
蛋白质氧化是肉质变老和营养流失的重要原因,其中羰基含量是衡量蛋白质氧化损伤的关键指标。如图4所示,在Fenton反应体系中,高活性羟自由基导致未添加PLF组(0 μg/mL)羰基含量显著升高,表明氧化破坏了MP结构并降低其功能。添加250、500、1 000 μg/mL PLF后,羰基含量显著下降11.86%、24.92%、37.27%(P<0.05)。这可能是由于PLF中的酚类化合物和胞外多糖等抗氧化成分清除自由基,并通过短链脂肪酸和多肽等螯合剂抑制金属离子在Fenton反应中的催化活性[15]。此外,PLF通过与MP表面形成保护层,达到阻断氧化剂的作用[36]。
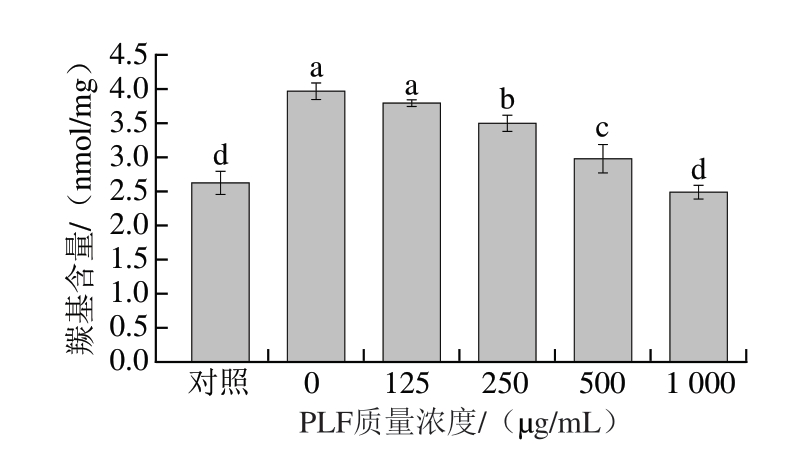
图4 不同质量浓度PLF对MP羰基含量的影响
Fig. 4 Effects of different concentrations of PLF on the carbonyl content of MP
小写字母不同表示差异显著(P<0.05)。图5、6同。
2.5 PLF对MP巯基含量的影响
巯基主要存在于蛋白质的半胱氨酸残基中,在氧化应激下易与氧化剂反应生成二硫键(S—S),导致巯基含量减少。活性巯基是暴露在蛋白质表面、具有较高化学活性的巯基,通常参与催化反应并维持蛋白质的生物活性。由图5可知,在未添加或添加低质量浓度PLF的情况下,MP中的巯基易受氧化,氧化导致大量巯基转化为二硫键,从而减少巯基和活性巯基的含量。相比于未添加PLF的对照组,PLF质量浓度达到500 μg/mL时巯基含量增加31.63%,PLF有效抑制了巯基的氧化损伤。巯基含量的增加表明MP中的二硫键减少,半胱氨酸残基受到保护,避免了氧化诱导的结构破坏[37]。PLF通过保护巯基维持蛋白质的三级和四级结构,从而增强了蛋白质的稳定性。
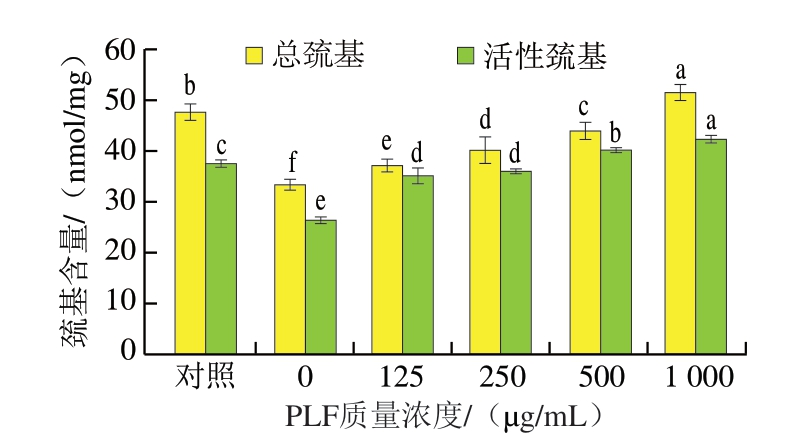
图5 不同质量浓度PLF对MP巯基含量的影响
Fig. 5 Effects of different concentrations of PLF on the sulfhydryl content of MP
2.6 PLF对MP表面疏水性的影响
蛋白质氧化会导致其构象发生改变,增加疏水性氨基酸残基的暴露,影响其结构和功能特性。Fenton氧化产生的羟自由基能够氧化蛋白质中的巯基,生成二硫键,同时氧化芳香族氨基酸残基,从而减少溴酚蓝结合位点。如图6所示,添加125 μg/mL PLF后,相比于未添加PLF组,溴酚蓝结合量显著增加15.3%(P<0.05)。PLF作为抗氧化剂保护蛋白质中的阳离子结合位点,使得更多阳离子基团保持还原状态,从而增强与溴酚蓝的结合[38-39]。然而,在高质量浓度(如1 000 μg/mL)下,PLF的过度还原作用可能引发MP重新折叠或聚集,减少阳离子结合位点的暴露[40],导致溴酚蓝结合量相比未添加PLF组下降12.9%。PLF通过清除自由基、保护阳离子结合位点有助于减缓氧化导致的蛋白质结构损伤[41]。
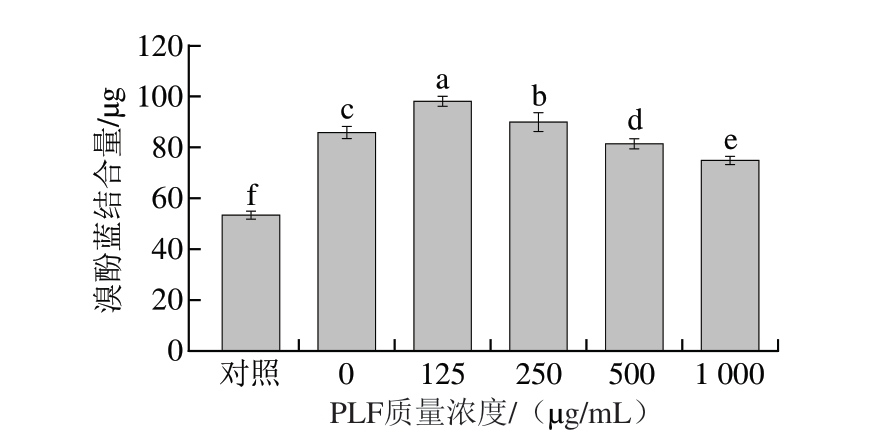
图6 不同质量浓度PLF对MP表面疏水性的影响
Fig. 6 Effects of different concentrations of PLF on the surface hydrophobicity of MP
2.7 PLF对MP紫外吸收光谱的影响
添加PLF后,MP的紫外吸收强度和光谱变化表明其三级结构发生了显著的动态变化。图7A中紫外吸收的增强显示,随着PLF质量浓度增大,芳香族氨基酸残基(如色氨酸和酪氨酸)从MP内部暴露至更极性的外部环境,这与局部展开相关,反映出蛋白质局部区域的构象改变[42]。同时,图7B中二阶导数光谱显示,随着PLF质量浓度增大,285 nm和293 nm吸收峰蓝移,表明部分芳香族氨基酸残基在PLF的作用下埋入疏水核心,整体结构变得更加紧密和稳定[43]。PLF引发了MP局部展开和整体结构重组,使部分芳香族氨基酸残基重新埋藏于疏水核心,这种局部和整体的动态变化有助于提高蛋白质结构的紧密性和稳定性。
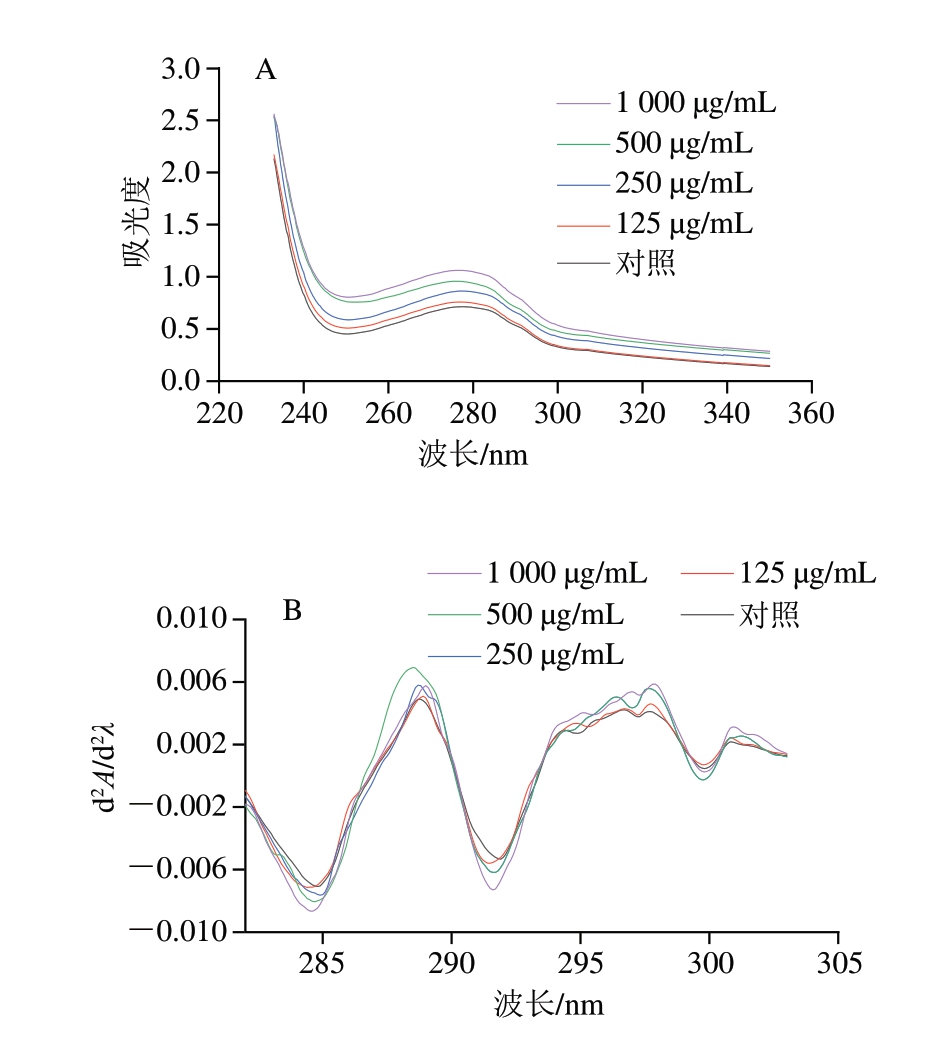
图7 不同质量浓度PLF对MP紫外吸收光谱(A)及其二阶导数光谱(B)的影响
Fig. 7 Effects of different concentrations of PLF on the normal (A) and second derivative UV absorption spectra (B) of MP
2.8 PLF对MP二级结构的影响
如图8所示,PLF的添加显著改变了MP的二级结构,表现为α-螺旋和无规卷曲减少,β-折叠和β-转角增加。这种变化表明MP经历局部解体与重新组织的动态过程。尤其是添加500、1 000 μg/mL PLF分别使α-螺旋结构相对含量显著降低至12.7%和11.9%,α-螺旋的减少归因于PLF中的有机酸改变了局部pH值,影响蛋白质的电荷状态,从而破坏了氢键的稳定性,导致局部螺旋结构解体[13,44]。同时β-折叠和β-转角相对含量显著增加至41.7%、43.4%和36.0%、37.3%,β-折叠和β-转角的增加加强了蛋白质结构域之间的连接[45]。随PLF质量浓度增加,无规卷曲减少,增强了蛋白质结构的稳定性。
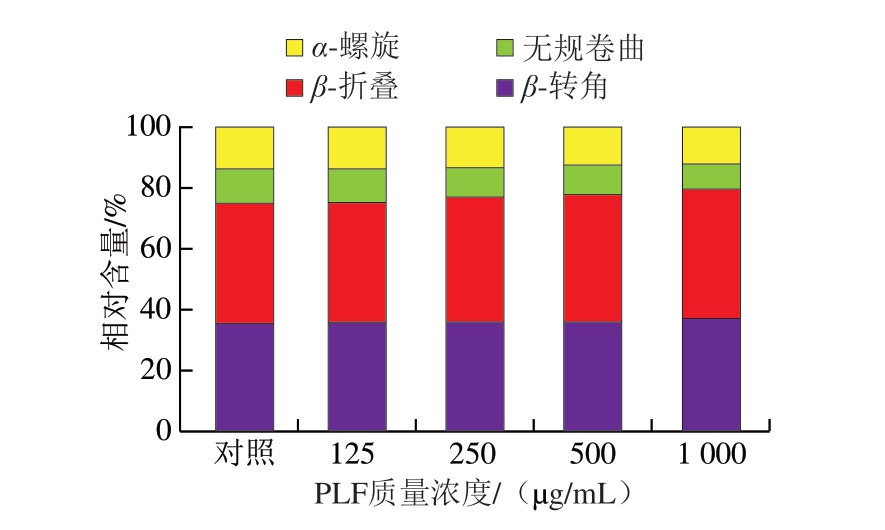
图8 不同质量浓度PLF对MP二级结构的影响
Fig. 8 Effects of different concentrations of PLF on the secondary structure of MP
2.9 PLF对MP拉曼光谱的影响
采用AgNPs辅助的表面增强拉曼散射模式增强MP的信号,以获取详细的拉曼指纹图谱[32]。如图9所示,不同质量浓度PLF处理后在396、970、1 036、1 150、1 356、1 460 cm-1处观察到有关MP特征峰显著增强,396 cm-1峰值增强通常与蛋白质二硫键(S—S)振动相关,反映了蛋白质分子中特定二级结构或分子间交联的增强,970、1 036 cm-1的拉曼信号通常与蛋白质骨架振动(如C—C、C—N键伸缩振动)相关,二级结构(如α-螺旋和β-折叠)的稳定性和重组会影响这些骨架振动强度的变化,导致拉曼信号增强[46],这与图8蛋白质的二级结构变化一致。1 150、1 356、1 460 cm-1峰值增强与疏水基团暴露有关[47]。PLF通过调节蛋白质分子间的相互作用并改变蛋白质骨架结构,对蛋白质的稳定性起到了积极作用。
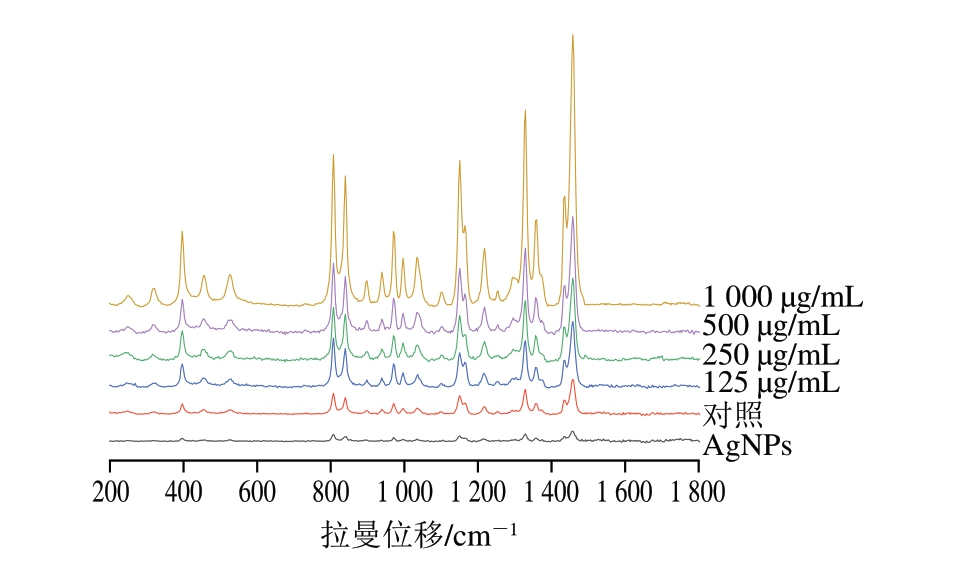
图9 不同质量浓度PLF对MP拉曼光谱的影响
Fig. 9 Effects of different concentrations of PLF on the Raman spectrum of MP
3 结论
PLF对MP的结构和稳定性具有显著的积极影响。随着PLF质量浓度的增加,肉糜品质得到有效改善,具体表现为硬度、弹性、咀嚼性、内聚性及持水性的提升,同时减缓了变质过程。此外,PLF在抑制MP氧化损伤方面表现出良好效果,主要体现在羰基含量的降低和巯基含量的增加,有效减缓了贮藏过程中因空气暴露导致的品质下降。光谱分析进一步验证了PLF对MP的调节作用。紫外吸收光谱和傅里叶变换红外光谱显示,PLF能显著影响MP的结构变化并使其趋于稳定;拉曼光谱则进一步证实了PLF对MP分子间相互作用及骨架结构的调节作用。综合上述发现,PLF不仅能够保护MP免受氧化变性,还显著改善了肉制品的品质。本研究为优化加工肉制品的品质提供了新的思路,同时为PLF及其他后生元在肉制品中的应用提供了理论支持。
[1] ZHANG J J, LIU Z J, HUANG Y Q, et al. Effects of sodium bicarbonate and sodium phosphates on the formation of advanced glycation end-products in minced pork during cold storage[J]. Journal of Food Measurement and Characterization, 2022, 16(6): 4425-4432.DOI:10.1007/s11694-022-01530-y.
[2] 刘燕, 柳佳芸, 章小雨, 等. 淡竹叶提取物对猪肉糜冷藏期间品质的影响[J]. 现代食品, 2024, 30(14): 216-219. DOI:10.16736/j.cnki.cn41-1434/ts.2024.14.069.
[3] 肖燃, 杜明静, 刘超峰, 等. 山药多糖对减糖猪肉糜脯风味的影响[J]. 肉类研究, 2024, 38(1): 51-60. DOI:10.7506/rlyj1001-8123-20240122-024.
[4] PINTON M B, LORENZO J M, SEIBT A C M D, et al. Effect of highpower ultrasound and bamboo fiber on the technological and oxidative properties of phosphate-free meat emulsions[J]. Meat Science, 2022,193: 108931. DOI:10.1016/j.meatsci.2022.108931.
[5] 李俊瑶, 王若莹, 陈钰, 等. 姜黄素微胶囊对冷藏猪肉糜氧化稳定性及品质的影响[J]. 保鲜与加工, 2024, 24(4): 20-25. DOI:10.3969/j.issn.1009-6221.2024.04.004.
[6] 贾琴, 黄予豫, 唐善虎, 等. 刺梨水提物对牦牛肉糜贮藏过程蛋白质和脂质氧化影响的研究[J]. 食品工业科技, 2023, 44(5): 347-355.DOI:10.13386/j.issn1002-0306.2022050210.
[7] ZHANG L P, YANG D S, LUO R M, et al. Research progress on the mechanism of the impact of myofibrillar protein oxidation on the flavor of meat products[J]. Foods, 2024, 13(20): 3268-3290.DOI:10.3390/foods13203268.
[8] 王守印, 王雯慧, 赵亚楠, 等. 迷迭香提取物与茶多酚对猪肉饼品质及蛋白氧化的影响[J]. 肉类研究, 2023, 37(9): 8-13. DOI:10.7506/rlyj1001-8123-20230509-040.
[9] 李嘉琦, 潘德胤, 马金明, 等. 草蔻提取液对鸭肉质构特性及金合欢醇对肌原纤维蛋白结构的影响[J]. 食品工业科技, 2024, 45(23):1-10. DOI:10.13386/j.issn1002-0306.2024010273.
[10] ZHAO S M, YANG L, HEI M R, et al. Conformation and functional modification of porcine myofibrillar protein by pepper leaf polyphenols under oxidative condition[J]. LWT-Food Science and Technology, 2024, 198: 116017. DOI:10.1016/j.lwt.2024.116017
[11] SALMINEN S, COLLADO M C, ENDO A, et al. The International Scientific Association of Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of postbiotics[J]. Nature Reviews Gastroenterology & Hepatology, 2021, 18(9): 671-671. DOI:10.1038/s41575-021-00481-x.
[12] ZHONG Y J, WANG T, LUO R L, et al. Recent advances and potentiality of postbiotics in the food industry: composition,inactivation methods, current applications in metabolic syndrome, and future trends[J]. Critical Reviews in Food Science and Nutrition, 2024,64(17): 5768-5792. DOI:10.1080/10408398.2022.2158174.
[13] SCOTT E, DE PAEPE K, VAN DE WIELE T. Postbiotics and their health modulatory biomolecules[J]. Biomolecules, 2022, 12(11): 1640-1657. DOI:10.3390/biom12111640.
[14] ABBASI A, HASHEMI M, POURJAFAR H, et al. Malva neglecta seed polysaccharide mucilage coating enriched by the Lactobacillus brevis TD4 postbiotics: a promising strategy to promote the shelf life of fresh beef[J]. International Journal of Biological Macromolecules,2024, 280: 135789. DOI:10.1016/j.ijbiomac.2024.135789..
[15] SUN Z, ZHAO Z, FANG B, et al. Effect of thermal inactivation on antioxidant, anti-inflammatory activities and chemical profile of postbiotics[J]. Foods, 2023, 12(19): 3579-3593. DOI:10.3390/foods12193579.
[16] JALALI S, MOJGANI N, HAGHIGHAT S, et al. Investigation of antimicrobial and antioxidant properties of postbiotics produced by Lactobacillus rhamnosus and Limosilactobacillus reuteri and their potential application in surface decontamination of red meat[J]. LWTFood Science and Technology, 2024, 209: 116758. DOI:10.1016/j.lwt.2024.116758.
[17] FAN Z B, JIA W. Lactobacillus casei-derived postbiotics elevate the bioaccessibility of proteins via allosteric regulation of pepsin and trypsin and introduction of endopeptidases[J]. Journal of Agricultural and Food Chemistry, 2023, 71(28): 10647-10669. DOI:10.1021/acs.jafc.3c02125.
[18] ZELENA E, DUNN W B, BROADHURST D, et al. Development of a robust and repeatable UPLC-MS method for the long-term metabolomic study of human serum[J]. Analytical Chemistry, 2009,81(4): 1357-1364. DOI:10.1021/ac8019366.
[19] WANT E J, MASSON P, MICHOPOULOS F, et al. Global metabolic profiling of animal and human tissues via UPLC-MS[J]. Nature Protocols, 2013, 8(1): 17-32. DOI:10.1038/nprot.2012.135.
[20] 吴颖, 赖利先, 张万刚. 产酸丙酸杆菌发酵甘油提取物对冷藏调理猪肉饼品质的影响[J]. 食品科学, 2021, 42(1): 228-234.DOI:10.7506/spkx1002-6630-20191118-207.
[21] XU Z F, DU Y S, LI N, et al. Effects of alfalfa meal on quality and function of pork meatballs[J]. Food Science & Nutrition, 2022, 10(8):2601-2610. DOI:10.1002/fsn3.2865.
[22] 任丽琨, 李婷婷, 赫彬彬, 等. 黑鱼鱼片复合保鲜剂的选择及其保鲜效果[J]. 中国食品学报, 2019, 19(9): 210-220. DOI:10.16429/j.1009-7848.2019.09.025.
[23] ZHANG Z S, ZHAO J S, ZANG J H, et al. The inhibition mechanism of PostbioYDFF-3 on quality deterioration of refrigerated grass carp fillets from the perspective of endogenous enzyme and microorganisms changes[J]. Food Chemistry, 2024, 450: 139345. DOI:10.1016/j.foodchem.2024.139345.
[24] HAN P, AN N, YANG L, et al. Molecular dynamics simulation of the interactions between sesamol and myosin combined with spectroscopy and molecular docking studies[J]. Food Hydrocolloids, 2022, 131:107801. DOI:10.1016/j.foodhyd.2022.107801.
[25] 李国昊, 祖拉, 毕秀芳, 等. 决明子提取物对牦牛肉肌原纤维蛋白氧化稳定性的影响[J]. 食品科技, 2024, 49(7): 122-128. DOI:10.13684/j.cnki.spkj.2024.07.011.
[26] ZHANG D D, GE X Y, JIAO Y, et al. Quality analysis of steamed beef with black tea and the mechanism of action of main active ingredients of black tea on myofibrillar protein[J]. Food Chemistry, 2024, 441:137997. DOI:10.1016/j.foodchem.2023.137997.
[27] 常海军, 伯朝英, 石源伟, 等. 姜黄素对羟自由基诱导的肌原纤维蛋白氧化及结构的影响[J]. 中国食品学报, 2023, 23(11): 74-83.DOI:10.16429/j.1009-7848.2023.11.008.
[28] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V. Technical note: a simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683. DOI:10.1016/j.meatsci.2006.05.019.
[29] 韦诚. 发酵过程中酸肉蛋白质的变化及其对食用品质的影响[D].重庆: 西南大学, 2018.
[30] 吴黎明, 周群, 周骁, 等. 蜂王浆不同贮存条件下蛋白质二级结构的Fourier变换红外光谱研究[J]. 光谱学与光谱分析, 2009, 29(1): 82-87. DOI:10.3964/j.issn.1000-0593(2009)01-0082-06.
[31] SU L Y, ZHAO Z R, XIA J L, et al. Protecting meat color: the interplay of betanin red and myoglobin through antioxidation and coloration[J]. Food Chemistry, 2024, 442: 138410. DOI:10.1016/j.foodchem.2024.138410.
[32] LIU J, HE H, XIE D, et al. Probing low-copy-number proteins in single living cells using single-cell plasmonic immunosandwich assays[J]. Nature Protocols, 2021, 16(7): 3522-3546. DOI:10.1038/s41596-021-00547-9.
[33] TAN C, XU Q D, CHEN N, et al. Cross-linking effects of EGCG on myofibrillar protein from common carp (Cyprinus carpio) and the action mechanism[J]. Journal of Food Biochemistry, 2022, 46(12):14416. DOI:10.1111/jfbc.14416.
[34] 孙悦欣, 史嘉琦, 李璟, 等. 不同保加利亚乳杆菌与嗜热链球菌S10复配对发酵乳特性的影响[J]. 中国食品学报, 2023, 23(10): 206-215.DOI:10.16429/j.1009-7848.2023.10.021.
[35] 许福, 李平, 周辉. 猪肉冷藏过程中加工品质及氧化特性研究[J]. 食品研究与开发, 2024, 45: 20-26. DOI:10.12161/j.issn.1005-6521.2024.24.003.
[36] AYDIN F, AKTEPE Y, KAHVE H I, et al. In vitro probiotic characterization of yeasts with their postbiotics’ antioxidant activity and biofilm inhibition capacity[J]. Current Microbiology, 2024, 81(11):364. DOI:10.1007/s00284-024-03881-9.
[37] DENG N, LIU Y P, CAI Y J, et al. Characterization, antioxidant,and sausage preservation effects of ethanol extract from lotus seed peel powder[J]. Food Control, 2024, 158: 110202. DOI:10.1016/j.foodcont.2023.110202.
[38] 闫玉红, 黄卉, 李来好, 等. 5 种氧化型减菌剂对罗非鱼片品质及蛋白质的影响[J]. 食品科学, 2024, 45(6): 15-23. DOI:10.7506/spkx1002-6630-20230525-245.
[39] HOSSEINZADEH N, ASQARDOKHT-ALIABADI A, SARABIAGHDAM V, et al. Antioxidant properties of postbiotics: an overview on the analysis and evaluation methods[J]. Probiotics and Antimicrobial Proteins, 2025, 17(2): 606-624. DOI:10.1007/s12602-024-10372-7.
[40] 游刚, 黄思雯, 钟湘, 等. 仙草多糖对冻藏鱼糜肌原纤维蛋白结构和理化性质及鱼糜凝胶特性的影响[J]. 食品工业科技, 2025, 46(6):1-9. DOI:10.13386/j.issn1002-0306.2024030444.
[41] 王一郎, 邹智芸, 王以澄, 等. 不同种类植物多酚对冷藏牦牛肉糜肌原纤维蛋白氧化特性、功能特性及结构的影响[J]. 食品与发酵工业, 2024, 50(17): 246-254. DOI:10.13995/j.cnki.11-1802/ts.037110.
[42] WANG H F, WANG P Y, SHEN Q, et al. Insight into the effect of ultrasound treatment on the rheological properties of myofibrillar proteins based on the changes in their tertiary structure[J].Food Research International, 2022, 157: 111136. DOI:10.1016/j.foodres.2022.111136.
[43] 黄春阳, 王灵娟, 王哲, 等. 非肉蛋白对肌原纤维蛋白及肉品品质影响的研究进展[J]. 肉类研究, 2023, 37(2): 62-67. DOI:10.7506/rlyj1001-8123-20220919-122.
[44] SIGNORINI M, SALAZAR J A, PONCE-ALQUICIRA E, et al. Effect of lactic acid and lactic acid bacteria treatment on myofibrillar protein degradation and dynamic rheology of beef[J]. Journal of Texture Studies, 2007, 38(3): 373-392. DOI10.1111/j.1745-4603.2007.00102.x.
[45] WANG M M, ZHAO Y Q, WANG M Y, et al. Effects of protein emulsion on the properties, and structure of myofibrillar protein gel[J].LWT-Food Science and Technology, 2023, 189: 115511. DOI:10.1016/j.lwt.2023.115511.
[46] 陈蓉, 周光明, 罗丹, 等. 纳米银为基底的表面增强拉曼光谱研究香豆素与牛血清白蛋白的相互作用[J]. 西南大学学报(自然科学版),2019, 41(5): 72-79. DOI:10.13718/j.cnki.xdzk.2019.05.012.
[47] 周家羽. 基于金银纳米材料的SERS传感器及其分析应用研究[D].重庆: 西南大学, 2021.