鸡肉因具有蛋白质含量高、脂肪含量低的特点而受到广大消费者的喜爱,是人们日常饮食的重要蛋白质来源。随着食品深加工技术的发展和对鸡肉蛋白、多肽研究的深入,鸡肉蛋白的水解物已被开发成具有不同营养价值的产品[1-2]。鸡肉蛋白质可以通过化学方法或生物途径水解利用[3]。然而,化学法水解具有所得产物营养特性差、游离氨基酸的L型结构被破坏等弊端,因此目前报道[4-5]中,更多学者采用生物酶解技术拟获取鸡肉多肽。
蛋白质酶解是开发食品调味料的重要工艺环节,其中中性蛋白酶、风味蛋白酶具有内切酶和外切酶属性,采用其进行酶解反应能够更加高效地将多肽和游离氨基酸释放出来。已有研究[6]表明,酶解后产生的游离氨基酸和小分子多肽很可能为呈味物质,或作为呈味前体物质发挥作用,不仅具有一定的滋味,还能与其他滋味成分相互作用,起到改善呈味特性的作用[7]。食物蛋白水解产生的活性多肽属于天然产物范畴,具有安全、高吸收等优点。目前已有报道显示,以鸡肉、鱼肉、磷虾等动物源蛋白为原料,可分离出多种活性肽[8-12],这些生物活性肽具有很高的营养价值,对人体健康有益,还具有许多潜在的生理功能[13]。
研究还发现,γ-谷氨酰肽作为一种典型的“Kokumi”肽,在食物体系中呈现“浓厚味”效果,既能增强咸、鲜、甜等基本味感,又能维持浓郁、圆润饱满、持久的味觉感受[14-15],同时随着研究的深入,其生物功能活性也逐渐被挖掘,Caco-2细胞来自人结肠腺癌细胞,能够模拟人类小肠上皮细胞的结构与功能,被广泛用于评价食品功能因子的抗炎、抗氧化、抗癌等功能性研究中[16]。例如,Zhang Hua等[17]通过构建Caco-2细胞模型对γ-谷氨酰半胱氨酸(γ-glutamyl cysteine,γ-EC)、γ-谷氨酰缬氨酸(γ-glutamyl valine,γ-EV)二肽的抗炎功能进行研究,结果表明,γ-EV和γ-EC均可缓解肿瘤坏死因子α(tumor necrosis factor α,TNF-α)诱导的肠道Caco-2细胞炎症;此外,γ-谷氨酰肽也被报道具有抗氧化、降血压等功能。因此,以γ-谷氨酰肽为主的“Kokumi”肽的生物活性还有待进一步探究。
天然存在的γ-谷氨酰肽含量低且难以提取,目前研究[18-20]多以蛋白质酶解物作为反应基料,添加谷氨酰胺及谷氨酰胺酶制备γ-谷氨酰肽,是改善酶解产物口感的有效方法。例如,大豆蛋白酶解产物具有强烈的苦味,而经过γ-谷氨酰基化后,其苦味大大降低;γ-谷氨酰化还能增强猪血红蛋白和肉蛋白水解产物的浓厚感,这与γ-谷氨酰肽的生成有关[19]。
目前鲜见以鸡肉蛋白酶解物为底物制备γ-谷氨酰基化产物的滋味及抗炎功能研究,因此本研究以鸡肉蛋白酶解物作为反应基料进行再加工利用,探究其经谷氨酰胺酶的γ-谷氨酰化后的呈味效果和其在Caco-2细胞中的抗炎作用。
1 材料与方法
1.1 材料与试剂
鸡胸肉、氯化钠、味精、单宁、鸡汤和酱油均为市购。
风味蛋白酶(20 U/mg)、中性蛋白酶(100 U/mg)、L-谷氨酰胺 上海源叶生物科技有限公司;L-异亮氨酸(食品级) 广州东巨实验仪器有限公司;谷氨酰胺酶(100 U/g) 中国天野酶制剂有限公司;细胞色素c(12 384 Da)、抑肽酶(6 511 Da)、杆菌肽(1 423 Da)、氧化型谷胱甘肽(621 Da)、Gly-Gly-Gly(189 Da)(均为色谱纯) 上海阿拉丁生物试剂股份有限公司。
1.2 仪器与设备
1290 Infinity II高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Agilent科技有限公司;L-8080全自动氨基酸分析仪 日立科学仪器(北京)有限公司;Alpha l-2LD冷冻干燥机 上海力辰邦西仪器科技有限公司;5810高速冷冻离心机 德国Eppendorf公司;FiveEasy Plus pH计 瑞士梅特勒-托利多公司;HWS-12电热恒温水浴锅 上海一恒科学仪器有限公司;BS223S电子天平 北京赛多利斯仪器系统有限公司;SPH-108D恒温摇床 上海优宁维生物科技股份有限公司。
1.3 方法
1.3.1 样品处理
将去掉油脂的鸡胸肉捣成泥状,以1∶2(g/mL)的料液比加入超纯水,匀浆,用3 mol/L HCl溶液将pH值调节至7.5后,置于55 ℃恒温水浴锅中预热10 min,加入质量分数0.75%(以鸡肉质量计)的中性蛋白酶和风味蛋白酶(质量比1∶1混合),反应4 h后,沸水浴灭酶10 min,待酶解液冷却至室温后均质,并用高速冷冻离心机4 ℃、10 000 r/min离心10 min,取上层清液进行冷冻干燥,得到鸡肉蛋白酶解样品,记为C1。从蛋白酶解样品中取出一部分,以1∶25(g/mL)的料液比加入去离子水,用3 mol/L NaOH溶液将pH值调节为10.0,置于35 ℃恒温水浴锅中预热10 min,加入质量分数7%谷氨酰胺和4%谷氨酰胺酶(以酶解物质量计),并迅速置于35 ℃恒温水浴锅中反应3 h,随后沸水浴灭酶10 min,待样品冷却至室温后冷冻干燥,得到鸡肉蛋白酶解物γ-谷氨酰基化产物,记为C2。
1.3.2 感官评价
感官评价小组由经过专业培训的5 名男性和5 名女性组成,年龄均在23~35 岁之间,地点为温度恒定在(23±2)℃的专业感官评价室。配制pH值为6.50±0.05的标准品,其中、咸味、鲜味、浓厚味评价标准品分别为质量分数0.35%氯化钠溶液、0.35%味精溶液、含0.005 mol/L谷胱甘肽的鸡汤溶液(以空白鸡汤作为对照)。将样品配制为10 mg/mL的溶液,调节pH值为6.50±0.05,让评价人员逐个对样品进行品尝。评价样品时采用10 分评分法,评价人员需要对样品的咸味、鲜味和浓厚味进行打分,其中标准品呈味得分设置为5 分,1 分表示样品没有此味道,10 分则表示该味道显著。每次品尝并记录下各个样品的味觉评分后,均需使用纯净水漱口至前样品的残留口感消除再进行下一个样品的品尝。本实验以感官评价得分为指标,并以谷氨酰胺添加量3%、5%、7%、9%(m/m),谷氨酰胺酶添加量2%、3%、4%、5%(m/m),γ-谷氨酰基化处理时间1、2、3、4 h为条件,对γ-谷氨酰基化反应的工艺进行优化。
1.3.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)法测定肽分子质量分布
将冷冻干燥鸡胸肉、C1、C2样品分别用超纯水溶解至10 mg/mL后,以体积比4∶1加入5×蛋白上样缓冲液,沸水浴加热5 min,降至室温后用高速冷冻离心机4 ℃、10 000 r/min离心2 min,待用。电泳条件:分离胶12%、浓缩胶5%;恒压电泳80 V、30 min,调至120 V,电泳90 min;停止电泳,置于固定液浸泡30 min,加入考马斯亮蓝染色液染色30 min,加入脱色剂脱色至条带清晰可见。
1.3.4 HPLC法测定肽分子质量分布
采用HPLC仪对冷冻干燥鸡胸肉、C1、C2样品进行肽分子质量的测定。色谱柱:TSKgel-G2000-SWXL(7.8 mm×300 mm);流动相为40∶60∶0.1(V/V)的乙腈-水-三氟乙酸;流速0.5 mL/min;柱温30 ℃;紫外检测波长214 nm;进样量20 μL,所有样品进样检测前需经0.22 μm滤膜过滤。选择细胞色素c(12 384 Da)、抑肽酶(6 511 Da)、杆菌肽(1 423 Da)、氧化型谷胱甘肽(621 Da)和Gly-Gly-Gly(189 Da)作为肽相对分子质量校正曲线的标准品。
1.3.5 游离氨基酸分析
采用全自动氨基酸分析仪测定C1和C2样品中游离氨基酸含量。取适量的样品溶解于超纯水,待样品充分溶解并均质后,于室温静置提取30 min,后用50 mL容量瓶定容,使样品溶液质量浓度为10 mg/mL。取4 mL定容后的溶液与1 mL 15 g/100 mL磺基水杨酸混合均匀,置于4 ℃冰箱中冷藏静置60 min,再于高速冷冻离心机4 ℃、10 000 r/min离心15 min,取上清液重复上述离心步骤;所得上清液经0.22 μm滤膜过滤后,使用全自动氨基酸分析仪进行检测。
1.3.6 γ-谷氨酰基化鸡肉蛋白酶解液中γ-谷氨酰肽的鉴定
参照Yang Juan等[21]的方法并稍作修改,采用HPLC-四极杆飞行时间-串联质谱(HPLC-quadrupole-time of flight-tandem mass spectrometry,HPLC-Q-TOF-MS/MS)法进行γ-谷氨酰基化鸡肉蛋白酶解液中γ-谷氨酰肽的鉴定。超滤组分采用Acquity UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm)进行色谱分离。采用二元流动相:流动相A:0.1%(V/V)甲酸;流动相B:含0.1%(V/V)甲酸的乙腈;流速0.3 mL/min。线性梯度洗脱程序:0~2 min,0%~15% B;2~5 min,15%~80% B;5~8 min,80% B;8~10 min,80%~15% B;10~12 min,15% B,柱温保持在40 ℃,进样量5 μL。采用双射流电离的Agilent 6545 Q-TOF-MS/MS系统进行分析。采用正离子模式,碰撞气体为氮气。参数设置:干气温度325 ℃;干气流量8 L/min;雾化器压力35 psi;护套气体温度325 ℃;护套气流量11 L/min;喷嘴电压500 V;毛细管电压3 500 V;碰撞能量分别设置为10、20、30 V;质谱扫描范围m/z 50~1 100。为获得高精度的质量测量,TOF参考混合物被用于正离子和负离子模式。使用MassHunter Qualitative Analysis B.07.00软件对γ-谷氨酰基多肽进行定性鉴定。通过对[M+H]+的质量信号峰进行质量分子提取实现定量分析,并对每个鉴定的分子进行峰比对和峰面积积分。
1.3.7 Caco-2细胞模型的抗炎活性实验
Caco-2细胞培养:以2×105 cells/mL的密度于48 孔板中培养,并生长5~7 d,直到获得密度80%的融合单层细胞,每2~3 d更换1 次新鲜培养基(含20%胎牛血清、1%青霉素-链霉素双抗的DMEM培养基)。用Hank’s缓冲盐溶液洗涤汇合的细胞,分别向细胞中加入10 mg/mL C1、C2样品,孵育2 h,加入2 ng/mL TNF-α以刺激炎症,反应4 h后,收集细胞培养上清液,用酶联免疫吸附法测定各组TNF-α、白细胞介素8(interleukin 8,IL-8)水平。
1.4 数据处理
每组实验进行3 次平行测定。采用SPSS 26.0软件对实验数据进行显著性差异分析,并采用Origin 2018软件作图。
2 结果与分析
2.1 鸡肉蛋白酶解物及其γ-谷氨酰基化产物的感官分析
由图1A可知,鸡肉蛋白经酶水解后,鲜味、浓厚味略有增强,这归因于中性蛋白酶、风味蛋白酶具有内切酶和外切酶属性,在适宜条件下能高效地将多肽和游离氨基酸从鸡肉蛋白中释放出来,进而生成更多呈味氨基酸。在加入谷氨酰胺酶后,C2样品的咸味、鲜味和浓厚味均显著强于C1(P<0.05),证实γ-谷氨酰基化能极大提升酶解物的呈味效果[18-20],与Li Qian等[18]对猪血红蛋白和猪肉酶解液进行γ-谷氨酰基化反应后的感官评价对比结果一致。产生该现象的原因可能为谷氨酰胺酶能够催化酶解液生成γ-谷氨酰二肽和γ-谷氨酰多肽,鸡肉蛋白酶解液中游离氨基酸或小肽作为γ-谷氨酰化的受体部分与外源添加的供体部分(谷氨酰胺)结合,形成新的具有增鲜、提高食物浓厚味作用的γ-谷氨酰基化合物[22-24]。由此可见,γ-谷氨酰基化可以提高鸡肉蛋白酶解物的味道,且有利于其作为食品成分的应用。因此,以感官评分为指标,对谷氨酰胺添加量、谷氨酰胺酶添加量和酶催化时间进行优化,如图1B~D所示,谷氨酰胺添加量7%、谷氨酰胺酶添加量4%、γ-谷氨酰基化3 h为最优条件。此条件下鸡肉水解物的咸味、鲜味和浓厚味明显增强,推测该条件下γ-谷氨酰肽的产率较高。
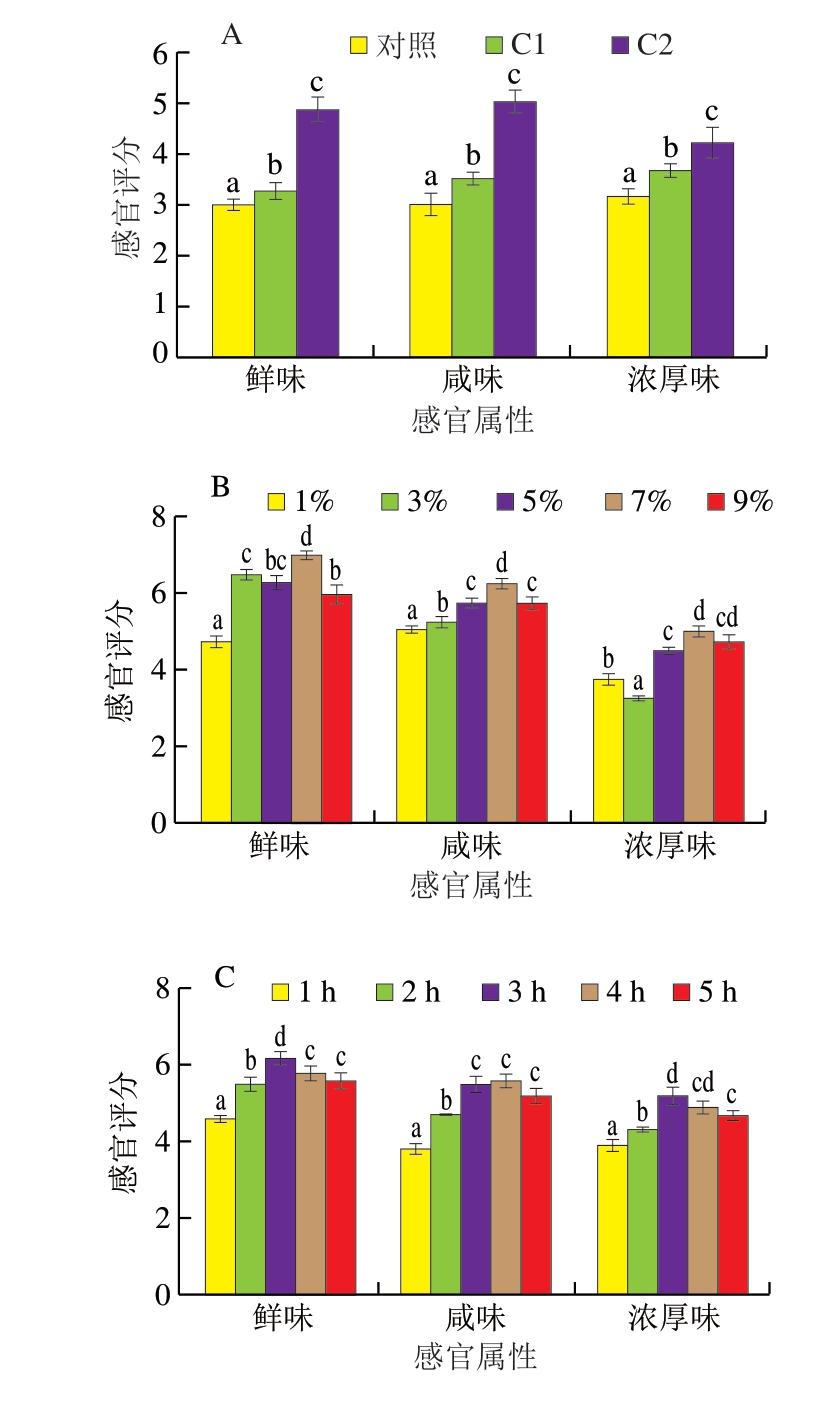
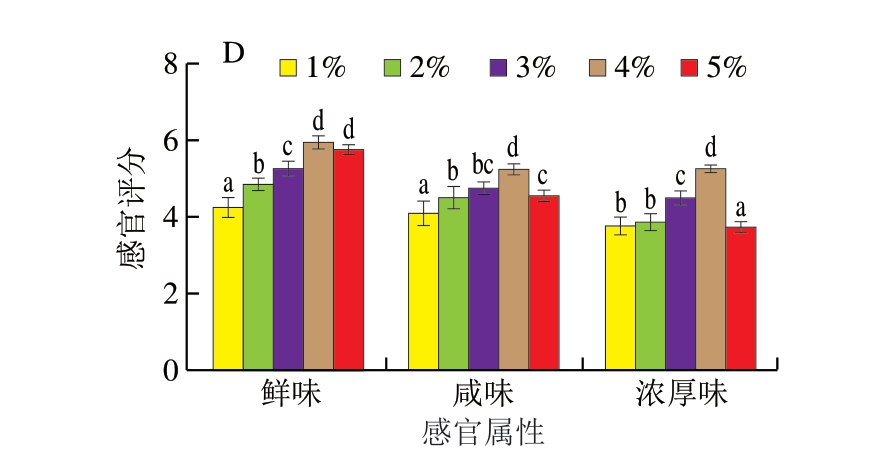
图1 鸡肉蛋白酶解前后及γ-谷氨酰基化产物感官评价结果及γ-谷氨酰化反应单因素试验结果
Fig. 1 Sensory scores of chicken protein, CPH, and GCPH and results of optimization of glutamylation condition by one-factor-at-a-time method
A.感官评分;B.谷氨酰胺添加量的优化;C. γ-谷氨酰基化处理时间的优化;D.谷氨酰胺酶添加量的优化。小写字母不同表示不同样品的同一指标间差异显著(P<0.05)。图4~6同。
2.2 SDS-PAGE法测定肽分子质量分布结果
鸡肉蛋白经过充分的酶解后,大分子肽可被酶解为小分子肽和游离氨基酸。由图2可知,未经酶解的鸡肉蛋白分子质量在6.5~270 kDa均有分布,主要集中在40、8 kDa,经中性蛋白酶和风味蛋白酶处理后,C1电泳条带主要分布在6.5 kDa,推测鸡肉蛋白中多数的大分子蛋白质能够被中性蛋白酶和风味蛋白酶酶解成分子质量6.5 kDa左右的小分子物质。对鸡肉蛋白酶解物进行γ-谷氨酰基化后,C2条带集中于<6.5 kDa的区间。
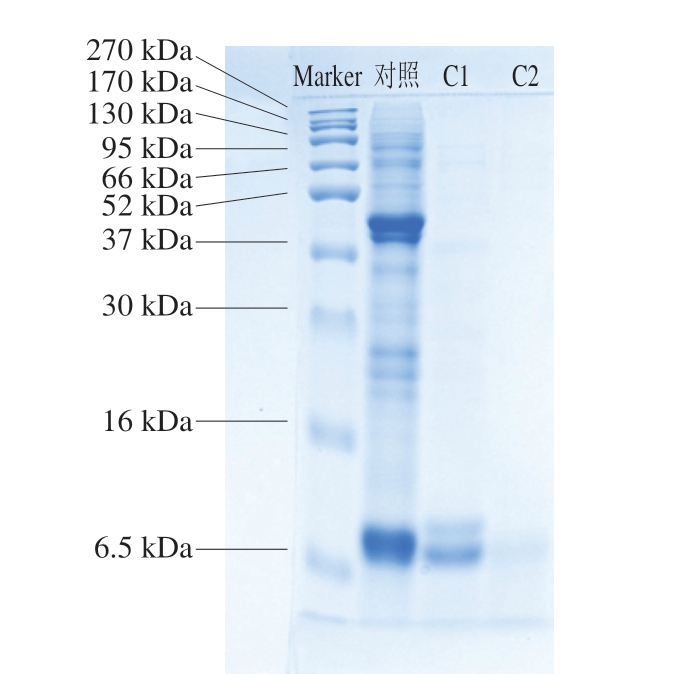
图2 鸡肉蛋白酶解前后及γ-谷氨酰基化产物SDS-PAGE图
Fig. 2 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis patterns of chicken protein, CPH, and GCPH
酶解及对酶解物γ-谷氨酰基化均能使鸡肉蛋白小分子肽与游离氨基酸等小分子物质含量增加,除能够增加鸡肉的风味外,还具有一定功能性[25]。通常分子质量<5 kDa的小分子肽可以增进或改善食品风味[26]。Kong Yan等[27]为分离和鉴定非挥发性鲜味化合物,制备鸡汤和鸡肉水解产物并分析其馏分,结果表明,鸡肉酶解物中的鲜味肽含量显著高于鸡汤,这与本研究感官评价结果一致。同时,许多小分子肽还具有优良的生物活性[28-30],Yu Wenlin等[31]研究表明,鸡肉经酶解后能够产生抗炎肽;郑华等[29]发现,鸡肉酶解物具有显著的抗疲劳和抗氧化效果。
2.3 HPLC法测定肽分子质量分布结果
由图3可知,鸡肉蛋白中以分子质量>5 kDa的蛋白质为主,其相对含量约为63%,而酶解后,分子质量>5 kDa的肽相对含量明显下降,分子质量3~5、1~3、<1 kDa的肽相对含量均有所增加,分子质量<1 kDa的肽增加最为明显,这是由于鸡肉蛋白经酶解后,大分子肽会被分解为小分子肽。研究表明,肽的功能及其生物活性与肽的分子质量相关,蛋白质酶解是生产对人类健康具有营养价值的生物活性肽成分的可行方法。李自会等[32]将鸡骨架和鸡胸肉复合底物酶解3 h后,发现酶解产物中小分子肽和氨基酸的相对含量高于90%,分子质量<1 kDa的肽大多具有一定的功能活性,如抗氧化、抗疲劳等作用[29,33]。
图3 鸡肉蛋白酶解前后及其γ-谷氨酰化产物肽分子质量分布
Fig. 3 Molecular mass distribution of peptides from chicken protein,CPH, and GCPH
鸡肉蛋白酶解液经γ-谷氨酰基化处理后,分子质量<1 kDa的肽相对含量进一步增加,这是由于谷氨酰胺酶和谷氨酰胺的加入与酶解物中的氨基酸和小肽发生反应,生成相应的γ-谷氨酰肽[34]。Chen Peiwen等[35]研究表明,对牛肉蛋白水解物进行γ-谷氨酰基化,能够提高其整体口感和胃肠道激素促分泌和抗炎能力。由此可见,γ-谷氨酰基化在鸡肉蛋白的再加工利用方面具有一定潜力。
2.4 鸡肉蛋白酶解物及其γ-谷氨酰基化产物氨基酸含量变化
如图4所示,通过测定C1和C2中游离氨基酸含量的变化,发现经γ-谷氨酰基化处理后,样品中各种游离氨基酸均有所消耗,Asp、Leu、Phe、Lys、Arg、Glu等氨基酸的含量显著下降(P<0.05),且鸡肉蛋白酶解液γ-谷氨酰基化后的总游离氨基酸含量(145.00 mg/g)显著低于酶解液(208.30 mg/g)(P<0.05),推测减少的氨基酸作为受体与谷氨酰胺生成新的γ-谷氨酰肽,与Li Qian[19]、Xia Xiaozhou[20]等研究结果一致。而Amino等[36]研究表明,分子质量<1 kDa的γ-谷氨酰肽可以使食物产生浓厚味,与本研究感官结果相互印证。
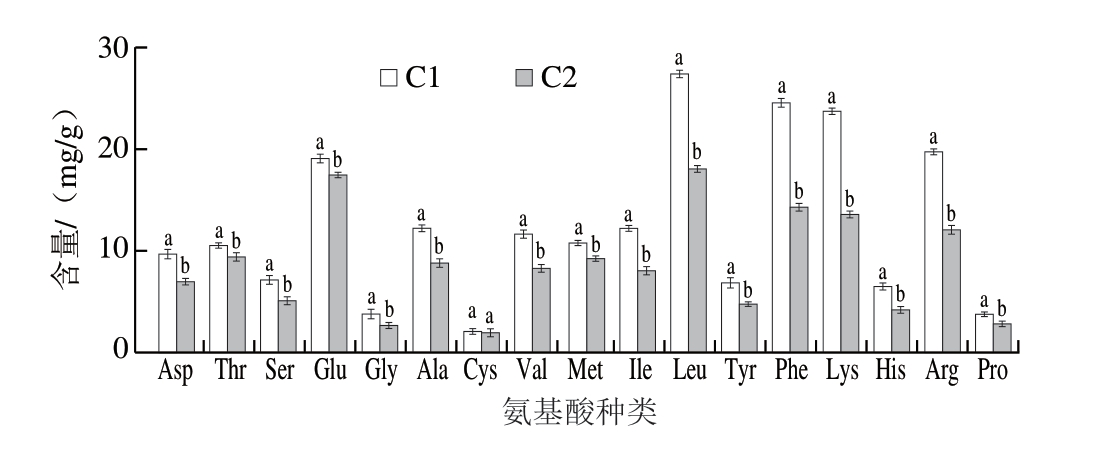
图4 鸡肉蛋白酶解物及其γ-谷氨酰化产物中氨基酸含量变化
Fig. 4 Comparison of amino acid contents of CPH and GCPH
2.5 γ-谷氨酰基化鸡肉蛋白酶解液中γ-谷氨酰肽的鉴定结果
如表1所示,共鉴定出20 个γ-谷氨酰肽,包括11 个γ-[Glu]n-AA(n=1或2)和9 个γ-Glu-AA-AA,具有“Kokumi”特性的γ-谷氨酰肽通常以二肽、三肽为主。含有Glu序列和N端为γ-谷氨酰残基的特性是γ-谷氨酰肽能够增强食物浓厚感的关键因素[37],而其浓厚味的强弱则与γ-谷氨酰肽分子质量有关[38]。在γ-谷氨酰化鸡肉蛋白酶解液中检出的所有γ-谷氨酰二肽均具有“Kokumi”特性,其中γ-Glu-Phe、γ-Glu-Trp、γ-Glu-Val、γ-Glu-Met已被证实具有抗炎和促进肠道健康的作用[39]。
表1 从鸡肉蛋白酶解液γ-谷氨酰基化产物中检测到的γ-谷氨酰肽
Table 1 Contents of γ-glutamyl peptides in GCPH
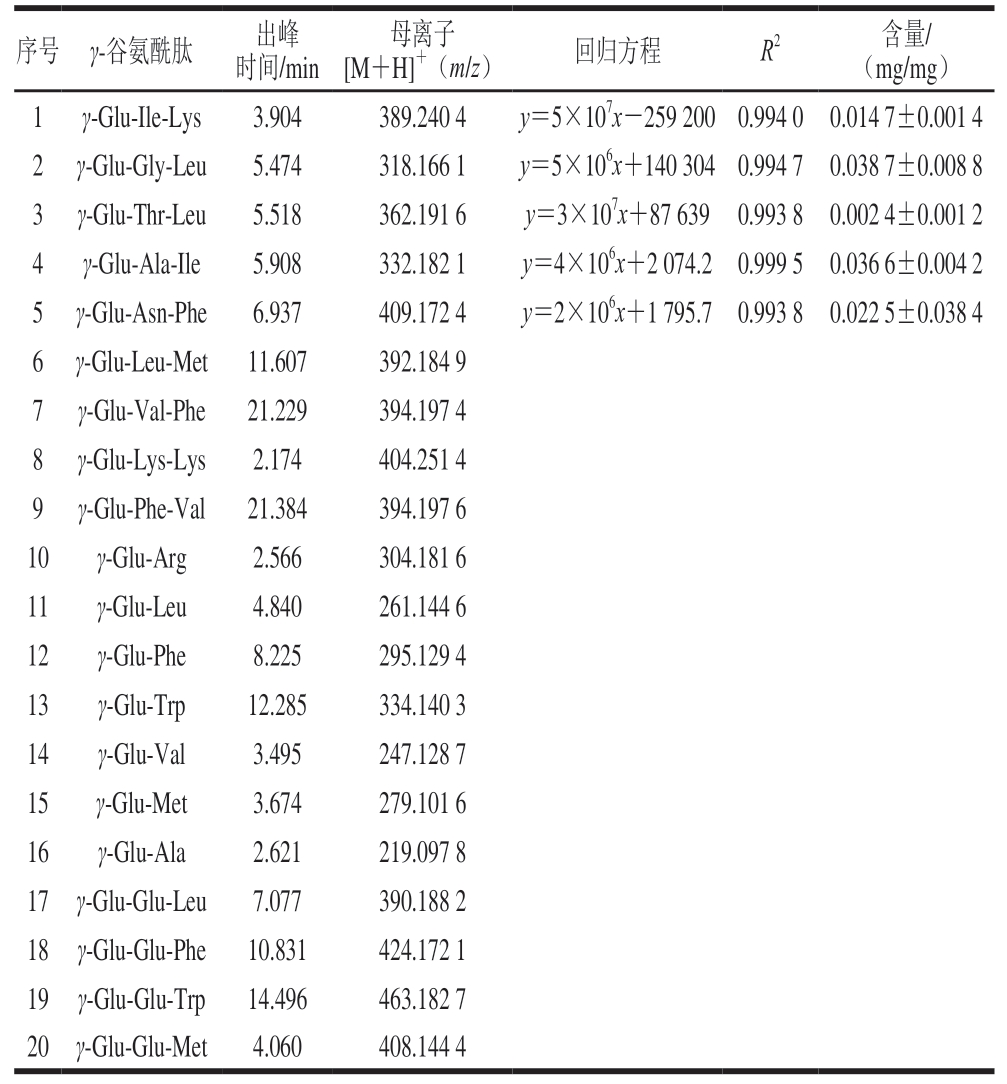
注:仅对序号1~5的γ-谷氨酰肽进行了定量分析。
[M+H]+(m/z)回归方程R2含量/(mg/mg)1γ-Glu-Ile-Lys3.904389.240 4y=5×107x-259 2000.994 00.014 7±0.001 4 2γ-Glu-Gly-Leu5.474318.166 1y=5×106x+140 3040.994 70.038 7±0.008 8 3γ-Glu-Thr-Leu5.518362.191 6y=3×107x+87 6390.993 80.002 4±0.001 2 4γ-Glu-Ala-Ile5.908332.182 1y=4×106x+2 074.20.999 50.036 6±0.004 2 5γ-Glu-Asn-Phe6.937409.172 4y=2×106x+1 795.70.993 80.022 5±0.038 4 6γ-Glu-Leu-Met11.607392.184 9 7γ-Glu-Val-Phe21.229394.197 4 8γ-Glu-Lys-Lys2.174404.251 4 9γ-Glu-Phe-Val21.384394.197 6 10γ-Glu-Arg2.566304.181 6 11γ-Glu-Leu4.840261.144 6 12γ-Glu-Phe8.225295.129 4 13γ-Glu-Trp12.285334.140 3 14γ-Glu-Val3.495247.128 7 15γ-Glu-Met3.674279.101 6 16γ-Glu-Ala2.621219.097 8 17γ-Glu-Glu-Leu7.077390.188 2 18γ-Glu-Glu-Phe10.831424.172 1 19γ-Glu-Glu-Trp14.496463.182 7 20γ-Glu-Glu-Met4.060408.144 4序号γ-谷氨酰肽出峰时间/min母离子
2.6 鸡肉蛋白酶解物及其γ-谷氨酰基化产物的抗炎作用
由图5、6可知,C1和C2均能显著下调促炎因子TNF-α、IL-8的表达水平(P<0.05),与对照组相比,经过酶解液预处理后,TNF-α、IL-8含量分别降低19%和15%,加入γ-谷氨酰化产物后,TNF-α、IL-8含量分别降低22%和17%,且C2下调促炎因子的能力优于C1,说明鸡肉蛋白酶解物能起到缓解炎症反应的作用[24-25],而鸡肉蛋白酶解物的γ-谷氨酰基化产物具有更强的抗炎作用。Yu Wenlin等[31]对废鸡肉蛋白酶解物的抗炎作用进行研究,对潜在肽段进行进一步分离,并测定其IL-6抑制活性,结果表明,在巨噬细胞U937模型中,废鸡肉蛋白酶解物表现出IL-6抑制活性。Xing Lujuan等[40]通过小鼠3T3-L1细胞系的体外模型研究γ-Glu-Val在脂肪细胞中的抗炎作用,结果表明,γ-Glu-Val介导的钙敏感受体激活可以抑制TNF-α诱导的脂肪细胞炎症,还可抑制胰岛素抵抗期间的炎症。Zhang Hua等[17]基于肠上皮Caco-2细胞的体外模型和葡聚糖硫酸钠诱导的结肠炎小鼠模型,证明γ-Glu-Cys和γ-Glu-Val可以通过激活钙敏感受体维持肠道稳态并缓解结肠炎症。由此可以推测,经γ-谷氨酰基化后,鸡肉蛋白酶解液下调促炎因子TNF-α、IL-8的能力更强,这是由于具有抗炎功能的γ-谷氨酰基肽的生成使促炎因子TNF-α、IL-8的表达得到缓和,将炎症下调至正常水平。综上所述,鸡肉蛋白酶解物及其γ-谷氨酰基化产物有望成为抗炎生物活性肽的来源。
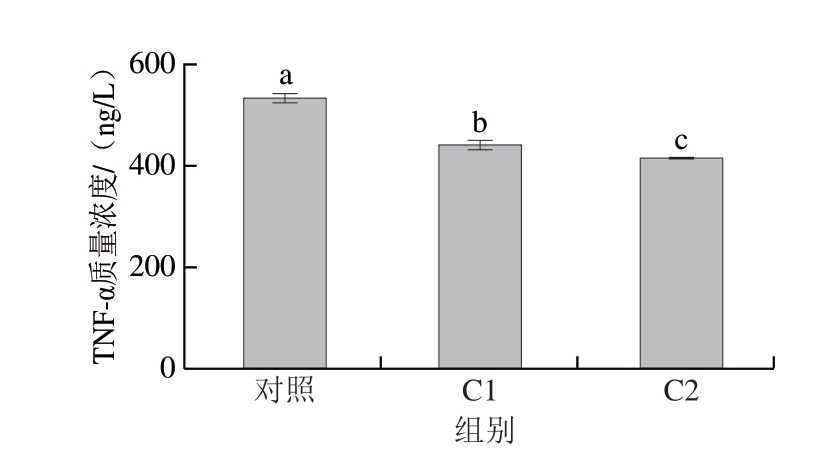
图5 鸡肉蛋白酶解物及其γ-谷氨酰化产物对TNF-α表达的影响
Fig. 5 Effect of CPH and GCPH on TNF-α expression in Caco-2 cells
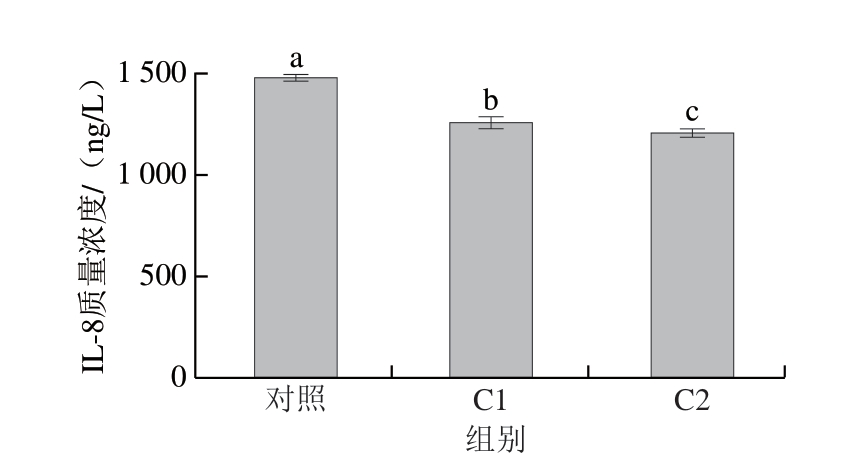
图6 鸡肉蛋白酶解物及其γ-谷氨酰化产物对IL-8表达的影响
Fig. 6 Effect of CPH and GCPH on IL-8 expression in Caco-2 cells
3 结论
本研究对鸡肉蛋白酶解物γ-谷氨酰基化的条件进行优化,得到最优条件为谷氨酰胺添加量7%、谷氨酰胺酶添加量4%、γ-谷氨酰基化3 h。以最优γ-谷氨酰基化条件为基础,探索鸡肉蛋白水解物的γ-谷氨酰基化改性作用。结果表明,γ-谷氨酰肽的生成增加了鸡肉蛋白水解物的咸味、鲜味及浓厚味感,下调了促炎因子表达,起到缓解炎症反应的作用,为鸡肉酶解物及其γ-谷氨酰基化产物的抗炎作用研究提供了理论基础。γ-谷氨酰基化处理作为鸡肉蛋白水解物的精深加工技术具有应用价值。
[1] 郝志林, 梁莉, 刘贺, 等. 热预处理对鸡胸肉和鸡骨泥滋味物质的影响[J]. 食品科学技术学报, 2022, 40(4): 107-115. DOI:10.12301/spxb202100314.
[2] 汤龙, 宋焕禄, 王丽金. 不同分子质量大豆蛋白和鸡肉酶解物的美拉德反应产物风味特征分析[J]. 食品科学技术学报, 2023, 41(3):148-162. DOI:10.12301/spxb202200174.
[3] YUE Z Y, LAI J, LI Q Q, et al. Enhancement of nutritional,organoleptic, and umami qualities of chicken soup induced by enzymatic pre-treatment of chicken[J]. Food Chemistry: X, 2024, 24:101914. DOI:10.1016/j.fochx.2024.101914.
[4] 闫昌誉, 丁肇俊, 李晓敏, 等. 鸡源性活性肽的研究进展[J]. 今日药学, 2022, 32(1): 4-16. DOI:10.12048/j.issn.1674-229X.2022.01.002.
[5] 林捷, 郑华, 田秀秀, 等. 2 种鸡肉蛋白源酶解产物抗氧化活性研究[J]. 现代食品科技, 2019, 35(3): 111-117. DOI:10.13982/j.mfst.1673-9078.2019.3.018.
[6] 胡晓倩, 桂子康, 邓军伟, 等. 大豆发酵食品毛豆腐中活性肽的制备及功效评价[J]. 中国食品学报, 2023, 23(3): 217-228. DOI:10.16429/j.1009-7848.2023.03.023.
[7] 刘天红, 王颖, 李红艳, 等. 沙蚕不同蛋白酶酶解产物滋味特征及聚类分析研究[J]. 食品安全质量检测学报, 2021, 12(21): 8351-8358.DOI:10.19812/j.cnki.jfsq11-5956/ts.2021.21.007.
[8] 司蕊, 章超桦, 曹文红, 等. 冻藏对水煮及酶解马氏珠母贝肉提取物呈味特性的影响[J]. 食品科学技术学报, 2021, 39(3): 62-72.DOI:10.12301/j.issn.2095-6002.2021.03.007.
[9] NI Y H, WANG Z R, ZHUGE F, et al. Hydrolyzed chicken meat extract and its bioactive cyclopeptides protect neural function by attenuating inflammation and apoptosis via PI3K/AKT and AMPK pathways[J]. Journal of Agricultural and Food Chemistry, 2024,72(30): 16708-16725. DOI:10.1021/acs.jafc.4c02063.
[10] WU J H, ZHANG M, QIU L Q, et al. Application of efficient pretreatment by physical fields for improving the taste and flavor of processed chicken enzymatic hydrolysate[J]. Journal of Food Processing and Preservation, 2022, 46(10): e16921. DOI:10.1111/jfpp.16921.
[11] TAN X Y, QI L B, FAN F J, et al. Analysis of volatile compounds and nutritional properties of enzymatic hydrolysate of protein from cod bone[J]. Food Chemistry, 2018, 264: 350-357. DOI:10.1016/j.foodchem.2018.05.034.
[12] KIM N. A comparative study on properties of fish meat hydrolysates produced by an enzymatic process at high pressure[J]. Food Science and Biotechnology, 2020, 29(1): 75-83. DOI:10.1007/s10068-019-00648-y.
[13] ARIHARA K, YOKOYAMA I, OHATA M. Bioactivities generated from meat proteins by enzymatic hydrolysis and the Maillard reaction[J]. Meat Science, 2021, 180: 108561. DOI:10.1016/j.meatsci.2021.108561.
[14] 杨娟, 廖剑洪, 郭晶, 等. 微生物γ-谷氨酰转肽酶分子改造合成γ-谷氨酰化合物的研究进展[J]. 中国调味品, 2022, 47(9): 214-220.DOI:10.3969/j.issn.1000-9973.2022.09.043.
[15] 伍圆明, 伍伦杰, 王莉, 等. γ-Kokumi肽及其合成酶γ-谷氨酰转肽酶的研究进展[J]. 食品科学, 2020, 41(5): 256-265. DOI:10.7506/spkx1002-6630-20190127-352.
[16] 杨梦雨, 钟浩, 杨开, 等. Caco-2细胞模型评价食品功能因子的吸收、代谢及其功能研究进展[J]. 中国食品学报, 2022, 22(10): 363-377. DOI:10.16429/j.1009-7848.2022.10.038.
[17] ZHANG H, KOVACS-NOLAN J, KODERA T, et al. γ-Glutamyl cysteine and γ-glutamyl valine inhibit TNF-α signaling in intestinal epithelial cells and reduce inflammation in a mouse model of colitis via allosteric activation of the calcium-sensing receptor[J]. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease, 2015, 1852(5):792-804. DOI:10.1016/j.bbadis.2014.12.023.
[18] LI Q, LIU J, DE GOBBA C, et al. Production of taste enhancers from protein hydrolysates of porcine hemoglobin and meat using Bacillus amyloliquefaciens γ-glutamyltranspeptidase[J]. Journal of Agricultural and Food Chemistry, 2020, 68(42): 11782-11789. DOI:10.1021/acs.jafc.0c04513.
[19] LI Q, ZHANG L T, LAMETSCH R. Increase of kokumi γ-glutamyl peptides in porcine hemoglobin hydrolysate using bacterial γ-glutamyltransferase[J]. Journal of Agricultural and Food Chemistry,2022, 70(50): 15894-15902. DOI:10.1021/acs.jafc.2c07045.
[20] XIA X Z, FU Y, MA L, et al. Protein hydrolysates from Pleurotus geesteranus modified by Bacillus amyloliquefaciens γ-glutamyl transpeptidase exhibit a remarkable taste-enhancing effect[J]. Journal of Agricultural and Food Chemistry, 2022, 70(38): 12143-12155.DOI:10.1021/acs.jafc.2c03941.
[21] YANG J, GUO S Q, ZENG X F, et al. Synthesis of taste active γ-glutamyl peptides with pea protein hydrolysate and their taste mechanism via in silico study[J]. Food Chemistry, 2024, 430: 136988.DOI:10.1016/j.foodchem.2023.136988.
[22] WANG H R, SUO R, LIU X B, et al. Kokumi γ-glutamyl peptides:some insight into their evaluation and detection, biosynthetic pathways,contribution and changes in food processing[J]. Food Chemistry Advances, 2022, 1: 100061. DOI:10.1016/j.focha.2022.100061.
[23] TU J, GUO J, DONG H, et al. Novel umami-, salty-, and kokumienhancing γ-glutamyl tripeptides synthesized with the bitter dipeptides from defatted peanut meal protein hydrolysate[J]. Journal of Agricultural and Food Chemistry, 2023, 71(20): 7812-7819.DOI:10.1021/acs.jafc.3c01467.
[24] LI Z L, ZHU R T, LIU Y Q, et al. γ-Glutamyltranspeptidase from Bacillus amyloliquefaciens: transpeptidation activity enhancement and L-theanine production[J]. Enzyme and Microbial Technology, 2020,140: 109644. DOI:10.1016/j.enzmictec.2020.109644.
[25] 肖雪, 钱明莉, 范江平, 等. 鸡肉酶解工艺及其产物功效研究进展[J]. 食品工业科技, 2021, 42(14): 394-400. DOI:10.13386/j.issn1002-0306.2020070239.
[26] 刘希, 侯莎. 呈味肽的分类及呈味效果定量评价方法综述[J]. 食品安全导刊, 2022(31): 141-145. DOI:10.16043/j.cnki.cfs.2022.31.005.
[27] KONG Y, YANG X, DING Q, et al. Comparison of non-volatile umami components in chicken soup and chicken enzymatic hydrolysate[J].Food Research International, 2017, 102: 559-566. DOI:10.1016/j.foodres.2017.09.038.
[28] 傅丽娟, 邢路娟, 张万刚. 食源性抗炎活性肽的研究进展[J].中国食品学报, 2022, 22(8): 343-352. DOI:10.16429/j.1009-7848.2022.08.037.
[29] 郑华, 莫妮妹, 戴妍, 等. 鸡肉酶解物提高小鼠的抗疲劳及抗氧化活性[J]. 现代食品科技, 2020, 36(6): 9-16; 39. DOI:10.13982/j.mfst.1673-9078.2020.6.1079.
[30] 戴妍, 林捷, 郑华, 等. 鸡肉酶解物对HepG2细胞抗氧化活性及小鼠血清抗氧化酶活性的影响[J]. 食品工业科技, 2020, 41(15): 310-314;331. DOI:10.13386/j.issn1002-0306.2020.15.048.
[31] YU W L, FIELD C J, WU J P. Purification and identification of anti-inflammatory peptides from spent hen muscle proteins hydrolysate[J]. Food Chemistry, 2018, 253: 101-107. DOI:10.1016/j.foodchem.2018.01.093.
[32] 李自会, 段晓杰, 刘昆仑, 等. 鸡骨架和鸡胸肉复合底物酶解工艺优化及产物呈味特性研究[J]. 食品工业科技, 2023, 44(15): 184-192.DOI:10.13386/j.issn1002-0306.2022090009.
[33] MOGHADAM M, SALAMI M, MOHAMMADIAN M, et al.Physicochemical and bio-functional properties of walnut proteins as affected by trypsin-mediated hydrolysis[J]. Food Bioscience, 2020, 36:100611. DOI:10.1016/j.fbio.2020.100611.
[34] SUZUKI H, NAKAFUJI Y, TAMURA T. New method to produce kokumi seasoning from protein hydrolysates using bacterial enzymes[J]. Journal of Agricultural and Food Chemistry, 2017, 65(48):10514-10519. DOI:10.1021/acs.jafc.7b03690.
[35] CHEN P W, ZENG X F, BAI W D, et al. γ-Glutamylation of beef protein hydrolysates to improve its overall taste and functions of gastro-intestinal hormone (CCK and GLP-1) pro-secretion and antiinflammation[J]. Food Chemistry, 2024, 452: 139466. DOI:10.1016/j.foodchem.2024.139466.
[36] AMINO Y, NAKAZAWA M, KANEKO M, et al. Structure-CaSRactivity relation of kokumi γ-glutamyl peptides[J]. Chemical &Pharmaceutical Bulletin, 2016, 64(8): 1181-1189. DOI:10.1248/cpb.c16-00293.
[37] 姚玉静, 崔春, 黄俊伟. γ-谷氨酰肽呈味特性、鉴定及制备方法研究进展[J]. 中国调味品, 2016, 41(3): 146-152. DOI:10.3969/j.issn.1000-9973.2016.03.036.
[38] 辛世华, 韩小珍, 贺晓光. 食品中γ-谷氨酰肽的研究进展[J]. 中国酿造, 2021, 40(12): 22-28. DOI:10.11882/j.issn.0254-5071.2021.12.005.
[39] LU Y J, WANG J, SOLADOYE O P, et al. Preparation, receptors,bioactivity and bioavailability of γ-glutamyl peptides: a comprehensive review[J]. Trends in Food Science & Technology, 2021, 113: 301-314.DOI:10.1016/j.tifs.2021.04.051.
[40] XING L J, ZHANG H, MAJUMDER K, et al. γ-Glutamylvaline prevents low-grade chronic inflammation via activation of a calciumsensing receptor pathway in 3T3-L1 mouse adipocytes[J]. Journal of Agricultural and Food Chemistry, 2019, 67(30): 8361-8369.DOI:10.1021/acs.jafc.9b02334.