牦牛(Bos mutus或Bos grunniens),别名西藏牛[1],偶蹄目牛科牛属哺乳动物,具有耐高寒[2]、耐劳苦、抗病力强等特性,能在缺氧、寒冷、恶劣的高海拔地区生存并为人类所用[3],故有“高原之舟”的美誉,是极为宝贵的稀有畜种。在世界范围内,牦牛主要分布于中国青藏高原及毗邻的高山及亚高山半湿润寒冷地区,且以青藏高原为中心呈辐射状分布。从东部的中国川甘青地区延伸至西部的阿富汗、巴基斯坦、俄罗斯等国家[4],从北部的蒙古国拓展至南部的印度、缅甸、尼泊尔等国家。近几年,欧美地区也逐渐开始引入牦牛。我国牦牛畜种发展历史悠久[5],是牦牛的起源地[6]。作为仅次于黄牛、水牛的主要牛种[7],我国牦牛数量占世界牦牛总数的95%以上[8],数量优势明显。
牦牛浑身都是宝。除了新鲜牦牛肉被广泛消费外,牦牛骨、牦牛乳、牦牛皮、牦牛血等副产物也具有极高的利用价值,近年牦牛副产物及相关产品研究详见表1。其中,牦牛血作为牦牛屠宰加工过程中的主要副产物之一,其营养成分相比其他动物血液更为丰富。牦牛血液中血红素的含量约为猪血的3 倍,免疫球蛋白(immunoglobulin,Ig)G含量也为普通肉牛血液含量的3 倍[9]。另有研究[10]表明,玛多牦牛血液中的血红蛋白含量高达163.4 g/L,明显高于黄牛的血红蛋白含量(117.8 g/L)。与此同时,牦牛全血蛋白质量分数约为15.5%,蛋白质在血浆中的占比为6.9%,在血细胞中的占比为32.7%,这使得牦牛血成为一种非常理想的动物蛋白资源[11]。然而,由于牦牛血存在血腥味重、色泽感官不佳、适口性和消化性较低及贮存困难等问题[9],牦牛血液被大量丢弃或排放,只有少部分被加工为血肠、血豆腐等初级产品,利用率极低,造成了严重的血液资源浪费和环境污染。
表1 牦牛主要副产物及其已开发的主要产品
Table 1 Main by-products of yak and main products that have been developed from them

牦牛主要副产物当前已开发的主要产品参考文献牦牛骨牦牛骨粉、牦牛骨胶原蛋白肽、牦牛骨汤、牦牛骨发酵类食品等[12]牦牛乳牦牛乳粉、牦牛奶酪、牦牛酸奶、牦牛奶茶、牦牛奶皮等[13]牦牛皮牦牛皮革、牦牛皮胶等[14]牦牛血牦牛血肠、牦牛血粉等[15-16]
因此,本文聚焦于牦牛血中蛋白类活性成分,对蛋白类活性成分的功能特性及开发技术进行综述,同时介绍牦牛血产品开发利用的研究进展,最后对牦牛血资源未来的发展趋势进行展望。重视并加强牦牛血资源的开发和利用不仅有助于实现血液资源的合理及高效利用,还能促进生态环境保护,提高牧民经济收益,推动经济与环境的可持续发展。
1 牦牛血的基本组成及功能特性
牦牛血主要由血浆和血细胞两部分组成,其中血浆约占血液总量的65%[17]。与其他动物血液相比,牦牛血液中的部分功能性蛋白成分含量更高,如血红蛋白、Ig等。这些活性成分有助于增强血液供氧能力和提高机体免疫力,在高原低氧环境适应、生物活性功能及应用等方面表现出显著优势。
1.1 血红蛋白
血红蛋白由血红素和珠蛋白组成,约占红细胞成分的90%。血红蛋白能够在肺部结合氧气并将其运输到全身的组织器官,同时将二氧化碳输送到体外[18],对牦牛适应高原低氧环境至关重要。研究表明,牦牛血液中的血红蛋白含量受多种因素的影响,如海拔高度、有无牛角及地区气候等。玛多牦牛血液中的血红蛋白含量明显高于低海拔地区的黄牛[10],且无角牦牛血红蛋白含量高于有角牦牛[19],更能适应高原低氧的恶劣环境。Podoinitsyna等[2]研究发现,奥卡牦牛生存环境具有温度波动剧烈、降雨量少及大陆性气候特征显著等特点,因此其血液中血红蛋白含量高于外贝加尔地区牦牛。这说明奥卡牦牛血液供氧能力更强,能适应多变的气候条件。不仅如此,牦牛的血红蛋白氧亲和能力也明显高于黄牛血红蛋白,且刘颜等[20]研究发现,牦牛血红蛋白的氧合速率远高于人血红蛋白,进一步解释了牦牛在高原低氧环境下适应性强的原因。
血红素作为一类重要的天然卟啉铁化合物,是血红蛋白的主要活性中心。血红蛋白水解产物已被证明是食品中血红素铁补充剂的最佳选择[21],其铁的吸收率高达10%~25%,同时具备良好的热稳定性[22],在临床上可用于缓解缺铁性贫血症状[23]。此外,血红素也被认为是开发抗肿瘤和抗癌药物的重要原料。Park等[24]研究表明,氯化血红素能够通过抑制钙激活氯通道蛋白1达到抗前列腺癌的效果。Coló等[25]通过对氯化血红素的蛋白质组学分析,证明了其抗乳腺癌的潜力。血红素还被广泛应用于食品领域,可作为着色剂赋予肉类真实的风味和色泽[26],并能够部分替代具有潜在致癌风险的亚硝酸盐。Zhou Kai等[27]研究表明,猪血中的血红素能够有效稳定反复冻融后的猪排颜色及气味。而牦牛血液中血红素含量会随着生活海拔升高而增加,且其血红素的含量约为猪血的3 倍[1]。因此,开发和利用牦牛血中的血红蛋白对于拓展食品添加剂种类、提升食品安全性及拓宽抗癌药物原料来源、降低药物生产成本具有深远意义。
1.2 Ig
Ig是一类广泛分布于哺乳动物血液中的球蛋白,具有抗病毒、抗菌、抗感染、增强免疫力等多种功能[28]。近年来,Ig在临床上的应用日益广泛,可用于治疗由肠道致病菌引起的腹泻、缓解疼痛及治疗皮肤病等,是一种极具临床价值的蛋白质[11]。其中,IgG是血清中Ig的主要成分,约占血液总Ig含量的75%~80%,是动物机体抵抗感染的重要免疫活性物质[5]。Liu Di等[29]研究表明,在肾活体组织检查时,IgG水平的降低与IgA肾病患者的病情恶化呈正相关,因此IgG水平可作为预测IgA肾病早期风险的重要指标。Saisujani等[30]提出可以通过静脉注射IgG治疗新生儿高胆红素血症。值得注意的是,牦牛血液中的IgG含量是普通肉牛血液含量的3 倍[1],显示出极高的研究潜力。
1.3 生物活性肽
生物活性肽是一种由氨基酸经肽键连接而成、介于氨基酸和蛋白质之间的小分子聚合物,其易被机体吸收且对生物机体的生命活动等有积极作用[31]。这些肽类具有多种生物学活性,如抗氧化、抗菌、抗癌、抗高血压、提高免疫力、维持肠道健康[32]、促进DNA合成及细胞生长等,同时还能改善食品的色、香、味等感官特性[33]。利用不同动物的血液蛋白制备生物活性肽并对其生物活性进行研究是目前国内外热门的研究领域。Ghalamara等[34]从鳕鱼血中分离纯化出的多肽具有良好的抗氧化和抗菌活性。Vasilchenko等[35]从鸡血中分离纯化得到2 种新型血红蛋白肽段,它们通过在大肠杆菌细胞膜上形成环形孔道实现杀菌作用,且在体外具有有效的抗菌活性。Kumari等[36]研究表明,绵羊、山羊和兔血液被胰蛋白酶水解的肽段具有抗氧化活性,且对病原微生物具有抑制作用。张冰清等[37]利用生物信息学分析软件对牛血红蛋白源抗菌肽(bovine hemoglobin-derived antimicrobial peptide,BHP)进行分析,结果表明,BHP能够与细菌细胞膜作用,从而导致菌体死亡。牦牛血中同样含有丰富的蛋白肽资源,在郝刚等[38]关于牦牛血抗菌肽分离纯化方法的研究中,其分离得到的色谱纯抗菌肽YakB-1和YakB-2具有明显的广谱抗菌活性。除此之外,肖岚[33]、杜昕[39]等制备出的牦牛血抗氧化肽具有良好的体内外抗氧化活性。同时有研究[40]表明,分子质量低于5 kDa的牦牛血蛋白肽展现出更优的体外抗氧化性能,更适用于开发具有抗氧化和抗缺氧功能的食品,从而满足消费者对健康的个性化需求。因此深入研究牦牛血中生物活性肽十分必要。
1.4 酶类
哺乳动物血液中含有的酶类种类繁多,它们在维持生理活动方面发挥着至关重要的作用。这些酶不仅参与机体的基础代谢,还在免疫调节、抗氧化、抗炎等多个生理过程中发挥关键作用。超氧化物歧化酶(superoxide dismutase,SOD)是一种抗氧化金属酶,具有抗氧化、抗炎、抗辐射、改善肠道健康、调节机体免疫等生理功能[41]。Guo Jingke等[42]发现口服SOD对2型糖尿病大鼠的降血糖作用,为其在糖尿病治疗中的应用提供了新的思路。凝血酶是另一种功能独特的酶,主要负责促进凝血过程。然而,研究表明,凝血酶不仅在止血方面具有重要作用,还具有促进软骨细胞增殖的特殊功能。朱志恒等[43]发现凝血酶对大鼠软骨细胞的增殖有显著促进作用,显示了其在组织修复中的潜力。总的来说,血液中的酶类在哺乳动物的生理活动中起到至关重要的作用,不仅在基本的生命维持功能中不可或缺,还在疾病治疗和组织修复等方面展现出广泛的应用前景。SOD和凝血酶是牦牛血中含量较为丰富的2 种酶类,有研究[44]表明,牦牛血中SOD含量高于其他动物血液;而早期有关凝血酶的提取多局限于猪血、羊血等[45],牦牛血中凝血酶的开发利用较少。因此,加强牦牛血中酶类物质的分离和提取方面的研究有助于糖尿病、消化系统疾病等的临床治疗手段拓展以及抗氧化、抗炎类药物的开发,从而进一步提升牦牛血的综合利用价值。
2 牦牛血蛋白资源开发技术研究进展
由于牦牛血蛋白资源所具有的供氧、抗氧化、抗癌、免疫调节等功能,近年来学者们针对牦牛血液蛋白资源提取与开发技术的研究逐步深入,拓宽了其在食品、医疗等领域的应用前景。当前针对牦牛血不同蛋白资源的开发技术见图1。
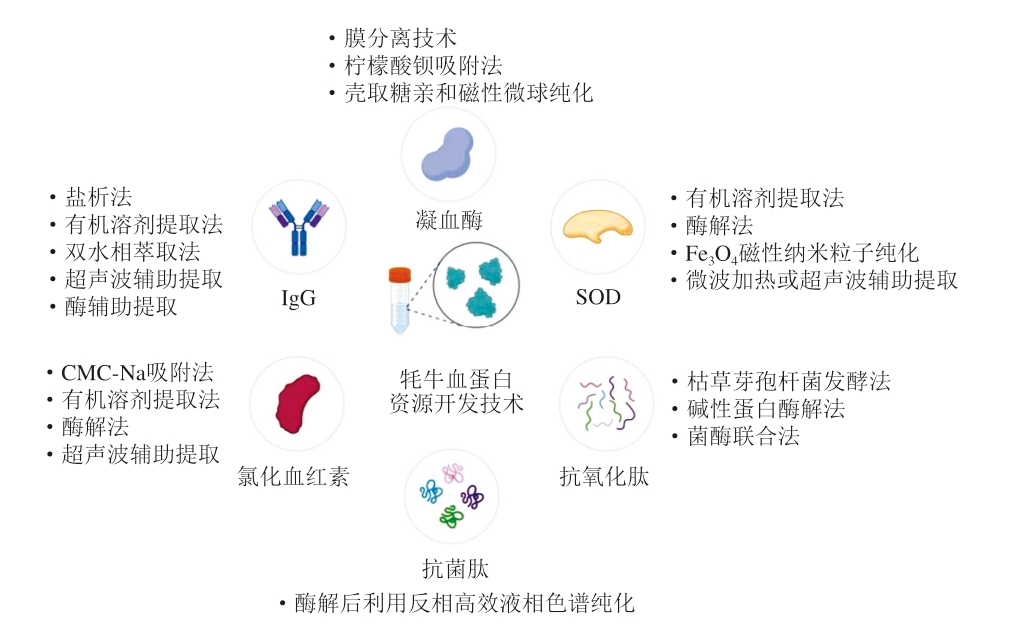
图1 牦牛血蛋白资源开发技术
Fig. 1 Techniques for the development of yak blood protein resources
CMC-Na.羧甲基纤维素钠(carboxymethylcellulose sodium)。
2.1 IgG提取技术
化学抽提法是常用的牦牛血中IgG的分离技术,其中主要包括盐析法、有机溶剂提取法和双水相法。盐析法是根据IgG在不同盐浓度下溶解度的差异从而达到提取目的,随着盐浓度的升高,盐溶液中蛋白质的溶解度逐渐下降,从而产生沉淀。金晶[28]利用饱和硫酸铵法提取牦牛血中的IgG,提取量为24.22 mg/mL。庞晨[7]用FeCl3盐析法和多聚磷酸盐沉淀法提取牦牛血中的IgG,研究表明,在最优工艺条件下IgG提取量分别为8.28 mg/mL和6.48 mg/mL。盐析法提取工艺简单、成本低,同时有效避免了有机溶剂等有害物质的污染,安全性好,但IgG纯度为61.4%,相对较低。有机溶剂提取法主要是基于IgG在不同条件下的溶解度差异及有机溶剂的沉淀作用,从而选择性地分离出IgG。金晶[46]、李延军[47]等均利用低温无水乙醇法提取牦牛血中的IgG,IgG提取量分别为9.283 mg/mL和9.205 mg/mL,结果相似。该提取方法相较于FeCl3盐析法和多聚磷酸盐沉淀法得率较高。但有机溶剂具有毒性、易挥发、回收难度较大,因此不适用于工业化生产。双水相萃取技术则是利用IgG在互不相溶的双水相间分配系数的差异进行分离。杜雨[5]比较采用聚乙二醇(polyethylene glycol,PEG)/磷酸氢二钾和PEG/羟丙基淀粉2 种双水相系统粗提牦牛血中的IgG,发现PEG/磷酸氢二钾双水相法较优,IgG提取量为13.90 mg/mL且纯度达到70%以上。该方法具有更温和的操作条件,IgG不易失活或变性,且该技术的提取量和纯度相对来说高于FeCl3盐析法、多聚磷酸盐沉淀法及低温无水乙醇法。
整体来说,单一的牦牛血IgG提取技术已经不能满足目前的产量需求,因此辅助提取技术的开发及应用极为重要。杜雨等[48]在金晶[28]以饱和硫酸铵法提取牦牛血中IgG的基础上,利用超声波进行辅助,与简单的盐析法相比静置时间可缩短65 min,IgG提取量为25.67 mg/mL。为了进一步提高提取量,肖雪莉[11]用α/β-半乳糖苷酶辅助饱和硫酸铵法提取牦牛血中的IgG,并探究最佳的工艺参数,在最佳工艺条件及2 种酶的辅助下IgG提取量均高于27 mg/mL,且与不加酶处理相比得率提高20%以上。
综上,牦牛血中IgG的提取技术主要集中于化学方法提取,利用物理抽提和酶类进行辅助,其中半乳糖苷酶对饱和硫酸铵法辅助提取牦牛血中IgG的效果相对较好,提取量能够达到27 mg/mL以上,超声波对提取也有较为明显的辅助效果。未来的研究可以进一步探索将化学提取与超声波萃取等物理抽提技术相结合,并结合多种酶类进行辅助提取,以进一步提升牦牛血IgG的提取效率。
2.2 氯化血红素提取技术
血红素广泛存在于动物的血液中,是血红蛋白主要的活性中心,由于血红素与珠蛋白分离后二价铁自动氧化为三价铁,因此氯化血红素是从动物血液中得到的主要血红素产品[49]。由于我国牦牛数量多,牦牛血资源丰富且富含血红蛋白,从中制备氯化血红素原料独特且成本低[50],因此越来越多的学者致力于从牦牛血中提取氯化血红素的研究。
CMC-Na是一种水溶性纤维素醚,常用作吸附剂提取氯化血红素。刘振斌等[51]利用超声破碎辅助CMC-Na法提取新鲜牦牛血中的氯化血红素,在最优提取工艺条件下,最终提取量为3.028 mg/mL。该提取方法操作简单、成本低,提取后氯化血红素性质稳定[49],然而其纯度相对较低,仅可达到29.42%。
酸性丙酮是一种常见的提取氯化血红素的有机溶剂,它能够在酸性条件下沉淀珠蛋白,溶解血红素。血粉法和醋酸钠法都是在酸性丙酮法基础上对氯化血红素进行提取。冰醋酸法是利用冰醋酸溶解血红蛋白并解离为珠蛋白与血红素。高子涵等[52]利用酸性丙酮从牦牛血粉中制备氯化血红素,并对超声处理时间、酸性丙酮溶液加入量、抽提时间、醋酸钠溶液加入量等进行优化,氯化血红素提取量为2.30 mg/g。杨生忠等[53]通过比较血粉法、冰醋酸法及醋酸钠法3种氯化血红素制备方法,发现利用血粉法提取新鲜牦牛血液中氯化血红素的提取量为7.38 g/L,纯度高达96%,远高于高子涵等[52]制备牦牛氯化血红素的提取量,更适于工业化生产,但该方法也有毒性大、成本高、安全性低等缺点。
近年来,酶解法因其反应条件温和、稳定、环保等优势而被广泛应用于提取牦牛血氯化血红素,其原理是通过酶解血红蛋白,从而使血红素与珠蛋白分离。贾志春[54]研究发现,在特定条件下,以质量比4∶6复配木瓜蛋白酶和中性蛋白酶酶解牦牛血红蛋白,氯化血红素提取量为6.76 μg/mL,高于单酶提取。郭晓东[49]研究发现,在最优工艺条件下,利用碱性蛋白酶酶解新鲜牦牛血,得到氯化血红素最大质量浓度为1.204 g/L,且得率较高。张晋等[55]利用超声波辅助风味蛋白酶酶解提取牦牛血粉中的氯化血红素,并探究最佳工艺条件,研究发现,与普通酶解提取相比,其得率和纯度显著提高。综合以上研究发现,尽管酶解法相比于有机溶剂提取法具有诸多优势,但是仍然存在提取效率有限、工艺较为复杂、产物纯度不高等问题。因此,未来多酶复配、新酶探索、物理辅助及高效的纯化方法应得到更深入的研究与探索。
2.3 血红蛋白生物活性肽制备技术
2.3.1 抗菌肽
抗菌肽是一类具有抗微生物活性的小分子多肽,具有抗菌活性高、稳定性强等特点,因而被广泛应用于食品和医药等领域。牛血红蛋白被认为是最有潜力的抗菌肽来源[56],其在酶解过程中可以产生多种具有抗菌活性的肽段。郝刚等[38]以牦牛血胰蛋白酶解液为原料,根据抗菌肽与大肠杆菌细胞之间的吸附结合性质,通过凝胶过滤层析确定酶解液中的目标抗菌肽,并利用反相高效液相色谱对其进行反复纯化,分离得到色谱纯抗菌肽YakB-1和YakB-2,二者对细菌和真菌都具有广谱抗菌活性,其中YakB-1对真菌的抗菌活性更强,YakB-2对细菌的抗菌活性更强。目前国内对于牦牛血中抗菌肽的提取研究相对较少,可以对其他动物血液中抗菌肽分离纯化的方法进行借鉴,如王亚贝等[57]在离心转速、NH4Cl溶液与样品体积比、超声功率及时间的最佳条件下提取新鲜黄牛血中的抗菌肽,粗抗菌肽得率可达0.008 5%,然后采用聚丙烯酰胺凝胶电泳确定抗菌肽的分子质量约为14 kDa,并通过电洗脱对其进行分离纯化,回收率为82%。马沐青[58]利用胰蛋白酶水解提取猪血细胞中的活性肽混合物,并运用超滤及纳滤2 种膜分离技术从中分离获得分子质量在500~3 000 Da的猪血抗菌肽粗提液。通过牛津杯法测定其抗菌活性,结果表明,该粗提液对大肠杆菌、铜绿假单胞菌、金黄色葡萄球菌和酵母菌具有明显的抗菌作用。随后利用质谱分析预测抗菌肽序列,并根据序列合成3种猪血抗菌肽,纯度均大于90%。以上基于黄牛血、猪血中抗菌肽的分离纯化技术为牦牛血抗菌肽分离纯化提供了更为广阔的思路。
2.3.2 抗氧化肽
牦牛血抗氧化肽的制备技术主要为枯草芽孢杆菌液态发酵法、碱性蛋白酶解法、菌酶联合法3种。杜昕等[39]对比枯草芽孢杆菌发酵法、碱性蛋白酶解法、菌酶联合法制备牦牛血抗氧化肽,研究发现,最佳制备方法为菌酶联合法,此法制备的抗氧化肽活性最好,超氧阴离子自由基清除能力、脂质过氧化抑制能力、还原力最强。其后探究了超滤及凝胶层析对牦牛血抗氧化肽纯化结果的影响。通过超滤分离菌酶联合法所得产物后发现分子质量小于5 kDa的抗氧化肽对羟自由基的半抑制浓度(half maximal inhibitory concentration,IC50)达到1.62 mg/mL;通过凝胶层析分离后得到4 个不同组分,分析发现其中分子质量>10 kDa的组分对羟自由基的清除能力最强,IC50达到0.72 mg/mL。肖岚[33]在杜昕等[39]研究的基础上利用枯草芽孢杆菌联合碱性蛋白酶制备牦牛血抗氧化肽,并采用液相色谱-质谱联用法对肽段组成及其序列进行检测,然后根据氨基酸组成、肽段序列、活性位点及分子质量筛选得到7 条肽段具有良好的体内外抗氧化活性;通过大鼠H9c2心肌细胞物理缺氧模型、小鼠常压耐缺氧实验、小鼠亚硝酸钠中毒实验验证了牦牛血抗氧化肽也具有良好的抗缺氧作用[59];通过小鼠负重游泳实验,发现牦牛血低聚肽能够延长小鼠负重游泳时间,运动后小鼠肝脏肝糖原含量提高,血清乳酸和尿素氮含量降低,证明牦牛血低聚肽还具有一定的抗疲劳能力,若与大豆低聚肽按照质量比5∶5进行复配效果更好[60]。这提示不同来源的低聚肽之间按照特定比例组合后具有良好的协同作用,未来可以利用这一特点探究不同血液低聚肽的作用效果。周雨等[61]通过响应面优化法确定利用枯草芽孢杆菌液态发酵法制备牦牛血抗氧化肽的最佳工艺条件,然后利用液相色谱-串联质谱法筛选出20 条可能具有较好抗氧化活性的肽段,并进行蛋白匹配,为牦牛血抗氧化肽的进一步开发利用提供了参考依据。
近年来,亚临界水萃取技术作为一种新兴技术,在活性肽提取方面受到了广泛关注。该技术利用高温高压下的水作为溶剂,能够促使蛋白质变性并分解为肽及游离氨基酸,这一过程不仅操作简单、提取效率高,而且能耗较低[62]。目前,该技术已在植物多糖类、多酚类等生物活性物质的提取中得到广泛应用。孙强等[63]通过亚临界水降解高温芝麻饼粕蛋白水解液,制备具有血管紧张素转换酶抑制活性的蛋白肽,并通过纳滤、超滤及液相层析系统进行分离纯化。该技术不仅能够快速提取目标肽段,还能避免高温对生物活性肽的热降解和氧化损伤[64]。未来,随着科学技术的进步,亚临界水萃取技术有望成为牦牛血活性肽生产的新手段,从而进一步推动其在功能性食品、医药保健产品中的应用。
2.4 酶类制备技术
目前对于牦牛血中酶类的提取,主要集中于SOD和凝血酶。赵文宝等[65]利用微波加热破膜与有机溶剂提取相结合的方法提取牦牛血红细胞中的SOD。他们通过优化微波处理时间及乙醇、氯仿、丙酮添加量等工艺参数,最终提取的SOD活力达到67.137 U/mL。该提取方法在微波加热的辅助下可以达到快速、高效的提取效果,并且在一定程度上减少了有机溶剂的用量,但有机溶剂的使用可能会导致SOD活性降低,同时在温度控制方面难度较大。杨林等[66]通过溶剂热法制备Fe3O4磁性纳米粒子,并利用其快速分离纯化牦牛血粗酶液中的SOD,在最佳分离条件下,SOD比活力为3 252 U/mg,回收率可达91.23%。狄蕊等[44]利用超声波和胰酶共同作用提取牦牛血血细胞中的SOD,在最优工艺条件下,所得的SOD比活力为1 410.62 U/mg,并且经过酶解处理后,牦牛血中SOD比活力相比不加酶处理提高21.43%,活性提高27.74%。此方法中,超声波的辅助作用提高了SOD的提取效率,而胰酶的使用则提供了温和的反应条件,有助于保护SOD的活性,但与Fe3O4磁性纳米粒子纯化后的结果相比,其所得SOD活性较低。
近年来,关于牦牛血中凝血酶的提取工艺也得到了较多关注。李耀曾[67]、曹芳[68]等均采用膜分离技术分离提取藏牦牛血中凝血酶,该方法可以有效去除大量杂质,节省溶剂。此外,柠檬酸钡吸附法也是提取和纯化牦牛血中凝血酶的一种有效方法,其原理是将血浆经柠檬酸钠抗凝后加入BaCl2生成柠檬酸钡沉淀,凝血酶原等物质可以被吸附并随之沉淀出来,通过对沉淀进行乙二胺四乙酸解吸及透析,最终可获得凝血酶原。张阳等[69]利用柠檬酸钡吸附法制取牦牛血中的凝血酶原,并对Ca2+激活凝血酶原的最佳工艺条件进行探究,结果表明,在激活温度27 ℃、Ca2+终浓度0.01 mol/L、激活时间1.95 h条件下,凝血酶的比活力最优为63.4 U/mg。该方法具有高选择性、高纯度的优势,但解吸和透析等增加了操作的复杂性和成本。此外,刘倩等[45]制备出壳聚糖亲和磁性微球用于对牦牛凝血酶粗酶液的纯化,纯化倍数为13,时间为0.83 h,吸附容量为4 956 U/g,纯化效果较好。
综上所述,尽管近年来牦牛血中酶类的提取技术研究取得了一定进展,但与氯化血红素、IgG及生物活性肽的提取技术相比,牦牛血中酶类制备技术的发展相对滞后。当前的研究主要集中在单一的提取技术和少数几种酶的提取,因此针对同一种酶的不同提取技术和其他酶类的开发仍需进一步探索。除此之外,为了实现牦牛血液资源的高效综合利用,未来多种生物活性物质的同步分离提取技术的开发具有重要的现实意义。
3 牦牛血产品的开发利用
牦牛血作为一种丰富的蛋白质和矿物质等的来源,其开发利用不仅可以提高牦牛血资源的利用率,还能为食品工业、医疗行业、农牧业等提供新的原料和产品。
3.1 食品
在牦牛血食品制作方面,传统的血肠、血豆腐等产品制作技术已经较为成熟,而创新产品如益生菌发酵血肠则提供了新的口味及健康价值。贡佳欣等[70]利用牦牛血及植物乳植杆菌、戊糖片球菌制作益生菌发酵血肠,并对发酵牦牛肉血肠生产过程中多个工艺条件进行优化,最终得到的牦牛血肠质地、口感适中、色泽良好、香气浓郁,综合品质较好。李思宁等[71]利用胃蛋白酶酶解得到的牦牛血血红蛋白抗氧化肽制作出一种具有高抗氧化活性的发酵血肠,该血肠总抗氧化能力可达6.89 U/mg,乳酸菌与酵母菌联合二次发酵后游离氨基酸总量可达12.74 mg/g,且风味和咀嚼性较好。
此外,牦牛血还作为一种重要的原材料被用于奶酪、能量棒等功能食品的开发中。张卫兵等[72]添加牦牛血粉制作奶酪,其不仅有普通奶酪的传统优点,还具有色泽鲜艳、铁含量高的特色。该产品中铁含量达到28.3 mg/100 g,可成为缺铁人群的理想补铁食品。罗景连等[73]以青稞肽、牦牛骨粉、牦牛血清、牦牛肉、红景天为主要原料制作出一种高钙、高蛋白的牦牛能量肽棒,可满足健身、高反、亚健康人群的能量需求。
随着人们食品安全及环境保护意识的提高,合成色素逐渐被天然色素所替代,牦牛血作为天然食用色素,在食品工业中展现出广阔的应用前景。贡佳欣等[74]利用牦牛血制备糖基化亚硝基血红蛋白,并确定了最佳反应条件,干燥后所得产品蛋白质量分数达到54.64%,且亚硝酸钠残留量较低,仅为0.009 mg/kg,适合作为食用红色素用于食品工业中。
3.2 医疗保健类产品
由于新鲜牦牛血不便于存放和携带、营养成分容易流失,目前延长其保质期及保持血液营养成分的方法主要有制作血粉和发酵。罗华秀等[15]先利用高效液相色谱-柱后衍生法初步测定得到,藏药牦牛血粉饮片中包括8 种人体必需氨基酸,后采用微波消解-电感耦合等离子体质谱测定出其无机元素以Al、Na、Mg、K、Ca、Fe为主,同时含有其他人体所需的微量元素,方法高效、准确,展现了藏药牦牛血粉饮片在为人体提供营养补充方面的潜在优势,并为牦牛血粉的进一步应用提供了科学参考。陈宇星等[75]通过正交试验筛选出黑曲霉与酵母菌组合为牦牛血的最适发酵组合,在最佳发酵工艺条件下,牦牛血可溶性蛋白质量分数由原始条件下的2.20%增加到10.60%,粗蛋白质量分数由30.45%增加到34.42%,粗纤维质量分数由5.03%减少至4.46%,颜色鲜亮,具有酵母发酵的香味。
在此基础上,牦牛血因其营养成分丰富、具有良好的免疫调节作用和抗氧化特性、能够促进血液健康,已被广泛应用于医疗保健类产品的开发。目前已有的保健类产品主要为牦牛血肽球蛋白片、牦牛血胶囊、微胶囊食品等。韩学燕等[76]利用中性蛋白酶水解牦牛血红蛋白,用活性炭对酶解液进行脱色,在最佳水解工艺和脱色工艺条件下,水解液中多肽含量为0.504 mg/mL,最终制备出蛋白多肽粉。蛋白多肽粉中的营养成分更易被人体吸收,可作为原料添加进保健类产品中。王智森等[77]利用牦牛血肽粉发明出一种牦牛血肽球蛋白片,这种新型特殊膳食用食品能够有效改善无痛性心肌缺血患者的症状,同时有助于改善患者的睡眠质量。杨敦豪等[78]则以牦牛血低温干燥精粉为主要原料,添加红参、当归、白芍等具有较高营养价值的中药材成分,制作高原牦牛血胶囊。该保健食品具有改善血液健康、增强体力和提高免疫抗病能力的潜在效果,适用于贫血患者及免疫功能不足的人群。靳义超等[79]以牦牛血红素粉、沙棘粉、红景天粉和红枣提取物为主要原料,开发出一种微胶囊食品。该食品具有滋补气血、抗高原反应的功效,能够有效改善贫血症状和缓解易疲劳的状况。
以上几种医疗保健类产品的开发不仅符合现代人健康生活的理念,满足消费者对产品天然、无害、营养丰富的追求,也推动了畜牧资源的高效利用和可持续发展,促进了产业链的延伸和升级。
3.3 农牧业用品
牦牛血作为一种富含蛋白质、氨基酸、矿物质和维生素等营养成分的可持续资源,可与其他营养物质进行调配制成化肥和饲料。与合成化肥和人工饲料相比,以牦牛血为原料制作的化肥和饲料不仅环保,还能提供更为安全的营养补充。刘元林[10]将碱性蛋白酶和风味蛋白酶复配酶解牦牛血,分析发现,酶水解牦牛血能够提高氨基酸含量,后利用水解产物氨基酸、矿物质与其他微量元素调配,得到流动性好、棕褐色、略带腥味的牦牛血氨基酸液体肥。李勤慎等[80]在虹鳟鱼的天然饲料中添加10%~40%牦牛毛发水解液粉剂、10%~45%牦牛血粉、10%~15%牦牛骨粉等多种材料,最终饲料营养丰富,整体呈深棕色且具有氨基酸的香味。这些产品的开发可以提高牦牛血资源的利用率,为牦牛血深加工及农牧业用品的开发提供新的思路,推动农业和畜牧业的可持续发展。
当前牦牛血主要产品如表2所示。
表2 目前已开发的牦牛血产品
Table 2 Existing yak blood products

牦牛血产品参考文献食品益生菌发酵血肠[70-71]奶酪[72]牦牛能量肽棒[73]医疗保健类产品蛋白多肽粉[76]牦牛血肽球蛋白片[77]牦牛血胶囊[78]牦牛血红素微胶囊[79]农牧业用品牦牛血氨基酸液体肥[10]虹鳟鱼天然饲料[80]
4 结语
牦牛血是一种十分优质的动物血液资源,近年来,在牦牛血及其产品的开发和利用方面具有较为显著的进展。牦牛血液资源开发主要集中在氯化血红素、Ig、生物活性肽及酶类,血液产品开发主要集中于低附加值产品,在一定程度上提高了牦牛血资源的利用率,促进了食品、生物医药行业以及国民经济的发展和进步。但目前牦牛血资源的开发利用率仍较低,相关产品的开发较少,大量的血液资源仍然被丢弃。未来,应通过进一步加强牦牛血采集、贮藏、生物活性物质同步分离、产品开发技术,以提升牦牛血资源的利用率和产品的附加值,减少资源浪费和环境污染,实现畜牧业的可持续发展。
[1] 闫忠心. 不同部位牦牛肉品质特性差异及机制研究[D]. 杨凌: 西北农林科技大学, 2022: 1-2.
[2] PODOINITSYNA T A, KOZUB Y A. Regular changes in hematological and biochemical indicators and immunogenetic certification of yak blood introduced in new conditions[J]. IOP Conference Series: Earth and Environmental Science, 2019, 315(4):042007-042007. DOI:10.1088/1755-1315/315/4/042007.
[3] ZENG R L, HUANG X P, FU W, et al. Construction of lentiviral vectors carrying six pluripotency genes in yak to obtain yak iPSC cells[J]. International Journal of Molecular Sciences, 2024, 25(17):9431-9431. DOI:10.3390/ijms25179431.
[4] 张强, 俄广鑫, 平措占堆, 等. 中国牦牛资源开发利用研究进展[J]. 动物营养学报, 2023, 35(12): 7492-7518. DOI:10.12418/CJAN2023.681.
[5] 杜雨. 超声波辅助盐析法提取及双水相法提取纯化牦牛血IgG的工艺条件研究[D]. 兰州: 甘肃农业大学, 2015: 1-2; 28-38.
[6] 李璇, 孙栋, 胡婷, 等. 高盐氧化体系对牦牛肉肌纤维蛋白理化特性及结构的影响[J]. 食品科学, 2024, 45(15): 49-58. DOI:10.7506/spkx1002-6630-20231106-032.
[7] 庞晨. 牦牛血IgG分离纯化工艺及其稳定性研究[D]. 兰州: 甘肃农业大学, 2013: 17-26.
[8] 张燕, 李升升, 赵立柱, 等. 烹饪温度对牦牛肉蛋白质氧化和体外消化特性的影响[J]. 食品科学, 2024, 45(2): 9-16. DOI:10.7506/spkx1002-6630-20230430-293.
[9] 王华清, 来进君, 段培琪, 等. 青海牦牛血液资源的研究现状及开发利用[J]. 青海畜牧兽医杂志, 2016, 46(2): 43-44.
[10] 刘元林. 复合酶酶解牦牛血制备氨基酸液体肥的研究[D]. 兰州: 西北民族大学, 2021: 28-30.
[11] 肖雪莉. α/β-半乳糖苷酶辅助饱和硫酸铵法提取牦牛血中免疫球蛋白G及其活性稳定性研究[D]. 兰州: 甘肃农业大学, 2017: 44-45.
[12] 倪蕴琪, 唐静仪, 刘怀高, 等. 牦牛骨资源综合利用的研究现状与展望[J]. 农产品加工, 2020, 22(11): 87-92. DOI:10.16693/j.cnki.1671-9646(X).2020.11.064.
[13] 任卫合, 徐轶飞, 罗龙龙, 等. 牦牛乳的研究进展[J]. 食品研究与开发, 2020, 41(24): 219-224. DOI:10.12161/j.issn.1005-6521.2020.24.036.
[14] 吴茜, 刘芳芳, 苗宇, 等. 牦牛皮在食品领域的利用现状及应用前景分析[J]. 食品与发酵工业, 2020, 46(13): 305-309. DOI:10.13995/j.cnki.11-1802/ts.024034.
[15] 罗华秀, 王晓玲, 王伟玲, 等. 藏药牦牛血粉饮片中氨基酸和无机元素测定[J]. 中国测试, 2020, 46(2): 56-61; 79. DOI:10.11857/j.issn.1674-5124.2019070100.
[16] 贡佳欣, 唐善虎, 李思宁, 等. 不同贮藏方式牦牛血对牦牛肉血肠品质变化影响的研究[J]. 食品科技, 2019, 44(11): 127-132.DOI:10.13684/j.cnki.spkj.2019.11.024.
[17] 温耀涵. 牛血红蛋白肽亚铁螯合物的制备及其稳定性研究[D].郑州: 河南农业大学, 2023: 3-4.
[18] 霍双双. 猪血红蛋白对免疫抑制小鼠的免疫功能及脾脏基因转录组的影响研究[D]. 西安: 西北大学, 2021: 1-2.
[19] 张志飞, 梁春年, 郭宪, 等. 无角牦牛与有角牦牛血液生理、生化指标的比较研究[J]. 中国畜牧兽医, 2016, 43(12): 3257-3262.DOI:10.16431/j.cnki.1671-7236.2016.12.026.
[20] 刘颜, 方彦雯, 张欣, 等. 磁场对血红蛋白氧合速率的影响[J]. 生物化学与生物物理进展, 2024, 51(9): 2210-2221. DOI:10.16476/j.pibb.2024.0035.
[21] CARMEN B G, CARMEN A M, GUADIX E M, et al. Valorisation of blood protein from livestock to produce haem iron-fortified hydrolysates with antioxidant activity[J]. International Journal of Food Science & Technology, 2022, 57(4): 2479-2486. DOI:10.1111/ijfs.15616.
[22] 闫忠心. 超声辅助提取冷冻牦牛血中血红素的工艺优化[J].青海大学学报, 2018, 36(5): 1-6. DOI:10.13901/j.cnki.qhwxxbzk.2018.05.001.
[23] 李滢, 张远红, 董浩, 等. 动物血液蛋白质及活性肽开发研究进展[J].食品安全质量检测学报, 2023, 14(7): 39-47. DOI:10.19812/j.cnki.jfsq11-5956/ts.2023.07.006.
[24] PARK S H, LEE Y, JEON H, et al. Anticancer effect of hemin through ANO1 inhibition in human prostate cancer cells[J]. International Journal of Molecular Sciences, 2024, 25(11): 6032. DOI:10.3390/ijms25116032.
[25] COLÓ G P, SCHWEITZER K, ORESTI G M, et al. Proteomic analysis of the effect of hemin in breast cancer[J]. Scientific Reports,2023, 13(1): 10091. DOI:10.1038/s41598-023-35125-4.
[26] 薛技科. 代谢改造酿酒酵母高效合成血红蛋白与肌红蛋白[D].无锡: 江南大学, 2023: 1-2.
[27] ZHOU K, ZHANG J, XIE Y, et al. Hemin from porcine blood effectively stabilized color appearance and odor of prepared pork chops upon repeated freeze-thaw cycles[J]. Meat Science, 2021, 175:108432. DOI:10.1016/j.meatsci.2021.108432.
[28] 金晶. 牦牛血IgG分离纯化工艺研究[D]. 兰州: 甘肃农业大学, 2010:28-40.
[29] LIU D, YOU J, LIU Y X, et al. Serum immunoglobulin G provides early risk prediction in immunoglobulin A nephropathy[J].International Immunopharmacology, 2019, 66: 13-18. DOI:10.1016/j.intimp.2018.10.044.
[30] SAISUJANI R, THIVIA J, CAMPBELL D M, et al. Intravenous immunoglobulin G therapy for neonatal hyperbilirubinemia[J].Pediatric Research, 2023, 94(6): 2092-2097. DOI:10.1038/s41390-023-02712-0.
[31] 杨玉亮. 牦牛骨源抗炎活性肽分离纯化与作用机制解析[D]. 无锡:江南大学, 2023: 3-4.
[32] WIGESEKARA T, ABEYRATHNE E D N S, AHN D U. Effect of bioactive peptides on gut microbiota and their relations to human health[J]. Foods, 2024, 13(12): 1853. DOI:10.3390/foods13121853.
[33] 肖岚. 牦牛血抗氧化肽的抗缺氧作用及其作用机制研究[D]. 雅安:四川农业大学, 2019: 77-78.
[34] GHALAMARA S, SILVA S, BRAZINHA C, et al. Valorization of fish by-products: purification of bioactive peptides from codfish blood and sardine cooking wastewaters by membrane processing[J]. Membranes,2020, 10(3): 44. DOI:10.3390/membranes10030044.
[35] VASILCHENKO A S, ROGOZHIN E A, VASILCHENKO A V, et al.Novel hemoglobin-derived antimicrobial peptides from chicken(Gallus gallus) blood: purification, structural aspects and biological activity[J]. Journal of Applied Microbiology, 2016, 121(6): 1546-1557.DOI:10.1111/jam.13286.
[36] KUMARI S, PANDEY A, SONI A, et al. Optimisation of antioxidant,antimicrobial and metal-chelating properties of bioactive peptides from blood wastes by enzymatic hydrolysis[J]. Animal Production Science,2022, 62(9): 891-900. DOI:10.1071/an21612.
[37] 张冰清, 杭柏林, 夏一赫, 等. 牛血红蛋白源抗菌肽BHP的生物信息学分析[J]. 黑龙江畜牧兽医, 2017, 60(17): 17-19. DOI:10.13881/j.cnki.hljxmsy.2017.1504.
[38] 郝刚, 唐善虎, 李思宁. 牦牛血胰蛋白酶水解液中抗菌肽的筛选研究[J]. 食品工业科技, 2018, 39(11): 121-125; 131. DOI:10.13386/j.issn1002-0306.2018.11.021.
[39] 杜昕, 李诚, 肖岚, 等. 牦牛血抗氧化肽制备方法对比及分离纯化研究[J]. 食品与生物技术学报, 2018, 37(8): 861-867. DOI:10.3969/j.issn.1673-1689.2018.08.012.
[40] XIONG L, PEI J, KALWAR Q, et al. Fat deposition in yak during different phenological seasons[J]. Livestock Science, 2021, 251:104671. DOI:10.1016/j.livsci.2021.104671.
[41] 江慧琼, 刘雅婷, 陈清华. 超氧化物歧化酶的生理功能及其在动物生产中的应用前景[J]. 中国畜牧兽医, 2024, 51(3): 945-954.DOI:10.16431/j.cnki.1671-7236.2024.03.006.
[42] GUO J K, LIU H Q, ZHAO D, et al. Glucose-lowering effects of orally administered superoxide dismutase in type 2 diabetic model rats[J].Science of Food, 2022, 6(1): 36. DOI:10.1038/s41538-022-00151-5.
[43] 朱志恒, 吴希晨, 丁佳滢, 等. 凝血酶促大鼠软骨细胞生长、形态转变和抑制胶原合成的作用[J]. 中国中医骨伤科杂志, 2022, 30(11):1-6.
[44] 狄蕊, 张珍, 张盛贵, 等. 酶法辅助提取牦牛血中超氧化物歧化酶的工艺条件优化[J]. 食品与发酵科技, 2017, 53(3): 8-13; 28.DOI:10.3969/j.issn.1674-506X.2017.03-002.
[45] 刘倩, 张珍, 徐红艳, 等. 壳聚糖磁性微球纯化牦牛凝血酶研究[J].食品与发酵科技, 2018, 54(5): 8-12. DOI:10.3969/j.issn.1674-506X.2018.05-003.
[46] 金晶, 张珍, 张丽, 等. 低温无水乙醇沉淀法提取牦牛血免疫球蛋白的工艺条件研究[J]. 甘肃农业大学学报, 2010, 45(4): 51-54.DOI:10.13432/j.cnki.jgsau.2010.04.003.
[47] 李廷军, 陈云政, 周玉青. 牦牛血清中免疫球蛋白的提取[J]. 青海畜牧兽医杂志, 2016, 46(5): 24-27.
[48] 杜雨, 张珍, 张盛贵, 等. 超声波辅助饱和硫酸铵法提取牦牛血中的IgG[J]. 食品科技, 2015, 40(5): 171-177. DOI:10.13684/j.cnki.spkj.2015.05.034.
[49] 郭晓东. 牦牛血液提纯氯化血红素工艺优化及产业化研究[D].兰州: 兰州理工大学, 2022: 12-21.
[50] 李得信, 师希雄, 文鹏程, 等. 牦牛血粉酶法制备氯化血红素工艺研究[J]. 中国食品工业, 2015, 30(7): 66-68.
[51] 刘振斌, 张珍, 张盛贵, 等. CMC-Na法提取牦牛血红素的工艺研究[J].甘肃农业大学学报, 2012, 47(4): 143-146. DOI:10.13432/j.cnki.jgsau.2012.04.012.
[52] 高子涵, 张卫兵, 梁琪, 等. 牦牛血粉制备氯化血红素工艺优化研究[J]. 食品工业科技, 2013, 34(19): 248-251. DOI:10.13386/j.issn1002-0306.2013.19.086.
[53] 杨生忠, 韩学燕, 李宗文, 等. 牦牛血液氯化血红素的分离提纯及工艺优化研究[J]. 中国畜牧兽医, 2017, 44(11): 3163-3169.DOI:10.16431/j.cnki.1671-7236.2017.11.009.
[54] 贾志春. 酶解牦牛血红蛋白制备氯化血红素工艺及其结构研究[D].兰州: 甘肃农业大学, 2016: 48-51.
[55] 张晋, 吴晓丽, 田雨薇, 等. 超声波辅助酶解牦牛血粉提取氯化血红素的响应面工艺优化及品质表征[J]. 浙江农业学报, 2024, 36(6):1357-1367. DOI:10.3969/j. issn.1004-1524.20230926.
[56] 徐彦召, 邓丽, 李杰, 等. 血红蛋白源抗菌肽hemocidins研究进展[J].黑龙江畜牧兽医, 2024, 67(18): 17-22. DOI:10.13881/j.cnki.hljxmsy.2023.10.0083.
[57] 王亚贝, 刘亚彬, 丁兰卉, 等. 牛血抗菌肽的制备及应用[J].食品研究与开发, 2023, 44(13): 147-152. DOI:10.12161/j.issn.1005-6521.2023.13.022.
[58] 马沐青. 猪血抗菌肽的制备及其与多种抗菌剂联合抗菌作用研究[D]. 长春: 吉林大学, 2016: 15-27.
[59] 肖岚, 王威, 吴玉娇, 等. 牦牛血低聚肽抗缺氧活性及其作用机制[J].食品科学, 2018, 39(23): 149-154. DOI:10.7506/spkx1002-6630-201823023.
[60] 肖岚, 李诚, 杜昕, 等. 牦牛血低聚肽对小鼠抗疲劳能力和缺氧H9c2细胞的影响[J]. 核农学报, 2020, 34(4): 831-838. DOI:10.11869/j.issn.100-8551.2020.04.0831.
[61] 周雨, 施丽芬, 朱捷, 等. 牦牛血抗氧化肽发酵制备工艺优化及结构分析研究[J]. 食品安全质量检测学报, 2023, 14(6): 270-278.DOI:10.19812/j.cnki.jfsq11-5956/ts.2023.06.034.
[62] DINI I, MANCUSI A. Food peptides for the nutricosmetic industry[J].Antioxidants, 2023, 12(4): 788. DOI:10.3390/antiox12040788.
[63] 孙强, 王瑞丹, 黄纪念, 等. 亚临界水制备芝麻ACE抑制肽的分离纯化、构效、分子对接[J]. 食品科学, 2023, 44(16): 106-112.DOI:10.7506/spkx1002-6630-20220602-020.
[64] CÁTIA F, MAFALDA S. A comprehensive review on deep eutectic solvents and its use to extract bioactive compounds of pharmaceutical interest[J]. Pharmaceuticals, 2024, 17(1): 124. DOI:10.3390/ph17010124.
[65] 赵文宝, 张珍, 郭建华, 等. 牦牛血中超氧化物歧化酶提取工艺研究[J].甘肃农业大学学报, 2010, 45(1): 147-150. DOI:10.13432/j.cnki.jgsau.2010.01.003.
[66] 杨林, 孙术国, 罗章. 磁性纳米粒子快速分离纯化超氧化物歧化酶[J]. 食品科学, 2013, 34(9): 80-84. DOI:10.7506/spkx1002-6630-201309018.
[67] 李耀曾. 超滤法从藏牦牛血中分离纯化凝血酶[J]. 中国生化药物杂志, 2005, 30(4): 237-238.
[68] 曹芳, 李耀曾, 杜兴, 等. 二次膜分离提取藏牦牛血凝血酶的工艺[J]. 兰州大学学报(医学版), 2009, 35(2): 51-53. DOI:10.13885/j.issn.1000-2812.2009.02.001.
[69] 张阳, 张珍, 张盛贵, 等. 响应面法优化Ca2+激活牦牛血中凝血酶原工艺研究[J]. 食品工业科技, 2014, 35(14): 293-296. DOI:10.13386/j.issn1002-0306.2014.14.056.
[70] 贡佳欣, 唐善虎, 李思宁, 等. 益生菌发酵牦牛肉血肠的制作工艺优化[J]. 食品工业科技, 2020, 41(9): 41-48. DOI:10.13386/j.issn1002-0306.2020.09.007.
[71] 李思宁, 唐善虎, 夏佳军, 等. 一种具有高抗氧化活性的发酵血肠制作方法: CN111406899A[P]. 2020-07-14.
[72] 张卫兵, 艾对元. 一种添加牦牛血粉的奶酪的制备方法:CN104255937A[P]. 2015-01-07.
[73] 罗景连, 罗永胜. 耗牛能量肽棒: CN119073525A[P]. 2024-12-06.
[74] 贡佳欣, 唐善虎, 刘星汶, 等. 糖基化亚硝基牦牛血红蛋白制备及工艺优化研究[J]. 西南民族大学学报(自然科学版), 2018, 44(3): 243-249. DOI:10.11920/xnmdzk.2018.03.004.
[75] 陈宇星, 郑玉才, 谈永萍, 等. 牦牛血发酵的最佳菌种组合及最优发酵条件探究[J].中国饲料, 2019(11): 81-85. DOI:10.15906/j.cnki.cn11-2975/s.20191118.
[76] 韩学燕, 李宗文, 杨生忠, 等. 酶法水解牦牛血制备蛋白多肽粉的技术研究[J]. 中国农学通报, 2018, 34(17): 115-121.
[77] 王智森, 刘水娟, 陈君, 等. 一种改善心肌缺血的特膳食品:CN117882776A[P]. 2024-04-16.
[78] 杨敦豪, 蔡旻君. 高原牦牛血胶囊及其制备方法:CN101244163B[P]. 2010-09-29.
[79] 靳义超, 闫忠心, 李升升. 一种牦牛血红素功能食品及其制作方法:CN105831756A[P]. 2016-08-10.
[80] 李勤慎, 邵东宏. 一种虹鳟鱼专用合成饲料及其制备工艺:CN102422988B[P]. 2013-07-17.