在全球肉类人均消费量中,牛肉排名第三,预计2025年,全球牛肉市场价值可达3 835亿 美元[1]。通过添加调味料腌制加工可赋予调理肉制品不同的风味和品质,经过合适的包装和杀菌处理后,可低温流通销售[2]。然而,由于肉品富含水分和营养物质,在贮藏和运输过程中易受微生物(如假单胞菌、乳酸菌和热杀索丝菌等)污染而发生腐败变质[3],同时脂质氧化和蛋白氧化也会引发肉制品品质劣变[4]。
调理牛肉作为热敏性肉制品,高温处理会对其感官品质产生负面影响,目前一般采用低温贮运、真空包装、气调包装(modified atmosphere packaging,MAP)等方法应对上述问题。MAP是在一定温度条件下,根据食品特性,将一定比例的O2、CO2、N2等混合气体充入包装内,改变包装内的气体组成,从而抑制微生物生长,减缓食品腐败变质,进而延长食品货架期的保鲜方式[5]。Cooksey[6]研究发现,含80% O2+20% CO2的高氧改性MAP可有效保持肉制品诱人的红色,并将冷藏保质期延长至10 d。CO2可抑制细菌生长,而O2有助于保持肉制品色泽,但高氧MAP可能会导致肉制品脱味和过早褐变,且MAP通常只能抑制微生物生长速率[7],因此优化合适的气体比例,协同其他冷杀菌方式,在不破坏肉制品品质的基础上延长其保质期,需要引入创新的活性包装方式。
低温等离子体(cold plasma,CP)是一种新型非热加工技术,通过向食品周围气体介质施加高压电场,使其电离分解产生带电粒子,形成具有高活性和能量的活性成分[8],可有效杀灭食品表面或内部的微生物,灭菌速率快、效果好、无毒副作用、无残留、无污染[9]。CP技术已应用于多种肉制品的杀菌保鲜,因各肉制品理化性质和污染微生物种类等存在差异,CP杀菌效果有所不同[10]。Lee等[11]采用介质阻挡放电(dielectric barrier discharge,DBD)-CP直接处理鸡胸肉,以10 kV、10 kHz处理5 min,可分别将金黄色葡萄球菌和大肠杆菌数降至2.3、2.1(lg(CFU/g))。Jayasena等[12]也发现DBD-CP处理可减少猪肉和牛肉表面微生物污染,可分别将猪肉样品中的大肠杆菌和沙门氏菌数降低2.54、2.68(lg(CFU/g));以12 kV、50 Hz直接处理10 min可分别将牛肉表面的沙门氏菌和单核细胞增生李斯特菌数降低2.4、2.2(lg(CFU/g))。
本研究采用DBD-CP处理MAP调理牛肉制品,并对其贮藏期安全性指标、氧化水平与理化指标进行监测,为开发新型调理牛肉活性MAP提供理论依据。
1 材料与方法
1.1 材料与试剂
生鲜牛肉、香辛料均为市购,其中生鲜牛肉为实验当天购买,并于4 ℃贮藏,当天使用。
聚酰胺/聚乙烯复合膜 山东路易达新材料有限公司;聚丙烯包装盒(178 mm×126 mm×35 mm、透氧率10 cm3/(m2·24 h)、透水率10 g/(m2·24 h))安纳鲜新材料(无锡)有限公司。
MRS琼脂培养基、营养琼脂培养基、热杀索丝菌分离(链霉素乙酸铊(streptomycin thallous acetate actidione,STAA)琼脂)培养基、假单胞菌CFC培养基、平板计数琼脂培养基 青岛海博生物技术有限公司;氯化钠、磷酸二氢钠、磷酸氢二钠、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、1,1,3,3-四甲氧基丙烷、焦磷酸钠、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、三氯乙酸(trichloroacetic acid,TCA)(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
SW-CJ-1FD超净工作台 江苏苏净集团有限公司;BK130/36等离子体发生器 美国Phenix公司;Allegra-64R台式冷冻离心机 美国Beckman公司;AY120电子天平 北京赛多利斯天平有限公司;101-0-S干燥箱上海跃进医疗器械有限公司;CR-410色差仪 日本柯尼卡美能达公司;85-2恒温磁力加热搅拌器 常州国华电器有限公司;MAP-H360复合气调保鲜包装机 苏州森瑞保鲜设备有限公司;HZQ-300A恒温培养摇床 上海一恒科学仪器有限公司;MT-30K-8高速匀浆机 博科勒生物科技(上海)有限公司;UV-2600紫外分光光度计日本岛津公司;XTC-16质构仪 上海保圣实业发展有限公司;FB-10 pH计 赛多利斯科学仪器(北京)有限公司。
1.3 方法
1.3.1 样品制备及处理
1.3.1.1 调理牛肉制备
参考格桑卓玛等[13]的方法并稍加修改。制备流程:新鲜牛肉→清洗→辅料腌制→调理牛肉→包装。辅料配比:食盐4 g/100 mL、复合香辛料(八角、花椒、丁香、黑胡椒)1 g/100 mL、料酒3 g/100 mL、白砂糖2 g/100 mL、椒盐0.5 g/100 mL、酱油0.5 g/100 mL。所有质量浓度以腌制液总体积计。
1.3.1.2 MAP处理
采用取样器取直径为10 cm、厚度2 cm的肉块,置于聚丙烯包装盒,按照表1气体成分组成对调理牛肉样品进行MAP处理。
表1 MAP气体成分组成
Table 1 Gas composition of MAP

组别O2体积分数/%CO2体积分数/%N2体积分数/%T103070 T2203050 T3403030 T4603010
1.3.1.3 DBD-CP处理
将MAP调理牛肉样品置于等离子体发生器两电极之间的等离子体发生区域,采用直接处理方式,处理电压70 kV、处理频率90 Hz、处理时间90 s。经DBDCP处理后,将样品立即转移至(4±1)℃、相对湿度(80±5)%下贮藏,0、2、4、6、8 d取样,测定安全性指标(微生物数、总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量)、氧化水平(脂质氧化和蛋白质氧化)、理化指标(水分含量、pH值、剪切力和红度值(a*))。以空气包装且未进行DBD-CP处理样品作为对照组(CK)。
1.3.2 指标测定
1.3.2.1 微生物数
参照GB/T 9695.19—2008《肉与肉制品 取样方法》并略作修改。取10 g牛肉样品,转移到含有90 mL无菌磷酸盐缓冲液(phosphate buffered saline,PBS;0.05 mol/L、pH 7.0)的均质袋中,均质混合2 min。采用无菌PBS进行10 倍梯度稀释,所有取样操作均在无菌条件下进行。按照GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》测定菌落总数;按照GB 4789.35—2023《食品安全国家标准 食品微生物学检验 乳酸菌检验》测定乳酸菌数;参照周彬静等[14]的方法测定假单胞菌和热杀索丝菌数,取5 g牛肉样品,加入45 mL无菌去离子水进行均质,将10 倍连续稀释的100 μL匀浆(10-7~10-6)分别均匀涂抹在假单胞菌CFC培养基和STAA琼脂培养基上,30 ℃培养48 h后,测定假单胞菌和热杀索丝菌数,结果均以lg(CFU/g)表示。
1.3.2.2 TVB-N含量
按照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》,利用自动凯氏定氮仪测定TVB-N含量。
1.3.2.3 脂质氧化
根据孟婧怡等[15]的方法并略作修改。将10 g搅碎牛肉样品与30 mL含2 g/100 mL 2-硫代巴比妥酸和0.1 g/100 mL EDTA的TCA溶液(25 g/100 mL)混合,10 000 r/min均质30 s。过滤后取10 mL滤液与等量20 mmol/L TCA溶液混合,100 ℃水浴加热40 min。冷却、2 000 r/min离心5 min后,取上清液,在532 nm处测定吸光度,并以1,1,3,3-四甲氧基丙烷标准曲线(y=2.015x+0.021 4(R2=0.996 8),其中y为吸光度,x为丙二醛质量浓度/(μg/mL))进行定量。
1.3.2.4 蛋白质氧化
根据Zhang Wangang等[16]的方法并稍加修改。将1 g牛肉样品与10 mL 2.0 mmol/L焦磷酸盐缓冲液(pH 7.4)混合,10 000 r/min充分匀浆。将匀浆液与20 g/100 mL TCA溶液按体积比1∶1混匀,离心(4 ℃、12 000×g、5 min),采用10 g/100 mL TCA溶解沉淀后在相同条件下离心,去除上清液后加入2 mL含10 mmol/L DNPH的HCl溶液(2 mol/L),室温静置30 min后,加入1 mL 20 g/100 mL TCA溶液,离心(4 ℃、12 000×g、5 min)并弃去上清液。沉淀用2 mL乙酸乙酯-乙醇(1∶1,V/V)清洗3 次,去除DNPH后,加入1 mL含6 mol/L盐酸胍的PBS(20 mmol/L),37 ℃反应30 min,再次离心(4 ℃、12 000×g、5 min),取上清液测定蛋白羰基含量。DNPH与羰基反应生成稳定的发色团反应物,在370 nm处具有最大吸收峰。以2 mol/L HCl溶液为空白对照组,羰基含量结果以摩尔消光系数22 000 L/(mol·cm)计算,结果表示为nmol/mg。
1.3.2.5 水分含量
参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》直接干燥法测定牛肉水分含量。
1.3.2.6 pH值
精确称取5 g牛肉样品于80 mL离心管中,加入10 mL蒸馏水,10 000 r/min匀浆1 min后,立即将pH计插入匀浆,测定pH值。
1.3.2.7 剪切力
将牛肉样品装入自封袋,80 ℃水浴加热至肉块中心温度达70 ℃,取出自封袋冷却至25 ℃,采用吸水纸吸干肉块表面水分后,顺着肌纤维方向取样(1 cm×1 cm×2 cm),然后在质构仪上测定其剪切力(kg/cm2)[17]。
1.3.2.8 a*
使用色差仪测定肉品表面色泽。包装打开后立即在肉快表面随机选取3 个位点,迅速测定a*。
1.4 数据处理
采用Excel 2019软件处理数据与作图,采用SAS 8.2软件进行方差分析。所有实验重复3 次,结果以平均值±标准差表示;采用Duncan多重检验进行组间差异显著性分析(P<0.05)。
2 结果与分析
2.1 DBD-CP协同MAP对调理牛肉微生物数的影响
一般认为新鲜牛肉的菌落总数在6(lg(CFU/g))以下,当菌落总数超过6(lg(CFU/g))时,即认为牛肉已变质。由图1A可知,DBD-CP协同MAP处理调理牛肉表面菌落总数显著下降(P<0.05),贮藏0 d,CK组菌落总数为3.95(lg(CFU/g)),T1、T2、T3、T4组菌落总数分别为3.02、2.28、1.56、1.33(lg(CFU/g))。贮藏8 d时,T1、T2、T3、T4组菌落总数分别为7.23、6.71、5.79、5.38(lg(CFU/g)),显著低于CK组(P<0.05),展现出DBD-CP协同MAP在调理牛肉杀菌保鲜方面的显著优势。另外,DBD-CP协同MAP保鲜作用与O2含量呈正相关,Huang Mingming等[18]也发现,与O2体积分数20%、40%的MAP相比,O2体积分数60%时,肉制品菌落总数更低。
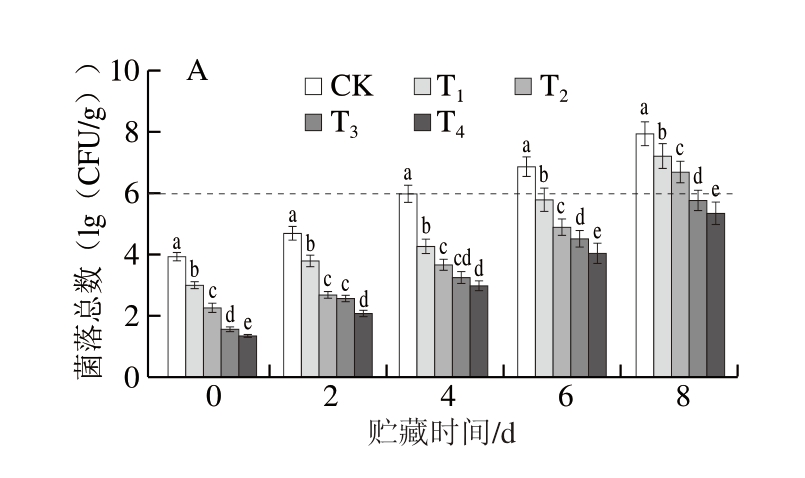
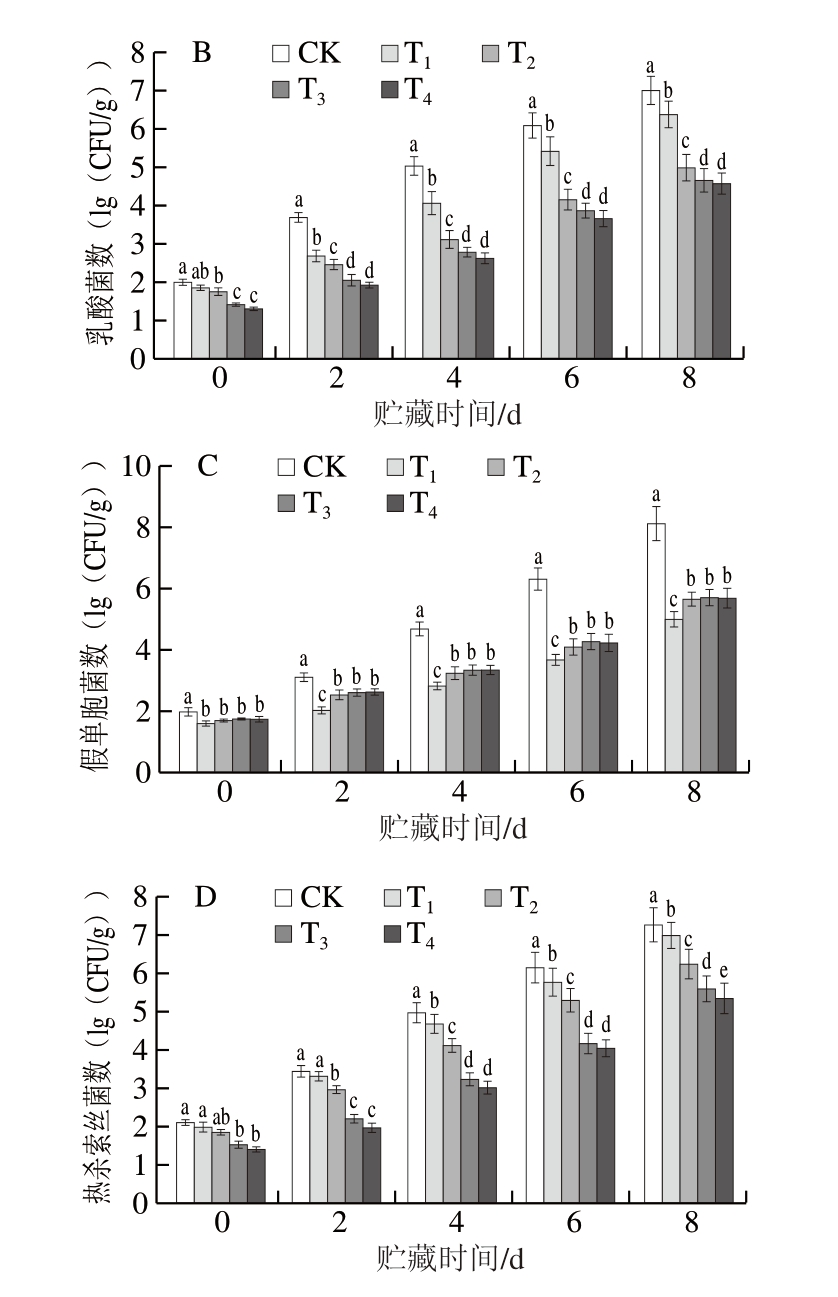
图1 DBD-CP协同MAP对调理牛肉微生物数的影响
Fig. 1 Effect of DBD-CP combined with MAP on the microbial load of prepared beef
A.菌落总数;B.乳酸菌数;C.假单胞菌数;D.热杀索丝菌数。小写字母不同表示组间差异显著(P<0.05)。图2~4同。
肉制品腐败通常由革兰氏阴性菌(假单胞菌、肠杆菌科)和革兰氏阳性菌(乳酸菌、热杀索丝菌)导致,微生物代谢活动及内源酶作用可导致不良代谢物积累,甚至产生有害物质,导致品质劣变[19]。由图1B可知,贮藏0 d时,CK组乳酸菌数为2.01(lg(CFU/g)),贮藏6 d达到6.12(lg(CFU/g))。而T1~T4组乳酸菌数随O2含量的上升呈显著下降趋势(P<0.05),高氧MAP组(T3、T4)乳酸菌数无显著差异(P>0.05)。贮藏8 d时,与CK组相比,T3、T4组乳酸菌数分别降低2.34、2.45(lg(CFU/g))(P<0.05),而T1组乳酸菌数已超过6.00(lg(CFU/g)),显著高于T2~T4组。Berruga等[20]也报道了相较于高氧MAP,真空包装牛肉肉糜贮藏期间乳酸菌数显著增加。
假单胞菌作为最具抵抗力的腐败菌之一,显著的环境适应性和代谢多样性使其成为食品腐败控制中的关键挑战。由图1C可知,贮藏6 d时,CK组假单胞菌数已达到6.33(lg(CFU/g))。T2~T4组之间在整个贮藏过程中均未见显著差异(P>0.05),这可能是由于假单胞菌是革兰氏阴性需氧菌,对CO2较为敏感,MAP可延长其滞后期,减缓其在对数期的生长速率[21],20%或更高体积分数CO2的MAP可显著抑制其生长[22]。T2~T4组CO2含量相同,故而表现出相似的抑菌效果,而T1组不含O2,因此对需氧性假单胞菌的抑制作用更加显著(P<0.05)。
热杀索丝菌是一种革兰氏阳性兼性厌氧菌,属于MAP牛肉中的天然菌群,也是其主要的腐败菌之一,能产生酸甜气味[23]。由图1D可知,CK组初始热杀索丝菌数为2.11(lg(CFU/g)),贮藏6 d超过6(lg(CFU/g))。贮藏期间,T3、T4组热杀索丝菌数显著低于T1、T2组,抑菌效果更好。
综上,相同贮藏时间下,DBD-CP协同MAP处理能够有效抑制调理牛肉中微生物的生长,且高氧环境总体抑菌效果更好,这可能归因于不同类型栅栏因子联合所产生的协同效应[24]。DBD-CP处理所产生的活性氧和活性氮(reactive oxygen and nitrogen species,RONS)是其主要抑菌物质[25],且初级氧化产物可通过一系列反应生成稳定的次级氧化产物,这些氧化产物不仅能够损坏细胞膜的通透性和完整性[26],还能够干扰细胞代谢通路,阻碍转录、逆转录和翻译过程,进而杀灭微生物[27]。而MAP对微生物的抑制效果主要取决于O2与CO2比例。
2.2 DBD-CP协同MAP对调理牛肉TVB-N含量的影响
TVB-N是动物性食品中的蛋白质在微生物与酶作用下分解产生的氨、胺类等碱性含氮物质[28],GB 2707—2016《食品安全国家标准 鲜(冻)畜、禽产品》规定鲜肉、肉制品TVB-N含量应小于15 mg/100 g。由图2可知,与CK组相比,含氧MAP协同DBD-CP处理可有效抑制贮藏过程中TVB-N含量的上升,且抑制效果随着MAP中O2含量的增加而增强。贮藏0 d时,CK组TVB-N含量为2.33 mg/100 g,贮藏6 d时,CK组TVB-N含量为15.78 mg/100 g,已成为变质肉。贮藏8 d时,TVB-N含量升至21.96 mg/100 g,此时T2组TVB-N含量为18.05 mg/100 g,T3、T4组TVB-N含量分别为13.77、12.93 mg/100 g,均显著低于CK组(P<0.05)且未超过限值,而无氧MAP中TVB-N含量为19.27 mg/100 g。贮藏过程中,牛肉TVB-N含量与其微生物种类与数量密切相关,假单胞菌与热杀索丝菌等腐败菌能够快速降解蛋白质形成碱性含氮物质[29],高氧MAP协同DBD-CP处理可有效降低牛肉表面腐败菌数量,有效延缓其TVB-N含量上升。
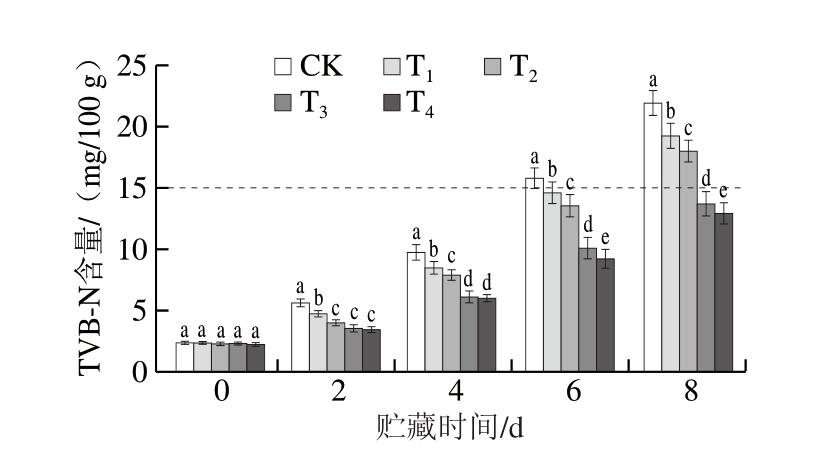
图2 DBD-CP协同MAP对调理牛肉TVB-N含量的影响
Fig. 2 Effect of DBD-CP combined with MAP on the TVB-N content of prepared beef
2.3 DBD-CP协同MAP对调理牛肉脂质氧化的影响
脂质过度氧化会产生过氧化物、羟基化合物、醛类等次级氧化产物,进而影响肉制品色泽、香味、营养等,甚至使其失去食用价值[30]。硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值常用以衡量肉制品氧化程度,由图3可知,与CK组相比,DBD-CP协同MAP可促进牛肉脂质氧化。贮藏0 d时,T1、T2、T3和T4组TBARS值分别为CK组的1.29、1.71、2.43、3.57 倍。贮藏过程中,含氧MAP牛肉TBARS值呈持续上升趋势,始终显著高于CK组(P<0.05),且TBARS值随O2含量的增加而显著升高(P<0.05)。Śmiecińska等[31]在牛肉MAP保鲜研究中也发现,高氧(80% O2)条件下贮藏的牛肉样品脂质氧化程度最高。这主要是因为CP产生的RONS可氧化牛肉中的不饱和脂肪酸,且RONS可与肉制品中的亚油酸和亚麻酸等多不饱和脂肪酸发生反应,生成相对稳定的过氧化物,从而促进自由基链式反应[15]。当TBARS值<0.6 mg/kg时,对肉制品品质无不良影响,TBARS值>1.0 mg/kg时,表明肉制品严重氧化,可判定为变质[30]。贮藏6 d时,T4组TBARS值已超过限值,但T1~T3组在贮藏8 d时仍低于限值。
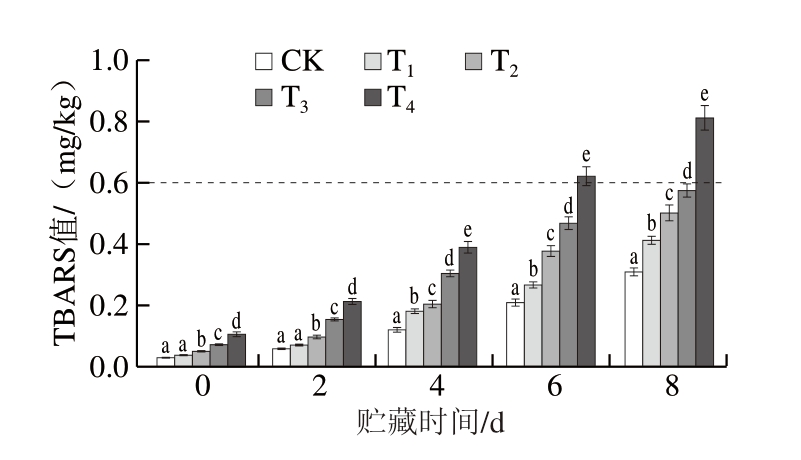
图3 DBD-CP协同MAP对调理牛肉TBARS值的影响
Fig. 3 Effect of DBD-CP combined with MAP on the TBARS value of prepared beef
2.4 DBD-CP协同MAP对调理牛肉蛋白质氧化的影响
羰基(如醛、酮、内酰胺等)主要由蛋白质中氨基酸侧链氧化修饰形成,可以反映蛋白质的氧化程度。由图4可知,贮藏0 d,T1~T4组羰基含量分别为CK组的1.02、1.04、1.15、1.22 倍。贮藏过程中,T2~T4组羰基含量始终显著高于CK组(P<0.05),贮藏8 d时,CK组羰基含量达1.18 nmol/mg,T1~T4组羰基含量分别为1.27、1.48、1.81、2.29 nmol/mg。CP处理产生的RONS能够与肉制品中的半胱氨酸残基发生反应,破坏蛋白质分子间和内部的二硫键,导致蛋白质变性和聚集[30]。同时,RONS能够与蛋白质中的芳香族氨基酸、半胱氨酸、赖氨酸、精氨酸等发生加成反应,生成羰基化产物,并继续与肉制品中已形成的羰基、硝基酪氨酸等发生反应,加速蛋白氧化[32]。此外,脂质氧化形成的一些脂质过氧化产物也会与肌球蛋白结合,促进羰基形成[33]。由此可知,在DBD-CP协同MAP保鲜牛肉的研究与实际应用中,需筛选合适的MAP参数,最大程度降低CP造成的负面影响。
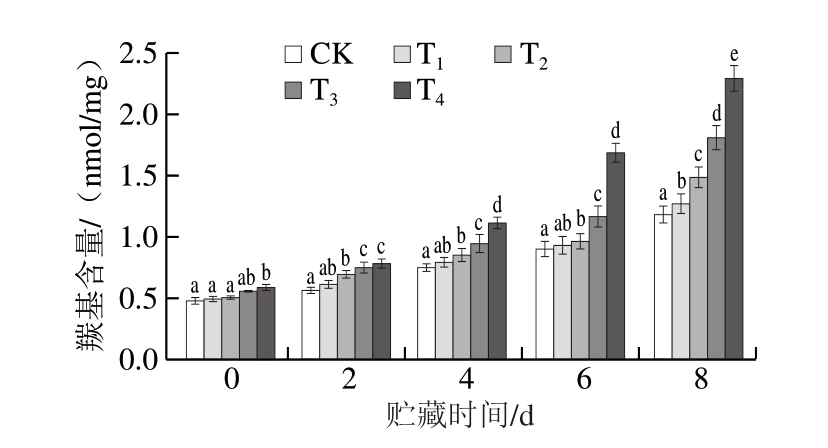
图4 DBD-CP协同MAP对调理牛肉羰基含量的影响
Fig. 4 Effect of DBD-CP combined with MAP on the carbonyl group content of prepared beef
2.5 DBD-CP协同MAP对调理牛肉水分含量的影响
由表2可知,贮藏0 d时,各组水分含量无显著差异(P>0.05)。随着贮藏时间的延长,各组水分含量均呈下降趋势,但DBD-CP协同MAP可有效延缓牛肉水分含量的下降。贮藏8 d时,CK组水分质量分数降至62.17%,显著低于T1~T4组水分含量(P<0.05),T3、T4组之间差异不显著(P>0.05)。研究发现,CP处理会显著缩短肌纤维束之间的距离,破坏牛肉肌原纤维结构[34],使得肌肉纤维束变得松散,产生更多的小片化结构,从而有效提高牛肉的保水性。
表2 DBD-CP协同MAP对调理牛肉水分含量的影响
Table 2 Effect of DBD-CP combined with MAP on the water content of prepared beef %

注:同行小写字母不同表示组间差异显著(P<0.05)。表3~5同。
贮藏时间/dCKT1T2T3T4 071.33±0.22a71.06±0.18a71.18±0.20a71.55±0.30a71.43±0.20a 269.62±0.30a69.65±0.22a69.63±0.19a69.67±0.18a69.74±0.26a 467.13±0.25a67.37±0.17ab67.25±0.22ab67.51±0.27ab67.59±0.18b 663.22±0.20a65.19±0.19b65.89±0.27c66.22±0.20c66.28±0.25c 862.17±0.21a63.52±0.22b64.33±0.18c64.90±0.19d64.97±0.27d
2.6 DBD-CP协同MAP对调理牛肉pH值的影响
由表3可知,贮藏0 d,CK组pH值为5.73,与之相比,而经DBD-CP协同MAP处理的牛肉pH值显著降至5.55~5.58(P<0.05)。值得注意的是,O2含量对MAP牛肉pH值的影响并不明显。MAP含有O2和N2,DBD-CP处理产生的过氧亚硝基溶于牛肉表面水可产生亚硝酸和硝酸[35],这可能是造成pH值下降的主要原因。贮藏过程中,CK组pH值上升明显,贮藏8 d时,CK组pH值升至6.32,已达次级鲜肉标准。这是由于贮藏过程中,表面微生物产生的蛋白酶可将牛肉蛋白水解生成胺类、硫化物等碱性含氮物质,导致pH值上升与腐败变质[36]。而此时,含氧MAP组pH值分别为5.97、5.83、5.82,低pH值环境有助于抑制牛肉贮藏过程中微生物的生长和TVB-N的产生,这与微生物数与TVB-N含量结果相符。
表3 DBD-CP协同MAP对调理牛肉pH值的影响
Table 3 Effect of DBD-CP combined with MAP on the pH of prepared beef
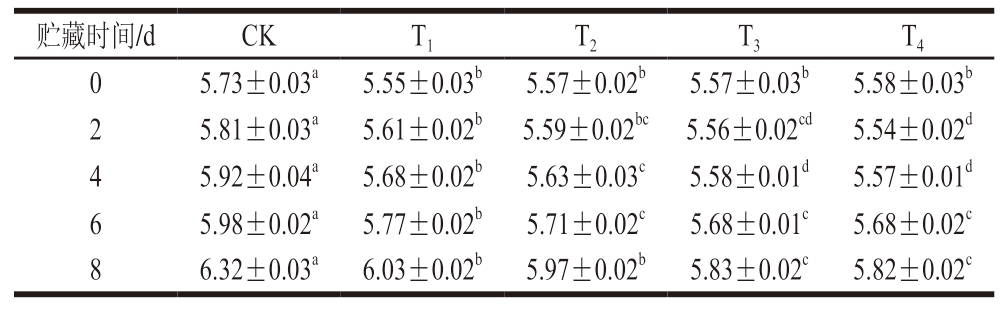
贮藏时间/dCKT1T2T3T4 05.73±0.03a5.55±0.03b5.57±0.02b5.57±0.03b5.58±0.03b 25.81±0.03a5.61±0.02b5.59±0.02bc5.56±0.02cd5.54±0.02d 45.92±0.04a5.68±0.02b5.63±0.03c5.58±0.01d5.57±0.01d 65.98±0.02a5.77±0.02b5.71±0.02c5.68±0.01c5.68±0.02c 86.32±0.03a6.03±0.02b5.97±0.02b5.83±0.02c5.82±0.02c
2.7 DBD-CP协同MAP对调理牛肉剪切力的影响
嫩度是牛肉重要的感官特性,剪切力大小可直观反映肉制品嫩度。由表4可知,贮藏0 d,与CK组相比,DBD-CP协同MAP对牛肉嫩度无显著影响(P>0.05)。贮藏过程中,各组剪切力均呈上升趋势,但DBD-CP协同MAP可有效延缓剪切力上升,进而有效保持牛肉嫩度,且贮藏后期,随着MAP中O2含量的提高,剪切力呈下降趋势,这可能与适度氧化应激反应有关。黄琳琳等[17]研究发现,一定程度的氧化应激反应可促进肌肉蛋白氧化,从而促进细胞凋亡蛋白酶产生,并协同钙蛋白酶水解牛肉肌原纤维蛋白,从而改善安格斯杂交牛肉的嫩度。Fu Qingquan等[37]也证明适度氧化应激反应可导致肉制品肌球蛋白氧化位点和酶解位点暴露,有效提升肉制品嫩度。贮藏8 d时,T1~T4组剪切力分别为2.47、2.36、2.33、2.30 MPa,显著低于CK组(2.63 MPa,P<0.05)。T1~T4组牛肉嫩度的保持还可能与其较低的pH值有关,酸性环境可改变肌节及胶原蛋白结构[38],可能导致牛肉肌原纤维肌节变化。综上,DBD-CP协同MAP有助于保持牛肉嫩度。
表4 DBD-CP协同MAP对调理牛肉剪切力的影响
Table 4 Effect of DBD-CP combined with MAP on the shear force of prepared beef MPa
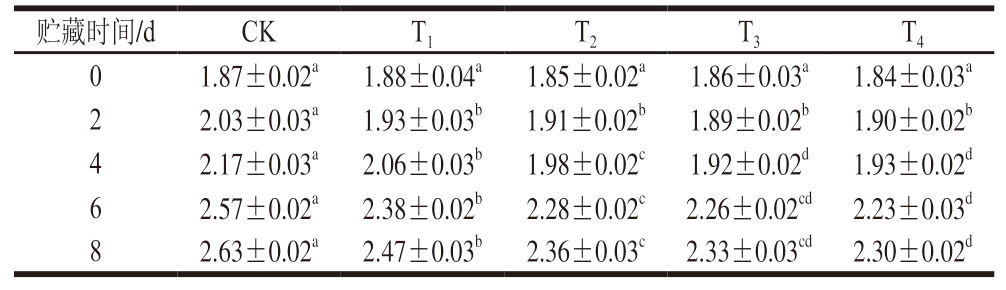
贮藏时间/dCKT1T2T3T4 01.87±0.02a1.88±0.04a1.85±0.02a1.86±0.03a1.84±0.03a 22.03±0.03a1.93±0.03b1.91±0.02b1.89±0.02b1.90±0.02b 42.17±0.03a2.06±0.03b1.98±0.02c1.92±0.02d1.93±0.02d 62.57±0.02a2.38±0.02b2.28±0.02c2.26±0.02cd2.23±0.03d 82.63±0.02a2.47±0.03b2.36±0.03c2.33±0.03cd2.30±0.02d
2.8 DBD-CP协同MAP对调理牛肉a*的影响
a*是消费者判断肉品新鲜度的关键指标,可在一定程度上反映肌红蛋白的氧合状态。由表5可知,随着贮藏时间的延长,各组a*均呈下降趋势。贮藏0 d,各组a*并无显著差异(P>0.05),贮藏8 d,CK组a*为22.73,而T1~T4组a*均显著低于CK组(P<0.05),分别为11.63、14.29、15.21和17.13。在放血充分的牛肉中,a*主要由肌红蛋白状态决定,O2充分时,肌红蛋白与O2结合形成氧合肌红蛋白,呈现鲜红色,但CP产生的RONS与脂质反应,产生的脂质自由基可在贮藏过程中攻击氧合肌红蛋白,形成高铁肌红蛋白,从而使肉色变成暗红色[39]。随着O2含量的提高,MAP牛肉的a*逐渐上升,这可能是由于高氧含量能够促进氧肌红蛋白(鲜红色)形成。Holman等[40]研究发现,当牛肉a*≥14.5时,其色泽可接受,由此判断,在贮藏8 d时,T3、T4组牛肉色泽仍在可接受范围内。
表5 DBD-CP协同MAP对调理牛肉a*的影响
Table 5 Effect of DBD-CP combined with MAP on the redness value of prepared beef
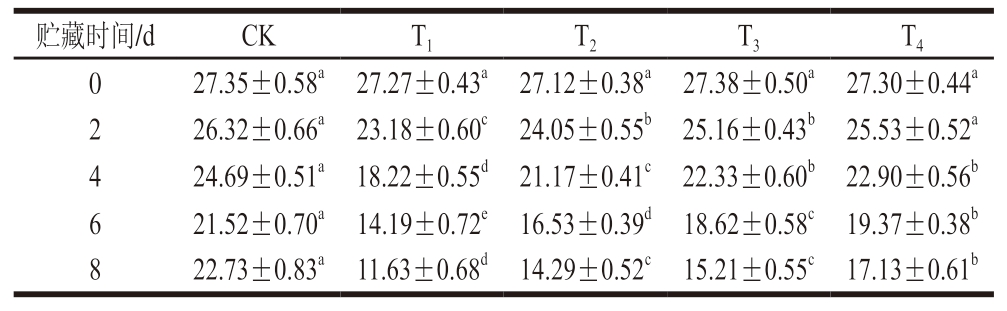
贮藏时间/dCKT1T2T3T4 027.35±0.58a27.27±0.43a27.12±0.38a27.38±0.50a27.30±0.44a 226.32±0.66a23.18±0.60c24.05±0.55b25.16±0.43b25.53±0.52a 424.69±0.51a18.22±0.55d21.17±0.41c22.33±0.60b22.90±0.56b 621.52±0.70a14.19±0.72e16.53±0.39d18.62±0.58c19.37±0.38b 822.73±0.83a11.63±0.68d14.29±0.52c15.21±0.55c17.13±0.61b
3 结论
探究DBD-CP协同MAP对调理牛肉微生物安全性和品质指标的影响。结果表明,随着MAP中O2含量的增加,DBD-CP协同MAP能够有效抑制调理牛肉贮藏过程中腐败微生物的生长,并有效延缓牛肉TVB-N含量的上升,说明该活性包装能够提高调理牛肉贮藏保鲜效果;CP产生的自由基会攻击牛肉中的脂质和蛋白质,造成蛋白质和脂质氧化,表现为随着MAP中O2含量的增加,牛肉中TBARS值和羰基含量显著上升(P<0.05),但牛肉a*随着O2含量增加而不断提升。当MAP中O2体积分数达40%时,DBD-CP协同MAP不仅可以有效降低牛肉中微生物数量和TVB-N含量,也可有效控制牛肉蛋白质和脂肪氧化水平,且能维持较好的牛肉嫩度和色泽。因此,40% O2、30% N2和30% CO2的MAP协同DBD-CP处理有望成为保持调理牛肉食用品质的新型活性包装方式,延长其货架期。
[1] KAPETANAKOU A E, PATERAKI G L, SKANDAMIS P N.Developing a commercial antimicrobial active packaging system of ground beef based on “tsipouro” alcoholic distillate[J]. Foods, 2020,9(9): 1171. DOI:10.3390/foods9091171.
[2] 雷英杰, 王卫, 刘文龙, 等. 调理肉制品防腐保鲜技术研究进展[J].农产品加工, 2020(11): 98-102. DOI:10.16693/j.cnki.1671-9646(X).2020.11.066.
[3] JI J, SHANKAR S, ROYON F, et al. Essential oils as natural antimicrobials applied in meat and meat products: a review[J]. Critical Reviews in Food Science and Nutrition, 2023, 63(8): 993-1009.DOI:10.1080/10408398.2021.1957766.
[4] FALOWO A B, FAYEMI P O, AND MUCHENJE V. Natural antioxidants against lipid-protein oxidative deterioration in meat and meat products: a review[J]. Food Research International, 2014, 64:171-181. DOI:10.1016/j.foodres.2014.06.022.
[5] 张毅, 欧阳何一, 雷飞飞, 等. 冷鲜鸭肉气调包装微环境优化及其对品质的影响[J]. 食品工业科技, 2021, 42(11): 268-274. DOI:10.13386/j.issn1002-0306.2020070209.
[6] COOKSEY K. Modified atmosphere packaging of meat, poultry and fish[M]//HAN J H. Innovations in food packaging. Amsterdam:Elsevier, 2014: 475-493. DOI:10.1016/B978-0-12-394601-0.00019-9.
[7] GIOACCHINO B, OKPALA C, ALBERIO G, et al. Toward shrimp consumption without chemicals: combined effects of freezing and modified atmosphere packaging (MAP) on some quality characteristics of giant red shrimp (Aristaeomorpha foliacea) during storage[J].Food Chemistry, 2016, 197(Part A): 581-588. DOI:10.1016/j.foodchem.2015.10.146.
[8] BOURKE P, ZIUZINA D, BOEHM D, et al. The potential of cold plasma for safe and sustainable food production[J].Trends in Biotechnology, 2018, 6(36): 615-626. DOI:10.1016/j.tibtech.2017.11.001.
[9] NASIRU M M, FRIMPONG E B, MUHAMMAD U, et al. Dielectric barrier discharge cold atmospheric plasma: influence of processing parameters on microbial inactivation in meat and meat products[J].Comprehensive Reviews in Food Science and Food Safety, 2021,20(3): 2626-2659. DOI:10.1111/1541-4337.12740.
[10] 韩格, 陈倩, 孔保华. 低温等离子体技术在肉品保藏及加工中的应用研究进展[J]. 食品科学, 2019, 40(3): 286-292. DOI:10.7506/spkx1002-6630-20180128-387.
[11] LEE H, YONG H I, KIM H, et al. Evaluation of the microbiological safety, quality changes, and genotoxicity of chicken breast treated with flexible thin-layer dielectric barrier discharge plasma[J]. Food Science and Biotechnology, 2016, 25(4): 1189-1195. DOI:10.1007/s10068-016-0189-1.
[12] JAYASENA D D, KIM H J, YONG H I, et al. Flexible thin-layer dielectric barrier discharge plasma treatment of pork butt and beef loin:effects on pathogen inactivation and meat-quality attributes[J]. Food Microbiology, 2015, 46: 51-57. DOI:10.1016/j.fm.2014.07.009.
[13] 格桑卓玛, 赵见营, 阮贵萍, 等. 生鲜牛肉调理配制方法对高氧MAP保鲜包装产品保鲜效果的影响研究[J]. 食品工业科技, 2013, 34(2):310-314; 318. DOI:10.13386/j.issn1002-0306.2013.02.080.
[14] 周彬静, 刘小花, 彭菁, 等. 荧光假单胞菌和热杀索丝菌对低温贮藏期间猪肉品质变化的影响[J]. 食品科学, 2022, 43(19): 208-216.DOI:10.7506/spkx1002-6630-20211010-093.
[15] 孟婧怡, 黄明明, 王佳媚, 等. 低温等离子体冷杀菌处理时间及电压强度对生鲜猪肉脂质氧化的影响[J]. 食品科学, 2019, 40(3): 135-141. DOI:10.7506/spkx1002-6630-20171207-079.
[16] ZHANG W G, XIAO S, LEE E J, et al. Consumption of oxidized oil increases oxidative stress in broilers and affects the quality of breast meat[J]. Journal of Agricultural and Food Chemistry, 2011, 59(3): 969-974. DOI:10.1021/jf102918z.
[17] 黄琳琳, 张一敏, 董鹏程, 等. 氧化应激对宰后初期牛肉嫩度的影响研究: 基于蛋白质氧化和细胞凋亡途径[J]. 食品与发酵工业, 2023,49(1): 199-206. DOI:10.13995/j.cnki.11-1802/ts.031080.
[18] HUANG M M, WANG J M, ZHUANG H, et al. Effect of in-package high voltage dielectric barrier discharge on microbiological, color and oxidation properties of pork in modified atmosphere packaging during storage[J]. Meat Science, 2019, 149: 107-113. DOI:10.1016/j.meatsci.2018.11.016.
[19] POTHAKOS V, DEVLIEGHERE F, VILLANI F, et al. Lactic acid bacteria and their controversial role in fresh meat spoilage[J]. Meat Science, 2015, 109: 66-74. DOI:10.1016/j.meatsci.2015.04.014.
[20] BERRUGA M, VERGARA H, GALLEGO L. Influence of packaging conditions on microbial and lipid oxidation in lamb meat[J].Small Ruminant Research, 2005, 57(2/3): 257-264. DOI:10.1016/j.smallrumres.2004.08.004.
[21] MORTAZAVI S M H, KAUR M, FARAHNAKY A, et al. The pathogenic and spoilage bacteria associated with red meat and application of different approaches of high CO2 packaging to extend product shelf-life[J]. Critical Reviews in Food Science and Nutrition,2023, 63(12): 1733-1754. DOI:10.1080/10408398.2021.1968336.
[22] PREETI S, ALI B W, SVEN S, et al. Understanding critical factors for the quality and shelf-life of MAP fresh meat: a review[J]. Critical Reviews in Food Science and Nutrition, 2011, 51(2): 146-177.DOI:10.1080/10408390903531384.
[23] MICHELLE M X, MANDEEP K, CHRISTOPHER P, et al. Effect of protective cultures on spoilage bacteria and the quality of vacuumpackaged lamb meat[J]. Food Bioscience, 2022, 50(3):102148.DOI:10.1016/j.fbio.2022.102148.
[24] CHENG H Y, YANG H Y, CHOU C C. Influence of acid adaptation on the tolerance of Escherichia coli O157:H7 to some subsequent stresses[J]. Journal of Food Protection, 2002, 65(2): 260-265.DOI:10.4315/0362-028X-65.2.260.
[25] BAUER A, NI Y, BAUER S, et al. The effects of atmospheric pressure cold plasma treatment on microbiological, physical-chemical and sensory characteristics of vacuum packaged beef loin[J]. Meat Science,2017, 128: 77-87. DOI:10.1016/j.meatsci.2017.02.003.
[26] ZHAO J Y, QIAN J, LUO J, et al. Morphophysiological changes in Staphylococcus aureus biofilms treated with plasma-activated hydrogen peroxide solution[J]. Applied Sciences, 2021, 11(24): 11597.DOI:10.3390/app112411597.
[27] WANG Z B, WANG X T, SHENG X W, et al. Unraveling the antibacterial mechanism of plasma-activated lactic acid against Pseudomonas ludensis by untargeted metabolomics[J]. Foods, 2023,12(8): 1605. DOI:10.3390/foods12081605.
[28] HAO R Y, ROY K, PAN J F, et al. Critical review on the use of essential oils against spoilage in chilled stored fish: a quantitative meta-analyses[J]. Trends in Food Science & Technology, 2021, 111:175-190. DOI:10.1016/j.tifs.2021.02.054.
[29] SAENZ-GARCIA C E, CASTANEDA-SERRANO P, MERCADOSILVA E M, et al. Insights into the identification of the specific spoilage organisms in chicken meat[J]. Foods, 2020, 9(2): 225.DOI:10.3390/foods9020225.
[30] 岑南香, 刘宸成, 陈姑, 等. 低温等离子体处理对羊肉脂质与蛋白质氧化性质的影响[J]. 食品工业科技, 2022, 43(14): 85-93.DOI:10.13386/j.issn1002-0306.2021100306.
[31] ŚMIECIŃSKA K, DASZKIEWICZ T. Lipid oxidation and color changes in beef stored under different modified atmospheres[J].Journal of Food Processing and Preservation, 2021, 45(3): e15263.DOI:10.1111/jfpp.15263.
[32] 符婉丽, 桑晓涵, 陈姑, 等. 低温等离子体对金鲳鱼蛋白质和脂质氧化的影响[J]. 食品研究与开发, 2022, 43(22): 15-22. DOI:10.12161/j.issn.1005-6521.2022.22.003.
[33] ESTEVEZ M. Protein carbonyls in meat systems: a review[J]. Meat Science, 2011, 89(3): 259-279. DOI:10.1016/j.meatsci.2011.04.025.
[34] LUO J, XU W M, LIU Q, et al. Dielectric barrier discharge cold plasma treatment of pork loin: effects on muscle physicochemical properties and emulsifying properties of pork myofibrillar protein[J].LWT-Food Science and Technology, 2022, 162(Part 3): 113484.DOI:10.1016/j.lwt.2022.113484.
[35] KIM H J, YONG H I, PARK S, et al. Effects of dielectric barrier discharge plasma on pathogen inactivation and the physicochemical and sensory characteristics of pork loin[J]. Current Applied Physics,2013, 13(7): 1420-1425. DOI:10.1016/j.cap.2013.04.021.
[36] BEKHIT A E A, HOLMAN B W B, GITERU S G, et al. Total volatile basic nitrogen (TVB-N) and its role in meat spoilage:a review[J]. Trends in Food Science & Technology, 2021, 109: 280-302. DOI:10.1016/j.tifs.2021.01.006.
[37] FU Q Q, LIU R, ZHANG W G, et al. In vitro susceptibility of oxidized myosin by μ-calpain or caspase-3 and the determination of the oxidation sites of myosin heavy chains[J]. Journal of Agricultural and Food Chemistry, 2020, 68(32): 8629-8636. DOI:10.1021/acs.jafc.0c01065.
[38] BARRALES A J, HADINOTO K, CULLEN P, et al. Effect of plasma activated water on the nutritional composition, storage quality and microbial safety of beef[J]. LWT-Food Science and Technology, 2022,154: 112794. DOI:10.1016/j.lwt.2021.112794.
[39] WANG X T, WANG Z B, ZHUANG H, et al. Changes in color,myoglobin, and lipid oxidation in beef patties treated by dielectric barrier discharge cold plasma during storage[J]. Meat Science, 2021,176: 108456. DOI:10.1016/j.meatsci.2021.108456.
[40] HOLMAN B, REMY J, MAO Y, et al. Using instrumental (CIE and reflectance) measures to predict consumers’ acceptance of beef colour[J]. Meat Science, 2017, 127: 57-62. DOI:10.1016/j.meatsci.2017.01.005.