肌肉是肉中最能体现其生物学特征的组成部分,而蛋白质是肌肉中最主要的成分。肌肉蛋白通常被分为3 类:肌原纤维蛋白(myofibrillar protein,MP)、肌浆蛋白和结缔组织蛋白。其中,MP是肌肉中一种具有重要生物学功能的结构蛋白,占肌肉蛋白质的一半以上,对肉的加工性能和肉制品的质量起着至关重要的作用[1],它与肉制品的质构、保水性、流变学特性等有着紧密的联系。
为有效改善肉制品及其凝胶类产品的品质,对其进行加工生产时,通常会添加一些多糖类物质,如膳食纤维[2-4]等。李可[5]、庄昕波[6]、曹云刚[7]等均发现膳食纤维可以显著改善MP的凝胶特性,但不同类型及来源的膳食纤维对凝胶型制品的持水性、质构等特性有不同的影响。
紫薯含有丰富的膳食纤维以及植物多酚、氨基酸、维生素、矿物质,尤其是硒元素等人体需要的营养成分与活性物质[8-9],在人体抗癌、抗氧化、防辐射、降血压等方面发挥着不同程度的功效。其中,紫薯膳食纤维(purple sweet potato dietary fiber,PPDF)富含黄酮类(花色素苷、黄烷、黄酮、黄酮醇、黄烷醇)、酚酸(没食子酸、阿魏酸)及缩合单宁(聚合的原花色素和高分子质量水解鞣质)等天然抗氧化成分[10-11],具有显著的抗氧化活性。目前,以紫薯为原料,利用PPDF改善肉制品质量的研究鲜见报道。
除添加物会对肉制品的质量产生影响外,一些加工处理方式也在一定程度上影响肉制品的品质,如超高压[12-13]、超声波[14-15]等。近年来,由于超声波具有成本低、污染小和效率高等优点,被广泛应用于食品加工中。超声波处理(ultrasound treatment,UT)能促进化学反应,使蛋白质发生交联[16]。李可等[17]发现,UT有助于改善低盐条件下鸡肉MP的物理稳定性与乳化特性;李颖畅等[18]发现,超声波辅助没食子酸能够改变蛋白质的结构,从而促进MP形成具有更高黏弹性的凝胶网络结构,使蛋白质凝胶性能得到显著提升;Xiong Yao等[19]发现,UT可以提高MP和黄原胶的络合程度,从而有效提高MP的凝胶乳化性能。
为有效改善鸡肉MP的凝胶特性,将PPDF与UT联合使用,探究它们之间的协同效应及其作用机理,对改善鸡肉MP的凝胶特性具有重要意义。本研究采用PPDF协同UT对MP凝胶体系进行处理,对不同UT条件下添加PPDF的MP凝胶特性进行研究,旨在为阐明PPDF-UT协同处理机制、开发和提高肉类产品质量提供理论基础。
1 材料与方法
1.1 材料与试剂
鸡胸肉 市购;PPDF 斯诺特生物科技有限公司。
氯化钠、磷酸二氢钠、磷酸氢二钠、8-苯胺基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)、氯化钾、氯化镁、硫酸铜、酒石酸钾钠、乙二醇双(2-氨基乙基醚)四乙酸(ethylene glycol tetraacetic acid,EGTA)、氢氧化钠(均为分析纯) 天津市科密欧化学试剂有限公司。
1.2 仪器与设备
S10手提式高速分散器 宁波新芝生物科技股份有限公司;DZKW-D-Z电热恒温水浴锅 北京市永光明医疗仪器有限公司;TDL-40B低速离心机 上海安亭科学仪器厂;FD-1A-80冷冻干燥机 上海比朗仪器制造有限公司;TMS-Pro质构仪 美国Food Technology Corporation;MCR 102e流变仪 江苏岱洛医疗科技有限公司;Cary Eclipse荧光分光光度计 美国安捷伦科技有限公司;TU-1810紫外-可见分光光度计 深圳市歌能清洗设备有限公司;G-080ST超声波清洗机 烟台喜来乐商贸有限公司。
1.3 方法
1.3.1 样品处理
将鸡胸肉去骨、去筋、去脂,用绞肉机将其搅碎(3 000 r/min绞碎2 次,每次20 s),混合均匀后装入真空袋中(150 g/袋),-20 ℃冻藏,2 周内使用完毕。
1.3.2 MP的提取
参考Li Ke等[20]的方法并稍作修改,将鸡胸肉放入4 ℃冰箱中解冻12 h,然后与提取缓冲液(10 mmol/L Na2HPO4/NaH2PO4、0.1 mol/L NaCl、2 mmol/L MgCl2、1 mmol/L EGTA,pH 7.0,4 ℃)以1∶4(g/mL)料液比用高速分散器进行混合,8 000 r/min均质3 次,每次30 s;所得肉浆用2 层纱布过滤,4 000 r/min离心15 min,收集沉淀,上述步骤重复2 次。向所得MP沉淀中加入4 倍体积提取液(0.1 mol/L NaCl),8 000 r/min均质3 次,每次30 s,所得沉淀混合液用2 层纱布过滤,4 000 r/min离心15 min,重复上述步骤2 次,得到纯化的MP。整个提取过程在4 ℃下进行。以结晶牛血清白蛋白作为标样,MP的含量采用双缩脲法进行测定。MP在4 ℃下冷藏,48 h内使用完毕。
1.3.3 PPDF-MP混合液的制备
参照Chen Xing等[21]的方法,将MP溶液质量浓度调整为30 mg/mL,加入质量分数2% PPDF,8 000 r/min均质30 s使样品混匀,用于进行UT。
1.3.4 不同超声功率处理PPDF-MP混合物
设置超声功率分别为0、120、180、240、300、360、420 W,超声时间为9 min,取25 mL PPDF-MP混合液于50 mL烧杯中进行UT,处理温度低于18 ℃,将处理后的混合物置于4 ℃冰箱保存备用,用于动态流变学特性、活性巯基含量、表面疏水性的测定及凝胶的制备。
1.3.5 不同超声时间处理PPDF-MP混合物
将超声功率设定为1.3.4节中得出的最适功率,设置超声时间分别为0、3、6、9、12、15、18 min,取25 mL PPDF-MP混合液于50 mL烧杯中进行UT,处理温度低于18 ℃,将处理后的混合物置于4 ℃冰箱保存备用,用于动态流变学特性、活性巯基含量、表面疏水性的测定及凝胶的制备。
1.3.6 不同PPDF添加量的PPDF-MP混合物UT
超声条件为1.3.4、1.3.5节中得出的最适超声功率与时间,将MP溶液质量浓度调节为30 mg/mL,PPDF的添加量分别为0%、1%、2%、3%、4%、5%,对25 mL不同PPDF添加量的PPDF-MP混合物进行UT,处理温度低于18 ℃,处理后的混合物置于4 ℃冰箱保存备用,用于动态流变学特性、活性巯基含量、表面疏水性的测定及凝胶的制备。
1.3.7 不同处理组MP溶液的对比实验
采用1.3.4、1.3.5节中得出的最适超声功率与时间对MP溶液进行处理,标记为UT;采用1.3.6节中得出的最适PPDF添加量对MP溶液进行处理,标记为PPDF;采用上述最适超声功率和时间结合最适PPDF添加量共同处理MP溶液,标记为UT-PPDF。每个处理组溶液体积为25 mL,处理温度低于18 ℃,处理后的混合物置于4 ℃冰箱保存备用,用于动态流变学特性、活性巯基含量、表面疏水性的测定及凝胶的制备。
1.3.8 动态流变学特性的测定
参考计红芳等[22]的方法并稍作修改,对仪器进行校准并调整参数后,选用pp 50圆形平板探头,将其间隙设置为1 mm,将样品涂抹在2 个平板之间,以2 ℃/min从20 ℃升温至80 ℃,并设置应变为1%,频率为1 Hz。记录储能模量(G’)和损耗模量(G”)随温度的变化。
1.3.9 活性巯基含量的测定
参考潘杰[23]的方法,将样品溶液用含0.4 mol/L NaCl的磷酸盐缓冲液(10 mmol/L Na2HPO4/NaH2PO4,pH 7.0)稀释至质量浓度为1 mg/mL,向4 mL稀释液中添加50 μL 10 mmol/L 5,5’-二硫代双(2-硝基苯甲酸)溶液,摇匀后,在避光条件下反应20 min。向上述4 mL磷酸盐缓冲液中加入50 μL 10 mmol/L 5,5’-二硫代双(2-硝基苯甲酸)溶液作为对照组,采用紫外分光光度计,于412 nm波长处测定吸光度(A412 nm)。活性巯基含量按式(1)计算:
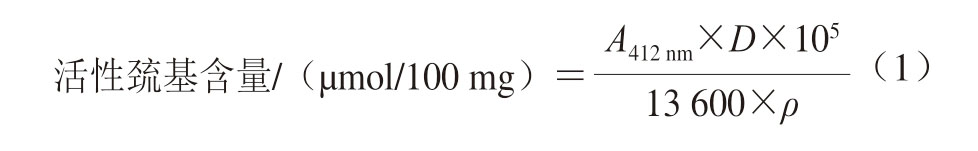
式中:D为稀释倍数;ρ为MP质量浓度/(mg/mL)。
1.3.10 表面疏水性的测定
参考Zhang Ziye等[24]的方法,PPDF-MP混合溶液表面疏水性的测定采用ANS荧光探针法进行。将PPDF-MP混合溶液稀释为一系列质量浓度(1、0.5、0.25、0.125 mg/mL)。向4 mL样品溶液中加入20 μL ANS缓冲液(8 mmol/L ANS、0.1 mol/L K2HPO4,pH 6.0),混匀。于黑暗处静置25 min后,使用荧光分光光度计,于激发波长374 nm、发射波长485 nm处测定其荧光强度。以荧光强度为纵坐标,蛋白质量浓度为横坐标作图,直线的初始斜率即为蛋白质的表面疏水性。
1.3.11 PPDF-MP混合凝胶的制备
取1.3.4~1.3.6节所得混合物10 mL,500×g离心3 min去除气泡,置于20 mL烧杯中,于水浴锅中以2 ℃/min速率从20 ℃升温至80 ℃,保温20 min后立即冰浴,4 ℃静置过夜,用于凝胶保水性、凝胶强度、质构特性的测定。
1.3.12 凝胶保水性的测定
参考滕安国等[25]的方法并稍作修改,将凝胶3 000 r/min离心5 min后称质量,用滤纸对离心后的凝胶进行擦拭,吸取水分后再次称质量。每个处理重复3 次,凝胶保水性按式(2)计算:
式中:m为离心管质量/g;m1为离心管和离心后凝胶质量/g;m2为离心管和离心前凝胶质量/g。
1.3.13 凝胶强度的测定
参考刘旺等[12]的方法并稍作修改,采用质构仪测定凝胶强度。使用P/5探头,设置测前速率120 mm/min,测试距离4 mm,测试速率60 mm/min,触发力0.1 N。每组样品测定3 次。
1.3.14 质构特性的测定
参考计红芳等[22]的方法并稍作修改,采用质构仪测定凝胶质构特性。选用P/36R探头,设置测前速率60 mm/min,形变量30%,测试速率120 mm/min,触发力0.1 N。每组样品测定3 次,求平均值。
1.4 数据处理
每组实验重复2~3 次。采用SPSS 26.0软件对数据进行方差分析和显著性分析,P<0.05表明具有显著差异;采用Origin软件绘图。
2 结果与分析
2.1 超声功率对PPDF-MP及其凝胶特性的影响
2.1.1 超声功率对PPDF-MP动态流变学特性的影响
G’和G”的变化可以反映凝胶的形成过程。如图1所示,在升温过程中,G’呈先增加后减小、最后又急剧增大的趋势。变化趋势主要分为3 个阶段,第1个阶段出现在45~55 ℃,是凝胶的形成阶段,这是由于MP的部分展开,MP通过二硫键发生不可逆的头部聚合;第2个阶段出现在55~65 ℃,是凝胶发生裂化的阶段,由于温度的逐渐升高,MP头部发生瓦解,尾部逐渐展开;第3个阶段出现在65 ℃之后,凝胶网络结构得到了强化,这是由于发生了连续的蛋白质聚集过程,从而形成稳定的结构,以及MP的变性程度增大,蛋白之间形成更多的二硫键,促进凝胶网络交联,使G’持续增加[26]。G”被广泛用于描述凝胶的黏度,一般而言,黏度越大的凝胶保水性越好。因此较高的G”有利于实现凝胶对水分的捕捉和固定,从而形成致密且均一的凝胶结构。
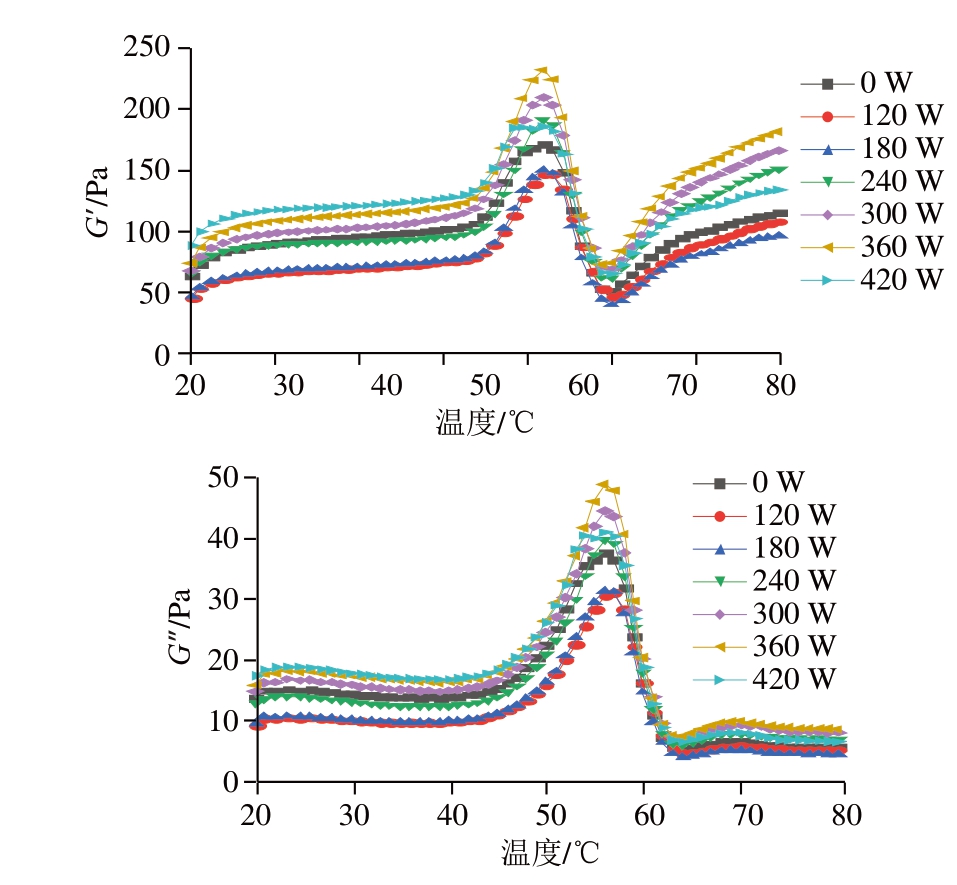
图1 不同超声功率处理下PPDF-MP混合物的温度扫描曲线
Fig. 1 Temperature sweep curves of PPDF-MP mixture treated with different ultrasonic powers
120、180 W超声条件下,样品的G’和G”均小于对照组(0 W),可能是由于当超声功率较低时,蛋白质会因超声作用转化为小片段的亚基,导致蛋白质颗粒减小,进而影响其凝胶特性[26]。当超声功率为360 W时,G’和G”均达到最大,由此可见,UT可以提高MP形成凝胶的能力。当超声功率大于360 W时,G’和G”出现降低的趋势,可能是由于超声功率过大,导致蛋白质发生了较大程度的变性。
2.1.2 超声功率对PPDF-MP活性巯基含量的影响
蛋白表面的活性巯基是蛋白中最活跃的功能基团之一,可以反映蛋白质氧化程度。如图2所示,超声功率为360 W时活性巯基含量最高,这可能是由于随着超声功率提高,蛋白结构逐渐展开,构象发生变化,诱导活性巯基暴露[27]。同时,巯基的暴露速度高于二硫键的形成速度,导致活性巯基含量显著增加(P<0.05)。但当超声功率进一步提高,活性巯基含量有所下降,这可能是由暴露在外的巯基被氧化所致[28]。
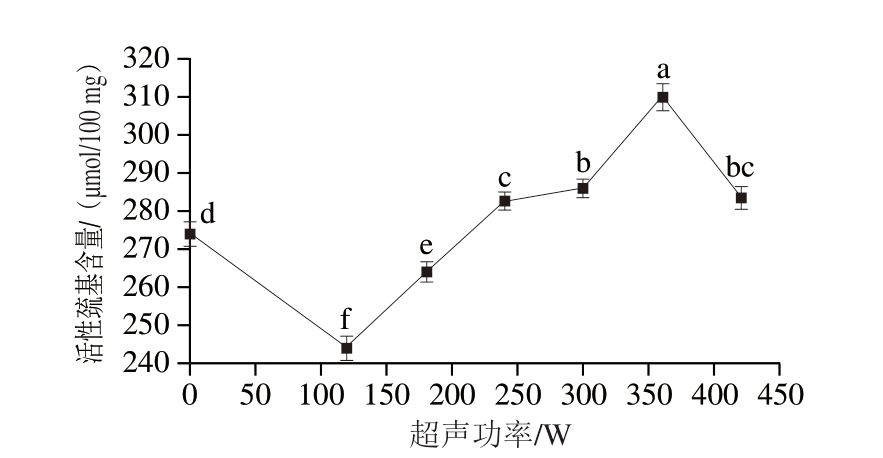
图2 不同超声功率处理下PPDF-MP混合物的活性巯基含量
Fig. 2 Active sulfhydryl group content of PPDF-MP mixture treated with different ultrasonic powers
小写字母不同表示差异显著(P<0.05)。图3~5、7~10、12~15同。
2.1.3 超声功率对PPDF-MP表面疏水性的影响
通过表面疏水性的变化可以判断蛋白质结构的改变。由图3可知,随着超声波功率增加(120~360 W),样品表面疏水性逐渐增大。空化和剪切作用使MP大分子聚集体发生裂解,使其内部疏水基团暴露,这可能是其表面疏水性增强的主要原因[29]。但随着超声波功率进一步增加,其表面疏水性降低,这可能是由于蛋白质在疏水相互作用的驱使下相互靠近,导致暴露的疏水基团重新被包埋在蛋白内部。王笑宇等[30]研究发现,超声波功率达到300 W,处理15 min后大豆球蛋白表面疏水性降低,与本研究的结果相似。
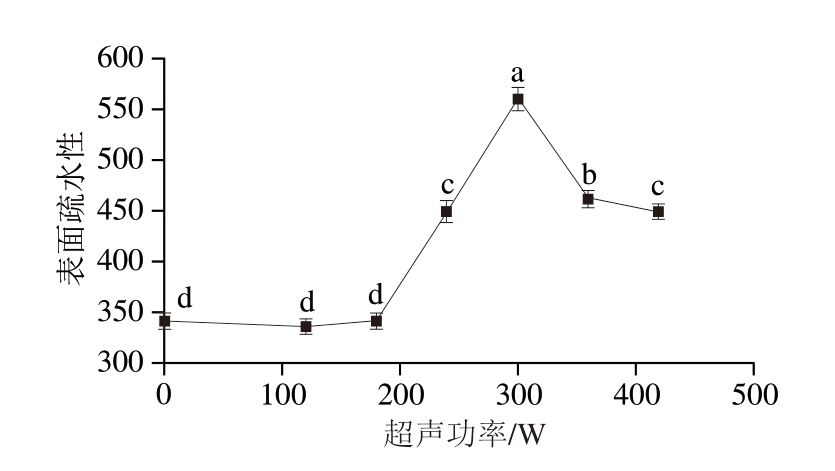
图3 不同超声功率处理下PPDF-MP混合物的表面疏水性
Fig. 3 Surface hydrophobicity of PPDF-MP mixture treated with different ultrasonic powers
2.1.4 超声功率对PPDF-MP凝胶保水性的影响
凝胶的保水性影响凝胶的嫩度和多汁性。由图4可知,在120~420 W的范围内,PPDF-MP凝胶的保水能力随超声功率的增加呈先增大后减小的变化规律,360 W超声功率处理的样品具有最好的凝胶保水性,原因可能是经过UT后,MP之间作用力增加,凝胶结构更加致密,保水能力增强。超声功率继续增加时,凝胶保水性有所下降,可能是因为超声功率的增加使MP发生变性[31]。
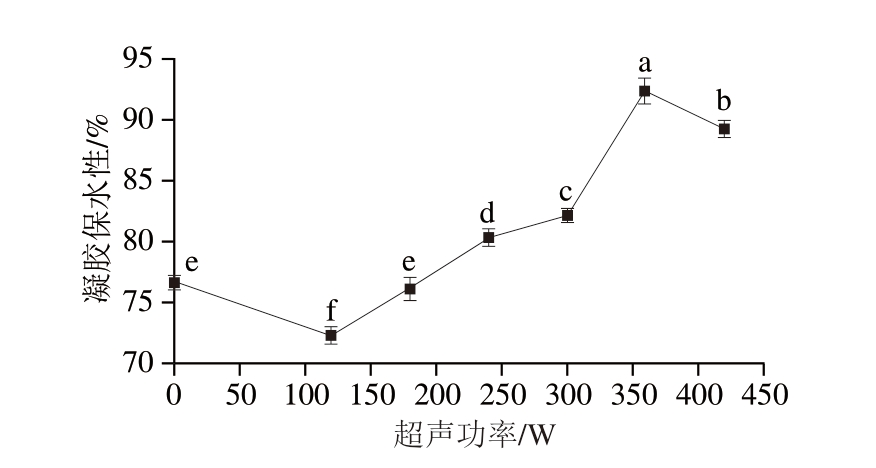
图4 不同超声功率处理下PPDF-MP凝胶的保水性
Fig. 4 Water-holding capacity of PPDF-MP gels with different ultrasonic powers
2.1.5 超声功率对PPDF-MP凝胶强度的影响
凝胶强度是衡量凝胶质量的重要指标。好的凝胶特性能够提高肉制品品质,为产品提供良好的保水性,使其具有更好的加工性能、口感和更高的营养价值,提高肉制品的得率。由图5可知,在120~420 W范围内,PPDF-MP的凝胶强度呈先上升后下降趋势。超声功率为360 W时,凝胶强度最大。这可能是因为UT可以改变MP分子的二级结构,减小MP分子的粒度,增强其分子间作用力,有利于形成稳定的凝胶结构,从而提高其凝胶强度。随着超声功率增大,MP分子膨胀,疏水残基暴露,促进MP分子间在凝胶过程中的相互作用[32]。而超声功率过高,则会破坏MP间的作用力,导致其间的黏附力下降,进而使凝胶强度降低。Zhao Yingying等[33]的研究也表明,低强度的UT能增加鸡肉MP与大豆油乳液形成的复合凝胶强度。
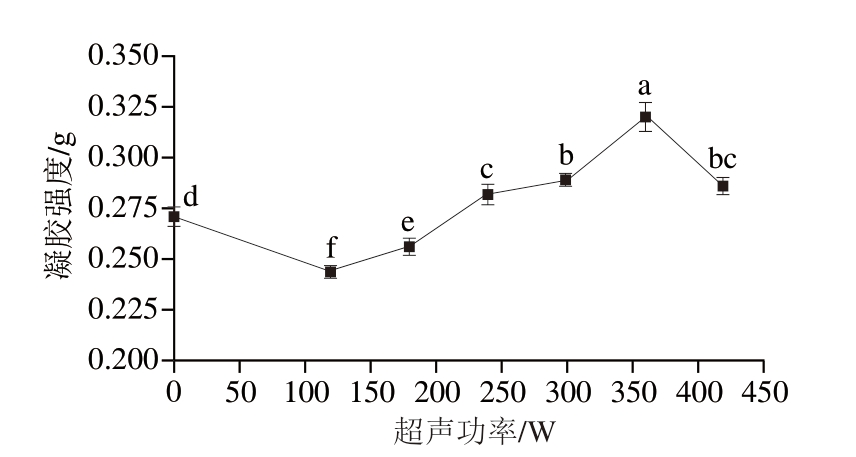
图5 不同超声功率处理下PPDF-MP的凝胶强度
Fig. 5 Gel strength of PPDF-MP gels different ultrasonic powers
2.1.6 超声功率对PPDF-MP凝胶质构特性的影响
如表1所示,随着超声功率的增大,PPDF-MP凝胶的硬度先增大后减小,其内聚性、胶黏性和弹性的变化趋势与之相同。超声功率的增加使蛋白质的变性程度随之增加,从而形成更加致密的凝胶网络结构,硬度也随之增加。而当超声功率进一步增大,蛋白质分子片段发生聚集,其凝胶性能下降,导致硬度降低[20]。另外,过高的超声功率会破坏蛋白凝胶的三维网状结构,分子片段发生聚集,弹性降低。
表1 不同超声功率处理下PPDF-MP凝胶的质构特性
Table 1 Texture characteristics of PPDF-MP gels with different ultrasonic powers
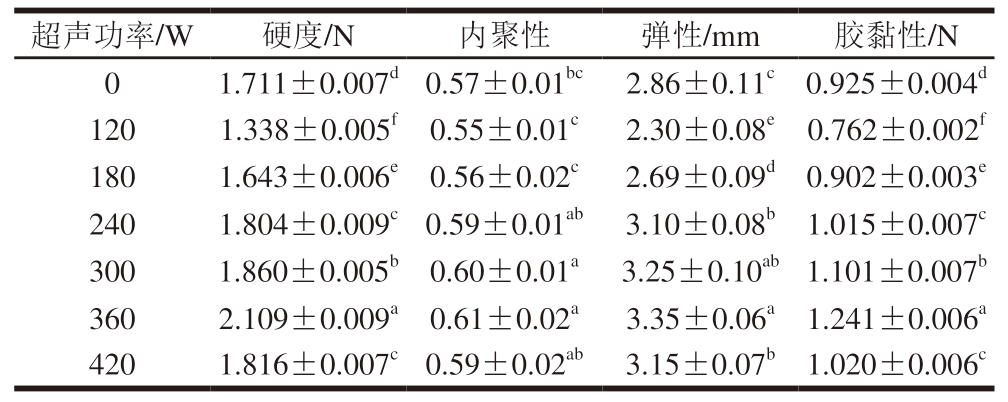
注:同列小写字母不同表示差异显著(P<0.05)。表2~4同。
超声功率/W硬度/N内聚性弹性/mm胶黏性/N 01.711±0.007d0.57±0.01bc2.86±0.11c0.925±0.004d 1201.338±0.005f0.55±0.01c2.30±0.08e0.762±0.002f 1801.643±0.006e0.56±0.02c2.69±0.09d0.902±0.003e 2401.804±0.009c0.59±0.01ab3.10±0.08b1.015±0.007c 3001.860±0.005b0.60±0.01a3.25±0.10ab1.101±0.007b 3602.109±0.009a0.61±0.02a3.35±0.06a1.241±0.006a 4201.816±0.007c0.59±0.02ab3.15±0.07b1.020±0.006c
2.2 超声时间对PPDF-MP及其凝胶特性的影响
2.2.1 超声时间对PPDF-MP动态流变学特性的影响
如图6所示,G’在接近45 ℃时开始急速上升,在55 ℃时达到顶峰后开始下降,在60 ℃时达到最低值后再次上升。不同的是,G”在60 ℃后增长较慢。超声时间为9 min时,样品的G’和G”均达到最大值,说明较长时间的UT有助于形成紧密、均一的凝胶网络结构。当超声时间进一步延长时,G’和G”降低,可能是由于过长时间的UT导致蛋白质发生变性。
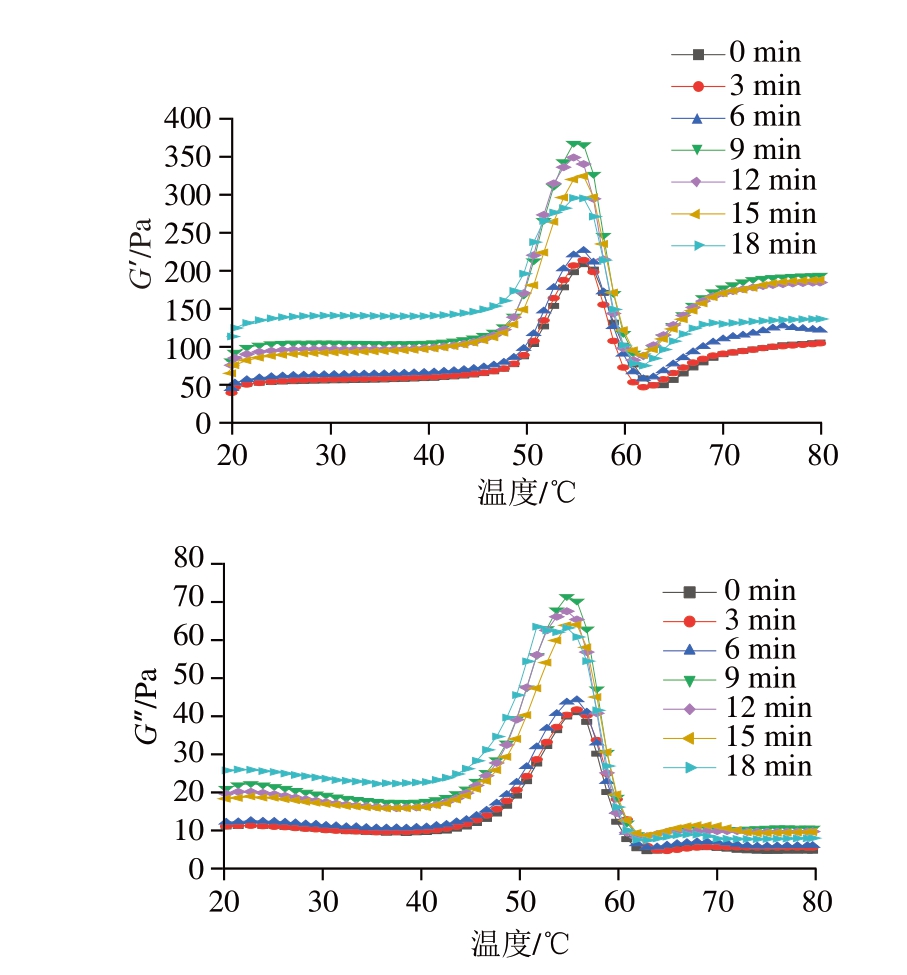
图6 不同超声时间处理下PPDF-MP混合物的温度扫描曲线
Fig. 6 Temperature sweep curves of PPDF-MP mixture with different ultrasonic times
2.2.2 超声时间对PPDF-MP活性巯基含量的影响
一般而言,大部分巯基均被包裹在蛋白质分子中。如图7所示,经不同超声时间处理,样品中的活性巯基含量变化显著(P<0.05)。超声时间为9 min时,活性巯基含量最高,为307.72 μmol/100 mg。结果表明,UT产生的空化效应能够减小MP颗粒,增加分子比表面积,有利于MP结构的展开,使埋藏在MP结构内部的巯基暴露在分子表面,进而增加了活性巯基含量[27]。但当超声时间进一步延长,MP的活性巯基含量开始降低,这可能是由于超声过程中的水分子降解会产生高活性自由基,促进巯基氧化为二硫键,当遇到蛋白溶液中的氧气时,更活泼的巯基基团和巯基间更短的距离导致二硫键的形成,从而使总巯基含量下降[34]。
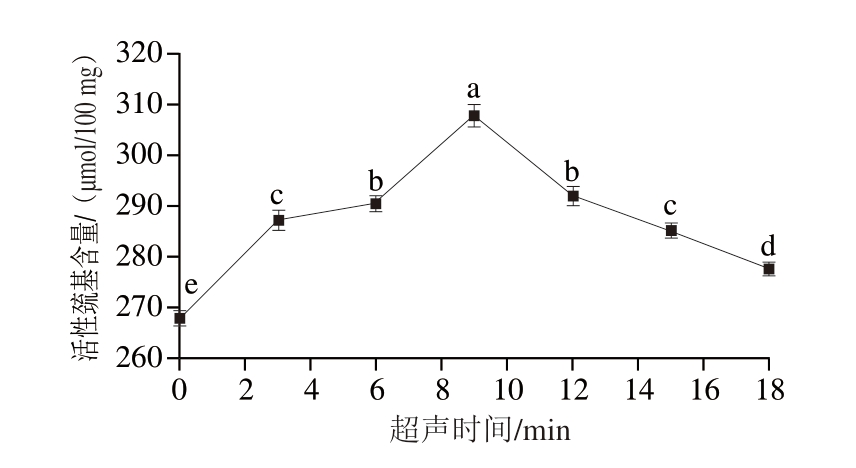
图7 不同超声时间处理下PPDF-MP混合物的活性巯基含量
Fig. 7 Active sulfhydryl group content of PPDF-MP mixture with different ultrasonic times
2.2.3 超声时间对PPDF-MP表面疏水性的影响
如图8所示,超声时间越长,样品表面疏水性越强,当超声时间为9 min时,其表面疏水性达到668.697,显著高于经其他超声时间处理的样品(P<0.05)。这是由于超声空化效应引起的机械力会对MP分子间的作用力造成破坏,蛋白质的展开和重折叠会使包埋的疏水性氨基酸暴露于表面,从而使表面疏水性增加[35]。随着超声时间的进一步延长,MP发生变性和聚集,暴露的疏水性残基又被重新掩藏[36],同时,疏水基团通过疏水相互作用再次聚合[37],导致MP表面疏水性降低。
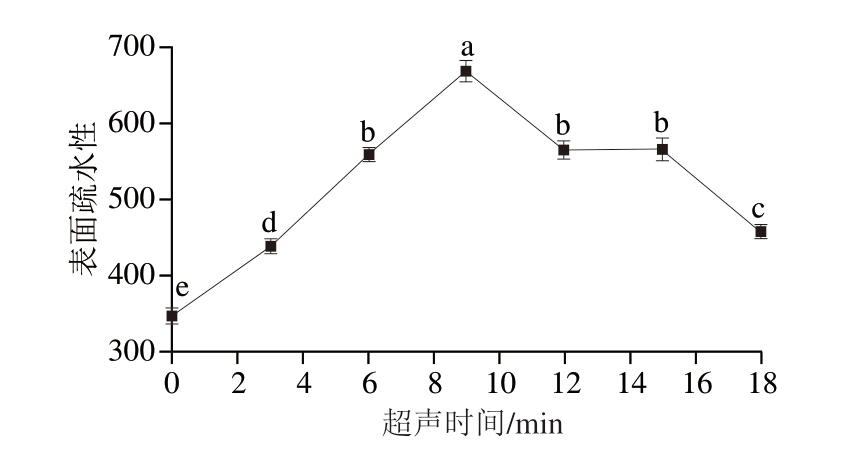
图8 不同超声时间处理下PPDF-MP混合物的表面疏水性
Fig. 8 Surface hydrophobicity of PPDF-MP mixture with different ultrasonic times
2.2.4 超声时间对PPDF-MP凝胶保水性的影响
如图9所示,PPDF-MP凝胶的保水性在经不同超声时间处理后有明显变化。超声时间为9 min时,样品的凝胶保水性达到最高,为93.18%。这可能是由于在超声波作用下,蛋白质分子结构发生变化,随着超声波作用的持续,形成紧密、均匀的凝胶结构,促进水分在凝胶网络结构中的富集[38],提高凝胶保水性。随着超声波作用时间延长,凝胶的保水性逐渐降低,这是由于过长时间的UT会引起MP的变性和聚集,使有序结构向无序结构转变,凝胶保水性降低[39]。
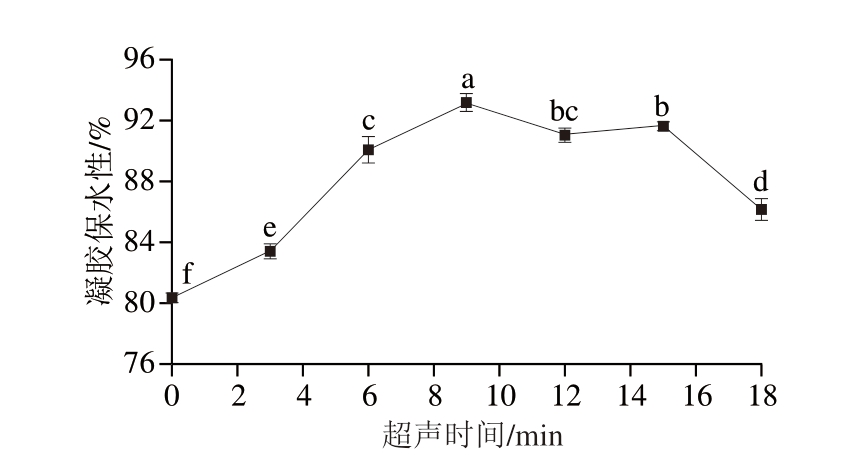
图9 不同超声时间处理下PPDF-MP凝胶的保水性
Fig. 9 Water-holding capacity of PPDF-MP gels with different ultrasonic times
2.2.5 超声时间对PPDF-MP凝胶强度的影响
如图10所示,PPDF-MP凝胶强度在经不同超声时间处理后有明显变化。超声时间为9 min时,样品凝胶强度最大,这可能是由于在长时间的UT下,MP分子展开,溶解性增加,颗粒变小[40],对蛋白形成密致的网络结构有一定的促进作用,从而使凝胶强度增加。随着UT时间进一步延长,凝胶强度开始下降,这可能是由于过长时间的UT导致MP的变性和聚集,致密、有序的凝胶结构被破坏[39]。
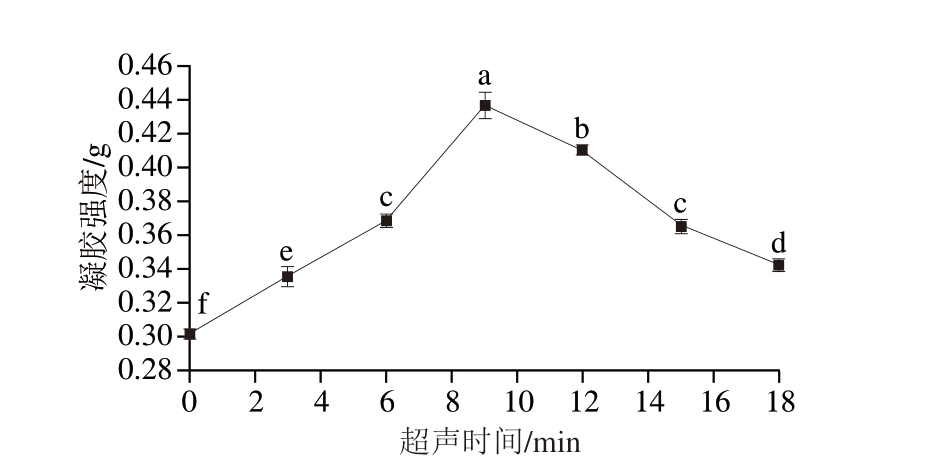
图10 不同超声时间处理下PPDF-MP的凝胶强度
Fig. 10 Gel strength of PPDF-MP gels with different ultrasonic times
2.2.6 超声时间对PPDF-MP凝胶质构特性的影响
如表2所示,随着超声时间的延长,PPDF-MP凝胶硬度逐渐增加,超声时间为9 min时,凝胶硬度最高。当超声时间进一步延长,凝胶硬度开始降低,这可能是由于在经长时间UT后,MP发生聚集,从而形成不溶性的大分子聚集体,这些聚集体内部结构较为致密,导致凝胶硬度增加。但长时间的UT会使分子键的柔性变差,在外界的作用力下易断裂[28],使凝胶网状结构被破坏,导致硬度降低。UT对凝胶的弹性和胶黏性均有较大影响,且随着UT时间的延长,均呈先增大后减小的趋势。
表2 不同超声时间处理下PPDF-MP凝胶的质构特性
Table 2 Texture characteristics of PPDF-MP gels with different ultrasonic times
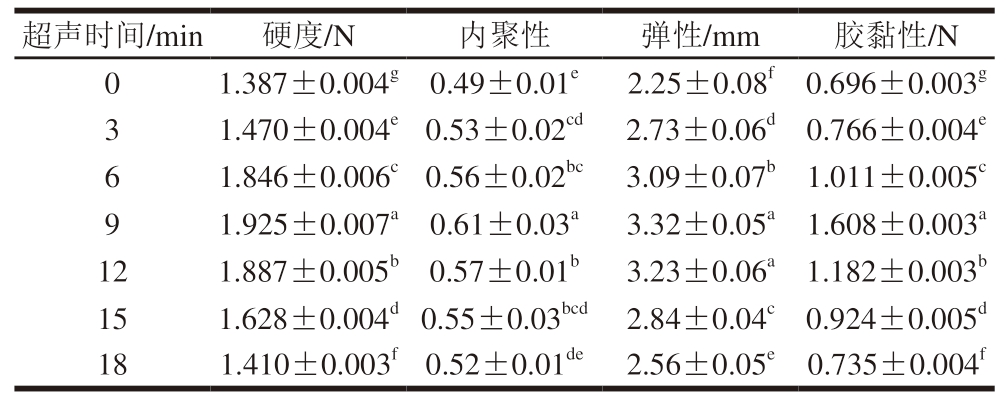
超声时间/min硬度/N内聚性弹性/mm胶黏性/N 01.387±0.004g0.49±0.01e2.25±0.08f0.696±0.003g 31.470±0.004e0.53±0.02cd2.73±0.06d0.766±0.004e 61.846±0.006c0.56±0.02bc3.09±0.07b1.011±0.005c 91.925±0.007a0.61±0.03a3.32±0.05a1.608±0.003a 121.887±0.005b0.57±0.01b3.23±0.06a1.182±0.003b 151.628±0.004d0.55±0.03bcd2.84±0.04c0.924±0.005d 181.410±0.003f0.52±0.01de2.56±0.05e0.735±0.004f
2.3 PPDF添加量对PPDF-MP及其凝胶特性的影响
2.3.1 PPDF添加量对PPDF-MP动态流变学特性的影响
如图11所示,PPDF的添加量变化对PPDF-MP的G’和G”影响较大。随着PPDF添加量的增加,体系的G’和G”呈先升高后降低的变化趋势,在添加量为4%时达到最大值。G’的增加可能是由于PPDF作用下的MP脱水效应:MP浓缩促进了MP折叠,二硫键和疏水相互作用力的占比增加[41],这些变化共同促进了浓缩MP的凝胶化[42]。G”的增大可能是由于PPDF作为一种增稠剂使体系的黏度增加。结果表明,适量添加PPDF可有效提高混合体系的凝胶形成能力。
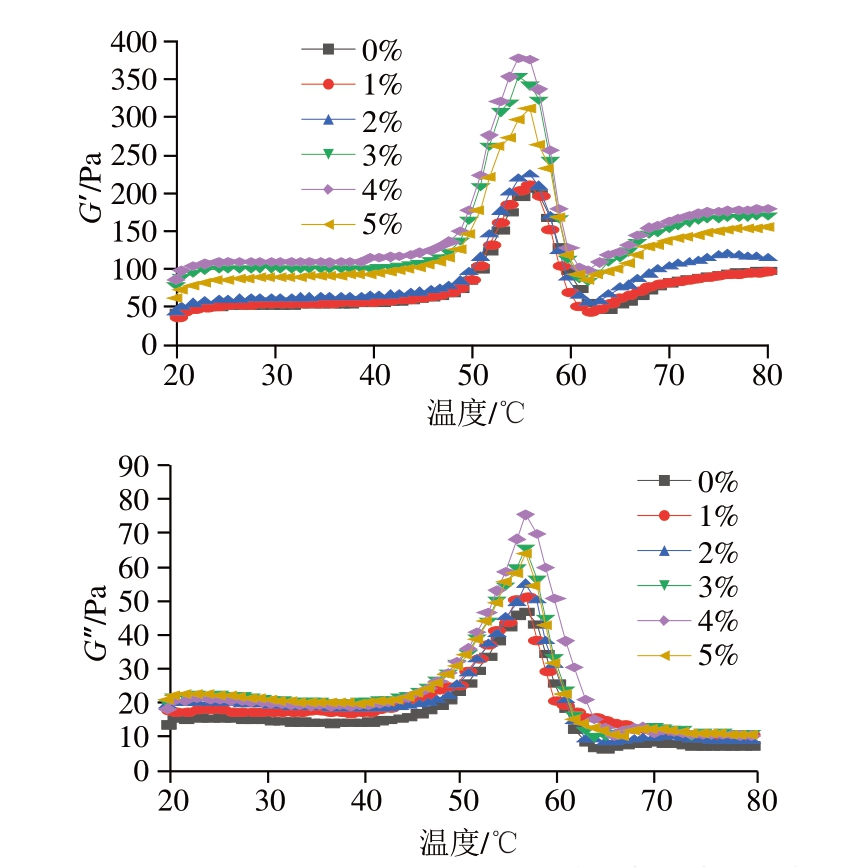
图11 不同PPDF添加量下PPDF-MP混合物的温度扫描曲线
Fig. 11 Temperature sweep curves of MP mixed with different amounts of PPDF
2.3.2 PPDF添加量对PPDF-MP活性巯基含量的影响
由图12可知,PPDF-MP体系活性巯基含量在不同的PPDF添加量下有明显的变化。当PPDF添加量为4%时,活性巯基含量最高,达313.46 μmol/100 mg。当添加量进一步增加,活性巯基含量显著下降(P<0.05)。
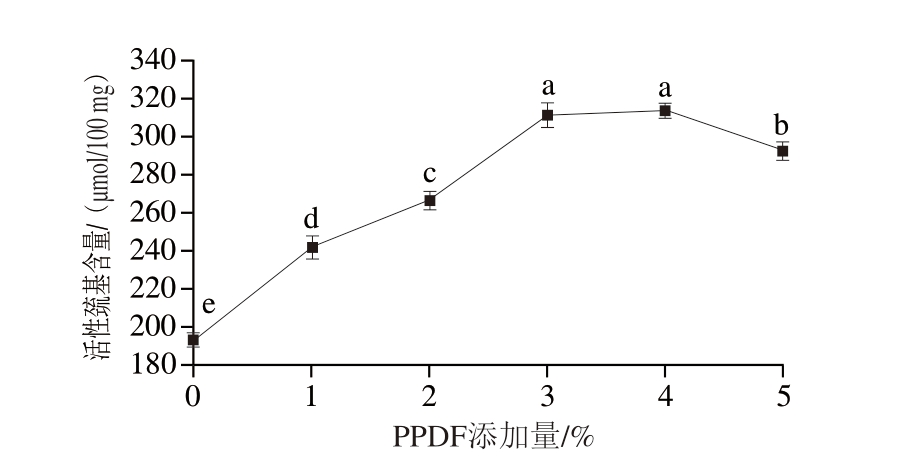
图12 不同PPDF添加量下PPDF-MP混合物的活性巯基含量
Fig. 12 Active sulfhydryl group content of MP mixed with different amounts of PPDF
2.3.3 PPDF添加量对PPDF-MP表面疏水性的影响
如图13所示,PPDF的加入使PPDF-MP表面疏水性显著提高(P<0.05)。当PPDF添加量为4%时,表面疏水性达到最大,为797.377。随着添加量的进一步增加,其表面疏水性降低。
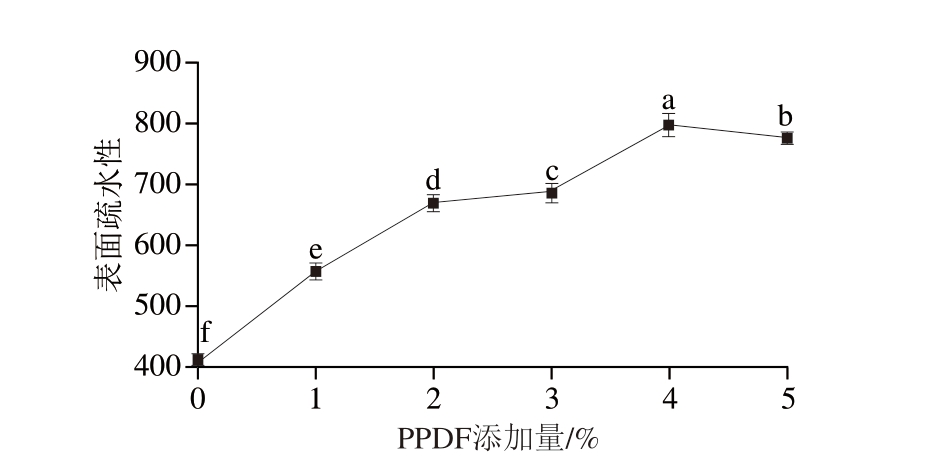
图13 不同PPDF添加量下PPDF-MP的表面疏水性
Fig. 13 Surface hydrophobicity of MP mixed with different amounts of PPDF
2.3.4 PPDF添加量对PPDF-MP凝胶保水性的影响
由图14可知,PPDF的添加显著影响凝胶的保水性(P<0.05)。随着添加量的增加,凝胶的保水性呈先增大后降低的趋势,当PPDF添加量为4%时,凝胶保水性达到最大,为91.15%,可能有2 种原因导致了这一现象:一是膳食纤维通过水合作用吸收水分;二是膳食纤维在凝胶网络中捕获水分子防止其渗出,消除了蛋白凝胶间的部分互连水通道,促进更加紧密凝胶网络的形成。
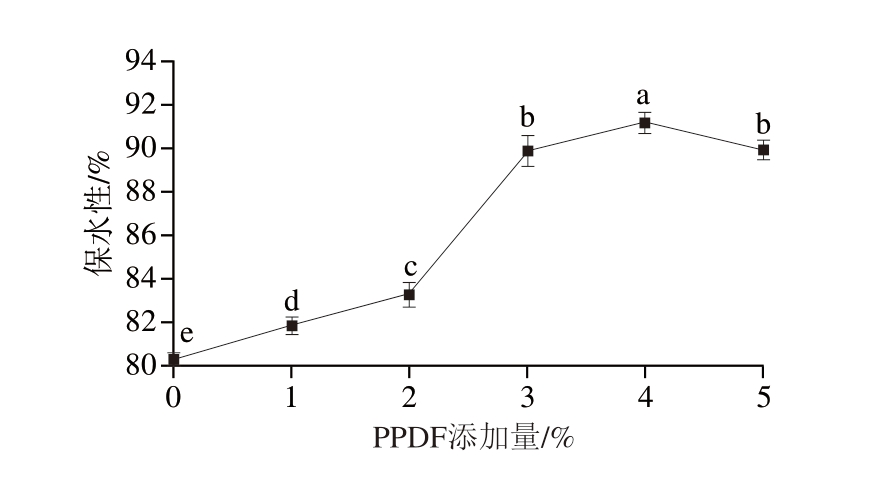
图14 不同PPDF添加量下PPDF-MP凝胶的保水性
Fig. 14 Water-holding capacity of MP gels mixed with different amounts of PPDF
2.3.5 PPDF添加量对PPDF-MP凝胶强度的影响
如图15所示,PPDF的添加显著影响MP凝胶强度(P<0.05)。当PPDF添加量为4%时,凝胶强度达到最高,这可能是由于PPDF中包含大量的亲水性多聚糖成分,这些成分在超声波作用下,能够与水进行有效结合,从而提高MP中巯基等活性基团的数量,促进MP分子间的相互作用,引起MP交联[16],形成更坚固的结构,使凝胶强度增加。但PPDF的过量加入会引起MP-多糖的大量聚集,暴露出MP中的疏水基团,改变MP分子结构,影响其成胶性,使凝胶强度降低。
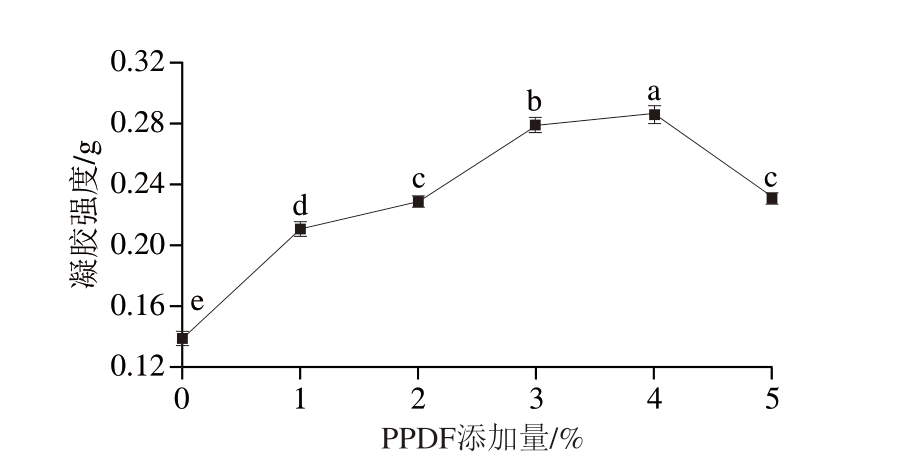
图15 不同PPDF添加量下PPDF-MP的凝胶强度
Fig. 15 Gel strength of MP gels mixed with different amounts of PPDF
2.3.6 PPDF添加量对PPDF-MP凝胶质构特性的影响
由表3可知,PPDF的添加显著影响凝胶硬度、内聚性、弹性和胶黏性(P<0.05)。凝胶的硬度、弹性和胶黏性随PPDF添加量的增加呈先增大后减小的趋势,但均显著高于对照组(P<0.05)。当PPDF添加量为4%时,凝胶的硬度、弹性和胶黏性均达到最高,较对照组分别提高45.94%、48.35%、104.36%,当PPDF添加量进一步增加,凝胶的硬度、弹性和胶黏性均显著下降(P<0.05)。在内聚性方面也观察到相似的变化趋势,但差异较小。
表3 不同PPDF添加量下PPDF-MP凝胶的质构特性
Table 3 Texture characteristics of MP gels mixed with different amounts of PPDF
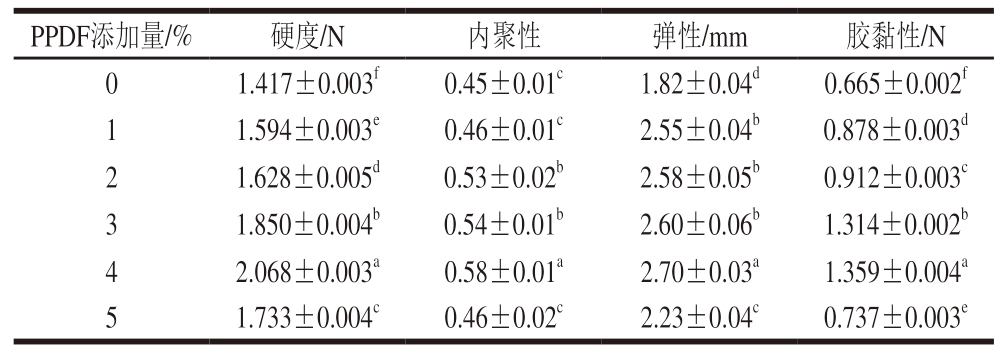
PPDF添加量/%硬度/N内聚性弹性/mm胶黏性/N 01.417±0.003f0.45±0.01c1.82±0.04d0.665±0.002f 11.594±0.003e0.46±0.01c2.55±0.04b0.878±0.003d 21.628±0.005d0.53±0.02b2.58±0.05b0.912±0.003c 31.850±0.004b0.54±0.01b2.60±0.06b1.314±0.002b 42.068±0.003a0.58±0.01a2.70±0.03a1.359±0.004a 51.733±0.004c0.46±0.02c2.23±0.04c0.737±0.003e
2.4 不同处理MP溶液的对比实验结果
如图16所示,UT-PPDF组的G’和G”均明显高于UT、PPDF组,表明UT结合PPDF能够增强MP之间的相互作用。
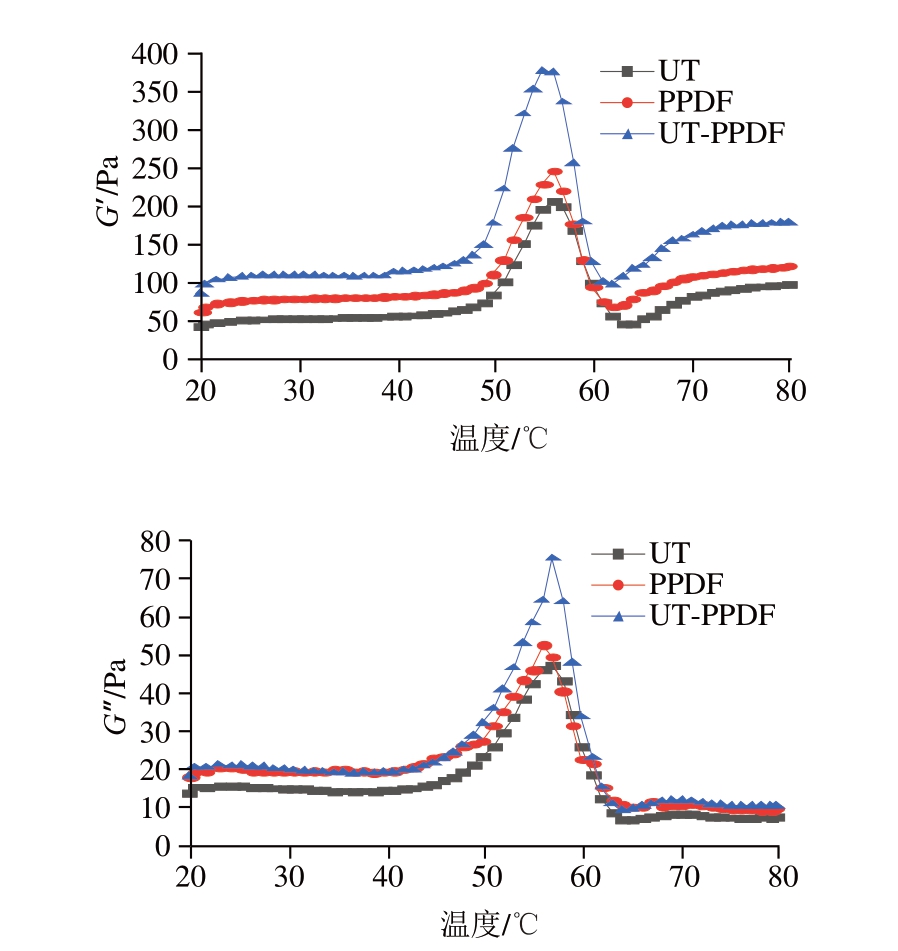
图16 UT、PPDF、UT-PPDF处理对MP G’和G”的影响
Fig. 16 Effects of UT, PPDF, and UT-PPDF on the G’ and G” of MP
由表4可知,UT-PPDF组的凝胶活性巯基含量、表面疏水性、凝胶保水性、凝胶强度、硬度、内聚性、弹性和胶黏性均达到最高,表明UT和PPDF具有良好的协同作用。
表4 UT、PPDF、UT-PPDF处理对MP活性巯基含量、表面疏水性、凝胶保水性、凝胶强度和质构特性的影响
Table 4 Effects of UT, PPDF, and UT-PPDF on the active sulfhydryl group content, surface hydrophobicity, water-holding capacity, gel strength, and texture properties of MP gels

凝胶质构特性硬度/N内聚性弹性/mm胶黏性/N UT192.79±1.46c410.66±1.38c80.03±0.68c0.139±0.005c1.417±0.003c0.45±0.01c1.82±0.04c0.665±0.002c PPDF270.32±1.37b622.08±1.53b91.15±1.25b0.199±0.008b1.628±0.005b0.53±0.02b2.58±0.05b0.912±0.003b UT-PPDF313.46±2.05a797.37±0.89a94.13±1.53a0.286±0.006a2.068±0.003a0.58±0.01a2.70±0.03a1.359±0.004a组别活性巯基含量/(μmol/100 mg)表面疏水性凝胶保水性/%凝胶强度/g
3 讨 论
取25 mL质量浓度为30 mg/mL的MP溶液,探究不同超声功率(0、120、180、240、300、360、420 W)、超声时间(0、3、6、9、12、15、18 min)和PPDF添加量(0%、1%、2%、3%、4%、5%)对复合凝胶体系的凝胶特性影响,结果如下:
随着超声功率的增加,样品的G’、G”、活性巯基含量、表面疏水性、凝胶保水性、凝胶强度、质构特性均呈先上升后下降的趋势。当超声功率为360 W时,样品G’、G”、活性巯基含量、凝胶保水性、凝胶强度均达到最高且质构特性最优。因此,360 W为最适的超声功率。
设置超声功率为360 W,当超声时间为9 min 时,活性巯基含量达到最高,为307.72 μmol/100 mg,较对照组增加14.82%;表面疏水性达到最大,较对照组提高94.26%;凝胶保水性达到最高,较对照组提高15.92%;凝胶强度同样达到最大且质构特性最优。因此,9 min为最适的超声时间。
设置超声功率为360 W,超声时间为9 min,当PPDF添加量为4%时,活性巯基含量达到最高,为313.46 μmol/100 mg,较对照组提高62.59%;表面疏水性达到最大,较对照组提高94.17%;保水性达到最高,较对照组提高13.51%;凝胶强度同样达到最大且质构特性最优。因此,4%为最适的PPDF添加量。
通过对比实验,发现在超声功率360 W,超声时间9 min,PPDF添加量4%的条件下,MP的凝胶特性最佳,与单独使用UT、PPDF相比,UT和PPDF协同处理对鸡肉MP凝胶特性的改善作用更强。
4 结论
将膳食纤维作为功能性成分添加到肉制品中,能够有效改善其品质。随着膳食纤维在肉制品加工中的应用研究越来越多,膳食纤维肉制品的研发也将带来更高的经济效益,具有较高的研究价值。然而,膳食纤维本身的性质、其与新型加工技术的结合使用及其对肉制品蛋白质的作用机制仍未被完全阐明,这将是今后肉品科学研究的重点。
[1] 曹云刚, 马文慧, 艾娜丝, 等. 氧化强度对肌原纤维蛋白结构及凝胶性能的影响[J]. 食品科学, 2019, 40(20): 21-27. DOI:10.7506/spkx1002-6630-20181105-059.
[2] ZHUANG X B, HAN M Y, JIANG X P, et al. The effects of insoluble dietary fiber on myofibrillar protein gelation: microstructure and molecular conformations[J]. Food Chemistry, 2019, 275: 770-777.DOI:10.1016/j.foodchem.2018.09.141.
[3] GILL S K, ROSSI M, BAJKA B, et al. Dietary fibre in gastrointestinal health and disease[J]. Nature Reviews. Gastroenterology &Hepatology, 2021, 18(2): 101-116. DOI:10.1038/s41575-020-00375-4.
[4] 姚全功. 速冻调理肉制品中功能性添加物对质构和口感的影响研究[J]. 中国食品工业, 2024(11): 131-133.
[5] 李可, 刘俊雅, 扶磊, 等. 竹笋膳食纤维对猪肉盐溶性蛋白热诱导凝胶特性的影响[J]. 食品科学, 2019, 40(4): 56-61. DOI:10.7506/spkx1002-6630-20171028-336.
[6] 庄昕波, 陈银基, 周光宏. 改性甘蔗膳食纤维对猪肉肌原纤维蛋白凝胶特性的影响[J]. 中国农业科学, 2021, 54(15): 3320-3330.DOI:10.3864/j.issn.0578-1752.2021.15.015.
[7] 曹云刚, 王凡, 艾娜丝, 等. 苹果膳食纤维对猪肉肌原纤维蛋白凝胶性能的影响[J]. 农业机械学报, 2020, 51(7): 365-371. DOI:10.6041/j.issn.1000-1298.2020.07.041.
[8] 杨磊, 胡阿丽. 紫薯颗粒全粉研究[J]. 中国农学通报, 2017, 33(19):148-151.
[9] 孙海燕. 2 种紫薯化学抗氧化能力比较[J]. 食品与发酵工业, 2017,43(3): 163-168. DOI:10.13995/j.cnki.11-1802/ts.201703029.
[10] SÁNCHEZ-ALONSO I, JIMÉNEZ-ESCRIG A, SAURA-CALIXTO F,et al. Antioxidant protection of white grape pomace on restructured fish products during frozen storage[J]. LWT-Food Science and Technology,2008, 41(1): 42-50. DOI:10.1016/j.lwt.2007.02.002.
[11] SANCHEZ-ALONSO I, BORDERÍAS J, LARSSON K, et al.Inhibition of hemoglobin-mediated oxidation of regular and lipidfortified washed cod mince by a white grape dietary fiber[J]. Journal of Agricultural and Food Chemistry, 2007, 55(13): 5299-5305.DOI:10.1021/jf0702242.
[12] 刘旺, 冯美琴, 孙健, 等. 超高压条件下亚麻籽胶对猪肉肌原纤维蛋白凝胶特性的影响[J]. 食品科学, 2019, 40(7): 101-107.DOI:10.7506/spkx1002-6630-20181130-348.
[13] 高廷轩, 邓绍林, 赵雪, 等. 多糖协同超声波处理对低盐鸡肉糜凝胶特性的影响[J]. 食品科学, 2021, 42(19): 148-156. DOI:10.7506/spkx1002-6630-20201102-016.
[14] 姚文晶, 张风雪, 曹传爱, 等. 新型辅助加工技术提高肉制品消化特性的研究进展[J]. 食品安全质量检测学报, 2024, 15(2): 168-176.DOI:10.19812/j.cnki.jfsq11-5956/ts.2024.02.013.
[15] 张茸茸, 刘佳丽, 李亦凡, 等. 超声技术对肌原纤维蛋白结构的影响及其在肌肉食品中的应用现状[J]. 食品安全质量检测学报, 2023,14(21): 10-19. DOI:10.19812/j.cnki.jfsq11-5956/ts.2023.21.001.
[16] ZHENG J, ZENG R Q, KAN J Q, et al. Effects of ultrasonic treatment on gel rheological properties and gel formation of highmethoxyl pectin[J]. Journal of Food Engineering, 2018, 231: 83-90.DOI:10.1016/j.jfoodeng.2018.03.009.
[17] 李可, 张怡雪, 王艳秋, 等. 超声波处理对低盐条件下鸡肉肌原纤维蛋白结构和氧化性质的影响[J]. 食品科学, 2024, 45(16): 177-187.DOI:10.7506/spkx1002-6630-20230725-280.
[18] 李颖畅, 师丹华, 赵淞民, 等. 超声波辅助没食子酸对鲈鱼肌原纤维蛋白结构特性的影响[J]. 中国食品学报, 2023, 23(7): 88-98.DOI:10.16429/j.1009-7848.2023.07.010.
[19] XIONG Y, LI Q R, MIAO S, et al. Effect of ultrasound on physicochemical properties of emulsion stabilized by fish myofibrillar protein and xanthan gum[J]. Innovative Food Science & Emerging Technologies, 2019, 54: 225-234. DOI:10.1016/j.ifset.2019.04.013.
[20] LI K, FU L, ZHAO Y Y, et al. Use of high-intensity ultrasound to improve emulsifying properties of chicken myofibrillar protein and enhance the rheological properties and stability of the emulsion[J]. Food Hydrocolloids, 2020, 98: 105275. DOI:10.1016/j.foodhyd.2019.105275.
[21] CHEN X, CHEN C G, ZHOU Y Z, et al. Effects of high pressure processing on the thermal gelling properties of chicken breast myosin containing κ-carrageenan[J]. Food Hydrocolloids, 2014, 40: 262-272.DOI:10.1016/j.foodhyd.2014.03.018.
[22] 计红芳, 李莎莎, 王雪菲, 等. 天然菊粉对鸡肉肌原纤维蛋白凝胶特性的影响[J]. 中国食品添加剂, 2019, 30(2): 124-130. DOI:10.3969/j.issn.1006-2513.2019.02.012.
[23] 潘杰. 超高压和氯化镁对鸡肉糜凝胶特性的影响及机制[D]. 合肥:合肥工业大学, 2017.
[24] ZHANG Z Y, YANG Y L, ZHOU P, et al. Effects of high pressure modification on conformation and gelation properties of myofibrillar protein[J]. Food Chemistry, 2017, 217: 678-686. DOI:10.1016/j.foodchem.2016.09.040.
[25] 滕安国, 李冰馨, 赵静怡, 等. 酸度调节剂协同水分保持剂对牛肉盐溶蛋白凝胶保水性的影响[J]. 食品研究与开发, 2020, 41(15): 1-5.DOI:10.12161/j.issn.1005-6521.2020.15.001.
[26] 冯佳雯, 郑云芳, 张芳, 等. 超声处理对鲈鱼肌原纤维蛋白结构和功能特性的影响[J]. 食品工业科技, 2022, 43(17): 95-103.DOI:10.13386/j.issn1002-0306.2021120027.
[27] HU H, WU J H, LI-CHAN E C Y, et al. Effects of ultrasound on structural and physical properties of soy protein isolate (SPI)dispersions[J]. Food Hydrocolloids, 2013, 30(2): 647-655.DOI:10.1016/j.foodhyd.2012.08.001.
[28] 谷俊华, 黄斐. 超声改性处理对豌豆蛋白结构性质的影响[J].吉林农业科技学院学报, 2022, 31(5): 8-11; 17. DOI:10.3969/j.issn.1674-7852.2022.05.002.
[29] LEE H, YILDIZ G, DOS SANTOS L C, et al. Soy protein nanoaggregates with improved functional properties prepared by sequential pH treatment and ultrasonication[J]. Food Hydrocolloids, 2016, 55:200-209. DOI:10.1016/j.foodhyd.2015.11.022.
[30] 王笑宇, 韩东, 陈子净, 等. 超声处理对β-伴大豆球蛋白乳化性能的影响[J]. 中国食品学报, 2018, 18(6): 153-159. DOI:10.16429/j.1009-7848.2018.06.020.
[31] 刁小琴, 关海宁, 乔秀丽, 等. 超声处理对肌原纤维蛋白凝胶特性和结构的影响[J]. 食品工业, 2020, 41(2): 197-200.
[32] 王莹. 超声-谷氨酰胺转氨酶制备核桃蛋白凝胶及其缓释效果研究[D]. 北京: 北京林业大学, 2020. DOI:10.26949/d.cnki.gblyu.2020.001152.
[33] ZHAO Y Y, WANG P, ZOU Y F, et al. Effect of pre-emulsification of plant lipid treated by pulsed ultrasound on the functional properties of chicken breast myofibrillar protein composite gel[J]. Food Research International, 2014, 58: 98-104. DOI:10.1016/j.foodres.2014.01.024.
[34] LIU H T, WANG Z, BADAR I H, et al. Combination of high-intensity ultrasound and hydrogen peroxide treatment suppresses thermal aggregation behaviour of myofibrillar protein in water[J]. Food Chemistry, 2022, 367: 130756. DOI:10.1016/j.foodchem.2021.130756.
[35] 王喜波, 王琳, 周国卫, 等. 超声时间对大豆-乳清混合蛋白结构及乳化性质的影响[J]. 农业机械学报, 2020, 51(8): 358-364.DOI:10.6041/j.issn.1000-1298.2020.08.040.
[36] 黄河. 高场强超声对花椒籽蛋白理化性质和乳液稳定性的影响[D].成都: 西华大学, 2020. DOI:10.27411/d.cnki.gscgc.2020.000596.
[37] 李三影. 超声波处理对类PSE鸡肉分离蛋白功能特性的影响研究[D]. 郑州: 郑州轻工业大学, 2022. DOI:10.27469/d.cnki.gzzqc.2022.000146.
[38] 刘竞男, 张智慧, 王琳, 等. 超声处理对谷氨酰胺转氨酶诱导的大豆分离蛋白凝胶冻融稳定性的影响[J]. 食品科学, 2020, 41(13): 76-82.DOI:10.7506/spkx1002-6630-20190710-145.
[39] 李钊. 超声波协同氯化镁对鲤鱼肌原纤维蛋白凝胶特性的影响[D].新乡: 河南科技学院, 2022. DOI:10.27704/d.cnki.ghnkj.2022.000170.
[40] 李颖畅, 师丹华, 张馨元, 等. 超声波辅助没食子酸改善海鲈鱼肌原纤维蛋白的凝胶性能[J]. 食品科学, 2022, 43(11): 82-91.DOI:10.7506/spkx1002-6630-20210409-121.
[41] KARTHIKEYAN M, DILEEP A O, SHAMASUNDAR B A. Effect of water washing on the functional and rheological properties of proteins from threadfin bream (Nemipterus japonicus) meat[J]. International Journal of Food Science & Technology, 2006, 41(9): 1002-1010.DOI:10.1111/j.1365-2621.2006.01122.x.
[42] YOON W B, GUNASEKARAN S, PARK J W. Characterization of thermorheological behavior of Alaska pollock and Pacific whiting surimi[J]. Journal of Food Science, 2004, 69(7): 338-343.DOI:10.1111/j.1365-2621.2004.tb13639.x.