大黄鱼作为一种营养丰富的海洋鱼类,因其鲜美的口感而备受消费者喜爱[1]。然而,由于大黄鱼富含营养,其被捕捞和死亡后易滋生细菌,发生品质劣变,一方面造成经济损失,另一方面还可能对消费者健康产生威胁[2]。捕捞后的大黄鱼需经一系列贮藏、运输等环节才能上架销售[3-5],这一过程对人力和设备要求较高,贮运不当也往往导致鱼肉品质迅速下降[6]。大黄鱼在冷链保鲜过程中的品质劣变是一个复杂的代谢过程,其劣变规律是水产保鲜领域的研究热点之一。在大黄鱼冷藏保鲜过程中,K值、pH值、保水性、总挥发性盐基氮含量等代谢相关生化指标变化与鱼肉品质劣变紧密相关[7-8]。然而,对于大黄鱼冷藏保鲜过程中代谢组分的动态变化研究较为匮乏,目前仍缺乏对其品质劣变规律的系统认识[9-10]。水产品宰杀后,其细胞中的线粒体仍保持一定的代谢活性,并持续消耗残留的氧气。线粒体作为细胞的能量代谢中心,承担着氧化磷酸化、钙离子储存与调控、柠檬酸循环和能量转化与代谢调控等功能[11],而上述生理过程将直接影响鱼肉代谢产物积累与品质稳定性。非靶向代谢组学为探究大黄鱼冷藏保鲜过程中的代谢动态变化提供系统研究手段,其可通过高通量技术对鱼肉组织中内源性小分子代谢物进行全面地定性和定量分析[12-13],并可基于多元统计学手段筛选差异代谢物。气相色谱-四极杆串联飞行时间质谱(gas chromatography quadrupole time-of-flight mass spectrometry,GC-Q-TOF-MS)兼具分离效率高和灵敏性高等特点,可实现对复杂生物样本中小分子代谢物的高效鉴定和准确定量分析。本研究以冷藏大黄鱼为研究对象,采用GC-Q-TOF-MS对贮藏0、9、18 d鱼肉代谢物组进行分析,筛选并鉴定与大黄鱼品质劣变相关的关键差异代谢物及代谢途径,探究代谢物变化引起大黄鱼品质劣变的关键原因。
1 材料与方法
1.1 材料与试剂
大黄鱼为市购,体质量(700±25)g。
三氯乙酸、氢氧化钾、硫酸钠(Na2SO4)、硫代硫酸钠(Na2S2O3)、磷酸二氢钠(NaH2PO4) 生工生物工程(上海)股份有限公司;甲醇、乙腈 上海佰晔生物科技中心;氯仿、吡啶 上海阿达玛斯试剂有限公司;甲氧胺盐酸盐 梯希爱(上海)化成工业发展有限公司;核糖醇 美国Sigma-Aldrich公司;双(三甲基硅烷基)三氟乙酰胺、三甲基氯硅烷、脂肪酸甲酯 赛默飞世尔科技(中国)有限公司。
1.2 仪器与设备
Tissuelyser-64组织研磨仪 上海净信实业发展有限公司;D3024R低温高速离心机 大龙兴创实验仪器(北京)股份有限公司;M200多功能酶标仪瑞士帝肯集团公司;7890B GC仪、DB-5MS色谱柱(30 m×250 μm,0.25 μm) 安捷伦科技(中国)有限公司;PEGASUS HT MS仪 美国力可公司;Forma 900 series超低温冰箱 赛默飞世尔科技(中国)有限公司;YM-080S超声仪 深圳方奥微电子有限公司;LNG-T98真空浓缩器 太仓华美生化仪器厂。
1.3 方法
1.3.1 样品制备
大黄鱼鲜活状态下立即运至实验室,去头、去内脏并清洗干净,无菌生理盐水清洗、沥干,从背部肌肉切取3 cm×2 cm×1.5 cm肉块(约5 g)置于无菌包装袋中,4 ℃保存,贮藏0、9、18 d取鱼肉样品(分别记为R0、R9、R18)进行分析,每组3 个平行。所有操作均在2 h内于超净工作台中完成。
1.3.2 代谢物提取
根据Liu Mengyang等[14]的方法并适当修改,对鱼肉样品中的代谢物进行提取。将(50±1)mg鱼肉加入含有钢珠的2 mL EP管中,加入1 mL预冷提取液(甲醇∶乙腈∶水=2∶2∶1(V/V),含内标:0.5 mg/mL核糖醇)。使用研磨仪以40 Hz研磨4 min,冰水浴40 kHz超声5 min,重复3 次。完成上述操作后,将鱼肉置于-40 ℃冰箱静置1 h,4 ℃、13 800×g离心15 min。取400 μL上清液于1.5 mL EP管中,每个鱼肉样品各取100 μL混合成质量控制(quality control,QC)样品(4 个QC样品,与检测样品穿插上机,以监测仪器、方法稳定性和可靠性)。在真空浓缩器中干燥提取物,并向干燥后的提取物中加入40 μL 20 mg/mL甲氧胺盐试剂(甲氧胺盐酸盐溶于吡啶),混匀后置于80 ℃烘箱30 min。向每个样品中加入60 μL含1%(V/V)三甲基氯硅烷的双(三甲基硅烷基)三氟乙酰胺,70 ℃孵育1.5 h。待冷却后加入5 μL脂肪酸甲酯(溶于氯仿),并上机检测。
1.3.3 代谢物检测
GC-TOF-MS参数:进样量1 μL;分流模式;隔垫吹扫流速3 mL/min;载气为氦气;DB-5MS色谱柱(30 m×250 μm,0.25 μm);柱流速1 mL/min;升温程序:50 ℃保持1 min,以10 ℃/min升至310 ℃,保持8 min;前进样口温度280 ℃;传输线温度280 ℃;离子源温度250 ℃;电离电压-70 eV;扫描范围m/z 50~500;扫描速率12.5 spectra/s;溶剂延迟6.25 min。
1.4 数据分析
使用ChromaTOF v4.3x软件对质谱数据进行峰提取、基线矫正、解卷积、峰积分、峰对齐等分析,将QC样品中检出率<50%或相对标准偏差>30%的峰去除。采用QC样品谱图比对结合主成分分析(principal component analysis,PCA)对QC样品数据进行整体评估。将原始数据与Fiehn公共数据库进行对比,使用多元变量统计分析方法对数据进行分析,采用火山图展示差异代谢产物分布,阈值设置为变量投影重要性(variable importance in projection,VIP)>1且P<0.05。查询样品所属物种的京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路注释,基于通路数据库的代谢组学分析方法构建KEGG注释图。基于显著差异代谢物数据,通过欧氏距离算法构建代谢物间相似性矩阵,以完全连锁方法对差异代谢物进行层次聚类分析,并以热图进行可视化展示。
2 结果与分析
2.1 鱼肉样品质控情况
由图1A可知,QC样品总离子流色谱图(total ion chromatogram,TIC)出峰保留时间和峰面积重叠较好,说明仪器稳定、可靠。将从9 组实验样品和QC样品中提取的代谢物离子峰数目进行归一化处理,然后进行PCA。由图1B可知,除F组的1 个样品外,其余鱼肉样品均处于95%置信区间内,各组重复样品相对集中,未见较大分散现象,表明各组内样品重复性较好,数据可靠。
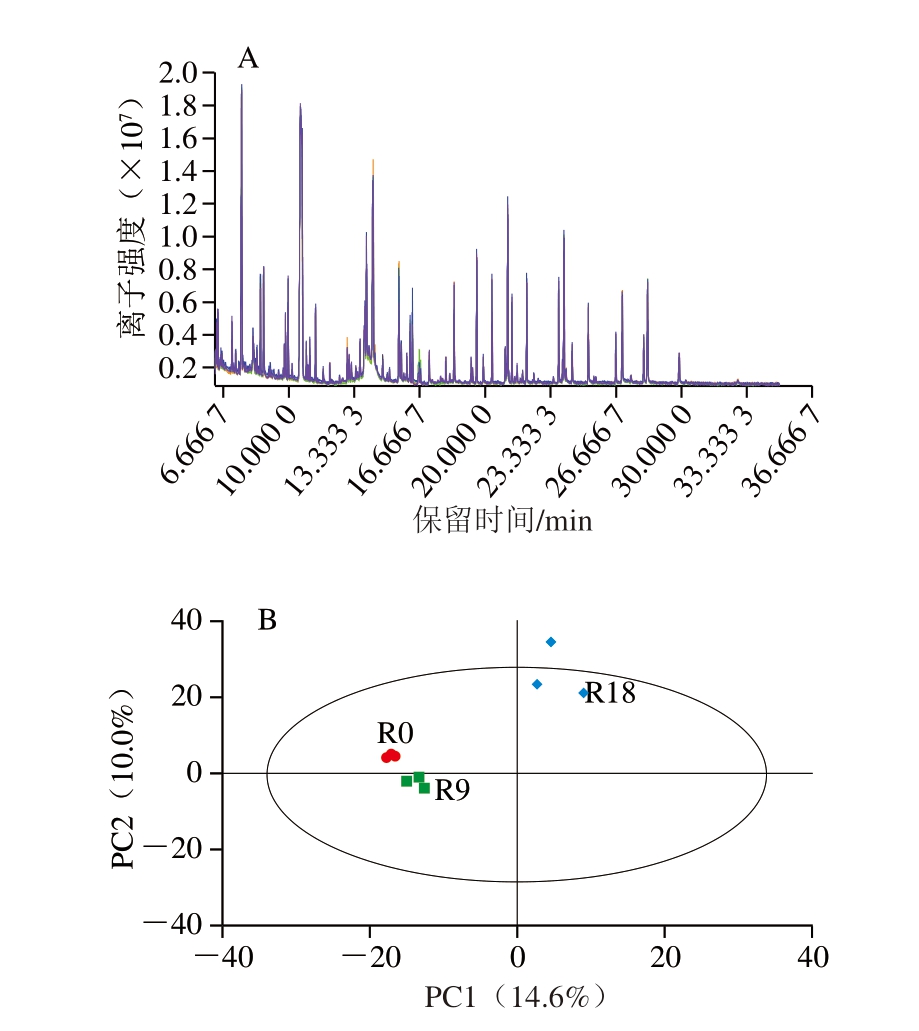
图1 贮藏0、9、18 d鱼肉QC样品TIC叠图(A)和PCA得分图(B)
Fig. 1 TIC overlay (A) and principal component analysis score plot (B) of QC samples of fish meat stored for 0, 9, and 18 days
2.2 差异代谢产物鉴定与筛选
由图2A、B可知,与贮藏0 d相比,贮藏9、18 d鱼肉中分别有36、45 种代谢物表达显著上调。由图2C可知,与贮藏9 d相比,贮藏18 d鱼肉中有48 种代谢物表达显著上调。这些代谢物可能与大黄鱼品质劣变紧密相关,需进一步聚类分析。
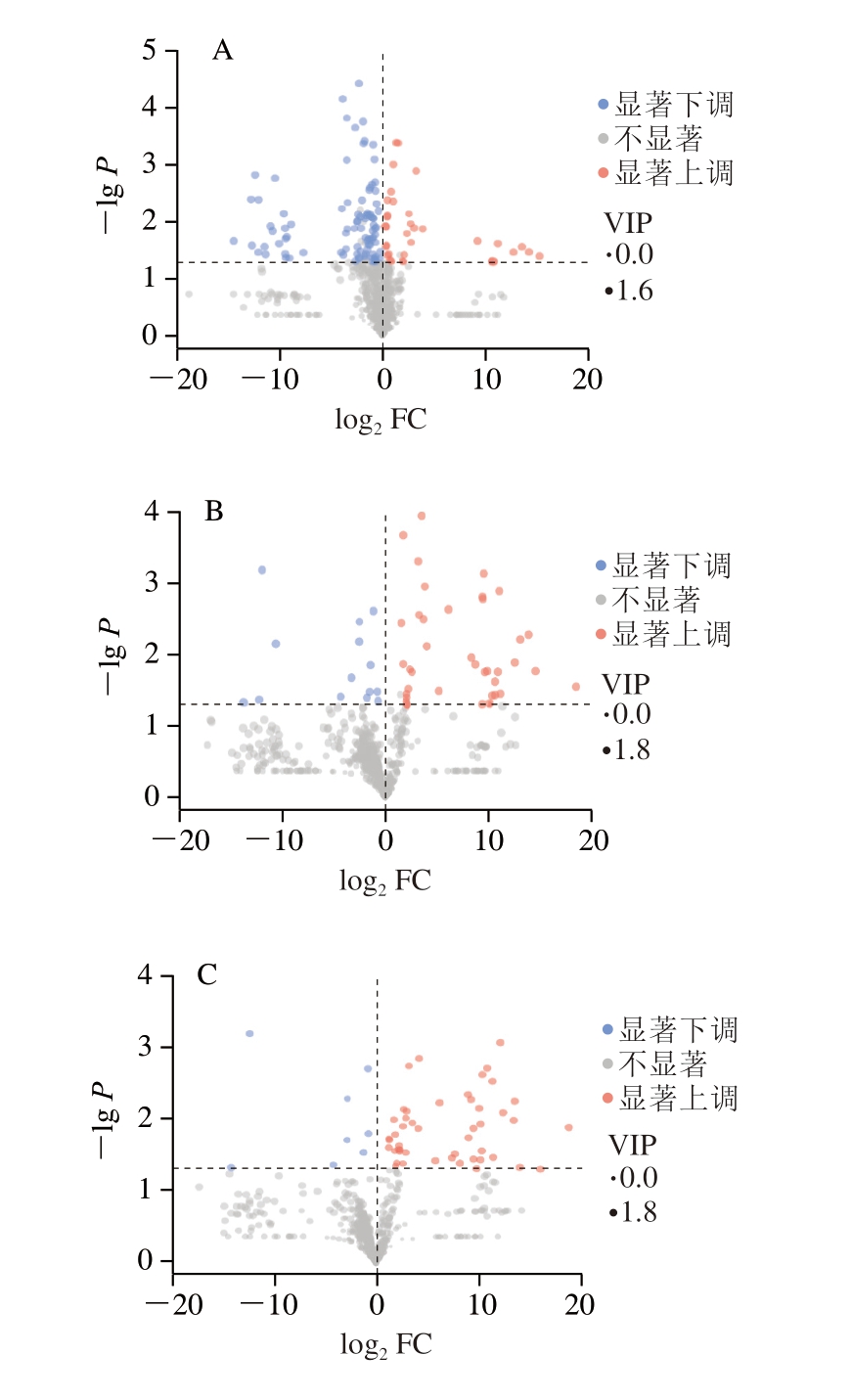
图2 贮藏0、9、18 d鱼肉差异代谢物火山图
Fig. 2 Volcano plots of differential metabolites across fish meat on days 0, 9, and 18 of refrigeration
A. R0 vs. R9;B. R0 vs. R18;C. R9 vs. R18。图3、4同。FC.差异倍数(fold change)。
2.3 差异代谢产物KEGG聚类分析
由图3可知,大黄鱼在冷藏保鲜过程中涉及的代谢途径主要包括精氨酸和脯氨酸代谢,甘氨酸、丝氨酸和苏氨酸代谢,半胱氨酸和蛋氨酸代谢,丙氨酸、天冬氨酸和谷氨酸代谢,赖氨酸降解,缬氨酸、亮氨酸和异亮氨酸生物合成,精氨酸生物合成。由图3A可知,贮藏0 d鱼肉与贮藏9 d鱼肉相比,KEGG通路主要体现在精氨酸和脯氨酸代谢,赖氨酸降解,甘氨酸、丝氨酸和苏氨酸代谢。由图3B可知,贮藏0 d鱼肉与贮藏18 d鱼肉相比,KEGG通路主要体现在精氨酸和脯氨酸代谢,半胱氨酸和蛋氨酸代谢,丙氨酸、天冬氨酸和谷氨酸代谢等。由图3C可知,贮藏9 d鱼肉与贮藏18 d鱼肉相比,KEGG通路主要体现在缬氨酸、亮氨酸和异亮氨酸生物合成。
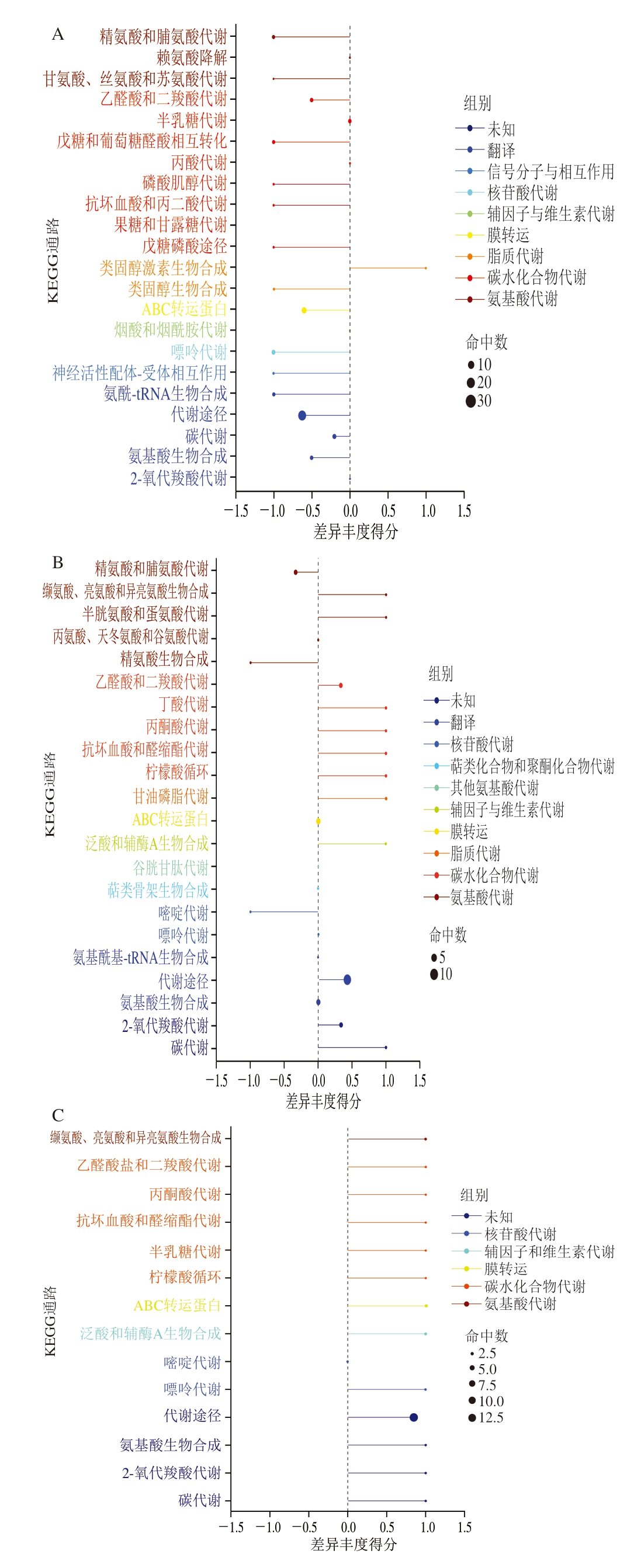
图3 贮藏0、9、18 d鱼肉差异代谢物KEGG注释图
Fig. 3 KEGG annotation maps of differential metabolites across fish meat on days 0, 9, and 18 of refrigeration
氨基酸作为蛋白质降解的关键产物,通过风味形成、质地调控等影响大黄鱼品质。在大黄鱼品质劣变过程中,氨基酸代谢的改变不仅能够直接影响大黄鱼的风味,还可作为风味化合物的前体物质,间接影响大黄鱼的风味[15]。研究[16]表明,甘油月桂酸酯(glycerol monolaurate,GML)作为饲料添加剂能够显著提高大黄鱼中风味氨基酸含量,如谷氨酸、甘氨酸和脯氨酸,代谢组学证明GML添加通过改变苯丙氨酸、酪氨酸和色氨酸生物合成,甘氨酸、丝氨酸、苏氨酸代谢及精氨酸、脯氨酸代谢改变鱼肉风味。此外,L-赖氨酸等碱性氨基酸能够影响鱼肉中多种酶的活性,从而促进三酰甘油降解、抑制磷脂降解和脂质氧化,进而影响鱼肉风味的形成[17]。
2.4 差异代谢产物层次聚类分析
由图4A可知,与贮藏0 d相比,贮藏9 d鱼肉代谢较为活跃,代谢产物中,阿苯达唑、蛋氨酸、L-谷氨酸、单硬脂酸、亚油酸、胍基乙酸、核糖、葡萄糖-1-磷酸、甘氨酸、葡萄糖醛酸、麦角固醇、茉莉酸甲酯、D-阿拉伯糖醇、草酸、半乳凝素、乳二烯酸、木糖醇、木糖、丙酮、白皮杉醇等代谢产物高表达,而且多数化合物与糖类、氨基酸、核酸代谢有关。由图4B可知,与贮藏0 d相比,贮藏18 d鱼肉中的羟脯氨酸、谷氨酰胺、甲氧基麻黄碱、(2R)-2-氨基-3-膦酰基丙酸、鸟氨酸、法尼醛、核糖酸-γ-内酯、胸苷等代谢产物高表达,多数化合物和氨基酸代谢有关。由图4C可知,与贮藏9 d相比,贮藏18 d鱼肉中的甲氧基麻黄碱、核糖酸-γ-内酯、胸苷、9-菲酚等代谢产物高表达。综上可知,大黄鱼冷藏保鲜过程中存在多种差异代谢物,主要有氨基酸类、糖类、核苷酸类等。
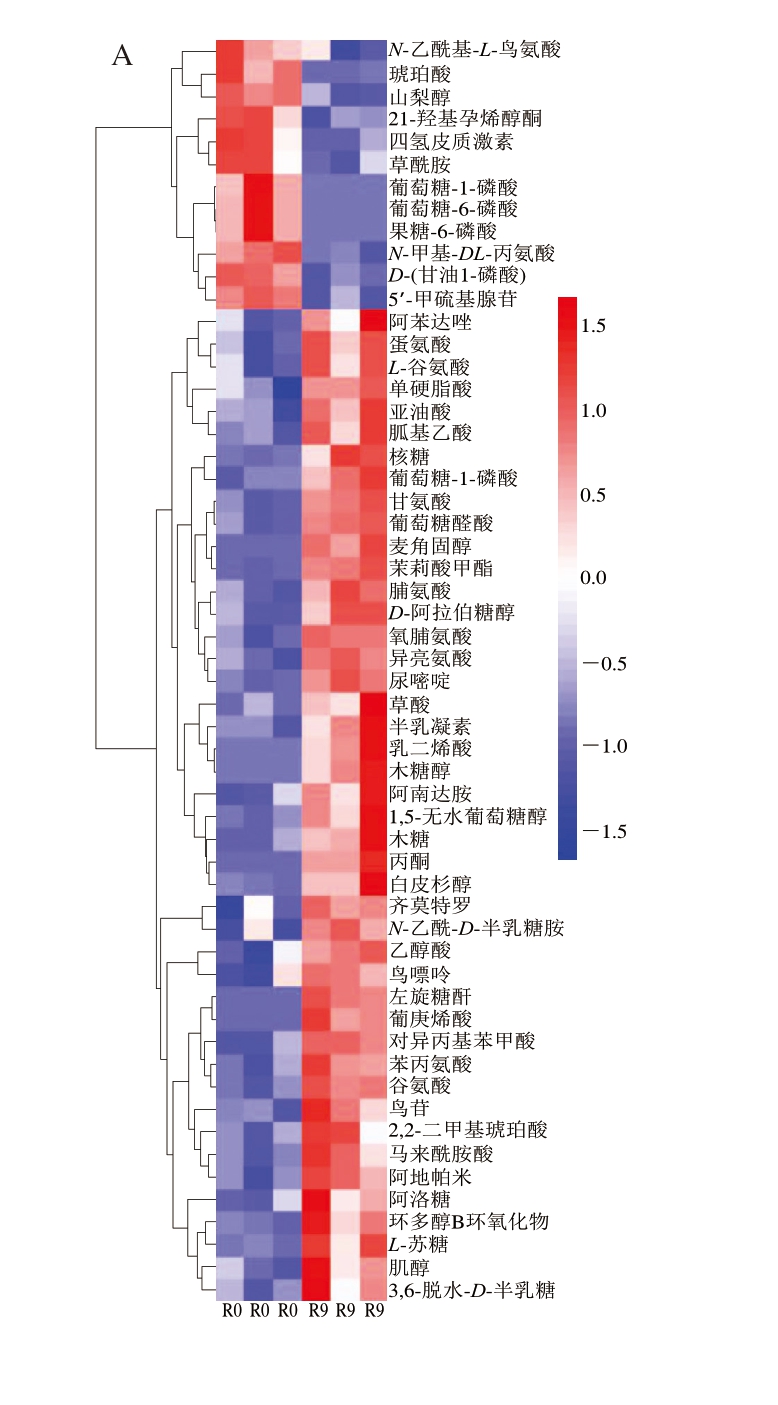
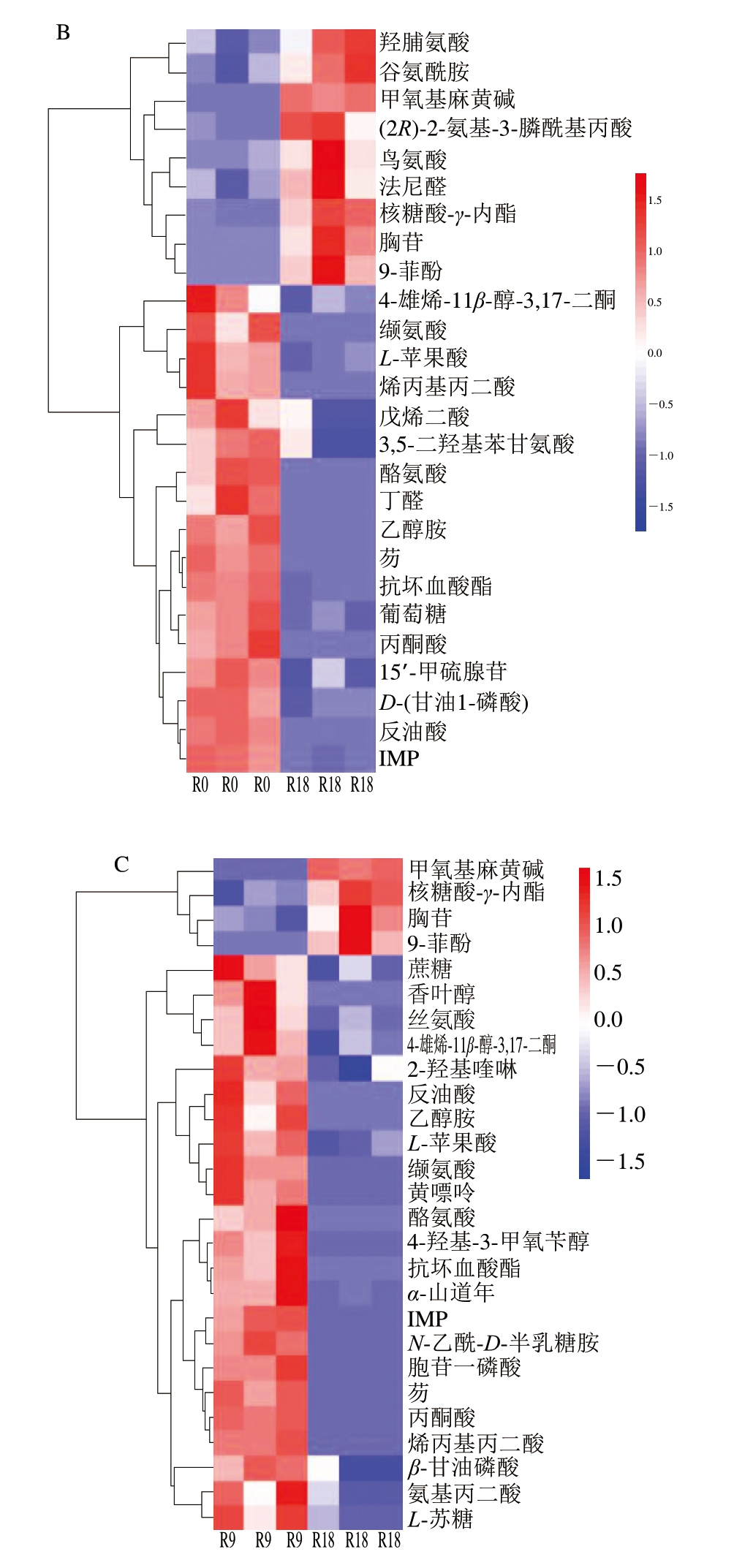
图4 贮藏0、9、18 d鱼肉差异代谢物层次聚类分析图
Fig. 4 Hierarchical cluster analysis of differential metabolites across fish meat on days 0, 9, and 18 of refrigeration
IMP. 5’-肌苷酸(5’-inosine monophosphate)。
2.5 冷藏大黄鱼品质劣变机制分析
2.5.1 氨基酸类
大黄鱼富含蛋白质,在冷藏过程中蛋白质在蛋白酶和肽酶作用下分解成小分子肽、游离氨基酸等中间产物[18],继而进一步降解为生物胺或其他代谢物,导致大黄鱼特有香气损失[1],因此,游离氨基酸可作为大黄鱼新鲜度指标。在鱼肉贮藏过程中,随着贮藏时间的延长,鱼肉的品质逐渐发生劣变。贮藏期间,缬氨酸和酪氨酸含量显著增加,且FC>1,表明这2 种游离氨基酸在贮藏过程中上调。缬氨酸和酪氨酸作为蛋白质分解产物,其含量增加反映鱼肉蛋白质发生降解,并可能对鱼肉风味产生显著影响,尤其是苦味可能增强。通常,苦味产生与蛋白质分解过程中特定氨基酸的释放密切相关,是鱼肉品质劣变的重要指标之一。
生物胺主要由蛋白质或氨基酸脱羧反应生成,如酪氨酸、组氨酸和鸟氨酸等氨基酸分别是酪胺、组胺和腐胺的前体物质,生物胺含量可间接反映大黄鱼的微生物污染情况,也是大黄鱼新鲜度和货架期评估的重要指标之一[19-21]。生物胺种类与含量受食品成分、微生物菌群、贮藏温度、成熟条件和包装等因素影响。与贮藏0 d相比,贮藏9、18 d鱼肉中多种氨基酸的显著上调与生物胺的增加直接相关,进而导致大黄鱼新鲜度下降和货架期缩短。
2.5.2 核苷与核苷酸类
核苷酸及其衍生物作为参与物质代谢的关键生理活性成分[22-23],对水产冷藏过程中的鲜味品质具有重要调控作用。在鲜味呈味物质中,核苷酸类物质是仅次于氨基酸的第2大风味贡献组分,其中,5’-三磷酸腺苷作为重要的核苷酸[24-25],可通过酶促降解途径发生系列转化,产生5’-二磷酸腺苷、5’-一磷酸腺苷、IMP等,IMP作为关键鲜味物质能够赋予产品愉悦风味,而其后续降解产物肌苷和次黄嘌呤的积累则会导致苦味和异味的形成,进而导致鱼肉风味品质劣变[26-29]。IMP降解产物还包括腺苷、黄嘌呤、腺嘌呤等[30-31]。
贮藏期间,大黄鱼肉差异核苷及核苷酸类物质主要有鸟苷、尿嘧啶、核糖、胸苷、黄嘌呤、IMP等。与贮藏0 d相比,贮藏9、18 d鱼肉中大部分核苷酸类物质下调(FC<1、P<0.05),表明随着贮藏时间的延长,大黄鱼品质下降与这些代谢物变化紧密相关。
3 结论
本研究基于代谢组学分析大黄鱼冷藏过程中的代谢物变化,随着贮藏时间的延长,代谢物和代谢途径发生改变,尤其是在冷藏初期。大黄鱼冷藏过程中差异代谢物种类主要包含氨基酸类、糖类、核苷酸类等,代谢途径主要集中于氨基酸代谢。氨基酸不仅可为大黄鱼直接贡献风味,还可作为风味化合物的前体物质间接影响大黄鱼的风味。综上,多种代谢物、代谢途径变化与冷藏大黄鱼品质下降直接相关,本研究可为冷藏大黄鱼新鲜度保持和货架期延长研究提供新思路。
[1] LAN W Q, SUN Y Q, CHEN M L, et al. Effects of pectin combined with plant essential oils on water migration, myofibrillar proteins and muscle tissue enzyme activity of vacuum packaged large yellow croaker (Pseudosciaena crocea) during ice storage[J]. Food Packaging and Shelf Life, 2021, 30: 100699. DOI:10.1016/j.fpsl.2021.100699.
[2] FU L L, WANG C, RUAN X M, et al. Preservation of large yellow croaker (Pseudosciaena crocea) by coagulin l1208, a novel bacteriocin produced by Bacillus coagulans l1208[J]. International Journal of Food Microbiology, 2018, 266: 60-68. DOI:10.1016/j.ijfoodmicro.2017.11.012.
[3] LIN B, ZHANG X J, ZHONG Y Q, et al. Preparation of vanillin nanoparticle/polyvinyl alcohol/chitosan film and its application in preservation of large yellow croaker[J]. International Journal of Biological Macromolecules, 2025, 287: 138440. DOI:10.1016/j.ijbiomac.2024.138440.
[4] MAO J L, FU J J, QI X E, et al. Effect of theaflavins on the quality of large yellow croaker (Larimichthys crocea) during refrigerated storage[J]. Journal of the Science of Food and Agriculture, 2023,103(12): 6033-6043. DOI:10.1002/jsfa.12671.
[5] CHU Y M, TAN M T, BIAN C H, et al. Effect of ultrasonic thawing on the physicochemical properties, freshness, and protein-related properties of frozen large yellow croaker (Pseudosciaena crocea)[J].Journal of Food Science, 2022, 87(1): 52-67. DOI:10.1111/1750-3841.15983.
[6] CHU Y M, DING Z Y, WANG J F, et al. Factors affecting the quality of frozen large yellow croaker (Pseudosciaena crocea) in cold chain logistics: retention time and temperature fluctuation[J]. Food Chemistry: X, 2023, 18: 100742. DOI:10.1016/j.fochx.2023.100742.
[7] 谢晨, 熊泽语, 李慧, 等. 金针菇多糖对微冻大黄鱼及其鱼片品质变化的影响[J]. 食品科学, 2021, 42(13): 215-222. DOI:10.7506/spkx1002-6630-20200713-171.
[8] 蓝蔚青, 刘嘉莉, 许巧玲, 等. 植酸与竹醋液对冰藏大黄鱼品质、微生物与水分迁移的影响[J]. 食品与发酵工业, 2020, 46(7): 173-179.DOI:10.13995/j.cnki.11-1802/ts.022876.
[9] FEI L F, MA Z, YUE A D, et al. Effect of low-voltage electrostatic field-assisted partial freezing on large yellow croaker protein properties and metabolomic analysis during storage[J]. Journal of the Science of Food and Agriculture, 2024, 104(4): 2359-2371. DOI:10.1002/jsfa.13145.
[10] ZHOU Y C, YIN X L, LI W Y, et al. Effects of transportation on physiological indices and metabolomics of the large yellow croaker Larimichthys crocea[J]. Fish Physiology and Biochemistry, 2023,49(4): 641-654. DOI:10.1007/s10695-023-01216-2.
[11] 罗辉, 何雨薇, 张杏亚, 等. 秦川牛肉冷藏期间能量代谢变化及其对肉品质的影响[J]. 食品科学, 2021, 42(17): 201-209. DOI:10.7506/spkx1002-6630-20201013-112.
[12] YU Q, PAN H J, SHAO H T, et al. UPLC/MS-based untargeted metabolomics reveals the changes in muscle metabolism of electron beam irradiated solenocera melantho during refrigerated storage[J]. Food Chemistry, 2021, 367: 130713. DOI:10.1016/j.foodchem.2021.130713.
[13] 李璞钰, 剧柠, 罗玉龙, 等. 基于UPLC-Q-TOF-MS技术分析原料乳冷藏过程中脂类代谢组学[J]. 食品科学, 2021, 42(20): 120-127.DOI:10.7506/spkx1002-6630-20210407-081.
[14] LIU M Y, QIAO G D, WANG Y B, et al. Unveiling the molecular mechanisms regulating muscle elasticity in the large yellow croaker:insights from transcriptomics and metabolomics[J]. International Journal of Molecular Sciences, 2024, 25(20): 10924. DOI:10.3390/ijms252010924.
[15] GAO D, LIN S Y, CHEN D C, et al. Inhibitory effect and mechanism of various fruit extracts on the formation of heterocyclic aromatic amines and flavor changes in roast large yellow croaker (Pseudosciaena crocea)[J]. Food Control, 2022, 131: 108410. DOI:10.1016/j.foodcont.2021.108410.
[16] WANG J, JIANG H Q, ALHAMOUD Y, et al. Integrated metabolomic and gene expression analyses to study the effects of glycerol monolaurate on flesh quality in large yellow croaker (Larimichthys crocea)[J]. Food Chemistry, 2022, 367: 130749. DOI:10.1016/j.foodchem.2021.130749.
[17] ZHANG M, FU J J, MAO J L, et al. Lipidomics reveals the relationship between lipid oxidation and flavor formation of basic amnio acids participated low-sodium cured large yellow croaker[J]. Food Chemistry, 2023, 429: 136888. DOI:10.1016/j.foodchem.2023.136888.
[18] TAN M T, YE J X, CHU Y M, et al. The effects of ice crystal on water properties and protein stability of large yellow croaker (Pseudosciaena crocea)[J]. International Journal of Refrigeration, 2021, 130: 242-252.DOI:10.1016/j.ijrefrig.2021.05.040.
[19] ZHAO Y N, LAN W Q, SHEN J L, et al. Combining ozone and slurry ice treatment to prolong the shelf-life and quality of large yellow croaker (Pseudosciaena crocea)[J]. LWT-Food Science and Technology, 2022, 154: 112615. DOI:10.1016/j.lwt.2021.112615.
[20] ARULKUMAR A, PARAMITHIOTIS S, PARAMASIVAM S.Biogenic amines in fresh fish and fishery products and emerging control[J]. Aquaculture and Fisheries, 2021, 8(4): 431-450.DOI:10.1016/j.aaf.2021.02.001.
[21] FONG F L Y, EL-NEZAMI H, SZE E P S. Biogenic amines-precursors of carcinogens in traditional chinese fermented food[J]. NFS Journal,2021, 23: 52-57. DOI:10.1016/j.nfs.2021.04.002.
[22] DONG M, QIN L, MA L X, et al. Postmortem nucleotide degradation in turbot mince during chill and partial freezing storage[J]. Food Chemistry, 2020, 311: 125900. DOI:10.1016/j.foodchem.2019.125900.
[23] LOU X W, ZHAI D D, YANG H S. Changes of metabolite profiles of fish models inoculated with Shewanella baltica during spoilage[J]. Food Control, 2020, 123: 107697. DOI:10.1016/j.foodcont.2020.107697.
[24] PRABHAKAR P K, VATSA S, SRIVASTAV P P, et al.A comprehensive review on freshness of fish and assessment:analytical methods and recent innovations[J]. Food Research International, 2020, 133: 109157. DOI:10.1016/j.foodres.2020.109157.
[25] HONG H, REGENSTEIN J M, LUO Y K. The importance of ATPrelated compounds for the freshness and flavor of post-mortem fish and shellfish muscle: a review[J]. Critical Reviews in Food Technology,2015, 57(9): 1787-1798. DOI:10.1080/10408398.2014.1001489.
[26] LIU W R, MEI J, XIE J. Effect of locust bean gum-sodium alginate coatings incorporated with daphnetin emulsions on the quality of Scophthalmus maximus at refrigerated condition[J]. International Journal of Biological Macromolecules, 2021, 170: 129-139.DOI:10.1016/j.ijbiomac.2020.12.089.
[27] MEI J, LIU F, FANG S Y, et al. High-CO2 modified atmosphere packaging with superchilling (1.3 ℃) inhibit biochemical and flavor changes in turbot (Scophthalmus maximus) during storage[J].Molecules, 2020, 25(12): 2826. DOI:10.3390/molecules25122826.
[28] FURUHASHI M. New insights into purine metabolism in metabolic diseases: role of xanthine oxidoreductase activity[J]. American Journal of Physiology-Endocrinology and Metabolism, 2020, 319(5):E827-E834. DOI:10.1152/ajpendo.00378.2020.
[29] YU D W, JING D T, YANG F, et al. The factors influencing the flavor characteristics of frozen obscure pufferfish (Takifugu obscurus)during storage: ice crystals, endogenous proteolysis and oxidation[J].International Journal of Refrigeration, 2020, 122: 147-155.DOI:10.1016/j.ijrefrig.2020.10.028.
[30] DOMÍNGUEZ-ÁLVAREZ J, MATEOS-VIVAS M, RODRÍGUEZGONZALO E, et al. Determination of nucleosides and nucleotides in food samples by using liquid chromatography and capillary electrophoresis[J]. Electrophoresis, 2010, 31(13): 2092-2105.DOI:10.1002/elps.201000048.
[31] LI J T, ZHOU G H, XUE P, et al. Spoilage microbes’ effect on freshness and imp degradation in sturgeon fillets during chilled storage[J]. Food Bioscience, 2021, 41(1): 101008. DOI:10.1016/j.fbio.2021.101008.