牦牛被誉为“高原之舟”,主要生长在空气稀薄、气候寒冷的高海拔地区[1]。牦牛肉具有高蛋白、低脂肪和矿物质含量高等优点,但在加工贮运中易受环境影响发生脂质和蛋白质氧化现象,氧化通常会影响肉制品的色泽、风味、质构、营养价值,甚至形成有毒物质,导致品质劣变或引发食品安全问题[2]。近年来的研究已证实蛋白质氧化在肉制品劣变过程中起关键作用,主要涉及活性氧或氧化应激副产物诱导的蛋白质共价修饰,进而改变蛋白质结构和功能特性[3-4]。pH值也是影响蛋白质品质和构象的重要因素,其可通过改变氨基酸侧链电荷的数量与分布影响蛋白质分子间的折叠状态,从而引起蛋白空间结构改变并最终影响蛋白的各种功能性质[5-7]。另外,不同NaCl浓度也会对蛋白质结构产生一定的影响。添加NaCl可能会导致蛋白质结构部分展开,NaCl可通过静电相互作用和疏水相互作用改变蛋白质构象,因此在决定蛋白质的功能特性方面起着重要作用[8-9]。虽然在肉制品中添加适量的NaCl可延长其货架期并改善其风味[10],但NaCl会在一定程度上影响肌原纤维蛋白(myofibril protein,MP)的氧化程度、蛋白结构与肌肉持水性[11-12]。
本研究在3种pH值(5.0、6.0、8.0)下构建Fenton氧化体系和不同NaCl浓度体系,并通过测定各体系下牦牛肉MP的总巯基含量、表面疏水性、溶解度、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)图谱及微观结构探究不同pH值下氧化程度与NaCl浓度对牦牛肉MP结构的影响,为不同pH值下氧化程度和NaCl浓度与MP结构变化之间的关系研究提供理论依据。
1 材料与方法
1.1 材料与试剂
背最长肌源于四川阿坝州红原县自然放牧区的健康无病公牦牛(36 月龄),经冷却排酸后4 ℃下运回实验室(约1 h),贮藏在-20 ℃下,4 ℃解冻后使用。
NaCl、L-抗坏血酸、溴酚蓝(bromophenol blue,BPB)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、乙二胺四乙酸二钠(ethylene diamine tetraacetic acid disodium salt,EDTA-2Na)、β-巯基乙醇 成都科隆化学品有限公司;哌嗪-N,N’-双(2-乙磺酸)(piperazine-N,N’-bis(2-ethanesulfonic acid),PIPES) 成都鹏世达实验用品有限公司;牛血清白蛋白、30%(V/V)H2O2、5,5-二硫代双(2-硝基苯甲酸)(5,5-dithiobis(2-nitrobenzoic acid),DTNB) 成都欣亿维生物科技有限公司。
1.2 仪器与设备
PL303电子天平 梅特勒-托利多(上海)仪器有限公司;CX23光学显微镜 日本奥林巴斯公司;UV1810S紫外-可见分光光度计 上海佑科仪器仪表有限公司;T-25高速匀浆机 德国IKA公司;Centrifuge 5804R高速离心机 德国Eppendorf公司;pH-STAR pH仪 德国Matthäus公司。
1.3 Fenton方法
1.3.1 Fenton提取与含量测定
参考Park等[13]的方法并略作修改,背最长肌中以质量比1∶4加入缓冲溶液A(0.1 mol/L NaCl、1 mmol/L EDTA、2 mmol/L MgCl2、20 mmol/L磷酸钠缓冲溶液(pH 7.0)),高速匀浆30 s后2 000×g离心15 min,弃上清液,上述步骤重复3 次,然后采用0.1 mol/L NaCl溶液重复洗涤2 次。提取的MP于4 ℃贮藏,并在48 h内使用。
以牛血清白蛋白为标准品,采用双缩脲法测定蛋白质量浓度(y=0.048 1x+0.001 2,R2=0.999 7)。
1.3.2 Fenton氧化体系与不同NaCl浓度体系构建
1.3.2.1 Fenton氧化体系构建
采用15 mmol/L PIPES缓冲溶液将MP溶液质量浓度调至10 mg/mL,0.5 mol/L NaOH或HCl溶液调节pH值至5.0、6.0、8.0,在4 ℃下,分别在Fenton氧化体系(1、10、20、50 mmol/L H2O2,0.1 mmol/L VC,0.01 mmol/L FeCl3)中氧化1 h,以未经Fenton氧化体系氧化(等量去离子水)为对照组,采用终浓度1 mmol/L EDTA-2Na终止氧化,4 ℃贮藏备用,48 h内测定相关指标。
1.3.2.2 不同NaCl浓度体系构建
采用15 mmol/L PIPES缓冲溶液将MP溶液质量浓度调至10 mg/mL,0.5 mol/L NaOH或HCl溶液调节pH值至5.0、6.0、8.0,在4 ℃下,分别在不同NaCl浓度(0.1、0.2、0.4、0.6、1.0 mol/L)体系中处理1 h,4 ℃贮藏备用,48 h内测定相关指标。
1.3.3 总巯基含量测定
参考Yuliana等[14]的方法并略作修改。采用15 mmol/L PIPES缓冲溶液将MP溶液质量浓度调至10 mg/mL,加入4 mL 50 mmol/L磷酸盐缓冲液(含10 mmol/L EDTA、0.6 mol/L KCl、8 mol/L尿素,pH 7.0)。取4 mL上述混合物加入0.4 mL 0.2 mol/L Tris-HCl缓冲溶液(含0.1% DTNB、pH 8.0),40 ℃水浴加热25 min,以0.6 mol/L KCl溶液作为空白,412 nm处测定吸光度。总巯基含量结果以蛋白质量计,单位为nmol/mg。
1.3.4 表面疏水性测定
参考彭泽宇[15]的方法并适当修改,采用20 mmol/L磷酸盐缓冲液(pH 6.0)将MP质量浓度调至2 mg/mL。取2 mL加入40 μL 1 mg/mL BPB溶液并充分混合。以磷酸盐缓冲液为对照组。室温下振荡10 min,4 ℃、4 000×g离心15 min。以磷酸盐缓冲液作为本底,取上清液测定595 nm处的光密度(optical density,OD)。以BPB结合量表示表面疏水性,BPB结合量按式(1)计算:
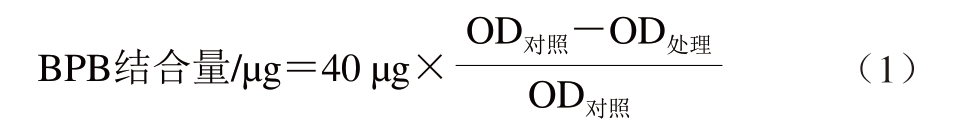
1.3.5 溶解度测定
参考Liu Zelong等[16]的方法并略作修改,采用15 mmol/L PIPES缓冲溶液将MP质量浓度调至5 mg/mL,4 ℃、5 000×g离心15 min,溶解度按(2)计算:
式中:ρ0表示上清液中MP质量浓度/(mg/mL);ρ表示MP溶液质量浓度(5 mg/mL)。
1.3.6 SDS-PAGE分析
采用5%浓缩胶和12%分离胶,等体积添加1 mg/mL MP溶液与上样缓冲液(还原电泳上样缓冲液中含5%β-巯基乙醇),上样量10 µL,浓缩胶电压80 V,分离胶电压120 V。采用0.2%考马斯亮兰染色液染色2 h后,脱色(7.5%甲醇和7.5%醋酸)后拍照分析。
1.3.7 微观结构观察
参照高瑞昌[17]的方法并略作修改,将不同氧化体系与不同NaCl浓度处理后的MP溶液质量浓度调至约10 mg/mL,置于载玻片上,在光学显微镜下观察,放大倍数为×1 000。以同样的处理方式分别添加5% β-巯基乙醇作为还原对照组,观察不同氧化体系与不同NaCl浓度下MP膨胀程度变化。
1.4 数据处理
采用Excel 2016软件进行数据处理和差异显著性分析,采用SPSS 20.0软件计算平均值与标准差,并进行方差分析,用Duncan多重范围检验对数据进行显著性分析,P<0.05表示差异显著,采用Origin 2018软件绘图,在显微镜OLD-SG软件中分析MP横向长度,所有实验均进行3 次平行。
2 结果与分析
2.1 不同pH值下蛋白氧化对MP结构的影响
2.1.1 氧化对MP总巯基含量的影响
巯基是MP中反应活性最高的官能团,是维持蛋白质三级结构的关键[18]。如图1所示,总巯基含量随着H2O2浓度的增加而降低,未经氧化时,各pH值下的总巯基含量差异不显著(P>0.05),当H2O2浓度为1 mmol/L时,各pH值下总巯基含量差异显著(P<0.05)。H2O2浓度为10 mmol/L时,3种pH值下的总巯基含量均显著低于对照组(P<0.05),这是因为氧化应激条件下,蛋白质分子中的游离巯基易被氧化,形成分子内或分子间二硫键。H2O2浓度为10 mmol/L时,pH 5.0、6.0(MP等电点附近)条件下总巯基含量较pH 8.0下降近30 nmol/mg,说明酸性条件下巯基氧化成二硫键的速率大于碱性条件下,这可能是因为酸处理更易引发硫醇-二硫键交换反应生成二硫键[19]。
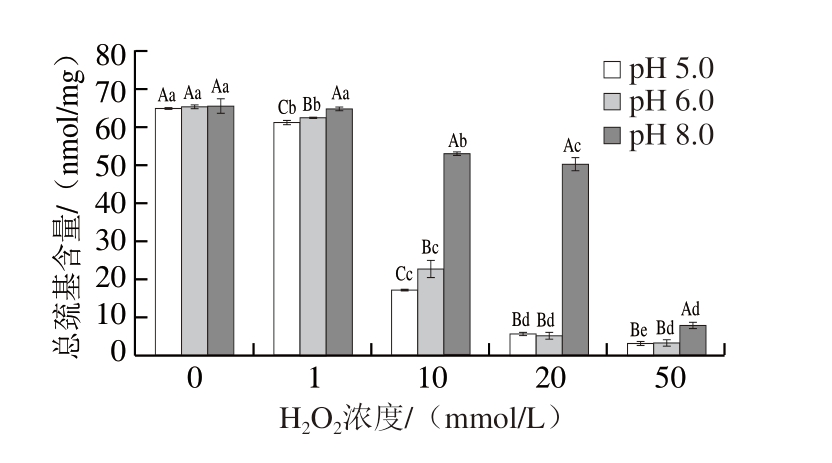
图1 不同pH值下H2O2浓度对MP总巯基含量的影响
Fig. 1 Influence of H2O2 concentration on the total sulfhydryl content of MP at different pH values
大写字母不同表示同一H2O2浓度、不同pH值之间差异显著(P<0.05);小写字母不同表示同一pH值、不同H2O2浓度之间差异显著(P<0.05)。图2、3、7、8同。
2.1.2 氧化对MP表面疏水性的影响
表面疏水性增加意味着蛋白质构象被破坏,更多疏水性残基暴露[20]。如图2所示,pH 5.0时,随着H2O2浓度的增加,表面疏水性显著增加(P<0.05),pH 6.0、8.0时,增加趋势明显减缓,H2O2浓度为10 mmol/L时,3种pH值下的表面疏水性均显著高于对照组(P<0.05)。pH值接近MP等电点时,表面疏水性更大,pH 8.0时,表面疏水性最小,但总体而言,pH 6.0与pH 8.0时表面疏水性差异较小,仅在H2O2浓度为1 mmol/L时表现出显著差异(P<0.05)。在环境pH值接近MP等电点时,MP表面暴露的非极性基团因水分子排斥作用而相互靠近,通过范德华力或疏水相互作用形成更紧密的结合。随着非极性基团暴露程度的进一步增加,蛋白质分子间相互作用增强,最终导致聚集。pH 8.0离MP等电点较远,蛋白分子间的排斥力使蛋白分子充分展开,从而促进蛋白与水分子间的相互作用,疏水相互作用减弱[21-22]。
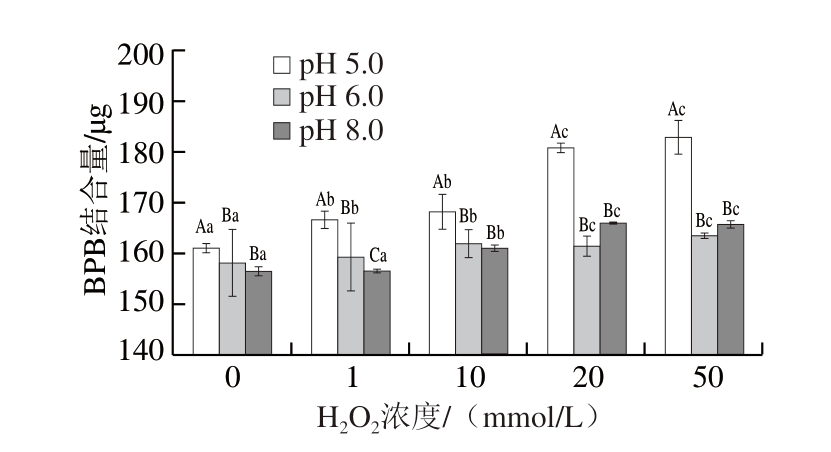
图2 不同pH值下H2O2浓度对MP表面疏水性的影响
Fig. 2 Effect of H2O2 concentration on the surface hydrophobicity of MP at different pH values
2.1.3 氧化对MP溶解度的影响
溶解度是反映蛋白质变性、聚集及氧化状态的关键指标之一[23]。如图3所示,随着H2O2浓度的增加,MP溶解度呈显著降低趋势(P<0.05),H2O2浓度为10 mmol/L时,3种pH值下的MP溶解度均显著低于对照组(P<0.05)。溶解度降低主要归因于氧化导致蛋白质聚集[24]。值得注意的是,在相同H2O2浓度下,随着pH值逐渐偏离MP等电点,MP溶解度呈显著增加趋势(P<0.05)。这主要归因于MP表面静电荷增加,静电斥力减弱蛋白分子间相互作用,使得蛋白质-水相互作用逐渐增加,导致蛋白溶解度升高[19]。
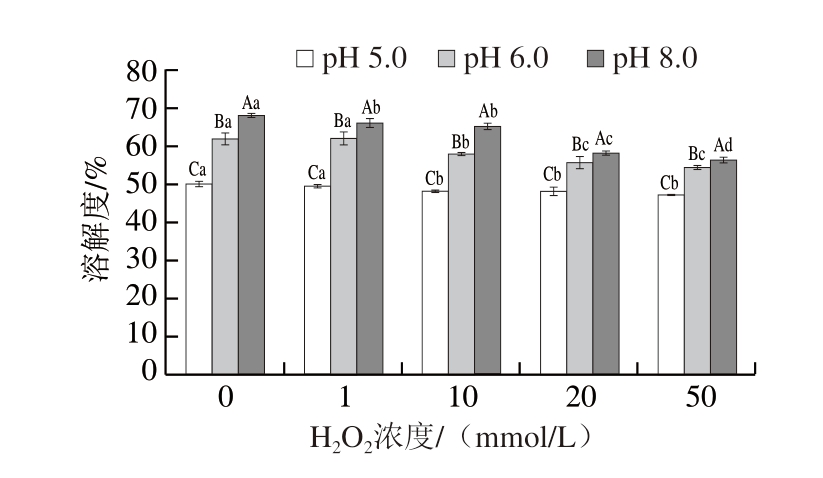
图3 不同pH值下H2O2浓度对MP溶解度的影响
Fig. 3 Influence of H2O2 concentration on the solubility of MP at different pH values
2.1.4 氧化对MP SDS-PAGE图谱的影响
如图4所示,在非还原胶中,对照组肌球蛋白重链(myosin heavy chain,MHC)和肌动蛋白条带颜色最深,随着H2O2浓度的增加,其条带颜色逐渐变浅。在相同H2O2浓度下,随着pH值的增加,条带颜色加深。在pH 5.0条件下,当H2O2浓度为20、50 mmol/L时蛋白条带颜色最浅,究其原因,其一,氧化导致蛋白交联;其二,等电点聚集效应,pH 5.0接近MP等电点,蛋白质表面净电荷减少,分子间静电斥力减弱,导致蛋白聚集沉淀。在相同pH值和H2O2浓度下,还原胶中蛋白条带颜色恢复,说明蛋白分子间除二硫键交联外还存在其他共价交联。
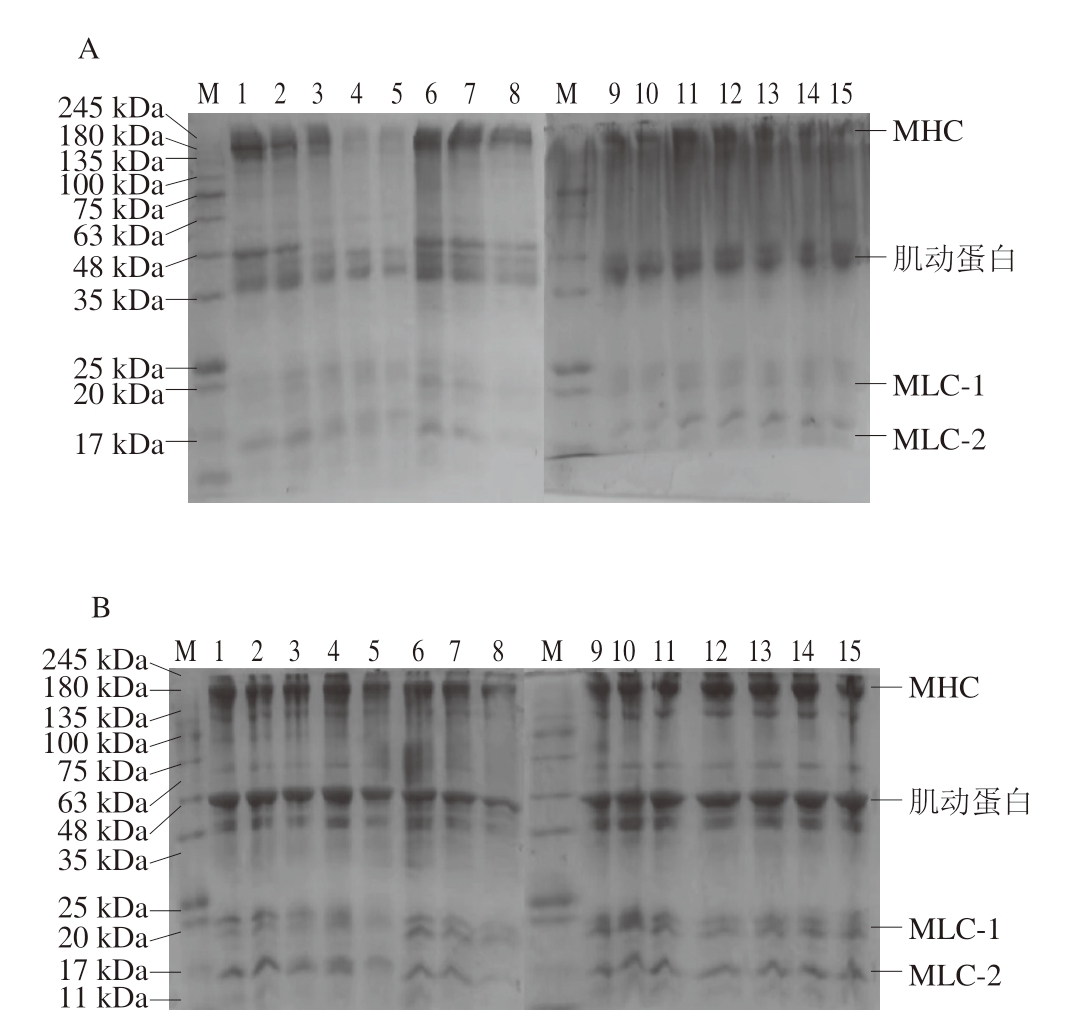
图4 不同pH值下H2O2浓度对非还原性(A)与还原性SDS-PAGE图谱(B)的影响
Fig. 4 Effects of H2O2 concentration on the non-reducing (A) and reducing SDS-PAGE profiles (B) of MP at different pH values
M. Marker;泳道1~5. pH 5.0时,H2O2浓度分别为0(对照组)、1、10、20、50 mmol/L;泳道6~10. pH 6.0时,H2O2浓度分别为0(对照组)、1、10、20、50 mmol/L;泳道11~15. pH 8.0时,H2O2浓度分别为0(对照组)、1、10、20、50 mmol/L;MLC.肌球蛋白轻链(myosin light chain)。
2.1.5 氧化对MP微观结构的影响
MP在光学显微镜下呈现周期性横纹结构,A带(暗带)和I带(亮带)交替排布。暗带中间较亮的区域为H区,A带和I带分别被M线和Z线分隔,相邻2 条Z线之间的区域构成1 个肌节。因分辨率限制,M线和Z线在常规光学显微镜下难以清晰区分。此外,同一样品在显微镜下的MP直径也会有所差别,这是由于肌丝蛋白的非均一性堆叠和聚集态分布所致[25-26]。如图5所示,能够清晰地观察到MP的A带和I带,随着H2O2浓度的增加,A带轴向增加,而I带轴向减小,说明MP溶解度随H2O2浓度增加而下降。
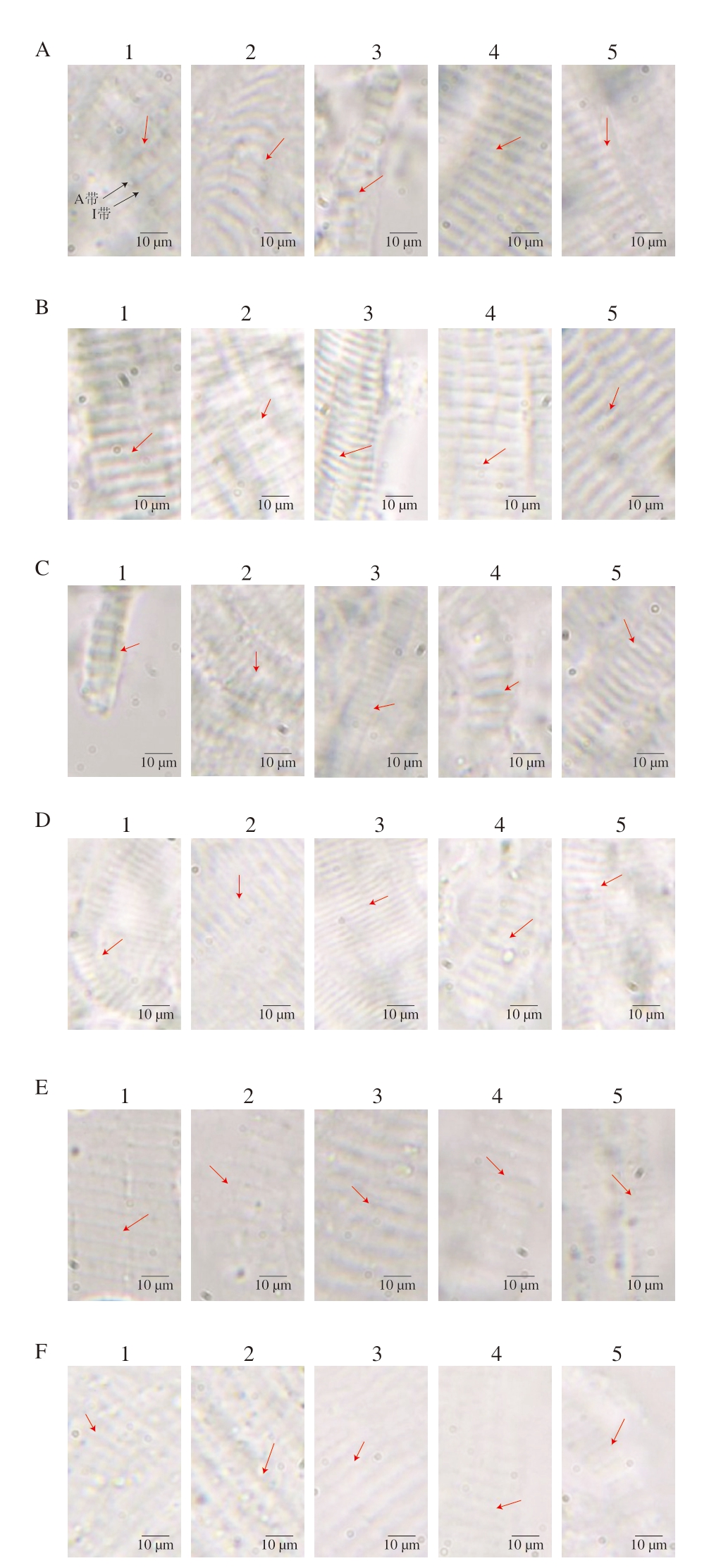
图5 不同pH值下H2O2浓度对MP形态结构变化的影响
Fig. 5 Influence of H2O2 concentration on the morphological and structural changes of MP at different pH values
A、B.分别为pH 5.0、pH 5.0+β-巯基乙醇;C、D.分别为pH 6.0、pH 6.0+β-巯基乙醇;E、F.分别为pH 8.0、pH 8.0+β-巯基乙醇;1~5. H2O2浓度分别为0、1、10、20、50 mmol/L。红色箭头表示A带,图10同。
如图6所示,随着H2O2浓度的增加,MP横向长度呈下降趋势,未加β-巯基乙醇、H2O2浓度为50 mmol/L时,与对照组相比,pH 8.0组MP横向长度缩短31.51%,加入β-巯基乙醇后,0~10 mmol/L H2O2浓度下MP横向长度与未加β-巯基乙醇之间差距不大,H2O2浓度为20 mmol/L和50 mmol/L时,MP横向长度明显大于未加β-巯基乙醇。结合图4可知,H2O2浓度为20、50 mmol/L时,SDS-PAGE图谱中MHC和肌动蛋白条带颜色相对较浅,加入β-巯基乙醇后条带颜色部分恢复,说明H2O2浓度为20、50 mmol/L时,蛋白因共价交联造成MP横向长度收缩。
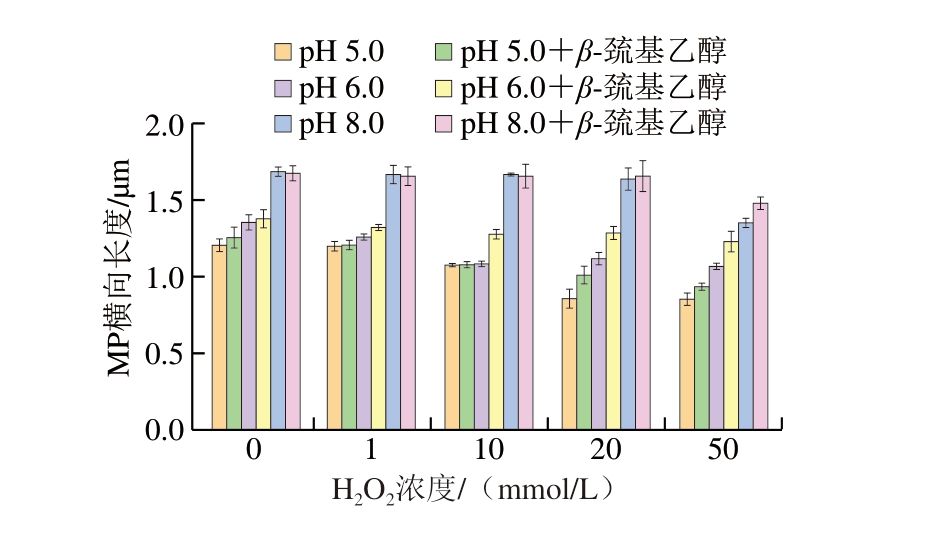
图6 不同pH值下H2O2浓度对MP横向长度的影响
Fig. 6 Effect of H2O2 concentration on the transverse length of MP at different pH values
与pH 5.0相比,pH 6.0时MP形态结构发生横向膨胀,A带轴向收缩,I带轴向增大,M线和Z线遭到破坏。pH 8.0时,A带进一步轴向收缩,I带进一步增大,M线和Z线遭到明显破坏,MP形态结构进一步横向膨胀,与溶解度和SDS-PAGE图谱结果相对应。相对于未加β-巯基乙醇时,加入β-巯基乙醇后A带轴向有所缩小,相反,I带轴向有所增加,MP发生横向膨胀,但在高浓度H2O2下,加入β-巯基乙醇后,MP横向膨胀并未得到恢复,这是因为蛋白氧化后蛋白分子间除二硫键交联外还存在其他共价交联,这与SDS-PAGE图谱结果相对应。
2.2 不同pH值下NaCl浓度对MP的影响
2.2.1 NaCl浓度对MP表面疏水性的影响
如图7所示,pH 5.0、6.0下,MP表面疏水性随NaCl浓度的增加而降低,NaCl浓度为0.4 mol/L时,2 种pH值条件下的表面疏水性均显著低于NaCl浓度为0.1 mol/L时(P<0.05)。吴菊清等[27]研究表明,0.1、0.2 mol/L NaCl对MP表面疏水性影响较小,但随着NaCl浓度增加,MP表面疏水性显著下降,这可能与低浓度NaCl下MP溶解性不佳有关。pH 8.0时,随着NaCl浓度的增加,MP表面疏水性显著增加(P<0.05)。Kang Zhuangli等[18]研究表明,1%、2%(m/m)NaCl处理MP表面疏水性差异并不显著,但3%(m/m)NaCl可使MP表面疏水性达到最大,这是因为NaCl浓度升高可诱导MP结构展开、分子内疏水残基暴露。pH 8.0偏离MP等电点,蛋白表面净电荷增加,分子间静电斥力增强,促使MP空间结构展开、横截面积增大,进而暴露出更多的疏水性基团,使表面疏水性增加[28]。
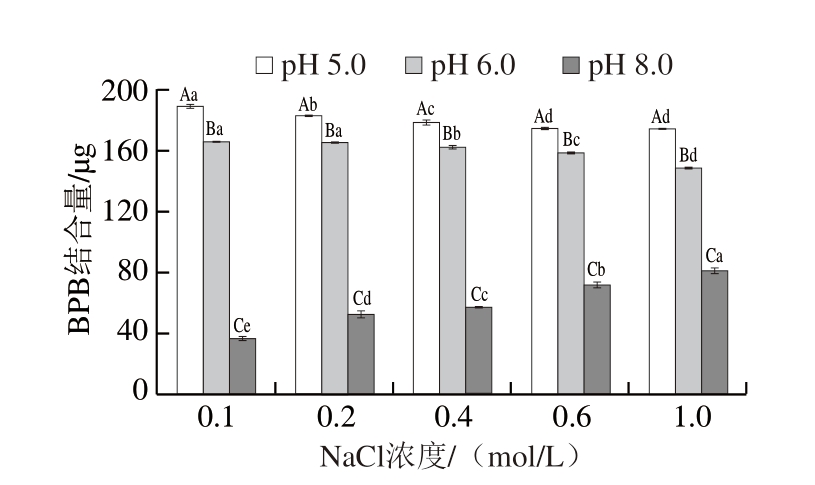
图7 不同pH值下NaCl浓度对MP表面疏水性的影响
Fig. 7 Influence of NaCl concentration on the surface hydrophobicity of MP at different pH values
2.2.2 NaCl浓度对MP溶解度的影响
如图8所示,MP溶解度随NaCl浓度的增加而增加,NaCl浓度为0.2 mol/L时,MP溶解度显著增加(P<0.05)。刘泽龙[5]研究表明,NaCl浓度≥0.5 mol/L时,MP便可溶解,且溶解度随着NaCl浓度的增加而增加。pH 5.0时,MP溶解度最低,这可能与蛋白质在酸性条件下的聚集行为有关。pH 8.0时,蛋白质溶解度最大,主要是因为pH值偏离MP等电点时,蛋白质结构充分展开,与水分子之间的氢键结合机会增加[27]。
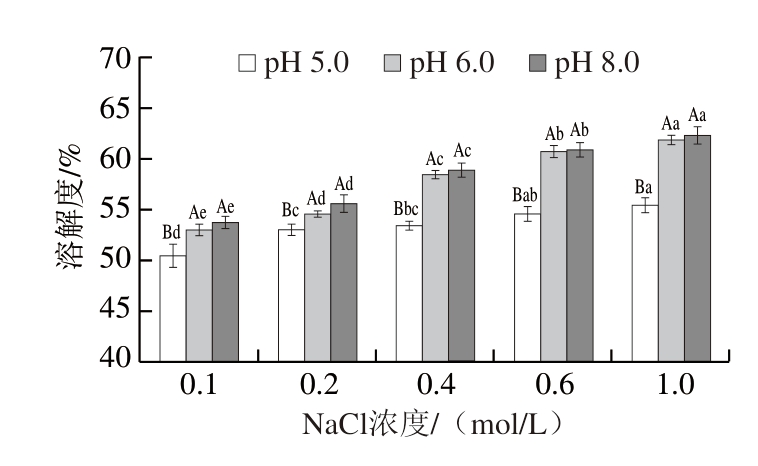
图8 不同pH值下NaCl浓度对MP溶解度的影响
Fig. 8 Influence of NaCl concentration on the solubility of MP at different pH values
2.2.3 NaCl浓度对MP SDS-PAGE图谱的影响
如图9所示,NaCl浓度为0.1 mol/L时,肌动蛋白、MLC-1和MLC-2的条带颜色相对较浅,NaCl浓度为0.2、0.4 mol/L时,条带颜色逐渐加深,这可能是因为在低NaCl浓度下蛋白溶解度较低,随着NaCl浓度的增加,蛋白溶解度增加,pH 5.0、6.0条件下,在NaCl浓度为0.6 mol/L时,蛋白条带颜色逐渐变深,说明MP溶解度逐渐增加[29]。与刘泽龙[5]的研究结果相一致。
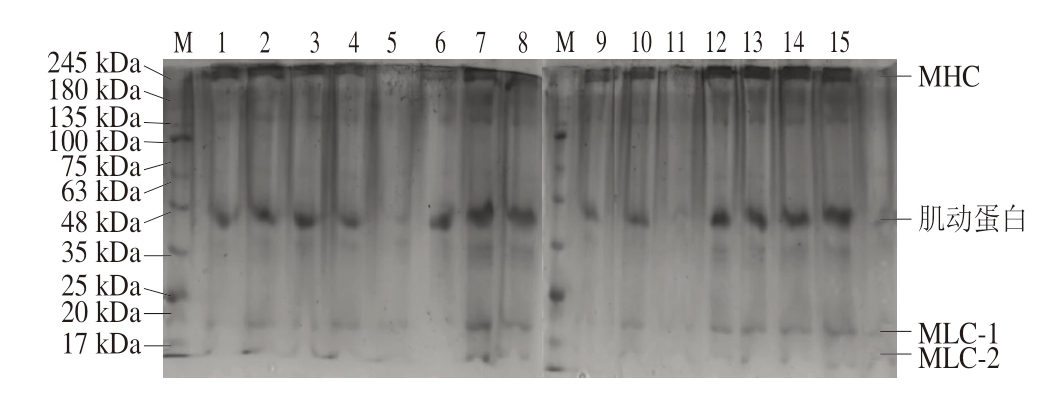
图9 不同pH值下NaCl浓度对MP SDS-PAGE图谱的影响
Fig. 9 Influence of NaCl concentration on the SDS-PAGE pattern of MP at different pH values
M. Marker;泳道1~5. pH 5.0时,NaCl浓度分别为0.1、0.2、0.4、0.6、1.0 mol/L;泳道6~10. pH 6.0时,NaCl浓度分别为0.1、0.2、0.4、0.6、1.0 mol/L;泳道11~15. pH 8.0时,NaCl浓度分别为0.1、0.2、0.4、0.6、1.0 mol/L。
2.2.4 NaCl浓度对MP微观结构的影响
如图10、11所示,在pH 5.0条件下,在NaCl浓度为0.1、0.2 mol/L时,MP形态结构完整,横向长度相对较短。NaCl浓度为0.4 mol/L时,在3种pH值下均可观察到MP发生横向膨胀,但形态结构仍相对完整,而在NaCl浓度为0.6、1.0 mol/L时,可观察到MP形态结构发生明显膨胀,A带轴向收缩,M线和Z线遭到破坏,I带变宽。在同一NaCl浓度下,pH 5.0时MP横向膨胀程度最小,而pH 6.0、8.0时能够明显观察到A带的轴向宽度较大,这与pH 5.0时MP溶解度较低的结果相对应。随着pH值的增加,MP膨胀程度增加,A带变窄、I带变宽,并且在pH 8.0条件下,NaCl浓度为1.0 mol/L时,可明显观察到M线和Z线被破坏,MP整体变得模糊,说明肌节部位发生断裂,MP内部横桥被破坏,粗丝与细丝发生分离。高瑞昌[17]研究表明,NaCl浓度增加能够使MP发生横向膨胀,且蛋白溶解度随离子强度的增加而升高。NaCl可使MP发生膨胀可能是因为氯离子能够选择性地结合到肌丝上,使肌丝所带净负电荷增加,同时钠离子由于静电相互作用在肌丝附近富集,导致水相中形成不均匀的离子分布,产生渗透压,水分子由于渗透压作用进入MP内部,导致MP发生膨胀[30-31]。

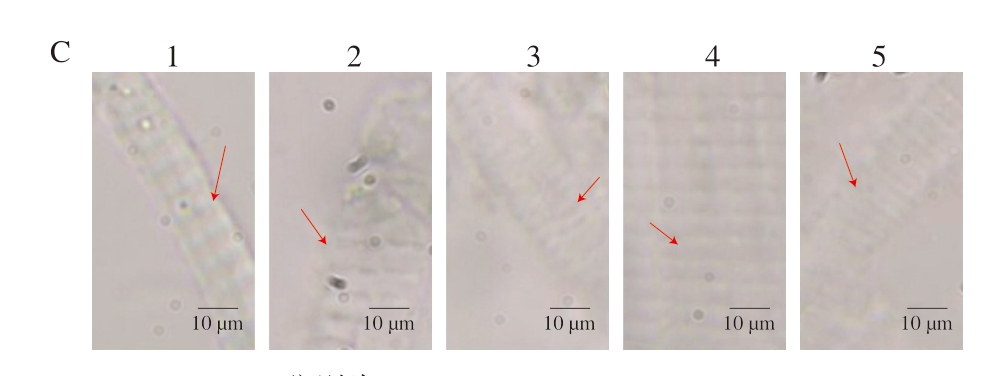
图10 不同pH值下NaCl浓度对MP形态结构变化的影响
Fig. 10 Effect of NaCl concentration on the morphological and structural changes of MP at different pH values
A~C.分别为pH 5.0、6.0、8.0;1~5. NaCl浓度分别为0.1、0.2、0.4、0.6、1.0 mol/L。
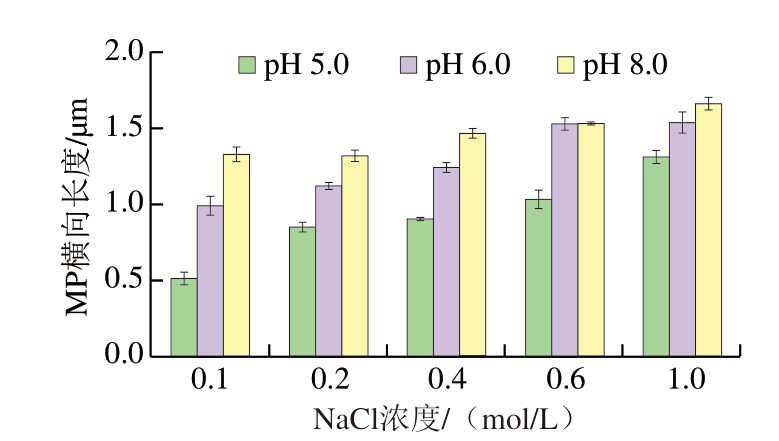
图11 不同pH值下NaCl浓度对MP横向长度的影响
Fig. 11 Effect of NaCl concentration on the transverse length of MP at different pH values
3 结论
本研究考察不同pH值下蛋白氧化和NaCl浓度对牦牛肉MP结构的影响,结果表明,在同一pH值下,随着H2O2浓度的增加,MP总巯基含量和溶解度下降、表面疏水性增加、横向膨胀程度降低,由SDS-PAGE图谱结果可知,MP氧化存在二硫键等共价键交联。在同一H2O2浓度下,随着pH值的增加,MP总巯基含量和溶解度增加、表面疏水性降低、二硫键等共价键交联程度加剧。随着NaCl浓度和pH值的增加,MP溶解度增加,表面疏水性降低,肌球蛋白条带颜色先加深后变浅,MP横向膨胀程度加剧。在同一pH值下,MP氧化导致蛋白分子间发生共价交联,MP横向膨胀程度降低,溶解度降低,而NaCl浓度的增加可导致MP横向膨胀程度加剧,溶解度增加。另外,pH值越偏离MP等电点,其横向膨胀程度和溶解度越大、表面疏水性越小。高浓度盐溶液结合高pH值可导致肌节断裂、横桥被破坏,进一步影响MP溶解度、表面疏水性和膨胀程度等结构特性。综上,不同pH值下,氧化和NaCl均对牦牛肉MP产生不利影响,当pH 6.0、NaCl浓度0.4 mol/L时,氧化对MP结构的负面影响程度最小。
[1] WANG Y, TIAN X J, LIU X Z, et al. Focusing on intramuscular connective tissue: effect of cooking time and temperature on physical,textual, and structural properties of yak meat[J]. Meat Science, 2021,184: 108690. DOI:10.1016/j.meatsci.2021.108690.
[2] BERTRAM H C, DONSTRUP S, KARLSSON H, et al. Continuous distribution analysis of T2 relaxation in meat-an approach in the determination of water-holding capacity[J]. Meat Science, 2002, 60(3):279-285. DOI:10.1016/S0309-1740(01)00134-6.
[3] BERTRAM H C, WHITTAKER A K, ANDERSEN H J,et al. Visualization of drip channels in meat using NMR microimaging[J]. Meat Science, 2004, 68(4): 667-670. DOI:10.1016/j.meatsci.2004.05.005.
[4] 叶凤凌, 周敏之, 池玉闽, 等. 蛋白氧化对肉品品质影响及其控制方法研究进展[J]. 食品工业科技, 2020, 41(15): 315-322.DOI:10.13386/j.issn1002-0306.2020.15.049.
[5] 刘泽龙. 蛋白质氧化对肉及肉制品持水与水合特性的影响机理研究[D]. 无锡: 江南大学, 2012: 96.
[6] 杨波若, 李华健, 苏娅宁, 等. 基于微观结构和蛋白质组学分析影响猪肉持水性的差异蛋白[J]. 食品工业科技, 2021, 42(7): 136-144.DOI:10.13386/j.issn1002-0306.2020070148.
[7] 王晶, 罗欣, 朱立贤, 等. 不同极限pH值牛肉品质差异及机制的研究进展[J]. 食品科学, 2019, 40(23): 283-288. DOI:10.7506/spkx1002-6630-20181109-109.
[8] LIU Y Y, ZHANG L T, GAO S, et al. Effect of protein oxidation in meat and exudates on the water holding capacity in bighead carp(Hypophthalmichthys nobilis) subjected to frozen storage[J]. Food Chemistry, 2021, 370: 131079. DOI:10.1016/j.foodchem.2021.131079.
[9] CHIARA R, MONIKA G, JOCHEN W. A research note: effect of pH on meat iridescence in precooked cured pork[J]. BMC Research Notes,2022, 15(1): 77. DOI:10.1186/S13104-022-05956-X.
[10] 李璇, 孙栋, 胡婷, 等. 高盐氧化体系对牦牛肉肌纤维蛋白的理化特性及结构的影响[J]. 食品科学, 2024, 45(15): 49-58. DOI:10.7506/spkx1002-6630-20231106-032.
[11] 赵亚南, 张牧焓, 王道营, 等. 氯化钠对鸡肉冷藏过程中肌原纤维蛋白氧化的影响[J]. 肉类研究, 2020, 34(8): 1-7. DOI:10.7506/rlyj1001-8123-20200518-126.
[12] 胡婷, 屈莎, 唐善虎, 等. 低盐环境下蛋白质氧化对牦牛肌肉结构及持水性的影响[J]. 食品科学, 2023, 44(10): 38-45. DOI:10.7506/spkx1002-6630-20220919-171.
[13] PARK D, XIONG Y L. Oxidative modification of amino acids in porcine myofibrillar protein isolates exposed to three oxidizing systems[J]. Food Chemistry, 2006, 103(2): 607-616. DOI:10.1016/j.foodchem.2006.09.004.
[14] YULIANA M, TRUONG C T, HUYNH L H, et al. Isolation and characterization of protein isolated from defatted cashew nut shell:influence of pH and NaCl on solubility and functional properties[J].LWT-Food Science and Technology, 2014, 55(2): 621-626.DOI:10.1016/j.lwt.2013.10.022.
[15] 彭泽宇. 微波联合解冻方式的筛选及其改善猪肉保水性的机制研究[D]. 新乡: 河南科技学院, 2021: 92. DOI:10.27704/d.cnki.ghnkj.2021.000101.
[16] LIU Z L, XIONG Y L, CHEN J. Identification of restricting factors that inhibit swelling of oxidized myofibrils during brine irrigation[J].Journal of Agricultural and Food Chemistry, 2009, 57(22): 10999-11007. DOI:10.1021/jf902722j.
[17] 高瑞昌. 鳙鱼中多聚磷酸盐水解机理及无磷保水剂的研究[D].青岛: 中国海洋大学, 2007: 115. DOI:10.7666/d.y1112232.
[18] KANG Z L, ZHANG X H, LI X, et al. The effects of sodium chloride on proteins aggregation, conformation and gel properties of pork myofibrillar protein running head: relationship aggregation,conformation and gel properties[J]. Journal of Food Science and Technology, 2021, 58(6): 2258-2264. DOI:10.1007/s13197-020-04736-4.
[19] 屈莎, 胡婷, 唐善虎, 等. 牦牛肉肌原纤维蛋白在不同pH值条件下的分子结构变化[J]. 现代食品科技, 2023, 39(8): 85-93. DOI:10.13982/j.mfst.1673-9078.2023.8.0904.
[20] VERONIQUE S L, LAURENT A, PHILIPPE G. Effect of oxidation on in vitro digestibility of skeletal muscle myofibrillar proteins[J].Journal of Agricultural and Food Chemistry, 2007, 55(13): 5343-5348.DOI:10.1021/jf070252k.
[21] 张兴, 杨玉玲, 马云, 等. pH对肌原纤维蛋白及其热诱导凝胶非共价键作用力与结构的影响[J]. 中国农业科学, 2017, 50(3): 564-573.DOI:10.3864/j.issn.0578-1752.2017.03.015.
[22] 李素, 王守伟, 朱宁, 等. 加工工艺对酱牛肉蛋白质结构和水分分布的影响[J]. 食品科学, 2022, 43(7): 74-80. DOI:10.7506/spkx1002-6630-20210322-263.
[23] ZHANG R Y, XING L J, KANG D C, et al. Effects of ultrasoundassisted vacuum tumbling on the oxidation and physicochemical properties of pork myofibrillar proteins[J]. Ultrasonics Sonochemistry,2021, 74(1): 105582. DOI:10.1016/j.ultsonch.2021.105582.
[24] KONG D, HAN R, YUAN M, et al. Ultrasound combined with slightly acidic electrolyzed water thawing of mutton: effects on physicochemical properties, oxidation and structure of myofibrillar protein[J]. Ultrasonics Sonochemistry, 2023, 93(2): 106309.DOI:10.1016/j.ultsonch.2023.106309.
[25] 孙皓, 徐幸莲, 王鹏. 鸡肉类PSE肉与正常肉功能特性比较研究[J].食品科学, 2013, 34(21): 60-63. DOI:10.7506/spkx1002-6630-201321013.
[26] 常海军, 周文斌, 谢娜娜, 等. 阿魏酸调控肉肌原纤维蛋白氧化及对乳化特性的影响[J]. 食品与发酵工业, 2023, 49(8): 194-200.DOI:10.13995/j.cnki.11-1802/ts.030959.
[27] 吴菊清, 邵俊花, 魏朝贵, 等. 离子强度对猪肉肌原纤维蛋白乳化特性和理化特性的影响[J]. 食品科学, 2014, 35(23): 14-19.DOI:10.7506/spkx1002-6630-201423003.
[28] ZHANG Y M, PUOLANNE E, ERTBJERG P. Mimicking myofibrillar protein denaturation in frozen-thawed meat: effect of pH at high ionic strength[J]. Food Chemistry, 2021, 15(2): 128017. DOI:10.1016/j.foodchem.2020.128017.
[29] 李亚楠. 鸭肉中肌原纤维蛋白的提取及凝胶特性的研究[D]. 天津:天津商业大学, 2012: 23. DOI:10.7666/d.Y2239259.
[30] YANG N, LIANG X L, CAO J X, et al. Denaturation manner of sarcoplasmic proteins in pale, soft and exudative meat determines their positive impacts on myofibrillar water-holding capacity[J]. Meat Science, 2021, 185: 108723. DOI:10.1016/j.meatsci.2021.108723.
[31] 余青青, 刘娇, 洪惠, 等. 生鲜肉持水性机理研究进展[J]. 食品科学,2023, 44(5): 241-247. DOI:10.7506/spkx1002-6630-20220413-157.