生鲜猪肉是指未经或只经少许加工、在常温下保质期较短的猪肉食品,约占我国肉类消费市场的70%。其在生产到销售的各个环节中均易受微生物污染,因此质量与安全问题愈发受到关注[1-2]。
微生物多样性是指特定群落中微生物种类组成及其相对丰度的变异程度,主要反映群落的丰度和均匀度[3]。通过开展微生物多样性研究,可系统解析微生物群体的结构特征和动态变化规律,从而有效防止食品变质,保障食品安全与品质。例如,肉品微生物群落结构研究有助于了解微生物对肉品贮藏品质的影响,为病原微生物检测提供理论指导[4]。当前,国内外关于生鲜猪肉微生物多样性研究多集中在微生物多样性影响因素、病原微生物和腐败微生物检测与控制、微生物多样性与肉品品质关系等方面。本文重点综述近年来国内外不同零售渠道下生鲜猪肉微生物多样性与生鲜猪肉保鲜技术研究进展,以期为生鲜猪肉微生物多样性研究提供新思路与新方向。
1 生鲜猪肉微生物多样性分析方法研究进展
生鲜猪肉微生物组成及其在不同贮藏条件下腐败菌群的演替规律一直是研究重点之一。为深入探究微生物群落结构及其动态变化,学者们采用多种分析方法展开研究,包括平板培养法、高通量测序(high-throughput sequencing,HTS)技术、聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)、实时荧光定量PCR(real-time fluorescence quantitative PCR,real-time PCR)及宏基因组学等。表1总结了常见的生鲜猪肉微生物多样性分析方法,这些技术为解析生鲜猪肉中微生物多样性及其对猪肉贮藏品质的影响提供了重要支持。
表1 常见的生鲜猪肉微生物多样性分析方法
Table 1 Common methods for microbial diversity analysis of fresh pork
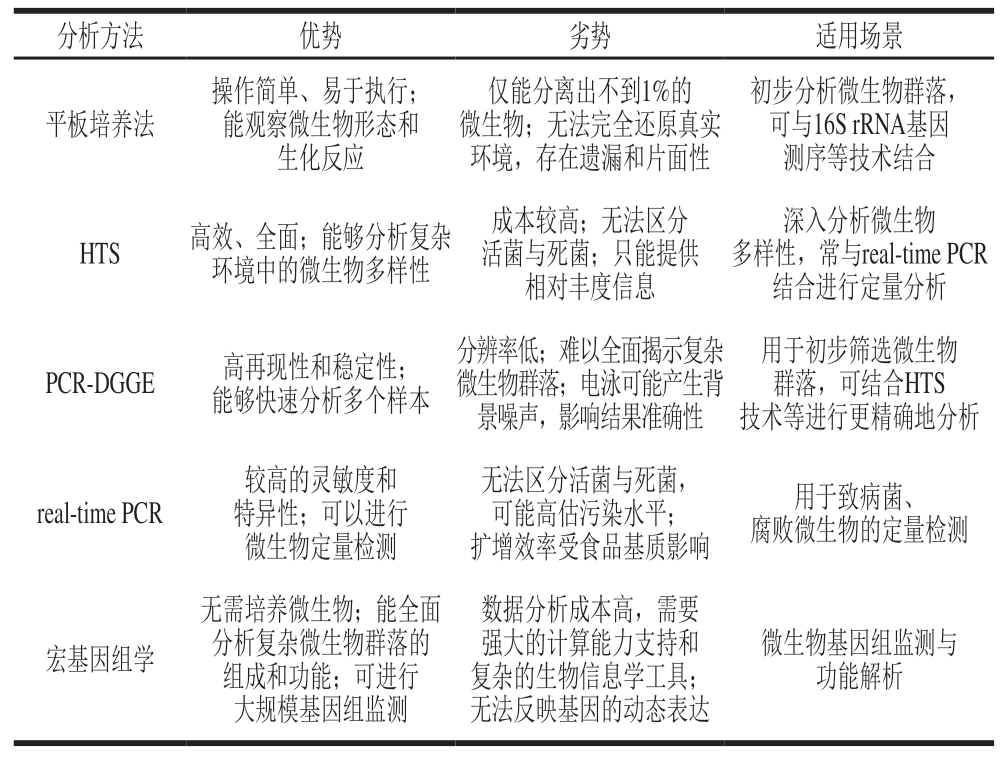
分析方法优势劣势适用场景平板培养法操作简单、易于执行;能观察微生物形态和生化反应仅能分离出不到1%的微生物;无法完全还原真实环境,存在遗漏和片面性初步分析微生物群落,可与16S rRNA基因测序等技术结合HTS高效、全面;能够分析复杂环境中的微生物多样性成本较高;无法区分活菌与死菌;只能提供相对丰度信息深入分析微生物多样性,常与real-time PCR结合进行定量分析PCR-DGGE高再现性和稳定性;能够快速分析多个样本分辨率低;难以全面揭示复杂微生物群落;电泳可能产生背景噪声,影响结果准确性用于初步筛选微生物群落,可结合HTS技术等进行更精确地分析real-time PCR较高的灵敏度和特异性;可以进行微生物定量检测无法区分活菌与死菌,可能高估污染水平;扩增效率受食品基质影响用于致病菌、腐败微生物的定量检测宏基因组学无需培养微生物;能全面分析复杂微生物群落的组成和功能;可进行大规模基因组监测数据分析成本高,需要强大的计算能力支持和复杂的生物信息学工具;无法反映基因的动态表达微生物基因组监测与功能解析
1.1 平板培养法
平板培养法通过分离、纯化和培养样本中的微生物获得目标菌株,通过分析菌落形态、结构和生化反应确定微生物类别[5]。分离时常采用稀释涂布、混合平板、划线分离、单孢分离及挑取菌丝先端等方法。培养不同菌株应选择合适的培养基,如培养肠杆菌科菌株采用结晶紫中性红胆盐葡萄糖琼脂、检测沙门氏菌属采用Rambach琼脂、分离与鉴别单核细胞增生李斯特菌采用Ottaviani & Agosti李斯特菌琼脂[6]。
平板培养法无法完全还原微生物生长的真实环境,分离的微生物不足环境微生物总数的1%,人为操作还可能导致菌种遗漏与腐败菌群增殖等问题,结果具有片面性与不确定性[6]。因此,常将传统培养法与其他技术相结合以更好地探究微生物多样性。Peruzy等[7]将平板培养法与16S rRNA基因测序技术结合,从生鲜猪肉中鉴定出的主要微生物包括假单胞菌属、索丝菌属和肉杆菌属等。
1.2 HTS技术
近年来,HTS技术被广泛应用于食品微生物分析。HTS通过DNA提取、PCR扩增、读数质控及拼接将微生物序列信息聚类为操作分类单元(operational taxonomic units,OTUs),并与数据库比对以确定样本中的微生物分类组成[8]。Illumina公司的Solexa测序平台广泛用于肉制品微生物研究,其中HiSeq(HTS)适合大规模研究,MiSeq(微型测序)常用于中小规模研究[9]。
HTS具有高效、全面、灵敏的特点,已广泛应用于生鲜肉类微生物多样性研究。Kim等[10]通过HTS技术发现生鲜猪肉零售阶段的主要腐败菌群包括考克氏菌属、巨大球菌属和不动杆菌属等,王新惠等[11]研究表明,冷鲜猪肉优势菌包括环丝菌属、发光杆菌属、不动杆菌属、假单胞菌属和泛菌属。然而,该技术测序成本较高,仅提供微生物的相对丰度,无法准确测定特定微生物的绝对数量,且HTS技术无法区分活菌和死菌[12],通常将其与real-time PCR等技术结合使用,以提供更精准的定量信息。
1.3 PCR-DGGE技术
PCR-DGGE是一种基于PCR扩增的分子生物学方法,采用含有梯度化学变性剂的聚丙烯酰胺凝胶电泳对获得的DNA片段进行分离和鉴定。通过分析电泳图谱及迁移距离能够快速识别样品中的微生物种类及其相对丰度。将电泳条带与GenBank数据库的参考序列比对,能够进一步确定微生物的系统发育关系[13]。
PCR-DGGE技术以其高再现性和稳定性,能够同时快速分析多个样本,该技术已被广泛应用于生鲜猪肉微生物多样性研究中。李苗云[14]与Jiang Yun[15]等的研究表明,假单胞菌、热杀索丝菌、气单胞菌、莫拉氏菌、乳酸菌和葡萄球菌是低温贮藏猪肉的主要优势菌群。翁丽华等[16]研究表明,热鲜肉贮藏末期的主要腐败菌包括巨大球菌属、克雷伯氏菌属、假单胞菌属等。然而,PCRDGGE分辨率较低,每个样本通常仅能分离出几十个优势菌群谱带,难以全面揭示复杂的微生物群落。其次,电泳过程可能产生背景噪声,影响分析结果的准确性,且条带强度在定量分析上存在一定局限性。因此,PCR-DGGE常用于初步筛选微生物群落,并与其他技术如HTS相结合,以获得更为全面和精确的微生物群落信息[17]。
1.4 real-time PCR
real-time PCR技术可对食源性致病菌和腐败微生物进行精确的定量分析。余姓鸿等[18]采用real-time PCR同时检测戊型肝炎病毒、猪流行性腹泻病毒和猪δ冠状病毒,具有良好的特异性和重复性。此外,Fan Wei等[19]将免疫磁性分离和real-time PCR技术相结合,对猪肉中的沙门氏菌属、单核细胞增生李斯特菌和大肠杆菌进行定量检测,方法的灵敏度、特异性和准确性分别为100%、98.1%和98.5%,检测时间显著缩短。然而,该技术无法区分活菌和死菌,可能高估微生物污染水平,可利用逆转录real-time PCR技术实现活菌的特异性检测[20]。同时,为满足国家和国际食品法规要求的微生物安全标准,real-time PCR检测前常需要数小时的富集处理,这将导致初始污染量无法量化[21],其扩增效率还可能受食品基质成分的影响,进而影响检测结果的准确性。
1.5 宏基因组学
宏基因组学由Handelsman提出,旨在研究某一环境中细菌、真菌、古菌和病毒等全部微生物的基因组成以及微生物群落的组成、功能及其相互作用。宏基因组学分析的主要流程包括DNA提取、DNA片段化、PCR扩增、测序、序列拼接与分析,可实现微生物的分类学鉴定、系统发育分析、功能基因注释及代谢途径的全面解析[22]。
宏基因组学无需对微生物进行培养,能够直接分析复杂环境中的微生物群落,已应用于猪肉生产链的基因组监测。Zhang Yu[23]、Lee[24]等的宏基因组学分析结果显示,生鲜猪肉中的优势菌属包括布罗克氏菌属、不动杆菌属、冷菌属、假单胞菌属等。然而,宏基因组学数据分析成本较高,且需要强大的计算能力和复杂的生物信息学方法。此外,宏基因组学无法反映特定条件下基因的动态表达与调控情况。随着第3代测序技术的发展,宏基因组测序的准确性和效率将得到进一步提升,这有望克服当前数据处理量大、成本高的限制[25]。
2 不同零售渠道下生鲜猪肉微生物多样性研究进展
生鲜猪肉保质期短,在生产、运输和销售过程中易受多种因素影响,导致微生物污染与腐败变质。关于生鲜猪肉的微生物多样性研究主要集中在腐败微生物和食源性病原菌污染上。Wang Wen等[26]发现,生鲜猪肉中常见的腐败微生物包括不动杆菌属、布罗氏菌属、假单胞菌属、发光杆菌属、嗜冷杆菌属、气单胞菌属和魏斯氏菌属等。此外,Liu Chenxing等[27]研究表明,生鲜猪肉中的食源性病原菌,如沙门氏菌、金黄色葡萄球菌、耐甲氧西林金黄色葡萄球菌和单核细胞增生李斯特菌等,可能对人类健康带来潜在危害。销售是生鲜猪肉供应链最为关键的环节之一,直接影响其微生物多样性[26]。因此,基于不同应用场景分析生鲜猪肉的微生物多样性及其影响因素,对于提升猪肉品质具有重要意义,表2对不同零售渠道生鲜猪肉微生物多样性进行了对比分析。
表2 不同零售渠道生鲜猪肉微生物多样性分析[4,11,26-36]
Table 2 Microbial diversity analysis of fresh pork from different retail channels[4,11,26-36]

项目传统零售市场现代零售市场电子商务平台主要微生物群落以嗜热菌与好氧菌为主,如假单胞菌属、不动杆菌属、醋杆菌属、泛菌属等以嗜冷菌和厌氧菌为主,如假单胞菌、短芽孢杆菌属、布罗克斯菌等以耐低温微生物为主,如乳酸杆菌属、热杀索丝菌和干酪乳杆菌等沙门氏菌71.950.913.32病原菌污染率/%单核细胞增生李斯特菌18.513.444.44金黄色葡萄球菌25.922.214.81耐药性对卡那霉素、四环素、对氨苄西林和环丙沙星耐药对替加环素、甲氧苄啶和莫西沙星耐药微生物多样性主要影响因素常温和高湿度环境;卫生条件较差;缺乏有效冷链措施;微生物相互作用低氧和低温环境;多样的包装方式;微生物相互作用供应商规模差异大;运输中的终点温度、时间和距离;供应链复杂程度;监管难度大
2.1 传统零售市场中的生鲜猪肉微生物多样性
传统零售市场涵盖大型市场及居民区的湿货市场,这些销售网点通常缺乏统一的管理和规范的设施,生鲜猪肉的微生物多样性复杂多样。此场景下的生鲜猪肉中存在多种微生物,包括各类致病菌和腐败菌,多为嗜热菌与好氧菌,显示出较高的微生物丰富度和多样性。Wang Wen等[26]研究发现,生鲜猪肉中常见致病菌包括沙门氏菌、大肠杆菌和变形杆菌等,优势菌为热适性强的不动杆菌。Ngan等[28]研究发现,生鲜猪肉中的致病菌包括弯曲杆菌属、金黄色葡萄球菌与克雷伯氏肺炎菌,主要优势菌群包括葡萄球菌、莫拉菌与假单胞菌等。王新惠等[11]将生鲜猪肉进行非密封包装并于4 ℃贮藏,假单胞菌属和泛菌属是贮藏初期与后期的优势菌属,不动杆菌属是贮藏中期的优势菌属,假单胞菌属相对丰度在前期和后期均维持在25%左右。
此外,通过与现代销售渠道的对比发现,传统零售市场中的病原菌污染率较高。具体地,Ngo等[29]发现零售猪肉中沙门氏菌污染率达71.9%,菌落总数为6.67(lg(CFU/g)),Chen Moutong等[30]发现生鲜猪肉中单核细胞增生李斯特菌检出率为18.5%,宋方宇[31]研究表明,生鲜猪肉中金黄色葡萄球菌检出率为25.9%,并且随季节显著波动,冬春季节(1—3月)检出率最高,进一步增加了食品安全风险。此外,生鲜猪肉中金黄色葡萄球菌表现出较强的多重耐药性,对卡那霉素、四环素和环丙沙星耐药性较高。Chen Moutong等[30]发现生鲜猪肉中单核细胞增生李斯特菌对氨苄西林、四环素和环丙沙星耐药性也较高。
总体来看,传统零售场景中猪肉微生物丰度和多样性的主要影响因素包括温度、湿度、卫生情况及微生物间的相互作用等。在常温和高湿度环境中,嗜热菌和好氧菌得以快速繁殖,这些环境条件可提高微生物多样性[26]。传统市场设施管理不善、卫生条件较差,运输和贮藏过程中缺乏有效的冷链措施,病原菌如大肠杆菌和沙门氏菌等的丰度显著增加[29]。此外,微生物群落之间的相互作用也会影响其生长,如假单胞菌属与肠杆菌属可能存在互生关系,不动杆菌属与泛菌属之间可能存在竞争关系[11]。
2.2 现代零售市场中的生鲜猪肉微生物多样性
现代零售市场通过超市、便利店和精品店等渠道销售生鲜猪肉,能够提供更环保、可追溯且高品质的产品。在现代零售场景下,猪肉微生物群落主要以嗜冷菌和厌氧菌为主。例如,Wang Wen等[26]发现布罗氏菌属和假单胞菌属的相对丰度较高。这些菌群能够在低温条件下保持生长活性,成为在冷链贮运中占主导地位的菌种。病原菌污染方面,张园园等[4]研究表明,单核细胞增生李斯特菌因其耐低温、耐酸和耐高盐的特性,在现代零售市场生鲜猪肉中较为常见,污染率达13.44%。Wang Yiqian[37]、Chen Moutong[30]等研究表明,生鲜猪肉中单核细胞增生李斯特菌优势序列分型(sequence type,ST)包括ST155、ST121和ST9等。沙门氏菌,特别是肠炎沙门氏菌和鼠伤寒沙门氏菌在现代零售场所中也存在较高的检出率,Ngo等[29]的研究中沙门氏菌污染率达50.9%。宋方宇[31]发现,尽管现代零售市场具有较严格的卫生管理,金黄色葡萄球菌检出率仍高达22.2%,尤其冬春季节(1—3月)更是高达34.8%,Velasco等[34]进一步对现代零售渠道进行细分,结果表明,超市金黄色葡萄球菌污染率明显低于零售商店,因为其温度和湿度控制方面更为严格。病原菌耐药性方面,Lowe等[32]发现从现代零售渠道生鲜猪肉中分离的大肠杆菌和粪肠杆菌菌株表现出对替加环素、甲氧苄啶和莫西沙星的多重耐药性。
影响现代零售市场猪肉微生物多样性的主要因素包括冷链贮运过程中的温度与湿度控制、包装方式及微生物间的相互作用等。尽管冷链贮运能够抑制部分病原菌生长,但耐低温菌属(如假单胞菌和单核细胞增生李斯特菌)以及环境适应力较强的菌属(如沙门氏菌属)仍具有较强的生存能力。在超市和零售商店,非包装肉类常直接暴露于外部环境中,更易受到微生物污染[34]。微生物之间的相互作用也会对微生物多样性造成影响,在低氧和低温环境中,假单胞菌和热杀索丝菌会通过竞争性排他机制与其他微生物争夺营养和氧气,成为冷藏肉品中的优势菌种[33]。
2.3 电子商务平台中的生鲜猪肉微生物多样性
随着互联网技术的发展,电子商务平台(如京东和淘宝)成为生鲜猪肉销售的渠道之一。当前对于电商平台生鲜猪肉微生物多样性的研究较少,Liu Chenxing等[27]研究表明,电子商务平台渠道获得的生鲜猪肉中金黄色葡萄球菌检出率约为15%,其中,耐甲氧西林金黄色葡萄球菌占比达25%,且对多种抗生素耐药。冷链物流是电商销售的核心之一,Wang Su等[36]研究发现,不同冷链物流模式下微生物多样性存在显著差异,低温(-1 ℃)零售模式下,微生物群落随时间变化较为平缓,乳酸菌始终占主导地位。较高温度(7 ℃)零售模式下,微生物群落随时间发生快速演替,假单胞菌属迅速取代其他菌种,加速腐败菌增殖,显著降低微生物多样性。
除温度、包装及卫生情况等常规因素外,在线平台生鲜猪肉微生物多样性还会受供应商规模、终点温度、运输时间和运输距离等的影响。小规模生产商的处理和运输标准可能不统一,导致微生物多样性存在差异。当生鲜猪肉运输时间超过20~36 h且温度高于10 ℃时,病原菌检出率显著上升,食品安全风险增加[27,38]。与线下渠道相比,电子商务平台更易受物流过程中温度控制不当的影响,导致病原菌繁殖加快。为保证生鲜猪肉的新鲜度和安全性,电子商务平台需要加强配送设备和冷链贮运设施的建设[39]。因此,通过构建冷链物流大数据系统,电商平台能够提高供应链效率,降低运输过程中微生物的增长风险,确保食品安全。电商平台的冷鲜肉相较于农贸市场和超市更为新鲜,不过生鲜肉品质稳定性低于线下平台,这可能是由于其供应链更为复杂且监管难度较大[35]。
2.4 不同零售销售渠道生鲜猪肉微生物多样性对比分析
传统零售市场、现代零售渠道和电子商务平台在生鲜猪肉的微生物多样性、微生物类型及污染风险上存在一定异同。传统零售市场一般为常温开放的销售环境,微生物多样性最高,病原菌如沙门氏菌和金黄色葡萄球菌的检出率也较高,主要以嗜热菌和好氧菌为主。现代零售市场通过严格的冷链贮藏和卫生管理,微生物污染较少,微生物类型以嗜冷菌和厌氧菌为主,如单核细胞增生李斯特菌和假单胞菌等。电子商务平台虽然能够提供更为新鲜的冷鲜肉,但由于其复杂的供应链和不稳定的温度控制可能会导致微生物检出率增加。总体来看,三大渠道的主要区别在于包装、贮藏与运输条件等的差异,这将导致生鲜猪肉微生物多样性差异。
3 生鲜猪肉保鲜技术研究进展
基于不同场景生鲜猪肉微生物多样性影响因素分析发现,微生物生长受温度、包装方式、pH值及菌群之间相互作用等因素的影响。近年来,随着人们对食品安全的日益重视,生鲜猪肉的保鲜技术研究取得了一定进展。研究[27,40]表明,保鲜技术能够有效延缓生鲜猪肉微生物多样性增加,采用保鲜技术的生鲜猪肉优势菌群多为兼性厌氧菌。同时,保鲜技术还能够有效降低优势菌群(如不动杆菌、链球菌和假单胞菌)的生长速率[41-42]。目前,生鲜猪肉保鲜技术研究主要聚焦在调整包装方式及包材、改变贮藏方式、添加天然保鲜剂及新型保鲜技术开发等方面(图1)。
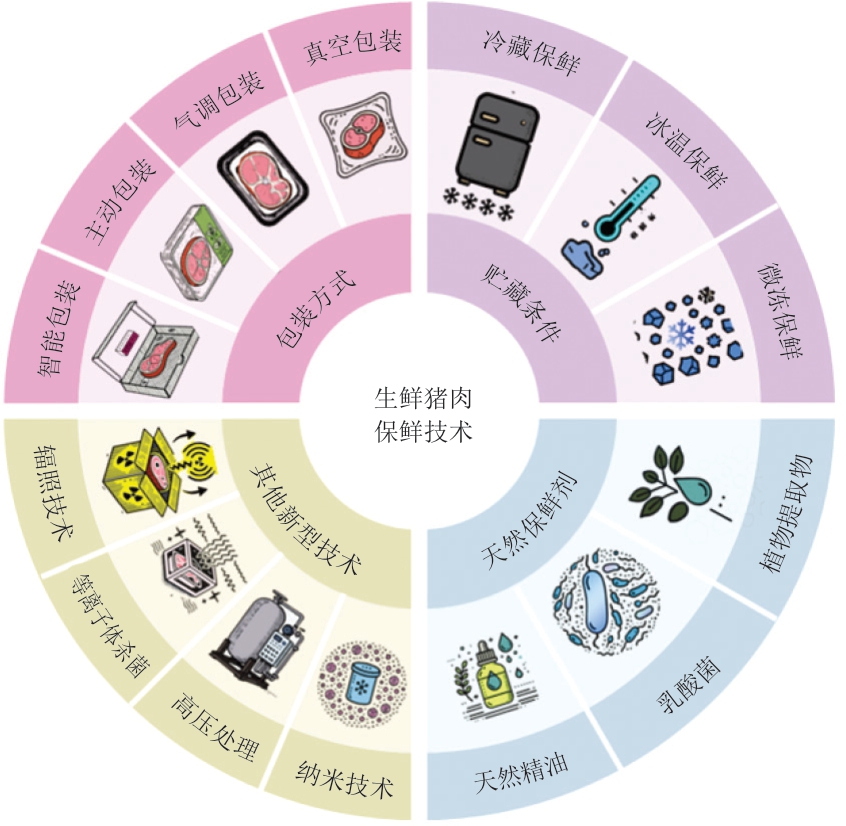
图1 生鲜猪肉保鲜技术概况
Fig. 1 Overview of fresh pork preservation technologies
3.1 调整包装方式及包材
在生鲜猪肉保鲜领域,包装方式和材料的选择对于延长产品保质期、控制微生物生长至关重要。其中,真空包装通过抽除包装内氧气并密封,显著延长食品保质期。Wen Xiangyuan等[43]研究表明,乳球菌属和广布乳杆菌属是真空包装羊肉的主要优势菌群,真空包装微生物多样性低于有氧包装。气调包装通过调整包装内气体成分组成与比例实现食品保鲜,常见气体成分包括氧气、二氧化碳和氮气。Liu Chenxing等[27]基于二氧化碳抗菌、抑制需氧微生物生长的特性,利用气调包装有效延长生鲜猪肉货架期,并指出相较于真空包装,气调包装可以减少包装贮藏损失,改善产品外观。
主动包装与智能包装也逐渐引起关注。主动包装通过在包装材料中加入抗菌剂、抗氧化剂等活性物质主动抑制微生物生长与繁殖。将多种天然活性物质与壳聚糖结合制备的复合膜不仅具有良好的保鲜效果,还表现出优异的机械性能和阻隔性能。例如,Souza等[44]制备的聚乙烯醇/亚硝酸盐薄膜、Ibeogu等[45]制备的姜黄素/明胶血清质膜及Zheng Tingting等[46]制备的胶原蛋白/没食子酸接枝壳聚糖/ε-聚赖氨酸活性包装膜,均对生鲜猪肉表现出良好的保鲜效果。智能包装通过集成传感器实时监控包装内部的温度、湿度、气体成分反馈食品的新鲜度和安全性,不仅能够延长猪肉的保质期,还能够减少由于不当贮藏或运输导致的损耗[47]。
3.2 优化贮藏条件
温度控制是生鲜猪肉保鲜的关键,传统冷藏(0~4 ℃)已经在食品工业中得到广泛应用,然而传统冷藏易形成冰晶,破坏肉类组织结构,解冻后易出现肉质变差与营养流失现象。这使得冰温保鲜逐渐受到关注,该方法将食品贮藏于0 ℃~冰温带,可有效抑制微生物增殖和酶活性及冰晶形成,避免肉类组织结构被破坏,郭依萍等[48]验证了该技术能够有效抑制微生物繁殖,延缓生鲜猪肉品质劣变,延长其货架期。此外,微冻技术也被证实可保持肉品新鲜度,其原理是将食品温度降至初始冰点以下1~2 ℃,此时食品表面会形成薄冰晶层,可有效阻止水分蒸发和氧气渗透,同时又不会对食品内部结构造成较大破坏,该技术有助于抑制腐败微生物生长,可将产品货架期延长至原来的1.5~4 倍[49]。
3.3 添加天然保鲜剂
天然保鲜剂已经逐渐替代化学保鲜剂,成为研究热点。花青素[50]、肉桂精油[51]、甜菜根提取物[52]等植物提取物因其抗菌、抗氧化活性在猪肉保鲜中表现突出。这类天然物质富含多酚类、黄酮类化合物,能够有效破坏微生物的细胞膜或干扰其DNA功能,具有良好的抗菌、抗氧化作用。乳酸菌通过发酵生成乳酸导致pH值降低,也有助于抑制腐败菌生长。Barcenilla等[42]研究表明,乳酸菌及其纯化或半纯化抗菌代谢物可作为生物防腐剂,具有抑制腐败菌和致病菌生长与繁殖及延长肉制品货架期的潜力。天然精油能够有效减少微生物负荷,延缓猪肉腐败,同时保持甚至提升其风味和质构特性,如百里香精油[53]、丁香精油[54]和牛至精油[55]等已被证实在生鲜猪肉保鲜中具有良好的抗菌能力。此外,天然果蔬汁富含酚类化合物和抗氧化剂,在延长猪肉保质期的同时能够改善肉类的感官品质和质构特性,Nour[56]证实酸樱桃汁和李子汁能延缓猪肉氧化,使之保持鲜艳的色泽。
3.4 新型保鲜技术
在肉类保鲜技术研究中,辐照杀菌、高压处理、低温等离子体冷杀菌技术及纳米技术等新型保鲜技术受到广泛关注。这些技术能够有效延长肉类货架期,改善微生物安全性,且对肉类的感官质量和营养成分影响较小。Hu Ziyi等[57]研究表明,辐照联合抗菌剂处理能够有效抑制金黄色葡萄球菌、沙门氏菌等常见致病菌,显著延长猪肉货架期。然而,辐照处理可能加剧脂肪氧化,对肉品风味具有负面影响。基于此,Wei Qi等[58]通过添加抗氧化剂降低辐照引起的氧化反应,有效改善肉品质量。低温等离子体冷杀菌技术是一种无需热处理的高效杀菌技术,其利用活性氧和活性氮等物质直接作用于微生物细胞膜,破坏其结构,Luo Ji等[59]利用该技术显著减少猪肉表面的微生物数量,且未显著加速脂质氧化。在低温环境下,高压(300~600 MPa)处理能够破坏微生物的细胞壁和细胞膜,导致其死亡,从而有效延长即食肉制品货架期[60]。高压处理能够有效保留肉制品中的水分和营养成分,特别是对蛋白质和脂肪含量无明显不良影响[61]。纳米技术在猪肉保鲜包装中展现出突出的抗菌效果,如银纳米颗粒因其广谱抗菌特性备受关注。例如,Du Yidi等[62]制备的银纳米颗粒/碳点纳米复合材料对大肠杆菌和金黄色葡萄球菌展现出良好的抗菌活性,可有效延长猪肉货架期。
基于植物提取物纳米抑菌材料、植物精油纳米抑菌材料、植物精油复合包装材料等的复合保鲜技术也取得长足进展。例如,含有纳米胶囊丁香乙醇提取物的壳聚糖明胶食用涂层能够延长猪肉保质期,并有助于保持冰鲜猪肉的感官品质[63],掺入壳聚糖纳米颗粒中的柑橘精油被证实可通过破坏金黄色葡萄球菌和大肠杆菌的细胞膜实现猪肉保鲜[64]。
4 结 语
目前,微生物多样性分析技术研究已取得一定进展,常见分析技术包括HTS、PCR-DGGE、real-time PCR和宏基因组学技术。各销售渠道中,传统零售市场的微生物污染率较高,嗜热菌与好氧菌处于优势地位;现代零售场景中,耐低温和厌氧菌在冷链贮运环境中仍广泛存在;电子商务平台由于物流环节的复杂性和监管难度高,微生物污染风险更具不确定性。为降低微生物污染风险,研究者们对现有保鲜技术(包装方式、贮藏条件、保鲜剂添加)进行改进,辐照技术、高压处理与纳米技术等新型技术也逐步推广。
综上所述,现有研究已经在生鲜猪肉微生物多样性方面取得了一定进展,未来可从以下几方面深入研究:1)生鲜猪肉微生物多样性分析方面,现有技术对微生物的致腐、致病机制研究不够深入,未来可从宏基因组学与多组学(比较基因组学、蛋白组学、脂质组学等)联合应用切入解决问题;2)目前的研究较少关注针对特定优势菌群的保鲜措施,未来应开发基于特定优势菌的靶向抑菌策略,以提升生鲜猪肉的保鲜效果;3)不同零售渠道中微生物多样性的对比分析相对不足,尤其是针对电商平台,该场景在未来生鲜猪肉市场中的应用将不断扩大,因此需进行更多针对性研究。
[1] 唐宇宏, 刘丽敏, 白莉, 等. 生鲜猪肉中单增李斯特菌动态生长预测与数值模拟[J]. 食品科学, 2022, 43(18): 90-97. DOI:10.7506/spkx1002-6630-20211017-169.
[2] VAN RECKEM E, DE VUYST L, WECKX S, et al. Next-generation sequencing to enhance the taxonomic resolution of the microbiological analysis of meat and meat-derived products[J]. Current Opinion in Food Science, 2021, 37: 58-65. DOI:10.1016/j.cofs.2020.09.004.
[3] LING H Z, SHI H L, CHEN X C, et al. Detection of the microbial diversity and flavour components of Northeastern Chinese soybean paste during storage[J]. Food Chemistry, 2022, 374: 131686.DOI:10.1016/j.foodchem.2021.131686.
[4] 张园园, 赵子驭, 张晏宁, 等. 后疫情时代下市售生鲜猪肉中单增李斯特菌的污染评估[J]. 微生物学通报, 2022, 49(8): 3220-3231.DOI:10.13344/j.microbiol.china.211181.
[5] PUROHIT S D, PRIYADARSHI R, BHASKAR R, et al. Chitosanbased multifunctional films reinforced with cerium oxide nanoparticles for food packaging applications[J]. Food Hydrocolloids, 2023, 143:108910. DOI:10.1016/j.foodhyd.2023.108910.
[6] 李宁. 冷鲜猪肉中微生物多样性和优势腐败菌分子检测技术研究[D].无锡: 江南大学, 2019: 1-9.
[7] PERUZY M F, MURRU N, YU Z, et al. Determination of the microbiological contamination in minced pork by culture dependent and 16S amplicon sequencing analysis[J]. International Journal of Food Microbiology, 2019, 290: 27-35. DOI:10.1016/j.ijfoodmicro.2018.09.025.
[8] IMANIAN B, DONAGHY J, JACKSON T, et al. The power, potential,benefits, and challenges of implementing high-throughput sequencing in food safety systems[J]. npj Science of Food, 2022, 6(1): 35.DOI:10.1038/s41538-022-00150-6.
[9] SALAMON D, ZAPAŁA B, KRAWCZYK A, et al. Comparison of iSeq and MiSeq as the two platforms for 16S rRNA sequencing in the study of the gut of rat microbiome[J]. Applied Microbiology and Biotechnology, 2022, 106(22): 7671-7681. DOI:10.1007/s00253-022-12251-z.
[10] KIM Y, BAN G H, HONG Y W, et al. Bacterial profile of pork from production to retail based on high-throughput sequencing[J].Food Research International, 2024, 176: 113745. DOI:10.1016/j.foodres.2023.113745.
[11] 王新惠, 孙劲松, 赵芮, 等. 冷鲜猪肉贮藏过程中细菌群落结构演替规律分析[J]. 中国食品学报, 2021, 21(9): 233-240. DOI:10.16429/j.1009-7848.2021.09.025.
[12] CHEN J H, ZHONG J W, LEI H, et al. Label-free multidimensional bacterial characterization with an ultrawide detectable concentration range by microfluidic impedance cytometry[J]. Lab on a Chip, 2023,23(23): 5029-5038. DOI:10.1039/d3lc00799e.
[13] ELSHARKAWY M M, KUNO S, HYAKUMACHI M, et al. PCRDGGE analysis proves the suppression of Rhizoctonia and Sclerotium root rot due to successive inoculations[J]. Journal of Fungi, 2022, 8(2):133. DOI:10.3390/jof8020133.
[14] 李苗云. 冷却猪肉中微生物生态分析及货架期预测模型的研究[D].南京: 南京农业大学, 2006: 39-55.
[15] JIANG Y, GAO F, XU X L, et al. Changes in the bacterial communities of vacuum-packaged pork during chilled storage analyzed by PCRDGGE[J]. Meat Science, 2010, 86(4): 889-895. DOI:10.1016/j.meatsci.2010.05.021.
[16] 翁丽华, 江芸, 徐幸莲, 等. PCR-DGGE研究热鲜肉贮藏过程中的菌相变化[J]. 食品科学, 2012, 33(23): 199-203.
[17] ZHANG S, ZHANG Y C, WU L H, et al. Characterization of microbiota of naturally fermented sauerkraut by high-throughput sequencing[J]. Food Science and Biotechnology, 2023, 32(6): 855-862.DOI:10.1007/s10068-022-01221-w.
[18] 余姓鸿, 张婧, 安微, 等. 猪肉及制品中HEV、PEDV和PDCoV三重qPCR方法的建立与应用[J]. 食品工业科技, 2024, 45(2): 210-219.DOI:10.13386/j.issn1002-0306.2023020164.
[19] FAN W, GAO X Y, LI H N, et al. Rapid and simultaneous detection of Salmonella spp., Escherichia coli O157:H7, and Listeria monocytogenes in meat using multiplex immunomagnetic separation and multiplex real-time PCR[J]. European Food Research and Technology,2022, 248(3): 869-879. DOI:10.1007/s00217-021-03933-5.
[20] AZINHEIRO S, GHIMIRE D, CARVALHO J, et al. Next-day detection of viable Listeria monocytogenes by multiplex reverse transcriptase real-time PCR[J]. Food Control, 2022, 133: 108593.DOI:10.1016/j.foodcont.2021.108593.
[21] POSTOLLEC F, FALENTIN H, PAVAN S, et al. Recent advances in quantitative PCR (qPCR) applications in food microbiology[J]. Food Microbiology, 2011, 28(5): 848-861. DOI:10.1016/j.fm.2011.02.008.
[22] WANG J, WANG X S, YANG W, et al. Comprehensive insights into the mechanism of flavor formation driven via inoculation with mixed starter cultures in dry-fermented tilapia sausages: integration of macrogenomics, volatilomics, and lipidomics[J]. Food Chemistry,2024, 455: 139950. DOI:10.1016/j.foodchem.2024.139950.
[23] ZHANG Y, SONG J X, ZHOU J F, et al. Analysis of microbial diversity and resistant genes among three types of pork via metagenomic and HPC-NGS[J]. Food and Agricultural Immunology,2024, 35(1): 2376600. DOI:10.1080/09540105.2024.2376600.
[24] LEE A W T, NG I C F, WONG E Y K, et al. Comprehensive identification of pathogenic microbes and antimicrobial resistance genes in food products using nanopore sequencing-based metagenomics[J]. Food Microbiology, 2024, 121: 104493.DOI:10.1016/j.fm.2024.104493.
[25] AKACIN I, ERSOY Ş, DOLUCA O, et al. Comparing the significance of the utilization of next generation and third generation sequencing technologies in microbial metagenomics[J]. Microbiological Research,2022, 264: 127154. DOI:10.1016/j.micres.2022.127154.
[26] WANG W, YI Z K, CAI W, et al. Differences in bacterial communities of retail raw pork in different market types in Hangzhou, China[J].Foods, 2023, 12(18): 3357. DOI:10.3390/foods12183357.
[27] LIU C X, XIAO Y P, HU D W, et al. The safety evaluation of chilled pork from online platform in China[J]. Food Control, 2019, 96: 244-250. DOI:10.1016/j.foodcont.2018.09.025.
[28] NGAN W Y, RAO S, CHAN L C, et al. Impacts of wet market modernization levels and hygiene practices on the microbiome and microbial safety of wooden cutting boards in Hong Kong[J].Microorganisms, 2020, 8(12): 1941. DOI:10.3390/microorganisms8121941.
[29] NGO H H T, NGUYEN-THANH L, PHAM-DUC P, et al.Microbial contamination and associated risk factors in retailed pork from key value chains in Northern Vietnam[J]. International Journal of Food Microbiology, 2021, 346: 109163. DOI:10.1016/j.ijfoodmicro.2021.109163.
[30] CHEN M T, CHENG J H, ZHANG J M, et al. Isolation, potential virulence, and population diversity of Listeria monocytogenes from meat and meat products in China[J]. Frontiers in Microbiology, 2019,10: 946. DOI:10.3389/fmicb.2019.00946.
[31] 宋方宇. 生鲜肉中金黄色葡萄球菌的分离鉴定及其耐药性研究[D].泰安: 山东农业大学, 2018: 31-40. DOI:10.7666/d.D01436655.
[32] LOWE M, STRASHEIM W, CHAN W Y, et al. Bacterial and genetic features of raw retail pork meat: integrative analysis of antibiotic susceptibility, whole-genome sequencing, and metagenomics[J].Antibiotics, 2024, 13(8): 700. DOI:10.3390/antibiotics13080700.
[33] 黄林, 陈全胜, 张燕华, 等. 冷却猪肉优势腐败菌分离鉴定及致腐能力测定[J]. 食品科学, 2013, 34(1): 205-209.
[34] VELASCO V, VERGARA J L, BONILLA A M, et al. Prevalence and characterization of Staphylococcus aureus strains in the pork chain supply in chile[J]. Foodborne Pathogens and Disease, 2018, 15(5):262-268. DOI:10.1089/fpd.2017.2381.
[35] HU D W, LIU C X, ZHAO H B, et al. Systematic study of the quality and safety of chilled pork from wet markets, supermarkets, and online markets in China[J]. Journal of Zhejiang University-SCIENCE B,2019, 20(1): 95-104. DOI:10.1631/jzus.B1800273.
[36] WANG S, ZHANG D Q, YANG Q F, et al. Effects of different cold chain logistics modes on the quality and bacterial community succession of fresh pork[J]. Meat Science, 2024, 213: 109502.DOI:10.1016/j.meatsci.2024.109502.
[37] WANG Y Q, JI Q, LI S W, et al. Prevalence and genetic diversity of Listeria monocytogenes isolated from retail pork in Wuhan,China[J]. Frontiers in Microbiology, 2021, 12: 620482. DOI:10.3389/fmicb.2021.620482.
[38] KIM C, STEIN R A, PAO S. Comparison of the microbial quality of lamb and goat meat acquired from internet and local retail markets[J]. Journal of Food Protection, 2015, 78(11): 1980-1987.DOI:10.4315/0362-028x.Jfp-15-026.
[39] REN Q S, FANG K, YANG X T, et al. Ensuring the quality of meat in cold chain logistics: a comprehensive review[J]. Trends in Food Science & Technology, 2022, 119: 133-151. DOI:10.1016/j.tifs.2021.12.006.
[40] BASSEY A P, CHEN Y, ZHU Z, et al. Assessment of quality characteristics and bacterial community of modified atmosphere packaged chilled pork loins using 16S rRNA amplicon sequencing analysis[J]. Food Research International, 2021, 145: 110412.DOI:10.1016/j.foodres.2021.110412.
[41] CHEN Y, LIN H X, YANG Y P, et al. Exploring the role of static magnetic field in supercooling storage from the viewpoint of meat quality and microbial community[J]. Food Research International,2024, 195: 114884. DOI:10.1016/j.foodres.2024.114884.
[42] BARCENILLA C, DUCIC M, LÓPEZ M, et al. Application of lactic acid bacteria for the biopreservation of meat products:a systematic review[J]. Meat Science, 2022, 183: 108661.DOI:10.1016/j.meatsci.2021.108661.
[43] WEN X Y, ZHANG D Q, LI X, et al. Dynamic changes of bacteria and screening of potential spoilage markers of lamb in aerobic and vacuum packaging[J]. Food Microbiology, 2022, 104: 103996. DOI:10.1016/j.fm.2022.103996.
[44] SOUZA R D, LOPES E R, RAMOS E M, et al. Active packaging:development and characterization of polyvinyl alcohol (PVA) and nitrite film for pork preservation[J]. Food Chemistry, 2024, 437:137811. DOI:10.1016/j.foodchem.2023.137811.
[45] IBEOGU I H, BAKO H K, YAR M S, et al. Gelatin-serum plasma film incorporated with curcumin for improvement of antioxidant and antibacterial properties for fresh pork packaging application[J]. Food Hydrocolloids, 2024, 149: 109617. DOI:10.1016/j.foodhyd.2023.109617.
[46] ZHENG T T, TANG P P, YANG C K, et al. Development of active packaging films based on collagen/gallic acid-grafted chitosan incorporating with ε-polylysine for pork preservation[J].Food Hydrocolloids, 2023, 140: 108590. DOI:10.1016/j.foodhyd.2023.108590.
[47] KONG J, GE X, SUN Y, et al. Multi-functional pH-sensitive active and intelligent packaging based on highly cross-linked zein for the monitoring of pork freshness[J]. Food Chemistry, 2023, 404: 134754.DOI:10.1016/j.foodchem.2022.134754.
[48] 郭依萍, 栗婧文, 窦晗, 等. 精准温控对冰温贮藏生鲜猪肉保鲜效果的影响[J]. 南京农业大学学报, 2023, 46(1): 150-158. DOI:10.7685/jnau.202112020.
[49] TAO Y, GUO Y P, LI J W, et al. Effect of temperature fluctuation during superchilling storage on the microstructure and quality of raw pork[J]. Meat Science, 2023, 198: 109096. DOI:10.1016/j.meatsci.2023.109096.
[50] KAN J, LIU J, XU F F, et al. Development of pork and shrimp freshness monitoring labels based on starch/polyvinyl alcohol matrices and anthocyanins from 14 plants: a comparative study[J]. Food Hydrocolloids, 2022, 124: 107293. DOI:10.1016/j.foodhyd.2021.107293.
[51] ZHANG J J, HUANG X W, ZHANG J N, et al. Development of nanofiber indicator with high sensitivity for pork preservation and freshness monitoring[J]. Food Chemistry, 2022, 381: 132224.DOI:10.1016/j.foodchem.2022.132224.
[52] GONG S Y, JIAO C Q, GUO L. Antibacterial mechanism of beetroot(Beta vulgaris) extract against Listeria monocytogenes through apoptosis-like death and its application in cooked pork[J]. LWTFood Science and Technology, 2022, 165: 113711. DOI:10.1016/j.lwt.2022.113711.
[53] WANG L, LIU T, LIU L, et al. Impacts of chitosan nanoemulsions with thymol or thyme essential oil on volatile compounds and microbial diversity of refrigerated pork meat[J]. Meat Science, 2022,185: 108706. DOI:10.1016/j.meatsci.2021.108706.
[54] ZHAO Z H, LIU H L, TANG J Y, et al. Pork preservation by antimicrobial films based on potato starch (PS) and polyvinyl alcohol(PVA) and incorporated with clove essential oil (CLO) Pickering emulsion[J]. Food Control, 2023, 154: 109988. DOI:10.1016/j.foodcont.2023.109988.
[55] ZDUŃCZYK W, TKACZ K, MODZELEWSKA-KAPITUŁA M. The effect of superficial oregano essential oil application on the quality of modified atmosphere-packed pork loin[J]. Foods, 2023, 12(10): 2013.DOI:10.3390/foods12102013.
[56] NOUR V. Effect of sour cherry or plum juice marinades on quality characteristics and oxidative stability of pork loin[J]. Foods, 2022,11(8): 1088. DOI:10.3390/foods11081088.
[57] HU Z Y, XIAO Y P, WANG B K, et al. Combined treatments of low dose irradiation with antimicrobials for inactivation of foodborne pathogens on fresh pork[J]. Food Control, 2021, 125: 107977.DOI:10.1016/j.foodcont.2021.107977.
[58] WEI Q, MEI J, XIE J. Application of electron beam irradiation as a non-thermal technology in seafood preservation[J]. LWT-Food Science and Technology, 2022, 169: 113994. DOI:10.1016/j.lwt.2022.113994.
[59] LUO J, XU W M, LIU Q, et al. Dielectric barrier discharge cold plasma treatment of pork loin: effects on muscle physicochemical properties and emulsifying properties of pork myofibrillar protein[J].LWT-Food Science and Technology, 2022, 162: 113484. DOI:10.1016/j.lwt.2022.113484.
[60] NUYGEN M, ARVAJ L, BALAMURUGAN S. The use of high pressure processing to compensate for the effects of salt reduction in ready-to-eat meat products[J]. Critical Reviews in Food Science and Nutrition, 2024,64(9): 2533-2547. DOI:10.1080/10408398.2022.2124398.
[61] INDIARTO R, IRAWAN A N, SUBROTO E. Meat irradiation:a comprehensive review of its impact on food quality and safety[J].Foods, 2023, 12(9): 1845. DOI:10.3390/foods12091845.
[62] DU Y D, ZHENG M. Silver nanoparticles/carbon dots nanocomposite with potent antibiofilm and long-term antimicrobial activity doped into chitosan/polyvinyl alcohol film for food preservation[J]. International Journal of Biological Macromolecules, 2024, 283: 137744.DOI:10.1016/j.ijbiomac.2024.137744.
[63] LÜ Y F, DENG Y Z, WANG M R, et al. Effect of chitosan-gelatine edible coating containing nano-encapsulated clove ethanol extract on cold storage of chilled pork[J]. Meat Science, 2023, 204: 109288.DOI:10.1016/j.meatsci.2023.109288.
[64] SONG X Y, WANG L, LIU T, et al. Mandarin (Citrus reticulata L.)essential oil incorporated into chitosan nanoparticles: characterization,anti-biofilm properties and application in pork preservation[J].International Journal of Biological Macromolecules, 2021, 185: 620-628. DOI:10.1016/j.ijbiomac.2021.06.195.