根据GB/T 29342—2012《肉制品生产管理规范》所述,肉制品是以畜禽肉或可食副产品等为主要原料,加入适当辅料(含食品添加剂),经相关加工工艺制成的食品[1]。作为现代食品工业的结晶之一,肉制品不仅含有丰富的脂肪、蛋白质和多种矿物质,还在风味与质地方面为消费者提供了不可替代的体验。然而,据联合国粮食及农业组织预测,2050年,全球的肉类消费需求将达到4.55亿 t,随着全球人口的增长,传统的畜牧业及肉制品生产加工模式将面临更加巨大的挑战[2]。不仅如此,盐分、脂肪摄入过多也会导致高血压、肥胖症及心血管疾病的发病率上升,随着生活水平的提高,越来越多的消费者开始倾向于选择低盐、低脂肉制品[3]。
在此背景下,探索和开发新型、绿色、健康的肉制品生产技术已成为当前食品科学研究领域的热点之一。其中,天然多糖类添加剂因其绿色、安全、功能多样等特性备受青睐,而魔芋葡甘露聚糖(konjac glucomannan,KGM)因其独特的分子结构与多重功能特性,在肉制品改良中展现出显著优势[4]。KGM是来源于魔芋块茎的非离子型水溶性高分子多糖,其本身对人体肠道健康具有多种效应,包括抗炎、缓解便秘、减缓糖脂吸收、调节肠道菌群和保护肠黏膜屏障等[5]。目前,国内外研究[6-8]已证实,KGM不仅能够改善肉制品质地与持水性,还能作为脂肪替代品降低产品的脂肪含量,此外还可以影响肉制品的消化吸收过程。同时,作为植物基原料,KGM的应用可减少对动物副产物的依赖,助力人造肉等新兴领域开发[9]。国内外研究人员对KGM性质及其在肉制品中的应用进行了深入研究,对推动肉制品行业的可持续发展具有重要意义,但目前较少有文献从功能特性的角度整理、汇总KGM在肉制品中的影响与应用。
因此,本文以KGM的分子结构为切入点,简要解释KGM独特的功能特性,并以此为基础进一步介绍KGM对肉制品的影响及作用机理,此外,还对KGM在新型人造肉制品中的应用进行探讨,以期为推动KGM的应用研究和肉制品生产、加工行业的科技进步提供理论基础与启发。
1 KGM的功能特性
KGM在常温下外观为白色或淡黄色粉末,易分散于pH 4.0~7.0的热水或冷水中形成高黏度溶液,但不溶于乙醇、丙酮、乙醚等有机溶剂。一般认为,KGM的主链大多是由D-甘露糖与D-葡萄糖按1.6∶1的比例通过β-1,4糖苷键随机连接而成的。主链上每约32 个糖残基存在3 个支链,并以β-1,3糖苷键连接到D-甘露糖的C3上,每约19 个糖残基上有1 个乙酰基,其分子结构如图1所示[10]。由于品种来源、提取手段、保存时间及测定方法等条件的不同,KGM的分子质量也会有一定的变化,一般在200~2 000 kDa之间[11]。KGM独特的分子结构赋予其多种功能特性,包括持水性、乳化稳定性、凝胶性及与其他多糖的协同作用等。
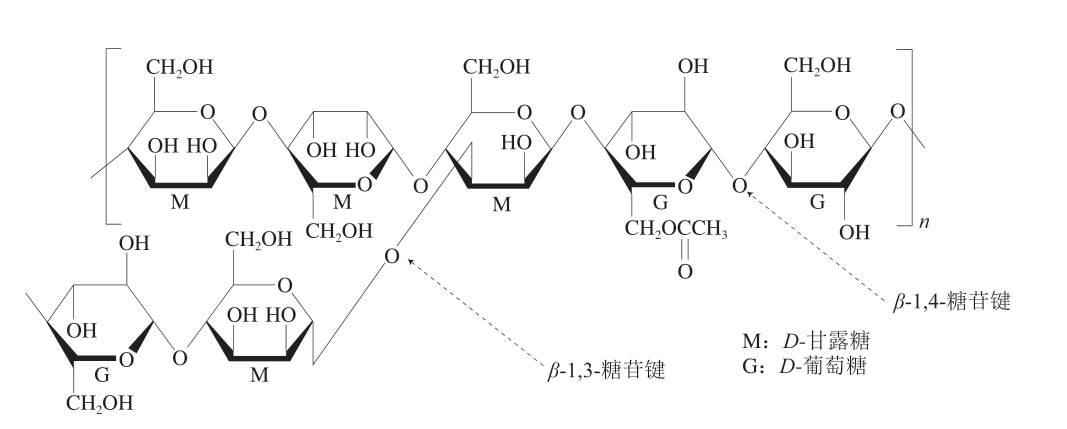
图1 KGM的分子结构示意图
Fig. 1 Molecular structure of KGM
1.1 持水性
持水性一般是指多糖分子吸附和保留水分的能力。多糖在溶液中伸展和相互缠绕,形成一个复杂的网络结构,限制水分子的运动,这与其增稠性相互关联。天然KGM的吸水能力可达104.5 g/g,是黏度最大的一种天然多糖,这归因于其特殊的分子结构和较强的水合作用[12]。有研究[13]表明,由于主链上疏水性乙酰基的存在,溶于水的KGM分子呈不规则的半柔性螺旋链构象,同时分子链上的环氧原子和糖苷氧原子通过氢键将糖环与1 个或多个水分子连接起来,使其具有极强的亲水性。乙酰基团的存在对KGM的螺旋结构非常重要,当脱去乙酰基后,KGM分子链间的疏水相互作用与氢键的平衡将被打破。由于裸露主链上氢键作用的显著增强,脱乙酰的KGM分子会发生缠绕卷曲,并最终形成较为稳定的球形结构,从而导致其持水性及黏度的大幅下降[14]。值得一提的是,与淀粉、纤维素等多糖的羧甲基化改性会提高KGM溶解度不同,亲水性羧甲基团的引入反而会导致KGM的持水性和溶解度出现一定的下降[15]。这可能与主链上的羧甲基增加了KGM分子的折叠,使其与水分子的相互作用减少有关[16]。
除了主链上的基团外,KGM分子质量同样会影响其黏度与持水性,一般分子质量越小,其持水能力越弱。例如,利用高压灭菌器可以快速、高效地制备魔芋低聚糖,仅20 min的高压处理即可使KGM的分子质量由654 kDa降低至420 kDa,对应的表观黏度也从最初的39 894 mPa·s下降至3 437 mPa·s[17]。此外,γ辐照处理同样会导致多糖的降解和持水能力下降,经过10 kGy辐照处理后的KGM分子质量由1 170 kDa下降至206 kDa,甚至当辐照剂量进一步提高至50 kGy后,其吡喃糖环的水分子结合数由6.24 mol/mol降低至5.31 mol/mol[18]。
1.2 凝胶性
KGM在碱性环境中加热后可形成热不可逆凝胶,其凝胶形成机制如下:KGM分子在强碱的环境中逐渐脱去乙酰基,其原本的半柔性螺旋链结构消失,暴露出更多的羟基,这将有助于分子间氢键的形成,同时乙酰基的脱去使分子间的疏水相互作用减弱,最后KGM分子链随着温度的提高而展开,并在以氢键为主的分子间作用力影响下交联,形成稳定的三维网络凝胶结构[19]。由此过程可知,分子质量或乙酰化程度等分子特性均会影响KGM的凝胶性能。当分子质量较大或乙酰化程度较高时,KGM分子链的聚集会受到抑制,凝胶形成速率减慢,但也代表分子会有更长的时间进行链重排,从而产生更多的有序交联结构,形成的凝胶强度随之上升[20-21]。此外,一些外部条件,如碱浓度、温度、盐溶液等也会影响KGM的凝胶性能,其中碱浓度与温度主要通过影响KGM分子链上乙酰基的脱除速率与程度以及分子链的展开和交联影响凝胶[22]。而盐溶液对KGM凝胶的影响可能更加复杂,大体可以用霍夫梅斯特序列,即![]() >
>![]() >SCN-进行解释。序列靠左的阴离子具有强水合效应,容易引起盐析,增强KGM在水中的疏水性,从而有助于KGM的凝胶过程,而靠右的是弱水合离子,主要诱导盐溶,会增加KGM链溶解度并抑制凝胶的形成[23-24]。
>SCN-进行解释。序列靠左的阴离子具有强水合效应,容易引起盐析,增强KGM在水中的疏水性,从而有助于KGM的凝胶过程,而靠右的是弱水合离子,主要诱导盐溶,会增加KGM链溶解度并抑制凝胶的形成[23-24]。
除了常规的碱热凝胶外,KGM也可以与一些在溶液中水解为多羟基水合物的盐类作用形成凝胶。例如,硼砂可以在水中解离成具有四面体构型的[B(OH)4]-,并与KGM通过配位作用形成凝胶网络[25]。但因为硼砂本身具有一定的毒性,这类凝胶在食品领域的应用尚未实施。另外,当KGM的含量较低时,由于分子间的距离较大及乙酰基的存在而难以聚集成胶,但当KGM的含量足够高,分子聚集的难度会大幅下降。如Dave等[26]曾指出,当KGM在水溶液中的质量分数达到7%时即可形成液晶相,当其质量分数超过10%则会完全表现出各向异性,即使不在碱性环境中脱去乙酰基也可形成凝胶。然而,受限于高含量KGM的黏度与溶解性问题,目前这种凝胶并未得到广泛应用。
1.3 乳化稳定性
KGM的乳化稳定性通常指其维持乳液均匀分散、不分层的能力。作为中性杂多糖,由于KGM分子链上的亲水基团远多于疏水基团(乙酰基占比仅为5%左右),因此并不具有足够的界面活性[6]。但其常被当做第2稳定剂加入到乳液中,通过影响蛋白乳液界面性质和流变特性维持乳液的稳定,如将KGM添加进全蛋液后可显著提高其乳化活性与稳定性,且实验结果呈明显的浓度依赖性[27]。一方面,KGM的添加显著提高了乳液体系中水相的黏度,同时在蛋白包埋的油滴外层形成包被,限制了体系中油滴的聚集;另一方面,KGM可通过氢键、疏水相互作用等与蛋白质结合,影响其空间结构,从而增强蛋白质的界面活性[28-29]。但当其达到一定含量时(1%,m/m),体系中未被吸收的KGM可能会在乳液液滴中产生空缺絮凝作用,从而显著影响体系稳定性,但相同含量下,黏度较低的魔芋低聚糖并未出现此问题,甚至可将肌原纤维蛋白(myofibrillar protein,MP)的乳化活性和乳化稳定性提高50%以上[30]。推测该效应可能与魔芋低聚糖诱导蛋白分子暴露出更多的疏水性氨基酸残基有关。
此外,KGM优良的环境耐受性和可于结肠降解的特点,使其在营养、药物递送领域受到关注,通过引入疏水基团使其转变为两亲化合物即可显著增强其乳化性能。例如,引入酯基的魔芋葡甘露聚糖辛烯基琥珀酸酯(konjac glucomannan octenyl succinate,KGOS)具有优良的乳化性能和结肠靶向性,且表现出对β-胡萝卜素优良的包埋效果[31]。进一步的研究[32]还发现,KGOS在高浓度的氯化钠、乙醇和酸性环境中均具有较强的稳定性,并可促进肠道益生菌生长、肠道发酵及短链脂肪酸产生。
1.4 与其他多糖的协同作用
KGM与其他多糖之间的协同作用通常通过氢键、疏水相互作用等非共价相互作用实现。这些相互作用往往能够协同增效,改善整个体系的性能。例如,单独的κ-卡拉胶凝胶往往存在易脱水收缩和高脆性的问题,通过与KGM混合则可以显著改善其柔韧性[33]。这是由于KGM与κ-卡拉胶的缔合作用在一定程度上抑制了卡拉胶自身的螺旋缔合,同时分子质量更高的KGM在复合凝胶网络中还起到“弹性活性链”的作用[34]。类似的效应也出现在KGM和结冷胶的复合体系中。在低温下,KGM可以吸附于结冷胶的螺旋结构,形成一个弱交联区域,抑制结冷胶自身交联的同时也与其形成三维网络结构[35]。
与其他多糖不同,黄原胶与KGM复配后表现出极强的增效作用。中性环境中,单独的KGM或黄原胶均不会形成凝胶,但二者混合后却可以形成稳定的固态凝胶结构,该作用与KGM的葡萄糖残基部分和黄原胶的侧链结合,进而影响其有序/无序构象的转变[36]。而在碱性环境中,二者复合凝胶过程可以分为2 步:在90 ℃孵育期间,主要形成KGM凝胶网络,但黄原胶的掺入会导致KGM凝胶网络的形成速率减慢;在随后的冷却过程中,黄原胶与KGM网络协同结合(开始于60 ℃左右),从而加强复合凝胶。复合凝胶的强度甚至比KGM凝胶高出5 倍以上,且黄原胶的添加还降低了凝胶在冻融处理过程中的脱水收缩率[37]。
2 KGM在肉制品中的应用
2.1 传统肉制品改良
随着健康消费理念的深化与肉类工业技术革新需求的增长,传统肉制品的高盐、高脂及低品质稳定性问题亟待突破。KGM作为天然功能性多糖,凭借优异的功能特性为肉制品的改良提供了创新路径,其在肉制品质地强化、脂肪模拟、替代及消化、吸收调节中的独特作用不仅契合现代食品健康化、功能化趋势,也为肉类加工工艺优化与产品升级奠定了理论与技术基础。
2.1.1 改善肉制品质地与强度
MP是肉制品生产加工过程中的关键蛋白质,其在加热或其他条件下能够形成凝胶,这一特性对于肉制品的质地、弹性、保水性等具有至关重要的影响[38]。而KGM具有极强的持水能力,在被加入肉制品中后,可以显著减少MP热凝胶过程中的水分渗出,并且其吸水溶胀和填充作用在一定程度上促进了MP的浓缩和疏水基团聚集,以形成更紧密的三维凝胶网络[39]。从MP的蛋白结构角度来看,KGM更易通过氢键等相互作用与其亲水性较好的尾部结合,形成多糖-蛋白质复合物,从而影响蛋白空间结构[40]。更进一步的研究[41]发现,KGM不仅有利于MP中有序结构α-螺旋在加热过程中的保留,还可能通过增加二硫键和非二硫共价键的形成抑制MP的不规则聚集,促进小聚集体的生成,从而使其通过有序排列形成更加均匀、连续的凝胶基质。然而,值得注意的是,由于多糖与蛋白质的热力学不相容性,当两者在体系中含量过高时,常会发生相分离现象。对于KGM和MP而言,当KGM的质量分数超过1%,往往会在复合凝胶内形成连续网络,这将阻碍蛋白质疏水基团在加热过程中的相互作用,使凝胶结构逐渐变得松散、粗糙[42]。
与一般KGM不同的是,脱乙酰KGM的溶解度和持水性能将会降低,其对MP凝胶持水能力的改善效果将被弱化。但脱乙酰KGM却能更好地改善鱼糜凝胶的强度,这与其更易在加热过程中与蛋白残基相互交联,影响了蛋白质的展开与聚集速率及疏水相互作用的变化有关[43]。也有研究[44]认为,这可能是由于脱乙酰KGM比一般KGM更有利于凝胶中氢键和二硫键的形成,且有效保护了加热过程中蛋白质的二级结构。但值得注意的是,当KGM的脱乙酰程度过高时,其与蛋白质的过度结合会使蛋白分子间或分子内的聚合减少,从而破坏凝胶网络结构的完整性[45]。
随着健康意识的提高,人们开始注意到一些肉制品中过高的盐分所带来的问题,相关低盐肉制品的研发也日渐增多。但天然MP在加工过程中非常敏感,即使是微小的环境变化(如pH值、离子强度、温度等)也会影响其结构和功能特性,并对肉制品的品质产生不良影响[46]。而NaCl除赋予肉制品咸味之外,还具有通过改变离子强度促进MP溶解、增强MP凝胶强度,以及与脂肪颗粒结合并提高黏度,从而稳定水分和脂肪等效果[47-48]。添加KGM可以解决低盐肉制品品质下降的问题,Gao Yongfang等[49]研究证明,在低盐浓度(0.3 mol/L NaCl)下,添加0.75%(m/m)的KGM可以显著提升MP凝胶强度,改善低盐鱼糜凝胶的口感,但这种效应在高盐浓度(0.6 mol/L NaCl)环境中并不明显。同时,这一作用在添加转谷氨酰胺酶的MP凝胶中则表现更为明显,当KGM与转谷氨酰胺酶联合添加时,产生的协同作用即使在极低盐浓度下(0.1 mol/L NaCl)也可以显著提高MP的凝胶强度[50]。另外,也有研究[51]表明,在去除37.5%(m/m)盐分的鸡胸肉糜中,添加0.75%(m/m)的KGM可以使产品的持水能力得到改善,蒸煮损失率与离心损失率显著下降。
冷冻贮藏是延长肉制品保质期的常用方法,然而同样会导致肉制品质地与凝胶强度的下降。在冷藏过程中,MP分子链会通过氢键、疏水相互作用等形成不溶性的大分子聚集体,进而导致其功能性降低,包括盐溶性、持水性、水合能力和凝胶能力下降等[52]。通过添加KGM或其改性产物可以抑制MP的变性聚集,延缓肉制品冷藏过程中的品质劣化。如Liu Jianhua等[53]利用KGM改善劣质冻藏鱼糜凝胶的感官特性,其中添加1.5%(m/m)KGM的鱼糜凝胶强度提高65%以上。而Wu Wenjin等[54]利用β-葡聚糖酶将KGM水解,并发现适度降解的魔芋低聚糖(128.70 kDa)较一般KGM而言可以通过氢键与MP更好地相互作用,改善草鱼鱼糜凝胶强度,同时也指出,过度水解的魔芋低聚糖(36.48 kDa)可能会影响蛋白质分子间氢键的交联。但也有研究[55]认为,水解后的魔芋低聚糖更易与MP发生美拉德反应,并在凝胶中形成双重交联网络,对MP凝胶强度的提高发挥积极作用。冷藏过程中,肉制品内脂质与蛋白质的氧化同样会影响其品质,而魔芋低聚糖具有一定的抗氧化活性,可以显著降低冷冻鱼糜中丙二醛的生成,同时会抑制鱼糜Ca2+-ATP酶活性的下降与MP中巯基的氧化与变性[56]。此外,魔芋低聚糖与MP的亲水基团发生相互作用,还可以在一定程度上抑制冰晶生成对其结构的破坏,减少蛋白表面疏水位点的暴露,进一步避免在冷冻贮藏过程中蛋白质发生变性和聚集[57]。
2.1.2 降低肉制品脂肪含量与热量
脂肪是人体必需的六大营养素之一,且在肉制品生产过程中还可以起到赋予产品独特的风味、口感以及减少烹饪汁液损失等作用[58]。KGM优异的持水性、凝胶性及乳化稳定性等特性使其在脂肪替代物开发方面备受青睐。根据基质的不同,脂肪替代物可被分为水基和油脂基。水基脂肪替代物即通过将KGM或其他多糖、添加剂等混合制备水凝胶,通过模拟生肉脂块,代替部分或全部脂肪直接加入到肉制品中。关于水基脂肪代替物的制备,一般选择使用多种多糖复合,以获得性质更加优良的水凝胶,适应后续复杂的食品加工条件。Kim等[59]通过使用3 种果蔬粉(芦荟、仙人掌果、麦芽)与KGM混合制备脂肪替代物,与单一KGM相比,混合脂肪替代物的持水性和乳化稳定性均有所提高,其中与仙人掌果粉混合后的代替物凝胶强度与感官接受度最高。而Jiménez-Colmenero等[60]则对比使用KGM、Ι-卡拉胶及玉米淀粉复合而成的水凝胶与猪背脂的差异,尽管凝胶在硬度、咀嚼性、挤压力等方面均低于猪背脂,但这种差异将随着研磨剪切(模拟斩拌加工)程度的增加而被抵消,且该凝胶还具有良好的持水能力及与猪背脂相似的流变学行为(>40 ℃时)。进一步研究[61]发现,通过冷藏处理可以将该脂肪替代物的凝胶强度提高约3 倍左右,但会削弱其水结合能力,同时还观察到样品在冷藏过程中表现出了较高的冻融稳定性。
当水基脂肪替代物被添加到食品中后,对食品的作用在很大程度上与替代比例相关。将KGM与κ-卡拉胶结合制成立方块脂肪代替物,当其替代哈尔滨干香肠中20%或40%的脂肪时,并不会对香肠品质产生显著影响,但当替代比例超过60%,即会由于过高的水分含量而影响香肠的干燥发酵过程,显著破坏香肠的特征品质[62]。余依敏等[63]也发现,当KGM与可得然胶复合凝胶的脂肪替代比例适当时(33%、66%),低脂乳化香肠的质地、蒸煮损失率和抗氧化能力明显改善,但当香肠中的脂肪被完全替代时,其内部会出现疏松微孔,存在大量的游离水分,导致其持水性、质构特性、总体接受度等均显著下降。Geng Xiaoyuan等[64]用KGM与燕麦β-葡聚糖复合水凝胶替代乳化香肠中的脂肪,也得出类似的结果。脂肪被完全替代的香肠不仅凝胶强度下降,其持水能力与蒸煮损失率也受到影响。综上可知,亲水胶体基的脂肪代替物仍存在一定的不足,这些问题是因其本身性质(强度低、口感不如真实脂肪等)或加工工艺(取代度过高、水分含量要求等)所导致,但均有望在未来通过改进生产原料、加工方式等弥补和改善。
油脂基脂肪替代物即使用KGM与其他添加剂,与优质油脂(一般为不饱和脂肪酸含量更高的植物油脂或复合油脂)一同乳化,将所得乳化凝胶加入生肉原料中以代替原有的动物脂肪。在肉制品中,乳化凝胶的应用解决了直接使用植物油代替动物脂肪导致的油滴聚集,及其所导致的体系质地劣化问题。如Tan Zhifeng等[65]以KGM和豌豆分离蛋白为原料制备大豆油乳化凝胶,其中KGM在水相中充分水合后可形成缠结的网络结构,起到促进油滴均匀分布和稳定、加强凝胶结构和可塑性的作用。Ren Yuqing等[66]进一步对比双重乳化(W/O/W)与单重乳化(O/W)凝胶的差别,结果表明,单重乳化凝胶的结构性质对KGM的含量变化更加敏感,且在相同的KGM含量下,单重乳化凝胶表现出更好的咀嚼性和更坚硬的质地,而双重乳化凝胶则表现出更低的口腔摩擦系数和更高的多汁性和油润感,这使后者更适合用作固体脂肪模拟物。
乳化凝胶中油相的性质也会影响它的应用,如鱼油虽富含ω-3多不饱和脂肪酸(主要为二十碳五稀酸和二十二碳六烯酸),这些成分赋予其独特的营养价值和健康益处,但当添加量过高时,附带的鱼腥味会破坏乳化凝胶的感官接受度。大量多不饱和脂肪酸也存在易氧化的问题,当以复配的鱼油、亚麻籽油、橄榄油作为油相的乳化凝胶完全替代猪背脂后,制成的肉饼中硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值甚至比对照组高2 倍以上[67]。椰子油同样具有多种健康功效,且其熔点比橄榄油、大豆油、芝麻油等其他植物油更高,在室温下呈洁白色或淡黄色的半固体脂肪状[68]。由于椰子油的这一特性与动物油脂类似却更加健康,一些研究开始考虑以椰子油为原料制备油脂基脂肪替代物。如Huang Lu等[69]利用4%(m/m)KGM与1%(m/m)大豆分离蛋白制备椰子油乳化凝胶,其不仅在外观和机械性能上接近猪背脂,且口腔摩擦行为类似,能够更好地模拟天然脂肪的吞咽感和润滑性。同样的体系下,Wei Lai等[70]使用KGM与大豆分离蛋白制备椰子油乳化凝胶并完全替代猪肉饼中的猪背脂,使其产品脂肪含量降低82.65%,且贮藏7 d后,其TBARS值仅为对照组的34%。另外,油脂基脂肪替代物除了可以满足保持良好口感、降低脂肪热量、改善脂肪酸组成等需求外,其独特的多层结构还具有包埋色素、调味物质或其他功能性成分的能力,这为开发新型多功能脂肪替代物提供了可能性。
2.1.3 影响肉制品消化与吸收
KGM被添加进肉制品中后,其独特的消化特性将影响食物的消化吸收。KGM的消化特性与其分子结构和极强的黏度、持水力和溶胀作用有关。KGM的持水特性会增加食物的黏度,延长胃部的排空过程和食物在肠道中的滞留时间,同时降低生长素释放肽水平,从而提供较强的饱腹感[71]。除此之外,黏度对KGM消化特性的影响还体现在能量的吸收利用方面,有研究[72]证明,尽管水合更快、黏度更高的KGM表现出更强的食欲抑制能力,但中等黏度的KGM可以更好地抑制葡萄糖的扩散并降低体内血糖水平。关于血糖,Chen Haihong等[73]同样发现,KGM的使用显著降低了空腹血糖、血清胰岛素、胰高血糖素样肽-1和糖化血清蛋白水平,这可能与其使进入肠道中的消化物黏稠度增加、延缓葡萄糖的扩散以及随后的胰岛素反应有关,并推测KGM在一定程度上有助于胰岛素敏感性的长期改善。另外,KGM具有的溶胀作用和吸收特性还可以吸附脂质并加速肠道蠕动,抑制空肠中的胆固醇和回肠中的胆汁酸吸收,这不仅减少了脂肪的积累和脂质过氧化,还改善了肝组织中肝细胞增生的问题[74]。同时,KGM还可以通过诱导大分子拥挤效应,显著影响其他溶质(如酶、底物)周围的物理化学环境,以限制酶分子的扩散、改变酶的构象稳定性等,从而降低胰腺α-淀粉酶、胃蛋白酶和胰腺脂肪酶活性,在不同程度上发挥消化调节作用[75]。必须指出的是,尽管KGM在防治肝脏脂肪积累方面具有一定的保护作用,但过高剂量的KGM也可能会促进肝细胞中毒性胆汁酸的积累[76]。
在肉制品中,亲水性多糖的添加增加了其在消化道中的附着力,并会进一步限制消化酶在胃肠中的扩散性和流动性,从而影响产品中蛋白质的消化吸收[77]。但不同多糖对蛋白质消化的影响不同,已有研究[78-79]表明,与阴离子多糖(黄原胶、海藻酸钠)相比,尽管KGM不易促进肌球蛋白的消化和小分子多肽的形成,却能够显著改善蛋白凝胶强度;与阳离子多糖(壳聚糖)相比,KGM不会通过静电相互作用等与蛋白质形成强交联,抑制消化吸收;与其他中性多糖(可得然胶)相比,KGM对消化酶裂解位点(亮氨酸、赖氨酸和精氨酸)的包埋率较低,抑制消化酶活性效果较弱。Huang Caiyan等[80]将KGM、菊粉、κ-卡拉胶添加入MP凝胶中时发现,三者均会抑制蛋白质的消化,但同时也指出,与另外两者相比,KGM组仍具有较高的消化率。值得一提的是,KGM的分子结构变化也会影响蛋白质的消化吸收。例如,适度水解后的KGM虽可以通过更强的相互作用改善鱼糜凝胶性质,但同时也会导致MP的消化酶裂解位点更多地被分子交联、包埋、掩藏[55]。总之,KGM通过自身特性及其与蛋白质的相互作用对肉制品的消化吸收产生影响。但在实际应用过程中,除一些特殊功能性食品的开发外,目前的研究重点仅在于添加KGM对肉制品体外各项特性的影响,而忽略了当其被食用后在体内消化道中的作用和变化。
2.2 人造肉制品开发
据统计,生产1 kg牛肉平均需要40 m2土地、15 cm3水,并产生300 kg二氧化碳,而联合国粮食及农业组织曾指出,全球肉类消费需求将在2050年达到4.55亿 t,传统的畜牧业要满足如此大的需求将面临巨大的资源和环境压力[81]。为了缓解这一压力,人们开始开发更加绿色、健康、可持续的新型人造肉制品,如植物蛋白肉和细胞培养肉等[82]。KGM作为一种常见且安全可靠的植物多糖,凭借其优异的功能特性在人造肉制品的生产研发中广受欢迎。
2.2.1 加强素肉纤维结构
蛋白质(主要是植物蛋白)在挤压过程中,经历高温、高压和高剪切力的作用而发生变性,维持蛋白结构的氢键、二硫键和离子键被破坏,并转变为可塑化的熔融体。随后蛋白分子链展开、重新聚集并交联,形成类似动物肉的纤维结构,这种产品即为植物蛋白肉,或称素肉[83]。而在挤压过程中,外源多糖对素肉纤维的构建起到了重要的作用,可改善单一素肉制品存在的结构松散、咀嚼性和弹性低、缺乏肉类口感等问题[84]。KGM的添加可显著增加高水分挤压时酶解大豆浓缩蛋白的纤维结构和热稳定性,这可能与其通过氢键结合蛋白质、影响蛋白质结构与聚集、促进蛋白质中二硫键的形成有关[85]。Sun Dongyu等[86]同样观察到,KGM促进了豌豆分离蛋白挤压过程中致密、均匀结构的形成,但不同的是,其认为这主要与添加KGM有利于熔融蛋白在挤压筒内的剪切变稀行为,在缩短蛋白停留时间的同时提高了熔融蛋白的无序、混合程度有关。
然而这些常用的植物蛋白与动物蛋白相比并不能完全满足消费者的需求,如大豆蛋白可能会引发过敏反应,而豌豆蛋白缺乏人体的必需氨基酸(蛋氨酸)等。酵母蛋白或有可能成为新一代的素肉原料,其并无上述植物蛋白缺陷,且生产加工成本更低。已有研究[87]表明,通过添加KGM可解决单一酵母蛋白挤压难以形成有效纤维结构的问题。
2.2.2 作为体系黏合剂
除挤压加工技术外,对于部分纤维结构需求较低的肉制品(如肉饼、肉丸、香肠)而言,通过将植物蛋白与多糖直接混合可以实现模拟肉制品的制备。其中,多糖作为黏合剂可以改善体系中蛋白质、水和脂质之间的相互作用,对组分间的凝聚起着至关重要的作用[88]。Yuliarti等[89]研究发现,KGM可起到充当“网络桥梁”的作用,将发酵大豆、小麦粉、小麦蛋白、甜菜根粉等材料结合,从而制备模拟牛肉饼。尽管最终产品在蒸煮处理前、后的硬度均略低于市售牛肉饼,但证明KGM可以提高模拟物的固体特性和黏聚性,并对其结构具有一定的稳定作用。也有研究[90]利用KGM与大豆蛋白的相互作用开发一种植物蛋白鱼丸,当KGM的添加量为6.5%(m/m)时,模拟物在凝胶强度、咀嚼性和微观结构上均与一般鱼糜鱼丸无显著差异,这归因于KGM对氢键和蛋白有序结构(α-螺旋、β-折叠)的保护作用。而Majzoobi等[91]则分别对比κ-卡拉胶、黄原胶、KGM对大豆蛋白模拟香肠品质的影响,结果表明,κ-卡拉胶和KGM均可显著提高样品的质地和感官接受度、降低蒸煮损失率,但黄原胶并未造成显著影响。
2.2.3 作为细胞培养支架
基于细胞生物技术在体外培养动物肌肉组织同样可以生产可食用替代肉制品,而细胞支架的构建是细胞培养肉生产过程中必不可少的环节之一。细胞支架主要起到支撑种子细胞生长、增殖与分化、辅助细胞吸收营养物质和氧气、排出代谢废物等作用,且最终会影响细胞培养肉产品的质构特性[92]。同时,细胞培养肉中的细胞支架还需要具有良好的生物相容性、可降解性及可食用性,因此多糖与蛋白质成为支架材料的主要来源[93]。Tang Xue等[94]利用KGM的凝胶性,将其与纤维蛋白结合,构建一种细胞支架,并通过改变两者的比例调控支架强度,进一步诱导外胚层间干细胞不同的成骨和成肌肉分化,制得质构特性和主要营养成分均与动物肉相近的产品。而王媛[95]基于低压电场技术构建KGM-大豆分离蛋白各向异性三维支架,并以此制得与肌肉有相似力学性能的C2C12成肌细胞培养肉,还发现KGM会显著提高成肌分化蛋白的表达,更有利于细胞的成肌分化和肌管排列。与之不同的是,Gu Xin等[96]聚焦于肉制品中的脂肪组织,利用KGM与κ-卡拉胶(二者本身均可作为脂肪代替物)构建细胞支架,并实现了对猪皮下前脂肪细胞和纤维脂肪生成祖细胞的培养,综合降解率、生物相容性、总脂滴面积、脂肪细胞球体聚集率等指标,确定最佳制备条件为1%(m/m)KGM∶κ-卡拉胶=4∶6(m/m)。
2.2.4 模拟天然肉中的其他部分
已有大量研究证明,通过蛋白质与多糖的相互作用可以充分模拟真实肉制品,主要模拟肉制品中的肌纤维结构和脂肪。但日常生活中,作为食物的肉类中并不仅有肌肉和脂肪,还包含必不可少的结缔组织,如筋膜、软骨等。结缔组织为动物的肌肉提供了结构支撑,且其在肉制品中的含量和组成可以显著影响肉制品品质,特别是在质地和保水能力方面[97]。Liu Shuqi等[98]以KGM、海藻粉、大豆分离蛋白、玉米淀粉为原料,制备一种高强度、高韧性的水凝胶,当体系中含有4%(m/m)KGM与海藻粉(1∶1,m/m)时,其拉伸与咀嚼性能均与天然结缔组织(牛筋)相近,其中KGM的添加起到了增强凝胶黏附性与热稳定性、促进更紧密的交联网络键合的作用。但也有研究[99]认为,天然结缔组织的结构为典型的各向异性,而水凝胶一般是由均匀分散在水介质中的单体聚合而成,为各向同性,结构上的不同或许是水凝胶和结缔组织在口感、质地上存在差异的根本原因。基于此,Yang Jiyu等[100]通过冻融循环、预拉伸和调节水分预处理,制备出一种牛胸肉筋膜模拟水凝胶,并证明预拉伸处理不仅能有效提高模拟筋膜的机械强度,且有利于模拟筋膜各向异性结构的形成。除筋膜外,软骨同样常见于各种加工肉制品中,但单一的多糖水凝胶往往难以模仿软骨高强度、高弹性、高脆性的机械性能。而Yang Jiyu等[101]对KGM、结冷胶和小麦纤维复合凝胶依次进行冻融循环、钙离子交联和挤压脱水处理,成功制备出猪月牙骨和鸡胸软骨的模拟凝胶(前者需要更高的硬度,后者需要更高的弹性)。其中,钙离子交联提高了复合凝胶的硬度与咀嚼性,而冻融循环与挤压脱水处理则起到了增强复合凝胶脆性的作用。事实上,这些模拟天然肉中的其他部分并不仅仅局限于与肌肉纤维、脂肪等重组成肉制品,其本身即可被开发成一种新型食品,如消费者较为熟悉的魔芋爽等产品,这为促进KGM的开发、利用提供了一个更为广阔的方向[102]。KGM在相关肉制品中的应用实例如表1所示。
表1 KGM在不同肉制品中的应用
Table 1 Application of KGM in different meat products
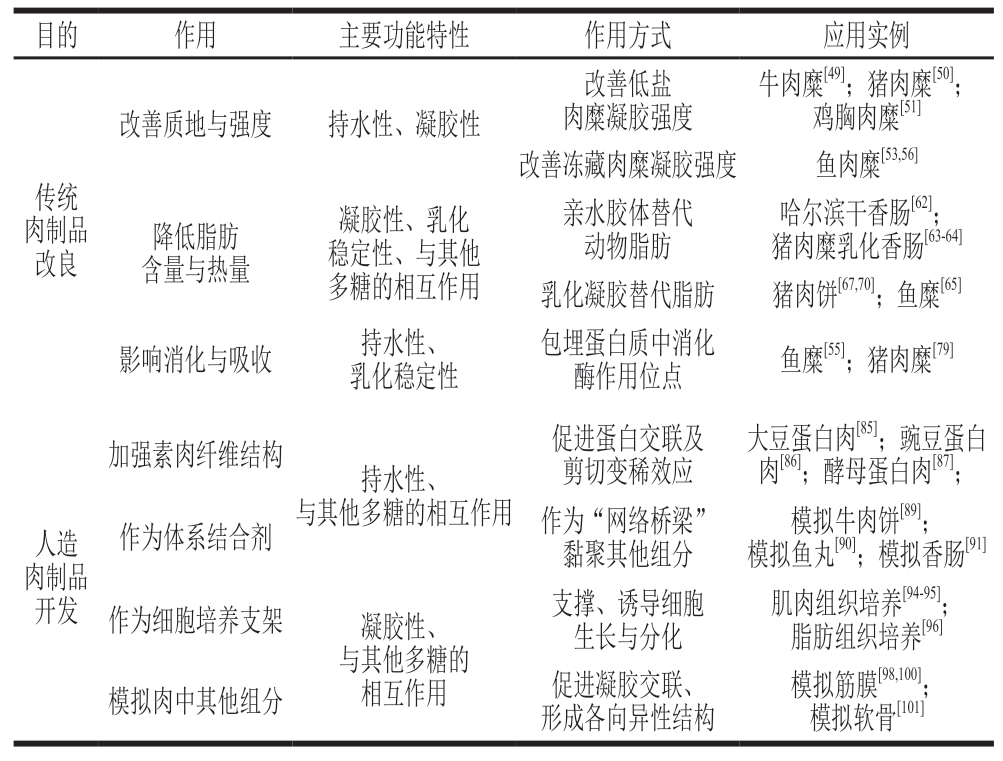
目的作用主要功能特性作用方式应用实例改善质地与强度持水性、凝胶性牛肉糜[49];猪肉糜[50];鸡胸肉糜[51]改善冻藏肉糜凝胶强度鱼肉糜[53,56]改善低盐肉糜凝胶强度传统肉制品改良哈尔滨干香肠[62];猪肉糜乳化香肠[63-64]乳化凝胶替代脂肪猪肉饼[67,70];鱼糜[65]影响消化与吸收持水性、乳化稳定性降低脂肪含量与热量凝胶性、乳化稳定性、与其他多糖的相互作用亲水胶体替代动物脂肪包埋蛋白质中消化酶作用位点鱼糜[55];猪肉糜[79]加强素肉纤维结构持水性、与其他多糖的相互作用促进蛋白交联及剪切变稀效应人造肉制品开发大豆蛋白肉[85];豌豆蛋白肉[86];酵母蛋白肉[87];作为体系结合剂作为“网络桥梁”黏聚其他组分模拟牛肉饼[89];模拟鱼丸[90];模拟香肠[91]肌肉组织培养[94-95];脂肪组织培养[96]模拟肉中其他组分促进凝胶交联、形成各向异性结构作为细胞培养支架凝胶性、与其他多糖的相互作用支撑、诱导细胞生长与分化模拟筋膜[98,100];模拟软骨[101]
3 结 语
本文综述KGM的功能特性及其在肉制品中的影响,并分别列举了KGM在相关肉制品中的应用实例。大量研究证明,KGM在无论是在传统肉制品、减盐、减脂健康肉制品、亦或是在新型人造肉制品中,均可凭借其持水性、凝胶性、乳化稳定性等功能特性及其与蛋白质、脂肪等的相互作用发挥不容忽视的作用,表现出巨大的应用潜力,仍需深入研究以优化KGM在肉制品中的使用。下面将按照食品供应链,即原料处理、生产加工、运输贮藏、消费食用的顺序依次简要列举KGM于肉制品中可能的优化方向:1)原料处理:除脱乙酰与降解外,KGM的改性处理还包括酯化、羧甲基化、氧化及接枝共聚等方法,尽管某些改性KGM可能会由于工艺、试剂等问题而存在安全隐患,但不可否认的是,改性KGM或许会对肉制品产生更加复杂、有效的影响,在通过细胞毒性实验初步确认安全性后,改性KGM对肉制品的影响同样值得探究。2)生产加工:一些肉制品的加工需要用到超声、辐照、高温高压等物理加工技术。这些技术一般通过影响肉制品中的蛋白质、脂肪等成分发挥作用。但必须考虑的是,它们同时也会影响加入肉制品中的KGM,有时即使最简单的高温高压灭菌处理也可能大幅度削弱KGM的持水性能。3)运输、贮藏:在关于KGM对肉制品影响的相关研究中,实验环境大多太过理想,实际很多肉制品从生产到出售,期间往往会经历多次冻融过程,而冻融处理对KGM凝胶特性的影响极为显著,某些在实验室中存在的良好改善效果在实际应用中可能会大打折扣甚至消失。4)消费食用:应多方面看待KGM对肉制品的影响,一般而言,添加KGM可以增强肉制品的黏性与凝胶强度,但这对于吞咽不便的老年人或某些疾病患者反而更不友好。另外,尽管KGM是公认安全、无毒的食品添加剂多糖,但过多摄入KGM也可能会影响肝脏或消化道的平衡与健康。综上,目前关于KGM在肉制品中应用的研究仍存在一些不足,未来应更加注重KGM基础研究与应用研究的结合,推动其在肉制品领域的广泛应用和深入发展。
[1] 国家质量监督检验检疫总局, 中国国家标准化管理委员会. 肉制品生产管理规范: GB/T 29342—2012[S]. 北京: 中国标准出版社, 2013: 1.
[2] RUBIO N R, XIANG N, KAPLAN D L. Plant-based and cell-based approaches to meat production[J]. Nature Communications, 2020,11(1): 6276. DOI:10.1038/s41467-020-20061-y.
[3] 周凤超, 陈伟娇, 辜银环, 等. 多糖替代动物脂肪与肌原纤维蛋白相互作用的研究现状[J]. 食品与发酵工业, 2020, 46(14): 283-288.DOI:10.13995/j.cnki.11-1802/ts.023684.
[4] 张颖. 魔芋葡甘聚糖理化性质及应用前景[J]. 食品安全导刊,2023(18): 148-150. DOI:10.16043/j.cnki.cfs.2023.18.043.
[5] JIAN X Y, JIAN S Y, DENG B C. Konjac glucomannan: a functional food additive for preventing metabolic syndrome[J]. Journal of Functional Foods, 2024, 115: 106108. DOI:10.1016/j.jff.2024.106108.
[6] 耿雪晴, 李昆, 李晓毓, 等. 魔芋胶的保健功能及其在低脂肉制品中的应用[J]. 江苏调味副食品, 2018, 35(3): 28-30. DOI:10.16782/j.cnki.32-1235/ts.2018.03.008.
[7] LI S, LIN S Y, JIANG P F, et al. Insight into the gel properties of Antarctic krill and Pacific white shrimp surimi gels and the feasibility of polysaccharides as texture enhancers of Antarctic krill surimi gels[J]. Foods, 2022, 11(16): 2517. DOI:10.3390/foods11162517.
[8] ZHANG Q, ZHONG D, SUN R, et al. Prevention of loperamide induced constipation in mice by KGM and the mechanisms of different gastrointestinal tract microbiota regulation[J]. Carbohydrate Polymers,2021, 256: 117418. DOI:10.1016/j.carbpol.2020.117418.
[9] TANG W, PAN Q, HE J F, et al. Plant-based meat: the influence on texture by protein-polysaccharide interactions and processing techniques[J]. Food Research International, 2025, 202: 115673.DOI:10.1016/j.foodres.2025.115673.
[10] 李斌, 谢笔钧. 魔芋葡甘聚糖分子链形态研究[J]. 中国农业科学,2004, 37(2): 280-284. DOI:10.3321/j.issn:0578-1752.2004.02.020.
[11] 杨雯, 李宏梁. 魔芋胶在低脂肉制品中的应用研究现状[J].食品研究与开发, 2015, 36(18): 192-195. DOI:10.3969/j.issn.1005-6521.2015.18.050.
[12] KOROSKENYI B, MCCARTHY S P. Synthesis of acetylated konjac glucomannan and effect of degree of acetylation on water absorbency[J].Biomacromolecules, 2001, 2(3): 824-826. DOI:10.1021/bm010014c.
[13] SUN Y L, XU X W, ZHANG Q H, et al. Review of konjac glucomannan structure, properties, gelation mechanism, and application in medical biology[J]. Polymers, 2023, 15(8): 1852.DOI:10.3390/polym15081852.
[14] JIAN W J, YAO M N, WANG Y, et al. Study on the hydration shell of single-helical of konjac glucomannan[J]. Chinese Journal of Structural Chemistry, 2011, 30(1): 127-133. DOI:10.14102/j.cnki.0254-5861.2011.01.022.
[15] ZHU F. Modifications of konjac glucomannan for diverse applications[J]. Food Chemistry, 2018, 256: 419-426. DOI:10.1016/j.foodchem.2018.02.151.
[16] XIAO M, DAI S H, WANG L, et al. Carboxymethyl modification of konjac glucomannan affects water binding properties[J]. Carbohydrate Polymers, 2015, 130: 1-8. DOI:10.1016/j.carbpol.2015.05.001.
[17] CHEN Z J, WANG S S, SHANG L C, et al. An efficient and simple approach for the controlled preparation of partially degraded konjac glucomannan[J]. Food Hydrocolloids, 2020, 108: 106017.DOI:10.1016/j.foodhyd.2020.106017.
[18] PRAWITWONG P, TAKIGAMI S, PHILLIPS G O. Effects of γ-irradiation on molar mass and properties of konjac mannan[J].Food Hydrocolloids, 2007, 21(8): 1362-1367. DOI:10.1016/j.foodhyd.2006.10.015.
[19] YE S X, ZONGO A W, SHAH B R, et al. Konjac glucomannan (KGM),deacetylated KGM (da-KGM), and degraded KGM derivatives: a special focus on colloidal nutrition[J]. Journal of Agricultural and Food Chemistry, 2021, 69(44): 12921-12932. DOI:10.1021/acs.jafc.1c03647.
[20] ZHANG H, YOSHIMURA M, NISHINARI K, et al. Gelation behaviour of konjac glucomannan with different molecular weights[J]. Biopolymers, 2001, 59(1): 38-50. DOI:10.1002/1097-0282(200107)59:1<38::AID-BIP1004>3.0.CO;2-A.
[21] GAO S J, NISHINARI K. Effect of deacetylation rate on gelation kinetics of konjac glucomannan[J]. Colloids and Surfaces B: Biointerfaces, 2004, 38(3/4): 241-249. DOI:10.1016/j.colsurfb.2004.02.026.
[22] LIU Z J, REN X, CHENG Y Q, et al. Gelation mechanism of alkali induced heat-set konjac glucomannan gel[J]. Trends in Food Science &Technology, 2021, 116: 244-254. DOI:10.1016/j.tifs.2021.07.025.
[23] YIN W C, ZHANG H B, HUANG L, et al. Effects of the lyotropic series salts on the gelation of konjac glucomannan in aqueous solutions[J]. Carbohydrate Polymers, 2008, 74(1): 68-78.DOI:10.1016/j.carbpol.2008.01.016.
[24] CHEN J, LI J, LI B. Identification of molecular driving forces involved in the gelation of konjac glucomannan: effect of degree of deacetylation on hydrophobic association[J]. Carbohydrate Polymers,2011, 86(2): 865-871. DOI:10.1016/j.carbpol.2011.05.025.
[25] LIU C J, LEI F H, LI P F, et al. A review on preparations,properties, and applications of cis-ortho-hydroxyl polysaccharides hydrogels crosslinked with borax[J]. International Journal of Biological Macromolecules, 2021, 182: 1179-1191. DOI:10.1016/j.ijbiomac.2021.04.090.
[26] DAVE V, SHETH M, MCCARTHY S P, et al. Liquid crystalline,rheological and thermal properties of konjac glucomannan[J]. Polymer,1998, 39(5): 1139-1148. DOI:10.1016/S0032-3861(97)00255-3.
[27] DENG L L, GAO Y G, ZHONG G, et al. Effects of konjac glucomannan on physicochemical and rheological properties of whole egg liquid and in vitro fermentation of egg curd[J]. International Journal of Biological Macromolecules, 2023, 246: 125695.DOI:10.1016/j.ijbiomac.2023.125695.
[28] LU W, ZHENG B D, MIAO S. Improved emulsion stability and modified nutrient release by structuring O/W emulsions using konjac glucomannan[J]. Food Hydrocolloids, 2018, 81: 120-128.DOI:10.1016/j.foodhyd.2018.02.034.
[29] TIAN L, ZHANG S L, YI J H, et al. The impact of konjac glucomannan on the physical and chemical stability of walnut oil-inwater emulsions coated by whey proteins[J]. Journal of the Science of Food and Agriculture, 2022, 102(10): 4003-4011. DOI:10.1002/jsfa.11748.
[30] DUAN Z Q, WANG Y T, YU X, et al. Effect of konjac oligoglucomannan on emulsifying properties of myofibrillar protein[J].Journal of the Science of Food and Agriculture, 2023, 103(11): 5261-5269. DOI:10.1002/jsfa.12596.
[31] LI Y C, ZHONG G, MENG F B, et al. Konjac glucomannan octenyl succinate (KGOS) as an emulsifier for lipophilic bioactive nutrient encapsulation[J]. Journal of the Science of Food and Agriculture, 2018,98(15): 5742-5749. DOI:10.1002/jsfa.9122.
[32] MENG F B, ZHANG Q, LI Y C, et al. In vitro fermentation and Camellia oil emulsification characteristics of konjac glucomannan octenyl succinate[J]. Food Science & Nutrition, 2020, 8(7): 3912-3922. DOI:10.1002/fsn3.1702.
[33] WANG X, ZHOU D Y, GUO Q, et al. Textural and structural properties of a κ-carrageenan-konjac gum mixed gel: effects of κ-carrageenan concentration, mixing ratio, sucrose and Ca2+ concentrations and its application in milk pudding[J]. Journal of the Science of Food and Agriculture, 2021, 101(7): 3021-3029. DOI:10.1002/jsfa.10936.
[34] KOHYAMA K, IIDA H, NISHINARI K. A mixed system composed of different molecular weights konjac glucomannan and κ-carrageenan: large deformation and dynamic viscoelastic study[J].Food Hydrocolloids, 1993, 7(3): 213-226. DOI:10.1016/S0268-005X(09)80173-2.
[35] MEI T, XU X, LI B, et al. Synergistic interaction of konjac glucomannan and gellan gum investigated by rheology and texture analysis[J]. Journal of Applied Polymer Science, 2012, 125(2): 1363-1370. DOI:10.1002/app.35247.
[36] LIANG S, LI B, DING Y, et al. Comparative investigation of the molecular interactions in konjac gum/hydrocolloid blends:concentration addition method (CAM) versus viscosity addition method (VAM)[J]. Carbohydrate Polymers, 2011, 83(3): 1062-1067.DOI:10.1016/j.carbpol.2010.08.026.
[37] YANG X, LI A Q, LI D, et al. Improved physical properties of konjac glucomannan gels by co-incubating composite konjac glucomannan/xanthan systems under alkaline conditions[J]. Food Hydrocolloids,2020, 106: 105870. DOI:10.1016/j.foodhyd.2020.105870.
[38] SULAIMAN N S, SINTANG M D, HUDA N, et al. Enhancing meat product quality: exploring the effects of additives on myofibrillar protein functionality[J]. Food and Bioprocess Technology, 2025, 18(2):1043-1060. DOI:10.1007/s11947-024-03503-z.
[39] ZHANG T, CHEN S J, XU X Q, et al. Effects of konjac glucomannan on physical properties and microstructure of fish myofibrillar protein gel: phase behaviours involved[J]. Food Hydrocolloids, 2023, 134:108034. DOI:10.1016/j.foodhyd.2022.108034.
[40] DENG Y, ROSENVOLD K, KARLSSON A H, et al. Relationship between thermal denaturation of porcine muscle proteins and waterholding capacity[J]. Journal of Food Science, 2002, 67(5): 1642-1647.DOI:10.1111/j.1365-2621.2002.tb08698.x.
[41] LIU J Y, YANG K, WU D, et al. Study on the interaction and gel properties of pork myofibrillar protein with konjac polysaccharides[J].Journal of the Science of Food and Agriculture, 2024, 104(4): 2284-2293. DOI:10.1002/jsfa.13116.
[42] ZHUANG X B, WANG L J, JIANG X P, et al. Insight into the mechanism of myofibrillar protein gel influenced by konjac glucomannan: moisture stability and phase separation behavior[J]. Food Chemistry, 2021, 339:127941. DOI:10.1016/j.foodchem.2020.127941.
[43] YUAN L, YU J M, MU J L, et al. Effects of deacetylation of konjac glucomannan on the physico-chemical properties of surimi gels from silver carp (Hypophthalmichthys molitrix)[J]. RSC Advances, 2019,9(34): 19828-19836. DOI:10.1039/c9ra03517f.
[44] ZHANG T, LI Z J, WANG Y M, et al. Effects of konjac glucomannan on heat-induced changes of physicochemical and structural properties of surimi gels[J]. Food Research International, 2016, 83: 152-161.DOI:10.1016/j.foodres.2016.03.007.
[45] ZHANG T, XUE Y, LI Z J, et al. Effects of deacetylation of konjac glucomannan on Alaska Pollock surimi gels subjected to hightemperature (120 ℃) treatment[J]. Food Hydrocolloids, 2015, 43: 125-131. DOI:10.1016/j.foodhyd.2014.05.008.
[46] YANG K, WANG H L, HUANG J, et al. Effects of direct current magnetic field treatment time on the properties of pork myofibrillar protein[J]. International Journal of Food Science & Technology, 2021,56(2): 733-741. DOI:10.1111/ijfs.14717.
[47] CHEN X, TUME R K, XU X L, et al. Solubilization of myofibrillar proteins in water or low ionic strength media: classical techniques, basic principles, and novel functionalities[J]. Critical Reviews in Food Science and Nutrition, 2017,57(15): 3260-3280. DOI:10.1080/10408398.2015.1110111.
[48] GORDON A, BARBUT S. Effect of chloride salts on protein extraction and interfacial protein film formation in meat batters[J].Journal of the Science of Food and Agriculture, 1992, 58(2): 227-238.DOI:10.1002/jsfa.2740580211.
[49] GAO Y F, LUO C, ZHANG J Y, et al. Konjac glucomannan improves the gel properties of low salt myofibrillar protein through modifying protein conformation[J]. Food Chemistry, 2022, 393: 133400.DOI:10.1016/j.foodchem.2022.133400.
[50] CHIN K B, GO M Y, XIONG Y L. Konjac flour improved textural and water retention properties of transglutaminase-mediated, heatinduced porcine myofibrillar protein gel: effect of salt level and transglutaminase incubation[J]. Meat Science, 2009, 81(3): 565-572.DOI:10.1016/j.meatsci.2008.10.012.
[51] SHI H B, KHAN I A, ZHONG H T, et al. Evaluation of partial saltreplacement with konjac glucomannan on chicken batters: edible quality and physicochemical properties of heat-set gel[J]. Food Chemistry, 2022, 387: 132952. DOI:10.1016/j.foodchem.2022.132952.
[52] LIMPISOPHON K, IGUCHI H, TANAKA M, et al. Cryoprotective effect of gelatin hydrolysate from shark skin on denaturation of frozen surimi compared with that from bovine skin[J]. Fisheries Science,2015, 81(2): 383-392. DOI:10.1007/s12562-014-0844-5.
[53] LIU J H, WANG X P, DING Y T. Optimization of adding konjac glucomannan to improve gel properties of low-quality surimi[J].Carbohydrate Polymers, 2013, 92(1): 484-489. DOI:10.1016/j.carbpol.2012.08.096.
[54] WU W J, QUE F, LI X H, et al. Effects of enzymatic konjac glucomannan hydrolysates on textural properties, microstructure, and water distribution of grass carp surimi gels[J]. Foods, 2022, 11(5): 750.DOI:10.3390/foods11050750.
[55] ZHU S C, WEI C S, JIN Y, et al. The fabrication and characterisation of surimi gel modified by konjac glucomannan with the different hydrolysis degree[J]. International Journal of Food Science &Technology, 2023, 58(2): 766-776. DOI:10.1111/ijfs.16228.
[56] LIU J H, FANG C H, LUO Y H, et al. Effects of konjac oligoglucomannan on the physicochemical properties of frozen surimi from red gurnard (Aspitrigla cuculus)[J]. Food Hydrocolloids, 2019, 89:668-673. DOI:10.1016/j.foodhyd.2018.10.056.
[57] 郭兵兵, 胡澳, 陈梦婷, 等. 魔芋葡甘聚糖对鱼糜抗冻机理和品质特性的研究进展[J]. 现代食品科技, 2025, 41(1): 331-342.DOI:10.13982/j.mfst.1673-9078.2025.1.0790.
[58] 王强, 周雅琳, 赵欣, 等. 脂肪替代品在低脂肉制品中的研究进展[J]. 食品工业科技, 2013, 34(12): 347-352. DOI:10.13386/j.issn1002-0306.2013.12.048.
[59] KIM D H, SHIN D M, SEO H G, et al. Effects of konjac gel with vegetable powders as fat replacers in frankfurter-type sausage[J].Asian-Australasian Journal of Animal Sciences, 2019, 32(8): 1195-1204. DOI:10.5713/ajas.18.0781.
[60] JIMÉNEZ-COLMENERO F, COFRADES S, HERRERO A M, et al.Konjac gel fat analogue for use in meat products: comparison with pork fats[J]. Food Hydrocolloids, 2012, 26(1): 63-72. DOI:10.1016/j.foodhyd.2011.04.007.
[61] JIMENEZ-COLMENERO F, COFRADES S, HERRERO A M,et al. Konjac gel for use as potential fat analogue for healthier meat product development: effect of chilled and frozen storage[J].Food Hydrocolloids, 2013, 30(1): 351-357. DOI:10.1016/j.foodhyd.2012.06.015.
[62] CHEN J X, ZHAO J H, LI X, et al. Composite gel fabricated with konjac glucomannan and carrageenan could be used as a cube fat substitute to partially replace pork fat in Harbin dry sausages[J].Foods, 2021, 10(7): 1460. DOI:10.3390/foods10071460.
[63] 余依敏, 夏强, 杨林林, 等. 魔芋葡甘聚糖-可得然胶共混凝胶替代动物脂肪对乳化肠品质特性的影响[J]. 食品科学, 2021, 42(16): 46-53.DOI:10.7506/spkx1002-6630-20210304-046.
[64] GENG X Y, ZHAO Y, ZHAO N, et al. Quality characteristics and gastrointestinal fate of low fat emulsified sausage formulated with konjac glucomannan/oat β-glucan composite hydrogel[J]. International Journal of Biological Macromolecules, 2023, 239: 124251.DOI:10.1016/j.ijbiomac.2023.124251.
[65] TAN Z F, YANG X Q, WANG Z M, et al. Konjac glucomannanassisted fabrication of stable emulsion-based oleogels constructed with pea protein isolate and its application in surimi gels[J]. Food Chemistry, 2024, 443: 138538. DOI:10.1016/j.foodchem.2024.138538.
[66] REN Y Q, WEI L, YOONG J H, et al. Effect of variation in basic emulsion structure and polysaccharide content on the physicochemical properties and structure of composite-based emulsion gels as cube fat mimetics[J]. Food Chemistry, 2024, 434: 137450. DOI:10.1016/j.foodchem.2023.137450.
[67] SALCEDO-SANDOVAL L, COFRADES S, RUIZ-CAPILLAS C, et al.Konjac-based oil bulking system for development of improved-lipid pork patties: technological, microbiological and sensory assessment[J].Meat Science, 2015, 101: 95-102. DOI:10.1016/j.meatsci.2014.11.010.
[68] DEEN A, VISVANATHAN R, WICKRAMARACHCHI D, et al.Chemical composition and health benefits of coconut oil: an overview[J]. Journal of the Science of Food and Agriculture, 2021,101(6): 2182-2193. DOI:10.1002/jsfa.10870.
[69] HUANG L, REN Y Q, LI H, et al. Create fat substitute from soybean protein isolate/konjac glucomannan: the impact of the protein and polysaccharide concentrations formulations[J]. Frontiers in Nutrition,2022, 9: 843832. DOI:10.3389/fnut.2022.843832.
[70] WEI L, REN Y Q, HUANG L, et al. Quality, thermo-rheology, and microstructure characteristics of cubic fat substituted pork patties with composite emulsion gel composed of konjac glucomannan and soy protein isolate[J]. Gels, 2024, 10(2): 111. DOI:10.3390/gels10020111.
[71] SHANG L C, WANG Y, REN Y Y, et al. In vitro gastric emptying characteristics of konjac glucomannan with different viscosity and its effects on appetite regulation[J]. Food & Function, 2020, 11(9): 7596-7610. DOI:10.1039/D0FO01104E.
[72] GUO L P, GOFF H D, CHEN M S, et al. The hydration rate of konjac glucomannan after consumption affects its in vivo glycemic response and appetite sensation and in vitro digestion characteristics[J].Food Hydrocolloids, 2022, 122: 107102. DOI:10.1016/j.foodhyd.2021.107102.
[73] CHEN H H, NIE Q X, HU J L, et al. Hypoglycemic and hypolipidemic effects of glucomannan extracted from konjac on type 2 diabetic rats[J]. Journal of Agricultural and Food Chemistry, 2019, 67(18):5278-5288. DOI:10.1021/acs.jafc.9b01192.
[74] SHANG W T, LI H X, STRAPPE P, et al. Konjac glucomannans attenuate diet-induced fat accumulation on livers and its regulation pathway[J]. Journal of Functional Foods, 2019, 52: 258-265.DOI:10.1016/j.jff.2018.11.006.
[75] CHEN W J, LI S, ALBAHI A, et al. The effect of konjac glucomannan on enzyme kinetics and fluorescence spectrometry of digestive enzymes: an in vitro research from the perspective of macromolecule crowding[J]. Food Research International, 2024, 184: 114247.DOI:10.1016/j.foodres.2024.114247.
[76] JIN H, XIA P K, DENG Z C, et al. Effects of konjac glucomannan on weight management and liver health: insights from liver lipidomics in obese and nonobese mice[J]. Journal of Agricultural and Food Chemistry, 2024, 72(14): 7906-7918. DOI:10.1021/acs.jafc.3c09540.
[77] ZENG X M, LÜ B W, ZHU Y, et al. Influence of hydrophilic polysaccharide fat replacers on the in vitro digestibility of protein in emulsion-type sausage[J]. Food Research International, 2023, 170:113008. DOI:10.1016/j.foodres.2023.113008.
[78] YU X, WANG X X, ZOU L F, et al. Insights into the in vitro digestibility of pork myofibrillar protein with different ionic polysaccharides from the perspective of gel characteristics[J]. Food Chemistry, 2023, 426: 136520. DOI:10.1016/j.foodchem.2023.136520.
[79] YU X, NIE W, CHEN X, et al. Anionic polysaccharides benefit the bioavailability of pork myofibrillar protein gels: evidence from a perspective of protein absorption and metabolism[J]. International Journal of Biological Macromolecules, 2024, 263: 130246.DOI:10.1016/j.ijbiomac.2024.130246.
[80] HUANG C Y, BLECKER C, WEI X R, et al. Effects of different plant polysaccharides as fat substitutes on the gel properties,microstructure and digestion characteristics of myofibrillar protein[J]. Food Hydrocolloids, 2024, 150: 109717. DOI:10.1016/j.foodhyd.2023.109717.
[81] MELZENER L, VERZIJDEN K E, BUIJS A J, et al. Cultured beef:from small biopsy to substantial quantity[J]. Journal of the Science of Food and Agriculture, 2021, 101(1): 7-14. DOI:10.1002/jsfa.10663.
[82] 王睿, 彭郁, 单子明, 等. 植物基肉制品的减钠策略研究进展[J].食品科学, 2024, 45(24): 367-376. DOI:10.7506/spkx1002-6630-20240612-078.
[83] 欧雨嘉, 郑明静, 曾红亮, 等. 植物蛋白肉研究进展[J]. 食品与发酵工业, 2020, 46(12): 299-305. DOI:10.13995/j.cnki.11-1802/ts.023823.
[84] 张田, 黄雨洋, 刘琳琳, 等. 多糖对高水分挤压植物蛋白肉结构及品质影响的研究进展[J]. 食品科学, 2024, 45(22): 341-350.DOI:10.7506/spkx1002-6630-20231127-223.
[85] ZHAO Y, SUI W J, ZHANG J X, et al. Intervening effect of polysaccharides on structured soy-based meat analogs by highmoisture extrusion[J]. Food and Bioprocess Technology, 2025, 18(1):648-661. DOI:10.1007/s11947-024-03492-z.
[86] SUN D Y, WU M, ZHANG T, et al. Conformational changes and physicochemical attributes of texturized pea protein isolate-konjac gum: with a new perspective of residence time during extrusion[J].Food Research International, 2023, 165: 112500. DOI:10.1016/j.foodres.2023.112500.
[87] XIA S G, SONG J, LI K, et al. Yeast protein-based meat analogues:konjac glucomannan induces the fibrous structure formation by modifying protein structure[J]. Food Hydrocolloids, 2023, 142:108798. DOI:10.1016/j.foodhyd.2023.108798.
[88] BOHRER B M. An investigation of the formulation and nutritional composition of modern meat analogue products[J]. Food Science and Human Wellness, 2019, 8(4): 320-329. DOI:10.1016/j.fshw.2019.11.006.
[89] YULIARTI O, NG L, KOH W M, et al. Structural properties of meat analogue with added konjac gels[J]. Food Hydrocolloids, 2023, 142:108716. DOI:10.1016/j.foodhyd.2023.108716.
[90] RAN X L, LOU X W, ZHENG H Q, et al. Improving the texture and rheological qualities of a plant-based fishball analogue by using konjac glucomannan to enhance crosslinks with soy protein[J].Innovative Food Science & Emerging Technologies, 2022, 75: 102910.DOI:10.1016/j.ifset.2021.102910.
[91] MAJZOOBI M, TALEBANFAR S, ESKANDARI M H, et al.Improving the quality of meat-free sausages using κ-carrageenan,konjac mannan and xanthan gum[J]. International Journal of Food Science & Technology, 2017, 52(5): 1269-1275. DOI:10.1111/ijfs.13394.
[92] LEVI S, YEN F C, BARUCH L, et al. Scaffolding technologies for the engineering of cultured meat: towards a safe, sustainable, and scalable production[J]. Trends in Food Science & Technology, 2022, 126: 13-25. DOI:10.1016/j.tifs.2022.05.011.
[93] NG S, KURISAWA M. Integrating biomaterials and food biopolymers for cultured meat production[J]. Acta Biomaterialia, 2021, 124: 108-129. DOI:10.1016/j.actbio.2021.01.017.
[94] TANG X, DENG G L, YANG L, et al. Konjac glucomannanfibrin composite hydrogel as a model for ideal scaffolds for cellculture meat[J]. Food Research International, 2024, 187: 114425.DOI:10.1016/j.foodres.2024.114425.
[95] 王媛. 基于大豆蛋白/魔芋多糖各向异性凝胶支架制备细胞培养肉[D]. 南昌: 南昌大学, 2024: 32-44. DOI:10.27232/d.cnki.gnchu.2024.002288.
[96] GU X, HUA S Y, HUANG Y Q, et al. κ-Carrageenan/konjac glucomannan composite hydrogel-based 3D porcine cultured meat production[J]. Food Hydrocolloids, 2024, 151: 109765. DOI:10.1016/j.foodhyd.2024.109765.
[97] JIANG S, SHANG L C, LIANG H S, et al. Preparation of konjac glucomannan/xanthan gum/sodium alginate composite gel by freezing combining moisture regulation[J]. Food Hydrocolloids, 2022, 127:107499. DOI:10.1016/j.foodhyd.2022.107499.
[98] LIU S Q, ZHAO D, SUN L Y, et al. Investigation into the fabrication of plant-based simulant connective tissue utilizing algae polysaccharidederived hydrogel[J]. International Journal of Biological Macromolecules,2024, 273: 133126. DOI:10.1016/j.ijbiomac.2024.133126.
[99] WANG Q, ZHANG Q, WANG G Y, et al. Muscle-inspired anisotropic hydrogel strain sensors[J]. ACS Applied Materials & Interfaces, 2022,14(1): 1921-1928. DOI:10.1021/acsami.1c18758.
[100] YANG J Y, JIANG S, ZHU S J, et al. Konjac glucomannan/xanthan gum/sodium alginate composite hydrogel simulates fascial tissue by pre-stretching and moisture regulation[J]. International Journal of Biological Macromolecules, 2023, 239: 124253. DOI:10.1016/j.ijbiomac.2023.124253.
[101] YANG J Y, ZHU S J, REN W W, et al. Constructing gellan gum/konjac glucomannan/wheat fiber composite hydrogel to simulate edible cartilage by ionic cross-link and moisture regulation[J]. Food Research International, 2024, 187: 114329. DOI:10.1016/j.foodres.2024.114329.
[102] 杨镕, 臧一宇, 吴鹏, 等. 多糖类食品胶体的功能特性及其在食品加工中的应用研究进展[J]. 食品科学, 2024, 45(5): 283-292.DOI:10.7506/spkx1002-6630-20230410-083.