随着生活水平的提高,消费者对肉制品品质的要求也越来越严格,不仅关注肉制品的质量安全和营养价值,对其口感、外观等感官品质也有较高的要求。牛肉干属于肉干产品之一,以其方便食用、保质期长、营养丰富等特点深受消费者欢迎。一般来说,品质理想的牛肉干具有质地柔韧、色泽优良及风味醇厚的特点[1]。肉嫩度受多种因素影响,其中结缔组织的分布及性质、其与肌肉蛋白质分子之间的相互作用力、肌原纤维蛋白的结构和状态是影响肌肉嫩度的主要因素[2]。
蛋白酶可为生物体提供必需的营养物质,也被认为是改善食品品质的有效介质,它可将大分子的蛋白质分解成较小的蛋白胨、多肽及游离氨基酸,这些物质具有较高的活性,在动物内脏、植物茎叶、果实和微生物中广泛存在[3]。蛋白酶能够分解肉制品肌原纤维和结缔组织中的蛋白质,将其降解为小分子的多肽甚至氨基酸,使肌肉丝断裂,从而达到嫩化的目的[4]。超声波是一种机械波,通过将电能转化为机械能实现能量传递,主要以空化效应、机械效应和热效应发挥作用,其传播速度受介质性质的显著影响[5]。王文艳等[6]利用超声波辅助菠萝蛋白酶对牛肉品质进行改善,结果表明,牛肉嫩度及肌原纤维小片化指数(myofibril fragmentation index,MFI)显著升高。廖林[7]的研究结果表明,超声波辅助复合蛋白酶可以破坏冬菜扣肉的纤维结构,使蛋白间隙增大,且能增加挥发性风味物质的种类和含量。因此,利用超声波辅助复合酶对牛肉干品质进行改善具有可行性,可为研制风味独特且口感俱佳的新型产品提供思路。
为适应不同消费群体的需求及扩大牛肉干消费市场,本研究采用超声波协同复合蛋白酶技术对牛肉干进行嫩化处理,通过对其蛋白理化性质及风味进行分析,探究该方法对牛肉干品质的提升机制,以期为肉干制品的嫩化提供更多的研究思路和方法。
1 材料与方法
1.1 材料与试剂
牛后腿肉 呼和浩特市特牛食品有限公司;生抽、料酒、酱油 海天食品有限公司;生姜粉、桂皮、五香粉、黑胡椒粉、白砂糖、大葱、盐 市售。
菠萝蛋白酶(5×105 U/g)、木瓜蛋白酶(8×105 U/g)大连美仑生物科技有限公司;磷酸氢二钾、磷酸氢二钠(均为分析纯) 天津市鑫铂特化工有限公司;氯化钠、盐酸、氢氧化钠、氯化镁、尿素、β-疏基乙醇、戊二醇、亚硝酸钠、乙二醇双(2-氨基乙基醚)四乙酸(ethylene glycol bis(2-aminoethylether)-N,N,N’,N’-tetraacetic acid,EGTA)(均为分析纯)国药集团化学试剂有限公司。
1.2 仪器与设备
GZX-9246MBE数显鼓风干燥箱 上海博迅实业有限公司医疗设备厂;ZXMP-A1430恒温恒湿箱 上海智城分析仪器制造有限公司;SYNERGY高速冷冻离心机、SYNERGY H1酶标仪 美国伯腾仪器有限公司;JXFSTPRP-CLN全自动样品冷冻研磨仪 上海净信实业发展有限公司;VORTEX 2漩涡振荡器德国IKA公司;ISENSQ电子鼻 上海瑞玢智能科技有限公司;8890-7000D GC-TQ气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪 美国安捷伦科技有限公司;Regulus 8230场发射扫描电子显微镜、MC1000离子溅射仪、ZM CPD300全自动临界点干燥仪 日本日立公司;UCM-30K超声波清洗机 上海皓庄仪器有限公司。
1.3 方法
1.3.1 牛肉干制作工艺流程及操作要点
牛肉干制作工艺流程:无筋膜牛腱子肉→辅料腌制→超声波处理→蛋白酶嫩化→恒温烘干→恒温烤制→成品。
操作要点:1)原料肉预处理:选择精瘦牛后腿肉作为实验原材料,清洗切块,剔除牛肉表面、内部筋膜及脂肪块,以避免其他因素带来的误差,顺着肌肉纤维方向切成3 cm×2 cm×2 cm形状规整、大小均匀的肉条。2)腌制:以牛肉质量计,加入质量分数5%生抽、5%料酒、5%酱油、2%生姜粉、2%桂皮、2%五香粉、5%黑胡椒粉、5%白砂糖、2%大葱、5%盐,在4 ℃条件下腌制12 h。亚硝酸盐按GB 2760—2014《食品安全国家标准 食品添加剂使用标准》中的限量进行添加。3)超声及嫩化:将预实验优化筛选出的复合蛋白酶缓冲液(200 U/g,木瓜蛋白酶与菠萝蛋白酶质量比1∶2),按5 mL/100 g(以牛肉质量计)采用均匀注射法打入牛肉中,酶的添加量为牛肉质量的0.04%,滚揉5 min,600 W、40 kHz超声30 min,于51 ℃条件下嫩化3.1 h。样品被分为3 组:空白组(未经复配蛋白酶和超声处理)、复合蛋白酶组(只添加复配蛋白酶嫩化)、超声蛋白酶组(超声协同复合酶嫩化)。4)烘干:牛肉经腌制、嫩化后,将其悬挂于电热恒温干燥箱中,90 ℃烘干3 h。5)烤制:在165 ℃条件下烤制25 min,得到牛肉干成品。
1.3.2 牛肉干肌原纤维蛋白特性测定
1.3.2.1 牛肉干肌原纤维蛋白溶解度测定
参考李文博等[8]的方法。称取3 g样品,加入10 倍体积的缓冲液A(0.1 mol/L氯化钾、0.002 mol/L氯化镁、0.002 mol/L EGTA、0.02 mol/L磷酸氢二钾,pH 6.8),冰浴匀浆后于2 000 r/min、4 ℃离心15 min,取沉淀,用8 倍体积的缓冲液B(0.1 mol/L氯化钾、0.002 mol/L氯化镁、0.002 mol/L EGTA、0.02 mol/L磷酸氢二钾、10%(V/V)Triton X-100,pH 6.8)洗涤2 次,再用0.1 mol/L氯化钾溶液洗涤2 次,得到的沉淀即为肌原纤维蛋白,并用考马斯亮蓝法测定蛋白含量。将上述肌原纤维蛋白用磷酸盐缓冲液C(0.6 mol/L氯化钠、0.05 mol/L磷酸氢二钠,pH 6.25)调整至质量浓度5 mg/mL,取适量置于离心管中,在5 500 r/min、4 ℃条件下离心15 min,随后测定上清液蛋白质量浓度,上述步骤重复3 次。溶解度按式(1)计算:

1.3.2.2 牛肉干肌原纤维蛋白表面疏水性测定
准确称取0.6 g切碎的肉样,加入20 mL 20 mmol/L磷酸盐缓冲液(pH 6.0),均质(10 000 r/min,10 s)2 次,立即吸取1 mL匀浆液与100 μL溴酚蓝涡旋混合30 s,并以1 mL磷酸盐缓冲液中添加100 μL溴酚蓝为对照,振荡器振荡(400 r/min、20 min),4 ℃、4 000 r/min离心15 min,取0.5 mL上清液与4.5 mL磷酸盐缓冲液涡旋混合,混合液于595 nm波长处测定吸光度,以磷酸盐缓冲液作为空白对照[9],上述步骤重复3 次。以溴酚蓝结合量表示牛肉干肌原纤维蛋白表面疏水性,按式(2)计算:
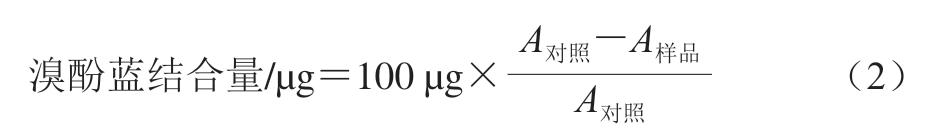
1.3.2.3 牛肉干肌原纤维蛋白MFI测定
将肌原纤维蛋白质量浓度调整至(0.50±0.05)mg/mL,定量吸取200 μL溶液,于540 nm波长处测定光密度(OD540 nm),上述步骤重复3 次。MFI按式(3)计算:
1.3.2.4 牛肉干肌原纤维蛋白分子间作用力测定
参考Ai Minmin[10]、董园园[11]等的方法并稍作修改。称取1 g切碎的肉样于离心管中,添加10 mL A1提取液(0.6 mol/L NaCl),于10 000 r/min条件下冰浴匀浆10 s,在4 ℃冰箱静置1 h,后于4 ℃、10 000 r/min离心25 min。向沉淀中依次加入A2(1.5 mol/L尿素+0.6 mol/L NaCl)、A3(8 mol/L尿素+0.6 mol/L NaCl)、A4(0.5 mol/L β-巯基乙醇+8 mol/L尿素+0.6 mol/L NaCl),以上述条件进行操作,向上清液中分别加入等体积20 g/100 mL三氯乙酸溶液,混合涡旋30 s,4 000 r/min、4 ℃离心15 min,去除上清液,向沉淀中加入1 mL 1 mol/L NaOH溶液,混合,置于4 ℃冰箱至沉淀溶解,采用考马斯亮蓝法测定蛋白质含量。结果以溶解的蛋白在总蛋白中的质量分数表示,A1、A2、A3、A4分别代表离子键、氢键、疏水相互作用和二硫键,上述步骤重复3 次。
1.3.2.5 牛肉干微观结构观察
使用场发射扫描电子显微镜观察牛肉干的微观结构,参考夏秀芳等[12]的方法制备样品,并稍作修改。将牛肉干样品切片(3 cm×3 cm×3 mm),浸泡于2.5%戊二醛-0.1 mol/L磷酸盐缓冲液(pH 7.2)中,4 ℃条件下固定24 h。使用体积分数50%、60%、70%、80%、90%、95%乙醇溶液和无水乙醇分别脱水10 min后,进行临界点干燥。将样品安装在带有双面胶带的支架上,使用离子溅射装置溅射镀金。加速电压15 kV,工作距离25 mm,分别放大100、500 倍进行观察。
1.3.3 牛肉干风味物质检测
1.3.3.1 牛肉干风味物质的电子鼻测定
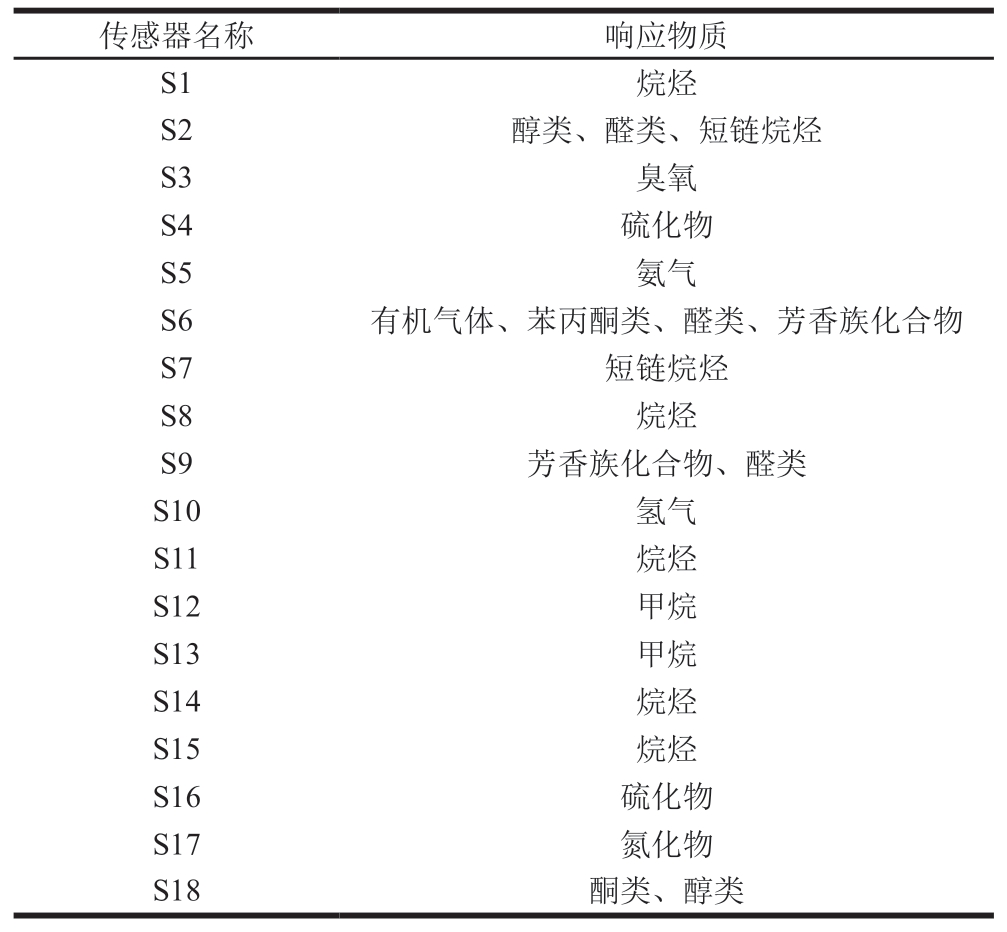
参照Tang Tiantian等[13]的方法,将5 g牛肉干置于特定的玻璃瓶中,于35 ℃烘箱中加热30 min,以富集风味化合物。空气流量1 L/min,清洗时间120 s,采样时间60 s。各传感器名称及对应的响应物质如表1所示。
表1 化学传感器及对应响应物质
Table 1 Performance description of electronic nose sensors
传感器名称响应物质S1烷烃S2醇类、醛类、短链烷烃S3臭氧S4硫化物S5氨气S6有机气体、苯丙酮类、醛类、芳香族化合物S7短链烷烃S8烷烃S9芳香族化合物、醛类S10氢气S11烷烃S12甲烷S13甲烷S14烷烃S15烷烃S16硫化物S17氮化物S18酮类、醇类
1.3.3.2 牛肉干挥发性风味物质种类及相对含量测定
参照罗玉龙等[14]的方法并稍作改动。采用固相微萃取法,称取3 g肉样于10 mL样品瓶中,将老化的萃取头插入样品瓶距离样品1 cm处,在60 ℃条件下吸附45 min后取出,并插入GC进样口,在250 ℃条件下解吸4 min。GC条件:HP-5MS色谱柱(30 mm×0.25 mm,0.25 μm),不分流进样,接口温度250 ℃,柱流量2 mL/min,柱箱升温程序:初始温度40 ℃,保持3 min,以4 ℃/min升温至150 ℃,保持1 min,以5 ℃/min升温至200 ℃,保持10 min,以20 ℃/min升温至230 ℃,保持5 min。MS条件:传输线温度250 ℃,离子源温度250 ℃,电子电离源,电子能量70 eV,溶剂延迟1 min,全扫描模式,扫描范围m/z 30~400,扫描时间200 ms。
将总离子流色谱图中的每个峰于Meanlib、NISTDemo和WileyLibrary数据库检索定性,以匹配度大于800作为鉴定依据,根据离子流色谱图峰面积,按照峰面积归一化法计算样品挥发性风味物质的相对含量。
1.4 数据处理
实验数据以平均值±标准差表示。使用IBM SPSS Statistics 22软件处理数据、进行单因素方差分析,P<0.05视为具有显著性差异。使用OriginPro 2021、Simica软件、微生信平台作图。
2 结果与分析
2.1 超声波辅助蛋白酶对牛肉干肌原纤维蛋白特性的影响
2.1.1 超声波辅助蛋白酶对牛肉干肌原纤维蛋白水合特性及MFI的影响
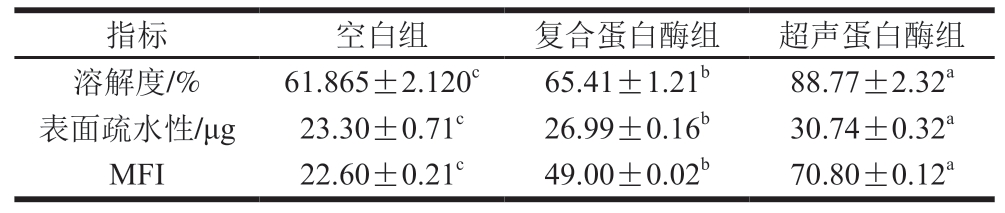
蛋白质在水中的分散程度主要以其溶解度表示,在一定程度上体现蛋白质氧化状态的同时,还可以表征蛋白质的变性情况[15]。溶解度不仅是评价蛋白质理化性质的重要指标,而且能反映乳化肉制品的乳化稳定性。如表2所示,2 组牛肉干的肌原纤维蛋白溶解度均与空白组存在显著差异(P<0.05),其中,复合蛋白酶组为65.41%,较空白组显著提升(P<0.05),这是由于蛋白酶对肌原纤维具有分解作用,蛋白质结构被破坏所导致的。超声蛋白酶组肌原纤维蛋白溶解度为88.77%,较空白组显著提升(P<0.05),这可能是由于超声波产生的空化效应对蛋白质结构具有强烈的破坏作用,并促进了蛋白酶深入牛肉干肌原纤维内部,蛋白质结构被严重破坏,大量疏水基团与亲水基团暴露,分子结构间的缝隙变大,继而提高了蛋白质与水分子的亲和力[16],从而促进蛋白质水合,并最终导致溶解度增加,即复合蛋白酶和超声波均能促进蛋白质溶解度的提高。
表2 超声波辅助蛋白酶对牛肉干肌原纤维蛋白水合特性及MFI的影响
Table 2 Effects of ultrasound combined with protease on hydration characteristics of myofibrillar protein and myofibril fragmentation index of beef jerky
注:同行小写字母不同表示差异显著(P<0.05)。表3同。
指标空白组复合蛋白酶组超声蛋白酶组溶解度/%61.865±2.120c65.41±1.21b88.77±2.32a表面疏水性/μg23.30±0.71c26.99±0.16b30.74±0.32a MFI22.60±0.21c49.00±0.02b70.80±0.12a
蛋白质表面疏水性反映了表面疏水氨基酸残基数量的变化[17],此外,表面疏水性是影响蛋白质功能特性和三级结构形成的重要因素,用于评估蛋白质去折叠的程度,并在蛋白质功能(包括乳化、起泡和凝胶化能力)中起重要作用[18]。3 组肌原纤维蛋白间表面疏水性存在显著差异(P<0.05),复合蛋白酶组表面疏水性较空白组提高15.84%,超声蛋白酶组较空白组与复合蛋白酶组分别提高31.93%、13.89%。这是由于蛋白酶与超声波处理可能会破坏肌原纤维蛋白的疏水相互作用和氢键[19],导致蛋白质构象解体。随着构象的展开,游离巯基和埋藏的疏水基团暴露,因此超声波辅助蛋白酶能促进牛肉干肌原纤维蛋白表面疏水性的提升。
MFI是评估肌肉组织肌原纤维完整性的参数,也是评估肉嫩度的重要指标,较高的MFI表明肌原纤维结构受到的损害更严重[20]。MFI也是衡量肌原纤维平均长度的指标,与肌原纤维和骨骼蛋白内部结构的破坏程度呈正相关[21]。复合蛋白酶组MFI较空白组显著提高116.81%(P<0.05),木瓜蛋白酶与菠萝蛋白酶能对牛肉肌肉纤维、消化结缔组织和肌肉蛋白进行分解,从达到嫩化的目的。超声蛋白酶组MFI较空白组提高213.27%,这是由于超声波的空化效应导致的。MFI的升高主要是由于微生物蛋白酶和内源蛋白酶在作用于肌肉蛋白时,肌原纤维间I带和Z线结合变弱直至断裂,肌原纤维间的连接蛋白被降解,肌肉结构遭到破坏,使肉的嫩度大幅提高,表现为MFI增大[22]。超声波除具有空化破碎作用外,还促进了酶制液在肌原纤维中的渗透,从而增强了蛋白酶的酶解效果。
2.1.2 超声波辅助蛋白酶对牛肉干肌原纤维蛋白分子间作用力的影响
根据肌原纤维蛋白在不同溶剂中的溶解度,可以确定蛋白质分子间的相互作用力,有助于探明蛋白质结构的稳定性。尿素用于破坏氢键,NaCl用于破坏疏水相互作用,β-巯基乙醇可以切割二硫键[23]。离子键指阴离子与阳离子之间通过静电作用形成的一种化学键,离子键在稳定蛋白质的三、四级结构方面起着至关重要的作用。如图1所示,超声蛋白酶组离子键相对含量较空白组和复合蛋白酶组显著降低(P<0.05)。氢键是维持蛋白质二级结构的主要驱动力,氢键在蛋白质受热变性时发生断裂,起到稳定结合水、提高肉干硬度的作用[24]。疏水相互作用和二硫键在稳定蛋白质构象中起着重要作用[25]。3 组之间氢键相对含量存在显著差异,且超声蛋白酶组显著低于其他2 组(P<0.05)。蛋白酶的添加与超声波辅助破坏了蛋白质的二、三级结构,这可能导致蛋白质结构的去折叠并从原始有序结构转变为无序结构。超声蛋白酶组疏水相互作用相对含量与其他2 组存在显著差异(P<0.05),超声处理使疏水基团暴露在蛋白质表面,提高了超声蛋白酶组疏水相互作用的相对含量[26],这与牛肉干中表面疏水性基团暴露程度的实验结果一致。蛋白质氧化可诱导某些疏水性氨基酸暴露,从而增强蛋白质间的疏水相互作用。此外,含硫氨基酸很容易从二硫键氧化为分子内/分子间二硫键,从而提高二硫键的相对含量[27]。二硫键的形成被认为和巯基的变化高度相关,凝胶强度随巯基含量的增加而降低,巯基含量减少主要是由于蛋白质三级结构展开,位于肌原纤维蛋白内部的巯基暴露,游离的巯基受氧化作用形成二硫键[28]。超声蛋白酶组中二硫键相对含量显著高于其他2 组(P<0.05),而空白组与复合蛋白酶组间无显著差异,复合蛋白酶组略低于空白组。
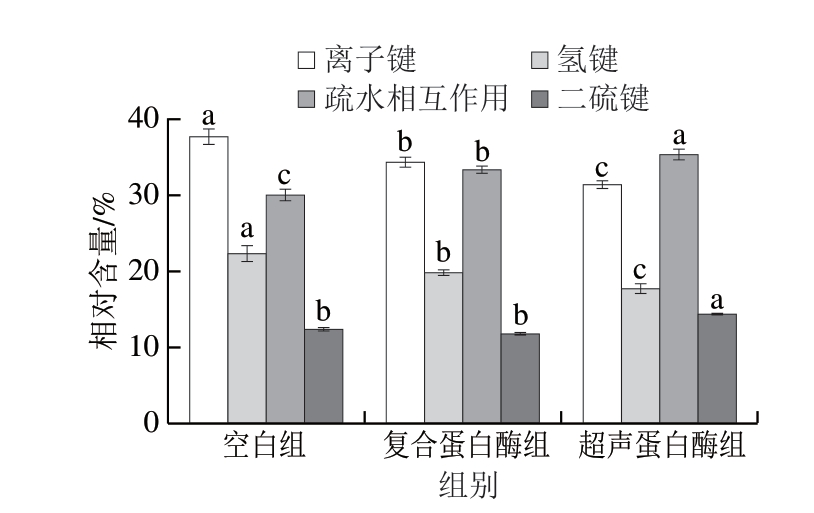
图1 超声波辅助蛋白酶对牛肉干肌原纤维蛋白分子间作用力的影响
Fig. 1 Effect of ultrasound combined with protease on intermolecular forces of myofibrillar protein from beef jerky
小写字母不同表示组间差异显著(P<0.05)。
2.1.3 超声波辅助蛋白酶对牛肉干微观结构的影响
肉类的微观结构直接反映肌肉结构的完整性变化,这对于分析肉类的物理性质具有重要意义[29]。如图2所示,空白组牛肉干纤维结构和肌膜结构比较紧密、完整,纤维间空隙较小。经复合酶处理后,肌原纤维缝隙变大,质地更松散,肌肉结构在一定程度上被破坏。酶解后的样品细胞破损严重,甚至出现内部组织状态凌乱、纤维结构疏松的现象。细胞纤维结构被破坏使牛肉干保水性提高,细胞严重破碎使MFI显著上升(P<0.05),与2.1.1节结果相吻合。超声波辅助促进牛肉肌原纤维进一步破裂,从而促进酶制液的进一步渗入,由于超声波的空化效应可以直接引起肌肉细胞完整性的破坏,使放大倍数×500下纤维结构均匀增大,结构更紧凑、致密,质地更均匀、细腻,且肌肉纤维也呈现典型的均匀、细腻三维立体网络结构,有助于捕获更多水分。

图2 超声波辅助蛋白酶对牛肉干微观结构的影响
Fig. 2 Effect of ultrasound combined with protease on the microstructure of beef jerky
2.2 牛肉干风味测定结果
2.2.1 电子鼻检测结果
电子鼻是一种旨在模仿人类嗅觉的设备,它由一系列传感器组成,用于检测复杂的气味,具有快速、简单、可靠和准确的优点,并已被验证可用于区分食品风味[30]。如图3所示,S1(烷烃)、S2(短链烷烃、醛类、醇类)、S9(醛类、芳香族化合物)、S14(烷烃)、S15(烷烃)、S16(硫化物)、S18(酮类、醇类)等传感器对每组样品均有明显的响应。因此,牛肉干样品中富含烷烃、醇类、醛类、芳香族化合物和硫化物等挥发性化合物。复合蛋白酶组和超声蛋白酶组的传感器信号响应值均高于空白组,表明超声辅助酶预处理能有效增加牛肉干的风味。
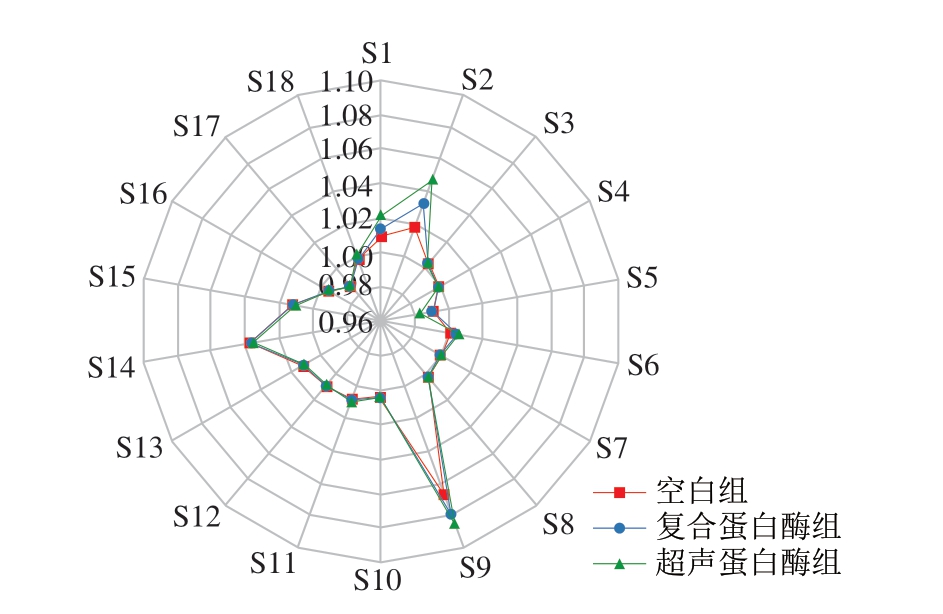
图3 牛肉干电子鼻响应值雷达图
Fig. 3 Radar plot of electronic nose response for beef jerkies
主成分分析(principal component analysis,PCA)可反映样本中挥发性气味丰度情况,样本之间位置越近则越相似,反之则差异越大。如图4所示,PC1和PC2的方差贡献率分别为78.90%、9.96%,累计方差贡献率达到88.86%,因此认为选取PC1、PC2分析样本具有较高的可靠性,复合蛋白酶组牛肉干样品的PCA结果与其他组明显不同,分别位于置信区间的两侧。从分布情况看,超声蛋白酶组、复合蛋白酶组及空白组牛肉干样本相距较远,说明3 组样品的风味差异较大。而每组牛肉干的3 个平行样品中,挥发性气味均有一定的离散性,说明组内样品间也存在一定的个体差异。
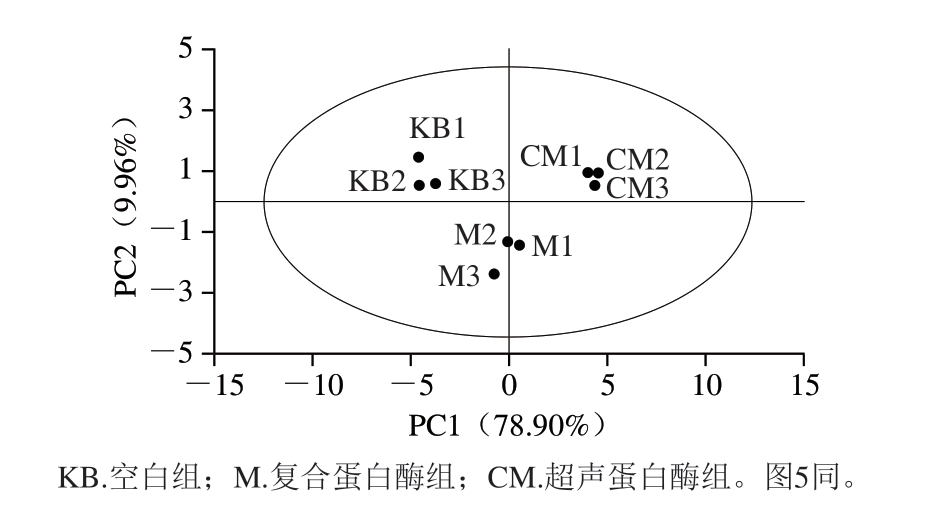
图4 牛肉干电子鼻测定结果PCA散点图
Fig. 4 Principal component analysis scatter plot of beef jerkies based on electronic nose signals
2.2.2 超声波辅助蛋白酶对牛肉干中挥发性风味物质的影响
风味是体现发酵肉制品感官特征的主要指标,而挥发性风味物质对肉制品的风味特征起决定性作用,在很大程度上决定了消费者对产品的偏好和接受度[31]。GC-MS是定性和定量检测食品中挥发性化合物最常用的技术。如表3所示,空白组、复合蛋白酶组、超声蛋白酶组牛肉干中分别鉴定出29、31、34 种挥发性风味物质,共45 种,包括11 种醇类、5 种醛类、17 种烃类、5 种酮类、1 种酚类、2 种酯类、1 种酸类、2 种醚类、1 种其他物质。
表3 超声辅助蛋白酶牛肉干中挥发性风味物质的种类及相对含量
Table 3 Relative contents of volatile flavor compounds in beef jerkies
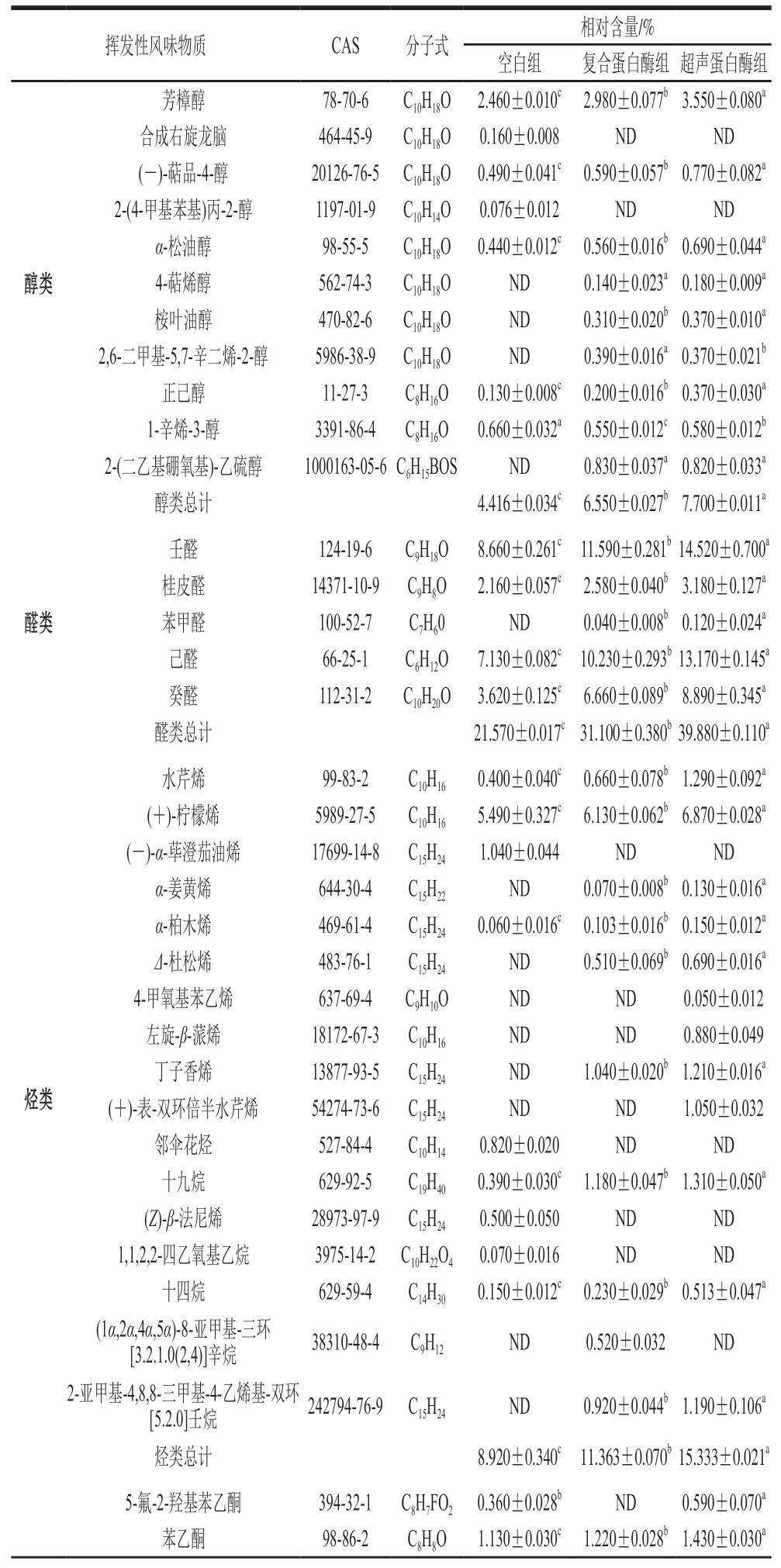
挥发性风味物质CAS分子式相对含量/%空白组复合蛋白酶组超声蛋白酶组醇类芳樟醇78-70-6C10H18O2.460±0.010c2.980±0.077b3.550±0.080a合成右旋龙脑464-45-9C10H18O0.160±0.008NDND(-)-萜品-4-醇20126-76-5C10H18O0.490±0.041c0.590±0.057b0.770±0.082a 2-(4-甲基苯基)丙-2-醇1197-01-9C10H14O0.076±0.012NDND α-松油醇98-55-5C10H18O0.440±0.012c0.560±0.016b0.690±0.044a 4-萜烯醇562-74-3C10H18OND0.140±0.023a0.180±0.009a桉叶油醇470-82-6C10H18OND0.310±0.020b0.370±0.010a 2,6-二甲基-5,7-辛二烯-2-醇5986-38-9C10H18OND0.390±0.016a0.370±0.021b正己醇11-27-3C8H16O0.130±0.008c0.200±0.016b0.370±0.030a 1-辛烯-3-醇3391-86-4C8H16O0.660±0.032a0.550±0.012c0.580±0.012b 2-(二乙基硼氧基)-乙硫醇1000163-05-6C6H15BOSND0.830±0.037a0.820±0.033a醇类总计4.416±0.034c6.550±0.027b7.700±0.011a醛类壬醛124-19-6C9H18O8.660±0.261c11.590±0.281b14.520±0.700a桂皮醛14371-10-9C9H8O2.160±0.057c2.580±0.040b3.180±0.127a苯甲醛100-52-7C7H60ND0.040±0.008b0.120±0.024a己醛66-25-1C6H12O7.130±0.082c10.230±0.293b13.170±0.145a癸醛112-31-2C10H20O3.620±0.125c6.660±0.089b8.890±0.345a醛类总计21.570±0.017c31.100±0.380b39.880±0.110a烃类水芹烯99-83-2C10H160.400±0.040c0.660±0.078b1.290±0.092a(+)-柠檬烯5989-27-5C10H165.490±0.327c6.130±0.062b6.870±0.028a(-)-α-荜澄茄油烯17699-14-8C15H241.040±0.044NDND α-姜黄烯644-30-4C15H22ND0.070±0.008b0.130±0.016a α-柏木烯469-61-4C15H240.060±0.016c0.103±0.016b0.150±0.012a Δ-杜松烯483-76-1C15H24ND0.510±0.069b0.690±0.016a 4-甲氧基苯乙烯637-69-4C9H10ONDND0.050±0.012左旋-β-蒎烯18172-67-3C10H16NDND0.880±0.049丁子香烯13877-93-5C15H24ND1.040±0.020b1.210±0.016a(+)-表-双环倍半水芹烯54274-73-6C15H24NDND1.050±0.032邻伞花烃527-84-4C10H140.820±0.020NDND十九烷629-92-5C19H400.390±0.030c1.180±0.047b1.310±0.050a(Z)-β-法尼烯28973-97-9C15H240.500±0.050NDND 1,1,2,2-四乙氧基乙烷3975-14-2C10H22O40.070±0.016NDND十四烷629-59-4C14H300.150±0.012c0.230±0.029b0.513±0.047a(1α,2α,4α,5α)-8-亚甲基-三环[3.2.1.0(2,4)]辛烷38310-48-4C9H12ND0.520±0.032ND 2-亚甲基-4,8,8-三甲基-4-乙烯基-双环[5.2.0]壬烷242794-76-9C15H24ND0.920±0.044b1.190±0.106a烃类总计8.920±0.340c11.363±0.070b15.333±0.021a 5-氟-2-羟基苯乙酮394-32-1C8H7FO20.360±0.028bND0.590±0.070a苯乙酮98-86-2C8H8O1.130±0.030c1.220±0.028b1.430±0.030a
续表3
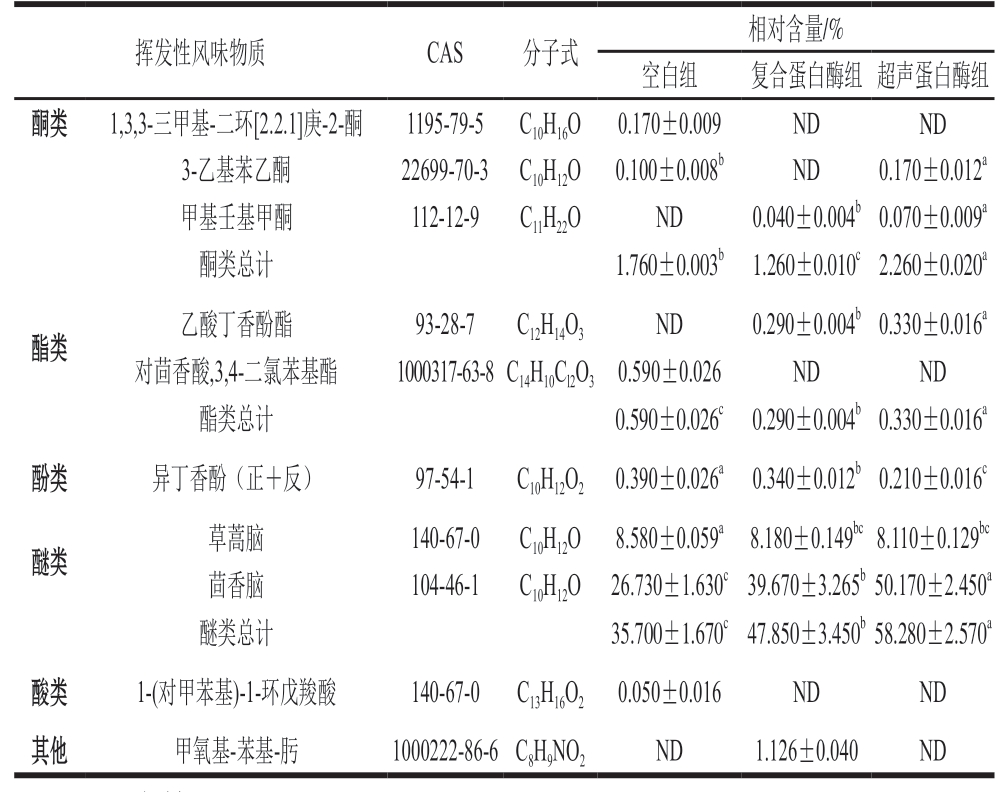
注:ND.未检出。
挥发性风味物质CAS分子式相对含量/%空白组复合蛋白酶组超声蛋白酶组酮类1,3,3-三甲基-二环[2.2.1]庚-2-酮1195-79-5C10H16O0.170±0.009NDND 3-乙基苯乙酮22699-70-3C10H12O0.100±0.008bND0.170±0.012a甲基壬基甲酮112-12-9C11H22OND0.040±0.004b0.070±0.009a酮类总计1.760±0.003b1.260±0.010c2.260±0.020a酯类乙酸丁香酚酯93-28-7C12H14O3ND0.290±0.004b0.330±0.016a对茴香酸,3,4-二氯苯基酯1000317-63-8C14H10Cl2O30.590±0.026NDND酯类总计0.590±0.026c0.290±0.004b0.330±0.016a酚类异丁香酚(正+反)97-54-1C10H12O20.390±0.026a0.340±0.012b0.210±0.016c醚类草蒿脑140-67-0C10H12O8.580±0.059a8.180±0.149bc8.110±0.129bc茴香脑104-46-1C10H12O26.730±1.630c39.670±3.265b50.170±2.450a醚类总计35.700±1.670c47.850±3.450b58.280±2.570a酸类1-(对甲苯基)-1-环戊羧酸140-67-0C13H16O20.050±0.016NDND其他甲氧基-苯基-肟1000222-86-6C8H9NO2ND1.126±0.040ND
3 组样品中醇类物质共11 种,包括芳樟醇、合成右旋龙脑、(-)-萜品-4-醇、2-(4-甲基苯基)丙-2-醇、α-松油醇、4-萜烯醇、桉叶油醇、2,6-二甲基-5,7-辛二烯-2-醇、正己醇、1-辛烯-3-醇、2-(二乙基硼氧基)-乙硫醇。在复合酶组和超声蛋白酶组中,芳樟醇相对含量相较于空白组分别显著提高至2.980%、3.550%(P<0.05),赋予牛肉干茉莉花香;(-)-萜品-4-醇相较于空白组显著提高至0.590%、0.770%(P<0.05),具有胡椒味;α-松油醇相较于空白组分别显著提高至0.560%、0.690%(P<0.05)。从经处理后的牛肉干中新检出4-萜烯醇、桉叶油醇、2,6-二甲基-5,7-辛二烯-2-醇,桉叶油醇赋予牛肉干草药香味。研究结果表明,超声辅助有助于醇类物质的产生。
醛类主要来源于氨基酸的热降解和脂肪的氧化分解,或来源于糖类的降解过程。在3 组牛肉干中检出壬醛、桂皮醛、苯甲醛、己醛、癸醛5 种醛类物质,具有脂肪香味,醛类是美拉德反应或脂质氧化反应中的重要中间体,可参与氨基酸与羰基之间的相互作用[32]。3 组牛肉干醛类物质相对含量分别为21.570%、31.100%、39.880%,复合蛋白酶处理和超声辅助蛋白酶处理使醛类物质相对含量显著增加(P<0.05)。而己醛、壬醛、癸醛因其感觉阈值低、含量相对较高,是牛肉干氧化过程中的关键挥发性风味化合物。壬醛通常呈清香与脂香,超声辅助蛋白酶处理促进了壬醛、癸醛相对含量的增加,从而增加了牛肉干的油脂香味。己醛是亚油酸和花生四烯酸的氧化产物,具有青草香、苹果香味。而壬醛则由亚油酸氧化产生,使牛肉干具有玫瑰香、柑橘香风味。同时,一些醛类来源于蛋白质氧化产生的羰基。特征苯甲醛由苯丙氨酸经Strecker降解反应而得,但苯甲醛会产生令人不愉快的味道,影响牛肉干的香气。
长链脂肪酸[33]或香料[34]是碳氢化合物的主要来源,包括烯烃和烷烃,主要由脂质自氧化产生。烃类是3 个处理组中种类最多的化合物,共17 种,包括水芹烯、(+)-柠檬烯、(-)-α-荜澄茄油烯、α-姜黄烯、α-柏木烯、Δ-杜松烯、4-甲氧基苯乙烯、左旋-β-蒎烯、丁子香烯、(+)-表-双环倍半水芹烯、邻伞花烃、十九烷、(Z)-β-法尼烯、十四烷、1,1,2,2-四乙氧基乙烷、(1α,2α,4α,5α)-8-亚甲基-三环[3.2.1.0(2,4)]辛烷、2-亚甲基-4,8,8-三甲基-4-乙烯基-双环[5.2.0]壬烷,空白组、复合蛋白酶组和超声蛋白酶组分别检出9、10、12 种。由于具有较高的气味阈值,单独的烃类化合物可能不会对肉制品的香气造成显著影响,除柠檬烯外,大部分烃类气味微弱,因此对牛肉干风味的贡献不大,水芹烯具有特别的薄荷香味。3 组牛肉干中烃类化合物相对含量分别为8.920%、11.363%、15.333%,超声波与复合蛋白酶处理促进了烃类物质种类增加及含量提升,这可能与脂质氧化程度的加深有关。
醚类物质能大幅增强牛肉干的风味,特别是有苯环的醚。3 组牛肉干中主要有2 种醚类,草蒿脑、茴香脑具有醇厚的甜味、茴香香气。超声蛋白酶组的醚类物质总相对含量显著高于空白组与复合蛋白酶组(P<0.05)。这可能是由于超声波处理会破坏牛肉肌肉纤维组织,使腌制辅料的渗透效率提高,从而增加醚类物质的含量[35]。酮类主要是脂质氧化和氨基酸降解的产物,具有较高的感觉阈值,大多具有果味和奶油香气,对肉制品的整体风味贡献不大[36]。牛肉干中的酮类物质为5-氟-2-羟基苯乙酮、苯乙酮、1,3,3-三甲基-二环[2.2.1]庚-2-酮、3-乙基苯乙酮、甲基壬基甲酮,具有浓郁的花香和果香。除此之外,还检出乙酸丁香酚酯、对茴香酸,3,4-二氯苯基酯2 种脂类,酯类是由醇类和羧酸通过酯化反应产生的,通常为食品提供良好的香气。其余共检出异丁香酚(正+反)1 种酚类物质和1-(对甲苯基)-1-环戊羧酸1 种酸类物质。其他化合物为甲氧基-苯基-肟,这类物质大多具有较高的气味阈值或较低的相对含量,对牛肉干风味影响不大。
聚类热图可将挥发性风味物质差异数据可视化。如图5所示,每行代表一个风味物质,每列代表一个样本。9 个样品的风味物质存在明显差异,这些特征被投射到热图上,并用于样本聚类。风味物质相对含量差异在3 组样品中具有明显区分,超声蛋白酶组相对含量较高的物质数量多于其他2 组,可见超声波与蛋白酶处理促进了挥发性风味物质的产生与含量增加。
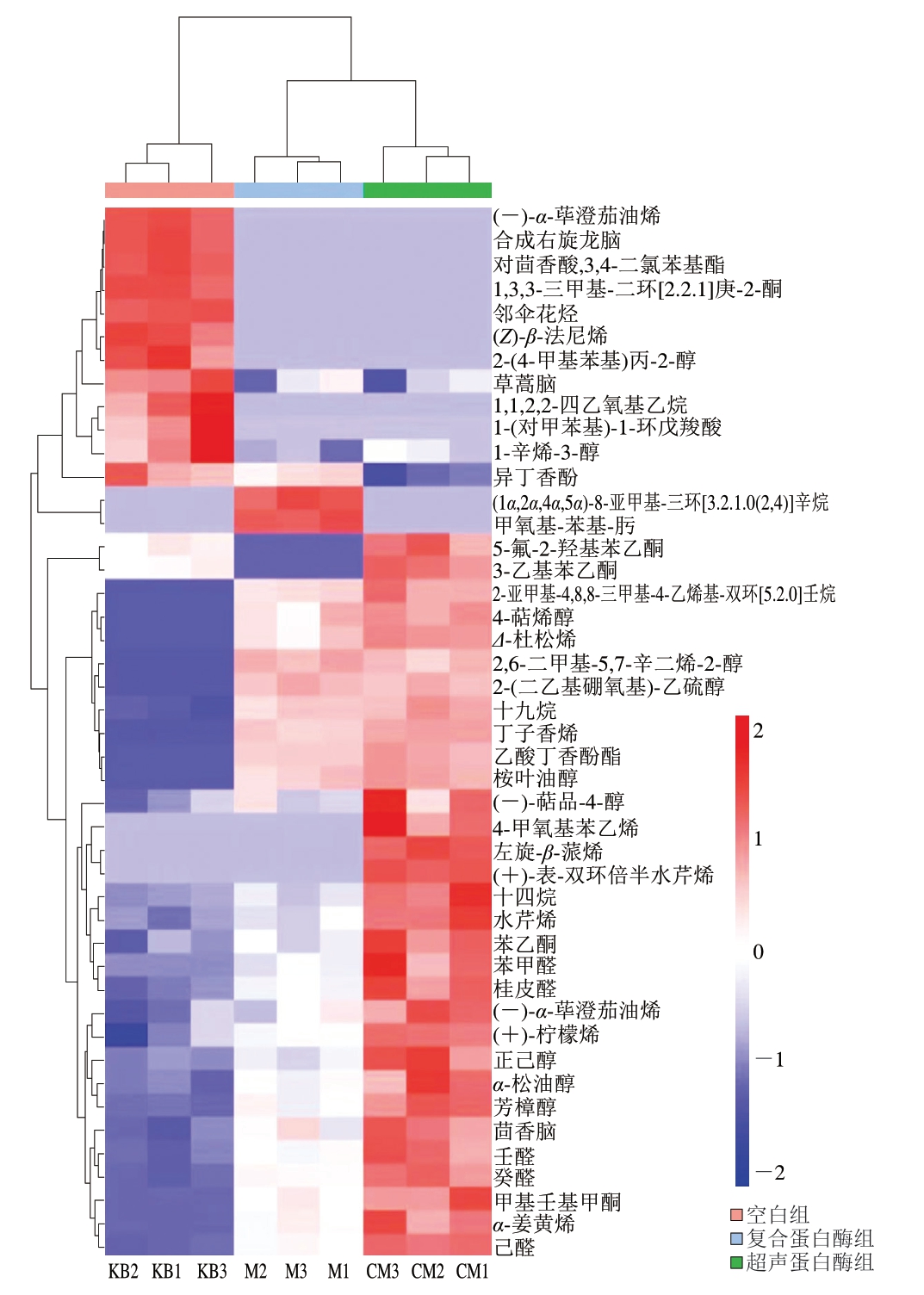
图5 超声辅助蛋白酶处理牛肉干中挥发性风味物质聚类热图
Fig. 5 Clustering heatmap of volatile flavor substances of beef jerkies
3 结论
本研究探索木瓜蛋白酶与菠萝蛋白酶复配后协同超声波技术对牛肉干肌原纤维蛋白理化性质、结构及风味的影响。研究结果表明,相较空白组,超声波辅助处理促使牛肉干肌原纤维蛋白溶解度及表面疏水性显著提升(P<0.05)。超声波处理破坏了牛肉的肌原纤维结构,肌原纤维蛋白MFI提高213.27%,促进蛋白酶的渗透,加快嫩化速率,提高牛肉干的嫩度。电子鼻18 个传感器可以很好地区分3 组牛肉干,超声蛋白酶组样品富含烷烃、醇类、醛类、芳香族化合物、含氮化合物和硫化合物等挥发性化合物。利用GC-MS技术对3 组牛肉干中挥发性风味物质进行测定,空白组、复合蛋白酶组、超声蛋白酶组牛肉干中分别鉴定出29、31、34 种挥发性风味物质,共鉴定出45 种风味物质,复合蛋白酶和超声蛋白酶处理均可增加牛肉干风味物质的种类与含量。同时,超声蛋白酶组的醛类、酮类和烃类等对牛肉干风味贡献大的风味物质相对含量均高于其他2 组,说明超声辅助蛋白酶处理可促进牛肉干香气形成。综上所述,超声波辅助可以促进复合酶酶解肌原纤维蛋白,从而改善牛肉干嫩度,对牛肉干肌原纤维蛋白结构造成显著影响,且可以促进牛肉干挥发性风味物质的形成,从而改善牛肉干品质。本研究期望为肉干制品的嫩化及开发风味独特的新型产品提供更多的研究思路和方法。
[1] HE J, JIA W Z, LIN Z H, et al. Improving the quality and processing efficiency of beef jerky via drying in confined conditions of prestretching[J]. Food Research International, 2023, 172: 113171.DOI:10.1016/j.foodres.2023.113171.
[2] ERTBJERG P, PUOLANNE E. Muscle structure, sarcomere length and influences on meat quality: a review[J]. Meat Science, 2017, 132:139-152. DOI:10.1016/j.meatsci.2017.04.261.
[3] NAVEENA B M, MENDIRATTA S K, ANJANEYULU A S R.Tenderization of buffalo meat using plant proteases from Cucumis trigonus Roxb (Kachri) and Zingiber officinale roscoe (Ginger rhizome)[J]. Meat Science, 2004, 68(3): 363-369. DOI:10.1016/j.meatsci.2004.04.004.
[4] 李永鹏, 余群力. 肉类成熟嫩化过程中的蛋白酶系及其作用[J]. 肉类研究, 2010, 24(5): 8-12. DOI:10.3969/j.issn.1001-8123.2010.05.004.
[5] 张曼君, 周春丽, 苏伟, 等. 超声波对果蔬及其制品品质影响的研究进展[J]. 食品研究与开发, 2024, 45(4): 186-193. DOI:10.12161/j.issn.1005-6521.2024.04.025.
[6] 王文艳, 陈睿璇, 魏贞, 等. 超声波辅助菠萝蛋白酶对牛肉嫩度的影响[J]. 食品科技, 2023, 48(6): 110-116. DOI:10.13684/j.cnki.spkj.2023.06.013.
[7] 廖林. 超声波辅助复合蛋白酶对冬菜扣肉加工工艺及品质特性的影响研究[D]. 重庆: 西南大学, 2023. DOI:10.27684/d.cnki.gxndx.2023.001569.
[8] 李文博, 罗玉龙, 郭月英, 等. 苏尼特羊宰后成熟过程中肌原纤维蛋白特性与肉品质的变化分析[J]. 食品科学, 2021, 42(3): 48-55.DOI:10.7506/spkx1002-6630-20191225-299.
[9] 周纷. 脂肪类型和脂肪酸饱和程度对猪肉蛋白质乳化特性的影响[D].锦州: 渤海大学, 2017.
[10] AI M M, ZHOU Q, GUO S G, et al. Effects of tea polyphenol and Ca(OH)2 on the intermolecular forces and mechanical, rheological,and microstructural characteristics of duck egg white gel[J]. Food Hydrocolloids, 2019, 94: 11-19. DOI:10.1016/j.foodhyd.2019.03.002.
[11] 董园园. 超声波辅助处理对牛肉干品质的影响[D]. 呼和浩特: 内蒙古农业大学, 2022. DOI:10.27229/d.cnki.gnmnu.2022.000229.
[12] 夏秀芳, 孔保华, 郭园园, 等. 反复冷冻-解冻对猪肉品质特性和微观结构的影响[J]. 中国农业科学, 2009, 42(3): 982-988. DOI:10.3864./j.issn.0578-1752.2009.03.029.
[13] TANG T T, ZHANG M, LIU Y P. Valorization of meat and bone residue by ultrasound and high voltage electrostatic field assisted two-stage enzymatic hydrolysis: nutritional characteristics and flavor analysis[J]. Food Bioscience, 2023, 56: 103203. DOI:10.1016/j.fbio.2023.103203.
[14] 罗玉龙, 赵丽华, 王柏辉, 等. 苏尼特羊不同部位肌肉挥发性风味成分和脂肪酸分析[J]. 食品科学, 2017, 38(4): 165-169. DOI:10.7506/spkx1002-6630-201704026.
[15] 刘冠绪, 肖宇, 张瑞, 等. 羊肉后熟过程中肌肉纤维结构变化及氧化特性[J]. 陕西师范大学学报(自然科学版), 2024, 52(1): 115-124.DOI:10.15983/j.cnki.jsnu.2024211.
[16] 李可, 李三影, 扶磊, 等. 低频高强度超声波对鸡胸肉肌原纤维蛋白性质的影响[J]. 食品科学, 2020, 41(23): 122-129. DOI:10.7506/spkx1002-6630-20191205-067.
[17] ZOU X L, KANG Z L, LI Y P, et al. Effect of sodium bicarbonate on solubility, conformation and emulsion properties of pale, soft and exudative meat myofibrillar proteins[J]. LWT-Food Science and Technology, 2022, 157: 113097. DOI:10.1016/j.lwt.2022.113097.
[18] KIM Y J, LEE M H, KIM S M, et al. Improvement of structural,physicochemical, and rheological properties of porcine myofibrillar proteins by high-intensity ultrasound treatment for application as Pickering stabilizers[J]. Ultrasonics Sonochemistry, 2023, 92: 106263.DOI:10.1016/j.ultsonch.2022.106263.
[19] AMIRI A, SHARIFIAN P, SOLTANIZADEH N. Application of ultrasound treatment for improving the physicochemical, functional and rheological properties of myofibrillar proteins[J]. International Journal of Biological Macromolecules, 2018, 111: 139-147.DOI:10.1016/j.ijbiomac.2017.12.167.
[20] CRUZ P L, PANNO P H C, DI GIORGIO GIANNOTTI J, et al.Effect of proteases from ginger rhizome on the fragmentation of myofibrils and tenderness of chicken breast[J]. LWT-Food Science and Technology, 2020, 120: 108921. DOI:10.1016/j.lwt.2019.108921.
[21] LI X, SUN Y Y, PAN D D, et al. The effect of CaCl2 marination on the tenderizing pathway of goose meat during conditioning[J].Food Research International, 2017, 102: 487-492. DOI:10.1016/j.foodres.2017.09.014.
[22] KOOHMARAIE M. Biochemical factors regulating the toughening and tenderization processes of meat[J]. Meat Science, 1996, 43: 193-201. DOI:10.1016/0309-1740(96)00065-4.
[23] DIAO X Q, GUAN H N, ZHAO X X, et al. Physicochemical and structural properties of composite gels prepared with myofibrillar protein and lard diacylglycerols[J]. Meat Science, 2016, 121: 333-341.DOI:10.1016/j.meatsci.2016.07.002.
[24] 刘芳芳, 林婉玲, 李来好, 等. 海鲈鱼糜加工及凝胶形成过程中蛋白质的变化机理[J]. 食品科学, 2020, 41(14): 15-22. DOI:10.7506/spkx1002-6630-20190620-232.
[25] LIU J, WANG Y, ZHU F X, et al. The effects of freezing under a highvoltage electrostatic field on ice crystals formation, physicochemical indices, and bacterial communities of shrimp (Solenocera melantho)[J]. Food Control, 2022, 142: 109238. DOI:10.1016/j.foodcont.2022.109238.
[26] KANG D C, ZOU Y H, CHENG Y P, et al. Effects of power ultrasound on oxidation and structure of beef proteins during curing processing[J].Ultrasonics Sonochemistry, 2016, 33: 47-53. DOI:10.1016/j.ultsonch.2016.04.024.
[27] WANG R, GUO F, ZHAO J Y, et al. Myofibril degradation and structural changes in myofibrillar proteins of porcine longissimus muscles during frozen storage[J]. Food Chemistry, 2024, 435: 137671.DOI:10.1016/j.foodchem.2023.137671.
[28] 梁恽红, 卢涵, 张香美. 蛋白二、三级结构对鱼糜凝胶质构和持水力的影响及其测定方法研究进展[J]. 东北农业大学学报, 2021,52(10): 87-96. DOI:10.19720/j.cnki.issn.1005-9369.2021.10.009.
[29] CHEN Z Y, WANG Y Y, GUO L N, et al. Application of multifrequency ultrasonic thawing on pork: thawing rate, quality properties and microstructure[J]. Food Physics, 2024, 1: 100002. DOI:10.1016/j.foodp.2023.100002.
[30] WEN R X, KONG B H, YIN X Y, et al. Characterisation of flavour profile of beef jerky inoculated with different autochthonous lactic acid bacteria using electronic nose and gas chromatography-ion mobility spectrometry[J]. Meat Science, 2022, 183: 108658. DOI:10.1016/j.meatsci.2021.108658.
[31] PATIL R A, ROBERTS S C. Implications of cellular heterogeneity on plant cell culture performance[M]//CHANDRA S, LATA H, VARMA A.Biotechnology for medicinal plants. Berlin: Springer, 2012: 207-239.DOI:10.1007/978-3-642-29974-2_9.
[32] SONG S Q, TANG Q, FAN L, et al. Identification of pork flavour precursors from enzyme-treated lard using Maillard model system assessed by GC-MS and partial least squares regression[J]. Meat Science, 2017, 124: 15-24. DOI:10.1016/j.meatsci.2016.10.009.
[33] DOMÍNGUEZ R, GÓMEZ M, FONSECA S, et al. Effect of different cooking methods on lipid oxidation and formation of volatile compounds in foal meat[J]. Meat Science, 2014, 97(2): 223-230.DOI:10.1016/j.meatsci.2014.01.023.
[34] PETRIČEVIĆ S, MARUŠIĆ R N, LUKIĆ K, et al. Differentiation of dry-cured hams from different processing methods by means of volatile compounds, physico-chemical and sensory analysis[J]. Meat Science, 2018, 137: 217-227. DOI:10.1016/j.meatsci.2017.12.001.
[35] LI H, LI X, ZHANG C H, et al. Flavor compounds and sensory profiles of a novel Chinese marinated chicken[J]. Journal of the Science of Food and Agriculture, 2016, 96(5): 1618-1626. DOI:10.1002/jsfa.7263.
[36] LI W Q, CHEN Y P, BLANK I, et al. GC × GC-ToF-MS and GC-IMS based volatile profile characterization of the Chinese dry-cured hams from different regions[J]. Food Research International, 2021, 142:110222. DOI:10.1016/j.foodres.2021.110222.