鱼糜是一种高蛋白、低脂肪的食品原料,其营养丰富、口感细腻,易加工成各种形状和风味的产品,如鱼丸、鱼糕、鱼香肠等。随着人们对高蛋白和低脂食品需求的增长,鱼糜因凝胶性好、营养价值高、食用方便受到国内外消费者青睐,具有良好的发展前景[1-3]。加工过程中,盐对鱼糜凝胶化起到至关重要的作用,盐能溶解鱼糜中的肌原纤维蛋白(myofibrillar protein,MP),加热诱导其变性、聚集,形成稳定的凝胶结构。然而,于当前倡导减盐的大环境下,直接减少钠盐的含量会导致产品性能下降,Tobin等[4]研究发现,食盐含量的降低使发酵香肠的凝胶质地逐渐变软,特征香味也明显降低。然而,鱼糜制品中过量的钠盐与诱发高血压、心脏病等疾病紧密相关。如何在降低NaCl含量的同时,保持鱼糜等凝胶类肉制品的凝胶特性是低钠盐凝胶类肉制品研发所面临的首要问题。当前最有效的方法是利用KCl、CaCl2等非钠盐类物质部分替代NaCl使用,CaCl2、KCl与NaCl具有相似的理化性质,因此将这2 种盐部分替代NaCl应用于低盐鱼糜制品生产中具有可行性。Gong Honggong等[5]用CaCl2部分替代NaCl制得的含钙低钠盐肉制品不仅营养价值高,且功能特性更好。Pi Ruobing等[6]研究发现,使用KCl替代30%(m/m)的NaCl可优化鱼糜质地与功能特性。
尽管KCl和CaCl2等盐类已被探索作为鱼糜凝胶中NaCl的替代物,但目前关于它们各自使用对鱼糜凝胶性能产生差异化影响的具体机制尚不清晰,且现有研究主要聚焦于NaCl的部分替代,通过调整NaCl与KCl、CaCl2等盐类的比例观察、分析鱼糜凝胶性能的变化。然而,对于单一盐类对鱼糜凝胶化过程及其各项物理、化学特性的直接影响则缺乏足够的关注和探讨。因此,本研究旨在对比分析不同盐类在鱼糜凝胶形成过程中的作用,以白鲢鱼糜为研究对象,通过保持一定的离子强度,探究NaCl、KCl及CaCl2在不同含量下自宏观至微观层面对鱼糜凝胶性能的影响,以期为开发低钠盐鱼糜凝胶产品提供科学理论依据。
1 材料与方法
1.1 材料与试剂
白鲢鱼糜购自通威水产食品有限公司。
NaCl、KCl、CaCl2 成都科隆化学品有限公司;尿素、无水乙醇 成都金山化学试剂有限公司;福林酚试剂 福州飞净生物科技有限公司;磷酸盐缓冲液北京兰杰柯科技有限公司。以上试剂均为分析纯。
1.2 仪器与设备
MCR302旋转流变仪 奥地利Anton-Paar公司;Apreo 2C场发射扫描电子显微镜 美国赛默飞世尔科技公司;IRTracer-100傅里叶变换红外(Fourier transform infrared,FTIR)光谱仪 日本岛津公司;D8 ADVANCE X射线衍射仪 德国布鲁克公司;SCIENTZ-10N冷冻干燥机 宁波新芝生物科技股份有限公司;TA.XT Plus质构仪 英国Stable Mirco Systems公司;HC-3018R高速冷冻离心机 安徽中科中佳科技仪器有限公司;UV-6000PC紫外-可见分光光度计 上海元析仪器有限公司;FJ300-SH高速分散均质机 上海沪析实业有限公司;Easy225料理机 美的集团有限公司。
1.3 方法
1.3.1 鱼糜凝胶制备
参照Zhao Yadong等[7]的方法并略作修改,将冷冻淡水鱼糜置于4 ℃冰箱中解冻12 h,随后取出切块。称取300 g鱼糜于料理机中低速(1 800 r/min)斩拌2 min;随后向其中分别添加NaCl、KCl、CaCl2(表1),高速斩拌2 min;加入一定冰水,高速(3 500 r/min)斩拌3 min。制备过程中控制温度始终低于10 ℃。将斩拌好的鱼糜挤入肠衣中,用棉线封口。对鱼肠使用水浴-微波联用加热法熟制,首先在40 ℃水浴锅中加热30 min,后放入微波炉400 W加热,每加热15 s暂停5 s,累计加热50 s,取出后置于冰水中冷却至室温,4 ℃冰箱中放置过夜,备用。
表1 鱼糜中不同盐类的添加量
Table 1 Amounts of different types of salt added to surimi
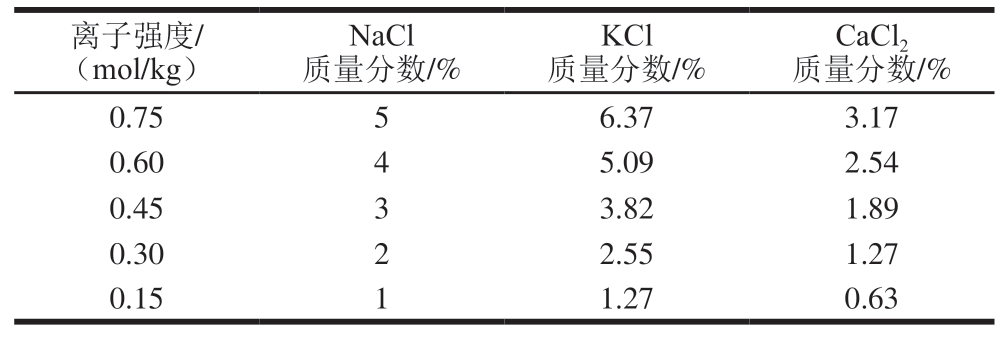
离子强度/(mol/kg)CaCl2质量分数/%0.7556.373.17 0.6045.092.54 0.4533.821.89 0.3022.551.27 0.1511.270.63 NaCl质量分数/%KCl质量分数/%
1.3.2 凝胶强度测定
参照Hunt等[8]的方法并略作修改,选用P/0.5S球形探头,触发力10 g,测前速率1 mm/s,压缩位移20 mm,测试速率1 mm/s,测后速率1 mm/s。凝胶强度为破断强度(g)与破断距离(mm)的乘积。
1.3.3 持水性测定
参照陈旭等[9]的方法并略作修改,称取约10 g样品至50 mL离心管中,准确称质量(m1/g),将离心管置于冷冻离心机中8 000 r/min离心20 min。取出后将离心管倒置,弃去液体,用滤纸将残余水分吸干,准确称质量(m2/g),离心管质量记为m0(g)。鱼糜凝胶持水性按式(1)计算:
1.3.4 白度测定
参照王冬妮等[10]的方法,将鱼糜凝胶于室温下恢复30 min,采用色差计测定样品的亮度值(L*)、红度值(a*)和黄度值(b*),每组样品平行测定3 次。鱼糜凝胶白度按式(2)计算:
1.3.5 质构测定
参照张立彦等[11]的方法,采用质构仪测定,测定模式选择质地剖面分析,选用P/10柱形探头,触发力5 g,2 次压缩时间间隔5 s,压缩位移5 mm,测前、测试、测后速率均为2 mm/s。
1.3.6 动态流变学测定
参照Wang Jiafei等[12]的方法并略作修改,采用旋转流变仪进行测定,选用50 mm平板,调节平板和样品台间隙为1 mm。参数设置:温度变化范围25~95 ℃,应变1.0%,选取50 个数据点,以温度为横坐标,储能模量(G’)为纵坐标作图。
1.3.7 FTIR光谱测定
参照Qian Xixin等[13]的方法并略作修改,将冷冻干燥后的鱼糜凝胶样品研磨成粉末,与一定量的KBr混合压片。于室温25 ℃条件下测定样品,波数范围400~4 000 cm-1,采用未取样的KBr作基线扫描。
1.3.8 扫描电子显微镜观察
参照Kang Zhuangli等[14]的方法并略作修改,将鱼糜凝胶样品切成边长约1 cm的立方体,用2.5%、pH 6.8的戊二醛固定24 h,后用0.2 mol/L磷酸盐缓冲液漂洗3 次,每次10 min,去离子水漂洗6 次,每次10 min,随后依次在50%、70%、90%乙醇溶液中梯度脱水,再用无水乙醇脱水3 次,每次15 min。处理后样品经真空冷冻干燥机干燥48 h,用导电胶将样品固定在样品台表面,喷金90 s,使用扫描电子显微镜将样品分别放大2 000、5 000 倍,观察其微观形貌。
1.3.9 分子间作用力测定
参照Liu Yang等[15]的方法,称取3.00 g鱼糜凝胶样品,分别加入15 mL不同溶液:0.05 mol/L NaCl(SA);0.6 mol/L NaCl(SB);0.6 mol/L NaCl+1.5 mol/L尿素(SC);0.6 mol/L NaCl+8 mol/L尿素(SD)。混合物采用高速分散机12 000 r/min均质90 s,4 ℃放置1 h,随后10 000×g冷冻离心15 min,采用Lowry法测定上清液蛋白质量浓度,分别代表鱼糜凝胶中非特异性连接、离子键、氢键、疏水相互作用含量。
1.3.10 低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)测定
参照Zhao Yadong等[16]的方法并略作修改,将2~4 g鱼糜凝胶样品放入核磁管,自旋-自旋弛豫时间(T2)用CPMG(Carr-Purcell-Meiboom-Gill)脉冲序列进行测定。参数设置:质子共振频率23 MHz,测定温度25 ℃,90°脉宽12 μs,采样点数375 020,180°脉宽23.04 μs,回波时间0.1 ms,采样频率20 kHz。
1.4 数据处理
所有实验重复3 次,每个实验进行3 组平行,结果表示为平均值±标准差。采用Excel 2021软件进行数据处理;采用SPSS19.0软件进行差异显著性分析,采用Origin 2021软件绘图,采用PeakFit v4.12软件进行去堆积拟合。
2 结果与分析
2.1 添加不同盐类鱼糜凝胶强度与持水性分析
凝胶强度反映凝胶体受到外力作用时的承受能力,持水性能评价蛋白质与水结合能力的强弱[10],两者均是反映鱼糜凝胶性能的重要指标。如图1所示,凝胶的持水性与凝胶强度具有正相关性,呈同样的变化趋势,其持水性和凝胶强度共同反映凝胶网络结构的稳定性。未添加盐的鱼糜无法形成凝胶,低盐添加量的鱼糜虽能形成凝胶,但其凝胶强度及持水性均较低。低盐环境中,鱼糜中的肌球蛋白会自发聚集,形成不溶性的粗丝形态,且加热时发生随机聚集,不利于凝胶网络的形成。随着盐添加量的提高,凝胶强度和持水性均有所改善,其中添加KCl和NaCl的鱼糜凝胶强度和持水性分别在质量分数6.37%、5%时达到最大值,而添加CaCl2的鱼糜凝胶则在质量分数1.89%时达到最大值,随后持续下降。可以看出,经K+和Na+处理的鱼糜具有相似的特性[11],一价盐离子有效溶解了MP,盐添加量越高,离子强度越高,凝胶性质更好[15]。Wang Yudong等[17]研究发现,高含量NaCl能促进MP充分溶解,有利于蛋白结构舒展,以形成品质优良的凝胶。而高含量Ca2+会削弱凝胶强度和持水性,原因是过多的Ca2+可能引起蛋白质聚集沉淀,阻碍肌球蛋白交联,致使凝胶强度与持水性降低[18]。Hunt等[8]的研究同样发现,添加KCl对改善鳕鱼鱼糜的凝胶特性效果更佳。
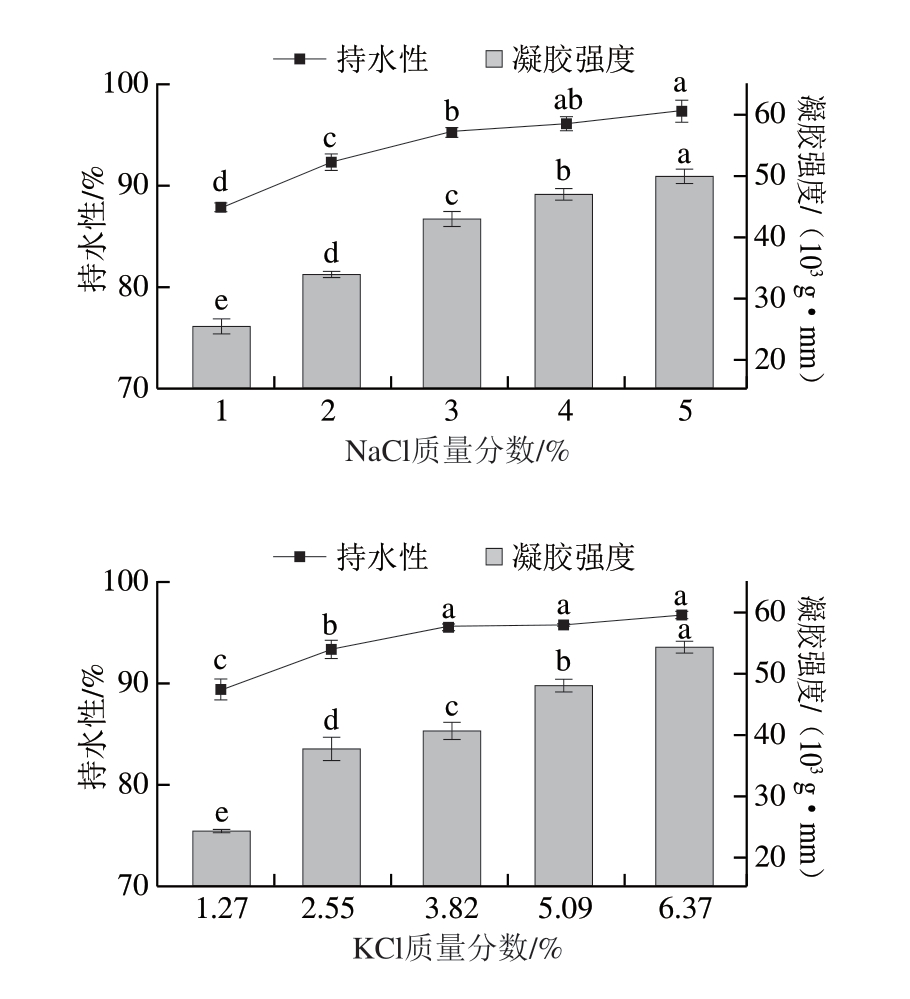
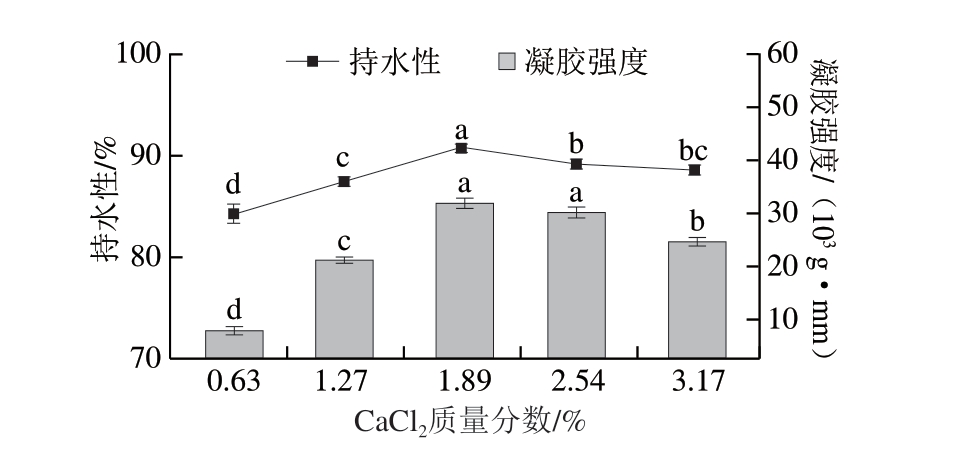
图1 添加不同盐类对鱼糜凝胶强度与持水性的影响
Fig. 1 Influence of different salts on the gel strength and water-holding capacity of surimi gel
小写字母不同表示差异显著(P<0.05)。
2.2 添加不同盐类鱼糜凝胶的白度分析
鱼糜的白度是评价其品质的重要指标之一。高白度的鱼糜制品更富有光泽,能够提高消费者的食欲。如图2所示,CaCl2组鱼糜凝胶白度有所上升,KCl组有所下降,而NaCl组无明显变化。随着盐添加量升高,鱼糜中的MP被逐步分解成肌球蛋白和肌动蛋白等蛋白质大分子。随后两者相互作用,形成肌动球蛋白复合物,进一步聚合,构建出更加致密的蛋白质网络结构,这一变化导致光散射现象减弱[16],表现为KCl组的白度由73.76降低至66.41,降低近10%。相反,CaCl2添加量的提高阻碍了肌球蛋白、肌动蛋白之间的交联,使网络结构较为疏松,这种结构变化增强了光散射效应,导致白度有所上升,由70.1上升至73.3,提高4.6%。
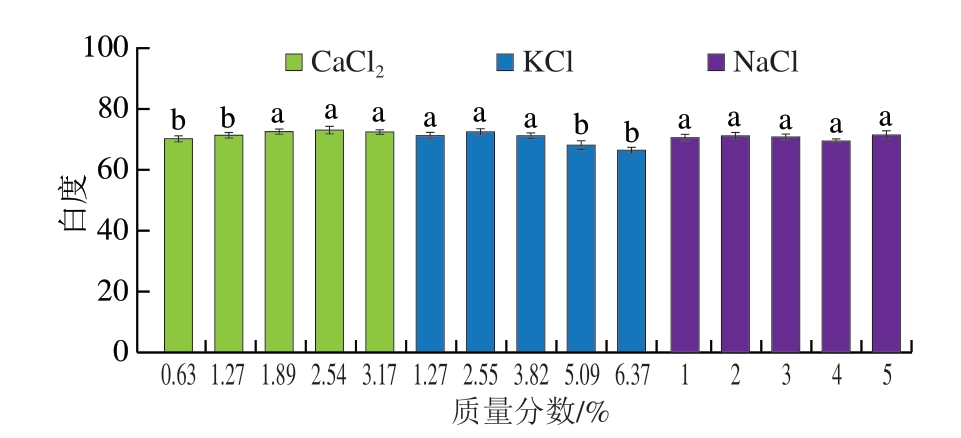
图2 添加不同盐类对鱼糜凝胶白度的影响
Fig. 2 Effect of different salts on the whiteness of surimi gel
小写字母不同表示不同添加量的同种盐类组间差异显著(P<0.05)。图4、6同。
2.3 添加不同盐类鱼糜凝胶的质构分析
如表2所示,凝胶的质构特性与凝胶强度具有相关性,低盐添加量下,3 种鱼糜的质构指标均较低,这是由于MP是盐溶性蛋白,于低盐环境中溶解不完全,不利于凝胶网络的形成。且随着盐含量的增加,鱼糜凝胶的硬度、黏着性和咀嚼性等均显著增强(P<0.05)。NaCl、KCl组变化趋势相似,在相同的离子强度下,各项质构特性均高于CaCl2组。与添加3.17% CaCl2的鱼糜凝胶相比,添加5% NaCl、6.37% KCl的鱼糜凝胶硬度分别提高35.70%、58.54%。可以看出,高含量Na+、K+有效促进了MP的溶解、提取及吸水膨胀能力,进一步促使蛋白内部的疏水基团暴露,从而有利于蛋白质充分折叠并形成稳定的网络结构[19]。与Na+相比,K+半径较大,更易与水分子形成氢键,这增强了凝胶网络的稳定性。因此将KCl质量分数提升至6.37%时,其性能依然保持稳定,而CaCl2组质构特性则在质量分数1.89%时最佳,原因是低含量Ca2+能激活谷氨酰胺转氨酶,有利于蛋白质结构的拉伸和内部活性基团的暴露,从而促进疏水相互作用及二硫键的形成[20]。但高含量Ca2+会削弱蛋白质的交联作用,导致凝胶硬度、咀嚼性等有所降低。例如,与添加1.89% CaCl2的鱼糜凝胶相比,添加3.17% CaCl2的鱼糜凝胶硬度下降20.24%,咀嚼性下降26.77%。Yan Bowen等[21]的研究同样发现,过量的Ca2+不利于鱼糜凝胶性质的改善。
表2 添加不同盐类对鱼糜凝胶质构的影响
Table 2 Effect of different salts on the textural properties of surimi gel
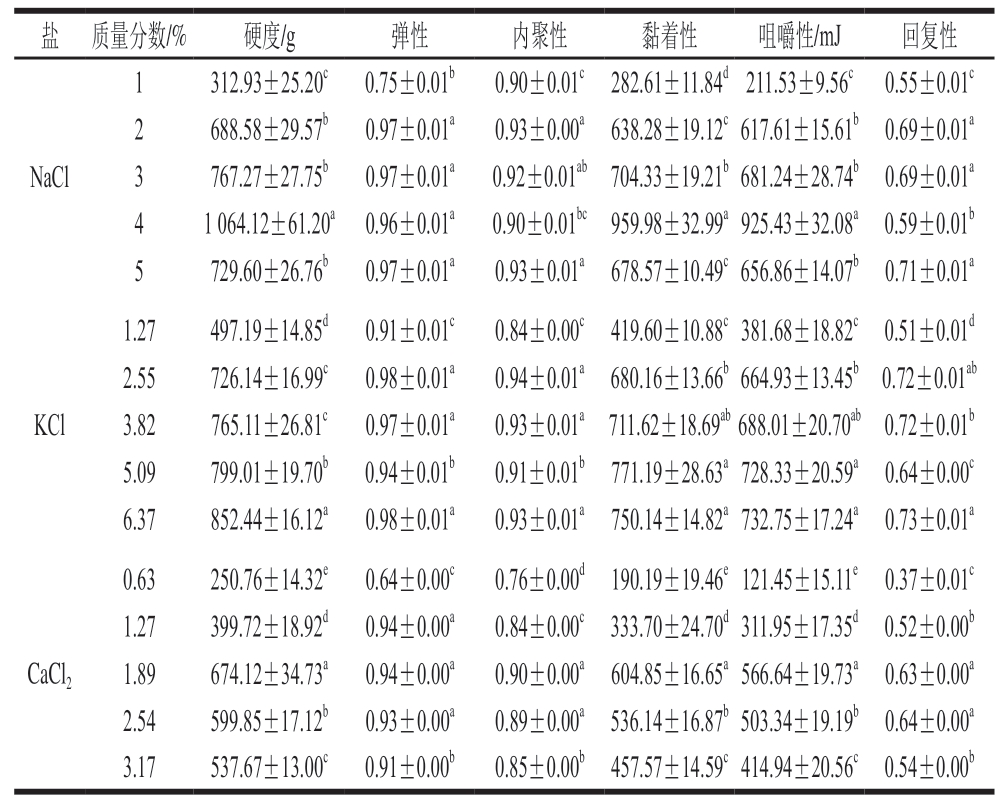
注:同列小写字母不同表示不同添加量的同种盐类组间差异显著(P<0.05)。
盐质量分数/%硬度/g弹性内聚性黏着性咀嚼性/mJ回复性NaCl 1312.93±25.20c0.75±0.01b0.90±0.01c282.61±11.84d211.53±9.56c0.55±0.01c 2688.58±29.57b0.97±0.01a0.93±0.00a638.28±19.12c617.61±15.61b0.69±0.01a 3767.27±27.75b0.97±0.01a0.92±0.01ab704.33±19.21b681.24±28.74b0.69±0.01a 41 064.12±61.20a0.96±0.01a0.90±0.01bc959.98±32.99a925.43±32.08a0.59±0.01b 5729.60±26.76b0.97±0.01a0.93±0.01a678.57±10.49c656.86±14.07b0.71±0.01a KCl 1.27497.19±14.85d0.91±0.01c0.84±0.00c419.60±10.88c381.68±18.82c0.51±0.01d 2.55726.14±16.99c0.98±0.01a0.94±0.01a680.16±13.66b664.93±13.45b0.72±0.01ab 3.82765.11±26.81c0.97±0.01a0.93±0.01a711.62±18.69ab688.01±20.70ab0.72±0.01b 5.09799.01±19.70b0.94±0.01b0.91±0.01b771.19±28.63a728.33±20.59a0.64±0.00c 6.37852.44±16.12a0.98±0.01a0.93±0.01a750.14±14.82a732.75±17.24a0.73±0.01a 0.63250.76±14.32e0.64±0.00c0.76±0.00d190.19±19.46e121.45±15.11e0.37±0.01c 1.27399.72±18.92d0.94±0.00a0.84±0.00c333.70±24.70d311.95±17.35d0.52±0.00b 1.89674.12±34.73a0.94±0.00a0.90±0.00a604.85±16.65a566.64±19.73a0.63±0.00a 2.54599.85±17.12b0.93±0.00a0.89±0.00a536.14±16.87b503.34±19.19b0.64±0.00a 3.17537.67±13.00c0.91±0.00b0.85±0.00b457.57±14.59c414.94±20.56c0.54±0.00b CaCl2
2.4 添加不同盐类鱼糜凝胶的动态流变学分析
如图3所示,鱼糜凝胶的G’约在45 ℃时降至最低,随后迅速增加,而后随着温度进一步上升,G’有所降低。在升温初期阶段,G’的下降可能源于—SH与S—S的减少,部分氢键和离子键被破坏,阻碍肌球蛋白头部的交联,从而削弱蛋白之间的相互作用,进而降低蛋白稳定性,导致G’下降[22]。随着温度持续上升,蛋白发生变性和解离,这一过程促进了蛋白质分子间的交联,使G’迅速升高,标志着稳定的凝胶结构已形成。随着温度进一步升高,G’下降,表明高温对凝胶网络的交联产生了不良影响。
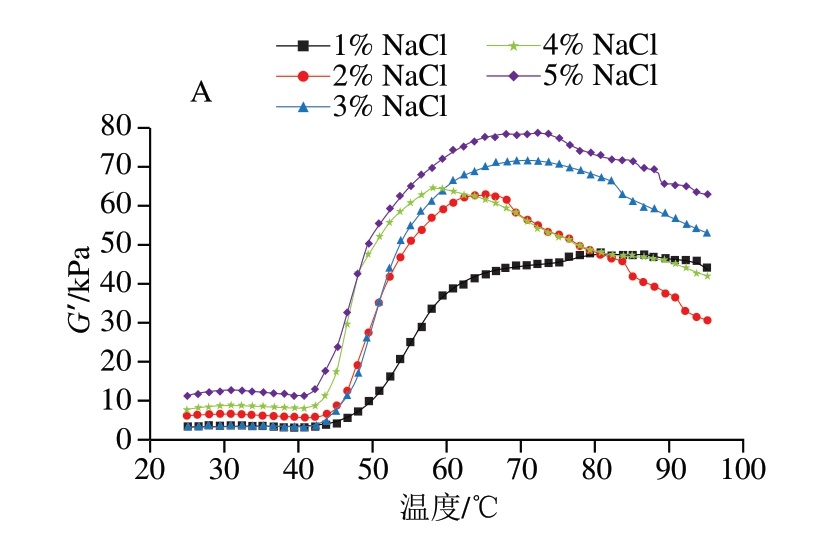
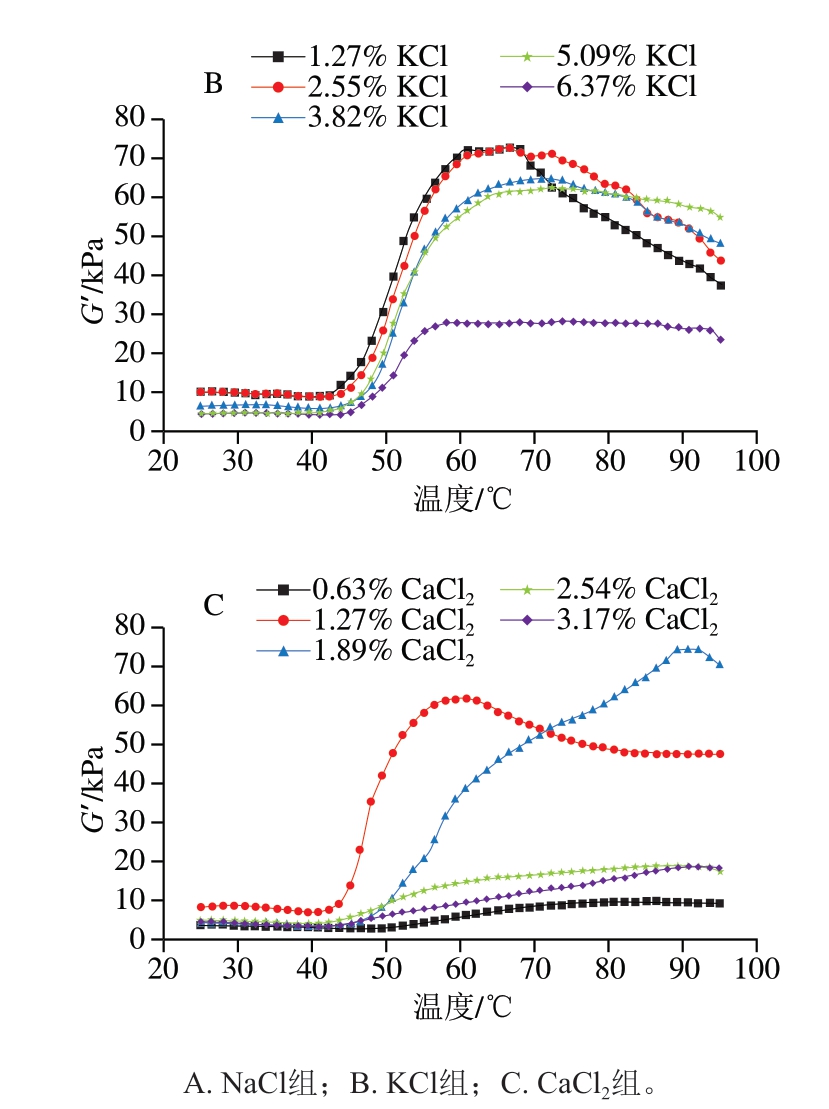
图3 添加不同盐类对鱼糜凝胶流变特性的影响
Fig. 3 Effect of different salts on the rheological properties of surimi gel
盐对鱼糜凝胶G’的具体影响因盐种类而异。随着盐添加量的提高,添加NaCl的鱼糜凝胶G’升高;而KCl组则呈先升高后下降的趋势,其中添加2.55% KCl的鱼糜凝胶G’最高,而KCl质量分数增至6.37%时,G’则降至最低;添加CaCl2的鱼糜凝胶G’在质量分数为1.89%时达最大值,进一步提高CaCl2添加量则导致G’明显降低。可以看出,高含量Na+对鱼糜凝胶G’的提升效果明显,而高含量的K+则会使其有所降低。此外,相较于添加CaCl2的鱼糜凝胶,添加NaCl和KCl的鱼糜凝胶G’更高,表明一价盐离子比Ca2+更能促进鱼糜形成良好的凝胶结构[12]。在CaCl2质量分数0.63%~1.89%范围内,Ca2+有助于MP的溶解,且激活了内源性谷氨酰胺转氨酶,促进ε-(γ-谷氨酰)赖氨酸键的生成,该赖氨酸键可交联鱼糜蛋白,促使形成网络更致密的凝胶[23],导致G’上升。然而,在CaCl2质量分数1.89%~3.17%范围内,过量的Ca2+导致鱼肉蛋白发生过度交联,蛋白分子间的结合异常紧密,进而引发蛋白质凝固,过度的凝固使凝胶结构劣化,导致G’大幅降低[7]。
2.5 添加不同盐类鱼糜凝胶的FTIR光谱分析
如图4A、C、E所示,每个样品均有多个特征吸收峰,且这些峰的位置大致相同。这一现象表明,不同类型的盐及其添加量变化对鱼糜凝胶的蛋白质骨架结构未产生明显影响,也未引起蛋白质基团改变,这与Qian Xixin等[13]的研究结果相似。
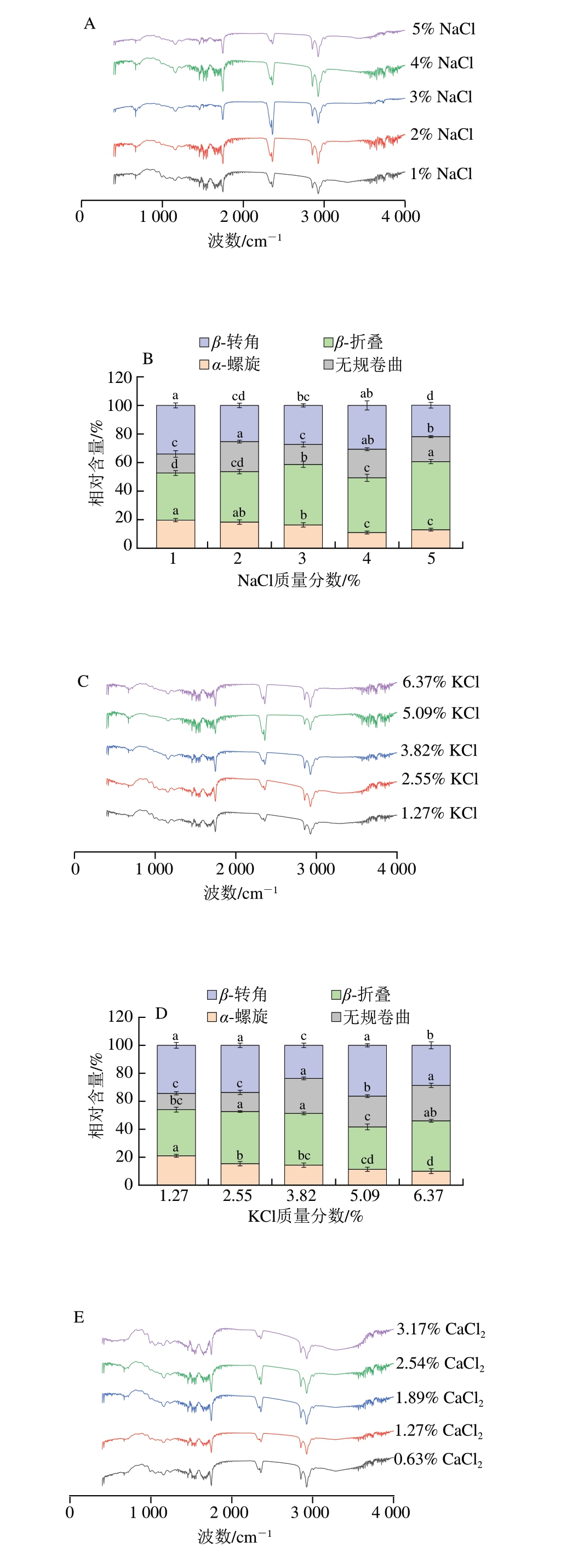
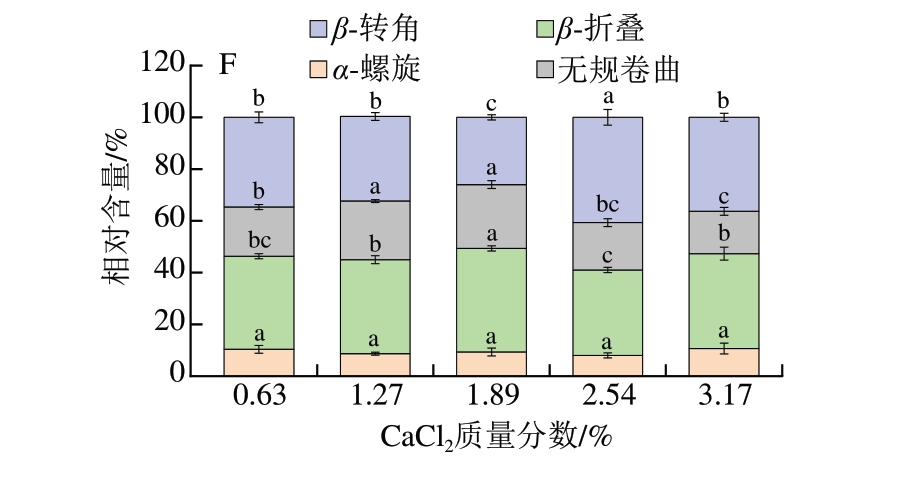
图4 添加不同盐类对鱼糜凝胶FTIR光谱和蛋白质二级结构相对含量的影响
Fig. 4 Effect of different salts on the Fourier transform infrared spectrum and relative content of protein secondary structure of surimi gel
A、C、E分别为添加NaCl、KCl、CaCl2鱼糜凝胶的FTIR光谱图;B、D、F分别为添加NaCl、KCl、CaCl2鱼糜凝胶的蛋白质二级结构相对含量。
酰胺I区谱带(1 600~1 700 cm-1)内的特征频率可表征蛋白质二级结构[24]。如图4B、D、F所示,随着盐添加量的提高,添加NaCl、KCl鱼糜凝胶的α-螺旋相对含量逐渐降低,而β-折叠有所上升,最高相对含量分别为47.5%、37.9%;添加CaCl2鱼糜凝胶的α-螺旋相对含量整体处于较低水平,在质量分数为1.89%时,β-折叠相对含量最高,为38.8%。结果表明,盐促使蛋白质分子中的α-螺旋展开与β-折叠形成,高相对含量β-折叠和低相对含量α-螺旋更有助于有序、致密凝胶网络的形成[25],且凝胶强度与β-折叠相对含量呈正相关,这种正相关性与凝胶强度及持水性的增强趋势相吻合。相较于NaCl、KCl,CaCl2更倾向于将鱼糜凝胶中的α-螺旋转变为无规卷曲和β-转角,可能是Ca2+通过增强蛋白质的表面疏水性与蛋白中特定的氨基酸残基(甘氨酸、脯氨酸等)发生相互作用,改变了蛋白质折叠的驱动力,进而影响其二级结构,导致产生不同的结构转变趋势[9]。
2.6 添加不同盐类鱼糜凝胶的微观形貌分析
离子强度为0.45 mol/kg的鱼糜凝胶强度高、持水性好,且其二级结构中β-折叠相对含量较高、α-螺旋相对含量较低,这些特性有利于观察鱼糜凝胶微观形貌,因此选择离子强度为0.45 mol/kg的3 种鱼糜凝胶进行微观结构观察。如图5所示,不同组鱼糜凝胶的微观形貌存在明显差异,在添加NaCl的鱼糜凝胶网络中观察到由大量紧密堆积的微小蛋白质颗粒构成的颗粒脉络,这些颗粒不仅数量众多且彼此聚集,共同形成错落有致、层次分明的结构,交织成密集、复杂的凝胶网络。添加KCl的鱼糜凝胶中颗粒数量相对较少,凝胶表面虽有轻微凹凸,但整体仍光滑均匀,光滑的表面增强了光线的反射,使其略显明亮,表明凝胶网络结构平滑、稳固,有利于持水力和凝胶强度的提高[26]。相比之下,添加CaCl2的鱼糜凝胶网络表面略微粗糙,整体脉络的层次不明显,其表面的颗粒相较于添加一价盐离子的鱼糜凝胶较为粗大,这可能是由于Ca2+使蛋白质过度凝结或沉淀所致,进而造成颗粒较大的现象。结果表明,一价盐离子有利于形成更均匀且有层次的凝胶网络结构[14],而Ca2+对凝胶网络的改善效果逊于一价盐离子。微观形貌结果进一步证实了一价盐离子相较于Ca2+在增强凝胶强度和持水性方面的优越性。
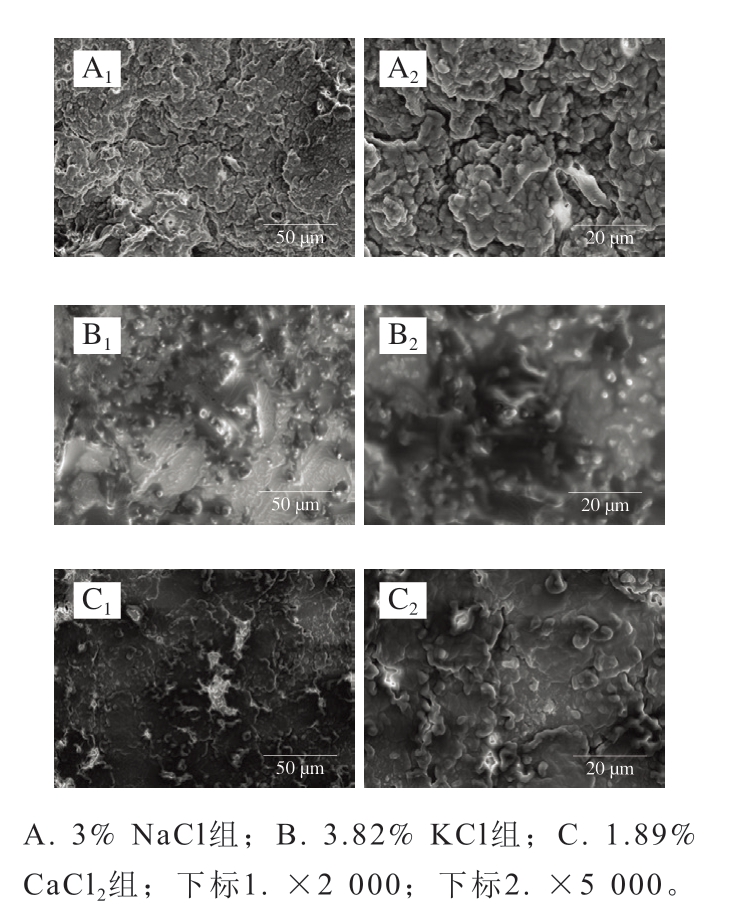
图5 添加不同盐类对鱼糜凝胶微观形貌的影响
Fig. 5 Effect of different salts on the microscopic morphology of surimi gel
2.7 添加不同盐类鱼糜凝胶的分子间作用力分析
蛋白质凝胶网络的形成极大依赖于离子键、氢键和疏水相互作用的协同作用。如图6所示,添加3 种盐后,凝胶体系的非特异性连接和离子键含量均有所增加,静电相互作用、范德华力等非特异性连接易被0.05 mol/L NaCl所断裂而含量较高。3 种鱼糜凝胶的非特异性连接含量均随盐添加量的提高呈上升趋势,且在CaCl2组中的含量高于其他2 组。随着盐添加量的提高,添加NaCl鱼糜凝胶的氢键含量先降低后升高,而添加KCl、CaCl2鱼糜凝胶的氢键含量先升高后降低,分别在质量分数5.09%、1.27%时达到最大值。NaCl组离子键含量在质量分数2%时最高;KCl组的离子键含量随着盐添加量的提高增长较快,于质量分数5.09%时达到最大值。可能是由于K+较大的离子半径及其电荷分布特点增强了蛋白质的表面张力,使蛋白质结构变得松弛,进而使氨基酸更多地暴露,从而增加了它们与蛋白质或其他组分结合的机会,促使添加KCl的鱼糜凝胶形成更丰富的离子键连接[27]。相反,添加CaCl2鱼糜凝胶的离子键含量在质量分数1.27%时达到最大值,随后持续降低。Ca2+易与蛋白质中的负电基团(如—COO-)结合形成盐桥,而过量的Ca2+可能会与原本用于形成离子键的基团结合,导致这些基团无法参与离子键的构建[16]。
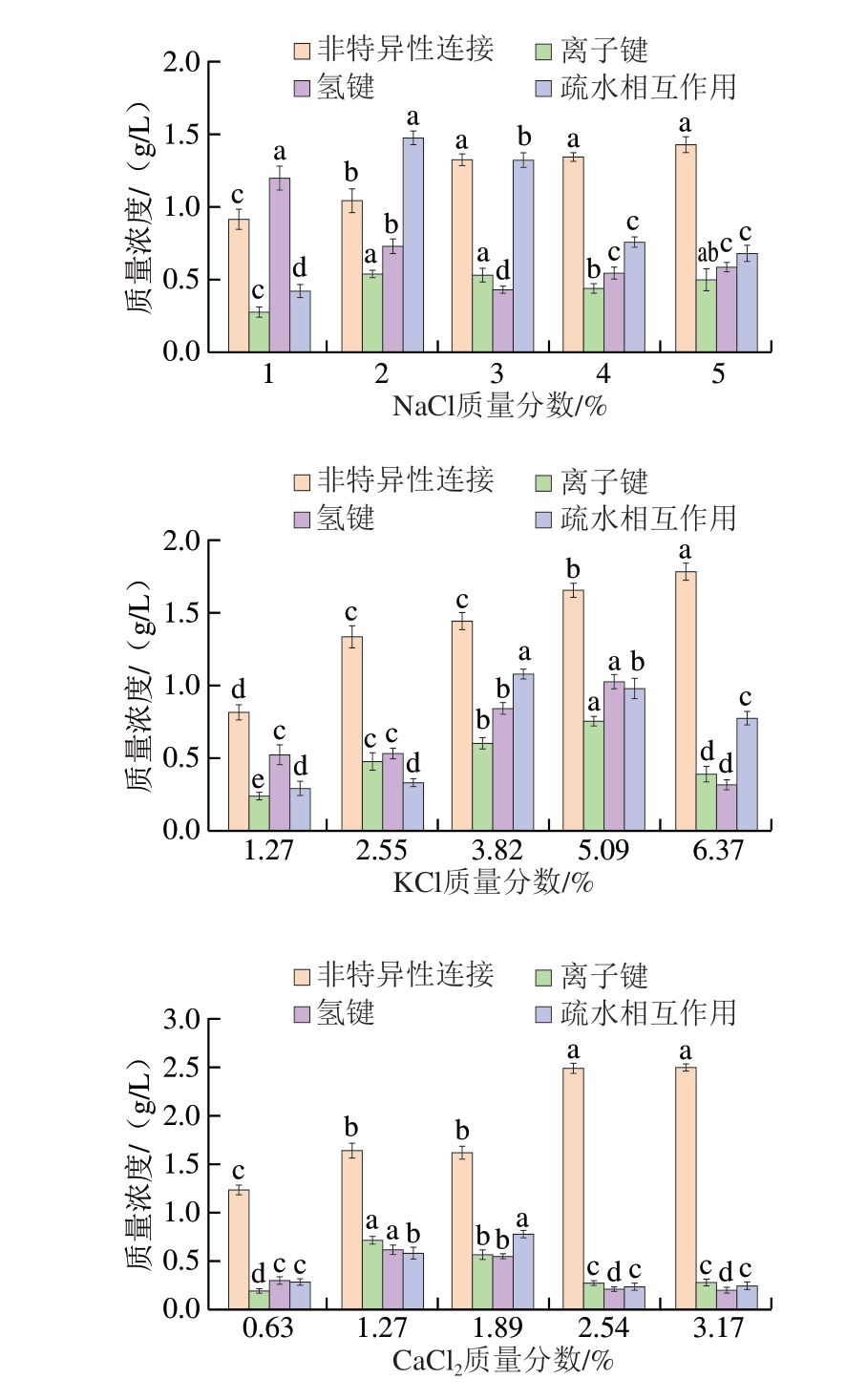
图6 添加不同盐类对鱼糜凝胶分子间作用力的影响
Fig. 6 Effect of different salts on the intermolecular forces of surimi gel
疏水相互作用被认为是稳定凝胶网络的主要作用力[28],添加NaCl、KCl鱼糜凝胶的疏水相互作用含量整体高于CaCl2组,可能是由于Na+、K+在体系内的迁移率高,分布更广泛,使它们能更有效地与氨基酸的相反电荷结合,从而促使足够多的肌动球蛋白疏水折叠[29]。随着CaCl2添加量增加,疏水相互作用含量呈先上升后下降趋势,在质量分数1.89%时达最大值。这是由于Ca2+使隐藏在蛋白质内部的疏水氨基酸残基暴露,增强了蛋白质的表面疏水性和疏水驱动力,进而促使蛋白交联、聚集,形成较大的可溶性聚集体[30]。而过量的Ca2+导致MP中过多疏水基团暴露,形成了过度疏水的环境,这种环境会减弱MP的水结合能力,从而削弱其分子间作用力。
2.8 添加不同盐类鱼糜凝胶的水分分布分析
如图7所示,添加不同盐类的鱼糜凝胶均有3 个峰,分别代表鱼糜中不同存在状态的水。第1个峰对应最难移动的水分,即结合水(T21,0.01~10 ms);第2个峰代表被凝胶网络结构束缚而流动受限的部分水,即不易流动水(T22,10~300 ms);第3个峰为可以自由移动的水,即自由水(T23,>300 ms)[31]。T2与氢质子所承受的束缚力及其自由度相关,当氢质子受到的束缚增强或自由度减小时,T2相应缩短;相反,如果氢质子受到的束缚减弱或自由度增大,则T2相应延长,且这些氢质子在网络内的迁移和扩散能力也会更强[32]。
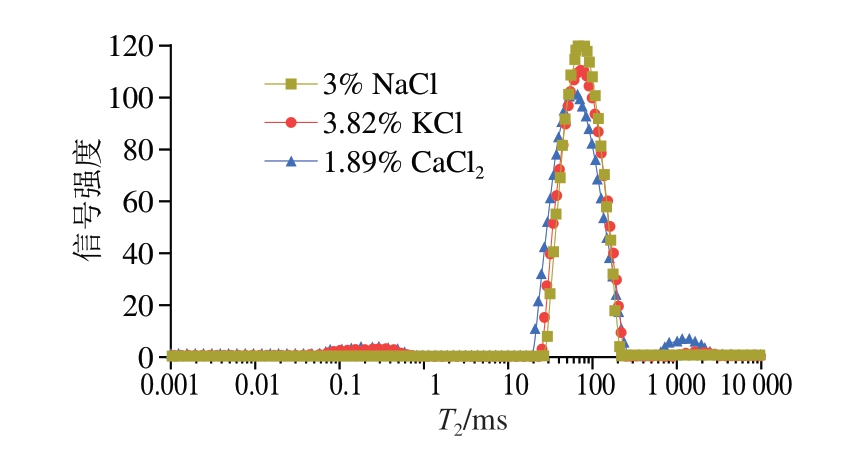
图7 添加不同盐类对鱼糜凝胶水分分布的影响
Fig. 7 Effect of different salts on the water distribution of surimi gel
可以看出,添加不同盐类的鱼糜凝胶呈现出相似的水分分布,不易流动水占比最高(92%~99%)。相较于添加CaCl2的鱼糜凝胶,KCl、NaCl组表现出更高的T22信号强度,其不易流动水相对含量更高,表明添加KCl、NaCl的鱼糜凝胶保水性更优,凝胶网络结构更完善,能有效固定水分,这与其微观形貌结果相互印证。Na+、K+促进了蛋白质-蛋白质及蛋白质-水之间的相互作用,这不仅增强了蛋白质之间的交联和聚集,还推动其形成有序的凝胶网络。在这一过程中,水的流动性被削弱,使更多水分被有效保留在网络内[33]。相反,添加CaCl2的鱼糜凝胶T22信号强度低于KCl、NaCl组,自由水相对含量高于其他2 组,达到4.0%,这反映出Ca2+对构建凝胶网络结构的效果相对较差,与微观形貌观察结果一致。这可能是由于Ca2+引起蛋白质收缩变性的作用更为明显,从而减弱了与水分的结合能力,故自由水相对含量较高[34]。同时,添加KCl、NaCl鱼糜凝胶的T2较长,表明其有助于增加不易流动水的自由度,可能是由于Na+、K+促进了盐溶性蛋白的充分溶出,改善了水分子的流动性。然而,添加CaCl2鱼糜凝胶的T2较短,可能是由于Ca2+诱导蛋白质水通道发生变性收缩,进而减弱了其与水分的结合,而较窄的通道增强了对水分的束缚作用[34],这一现象也可能与Ca2+形成的盐桥作用有所关联。
3 结论
随着盐添加量的提高,KCl、NaCl、CaCl2均能有效提高鱼糜凝胶强度、持水性、质构特性及G’,但当Ca2+含量过高,上述性能均有所下降。K+、Na+促进鱼糜凝胶蛋白中α-螺旋向β-折叠转变,有利于凝胶网络形成,而Ca2+倾向于将α-螺旋转变为无规卷曲和β-转角。添加3 种不同盐类鱼糜凝胶的离子键和疏水相互作用含量均呈先升高后降低的趋势,且添加KCl、NaCl的鱼糜凝胶疏水相互作用含量整体高于CaCl2组。相较于CaCl2组,添加KCl、NaCl的鱼糜凝胶不易流动水相对含量更高,自由水相对含量更低,表现出更强的保水能力。综上所述,KCl、NaCl、CaCl2的添加均能有效提升鱼糜凝胶性能,但相比之下,KCl、NaCl在改善鱼糜凝胶性能方面展现出比CaCl2更优的效果。
[1] MI H B, LIANG S Y, CHEN J X, et al. Effect of starch-based emulsion with different amylose content on the gel properties of Nemipterus virgatus surimi[J]. International Journal of Biological Macromolecules,2024, 259: 129183. DOI:10.1016/j.ijbiomac.2023.129183.
[2] ZHAO Q L, ZHENG B, LI J W, et al. Emulsion-filled surimi gel:a promising approach for enhancing gel properties, water holding capacity, and flavor[J]. Trends in Food Science & Technology, 2024,152: 104663. DOI:10.1016/j.tifs.2024.104663.
[3] WANG Y H, HU D, YUE W, et al. High internal phase emulsions of ω-3 fatty acids stabilized by fish scale gelatin particles: application to lipid-enhanced surimi 3D printing[J]. Food Hydrocolloids, 2024, 146:109254. DOI:10.1016/j.foodhyd.2023.109254.
[4] TOBIN B D, O’SULLIVAN M G, HAMILL R M, et al. The impact of salt and fat level variation on the physiochemical properties and sensory quality of pork breakfast sausages[J]. Meat Science, 2013,93(2): 145-152. DOI:10.1016/j.meatsci.2012.08.008.
[5] GONG H H, JANG J, DENG Y S, et al. Effect and mechanism of DC magnetic field combined with calcium chloride on saltiness and flavor enhancement of low salt pork gel[J]. Food Research International,2023, 173: 113235. DOI:10.1016/j.foodres.2023.113235.
[6] PI R B, LI G J, ZHUANG S, et al. Effect of the partial substitution of sodium chloride on the gel properties and flavor quality of unwashed fish mince gels from grass carp[J]. Foods, 2022, 11(4): 576.DOI:10.3390/foods11040576.
[7] ZHAO Y D, LI J J, WEI G P, et al. Fortification of surimi gels by tuning the synergetic effect of multiple enzyme-related factors[J]. Food Hydrocolloids, 2023, 143: 108895. DOI:10.1016/j.foodhyd.2023.108895.
[8] HUNT A, PARK J W. Alaska pollock fish protein gels as affected by refined carrageenan and various salts[J]. Journal of Food Quality,2013, 36(1): 51-58. DOI:10.1111/jfq.12010.
[9] 陈旭, 陈惠敏, 伍久林, 等. 基于人体必需金属盐替代的低钠盐肌原纤维蛋白凝胶特性和作用机理[J]. 食品科学, 2023, 44(6): 25-33.DOI:10.7506/spkx1002-6630-20220914-117.
[10] 王冬妮, 范馨茹, 祁立波, 等. 淀粉和蛋白类添加物对鱿鱼鱼糜凝胶特性的影响[J]. 中国食品学报, 2018, 18(4): 65-71. DOI:10.16429/j.1009-7848.2018.04.010.
[11] 张立彦, 胡嘉颖, 王仕钰. 食盐添加量对微波加热鸡胸肉糜凝胶品质的影响[J]. 现代食品科技, 2016, 32(3): 183-188. DOI:10.13982/j.mfst.1673-9078.2016.3.030.
[12] WANG J F, CUI Y Q, SHI L F, et al. Effect of ionic types on the characteristics of Pickering emulsions stabilized by myofibrillar proteins from hairtail (Trichiurus lepturus)[J]. LWT-Food Science and Technology, 2023, 189: 115559. DOI:10.1016/j.lwt.2023.115559.
[13] QIAN X X, LIN S Y, CHEN T J, et al. Evaluation of the texture characteristics and taste of shrimp surimi with partial replacement of NaCl by non-sodium metal salts[J]. Food Chemistry, 2024, 459:140403. DOI:10.1016/j.foodchem.2024.140403.
[14] KANG Z L, LI B, MA H J, et al. Effect of different processing methods and salt content on the physicochemical and rheological properties of meat batters[J]. International Journal of Food Properties,2016, 19(7): 1604-1615. DOI:10.1080/10942912.2015.1105819.
[15] LIU Y, SUN Q X, WEI S, et al. Insight into the correlations among rheological behaviour, protein molecular structure and 3D printability during the processing of surimi from golden pompano (Trachinotus ovatus)[J]. Food Chemistry, 2022, 371: 131046. DOI:10.1016/j.foodchem.2021.131046.
[16] ZHAO Y D, WEI G P, LI J J, et al. Comparative study on the effect of different salts on surimi gelation and gel properties[J]. Food Hydrocolloids, 2023, 144: 108982. DOI:10.1016/j.foodhyd.2023.108982.
[17] WANG Y D, ZHUANG Y, ZHANG J Y, et al. Effects of different pH values and monovalent/divalent cations in washing on the physicochemical characteristics of silver carp surimi gel[J]. LWTFood Science and Technology, 2024, 196: 115865. DOI:10.1016/j.lwt.2024.115865.
[18] ZHAN J Q, CHEN Y W, LI G S, et al. Study on the structure and preservation mechanism of 3D-printed surimi with Ca2+ and xylooligosaccharides[J]. Food Bioscience, 2023, 54: 102905. DOI:10.1016/j.fbio.2023.102905.
[19] GAN X, ZHAO L, LI J G, et al. Effects of partial replacement of NaCl with KCl on bacterial communities and physicochemical characteristics of typical Chinese bacon[J]. Food Microbiology, 2021,93: 103605. DOI:10.1016/j.fm.2020.103605.
[20] LI G S, ZHAN J Q, HU Z H, et al. Effect of Ca2+ on 3D printing accuracy and antioxidant efficacy of nano starch-lutein surimi:mechanical properties, chemical bonds and release rate[J]. Journal of the Science of Food and Agriculture, 2023, 103(12): 5927-5937.DOI:10.1002/jsfa.12681.
[21] YAN B W, JIAO X D, ZHU H P, et al. Chemical interactions involved in microwave heat-induced surimi gel fortified with fish oil and its formation mechanism[J]. Food Hydrocolloids, 2020, 105: 105779.DOI:10.1016/j.foodhyd.2020.105779.
[22] SHI H B, ZHANG M X, LIU X C, et al. Improved qualities of salt-reduced Tilapia surimi by adding konjac glucomannan:insight into the edible traits, gel properties and anti-freezing ability[J]. Food Hydrocolloids, 2024, 153: 109971. DOI:10.1016/j.foodhyd.2024.109971.
[23] TONG X Y, LIU Y J, WEI G P, et al. Understanding the role of CaCl2 in salt substitute for low-salt and high-quality surimi products[J].Current Research in Food Science, 2024, 9: 100877. DOI:10.1016/j.crfs.2024.100877.
[24] ZHANG T, WANG J, FENG J Q, et al. Effects of ultrasonicmicrowave combination treatment on the physicochemical, structure and gel properties of myofibrillar protein in Penaeus vannamei(Litopenaeus vannamei) surimi[J]. Ultrasonics Sonochemistry, 2022,90: 106218. DOI:10.1016/j.ultsonch.2022.106218.
[25] ZHANG S, MEENU M, XIAO T, et al. The impact of pressure-shift freezing on the three-dimensional network structure and properties of myofibrillar proteins in surimi gel derived from freshwater fish[J].Innovative Food Science & Emerging Technologies, 2024, 94: 103673.DOI:10.1016/j.ifset.2024.103673.
[26] WENG W Y, ZHENG W X. Silver carp (Hypophthalmichthys molitrix)surimi acid-induced gel extract characteristics: a comparison with heatinduced gel[J]. International Journal of Food Properties, 2015, 18(4):821-832. DOI:10.1080/10942912.2013.864675.
[27] ZHANG D, LI H J, EMARA A M, et al. Study on the mechanism of KCl replacement of NaCl on the water retention of salted pork[J]. Food Chemistry, 2020, 332: 127414. DOI:10.1016/j.foodchem.2020.127414.
[28] ZHANG C, CHEN L, LU M X, et al. Effect of cellulose on gel properties of heat-induced low-salt surimi gels: physicochemical characteristics, water distribution and microstructure[J]. Food Chemistry: X, 2023, 19: 100820. DOI:10.1016/j.fochx.2023.100820.
[29] YANG H H, ZHONG C, SUN L C, et al. Effects of partial substitution of NaCl on myofibrillar protein properties from pearl mussel Hyriopsis cumingii muscle: structural characteristics and aggregation behaviors[J]. Food Chemistry, 2021, 356: 129734. DOI:10.1016/j.foodchem.2021.129734.
[30] HUANG X L, CUI Y Q, SHI L F, et al. Structural properties and emulsification of myofibrillar proteins from hairtail (Trichiurus haumela) at different salt ions[J]. International Journal of Biological Macromolecules, 2023, 253: 127598. DOI:10.1016/j.ijbiomac.2023.127598.
[31] 裴志胜, 薛长风, 文攀, 等. 食盐添加量对鱼糜凝胶过程中水分状态的影响[J]. 肉类研究, 2019, 33(10): 15-21. DOI:10.7506/rlyj1001-8123-20190823-19.
[32] YANG R, XU A Q, CHEN Y T, et al. Effect of laver powder on textual,rheological properties and water distribution of squid (Dosidicus gigas) surimi gel[J]. Journal of Texture Studies, 2020, 51(6): 968-978.DOI:10.1111/jtxs.12556.
[33] ZHANG C, HE Y J, ZHENG Y M, et al. Effect of carboxymethyl cellulose (CMC) on some physico-chemical and mechanical properties of unrinsed surimi gels[J]. LWT-Food Science and Technology, 2023,180: 114653. DOI:10.1016/j.lwt.2023.114653.
[34] 王红妮, 刘会平, 刘平伟, 等. 糟蛋减压加工过程中蛋黄蛋白质二级结构的变化研究[J]. 现代食品科技, 2013, 29(6): 1262-1265.DOI:10.13982/j.mfst.1673-9078.2013.06.051.