小龙虾学名克氏原螯虾(Procambarus clarkii),是一种淡水经济甲壳类动物,因其繁殖力强、摄食习性杂、生长速率快、繁殖简单而成为重要的水产资源[1]。虾肉因其蛋白质含量高、脂肪含量低[2]等特点而受到许多消费者青睐。如今,消费者除要求食物口感鲜美外,更加注重营养与健康。
热处理过程中,高温会引起肉制品中的蛋白质发生氧化,进而影响氨基酸残基的化学结构,并引发蛋白质结构变化[3]和脂质氧化[4]。传统上,人们多只关注熟制过程中肉制品是否成熟,而较少关注肉制品熟制程度对其品质和消化特性的影响。目前,许多研究关注不同加工方式对肉制品营养品质、蛋白氧化和消化特性的影响,研究发现不同热处理方式对虾肉蛋白氧化程度有显著影响。韦婕妤[5]研究表明,在相同中心点温度下,煎制和炸制处理羊肉制品蛋白氧化程度更高,且其蛋白羰基含量高于微波和蒸煮处理。熟制对蛋白结构破坏越剧烈,其氧化程度越高,这将显著降低肉制品的营养品质[1,6-7]。此外,不同加工方式会对肉制品蛋白氧化程度和结构产生不同的影响,从而造成消化率差异[8-10]。不同热处理方式对肉制品蛋白消化特性的影响差异可能与蛋白质结构破坏程度、蛋白质分子交联聚集程度不同有关。此外,蛋白质分子交联聚集会进一步掩蔽蛋白的酶切位点,从而阻碍消化酶对蛋白质的有效识别和水解,导致蛋白质消化率降低[11-12]。
本研究以小龙虾为研究对象,测定不同熟制程度虾肉微观结构和质构特性变化,以及蛋白羰基含量、巯基含量、二级结构、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)图谱等,分析不同熟制程度对虾肉品质和蛋白质消化特性的影响,筛选较佳的熟制程度,为小龙虾加工生产工艺优化提供理论依据。
1 材料与方法
1.1 材料与试剂
鲜活克氏原螯虾(160 只,体质量(22.37±1.53)g)购于武汉南湖海鲜市场。
人工模拟胃、肠消化液 福州飞净生物科技有限公司;SDS-PAGE凝胶制备试剂盒 常州伯仪生物科技有限公司;蛋白质标准品Marker 北京兰杰柯科技有限公司;考马斯亮蓝试剂盒 南京建成生物工程研究所;氯化钠、氯化钾、盐酸、硫酸、硼酸、氢氧化钠、硫酸铜、硫酸钾、磷酸二氢钾、磷酸氢二钾、磷酸二氢钠、磷酸氢二钠、乙酸乙酯、乙醇、盐酸胍、尿素、2-硫代巴比妥酸、β-巯基乙醇、5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis(2-nitrobenzoic acid),DTNB)、Tris-Maleate(均为分析纯) 国药集团化学试剂有限公司;三氯乙酸(分析纯) 上海麦克林生化科技有限公司。
1.2 仪器与设备
C21-RT21E01电磁炉 美的集团股份有限公司;FA2204电子分析天平 上海衡平仪器仪表厂;XHF-DY高速分散器 宁波新芝生物科技股份有限公司;HC-3618R高速冷冻离心机 安徽中科中佳科学仪器有限公司;TA612C中心温度计 苏州特安斯电子有限公司;SWT-100恒温水浴摇床 杭州米欧仪器有限公司;SPH620石墨消解仪 济南阿尔瓦仪器有限公司;A360紫外-可见分光光度计 翱艺仪器(上海)有限公司;TA.XT2i/50质构分析仪 英国Stable Micro System有限公司;90 Plus激光粒度分析仪 丹东百特仪器有限公司;DYY-6D电泳仪 北京六一生物科技有限公司;SU8010扫描电子显微镜 国仪量子技术(合肥)股份有限公司;NMI20-025V-I核磁共振分析仪 上海纽迈电子科技有限公司;K9840自动凯氏定氮仪 海能未来技术集团股份有限公司;Nicolet iS50傅里叶变换红外(Fourier transform infrared,FTIR)光谱仪 美国赛默飞世尔科技公司。
1.3 方法
1.3.1 样品制备
鲜活小龙虾装在置有冰块的泡沫箱中,运至实验室清洗后,随机分为4 组,冰水致死后放在蒸锅上,加入1.5 L冷水进行蒸制。采用中心温度计测定虾肉中心温度,绘制温度-时间曲线并确定蒸制时间。分别按照11.5、12、12.5、13.7 min 加热处理4 组小龙虾,使虾肉中心温度达70、80、90、100 ℃,室温自然冷却,以未经热处理的生虾(CK)为对照,剥壳取虾肉,擦干虾肉表面水分,切碎后待用。
1.3.2 肌原纤维蛋白提取率测定
参考Zhao Bing等[11]的方法并略作改动。取4 g虾肉放入10 倍体积缓冲液A(4 ℃预冷的50 mmol/L KCl-20 mmol/L Tris-Maleate、pH 7)中,4 000 r/min匀浆30 s后,8 000 r/min、4 ℃离心10 min,弃上清液,重复操作2 次。沉淀用5 倍体积缓冲液B(0.6 mol/L KCl-20 mmol/L Tris-Maleate、pH 7)溶解并混匀,4 ℃下搅拌浸提1 h后,离心30 min(9 000 r/min、4 ℃),所得上清液为肌原纤维蛋白溶液,使用考马斯亮蓝试剂盒在495 nm处测定蛋白含量。肌原纤维蛋白提取率按式(1)计算:
式中:m0为提取的肌原纤维蛋白质量/g;m为虾肉样品质量/g。
1.3.3 体外静态消化和蛋白消化率测定
参考Brodkorb等[12]的静态体外胃肠消化方案并适当修改。取不同熟制程度虾肉各4 g,分别装入50 mL离心管,每组3 份,使用人工模拟胃、肠消化液消化,消化完毕后90 ℃高温水浴5 min,灭酶终止反应,冷却后离心(8 000 r/min、20 min),将消化残留沉淀和上清液分别于-18 ℃冻藏待测。整个消化过程在37 ℃恒温振荡水浴锅(180 r/min)中进行。消化后沉淀物中的蛋白质含量参考Zhang Wangang等[13]的方法测定。每个样品重复3 次,蛋白消化率按式(2)计算:
式中:w0和wT分别为消化前和消化后样品的蛋白质量分数/%。
1.3.4 粒径测定
将消化液稀释20 倍,采用激光粒度分析仪测定平均粒径,每组设置6 个平行。
1.3.5 羰基和巯基含量测定
蛋白质羰基含量测定参考Zhang Wangang等[13]的方法并略作改动。称取2 g虾肉,每组3 个平行,加入10 mL 0.6 mol/L NaCl-20 mmol/L磷酸缓冲溶液(pH 6.5)后,均质(6 000 r/min、30 s)处理后离心(8 000 r/min、20 min、4 ℃);取0.8 mL上清液与0.4 mL 10 mmol/L 2,4-二硝基苯肼-2 mol/L HCl溶液37 ℃黑暗中反应1 h;加入三氯乙酸(1 mL,40 g/mL)后离心(8 000 r/min、10 min、4 ℃)获得沉淀。采用1 mL乙酸乙酯-乙醇(1∶1,V/V)溶液多次洗涤沉淀,直至上清液为无色透明,然后加入3 mL 6 mol/L盐酸胍溶液,37 ℃反应30 min。采用紫外分光光度计在370 nm波长处测定吸光度(A370 nm)。同时,采用考马斯亮蓝法测定蛋白质含量。羰基含量按式(3)计算:
式中:n为比色皿光程(1 cm);ε为羰基分子摩尔吸光系数(22 000 L/(mol·cm);ρ为上清液蛋白质量浓度/(mg/mL)。
巯基含量测定参考Kang Dacheng等[14]的方法并作修改。称取2 g虾肉,每组3 个平行。加入10 mL 50 mmol/L磷酸缓冲溶液(pH 8.0)后,均质处理(6 000 r/min、30 s)后离心(8 000 r/min、20 min、4 ℃)。取1 mL上清液,10 倍稀释后取4 mL,加入0.02 mL 2 mmol/L DTNB溶液,25 ℃避光反应1 h,采用紫外分光光度计在412 nm波长处测定吸光度(A412 nm)。巯基含量按式(4)计算:
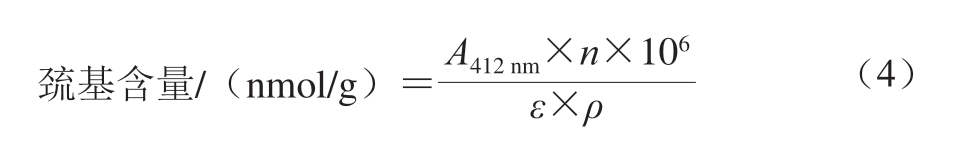
式中:n为比色皿光程(1 cm);ε为巯基分子摩尔吸光系数(13 600 L/(mol·cm);ρ为上清液蛋白质量浓度/(mg/mL)。
1.3.6 表面疏水性测定
参考Chelh等[15]的方法并略有改动。将0.2 mL 1 mg/mL溴酚蓝(bromophenol blue,BPB)溶液加入1 mL 5 mg/mL肌原纤维蛋白质溶液(1.3.2节)中,离心(8 000 r/min、15 min、4 ℃),取上清液稀释10 倍,采用紫外分光光度计在590 nm波长处测定吸光度(A)。将5 mL磷酸盐缓冲溶液(20 mmol/L、pH 6.0)和1 mL BPB溶液(1 mg/mL)均匀混合,作为BPB空白样,吸光度记为A0,采用磷酸缓冲溶液(20 mmol/L、pH 6.0)调零。每个样品至少平行测定3 次。蛋白质表面疏水性以每毫克肌原纤维蛋白的BPB结合量表示,按式(5)计算:
1.3.7 二级结构测定
参考Yang Huanhuan等[16]的方法,采用FTIR光谱仪分析肌原纤维蛋白的二级结构。将提取的肌原纤维蛋白溶液-80 ℃预冻12 h,置于冷冻干燥机冷冻干燥(-50 ℃、10 Pa、48 h)。准确称量冷冻干燥样品粉末2 mg、溴化钾200 mg,研磨压片后进行扫描,扫描范围400~4 000 cm-1,根据各指认峰及其面积分析蛋白二级结构变化。
1.3.8 SDS-PAGE分析
参考Wang Chong等[17]的方法并稍加改动,采用12%蛋白预制胶。将肌原纤维蛋白溶液(1.3.2节)质量浓度调至5 mg/mL,电泳分离后,采用0.025 g/100 mL考马斯亮蓝混合液染色4 h,再采用脱色液(甲醇和乙酸等体积混合)脱色,对凝胶进行拍照。
1.3.9 持水力(water-holding capacity,WHC)和蒸煮损失率测定
参考Xie Yong等[18]的方法并略作修改,称取2 g虾肉样品,用滤纸折叠包裹,每个样品设置3 个平行。空离心管质量为m0/g,样品与离心管总质量为m1/g,10 000 r/min、4 ℃离心10 min,弃去管中水分后称取总质量m2/g。WHC按式(6)计算:
随机选3 只小龙虾,称取质量(精确到0.1 g),记为m1/g,按1.3.1节方法蒸制处理,冷却至室温,擦干表面水分称取质量,记为m2/g,蒸煮损失率按式(7)计算:
1.3.10 低场核磁共振测定和磁共振成像
采用核磁共振分析仪进行低场核磁共振弛豫测定,将3.00 g虾肉样品放置在直径为4 cm的核磁共振管中。使用Carr-Purcell-Meiboom-Gill序列测定横向弛豫时间(T2),获得T2分布谱图,并分析不同状态水分相对含量。
1.3.11 化学作用力测定
参考Lu Weiwei等[9]的方法并加以修改,测定肌原纤维蛋白分子间化学作用力。采用磷酸钠缓冲液(50 mmol/L、pH 6.0)将肌原纤维蛋白溶液稀释至15 mg/mL,涡旋30 s。然后,在5 mL样品中分别加入20 mL A1(0.05 mol/L NaCl)、A2(0.6 mol/L NaCl)、A3(0.6 mol/L NaCl、1.5 mol/L尿素)、A4(0.6 mol/L NaCl、8 mol/L尿素)和A5(0.6 mol/L NaCl、8 mol/L尿素和0.05 mol/L β-巯基乙醇),均质30 s,4 ℃孵育90 min,4 ℃、5 000×g离心10 min,采用Bradford法测定上清液中蛋白质含量。以特定溶液中蛋白质质量浓度差值确定离子键(A2、A1之间的差值)、氢键(A3、A2之间的差值)、疏水相互作用(A4、A3之间的差值)和二硫键(A5、A4之间的差值)贡献。
1.3.12 苏木精-伊红(hematoxylin & eosin,H&E)染色切片观察
根据刘晓芳等[19]的方法并略作修改,将虾肉样品切成1 cm×1 cm×1 cm小块,在4 g/100 mL多聚甲醛溶液中浸泡12 h以固定虾肉,采用体积分数75%~100%乙醇溶液洗脱样品,脱去水分后使用石蜡包埋。切片后进行H&E染色,使用光学显微镜观察组织形态。
1.3.13 质构特性测定
参考Liu Dongyin等[20]方法并略作修改。将虾肉样品切成1 cm×1 cm×1 cm小块,采用配备36 mm圆柱形探针(P36/R)的质构分析仪测定其质构特性,触发力5 g,形变至50%时停止,测前、测中、测后速率均为1 mm/s。每个处理组设置5 个平行。
1.4 数据处理
采用Origin 2023软件进行方差分析,数据表示为平均值±标准差,采用Tukey检验进行显著性分析,以P<0.05表示差异显著。
2 结果与分析
2.1 不同中心温度对虾肉肌原纤维蛋白提取率的影响
肌原纤维蛋白是组成肌肉中肌原纤维的一类蛋白[21]。肌原纤维蛋白在受热或氧化过程中易发生变性和聚合,从而导致提取率下降。因此,肌原纤维蛋白提取率变化可作为判断蛋白质变性和聚合程度的指标之一。Wu Zixuan等[22]研究表明,肌原纤维蛋白提取率低于11%说明蛋白疏水性增大,肉中蛋白质发生严重的氧化变性。由图1可知,随着虾肉中心温度的升高,肌原纤维蛋白提取率呈显著下降趋势(P<0.05)。虾肉中心温度90 ℃时,肌原纤维蛋白提取率为9.16%。畅鹏等[23]研究发现,鲤鱼肌原纤维蛋白随温度的升高发生变性和聚集,溶解度下降。热加工时间的延长使虾肉蛋白质发生剧烈氧化,更多的内部疏水性基团暴露[24],导致蛋白质-水相互作用减弱[25],这可能是肌原纤维蛋白提取率下降的主要原因。综上,虾肉中心温度达90 ℃及以上时,虾肉蛋白将发生剧烈的氧化变性与聚集。
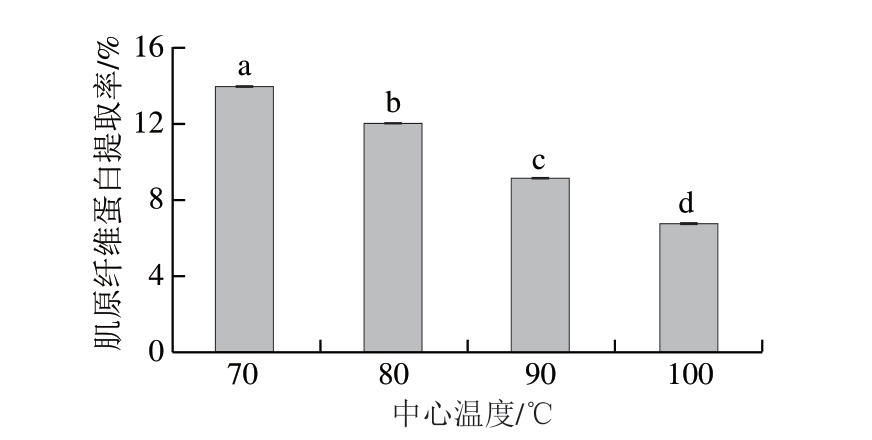
图1 不同中心温度对虾肉肌原纤维蛋白提取率的影响
Fig. 1 Effect of different internal temperatures on the extraction yield of myofibrillar proteins from crayfish meat
小写字母不同表示组间差异显著(P<0.05)。图2~4、7、9、11同。
2.2 不同中心温度对虾肉蛋白消化率和粒径的影响
蛋白质消化率可反映肉类品质[26]。由图2A可知,虾肉蛋白消化率随中心温度的上升呈先显著上升后显著下降的趋势(P<0.05),在中心温度90 ℃时达到最大值(61.73%)。适度氧化诱导蛋白质结构展开并暴露消化位点,进而提高消化率[27],但温度过高会引起蛋白过度氧化[28],使其发生交联和聚集,导致消化率下降[29]。
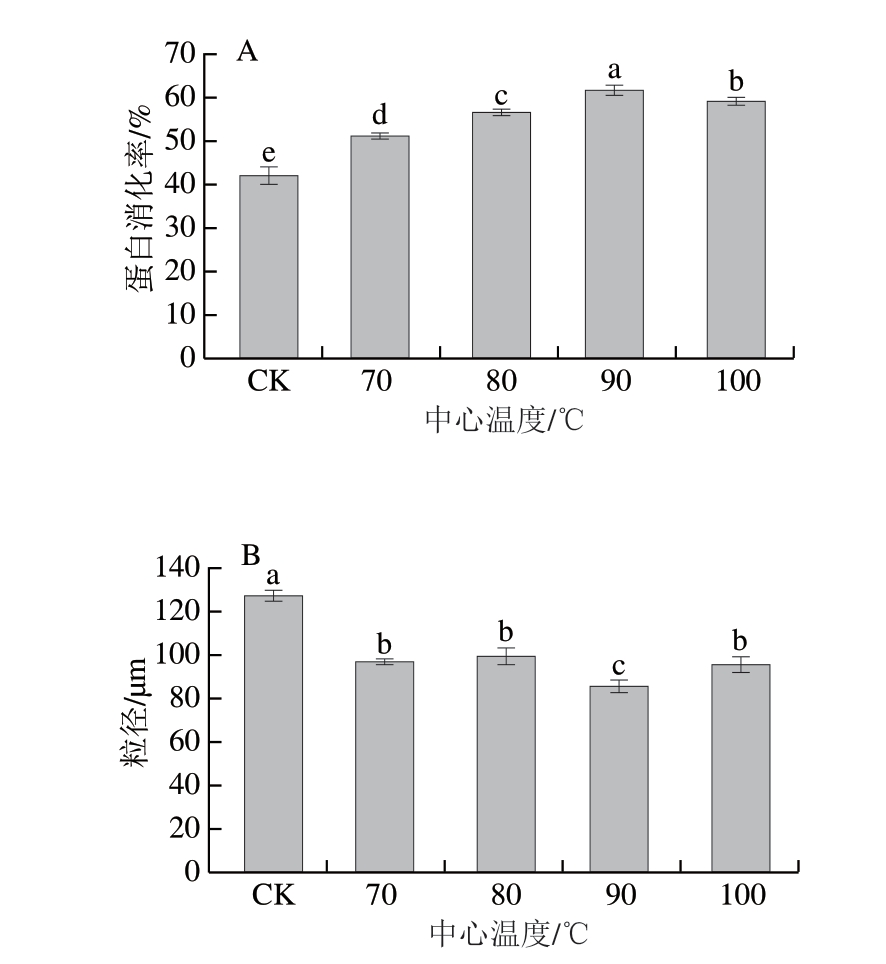
图2 不同中心温度对虾肉蛋白消化率(A)和粒径(B)的影响
Fig. 2 Effect of different internal temperatures on protein digestibility (A) and particle size (B) of crayfish meat
粒径可反映样品消化效果,粒径越小,表明消化效果越好[30]。由图2B可知,在中心温度90 ℃时,虾肉蛋白粒径最小,这与蛋白消化率结果相对应。说明虾肉中心温度在90 ℃时,蛋白消化效果最好。然而,进一步提高熟制程度会引起蛋白消化特性降低,这可能与进一步提高温度导致虾肉蛋白过度氧化而发生交联与聚集有关。此外,过度氧化会掩盖消化酶识别位点或降低消化酶敏感性[31],因此虾肉蛋白粒径呈现先降低后增大的变化趋势。
2.3 不同中心温度对虾肉肌原纤维蛋白羰基和巯基含量的影响
羰基化合物的形成是蛋白质氧化的标志[32]。由图3A可知,生虾肉蛋白羰基含量为1.095 nmol/mg。随着中心温度的升高,羰基含量显著增加(P<0.05),在中心温度100 ℃时达到最大值(3.569 nmol/mg),说明中心温度升高可加剧虾肉蛋白质氧化。这与先前研究[10,33]结果一致,高温引起的羰基含量增加主要与高温诱导产生的活性氧自由基导致蛋白质氧化有关。
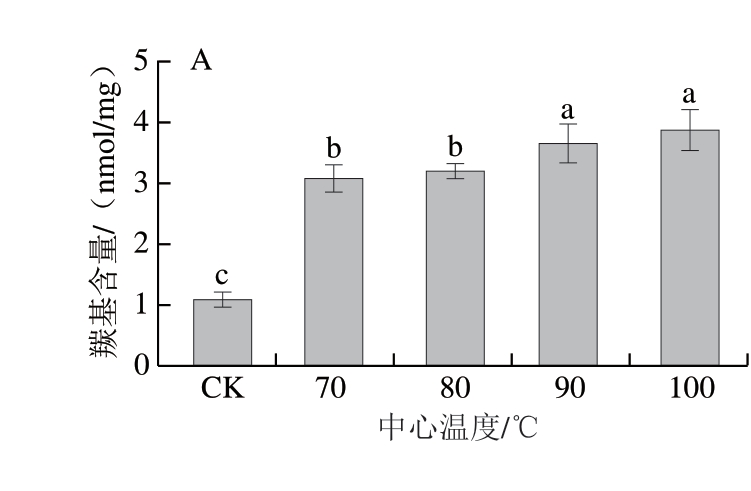
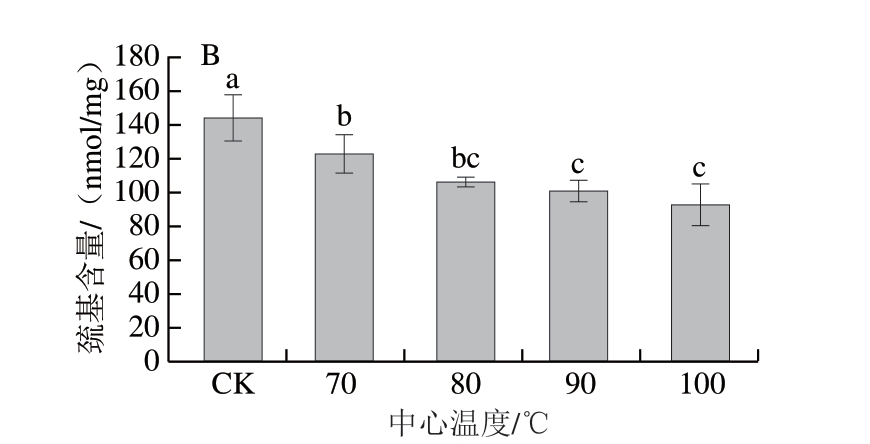
图3 不同中心温度对虾肉肌原纤维蛋白羰基含量(A)和巯基含量(B)的影响
Fig. 3 Effects of different internal temperatures on the carbonyl content (A) and sulfhydryl content (B) of myofibrillar proteins from crayfish meat
由图3B可知,生虾蛋白巯基含量为143.908 nmol/mg,随着中心温度的升高,虾肉蛋白巯基含量显著降低(P<0.05),在中心温度100 ℃时达到最小值(92.684 nmol/mg),降低35.59%。这可能是由于高温引起蛋白质表面的巯基和其他氨基酸侧链氧化,巯基形成二硫键,导致游离巯基含量降低。此外,蛋白质内部的氨基酸残基暴露并受到自由基攻击,也可能进一步促进巯基氧化[10]。
综上,高温条件诱导虾肉蛋白的氨基酸侧链氧化或蛋白质骨架氧化裂解,造成蛋白羰基含量升高和巯基含量下降。
2.4 不同中心温度对虾肉肌原纤维蛋白表面疏水性的影响
肌原纤维蛋白表面疏水性的改变是蛋白质去折叠的结果[34],BPB能与蛋白质中的疏水氨基酸残基发生相互作用,因此可通过两者间的结合程度判断表面疏水性变化。由图4可知,表面疏水性随着中心温度的升高而显著升高(P<0.05),生虾肌原纤维蛋白的BPB结合量为269.06 μg/mg,中心温度达到100 ℃后,BPB结合量为841.58 μg/mg。这可能是因为温度升高导致蛋白质结构改变、氢键断裂、双螺旋结构展开,生成或暴露出更多疏水性基团[24]。因蛋白消化酶(如胃蛋白酶、胰蛋白酶)多为亲水性,这也将导致虾肉蛋白与消化酶结合率下降,从而造成蛋白消化率下降。但本研究虾肉蛋白消化率随中心温度上升而显著升高(P<0.05),在中心温度达100 ℃时才出现显著下降(P<0.05),这可能是由于升温过程中,蛋白质结构伸展,更多的消化酶结合位点暴露,减弱了表面疏水性增大导致消化酶结合率下降的负面影响。
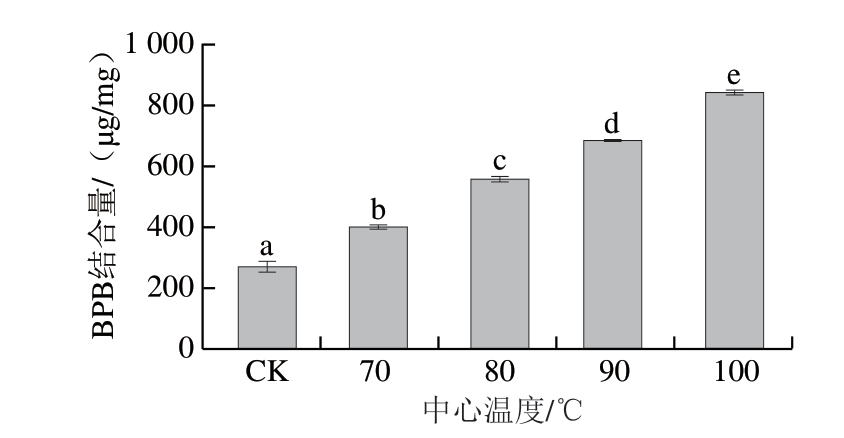
图4 不同中心温度对虾肉肌原纤维蛋白表面疏水性的影响
Fig. 4 Effect of different internal temperatures on the surface hydrophobicity of myofibrillar proteins in crayfish meat
2.5 不同中心温度对虾肉肌原纤维蛋白二级结构的影响
熟制处理可改变肉类蛋白质结构。FTIR光谱图的酰胺I带(1 600~1 700 cm-1)反映蛋白质二级结构中的α-螺旋、β-折叠、β-转角和无规卷曲结构[35]。由图5A可知,不同中心温度虾肉肌原纤维蛋白在酰胺I带的特征峰波数与CK存在明显差异。这可能是由于高温引起蛋白质结构改变,肽链的化学作用稳定性被破坏,内部某些基团(C=O、N—H)暴露,导致波数发生变化。
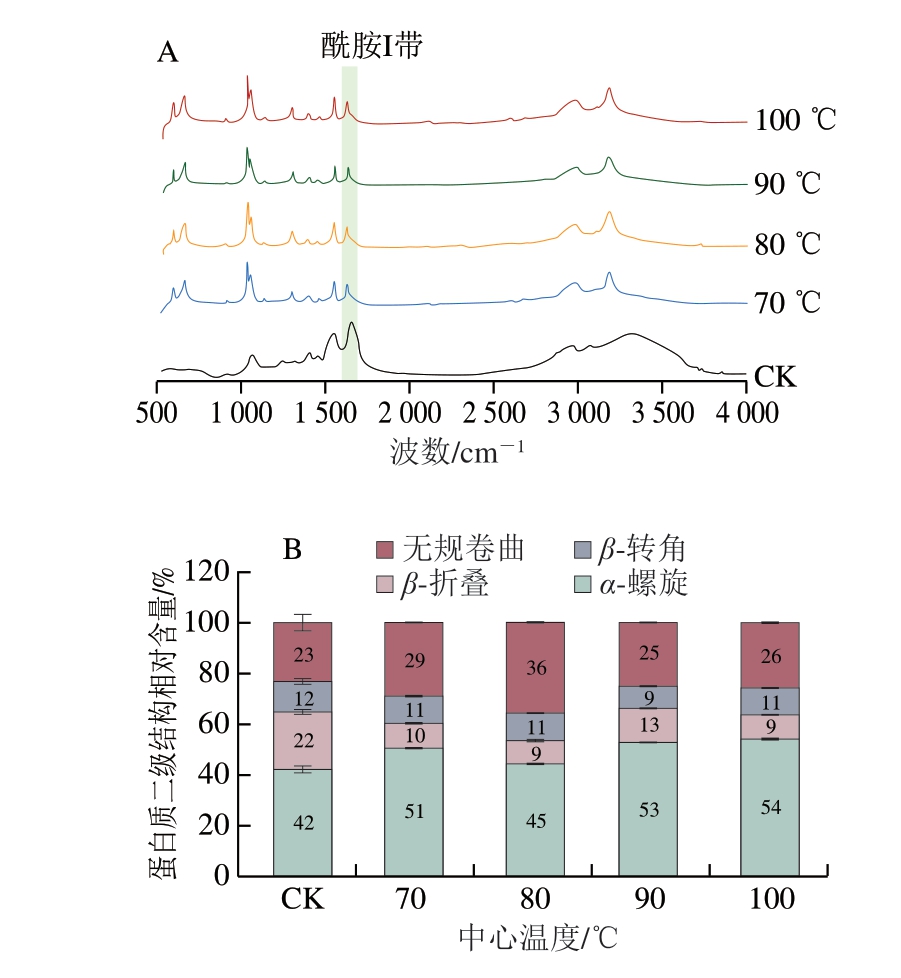
图5 不同中心温度对虾肉肌原纤维蛋白FTIR光谱(A)与二级结构相对含量(B)的影响
Fig. 5 Effect of different internal temperatures on the FTIR spectra (A) and relative content of secondary structures (B) of myofibrillar proteins in crayfish meat
由图5B可知,在生虾肌原纤维蛋白二级结构中,α-螺旋相对含量最高(42%),β-转角相对含量最低(12%)。随着中心温度的上升,α-螺旋相对含量增加,β-折叠相对含量减少,β-转角和无规卷曲相对含量呈波动变化。蛋白质二级结构变化与其相互转化有关[35]。王一帆[36]研究发现,随着加热温度的上升,扇贝蛋白的α-螺旋相对含量下降,β-折叠相对含量增加,这是因为蛋白分子内氢键被高温破坏,疏水相互作用增强、二硫键含量增加,导致部分二级结构向β-折叠结构转变[37]。而本研究中虾肉肌原纤维蛋白α-螺旋相对含量增加可归因于高温导致的蛋白二级结构重排(C—N伸缩振动和N—H弯曲振动变化),以及内部疏水性基团暴露引起的蛋白疏水区局部结构和三级结构改变[38]。另外,β-转角相对含量被认为是影响蛋白质消化率的因素之一,其比例越高,蛋白水解抗性越高[39]。与中心温度90 ℃相比,中心温度达到100 ℃时虾肉肌原纤维蛋白的β-转角相对含量增加,蛋白聚集程度进一步加强,水解抗性增强[40],这与蛋白消化率结果相对应。
2.6 不同中心温度对虾肉肌原纤维蛋白SDS-PAGE图谱的影响
由图6可知,各组蛋白电泳条带与生虾肌原纤维蛋白电泳条带存在明显差异,说明热处理改变了虾肉肌原纤维蛋白组成。其中,肌球蛋白重链200 kDa条带和辅肌动蛋白75 kDa条带完全消失。随着中心温度的上升,肌动蛋白43 kDa、原肌球蛋白35 kDa条带均变宽。此外,30 kDa和20 kDa低分子质量蛋白条带也随中心温度的升高而逐渐变宽。肌球蛋白重链具有一定的稳定性[41],其条带丢失可能与高温诱导结构改变、疏水残基暴露所导致的蛋白分子展开与聚集[29]等有关,这与表面疏水性结果相对应。随着中心温度的不断上升,肌动蛋白变性并形成聚集体[28],这可以解释升温过程中35 kDa条带变宽现象。另外,原肌球蛋白由2 条平行的多肽链组成α-螺旋构型,蛋白质受热变性后,去折叠生成大量多肽链,这些多肽链通过聚集和相互作用形成类似α-螺旋的构型,也会导致35 kDa条带变宽[42]。随着中心温度的升高,30 kDa和20 kDa低分子质量蛋白条带变宽,表明大分子质量蛋白质发生降解。此外,肌原纤维蛋白在加热后聚集会导致分子质量变大,无法通过浓缩凝胶形成电泳带,导致部分蛋白电泳条带变浅甚至消失。
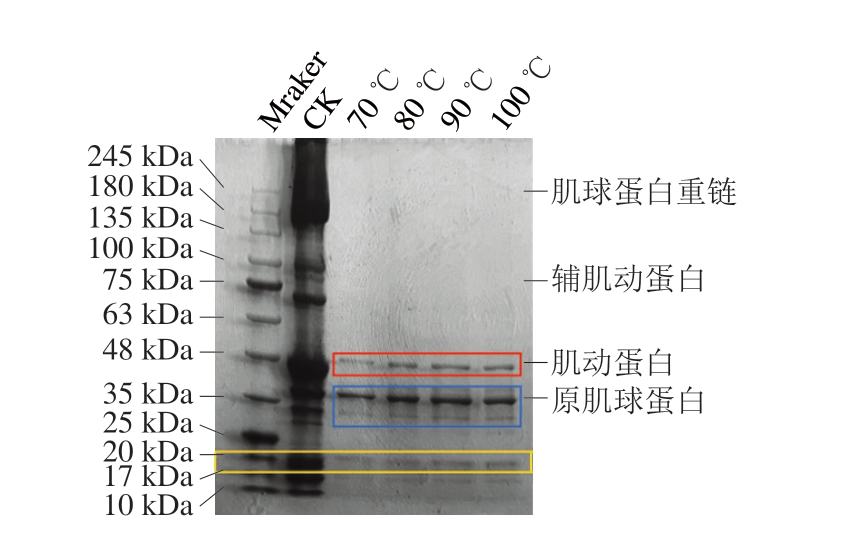
图6 不同中心温度虾肉肌原纤维蛋白的SDS-PAGE图谱
Fig. 6 SDS-PAGE profiles of myofibrillar proteins in crayfish meat at different internal temperatures
2.7 不同中心温度对虾肉蒸煮损失率和WHC的影响
由图7A可知,随着虾肉中心温度的升高,蒸煮损失率显著升高(P<0.05),在100 ℃时达到最大值(15.95%)。这与已报道[43]结果相一致,鱼肉中心温度越高,其空间结构破坏程度越高,蒸煮损失率越大。一方面,蛋白氧化可导致虾肉肌原纤维网络结构、肌肉组织微观结构被破坏,汁液损失增加[44]。另一方面,高温导致的蛋白表面疏水性增加可降低其对水分的束缚能力,进一步加剧汁液损失。
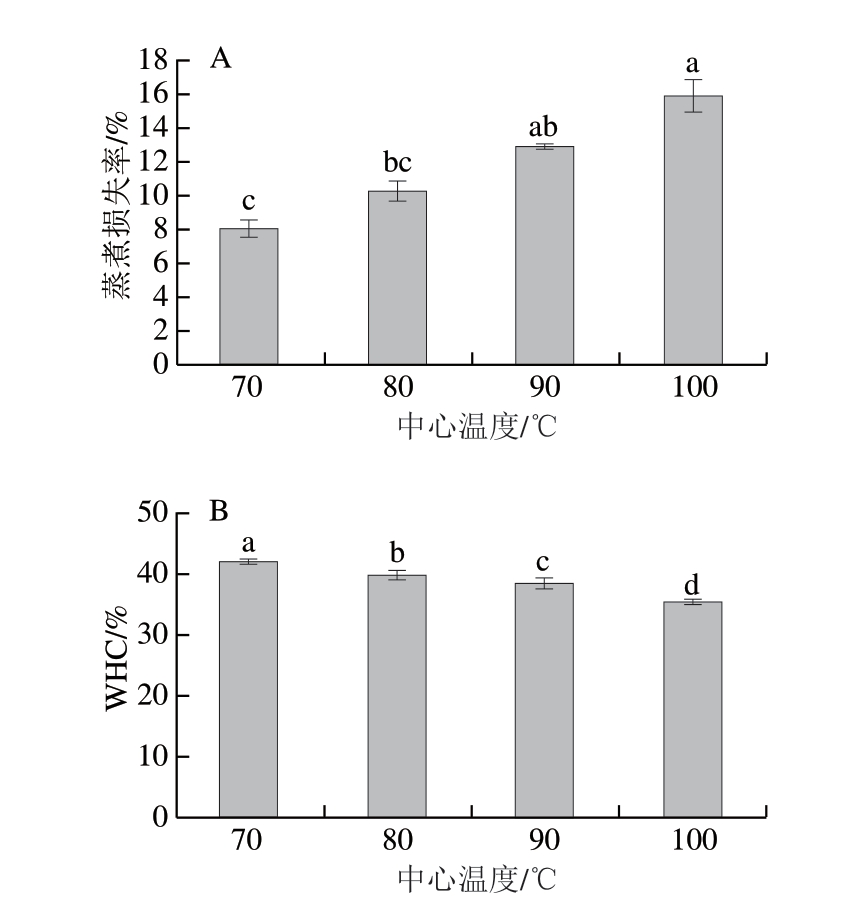
图7 不同中心温度对虾肉蒸煮损失率(A)和WHC(B)的影响
Fig. 7 Effect of different internal temperatures on the cooking loss (A) and water-holding capacity (B) of crayfish meat
由图7B可知,随着中心温度的升高,虾肉WHC显著降低(P<0.05)。肌肉中的大部分水分基于毛细管作用和静电相互作用等滞留于肌原纤维内部[15],高温引发肌原纤维内部微环境变化[45],导致吸附的水分被释放出来。然而,WHC降低幅度相对较小,可能是因为高温诱导蛋白质发生交联与聚集,因此形成的致密而有序的三维网状结构[7]将水分截留在内,从而缓解高温引发的水分流失现象。
2.8 不同中心温度对虾肉水分分布的影响
由图8A可知,在低场核磁共振曲线的3 个峰中,T2b(0.1~1 ms)对应的结合水通常与肌肉蛋白上亲水性基团紧密结合,并可与周围水分子不断交换。T21(10~100 ms)对应的不易流动水位于肌原纤维蛋白结构中,对温度较为敏感[18],易发生迁移。T22(100~1 000 ms)对应的自由水是水分流失的主要来源[46]。中心温度100 ℃虾肉的T2b较其他组略有延长,而随中心温度的升高,T21峰值呈下降趋势,在100 ℃时达到最低值(200.09),T22随中心温度的升高而延长,表明水分流动性增强,说明虾肉中心温度达100 ℃时,蛋白质发生剧烈变性和聚集,掩蔽亲水性基团并暴露出更多的疏水性基团,导致结合水流失。T21峰值下降是因为高温破坏了肌原纤维蛋白结构,降低了组织微观结构截留水分的能力[47]。在温和加热条件下,自由水会从肉的内部转移到表面,在一定程度上有助于缓解表面温度的急剧升高,但会导致自由水含量降低[48]。另一方面,高温会引起肌原纤维外部区域空间增加,使自由水稳定性降低。
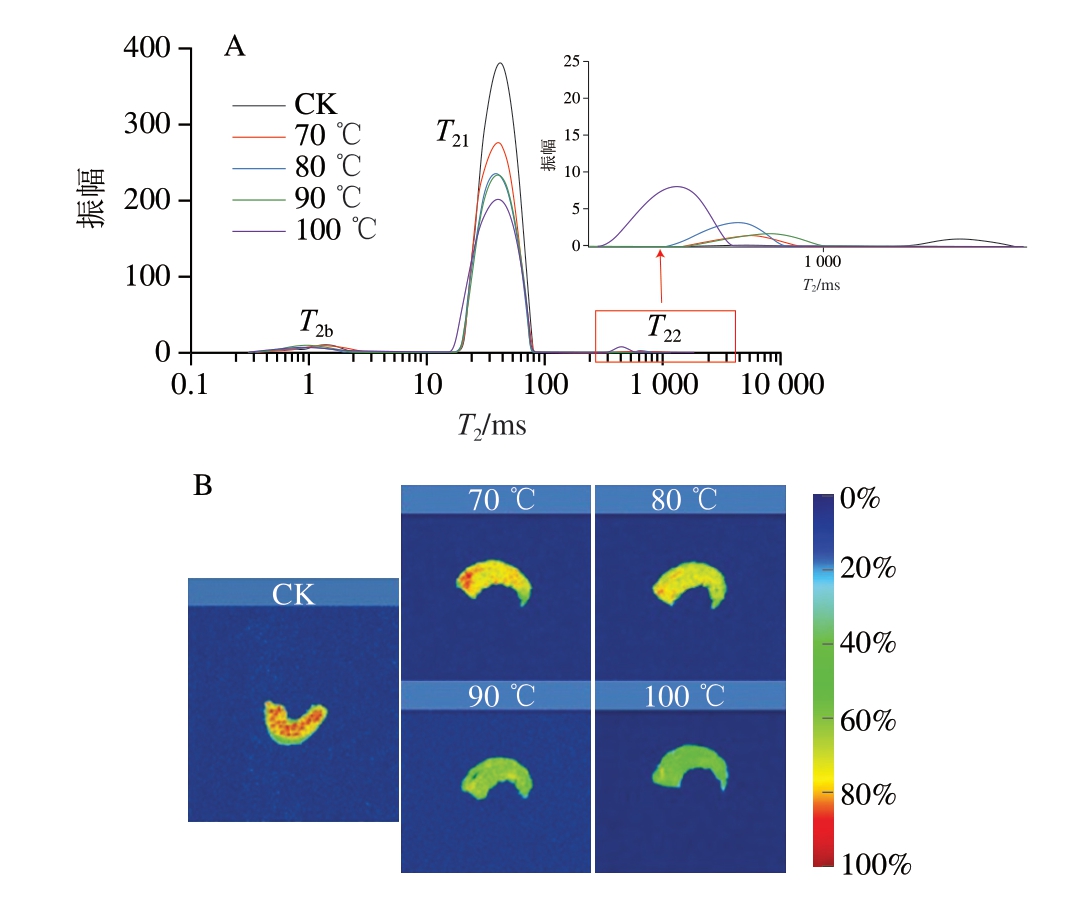
图8 不同中心温度虾肉低场核磁共振弛豫谱(A)与伪彩图(B)
Fig. 8 Low-field nuclear magnetic resonance relaxation spectra (A) and pseudo-color images (B) of crayfish meat at different internal temperatures
伪彩图红色区域表示氢质子密度高、水分含量高,蓝色区域表示氢质子密度低、水分含量低。
由图8B可知,70 ℃虾肉样品的红色区域更大、分布更均匀,随着中心温度的升高,虾肉样品的红色区域逐渐减少,特别是虾肉中心温度达到100 ℃时,红色区域几乎消失。这表明高温造成肌纤维细胞破坏,进而导致肌原纤维蛋白及其他大分子固定水分的能力下降[49],造成水分流失。该变化与蒸煮损失率、WHC结果相一致。随着中心温度的升高,虾肉蛋白暴露出更多的疏水性基团,失水程度不断增加,进而对虾肉品质造成影响。
2.9 不同中心温度对虾肉肌原纤维蛋白化学作用力的影响
肌原纤维蛋白结构的整体稳定性由化学作用力维持。由图9可知,随着中心温度的升高,虾肉中二硫键和疏水相互作用含量呈显著上升趋势(P<0.05),而离子键和氢键含量呈显著下降趋势(P<0.05)。二硫键在稳定肽链空间结构方面起着重要作用。随着中心温度的升高,疏水键可能会展开,二硫键也开始形成。此外,温度升高还可能导致氢键断裂、离子键解离。这些作用力的变化不仅影响肽链的稳定性,还可能促进蛋白质与自由基之间的反应,进一步改变蛋白质的功能状态[50],表面疏水性的不断增加引起蛋白质聚集,这将掩盖虾肉蛋白的部分消化位点并降低蛋白酶敏感性,这也可以解释中心温度100 ℃时蛋白消化率略微下降的现象。氢键和离子键含量降低主要是因为高温破坏蛋白结构,使其螺旋结构逐步展开,氢键和离子键断裂,而氢键断裂被认为是表面疏水性增加的主要原因[51]。这些不良的变化均与上述指标变化对应,随着虾肉中心温度的升高,尤其是在100 ℃时,氢键的大量断裂不仅显著降低蛋白束缚水分的能力,也显著降低消化酶与蛋白位点之间的结合效率[24],造成蛋白消化率显著降低。
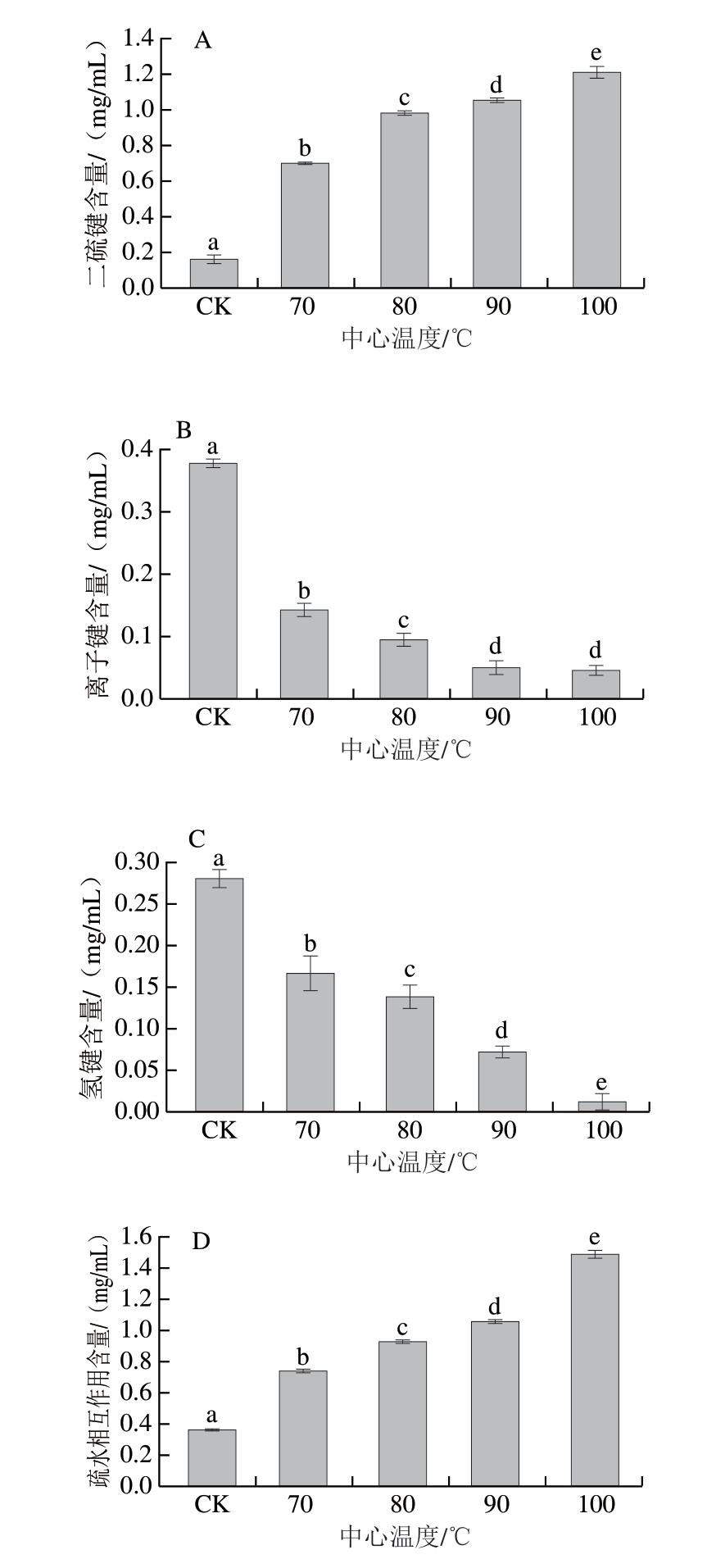
图9 不同中心温度对虾肉肌原纤维蛋白二硫键(A)、离子键(B)、氢键(C)和疏水相互作用含量(D)的影响
Fig. 9 Effect of different internal temperatures on the contents of disulfide bonds (A), ionic bonds (B), hydrogen bonds (C), and hydrophobic interactions (D) of myofibrillar proteins in crayfish meat
2.10 不同中心温度对虾肉微观结构的影响
由图10可知,生虾肌纤维间隙小、排列紧密、肌纤维结构清晰。熟制处理后,无论是在虾肉横切面还是纵切面均可观察到肌纤维间隙增大,且间隙随着中心温度升高而增大。这可能是高温使肌纤维脱水收缩、蛋白质骨架解聚、肌纤维束变得松散并进行空间重组所致[52]。中心温度低于80 ℃时,虾肉微观结构变化较小,中心温度超过80 ℃后,其微观结构发生显著变化。这表明高温使肌原纤维收缩,引起蛋白质变性与聚集,同时造成水分流失。
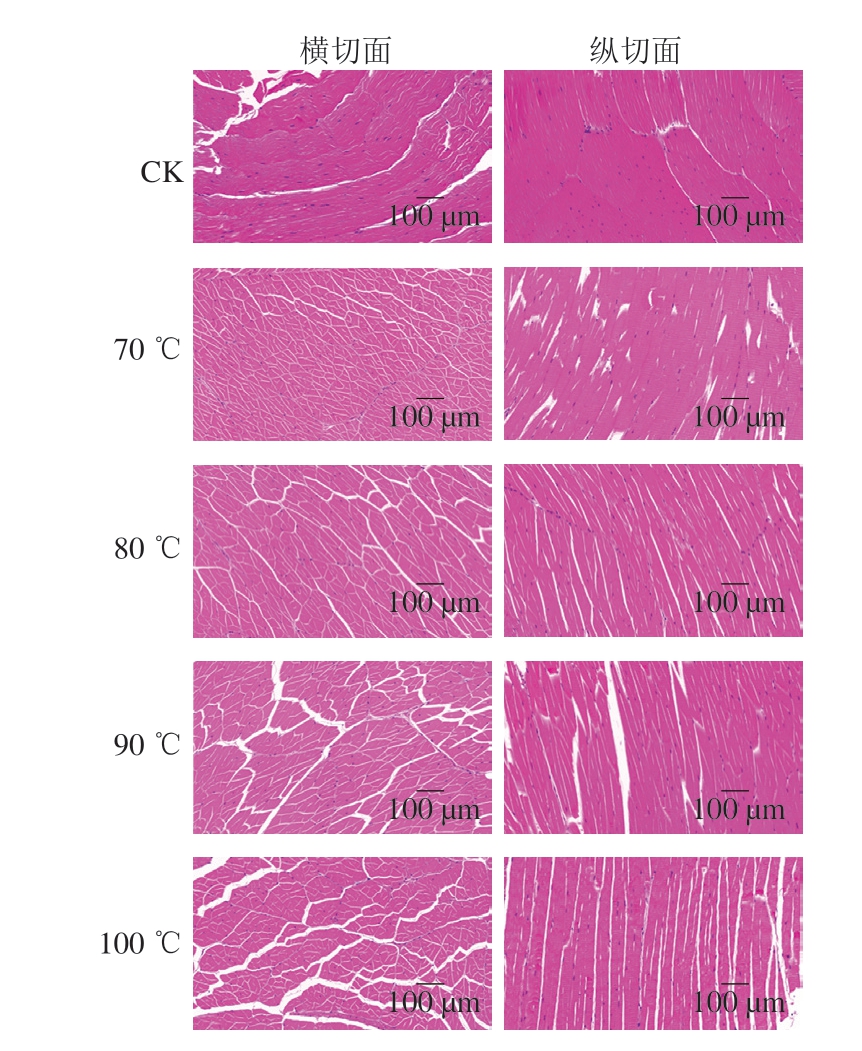
图10 不同中心温度对虾肉微观结构的影响
Fig. 10 Effect of different internal temperatures on the microstructure of crayfish meat
2.11 不同中心温度对虾肉质构特性的影响
肌肉微观结构与其质构特性联系紧密[53],水分流失、蛋白质氧化等均会导致虾肉质构特性发生变化。由图11可知,随着中心温度的升高,虾肉的硬度、黏附性和咀嚼性均显著升高(P<0.05),但弹性变化不显著(P>0.05)。肉类质构特性受多种因素影响,其中蛋白质水解、变性和水分流失是2 个关键因素[54]。蛋白质水解、变性是指在加热或酶解作用下,肉类蛋白三维结构被破坏,导致其功能改变,进而影响肉质。水分流失可使蛋白质聚集程度增加,导致肉质变得干硬。虾肉肌原纤维蛋白氧化程度随着中心温度的升高而增大,肌原纤维收缩剧烈,水分损失加剧,进而造成硬度和咀嚼性增加,导致肉质下降。
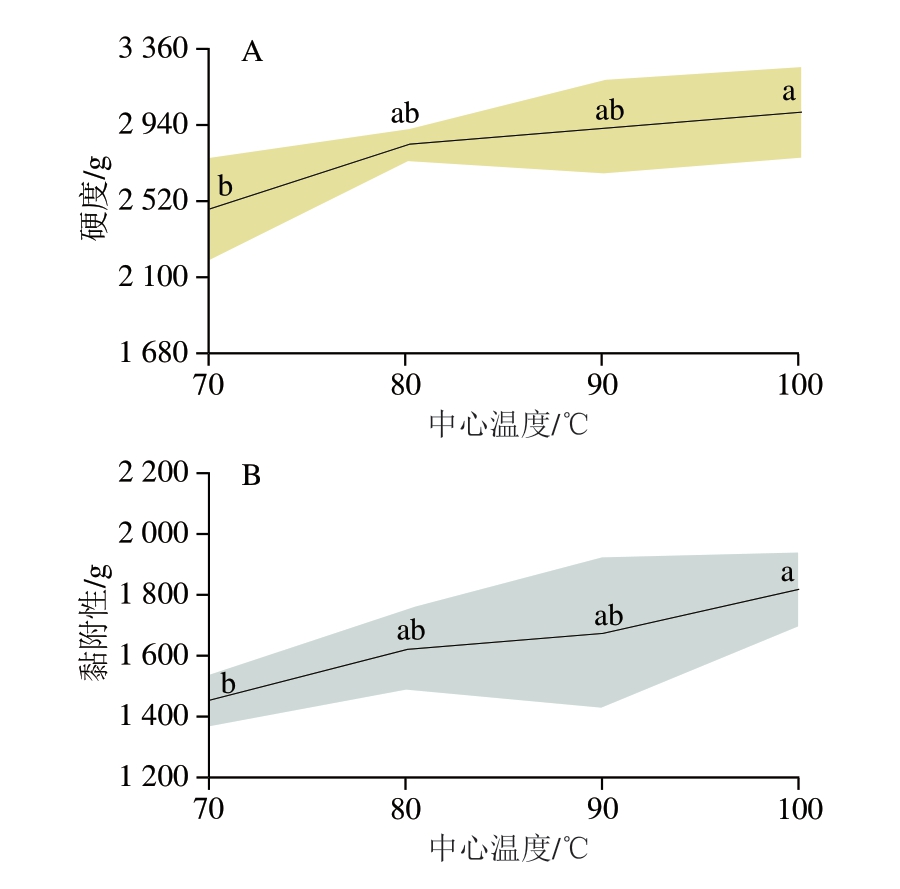
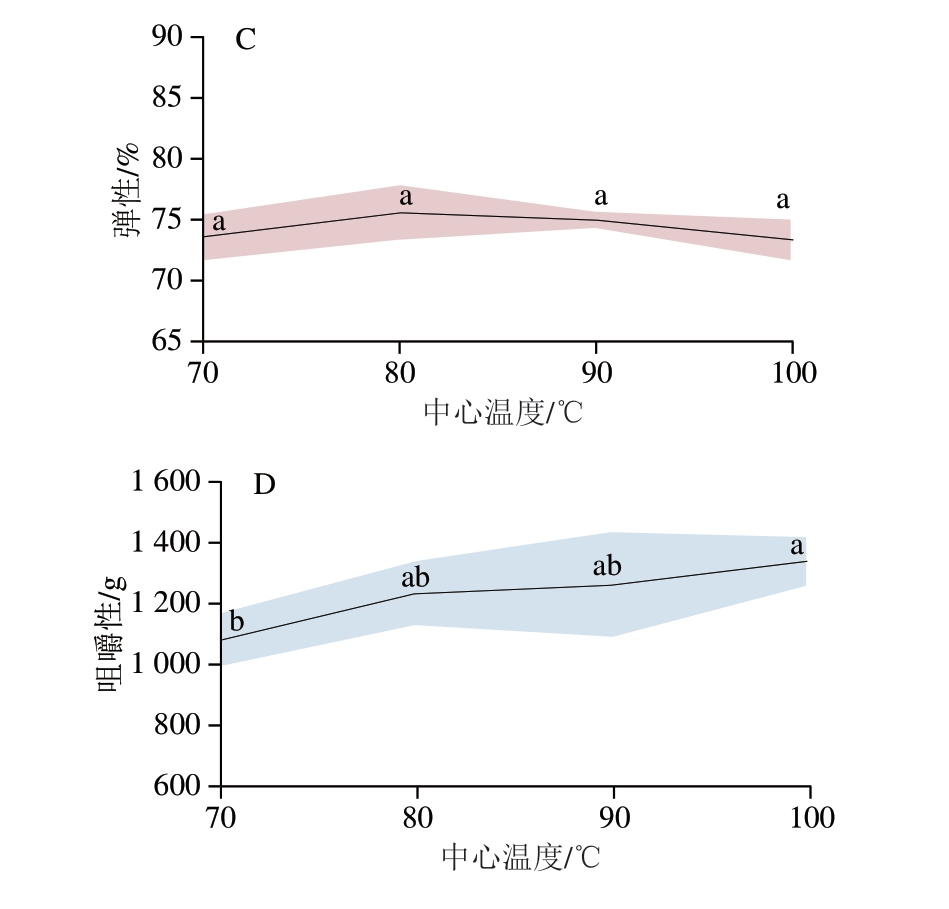
图11 不同中心温度对虾肉硬度(A)、黏附性(B)、弹性(C)和咀嚼性(D)的影响
Fig. 11 Effect of different internal temperatures on the hardness (A),gumminess (B), springiness (C), and chewiness (D) of crayfish meat
3 结论
随着中心温度的升高,虾肉WHC和巯基含量均呈下降趋势,表面疏水性和羰基含量均呈上升趋势。中心温度90 ℃时,虾肉蛋白消化率较优,硬度、咀嚼性和蛋白氧化程度适宜。综合微观结构、质构特性和蛋白二级结构变化可知,随着虾肉中心温度的升高,蛋白质结构稳定性被破坏,肌纤维束间隙增加,水分损失加剧,进而造成虾肉消化特性和肉质发生显著变化。综上,中心温度达90 ℃时,虾肉蛋白表现出较佳的消化率并保持较好地质地和适当的水分含量,中心温度进一步上升则会导致虾肉肉质下降。本研究结果可为小龙虾产品的热加工提供理论支撑,进一步促进小龙虾产品的综合开发与利用。
[1] YANG B, ZHANG Y L, JIANG S T, et al. Effects of different cooking methods on the edible quality of crayfish (Procambarus clarkii)meat[J]. Food Chemistry Advances, 2023, 2: 100168. DOI:10.1016/j.focha.2022.100168.
[2] CHEN Y D, CHEN H, GONG F S, et al. A comparison of eating safety and quality of live and dead freshwater crayfish (Procambarus clarkii)at different stages[J]. Food Research International, 2022, 159: 111630.DOI:10.1016/j.foodres.2022.111630.
[3] LIU Y Y, ZHANG L T, GAO S, et al. Effect of protein oxidation in meat and exudates on the water holding capacity in bighead carp(Hypophthalmichthys nobilis) subjected to frozen storage[J]. Food Chemistry, 2022, 370: 131079. DOI:10.1016/j.foodchem.2021.131079
[4] 张苗靖, 郭庆启, 符群, 等. 三种食用菌对冻融猪肉饼贮藏品质的影响[J]. 食品工业科技, 2024, 45(17): 83-94. DOI:10.13386/j.issn1002-0306.2023090178.
[5] 韦婕妤. 热加工方式对羊肉制品蛋白质氧化及体外模拟消化性的影响研究[D]. 成都: 西南民族大学, 2019. DOI:10.27417/d.cnki.gxnmc.2019.000134.
[6] HAN J P, SUN Y J, ZHANG T, et al. The preservable effects of ultrasound-assisted alginate oligosaccharide soaking on cooked crayfish subjected to freeze-thaw cycles[J]. Ultrasonics Sonochemistry,2023, 92: 106259. DOI:10.1016/j.ultsonch.2022.106259.
[7] ZHANG S N, MEENU M, XIAO T, et al. The impact of pressure-shift freezing on the three-dimensional network structure and properties of myofibrillar proteins in surimi gel derived from freshwater fish[J].Innovative Food Science and Emerging Technologies, 2024, 94:103673. DOI:10.1016/j.ifset.2024.103673.
[8] LU Y F, CHENG H F, JIANG S T, et al. Impact of three different processing methods on the digestibility and allergenicity of Chinese mitten crab (Eriocheir sinensis) tropomyosin[J]. Food Science and Human Wellness, 2023, 12(3): 903-911. DOI:10.1016/j.fshw.2022.09.024.
[9] LU W W, WU D, WANG L M, et al. Insoluble dietary fibers from Lentinus edodes stipes improve the gel properties of pork myofibrillar protein: a water distribution, microstructure and intermolecular interactions study[J]. Food Chemistry, 2023, 411: 135386.DOI:10.1016/j.foodchem.2023.135386.
[10] HAN T L, WANG Z X, LI C X, et al. Raw to charred: changes of protein oxidation and in vitro digestion characteristics of grilled lamb[J]. Meat Science, 2023, 204: 109239. DOI:10.1016/j.meatsci.2023.109239.
[11] ZHAO B, ZHOU H M, ZHANG S L, et al. Changes of protein oxidation, lipid oxidation and lipolysis in Chinese dry sausage with different sodium chloride curing salt content[J]. Food Science and Human Wellness, 2020, 9(4): 328-337. DOI:10.1016/j.fshw.2020.04.013.
[12] BRODKORB A, EGGER L, ALMINGER M, et al, INFOGEST static in vitro simulation of gastrointestinal food digestion[J]. Nature Protocols, 2019, 14(4): 991-1014. DOI:10.1038/s41596-018-0119-1.
[13] ZHANG W G, XIAO S, LEE E J, et al. Consumption of oxidized oil increases oxidative stress in broilers and affects the quality of breast meat[J]. Journal of Agricultural and Food Chemistry, 2011, 59(3): 969-974. DOI:10.1021/jf102918z.
[14] KANG D C, ZOU Y, CHENG Y P, et al. Effects of power ultrasound on oxidation and structure of beef proteins during curing processing[J].Ultrasonics Sonochemistry, 2016, 33: 47-53. DOI:10.1016/j.ultsonch.2016.04.024.
[15] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V. Technical note: a simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683. DOI:10.1016/j.meatsci.2006.05.019.
[16] YANG H H, ZHONG C, SUN L C, et al. Effects of partial substitution of NaCl on myofibrillar protein properties from pearl mussel Hyriopsis cumingii muscle: structural characteristics and aggregation behaviors[J]. Food Chemistry, 2021, 356: 129734. DOI:10.1016/j.foodchem.2021.129734.
[17] WANG C, ZHAO F, BAI Y, et al. Effect of gastrointestinal alterations mimicking elderly conditions on in vitro digestion of meat and soy proteins[J]. Food Chemistry, 2022, 383: 132465. DOI:10.1016/j.foodchem.2022.132465.
[18] XIE Y, ZHOU K, CHEN, B, et al. Mechanism of low-voltage electrostatic fields on the water-holding capacity in frozen beef steak:insights from myofilament lattice arrays[J]. Food Chemistry, 2023,428: 136786. DOI:10.1016/j.foodchem.2023.136786.
[19] 刘晓芳, 姜鹏飞, 杜晓平, 等. 离子强度对南极磷虾肉保水性及其肌原纤维蛋白特性的影响[J]. 食品工业科技, 2025, 46(6): 64-74.DOI:10.13386/j.issn1002-0306.2024030388.
[20] LIU D Y, DU L, HUANG Q, et al. Effects of ultrasound treatment on muscle structure, volatile compounds, and small molecule metabolites of salted Culter alburnus fish[J]. Ultrasonics Sonochemistry, 2023, 97:106440. DOI:10.1016/j.ultsonch.2023.106440.
[21] GAO S, FU Z X, ZHANG L T, et al. Oxidation and side-chain modifications decrease gastrointestinal digestibility and transport of proteins from salted bighead carp fillets after frozen storage[J]. Food Chemistry, 2023, 428: 136747. DOI:10.1016/j.foodchem.2023.136747.
[22] WU Z X, LI D Y, SHEN M, et al. Effect of different sous-vide cooking conditions on textural properties, protein physiochemical properties and microstructure of scallop (Argopecten irradians) adductor muscle[J]. Food Chemistry, 2022, 394: 133470. DOI:10.1016/j.foodchem.2022.133470.
[23] 畅鹏, 谢艳英, 王浩, 等. 热处理温度及时间对镜鲤鱼肌原纤维蛋白热聚集行为的影响[J]. 食品科学, 2021, 42(1): 101-107.DOI:10.7506/spkx1002-6630-20191213-152.
[24] DONG X, WANG J, RAGHAVAN V. Impact of microwave processing on the secondary structure, in-vitro protein digestibility and allergenicity of shrimp (Litopenaeus vannamei) proteins[J]. Food Chemistry, 2020, 337: 127811. DOI:10.1016/j.foodchem.2020.127811.
[25] XIONG Y L, GUO A Q. Animal and plant protein oxidation: chemical and functional property significance[J]. Foods, 2020, 10(1): 40.DOI:10.3390/foods10010040.
[26] SÁ A G A, HOUSE J D. Protein quality of cereals: digestibility determination and processing impacts[J]. Journal of Cereal Science,2024, 117: 103892. DOI:10.1016/j.jcs.2024.103892.
[27] DOMÍNGUEZ R, PATEIRO M, MUNEKATA P E S, et al. Protein oxidation in muscle foods: a comprehensive review[J]. Antioxidants,2021, 11(1): 60. DOI:10.3390/antiox11010060.
[28] CHEN H, ZHAO G M, YU X L, et al. Exploring in vitro gastrointestinal digestion of myofibrillar proteins at different heating temperatures[J]. Food Chemistry, 2023, 414: 135694. DOI:10.1016/j.foodchem.2023.135694.
[29] DEAN R T, FU S, STOCKER R, et al. Biochemistry and pathology of radical-mediated protein oxidation[J]. The Biochemical Journal, 1997,324(Part 1): 1-18. DOI:10.1042/bj3240001.
[30] 张毓瑜. 婴儿配方奶粉DHA藻油微胶囊化制备与母乳化脂肪功能评价[D]. 北京: 中国农业科学院, 2020. DOI:10.27630/d.cnki.gznky.2020.000399.
[31] DU X J, SUN Y Y, PAN D D, et al. The effect of structural change on the digestibility of sarcoplasmic proteins in Nanjing dry-cured duck during processing[J]. Poultry Science, 2018, 97: 4450-4457.DOI:10.3382/ps/pey316.
[32] ZAVADSKIY S, SOLOGOVA S, MOLDOGAZIEVA N. Oxidative distress in aging and age-related diseases: spatiotemporal dysregulation of protein oxidation and degradation[J]. Biochimie, 2022, 195: 114-134. DOI:10.1016/j.biochi.2021.12.002.
[33] YIN Y T, ZHOU L, PEREIRA J, et al. Insights into digestibility and peptide profiling of beef muscle proteins with different cooking methods[J]. Journal of Agricultural and Food Chemistry, 2020, 68(48):14243-14251. DOI:10.1021/acs.jafc.0c04054.
[34] GAWAT M, BOLAND M, CHEN J, et al. Effects of microwave processing in comparison to sous vide cooking on meat quality, protein structural changes, and in vitro digestibility[J]. Food Chemistry, 2023,434: 137442. DOI:10.1016/j.foodchem.2023.137442.
[35] NÚÑEZ-FLORES R, CANDO D, BORDERÍAS A J, et al. Importance of salt and temperature in myosin polymerization during surimi gelation[J]. Food Chemistry, 2017, 239: 1226-1234. DOI:10.1016/j.foodchem.2017.07.028.
[36] 王一帆. 海湾扇贝闭壳肌凝胶特性研究及功能产品开发[D]. 大连:大连海洋大学, 2024. DOI:10.27821/d.cnki.gdlhy.2024.000026.
[37] 康怀彬, 邹良亮, 张慧芸, 等. 高温处理对牛肉蛋白质化学作用力及肌原纤维蛋白结构的影响[J]. 食品科学, 2018, 39(23): 80-86.DOI:10.7506/spkx1002-6630-201823013.
[38] VANGA S K, SINGH A, KALKAN F, et al. Effect of thermal and high electric fields on secondary structure of peanut protein[J]. International Journal of Food Properties, 2015, 19: 1259-1271. DOI:10.1080/10942 912.2015.1071841.
[39] SOTO C, CASTAÑO E M. The conformation of Alzheimer’s β peptide determines the rate of amyloid formation and its resistance to proteolysis[J]. The Biochemical Journal, 1996, 314(Part 2): 701-707.DOI:10.1042/bj3140701.
[40] YU X, WANG X X, ZOU L F, et al. Insights into the in vitro digestibility of pork myofibrillar protein with different ionic polysaccharides from the perspective of gel characteristics[J]. Food Chemistry, 2023, 426: 136520. DOI:10.1016/j.foodchem.2023.136520.
[41] RICHTER S, MARTIN R, GUTZEIT H O, et al. In vitro and in vivo effects of inhibitors on actin and myosin[J]. Bioorganic & Medicinal Chemistry, 2020, 30: 115928. DOI:10.1016/j.bmc.2020.115928.
[42] BECK S M, KNOERZER K, SELLAHEWA J, et al. Effect of different heat-treatment times and applied shear on secondary structure,molecular weight distribution, solubility and rheological properties of pea protein isolate as investigated by capillary rheometry[J].Journal of Food Engineering, 2017, 208: 66-76. DOI:10.1016/j.jfoodeng.2017.03.016.
[43] UTAMA D T, BAEK K H, JEONG H S, et al. Effects of cooking method and final core-temperature on cooking loss, lipid oxidation,nucleotide-related compounds and aroma volatiles of Hanwoo brisket[J]. Asian-Australasian Journal of Animal Sciences, 2018, 31(2):293-300. DOI:10.5713/ajas.17.0217.
[44] 李璇, 孙栋, 胡婷, 等. 高盐氧化体系对牦牛肉肌纤维蛋白理化特性及结构的影响[J]. 食品科学, 2024, 45(15): 49-58. DOI:10.7506/spkx1002-6630-20231106-032.
[45] ZHANG Y M, PUOLANNE E, ERTBJERG P. Mimicking myofibrillar protein denaturation in frozen-thawed meat: effect of pH at high ionic strength[J]. Food Chemistry, 2021, 338: 128017. DOI:10.1016/j.foodchem.2020.128017.
[46] QIAN S Y, HU F F, MEHMOOD W, et al. The rise of thawing drip:freezing rate effects on ice crystallization and myowater dynamics changes[J]. Food Chemistry, 2022, 373(Part B): 131461. DOI:10.1016/j.foodchem.2021.131461.
[47] WANG K X, LIN X Y, ZHAO W Y, et al. Low-temperature steaming improves eating quality of whitefish[J]. Journal of Texture Studies,2020, 1(5): 830-840. DOI:10.1111/jtxs.12540.
[48] LI Y, HE J L, QUAN W, et al. Effects of polyphosphates and sodium chloride on heterocyclic amines in roasted beef patties as revealed by UPLC-MS/MS[J]. Food Chemistry, 2020, 326: 127016. DOI:10.1016/j.foodchem.2020.127016.
[49] CHENG S S, WANG X H, LI R R, et al. Influence of multiple freezethaw cycles on quality characteristics of beef semimembranous muscle: with emphasis on water status and distribution by LFNMR and MRI[J]. Meat Science, 2019, 147: 44-52. DOI:10.1016/j.meatsci.2018.08.020.
[50] GAO F, ZHANG X F, WANG J Q, et al. Systematical characterization of functional and antioxidative properties of heat-induced polymerized whey proteins[J]. Food Science and Biotechnology, 2018, 27: 1619-1626. DOI:10.1007/s10068-018-0402-5.
[51] SANTÉ-LHOUTELLIER V, AUBRY L, GATELLIER P. Effect of oxidation on in vitro digestibility of skeletal muscle myofibrillar proteins[J]. Journal of Agricultural and Food Chemistry, 2007, 55(13):5343-5348. DOI:10.1021/jf070252k.
[52] ZOU Y, LI L, YANG J, et al. Effect of ultrasound assisted collagen peptide of chicken cartilage on storage quality of chicken breast meat[J]. Ultrasonics Sonochemistry, 2022, 89: 106154. DOI:10.1016/j.ultsonch.2022.106154.
[53] 吕春阳, 张玲, 杜明, 等. 超声处理对卤虾品质的影响[J]. 中国调味品, 2024, 49(6): 64-69. DOI:10.3969/j.issn.1000-9973.2024.06.009.
[54] CORDEIRO M W S, MOURO D M M, DOS SANTOS I D, et al.Effect of γ irradiation on the quality characteristics of frozen yacare caiman (Caiman crocodilus yacare) meat[J]. Meat Science, 2022, 185:108728. DOI:10.1016/j.meatsci.2021.108728.