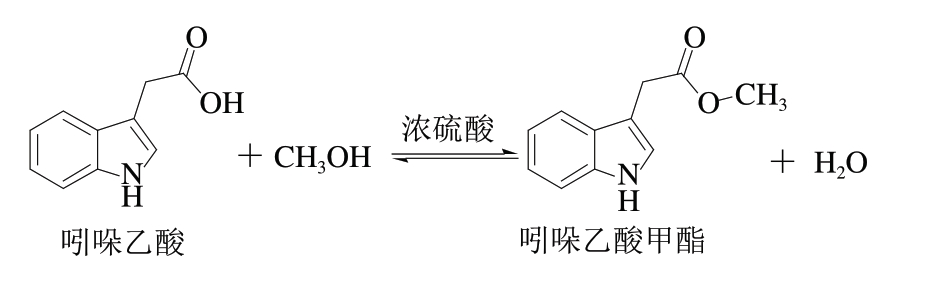
图1 吲哚乙酸衍生化反应方程式
Fig.1 Derivatization reaction of indoleacetic acid
Rapid Determination of Indoleacetic Acid in Meat by Single-Step, Cheap, Effective, Rugged, and Safe (SinChERS)Purification Coupled with Gas Chromatography-Mass Spectrometry
李霞, 高喜凤, 崔玉花, 等.SinChERS净化-气相色谱-质谱法快速测定畜肉中吲哚乙酸[J].肉类研究, 2025, 39(4): 11-16.DOI:10.7506/rlyj1001-8123-20241021-277.http://www.rlyj.net.cn
LI Xia, GAO Xifeng, CUI Yuhua, et al.Rapid determination of indoleacetic acid in meat by single-step, cheap, effective,rugged, and safe (SinChERS) purification coupled with gas chromatography-mass spectrometry[J].Meat Research, 2025,39(4): 11-16.DOI:10.7506/rlyj1001-8123-20241021-277.http://www.rlyj.net.cn
吲哚乙酸不仅是一种植物激素,也是色氨酸在动物体内的代谢产物[1-3],具有广泛的生物活性。自1942年起,科学家们便开始进行吲哚乙酸在抗肿瘤细胞方面的基础研究。吲哚乙酸还具有抗氧化应激[4]、抗炎症[5-6]、介导细胞凋亡和抗抑郁[7-8]等多重作用。吲哚乙酸在植物生长过程中被广泛应用[9-11],盲目或者过量使用吲哚乙酸会造成环境污染,残留量超标,进而通过食物迁移到畜肉中。据文献[12-13]报道,人类过量摄入吲哚乙酸可引发咳嗽、头痛、呕吐等症状,危害身体健康。因此,需要对畜肉中吲哚乙酸的含量进行监测。目前,关于吲哚乙酸的检测研究主要集中于豆芽[14]、水果[15]及蔬菜[16-17]等植物源性食品,畜肉中含量检测的方法与标准尚显不足。因此,有必要开发针对畜肉中吲哚乙酸的快速检测技术。
目前关于吲哚乙酸检测技术主要有高效液相色谱(high performance liquid chromatography,HPLC)法[18-19]、HPLC-串联质谱(HPLC-tandem mass spectrometry,HPLC-MS/MS)法[20-22]、气相色谱(gas chromatography,GC)[23-24]和GC-质谱联用(GC-mass spectrometry,GC-MS)法[25-27]等。HPLC灵敏度不高,往往需要浓缩和较好的净化条件。HPLC-MS/MS仪器购置和运行成本高昂,难以实现普及。GC-MS在测定复杂体系的痕量成分中具有显著优势,吲哚乙酸可通过衍生化反应降低极性,改善其在GC-MS上的分离状况,本研究选择GC-MS技术进行检测。
畜肉基质复杂,除脂在吲哚乙酸的检测中尤为重要。文献中常采用固相萃取法[28]、凝胶渗透色谱法[29]和冷冻除脂法[30]。前2 种方法有机溶剂消耗量大,前处理过程复杂,冷冻除脂法需要较长的冷冻时间和低温条件。本研究选择SinChERS(single-step, cheap, effective,rugged, and safe)方法除脂。SinChERS是基于QuEChERS(quick, easy, cheap, effective, rugged, safe)方法开发的一种新技术,该技术将特定的纳米结构填料与固相吸附相结合作为净化材料填充于针管式柱管中,使样品提取液缓慢流过净化材料而使杂质充分吸附,从而一步完成净化过程[31]。目前SinChERS净化柱在畜肉中吲哚乙酸检测方面的应用研究较少。
本研究以畜肉中吲哚乙酸为研究对象,通过调节样品溶液的pH值和优化提取试剂,提高提取效率,利用SinChERS净化柱对提取溶液进行净化,加入浓硫酸和甲醇进行衍生化反应(反应方程式如图1所示),再用GC-MS对吲哚乙酸进行分析测定。旨在提高实验效率的同时降低样品本身带来的基质效应,为畜肉中吲哚乙酸的快速检测提供方法和依据。

图1 吲哚乙酸衍生化反应方程式
Fig.1 Derivatization reaction of indoleacetic acid
羊肉、猪肉、牛肉样品均购自当地超市。
吲哚乙酸标准品(1 000 mg/L) 北京曼哈格生物科技有限公司;硫酸、甲酸、氯化钠(均为分析纯)国药集团化学试剂有限公司;乙腈、乙醇、乙醚、正己烷、丙酮(均为色谱纯) 德国Merck公司;SinChERS净化柱 天津氏安科技发展有限公司;有机微孔滤膜(0.22 μm) 上海安谱科学仪器有限公司。
7890-5977B GC-MS仪(配有电子电离源) 美国Agilent公司;Milli-Q超纯水机 德国Millipore公司;SECURA2102-1CN电子天平(精度0.01 g)、BT125D电子天平(精度0.000 1 g) 赛多利斯科学仪器(北京)有限公司;3-18K离心机 德国Sigma公司;MS 3涡旋混合器 德国IKA公司。
1.3.1 样品制备
将羊肉、猪肉、牛肉样品切碎,用组织捣碎机捣碎,混匀。制备好的样品装入洁净容器内,于4 ℃冰箱中保存,备用。
1.3.2 提取
称取粉碎均匀的样品5.0 g(精确至0.01 g)于50 mL离心管中,加入10 mL水,涡旋振荡2 min,用甲酸调节pH值为3,加入20 mL乙腈和2 g氯化钠,涡旋振荡5 min,再以8 000 r/min离心3 min。
1.3.3 净化
将SinChERS净化柱垂直插入上述离心管内,缓慢下压净化柱顶部至无法下压,得到净化液。准确移取4 mL净化液于15 mL离心管中,于40 ℃水浴中缓慢氮吹至干。
1.3.4 衍生
向上述样品中加入200 μL浓硫酸-甲醇混合液(含40 μL浓硫酸和160 μL甲醇),涡旋振荡1 min进行衍生化反应。加入1 mL正己烷,涡旋振荡1 min,再加入0.5 mL饱和氯化钠溶液涡旋振荡0.5 min,静置分层,取上清液过0.22 μm有机相滤膜,使用GC-MS仪进行测定。
1.3.5 标准溶液的配制
标准储备液配制:准确移取标准品100 μL,加入甲醇溶解并定容至10 mL,配制成质量浓度为10 mg/L的标准储备液,于4 ℃保存,备用。
溶剂标准工作液配制(实验中配制):分别吸取1.0、10.0、20.0、50.0、100、200、500 μL标准储备液加入到7 个15 mL离心管中,氮吹浓缩至干,采用1.3.4节方法同步操作,得到质量浓度分别为0.01、0.1、0.2、0.5、1.0、2.0、5.0 μg/mL的溶剂标准工作液。
基质匹配标准工作液配制(实验中配制):选取空白样品按1.3.2、1.3.3节方法制备空白基质,分别吸取标准储备液1.0、10.0、20.0、50.0、100、200、500 μL加入到7 个空白基质中,氮吹浓缩至干,采用1.3.4节方法同步操作,得到质量浓度分别为0.01、0.1、0.2、0.5、1.0、2.0、5.0 μg/mL的基质匹配标准工作液。
1.3.6 GC-MS条件
GC条件:HP-5MS毛细管色谱柱(30 m×250 μm,0.25 μm);进样口温度250 ℃;进样方式:不分流进样;进样量1 μL;载气:高纯氦气(纯度99.999%),流速1 mL/min;程序升温条件:初始温度120 ℃,保持1 min;以10 ℃/min升温至150 ℃;以5 ℃/min升温至280℃,保持2.5 min。
MS条件:离子源温度300 ℃;传输线温度280 ℃;四极杆温度180 ℃;电离能量70 eV;溶剂延迟5 min;监测方式:离子监测模式。
1.3.7 实验条件的优化
1.3.7.1 提取条件的优化
因羊肉基质更为复杂,选择阴性羊肉样品进行对比实验。分别向5.0 g阴性羊肉样品中不加入水、加入10 mL水、加入10 mL水并用甲酸调节pH值为3,对比3 种条件下的吲哚乙酸回收率,确定最适处理方式。
向5.0 g阴性羊肉样品中加入10 mL水,用甲酸分别调节pH值为1、2、3、4、5、6,测定吲哚乙酸回收率,确定最适提取pH值。
结合吲哚乙酸的性质,分别选择乙醇、乙醚、丙酮和乙腈4 种溶剂作为吲哚乙酸提取溶剂,通过GC-MS全扫描,对4 种溶剂的提取效果进行比较,确定最适提取溶剂。
1.3.7.2 净化柱的优化
对比4 种常用SinChERS净化柱的净化效果,型号分别为PS1101、PS1201、PS1501和PS1601。通过GC-MS全扫描,对4 种净化柱的净化效果进行比较,确定最适净化柱。
1.3.7.3 衍生条件的优化
向5.0 g空白羊肉样品中添加吲哚乙酸标准储备液,使其吲哚乙酸含量为0.1 mg/kg,对浓硫酸体积、甲醇体积和衍生时间进行优化。
固定加入浓硫酸40 μL、衍生化60 s,在不同甲醇用量(40、80、120、160、200 μL)下测定吲哚乙酸回收率,确定最佳甲醇用量。
固定加入甲醇160 μL、衍生化60 s,在不同浓硫酸用量(10、20、40、60、80 μL)下测定吲哚乙酸回收率,确定最佳浓硫酸用量。
固定加入浓硫酸40 μL、甲醇160 μL,在不同衍生时间(20、40、60、80、120 s)下测定吲哚乙酸回收率,确定最佳衍生时间。
1.3.8 基质效应(matrix effects,ME)评价
对基质标准工作液和溶剂标准工作液进行GC-MS分析,以其质量浓度(mg/L)为横坐标,相应响应值为纵坐标绘制标准曲线。采用基质匹配标准曲线斜率与溶剂标准曲线斜率的比值评价ME,ME按下式计算:
|ME|越大表明基质效应越强,|ME|>50%为强基质效应,20%<|ME|≤50%为中等基质效应,|ME|≤20%为弱基质效应。
1.3.9 加标回收率、方法检出限及定量限测定
使用吲哚乙酸标准储备溶液向空白样品基质中加标,加标量分别为0.01、0.05、0.10 mg/kg,按加标量从低到高的顺序依次进样,分别计算样品加标回收率。在优化色谱条件下,根据所得信噪比,以3 倍信噪比计算得出方法检出限,以10 倍信噪比计算得出方法定量限。
通过仪器自带的Mass Hunter软件进行数据处理,采用Excel 2021软件进行结果分析,采用Origin 9.0软件绘图。
2.1.1 样品中水和甲酸添加量及pH值的确定
畜肉样品经粉碎后直接加入提取溶剂,在涡旋振荡时易黏连成团,不利于提取,因此对比样品加水或加水和甲酸对提取效率的影响。如图2所示,不加水时回收率为21%;加水增加了样品的分散性,但回收率下降,仅为12%;加水并用甲酸调节pH值后,提取效率大幅提高,回收率为98%。这是由于吲哚乙酸结构中含有羧基基团,在酸性条件下易形成正离子,呈现非解离状态,更有利于吲哚乙酸进入有机相,从而提高提取效率,因此加水后用甲酸调节环境至酸性更有利于吲哚乙酸的提取。向样品中加入10 mL水足以没过样品,满足提取要求。
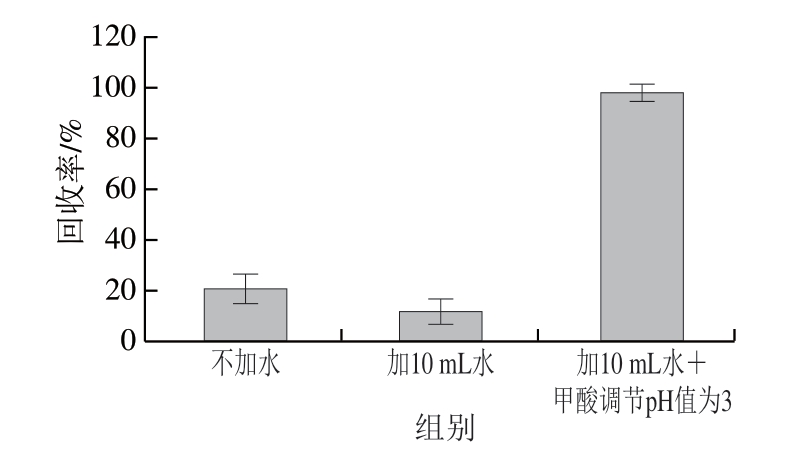
图2 水和甲酸添加量的优化(n =3)
Fig.2 Optimization of additive amount of water and formic acid (n = 3)
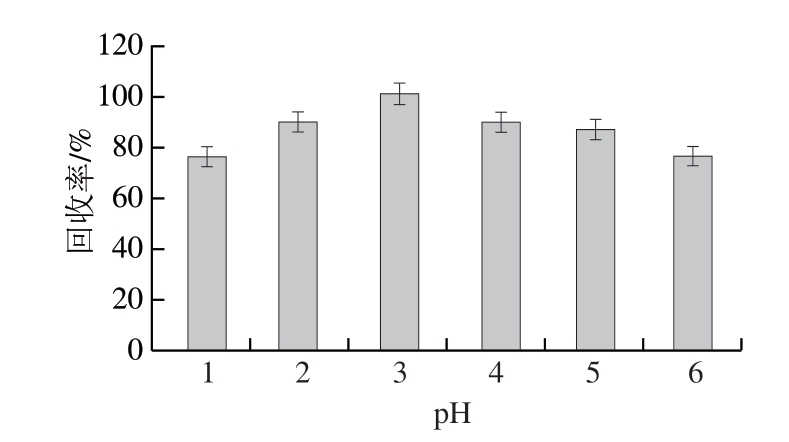
图3 提取pH值条件的优化(n =3)
Fig.3 Optimization of pH extraction conditions (n = 3)
2.1.2 提取溶剂的优化
提取溶剂是影响吲哚乙酸回收率的关键因素,如图4所示,乙醇作为提取溶剂时杂质峰最多,提取的油脂较多,易对仪器造成污染,且回收率平行性差;乙醚和丙酮作为提取溶剂时效果优于乙醇,但回收率均低于85%;乙腈作为提取溶剂时杂质峰最少,目标物周围无干扰,回收率大于95%,提取效率最高。乙腈具有良好的蛋白沉降效果,不易萃取出油脂类杂质,经综合考虑,选择乙腈作为提取剂。
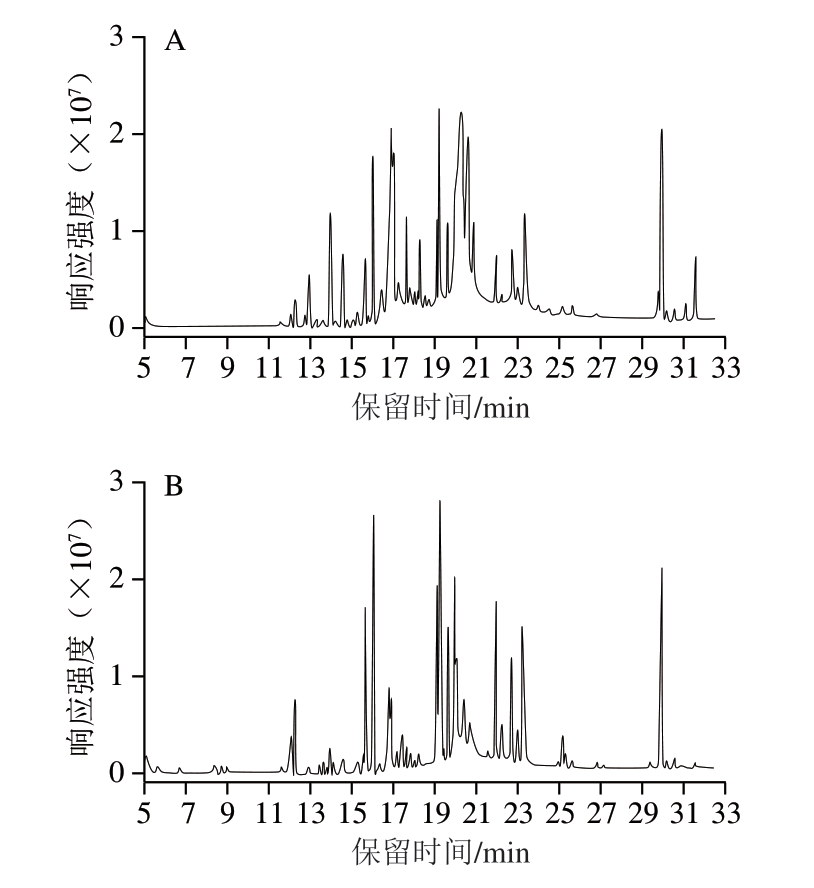
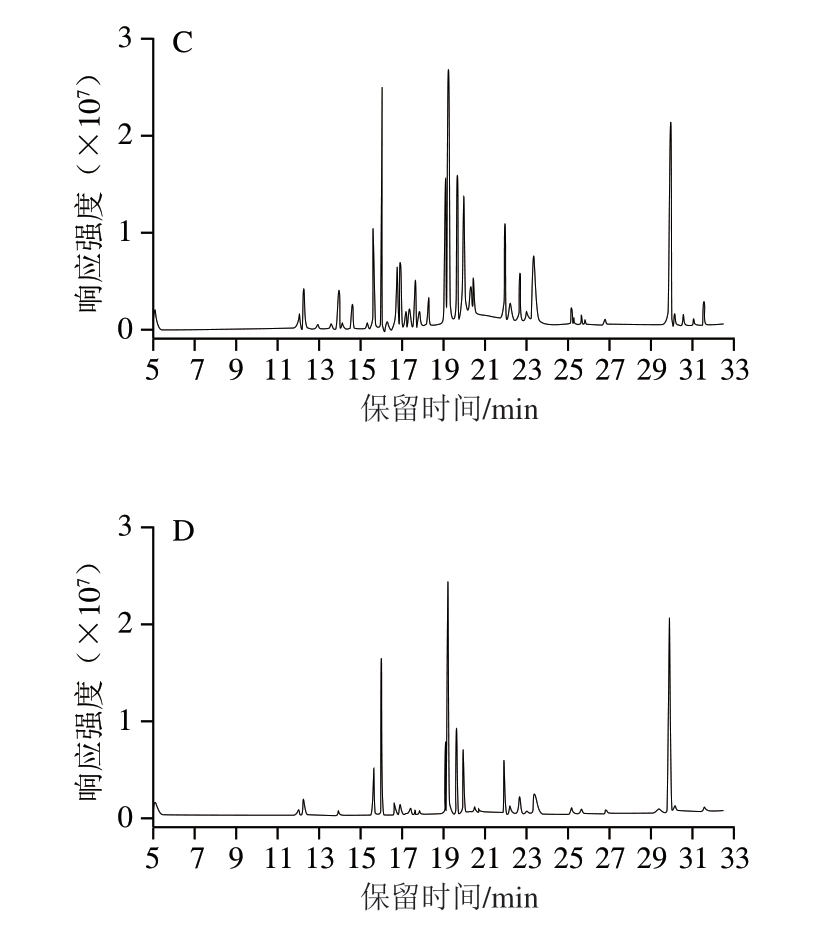
图4 不同提取溶剂的GC-MS全扫描结果对比
Fig.4 Comparison of GC-MS profiles with different extraction solvents
A.乙醇;B.乙醚;C.丙酮;D.乙腈。
如图3所示,随着pH值的减小,回收率先增加后降低,且pH值为3时,吲哚乙酸的回收率最高,表明在pH值为3的酸性环境中,吲哚乙酸更易被有机物提取。因此选择加水10 mL,用甲酸调节样品溶液pH值为3进行后续实验。
GC-MS全扫描结果显示,样品经4 种净化柱净化后杂质明显减少,目标物周围无杂峰干扰,SP1501净化效果最佳,目标物响应值最高,其次为SP1601和SP1201,SP1101目标物响应值最低。如表1所示,不同填料组合的净化柱回收率不同,SP1501净化柱回收率为103.5%,优于其他净化柱,表明MgSO4、乙二胺-N-丙基硅烷(primary secondary amine,PSA)、C18与石墨化碳黑(graphitized carbon black,GCB)组合更有利于样品的净化和吲哚乙酸的提取,因此优选SP1501作为SinCHERS的净化柱。
表1 不同型号的SinChERS净化柱回收率和相对标准偏差(n =6)
Table 1 Recoveries and relative standard deviations using different models of SinChERS purification column (n = 6)

相对标准偏差/%SP11011.2 g MgSO4、400 mg PSA、400 mg C1885.34.5 SP12011.2 g MgSO4、400 mg PSA、25 mg GCB76.35.6 SP1501 1.2 g MgSO4、400 mg PSA、400 mg C18、15 mg GCB103.53.1 SP16011.2 g MgSO4、400 mg PSA、60 mg GCB70.56.7净化柱型号填料成分平均回收率/%
吲哚乙酸常用的衍生化试剂有重氮甲烷[32-33]、三氟乙酸酐[34]、三氟化硼甲醇[35]。重氮甲烷衍生快速但毒性高且制作复杂;三氟乙酸酐和三氟化硼甲醇等价格昂贵,实验成本较高。浓硫酸-甲醇混合液作为衍生化试剂安全、易得,衍生化反应高效且迅速。如图5所示,甲醇与浓硫酸的用量直接影响衍生化效率,用量不足会导致衍生速率缓慢且灵敏度低下,但浓硫酸过量会破坏反应生成的酯类产物,导致回收率下降;反应时间≥60 s时,回收率趋于稳定。因此确定甲醇体积为160 μL,浓硫酸体积为40 μL,衍生时间为60 s。
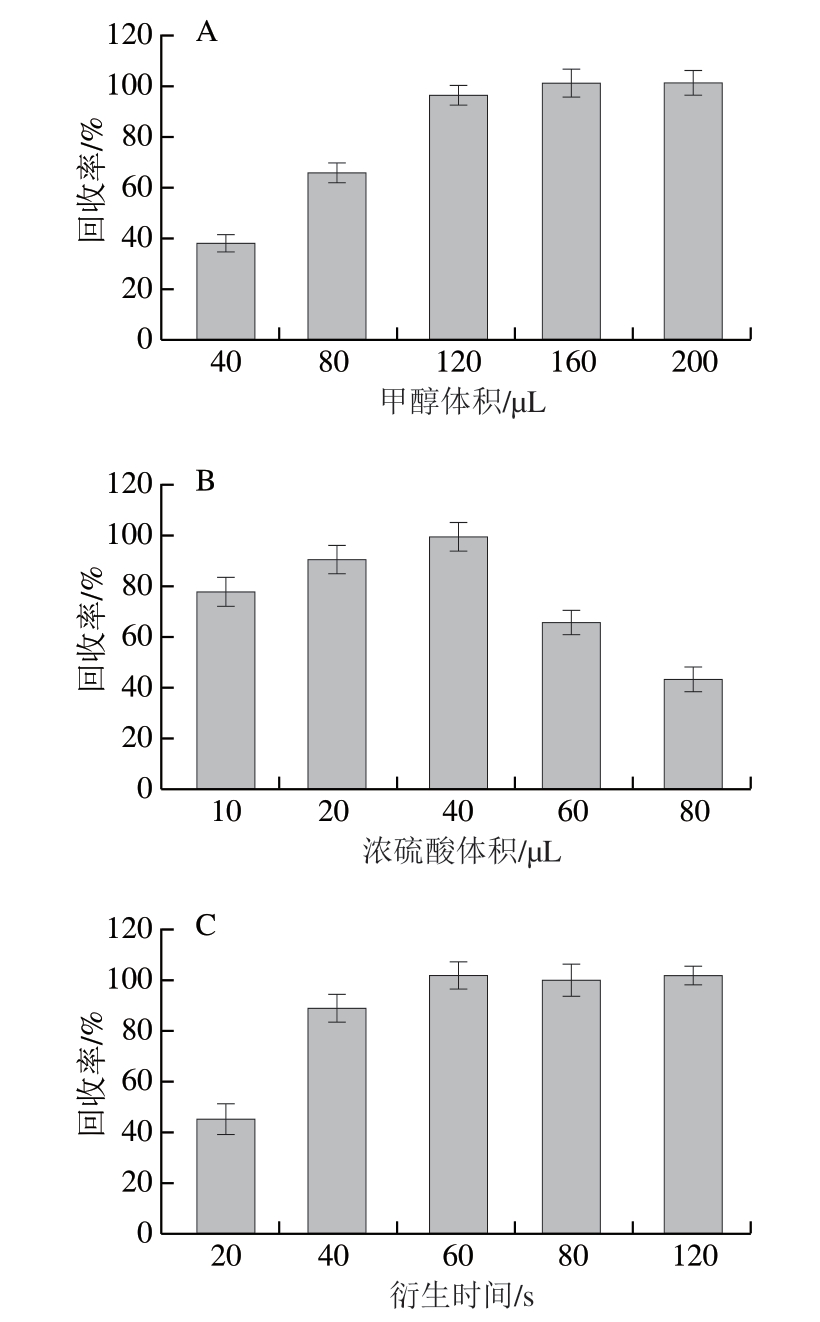
图5 衍生条件的优化(n =3)
Fig.5 Optimization of derivatization conditions (n = 3)
选择定量离子m/z 130和定性离子m/z 189、103、77进行选择离子检测。采用程序升温将目标物和杂质峰分离,以消除干扰。吲哚乙酸甲酯(吲哚乙酸衍生产物)质谱图如图6所示,确定其保留时间为14.21 min。

图6 吲哚乙酸甲酯质谱图
Fig.6 Mass spectrum of methyl indole acetate
1.m/z 130;2.m/z 189;3.m/z 103;4.m/z 77。
通过优化提取、净化条件,有效减轻了基质效应的干扰,但牛肉、猪肉和羊肉样品仍表现为中等基质效应(表2)。因此采用空白基质匹配法制作标准工作曲线,以减少基质干扰。在0.01~5.0 μg/mL范围内,吲哚乙酸质量浓度与其响应值呈良好线性关系,相关系数大于0.999。
表2 基质效应和线性范围的考察
Table 2 Investigation of matrix effect and linear range
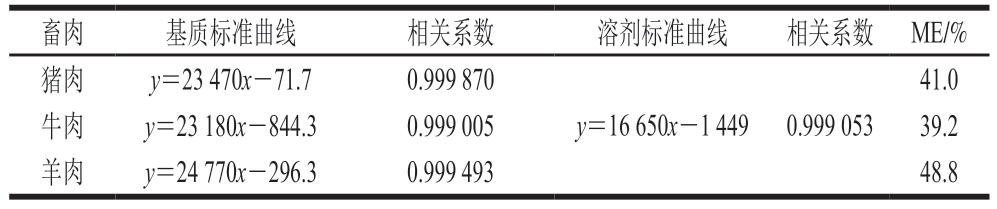
畜肉基质标准曲线相关系数溶剂标准曲线相关系数 ME/%猪肉y=23 470x-71.70.999 870 y=16 650x-1 449 0.999 053 41.0牛肉y=23 180x-844.30.999 00539.2羊肉y=24 770x-296.30.999 49348.8
实验结果表明,方法检出限为0.003 mg/kg,方法定量限为0.01 mg/kg。如表3所示,在0.01、0.05、0.10 mg/kg吲哚乙酸加标量的猪肉、羊肉和牛肉样品中,平均加标回收率为92.1%~102.1%,相对标准偏差为2.6%~5.7%。
表3 平均加标回收率和精密度实验结果(n =6)
Table 3 Average recoveries and precision for spiked samples (n = 6)
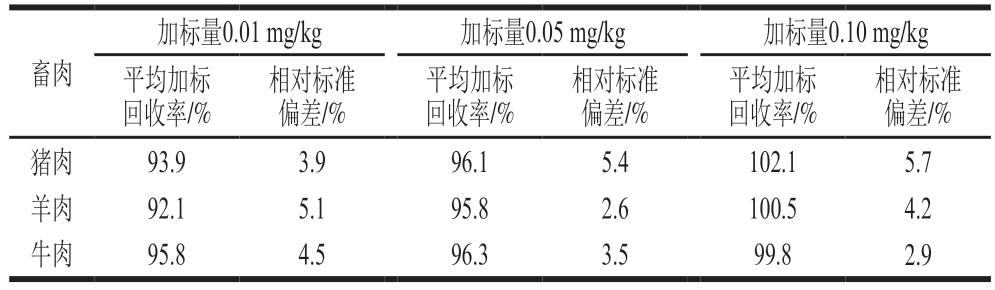
畜肉加标量0.01 mg/kg加标量0.05 mg/kg加标量0.10 mg/kg平均加标回收率/%相对标准偏差/%猪肉93.93.996.15.4102.15.7羊肉92.15.195.82.6100.54.2牛肉95.84.596.33.599.82.9相对标准偏差/%平均加标回收率/%相对标准偏差/%平均加标回收率/%
本研究采用SinChERS净化柱结合快速衍生化建立畜肉中吲哚乙酸的GC-MS快速检测方法。针对畜肉复杂的食品基质,适量水的加入增大了样品的分散性,结合调节pH值和使用乙腈作为提取溶剂,提高了畜肉中吲哚乙酸的提取效率。采用SinChERS净化柱净化,实现样品的一步式净化,减少了有机试剂的使用。选用浓硫酸-甲醇进行衍生化反应,反应仅需1 min,大大缩短了衍生化和前处理时间。本方法检出限可达0.003 mg/kg,定量限可达0.01 mg/kg,填补了畜肉中吲哚乙酸含量检测标准的空白,为畜肉中吲哚乙酸含量的检测提供了一种便捷、高效的筛查和定量方法,具有较好的实际应用价值。
[1] 郭瑞, 张滋龙, 龚俊, 等.微生物-吲哚乙酸-脑轴介导小鼠海马神经元突触异常和自闭样行为[C]//中国食品科学技术学会第二十一届年会论文摘要集.北京: 中国食品科学技术学会, 2024: 358-359.DOI:10.26914/c.cnkihy.2024.042065.
[2] 杨睿, 杨艳, 何凯凯, 等.乳酸菌及其代谢物吲哚乙酸通过AhR激活TAM免疫改善胃癌的发生发展[C]//浙江省免疫学会第十三次学术大会论文集.杭州: 浙江省免疫学会, 2023: 77.DOI:10.26914/c.cnkihy.2023.119675.
[3] 周冰洋, 吕嘉枥, 吴定燕, 等.UHPLC-Q-Orbitrap MS/MS检测益生菌来源的3 种吲哚衍生物[J].中国乳品工业, 2022, 50(9): 53-58.DOI:10.19827/j.issn1001-2230.2022.09.010.
[4] 查翠芳.色氨酸及吲哚类物质对生长前期马冈鹅肠道发育及相关基因表达的影响[D].广州: 华南农业大学, 2020.DOI:10.27152/d.cnki.ghanu.2020.001558.
[5] 孙菡丽, 翁尊尧.肿瘤的化学治疗: XXXXIII.若干硝基色氨酸及其有关化合物吲哚乙酸和色胺类化合物的合成[J].药学学报, 1982,17(4): 275-281.DOI:10.16438/j.0513-4870.1982.04.006.
[6] 韩春明, 左琨, 王攀, 等.高血压患者肠道代谢产物吲哚乙酸与肠道菌群失调的关系[J].中国心血管病研究, 2021, 19(4): 324-329.DOI:10.3969/j.issn.1672-5301.2021.04.07.
[7] CHEN Y, TIAN P J, WANG Z, et al.Indole acetic acid exerts antidepressive effects on an animal model of chronic mild stress[J].Nutrients, 2022, 14(23): 5019.DOI:10.3390/nu14235019.
[8] GUPTA N, SHARMA R K, MAITRA A, et al.In-vitro and in-vivo efficacy of hollow gold nanoparticles encapsulating horseradish peroxidase: oxidative stress-mediated tumor cell killing[J].Journal of Drug Delivery Science and Technology, 2023, 79: 103979.DOI:10.1016/j.jddst.2022.103979.
[9] ZHOU J H, CHENG K, SONG L P, et al.Exogenous indoleacetic acid induces cadmium accumulation and growth in Cinnamomum camphora[J].Scientia Horticulturae, 2024, 323: 112518.DOI:10.1016/j.scienta.2023.112518.
[10] ZHU C Q, JIANG R H, WEN S F, et al.Foliar spraying of indoleacetic acid (IAA) enhances the phytostabilization of Pb in naturally tolerant ryegrass by limiting the root-to-shoot transfer of Pb and improving plant growth[J].PeerJ, 2023, 11: e16560.DOI:10.7717/peerj.16560.
[11] ALARAIDH I A.Exogenous application of salicylic acid, indoleacetic acid and tryptophan protects growth, chlorophyll synthesis and antioxidant activities and gene expression in Catharanthus roseus[J].Pakistan Journal of Botany, 2020, 52(3): 893-899.DOI:10.30848/pjb2020-3(15).
[12] 宋利军, 付倩, 刘瑞弘, 等.QuEChERS提取-气相色谱-质谱法测定豆芽中的7 种植物生长调节剂残留量[J].中国卫生检验杂志, 2017,27(13): 1855-1857; 1862.
[13] 石金娥, 侯宇, 王莹, 等.吉林省市售豆芽中7 种植物生长调节剂的含量监测分析[J].吉林蔬菜, 2014(12): 54-55.DOI:10.3969/j.issn.1672-0180.2014.12.047.
[14] 李静, 张居舟, 余晓娟, 等.超高效液相色谱-串联质谱法测定豆芽中植物生长调节剂残留量的不确定度评定[J].食品科学, 2019, 40(10):292-297.DOI:10.7506/spkx1002-6630-20180323-304.
[15] 蒋艳芳, 黄岛平, 陈秋红, 等.超高效液相色谱法测定柑橘果肉中四种植物性内源激素的含量[J].湖北农业科学, 2012, 51(1): 165-169.DOI:10.14088/j.cnki.issn0439-8114.2012.01.006.
[16] 赵振东, 李平, 朱建忠.离子色谱法测定水果和蔬菜中3-吲哚乙酸和3-吲哚丁酸的含量[J].理化检验-化学分册, 2017, 53(5): 590-593.DOI:10.11973/lhjy-hx201705023.
[17] 谢勇平, 郑新宇, 林丹丽, 等.高效液相色谱法同时分离测定包菜中4 种植物生长素[J].新疆农业大学学报, 2010, 33(5): 409-411.DOI:10.3969/j.issn.1007-8614.2010.05.008.
[18] 刘晓婷, 姚拓, 马亚春, 等.植物根际促生菌发酵液中植物激素含量的液液萃取-高效液相色谱测定法[J].草业科学, 2022, 39(10): 2222-2228.
[19] 朱海荣, 张娟, 刘爽, 等.液相色谱-紫外检测法测定肥料中多种植物生长调节剂[J].湖北农业科学, 2022, 61(9): 132-135; 140.DOI:10.14088/j.cnki.issn0439-8114.2022.09.026.
[20] 薛荣旋, 黄诚, 刘国平, 等.QuEChERS结合气相色谱-串联质谱法测定水果中5 种植物生长调节剂[J].中国食品卫生杂志, 2017, 29(5):561-566.DOI:10.13590/j.cjfh.2017.05.008.
[21] MYEONGHAN Y, JUEUN K, CHUL W L.Establishment of simultaneous analysis method for indole acetic acid, abscisic acid, and jasmonic acid in bacteria using HPLC-MS/MS[J].The Korean Society of Analytical Sciences, 2021, 11: 172.
[22] 任静.豆芽中农药及生长素残留同时检测及风险分级[D].重庆: 重庆三峡学院, 2023.DOI:10.27883/d.cnki.gcqsx.2023.000493.
[23] BOSIN T R, BUCKPITT A R, MAICKEL R P.Comparative gas-liquid chromatography of biologically important indoles, and their benzo(b)thiophene and 1-methylindole analogs[J].Journal of Chromatography,1974, 94: 316-320.DOI:10.1016/s0021-9673(01)92388-x.
[24] 杜黎明, 许庆琴.气相色谱法直接测定植物生长素[J].色谱, 2000,18(2): 160-161.DOI:10.3321/j.issn:1000-8713.2000.02.019.
[25] 田丽, 胡佳薇, 王敏娟, 等.气相色谱-质谱法测定豆芽中6 种植物生长调节剂残留[J].中国卫生检验杂志, 2016, 26(20): 2913-2915.
[26] 赵海玲, 邱宏萌, 何娟, 等.赣州市豆芽中5 种植物生长调节剂的残留监测结果分析[J].实验与检验医学, 2018, 36(2): 271-272.DOI:10.3969/j.issn.1674-1129.2018.02.047.
[27] 吴平谷, 谭莹, 张晶, 等.分级净化结合气相色谱-质谱联用法测定豆芽中10 种植物生长调节剂[J].分析化学, 2014, 42(6): 866-871.DOI:10.3724/SP.J.1096.2014.40105.
[28] 王娟强, 刘梦瑶, 张明悦, 等.超高效液相色谱-串联质谱法检测畜肉及内脏中苯甲酸和马尿酸残留[J].食品科学, 2022, 43(14): 311-318.DOI:10.7506/spkx1002-6630-20211018-184.
[29] 李洁, 鞠香, 王艳丽, 等.QuEChERS-在线凝胶渗透色谱-气相色谱-串联质谱法高通量筛查动物源性食品中的多农药残留[J].色谱,2023, 41(7): 610-621.DOI:10.3724/SP.J.1123.2022.10010.
[30] 何康昊, 邹晓莉, 刘祥, 等.反相高效液相色谱-二极管阵列检测蛋黄中的角黄素和虾青素[J].四川大学学报(医学版), 2012, 43(1): 113-117.DOI:10.13464/j.scuxbyxb.2012.01.003.
[31] 乔颖, 刘雪红, 韩凤丽, 等.SinChERS结合超高效液相色谱-串联质谱法同时测定禽类产品中磺胺类药物及其增效剂[J].食品安全质量检测学报, 2021, 12(23): 9062-9069.DOI:10.19812/j.cnki.jfsq11-5956/ts.2021.23.011.
[32] 陈华君, 王天华, 金幼菊.用GC-MS-SIM测定植物中IAA含量方法的研究[J].北京林业大学学报, 1991, 13(3): 56-61.
[33] 李金克, 陈华君, 陈少良.GC-MS内标法定量分析植物组织中的JA、IAA和ABA[J].北京林业大学学报, 2010, 32(5): 143-148.DOI:10.13332/j.1000-1522.2010.05.027.
[34] 房耀仁, 徐慕霞, 冯菊芬, 等.毛细管气相色谱法测定植物内源激素:吲哚-3-乙酸[J].北京师范大学学报(自然科学版), 1986, 22(1): 78-83.
[35] 张文华, 谢文, 侯建波, 等.气相色谱-串联质谱法测定豆芽与番茄中6 种植物生长调节剂[J].分析测试学报, 2016, 35(10): 1241-1247.DOI:10.3969/j.issn.1004-4957.2016.10.004.