Influence of Partial Replacement of NaCl with Other Chloride Salts on the Regulation of Endogenous Enzymes and Texture Quality of Dry-Cured Pork Coppa
高航, 张欣, 席丽琴, 等.不同金属盐组合物替代钠盐对干腌猪颈肉内源酶系调控及质构品质的影响[J].肉类研究,2025, 39(4): 1-10.DOI:10.7506/rlyj1001-8123-20241028-282.http://www.rlyj.net.cn
GAO Hang, ZHANG Xin, XI Liqin, et al.Influence of partial replacement of NaCl with other chloride salts on the regulation of endogenous enzymes and texture quality of dry-cured pork coppa[J].Meat Research, 2025, 39(4): 1-10.DOI:10.7506/rlyj1001-8123-20241028-282.http://www.rlyj.net.cn
干腌肉制品经腌制、干燥和成熟等工艺加工而成,因其独特的风味和口感深受广大消费者喜爱[1]。传统干腌肉制品的含盐量较高,如干腌火腿的含盐量为产品的6%~12%(m/m),咸肉的含盐量为产品的8%(m/m)左右[2-3]。随着生活水平的不断提高,人们越来越注重健康饮食,而长期的高钠饮食与高血压、心血管等疾病的发生呈正相关性[4-5]。在干腌肉制品加工过程中,食盐的含量与脂质氧化、蛋白质降解等密切相关,进而影响产品的品质[6]。虽然减少钠盐的添加量是最直接有效的降钠方法,但产品的防腐能力、口感和质构特性等也随之下降。因此,干腌肉制品减少钠盐与保持品质之间的矛盾是肉制品加工中亟需解决的一大难题。
肉制品的理化特性、蛋白降解程度及内源酶活力是干腌肉制品加工过程中的关键参数,其变化水平直接影响产品品质[7]。因此,替代盐对关键参数的影响需具有与食盐相似的效果。目前国内外学者的研究多集中在采用KCl、CaCl2、MgCl2等作为钠盐的替代物上。Gou等[8]发现,当KCl替代NaCl的比例小于50%(m/m)时,对干腌里脊肉的色泽和质地没有明显影响。类似地,吴海舟等[9]也发现,KCl替代NaCl的比例为40%(m/m)时,干腌猪后腿的蛋白降解指标和风味不产生明显变化。Garcı́a-Garrido等[10]采用CaCl2或MgCl2替代部分钠盐腌制里脊肉时发现,CaCl2和MgCl2具有比NaCl更强的蛋白质极性基团结合性,可降低盐分对组织蛋白酶活性的抑制作用,以促进蛋白质降解并改善干腌里脊肉品质。然而,单一离子替代在使用上具有一定的局限性。KCl会促进肌红蛋白氧化,影响干腌肉制品颜色[11]。此外,KCl对产品的理化特性还具有一定的负面影响,因而限制了其在食品加工中作为钠盐替代物的使用[12]。然而,MgCl2可以提高肉制品的保水能力和色泽[13]。因此,金属盐组合替代钠盐的方式成为干腌肉制品低钠盐化的发展趋势,在实现减盐的基础上最大限度地提高肉制品品质。Ripollés等[14]研究发现,与质量分数50% KCl+50% NaCl腌制用盐相比,质量分数55% NaCl+25% KCl+15% CaCl2+5% MgCl2可使干腌火腿产品具有更好的滋味。Lorenzo等[15]采用质量分数45% NaCl+25% KCl+20% CaCl2+10%MgCl2替代西班牙干腌腊肉中的钠盐时发现,其可以促进肉蛋白降解,从而促进风味和滋味物质的产生。Aliño等[16]用质量分数55% KCl+15% CaCl2+5% MgCl2+30% NaCl替代钠盐时发现,其可显著增加干腌里脊肉的硬度和咀嚼性。由此可见,多种金属盐组合替代的方式对食盐替代物的开发具有重要意义。虽然国内外已有一些关于金属盐组合物替代钠盐的应用研究,但不同金属盐组合物对干腌肉内源酶系调控及质构品质影响的研究还有待进一步阐述。
干腌猪颈肉是一种典型的意大利干腌肉制品,也被称为“Coppa”,是将猪颈肉经修剪、清洗、盐腌等步骤后,在一定温度和湿度下干燥制成,加工周期一般在几周到几个月[17]。因猪颈部脂肪和瘦肉比例适中,保证了肉制品在干燥后仍能保持湿润和柔软的口感,因此在欧美地区广受欢迎,作为即食类高品质肉制品在国内逐渐被认可。然而,传统干腌猪颈肉产品含盐量较高,约为20%(m/m),不利于控制盐的摄入,因而通过盐替代的方法在保证干腌猪颈肉质构品质的同时减少盐用量具有重要意义。因此,本研究以猪颈肉为对象,以不同金属盐的组合物替代钠盐进行腌制,探索其在加工过程中理化性质、内源酶活性、蛋白降解和质构特性等各个关键参数的变化情况,以期为低钠盐干腌猪颈肉的生产、加工和工艺优化提供数据参考。
猪颈肉(长白猪,常规饲养,5~6 月龄,体质量80~90 kg,猪颈肉处于宰后成熟阶段)购自北京二商肉类食品集团有限公司。
A l a-7-氨基-4-甲基香豆素(7-a m i d o-4-methylcoumarin,AMC)、Arg-AMC、Leu-AMC、Gly-Arg-AMC、Gly-Pro-AMC(均为分析纯) 吉尔生化(上海)有限公司;乙二醇-双-(2-氨基乙醚)四乙酸、二硫苏糖醇、Tris-HCl、E-64蛋白酶抑制剂(均为分析纯)北京索莱宝生物科技有限公司;Brij-35(分析纯)美国Sigma-Aldrich公司;Type H氨基酸标准混合物(色谱纯) 日本Wako公司。
Seven2Go Pro便携式pH计 瑞士Mettler Toledo公司;Novasina AG控温型水分活度仪 瑞士Novasina公司;L-8900全自动氨基酸分析仪 日本Hitachi公司;H4MLFPTA多功能酶标仪 美国伯腾仪器有限公司;TA.XT Plus质构仪 英国Stable Micro Systems公司;Kjeltec™ 8400凯氏定氮仪 丹麦Foss公司;GZX-9070MBE电热鼓风干燥箱 上海博迅医疗生物仪器股份有限公司;HH-6数显恒温水浴锅 常州国华电器有限公司。
1.3.1 干腌猪颈肉制备
取猪颈肉冷鲜肉,经修形后选取80 块,平均质量为(1.3±0.2)kg、尺寸为(30.0±1.5)cm×(10.0±1.0)cm×(8.0±1.0)cm。根据本团队前期研究[18],确定替代盐组成,并将肉块分为对照组(C K,质量分数100% NaCl)、替代盐1组(T1,质量分数75% NaCl+15% KCl+5% CaCl2+5% MgCl2)、替代盐2组(T2,75% NaCl+15% KCl+5% CaCl2+5% ZnCl2)、替代盐3组(T3,75% NaCl+15% KCl+5% MgCl2+5% ZnCl2)。各组肉块按质量分数3.5%的用盐量在4 ℃、相对湿度90%下腌制。腌制结束后,在8 ℃、相对湿度80%下干燥。最后在15 ℃、相对湿度65%~85%下成熟。
1.3.2 取样
分别在原料肉(0 d)、腌制结束(4 d)、干燥结束(16 d)、成熟前期(28 d)、成熟后期(40 d)、后熟结束(70 d)时进行取样。每个时间节点至少随机选取3 个肉块,记录质量,剔除筋膜和可见脂肪后,真空包装,置于-20 ℃保存备用。
1.3.3 干腌猪颈肉加工过程中理化指标测定
1.3.3.1 pH值测定
切除表面1.5 cm左右表面氧化层后,利用便携式pH计,根据GB 5009.237—2016《食品pH值的测定》[19]的方法测定样品pH值。
1.3.3.2 质量损失率测定
采用称量法,记录每个阶段肉块质量,并计算因蒸发失水而损失的质量[20]。质量损失率按式(1)计算:
式中:m0为原料肉质量/g;mi为不同阶段样品质量/g。
1.3.3.3 水分含量测定
切除1.5 cm左右表面氧化层及脂肪和筋膜,将肉块切碎后,取3.0 g样品根据GB 5009.3—2016《食品中水分的测定》[21]中的第一法测定样品水分含量。
1.3.3.4 水分活度测定
切除1.5 cm左右表面氧化层及脂肪和筋膜,将肉块切碎后铺满样品皿,利用水分活度仪测定样品水分活度[22]。
1.3.4 干腌猪颈肉加工过程中蛋白降解指数(proteolysis index,PI)测定
总氮含量测定:参考GB 5009.5—2016《食品中蛋白质的测定》[23]方法。称取1.000 g样品至消化管中,加入消化片和10 mL浓硫酸于消化炉中进行消化,并采用自动凯氏定氮仪测定总氮含量。
非蛋白氮含量测定:称取5.000 g样品,加入25 mL预冷的10%(V/V)三氯乙酸溶液均质3 次(10 000 r/min,每次间隔30 s),4 ℃、5 000 r/min离心5 min,收集上清液,用预冷的10%三氯乙酸溶液定容至50 mL。吸取5 mL样品,移入消化管中进行消化,并采用自动凯氏定氮仪测定总氮含量。
PI按式(2)计算:
1.3.5 干腌猪颈肉加工过程中游离氨基酸测定
称取1.0 g去除筋膜和脂肪的样品,加入15 mL 0.02 mol/L盐酸溶液充分均质,混合物4 ℃、5 000 r/min离心10 min,收集上清液,加入等体积5%(V/V)磺基水杨酸混合,4 ℃、10 000 r/min离心10 min,用0.22 μm水相滤膜过滤后,采用全自动氨基酸分析仪分析游离氨基酸含量[24]。
1.3.6 干腌猪颈肉加工过程中氨肽酶活力测定
称取5.0 g去除脂肪和结缔组织的样品,切碎后加入20 mL提取缓冲液(50 mmol/L,含5 mmol/L乙二醇-双-(2-氨基乙醚)四乙酸的磷酸缓冲液,pH 7.5),在冰浴条件下均质3 次(10 000 r/min,每次间隔30 s)。混合物在4 ℃下静置60 min,随后25 000 r/min离心20 min,收集过滤后的上清液作为酶提取液。
一个酶活力单位(U)定义为在37 ℃下每分钟每克蛋白质生成1 μmol AMC所需的酶量[25-26]。
1.3.6.1 丙氨酸氨基肽酶(alanine aminopeptidase,AAP)活力测定
移取25 μL酶提取液,加入125 μL反应液(100 mmol/L,含0.33%(V/V)Brij-35、5 mmol/L CaCl2、1 mmol/L二硫苏糖醇、250 μmol/L Ala-AMC的磷酸缓冲液,pH 7.0),37 ℃孵育30 min,加入300 μL无水乙醇终止反应,4 ℃、10 000 r/min离心5 min。上清液于激发波长360 nm、发射波长440 nm处测定荧光强度。
1.3.6.2 精氨酸氨基肽酶(arginine aminopeptidase,RAP)活力测定
移取25 μL酶提取液,加入10 μL 1 mmol/L E-64蛋白酶抑制剂,再加入125 μL反应液(50 mmol/L,含0.33%(V/V)Brij-35、150 mmol/L NaCl、1 mmol/L二硫苏糖醇、250 μmol/L Arg-AMC的磷酸缓冲液,pH 6.5),37 ℃孵育30 min,加入300 μL无水乙醇终止反应,4 ℃、10 000 r/min离心5 min。上清液于激发波长360 nm、发射波长440 nm处测定荧光强度。
1.3.6.3 亮氨酸氨基肽酶(leucine aminopeptidase,LAP)活力测定
移取25 μL酶提取液,加入125 μL反应液(50 mmol/L,含0.33% Brij-35、5 mmol/L MgCl2、1 mmol/L二硫苏糖醇、250 μmol/L Leu-AMC的磷酸缓冲液,pH 6.5),37 ℃孵育30 min,加入300 μL无水乙醇终止反应,4 ℃、10 000 r/min离心5 min。上清液于激发波长360 nm、发射波长440 nm处测定荧光强度[27]。
1.3.7 干腌猪颈肉加工过程中二肽酶活力测定
酶提取液制备方法同1.3.4节。
1.3.7.1 二肽基肽酶I(dipeptidyl peptidase I,DPP I)活力测定
移取25 μL酶提取液,加入125 μL反应液(50 mmol/L,含0.5 mmol/L二硫苏糖醇、0.5 mmol/L Gly-Arg-AMC的柠檬酸缓冲液,pH 6.0),37 ℃孵育20 min,加入300 μL无水乙醇终止反应,4 ℃、10 000 r/min离心5 min。上清液于激发波长380 nm、发射波长440 nm处测定荧光强度[28]。
1.3.7.2 DPP IV活力测定
移取2 5 μ L 酶提取液,加入1 2 5 μ L 反应液(200 mmol/L,含0.5 mmol/L二硫苏糖醇、0.25 mmol/L Gly-Pro-AMC的Tris-HCl缓冲液,pH 8.0),37 ℃孵育20 min,加入300 μL无水乙醇终止反应,4 ℃、10 000 r/min离心5 min。上清液于激发波长380 nm、发射波长440 nm处测定荧光强度[18]。
1.3.8 干腌猪颈肉加工过程中质构分析
切除1.5 cm左右表面氧化层及脂肪和筋膜,将肉块切成1.0 cm×1.0 cm×1.0 cm的立方体,放置在质构仪的切槽上进行分析。参数设置:测前速率2.0 mm/s;测试速率1.0 mm/s;测后速率1.0 mm/s;探头类型P50。测定结果取硬度、弹性、内聚力和咀嚼性[27]进行分析。
利用SPSS 23.0软件进行单因素方差分析,P<0.05为具有显著差异;采用Origin 8.5软件对实验数据进行处理、分析和作图。
由图1a所示,CK组pH值在5.97~6.29之间波动,pH值的波动可能是由于干腌过程中有机酸的积累和蛋白质的降解所致[28]。从腌制结束到成熟结束,各个替代组的pH值均显著低于CK组(P<0.05)。Zhang Xin等[18]在CaCl2和ZnCl2分别替代干腌肉块加工过程中NaCl的研究中也得到了类似的结果。
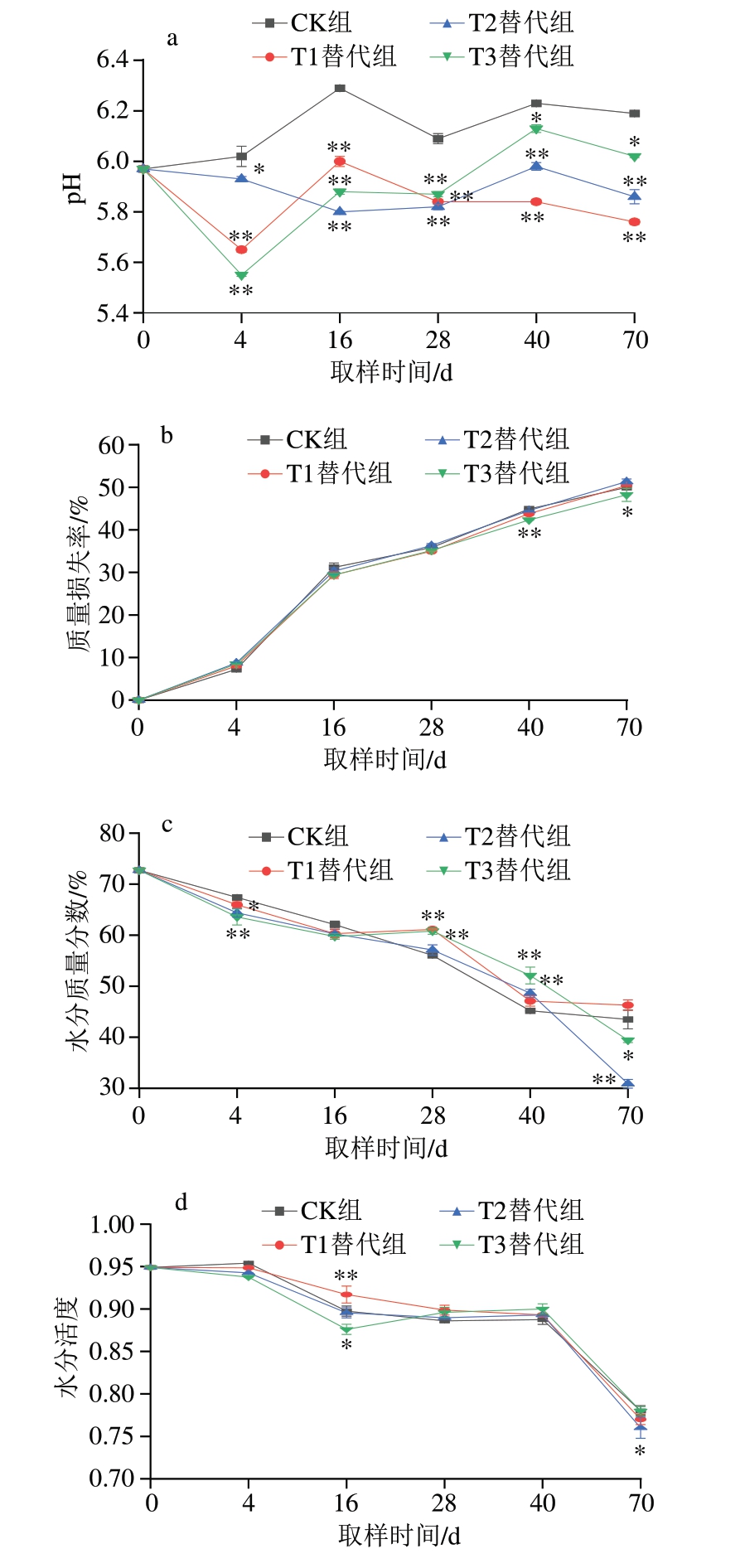
图1 干腌猪颈肉加工过程中理化指标的变化(n =5)
Fig.1 Changes in physicochemical properties of dry-cured pork coppa during processing (n = 5)
a.pH值;b.质量损失率;c.水分质量分数;d.水分活度。与CK组相比,*.差异显著(P<0.05);**.差异极显著(P<0.01),下同。
如图1b所示,CK组和各个替代组的质量损失率变化趋势基本一致,腌制后各组质量损失率均迅速增加,随着加工时间的延长,在食盐渗透性和保水性的共同作用下,质量损失速率变缓[29]。CK组在后熟结束时质量损失率为49.97%,与T1和T2替代组无显著差异,而T3替代组质量损失率在成熟后期和后熟结束时则显著低于CK组(P<0.05)。
如图1c所示,在整个加工过程中,CK组和各个替代组的水分含量呈现出相似的下降趋势。CK组水分质量分数从原料肉的72.71%降至后熟结束时的43.48%;T1替代组水分质量分数从原料肉的72.71%降至后熟结束时的46.28%,这可能是由于腌制过程中T1替代组的金属盐组成阻碍脱水过程,减缓了肌肉中的水分流失。T2和T3替代组在成熟结束时的水分含量虽极显著高于CK组(P<0.01),但经过后熟这一过程,其水分含量迅速降低,从而显著低于CK组(P<0.05)。
如图1d所示,由于不同替代组金属盐渗透进原料的速率不同,腌制后肉块的自由水流失速率呈现出差异,进而导致T1和T3替代组与CK组水分活度之间出现显著差异(P<0.05)。随着腌制时间的延长,盐分逐渐进入肌肉组织,增加了肉块的渗透压,尤其在后熟阶段,肉块加速脱水,导致水分活度快速降低。水分活度的迅速下降使T2替代组的水分活度显著低于CK组(P<0.05),而T1和T3替代组在后熟结束时的水分活度分别为0.77和0.78,与CK组无显著差异,说明75% NaCl+15% KCl+5% CaCl2+5% MgCl2和75% NaCl+15% KCl+5%MgCl2+5% ZnCl2替代不会影响终产品的水分活度。根据Tapia等[30]的报道可知,当水分活度低于0.91时,大部分细菌均被抑制。因此,从微生物防腐角度考虑,各个组均满足水分活度的要求。
蛋白质降解是传统干腌肉制品加工过程中重要的生化反应,也是肽和游离氨基酸形成的关键过程[31]。PI是评价蛋白质降解程度的重要参考指标[18]。如图2a所示,CK组PI在9%~11%之间波动,随着成熟时间的延长,肉块的PI增加趋势逐渐平缓。3 个替代组从成熟开始,与CK组逐渐出现显著差异(P<0.05),说明在成熟及后熟阶段,替代组的肌肉蛋白质降解程度更高。在后熟结束时,T1、T2和T3替代组的PI分别为12.29%、11.95%和12.64%,均显著高于CK组(P<0.05),表明此阶段还具有强烈的蛋白质降解反应。前期研究[25]发现,金华火腿在后熟阶段也进行着强烈的蛋白质降解反应,可能是由于后熟阶段会有一定的霉菌生长,霉菌生长产生的蛋白酶可能参与后熟期间进行的蛋白质降解反应,从而发生蛋白质持续降解的现象。
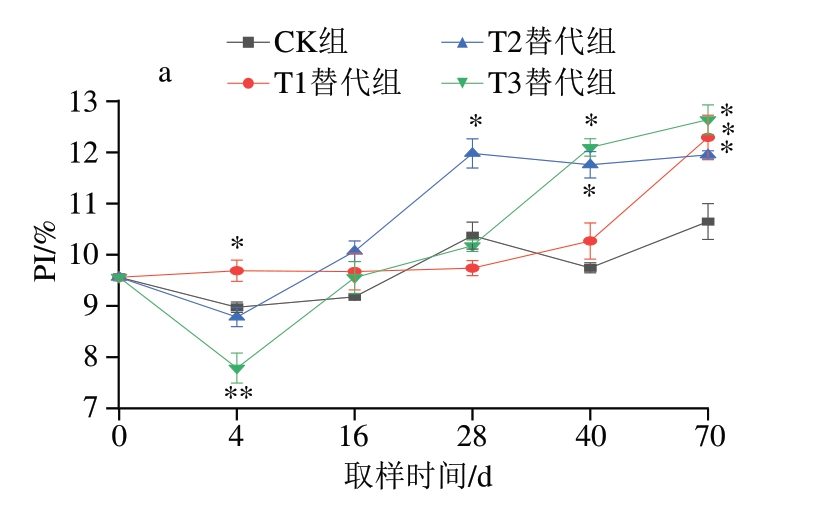
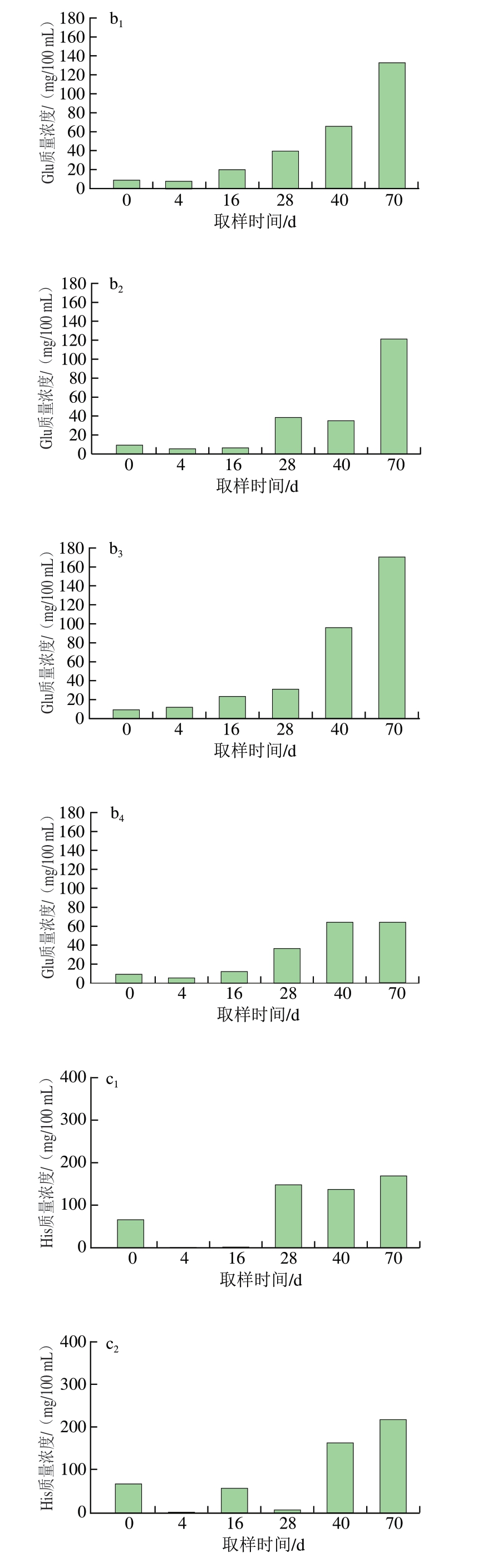
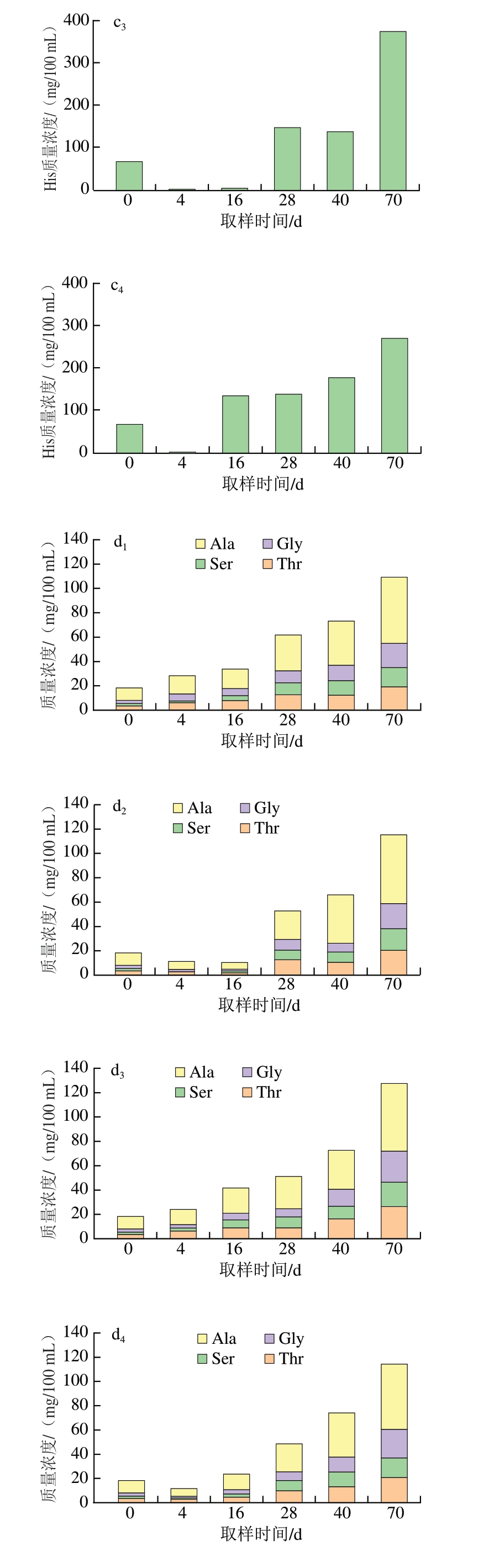
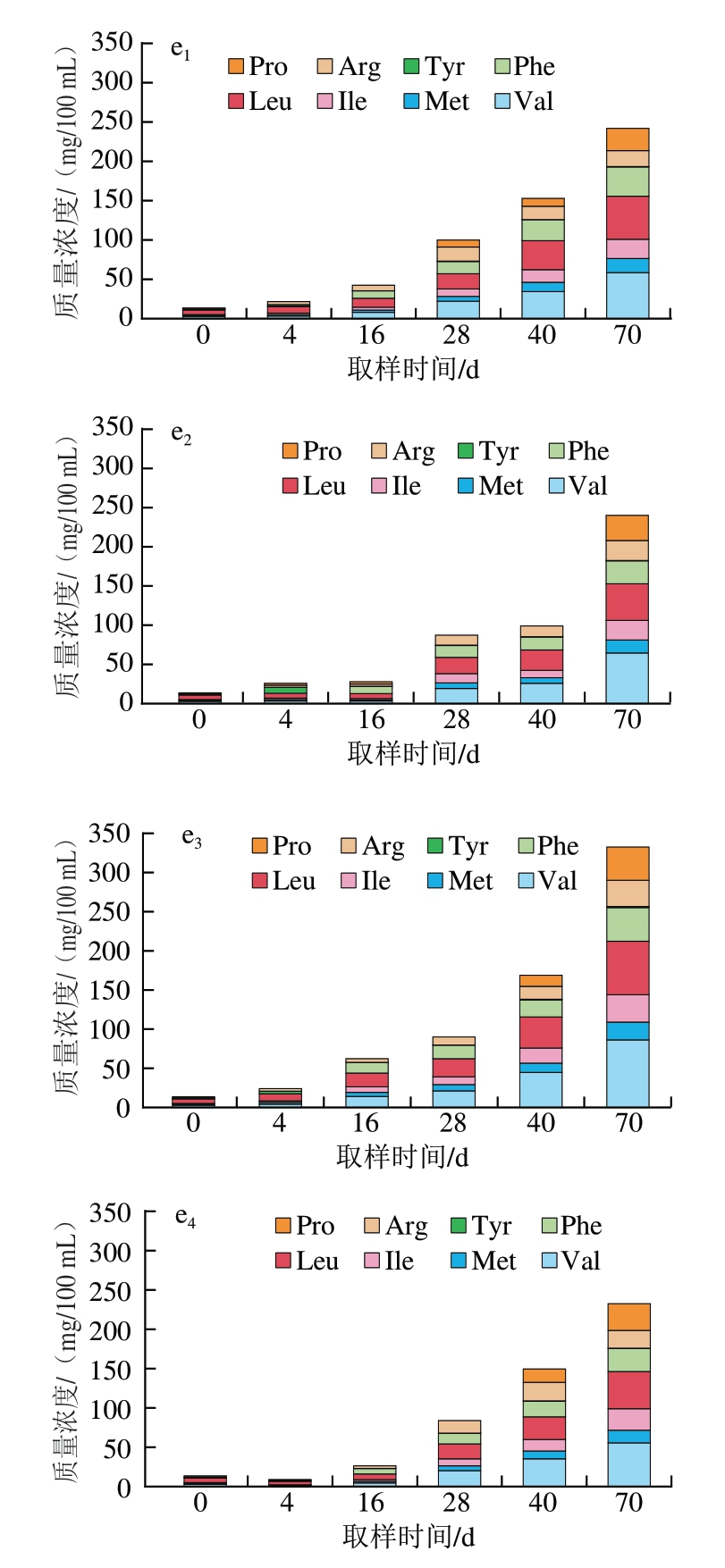
图2 干腌猪颈肉加工过程中PI和游离氨基酸含量的变化(n =5)
Fig.2 Changes in proteolysis index and free amino acid contents of dry-cured pork coppa during processing (n = 5)
a.PI;b.鲜味氨基酸含量;c.酸味氨基酸含量;d.甜味氨基酸含量;e.苦味氨基酸含量。下标1.CK组;下标2.T1替代组;下标3.T2替代组;下标4.T3替代组。
干腌肉制品中的游离氨基酸主要由多肽和蛋白质在酶的作用下水解产生,并与成品滋味和风味的形成密切相关[32]。如图2b~e所示,成熟及后熟阶段是蛋白降解最快的时期,同时也是游离氨基酸积累逐渐增多的时期。对于鲜味氨基酸,Asp一直处于较低水平,且CK组和替代组之间变化趋势一致。而随着干腌进程逐渐深入,在后熟结束时,T2替代组Glu质量浓度为169.83 mg/100 mL,高于CK组的132.18 mg/100 mL。对于酸味氨基酸,无论CK组还是替代组,在腌制后均出现His含量减少的趋势,但从干燥到后熟阶段,His含量又逐渐升高。对于甜味氨基酸,CK组和替代组的Thr、Ser、Gly和Ala含量均处于同一水平,说明金属盐组合替代后未影响样品中甜味氨基酸的含量。相较于其他呈味氨基酸,苦味氨基酸的种类最多。T1和T3替代组的苦味氨基酸总含量与CK组相当,而T2替代组的苦味氨基酸含量则高于CK组。在后熟结束时,CK组、T1替代组和T3替代组苦味氨基酸的总量在232~242 mg/100 mL范围内,而T2替代组苦味氨基酸的总量为332.39 mg/100 mL,提示T3替代组的金属盐组合可提高干腌猪颈肉苦味氨基酸含量。
基于2.2节结果,发现在干腌猪颈肉加工过程中,尤其在成熟及后熟阶段,肌肉PI增加,且游离氨基酸含量大幅增加,表明这2 个阶段内源酶发挥了强烈的作用。因此,进一步对不同替代组猪颈肉加工过程中的内源酶活力变化进行分析。如图3a所示,CK组和各个替代组在腌制时均对AAP活力起到一定的抑制作用,导致其活力迅速下降。在成熟前期和后期,T3替代组AAP活力显著高于CK组(P<0.05)。虽然KCl单独替代NaCl时对AAP活力无显著影响[32],但以75% NaCl+15% KCl+5% MgCl2+5% ZnCl2的组合形式替代NaCl时,可增强AAP活力,从而促进蛋白质降解(图2a)。此外,T1和T2替代组的AAP活力虽低于CK组,但并无显著差异。
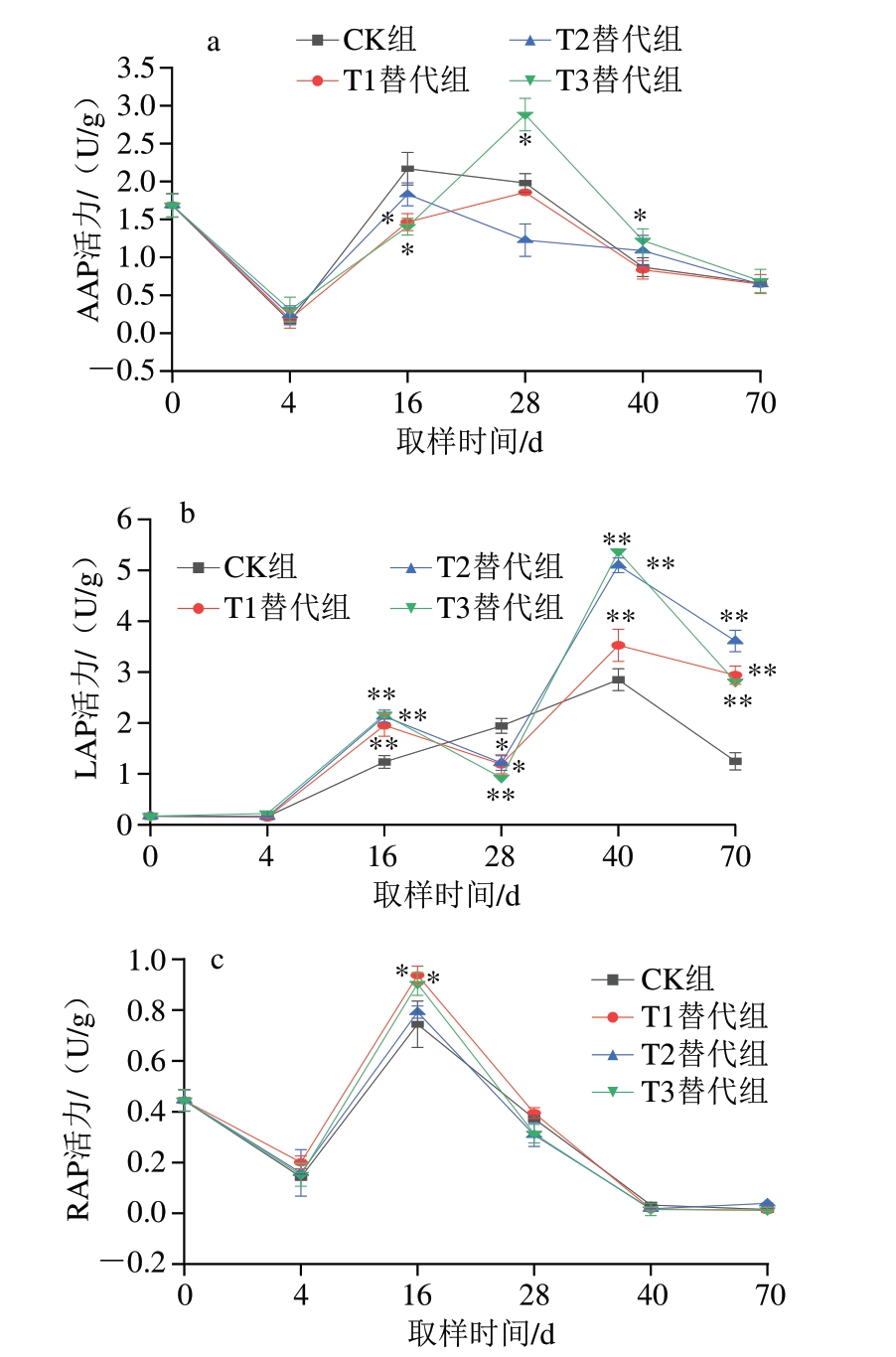
图3 干腌猪颈肉加工过程中氨肽酶活力的变化(n =5)
Fig.3 Changes in aminopeptidases activity of dry-cured pork coppa during processing (n = 5)
a.AAP活力;b.LAP活力;c.RAP活力。
如图3b所示,CK组的LAP活力在腌制后逐渐增加至2.850 U/g,随后在后熟阶段降低至1.247 U/g。在一定温度范围内,LAP活力会随着温度的升高而提高[32],在加工过程中,温度由4 ℃增加至15 ℃,使LAP活力逐渐提高。然而,由于NaCl对LAP活力有明显的抑制作用,加工后期则出现活力降低的现象。3 个替代组除在成熟前期出现LAP活力显著低于CK组(P<0.05)外,其他加工阶段的LAP活力均极显著高于CK组(P<0.01),尤其在后熟结束时,T1、T2和T3替代组的LAP活力分别为2.940、3.611、2.811 U/g,具有较高的残留活性。该结果提示3 个替代组均可改善食盐对LAP活性的抑制作用,从而使LAP在整个加工过程中保持较高活性。
如图3c所示,CK组和各个替代组的RAP活力变化趋势基本保持一致。从原料肉至腌制结束,RAP活力降低。干燥阶段,RAP活力迅速增加至峰值,且T1替代组(0.937 U/g)和T3替代组(0.903 U/g)的RAP活力均显著高于CK组(0.744 U/g)(P<0.05)。在成熟和后熟阶段,RAP活力逐渐降低,但各组之间无显著差异。吴海舟等[9]采用KCl部分替代干腌猪后腿肉中NaCl时也发现,KCl替代NaCl对产品中氨肽酶的活力无显著影响,Sanceda[33]、Katsiari[34]等也在发酵香肠和菲达奶酪的研究中得出类似结果。
骨骼肌中有4 种二肽酶,包括DPP I、DPP II、DPP III和DPP IV,其中DPP I和DPP IV在干腌肉制品加工过程中能够保持较高的潜在活力,可能在干腌过程中起主要作用[35]。因此,对干腌猪颈肉加工过程中DPP I和DPP IV的活力进行分析。如图4所示,CK组DPP I活力从原料肉至腌制阶段逐渐下降,而在干燥阶段逐渐上升至峰值后,在成熟及后熟阶段又逐渐降低(图4a)。相较于CK组,T3替代组在腌制和干燥阶段DPP I活力显著提高(P<0.05),尤其在干燥阶段,T3替代组DPP I活力为0.612 U/g,约为CK组的2 倍。T2替代组在腌制和干燥阶段均未与CK组表现出显著差异,而成熟前期,T2替代组的DPP I活力显著高于CK组(P<0.05)。前期研究[32]表明,DPP I的最适pH值为5.5,CK组从腌制阶段到成熟前期的pH值在6.0~6.3之间,T3替代组在腌制和干燥阶段的pH值在5.5~5.9之间,T2替代组在成熟前期pH值为5.82,推测可能是T2和T3替代组的金属盐组成改变了加工过程中肉块的pH值,从而提高了DPP I活性。而T1替代组的DPP I活力在加工过程中低于CK组,可能是由于T1替代组的离子组成对DPP I活力产生了一定的抑制作用。
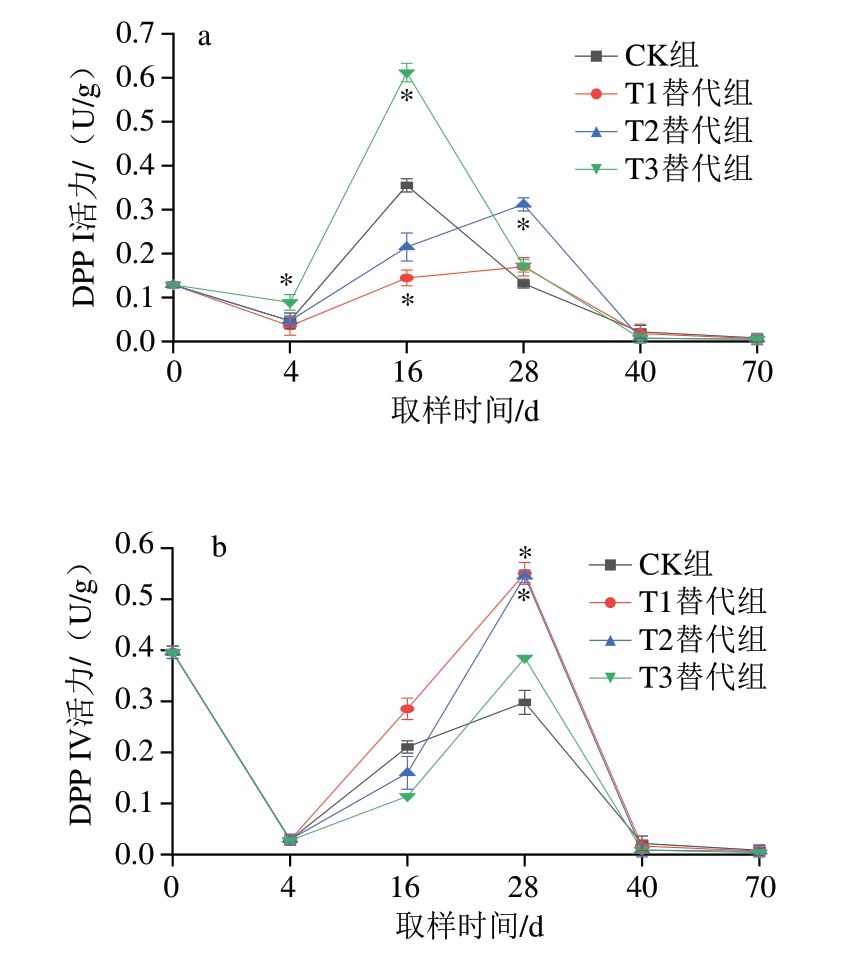
图4 干腌猪颈肉加工过程中二肽酶活力的变化(n =5)
Fig.4 Changes in dipeptidyl peptidases activity of dry-cured pork coppa during processing (n = 5)
a.DPP I活力;b.DPP IV活力。
如图4b所示,在加工过程中,各个组之间DPP IV活力的变化趋势基本一致,由原料肉的0.396 U/g迅速降至腌制后的0.028 U/g,之后逐渐升高,并在成熟前期达到峰值后又迅速下降,在成熟后期和后熟阶段DPP IV已基本不具有活性。食盐对DPP IV会产生强烈的抑制作用,因此T1和T2替代组仅在成熟前期显著高于CK组(P<0.05),而在其他阶段均未产生显著影响。可见,NaCl的存在对DPP IV活力的影响较大。此外,DPP IV在碱性条件下会表现出最大活性[32],而腌制过程基本处于偏酸性的环境,很难达到DPP IV的最适pH值范围。
干腌肉品质既取决于原料的某些特性(如p H值、内源酶活性),也取决于工艺变量(如腌制用盐组成)[32]。质构特性反映肉类结构物理特性,对产品口感起着决定性作用,是评价产品质量的重要指标之一[36]。近年来,质构仪等仪器的应用使肉类产品品质评价的内容更为丰富,评价参数的设定也更为客观,克服了传统检测法的一些缺点[37]。由图5a可知,随着加工时间的延长,CK组和替代组的硬度逐渐提高,这和水分含量降低密切相关。在后熟结束时,仅有T3替代组的硬度显著低于CK组(P<0.05),而其他替代组与CK组无显著差异。该结果可能是由于使用T3替代组的金属盐组合腌制猪颈肉导致肉块持水力增加,进而降低了肉块的硬度。
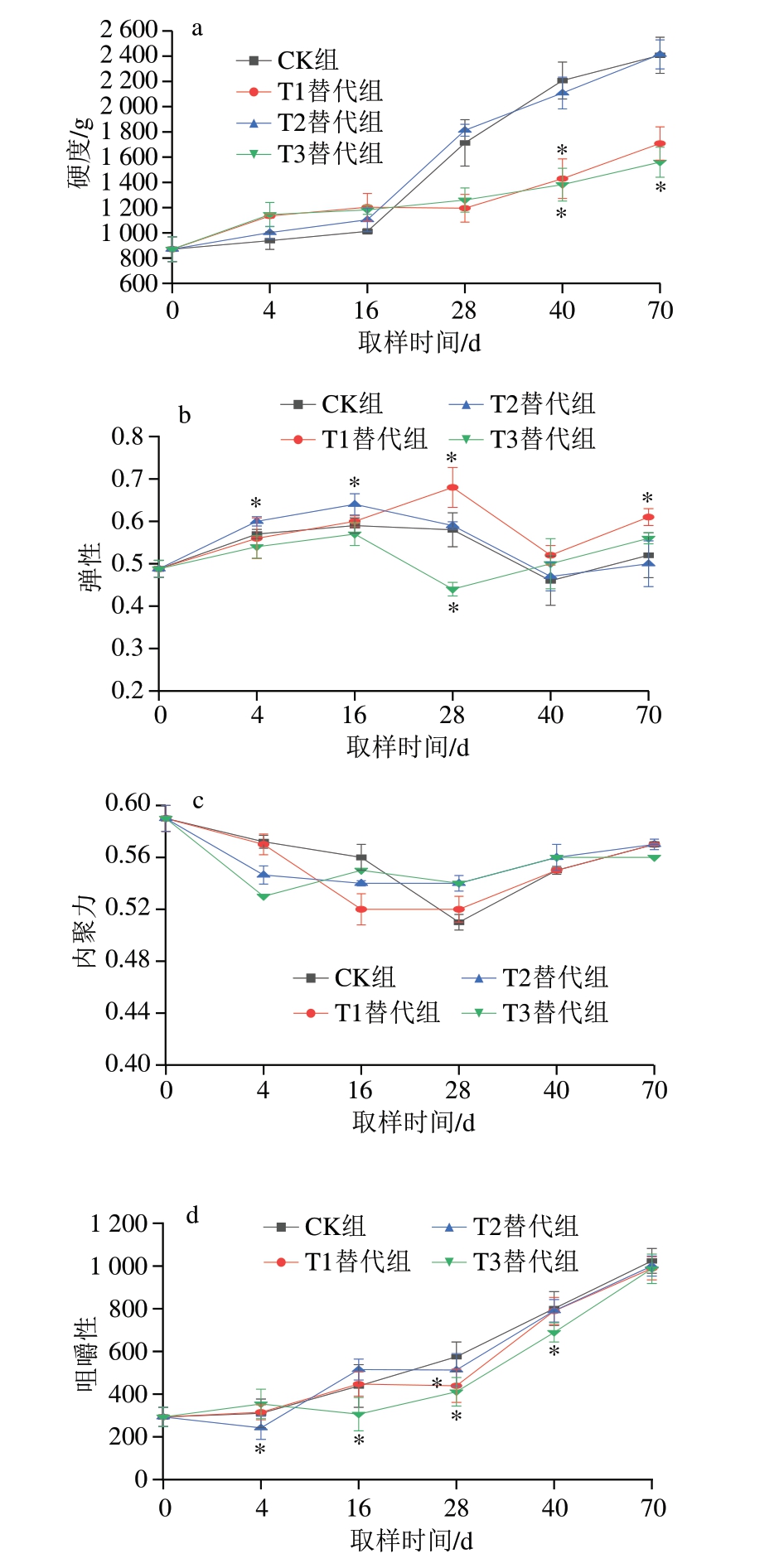
图5 干腌猪颈肉加工过程中质构特性的变化(n =5)
Fig.5 Changes in texture properties of dry-cured pork coppa during processing (n = 5)
a.硬度;b.弹性;c.内聚力;d.咀嚼性。
如图5b所示,随着加工时间的延长,肉块的弹性呈先增加后降低、成熟后期又增加的趋势。在后熟结束时,T1替代组的弹性显著高于CK组(P<0.05)。前期研究[38]结果表明,肉块弹性与水分含量直接相关,CK组和T1替代组的水分质量分数分别为43.48%和46.28%,本研究结果也验证了水分含量的增加会导致猪颈肉弹性增加。
如图5c所示,在加工过程中,内聚力呈现出先降低后增加的趋势。李斌等[39]研究发现,内聚力与样品分子内部的蛋白基质结构有关,联结不紧密会使其内聚性降低。CK组与各个替代组之间无显著差异,说明改变腌制盐的组成不会改变终产品的内聚力。
咀嚼性与硬度、弹性和内聚力等相关[35]。如图5d所示,在加工过程中,咀嚼性逐渐增强,虽然CK组和各个替代组之间出现显著差异(P<0.05),但经过后熟阶段,各组终产品咀嚼性无显著差异,提示使用不同组合的金属盐对NaCl进行替代不会影响干腌肉块终产品的咀嚼性。
本研究通过分析不同金属盐组合物对干腌猪颈肉加工过程中理化性质、蛋白降解能力、内源酶活力及质构特性的影响,探讨钠盐替代对干腌猪颈肉品质的影响。结果表明,与对照组相比,采用75% NaCl+15% KCl+5% CaCl2+5% MgCl2组合替代钠盐能够提高干腌猪颈肉蛋白降解程度、RAP和LAP活力,增加终产品弹性;采用75% NaCl+15% KCl+5% CaCl2+5% ZnCl2组合替代钠盐能够降低猪颈肉水分活度,提高蛋白降解程度及呈味氨基酸含量,同时提高LAP、DPP I和DPP IV活力;采用75% NaCl+15% KCl+5% MgCl2+5% ZnCl2组合替代钠盐能够提高猪颈肉蛋白降解程度、AAP、RAP、LAP和DPP I活力,并降低终产品硬度。研究结果为金属盐组合物替代钠盐提供了理论基础。后续可进一步对不同金属盐组合物对干腌猪颈肉品质影响的机制进行探索,为低钠盐干腌肉制品的研发提供参考。
[1] AQUILANI C, PUGLIESE C.Coppa[M]//LORENZO J M,DOMÍNGUEZ R, PATEIRO M, et al.Production of traditional mediterranean meat products.Salt Lake City: Academic Press, 2022:117-123.
[2] TOMAŽIN U, MARTIN Š, PREVOLNIK POVŠE M, et al.The effect of salting time and sex on chemical and textural properties of dry cured ham[J].Meat Science, 2020, 161: 107990.DOI:10.1016/j.meatsci.2019.107990.
[3] 胡典纶, 贺菊萍, 陈怡君, 等.三种干腌法对猪腌肉理化性质的影响[J].食品与发酵工业, 2021, 47(24): 144-149.DOI:10.13995/j.cnki.11-1802/ts.029067.
[4] PREUSS H G, BAGCHI M, BAGCHI D.Table salt (sodium chloride):vital aspects of metabolism and blood pressure regulation in health and disease[M]//PREUSS H G, BAGCHI D.Dietary sugar, salt and fat in human health.Amsterdam: Elsevier, 2020: 395-421.DOI:10.1016/b978-0-12-816918-6.00019-6.
[5] STOLARZ-SKRZYPEK K, STAESSEN J A.Reducing salt intake for prevention of cardiovascular disease: times are changing[J].Advances in Chronic Kidney Disease, 2015, 22(2): 108-115.DOI:10.1053/j.ackd.2014.12.002.
[6] UĞUZ Ş, SOYER A, DALMIŞ Ü.Effects of different salt contents on some quality characteristics during processing of dry-cured Turkish pastirma[J].Journal of Food Quality, 2011, 34(3): 204-211.DOI:10.1111/j.1745-4557.2011.00382.x.
[7] LI M M, ZHANG X, YIN Y T, et al.Perspective of sodium reduction based on endogenous proteases via the strategy of sodium replacement in conjunction with mediated-curing[J].Critical Reviews in Food Science and Nutrition, 2024, 64(26): 9353-9364.DOI:10.1080/104083 98.2023.2212287.
[8] GOU P, GUERRERO L, GELABERT J, et al.Potassium chloride,potassium lactate and glycine as sodium chloride substitutes in fermened sausages and in dry-cured pork meat[J].Meat Science, 1996,42(1): 37-48.DOI:10.1016/0309-1740(95)00017-8.
[9] 吴海舟, 张迎阳, 黎良浩, 等.KCl部分替代NaCl腌制对干腌肉制品蛋白质水解和感官品质的影响[J].食品科学, 2014, 35(1): 39-43.DOI:10.7506/spkx1002-6630-201401008.
[10] GARCÍA-GARRIDO J A, QUILES-ZAFRA R, TAPIADOR J, et al.Activity of cathepsin B, D, H and L in Spanish dry-cured ham of normal and defective texture[J].Meat Science, 2000, 56(1): 1-6.DOI:10.1016/S0309-1740(00)00005-X.
[11] CHENG J H, WANG S T, OCKERMAN H W.Lipid oxidation and color change of salted pork patties[J].Meat Science, 2007, 75(1): 71-77.DOI:10.1016/j.meatsci.2006.06.017.
[12] ISRAR T, RAKHA A, SOHAIL M, et al.Salt reduction in baked products: strategies and constraints[J].Trends in Food Science &Technology, 2016, 51: 98-105.DOI:10.1016/j.tifs.2016.03.002.
[13] KIM G D, HUR S J, PARK T S, et al.Quality characteristics of fatreduced emulsion-type pork sausage by partial substitution of sodium chloride with calcium chloride, potassium chloride and magnesium chloride[J].LWT-Food Science and Technology, 2018, 89: 140-147.DOI:10.1016/j.lwt.2017.10.033.
[14] RIPOLLÉS S, CAMPAGNOL P C B, ARMENTEROS M, et al.Influence of partial replacement of NaCl with KCl, CaCl2 and MgCl2 on lipolysis and lipid oxidation in dry-cured ham[J].Meat Science,2011, 89(1): 58-64.
[15] LORENZO J M, CITTADINI A, BERMÚDEZ R, et al.Influence of partial replacement of NaCl with KCl, CaCl2 and MgCl2 on proteolysis, lipolysis and sensory properties during the manufacture of dry-cured lacón[J].Food Control, 2015, 55: 90-96.DOI:10.1016/j.foodcont.2015.02.035.
[16] ALIÑO M, GRAU R, TOLDRÁ F, et al.Influence of sodium replacement on physicochemical properties of dry-cured loin[J].Meat Science, 2010, 83, 423-430.
[17] RUTIGLIANO M, LOIZZO P, SPADACCINO G, et al.A proteomic study of “Coppa Piacentina”: a typical Italian dry-cured salami[J].Food Research International, 2023, 166: 112613.DOI:10.1016/j.foodres.2023.112613.
[18] ZHANG X, YANG J N, GAO H, et al.Substituting sodium by various metal ions affects the cathepsins activity and proteolysis in drycured pork butts[J].Meat Science, 2020, 166: 108132.DOI:10.1016/j.meatsci.2020.108132.
[19] 国家卫生和计划生育委员会.食品安全国家标准 食品pH值的测定: GB 5009.237—2016[S].北京: 中国标准出版社, 2017.
[20] 昝博文, 白婷, 唐丽, 等.热加工工艺对调理里脊肉色泽和质构特性的影响[J].中国调味品, 2022, 47(12): 53-60.DOI:10.3969/j.issn.1000-9973.2022.12.010.
[21] 国家卫生和计划生育委员会.食品安全国家标准 食品中水分的测定: GB 5009.3—2016[S].北京: 中国标准出版社, 2017.
[22] 雷虹.传统风干肉在风干和贮藏过程中品质及风味物质的变化研究[D].呼和浩特: 内蒙古农业大学, 2018.
[23] 国家卫生和计划生育委员会, 国家食品药品监督管理总局.食品安全国家标准 食品中蛋白质的测定: GB 5009.5—2016[S].北京: 中国标准出版社, 2017.
[24] GONG X H, MI R F, CHEN X, et al.Evaluation and selection of yeasts as potential aroma enhancers for the production of dry-cured ham[J].Food Science and Human Wellness, 2023, 12(1): 324-335.DOI:10.1016/j.fshw.2022.07.022.
[25] 周昌瑜.基于现代工艺金华火腿蛋白降解及其滋味物质形成机制的研究[D].南京: 南京农业大学, 2020.DOI:10.27244/d.cnki.gnjnu.2020.000016.
[26] ARMENTEROS M, ARISTOY M C, TOLDRÁ F.Effect of sodium,potassium, calcium and magnesium chloride salts on porcine muscle proteases[J].European Food Research and Technology, 2009, 229(1):93-98.DOI:10.1007/s00217-009-1029-9.
[27] CONTRERAS M, BENEDITO J, QUILES A, et al.Assessing the textural defect of pastiness in dry-cured pork ham using chemical, microstructural, textural and ultrasonic analyses[J].Journal of Food Engineering, 2020, 265: 109690.DOI:10.1016/j.jfoodeng.2019.109690.
[28] SENTANDREU M A, TOLDRÁ F.Purification and biochemical properties of dipeptidyl peptidase I from porcine skeletal muscle[J].Journal of Agricultural and Food Chemistry, 2000, 48(10): 5014-5022.DOI:10.1021/jf990892q.
[29] 李美桃.干腌肉块的理化特性研究[D].北京: 中国农业大学, 2005.
[30] TAPIA M S, ALZAMORA S M, CHIRIFE J.Effects of water activity(aw) on microbial stability as a hurdle in food preservation[M]//BARBOSA-CÁNOVAS G V, FONTANA A J, SCHMIDT S J, et al.Water activity in foods: fundamentals and applications.Oxford:Blackwell Publishing, 2020.
[31] JOHNSON B, BROOKS J C, LEGAKO J F, et al.Determination of package and muscle-type influence on proteolysis, beef-flavorcontributing free amino acids, final beef flavor, and tenderness[J].Meat and Muscle Biology, 2020, 4(1): 10933.DOI:10.22175/mmb.10933.
[32] 赵改名.肌肉蛋白水解酶在金华火腿加工过程中作用的研究[D].南京: 南京农业大学, 2004.
[33] SANCEDA N, SUZUKI E, KURATA T.Quality and sensory acceptance of fish sauce partially substituting sodium chloride or natural salt with potassium chloride during the fermentation process[J].International Journal of Food Science & Technology, 2003, 38(4): 435-443.DOI:10.1046/j.1365-2621.2003.00710.x.
[34] KATSIARI M C, ALICHANIDIS E, VOUTSINAS L P, et al.Proteolysis in reduced sodium Feta cheese made by partial substitution of NaCl by KCl[J].International Dairy Journal, 2000, 10(9): 635-646.DOI:10.1016/S0958-6946(00)00097-2.
[35] ZHOU C Y, TANG C B, WANG C, et al.Insights into the evolution of myosin light chain isoforms and its effect on sensory defects of drycured ham[J].Food Chemistry, 2020, 315: 126318.DOI:10.1016/j.foodchem.2020.126318.
[36] ZHAO D D, FANG Y Z, WEI Z X, et al.Proteomics reveals the mechanism of protein degradation and its relationship to sensorial and texture characteristics in dry-cured squid during processing[J].Food Chemistry: X, 2024, 22: 101409.DOI:10.1016/j.fochx.2024.101409.
[37] 刘梦, 杨震, 史智佳, 等.超声辅助腌制处理对牛肉干干燥及理化特性的影响[J].食品科学, 2019, 40(21): 121-126.DOI:10.7506/spkx1002-6630-20181204-046.
[38] 米红波, 张婷, 姜琦, 等.低温无水保活对虾夷扇贝肌肉质构和肝脏生化特性的影响[J].食品科学技术学报, 2022, 40(2): 141-150.DOI:10.12301/spxb202100418.
[39] 李斌, 陶敏, 徐丹丹, 等.长江上游中华沙鳅食性特征的C、N同位素分析[J].水生生物学报, 2016, 40(5): 978-984.DOI:10.7541/2016.126.