刘丹怡(1990—)(ORCID: 0000-0001-7576-7634),女,讲师,博士,研究方向为副产物综合利用。E-mail: liudanyi@126.com
Effect of Different Sterilization Treatments on Heparin Titer, Protein Content in Wastewater and Microflora in Porcine Small Intestine
全润, 吴晓龙, 种正晨, 等.不同除菌方式对猪小肠肝素效价、废水蛋白含量及微生物菌群的影响[J].肉类研究, 2025,39(3): 18-28.DOI:10.7506/rlyj1001-8123-20240926-254.http://www.rlyj.net.cn
QUAN Run, WU Xiaolong, CHONG Zhengchen, et al.Effect of different sterilization treatments on heparin titer, protein content in wastewater and microflora in porcine small intestine[J].Meat Research, 2025, 39(3): 18-28.(in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-20240926-254.http://www.rlyj.net.cn
猪小肠是消化与吸收的主要器官,同时也是非特异性免疫反应的重要场所,这决定了小肠黏膜含有特殊的生理活性成分,如碱性磷酸酶、硫酸皮肤素、肝素和小肠黏膜蛋白(肽)等[1-2]。其中,肝素是由动物结缔组织肥大细胞产生的黏多糖,具有抗凝血性,作为抗凝剂应用于医药行业[3]。肝素多以新鲜猪小肠为原料进行生产,然而猪小肠内含有大量微生物,若保存不当会导致小肠中肝素组分被微生物及其代谢产物(酶)分解,进而造成得率下降,微生物代谢产生的毒素也会污染肝素废水蛋白,造成不必要的损失。然而,目前国内外对于猪小肠除菌技术研究甚少。因此,开发合理的除菌方法对提升肝素品质和回收肝素废水蛋白具有重要意义。
微酸性电解水(slightly acidic electrolyzed water,SAEW)是使用无隔膜技术,通过微弱的直流电压电解氯化钠溶液生成的pH值在5.0~6.5之间且具有强氧化特性的功能水[4]。SAEW能够通过破坏微生物细胞膜结构、改变细胞内环境导致其死亡[5-6]。与其他消毒剂相比,SAEW具有杀菌高效、贮藏稳定、无毒且无残留等优势[7-8]。赵莉等[9]研究SAEW、臭氧化水、次氯酸钠溶液和超声处理对鲜食花生保鲜效果的影响,结果表明,SAEW和次氯酸钠溶液能够有效控制微生物生长,以SAEW更安全。姜晓东等[10]研究SAEW和冷盐水预处理对虹鳟鱼肉贮藏品质的影响,发现SAEW抑制鱼肉微生物数量增长、维持鱼肉品质的效果优于冷盐水。
在实际应用中,除采用SAEW直接浸泡、清洗处理外,还常将其与超声和喷雾等技术联用,以提高除菌效果。超声在液体介质中传播时形成纵波,其周期性压力变化易引起空化效应。空化气泡坍塌瞬间产生的局部高温高压可破坏细胞结构,有效杀灭液体中的部分微生物[11]。超声处理能够加速SAEW的有效氯进入微生物细胞膜,达到更好的除菌效果。Feng Yabin等[12]比较单独使用超声、SAEW和2 种方式联合使用清洗葡萄的除菌效果,发现超声与SAEW联用的除菌效果最好。此外,喷雾SAEW已经被证明是一种有效的微生物杀灭技术。与直接浸泡相比,喷雾处理可避免污染物直接污染SAEW,从而避免其除菌效果减弱,这种处理方式已经被用于温室除菌[13]。
本研究以SAEW为杀菌剂,分别对猪小肠进行直接浸泡、超声浸泡及喷雾处理,探究不同除菌方式的除菌效果以及对猪小肠肝素效价、废水蛋白的影响,确定最佳除菌方式,并分析最佳除菌方式下猪小肠微生物菌群变化,以期为猪小肠肝素提取前的除菌处理提供理论与技术支持。
猪小肠源自东北农业大学三花猪。
胰蛋白酶(250 U/mg) 浙江福轩生物科技有限公司;肝素标准品(纯度>98.5%) 上海哈灵生物科技有限公司;牛血清蛋白标准品(纯度>98%) 北京博奥拓达科技有限公司;肝素试剂盒 上海瑞番生物科技有限公司;平板计数琼脂 上海力辰仪器科技有限公司;氯化钠、氢氧化钠、盐酸(均为分析纯) 国药集团化学试剂有限公司。
T15-100STD酸性电解水(acidic electrolyzed water,AEW)设备 丹麦Danish Clean Water公司;HI83224余氯测试仪 青岛聚创环保集团有限公司;RWP微纳米气泡发生器 江苏如克环保设备有限公司;JC-100电热恒温培养箱 青岛精诚仪器仪表有限公司;LDZX-30KBS高压灭菌锅 上海申安医疗器械厂;JD-CJ-2S单人双面垂直净化工作台 苏州金大净化工程设备有限公司;FE28 pH计 梅特勒-托利多仪器(上海)有限公司。
1.3.1 SAEW制备
以氯化钠和水为原料,使用AEW设备制备AEW(有效氯质量浓度(available chlorine concentration,ACC)为700 mg/L、pH 2.15),在1 h内使用以保持其活性。使用余氯测试仪测定其ACC,使用pH计测定其pH值。通过稀释AEW制备SAEW(pH 6)。
1.3.2 猪小肠肝素提取
参考王忠民[14]的方法,采用酶解法提取猪小肠肝素。首先,将除菌处理前后的猪小肠以1∶1 100(g/mL)溶于20 mmol/L Tris-HCl(含1%(m/m)吐温-20,pH 8.5)中,4 ℃、10 000 r/min离心20 min,收集上清液,即得肝素废水。将沉淀冻干后与适量去离子水混合,料液比为1∶10(g/mL),调节pH值为8.1,加入4 g/100 mL氯化钠,转入恒温水浴锅,温度达到40 ℃时加入2 g/100 mL胰蛋白酶,随后在37 ℃保温2 h。提取结束后,将温度升至86 ℃,灭活胰蛋白酶10 min,然后在4 ℃、10 000 r/min离心15 min,收集上清液,即得猪小肠肝素溶液。
1.3.3 除菌方式筛选
猪小肠清洗干净后,采用S A E W 按照料液比1∶6(g/mL)浸泡猪小肠,或采用SAEW对猪小肠进行均匀喷雾,以猪小肠菌落总数与所提取肝素效价为指标筛选除菌条件与方式。
1.3.3.1 直接浸泡
猪小肠分别在ACC为0、25、50、75、100 mg/L的SAEW中浸泡120 s,确定最佳除菌ACC。猪小肠在ACC为75 mg/L的SAEW中分别浸泡0、60、120、180、240 s,确定最佳浸泡时间。
1.3.3.2 超声浸泡
猪小肠分别在ACC为0、25、50、75、100 mg/L的SAEW中超声浸泡120 s,超声功率50 W,确定最佳除菌ACC。猪小肠在ACC为50 mg/L的SAEW中分别超声浸泡0、60、120、180、240 s,超声功率50 W,确定最佳超声浸泡时间。在0、25、50、75、100 W超声功率下,猪小肠在ACC为50 mg/L的SAEW中超声浸泡120 s,确定最佳超声功率。
1.3.3.3 喷雾处理
采用ACC为0、25、50、75、100 mg/L的SAEW对猪小肠均匀喷雾180 s,喷雾压力100 MPa,确定最佳除菌ACC。采用ACC为75 mg/L的SAEW喷雾0、90、180、270、360 s,喷雾压力100 MPa,确定最佳喷雾时间。在喷雾压力80、90、100、110、120 MPa下,采用ACC为75 mg/L的SAEW喷雾180 s,确定最佳喷雾压力。
1.3.4 菌落总数测定
根据GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》测定猪小肠菌落总数。减菌率按下式计算:
式中:N1为处理前的猪小肠菌落总数/(CFU/g);N2为处理后猪小肠菌落总数/(CFU/g)。
1.3.5 肝素效价测定
参考郭明珠[15]的天青A比色法测定猪小肠肝素效价,采用肝素试剂盒测定3 种除菌方式处理后猪小肠肝素效价。取肝素标准品(2 500 U)配制肝素标准溶液(2 U/mL),取肝素标准溶液配制一系列浓度梯度(0.2、0.4、0.6、0.8、1、2、4 U/mL)的标准溶液,分别加入0.5 mL天青显色工作液(天青显色液中加入5 倍体积的蒸馏水),在505 nm处测定吸光度并计算肝素效价,以吸光度为纵坐标,肝素效价(U/mL)为横坐标绘制标准曲线。标准曲线方程为y=0.099 6x+0.015 4(R2=0.992)。将猪小肠肝素溶液按照一定比例稀释后,在505 nm处测定吸光度,由标准曲线方程计算肝素效价。
1.3.6 肝素废水蛋白含量与组成测定
采用双缩脲法[16]测定肝素废水蛋白含量。准确配制10 mg/mL牛血清蛋白标准溶液,并稀释为一系列质量浓度梯度(0、2、4、6、8、10 mg/mL)的标准溶液,分别向1 mL标准溶液中加入4 mL双缩脲试剂混匀静置20 min,在540 nm处测定吸光度,绘制标准曲线。标准曲线方程为y=0.047 3x+0.006 5(R2=0.999 3)。将除菌处理前后的肝素废水按照一定比例稀释后,向1 mL样品中加入4 mL双缩脲试剂,并混匀静置20 min。在540 nm处测定吸光度,由标准曲线方程计算蛋白含量。
参照唐嘉诚等[17]的方法并略作调整,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfatepolyacrylamide gel electrophoresis,SDS-PAGE)测定肝素废水蛋白组成。首先,将猪小肠清洗、翻面,刮取猪肠内表面黏膜,真空冷冻干燥后精细研磨,作为未经肝素提取的肠黏膜样品。采用12%分离胶和6%浓缩胶将样品蛋白和上样缓冲液混合后,95 ℃加热5 min使蛋白质完全变性。每个样品取10 μL进行凝胶电泳。电泳在恒压120 V下进行,直至指示剂到达凝胶底1~2 cm处停止电泳。采用考马斯亮蓝R-250染色2 h,用脱色液脱色,直至蛋白条带清晰可见。使用凝胶成像仪拍摄蛋白条带,然后使用ImageJ软件进行灰度分析。
1.3.7 微生物组学分析
分别采用ACC 0、25、50、75、100 mg/L的SAEW在110 MPa喷雾压力下处理猪小肠270 s,收集猪小肠样品并提取DNA,采用聚合酶链式反应(polymerase chain reaction,PCR)扩增技术对微生物16S rDNA V3~V4可变区进行PCR扩增,上游引物:338F:5’-ACTCCTACGGGAGGCAGCA-3’,下游引物:806R:5’-GGACTACHVGGGTWTCTAAT-3’。
委托北京奥维森基因科技有限公司进行测序,得到原始数据后利用Pear软件进行质控、去除错位碱基和引物、过滤拼接。对相似度≥97%的有效片段进行操作分类单元(operational taxonomic unit,OTU)聚类,与已建立的数据库对比并进行分类注释,从而实现基于OTU的多样性分析。
所有指标均进行3 次重复测定,使用SPSS 2019软件统计分析数据,采用最小显著差异(least significant difference,LSD)法对各处理组数据进行多重比较,P<0.05为差异显著,结果以平均值±标准差表示,使用Origin 2021软件绘制相关图表。
2.1.1 直接浸泡ACC对猪小肠除菌效果及肝素效价的影响
由图1a可知,直接浸泡可有效地除去猪小肠中的细菌,随着SAEW ACC的增加,猪小肠菌落总数显著降低(P<0.05),除菌效果显著增强。Tantratian等[18]使用不同ACC SAEW清洗新鲜牡蛎,除菌效果也随着ACC的增加逐渐增强,与本研究结果一致。这是由于SAEW主要通过有效氯成分破坏细菌细胞膜结构、影响细胞的代谢过程导致细菌死亡[19],ACC越高,SAEW的除菌效果越强。与ACC 0 mg/L相比,ACC达到75 mg/L时,菌落总数减少2.61(lg(CFU/g)),减菌率达(99.75±0.06)%,继续增加ACC,减菌率增加不显著(P>0.05)。因此,ACC达到一定水平时,即可取得较为理想的除菌效果,考虑到实际生产成本,选择ACC 75 mg/L的SAEW进行直接浸泡除菌处理。如图1b所示,随着SAEW ACC的增加,肝素效价显著降低(P<0.05)。SAEW的有效氯成分能够破坏细胞膜结构,促进细胞内活性成分释放[20],导致更多肝素溶解于SAEW,进而降低肝素提取率。当ACC达到75 mg/L时,肝素效价为(9.26±0.18)U/mL,与0 mg/L相比,降低1.74 U/mL。
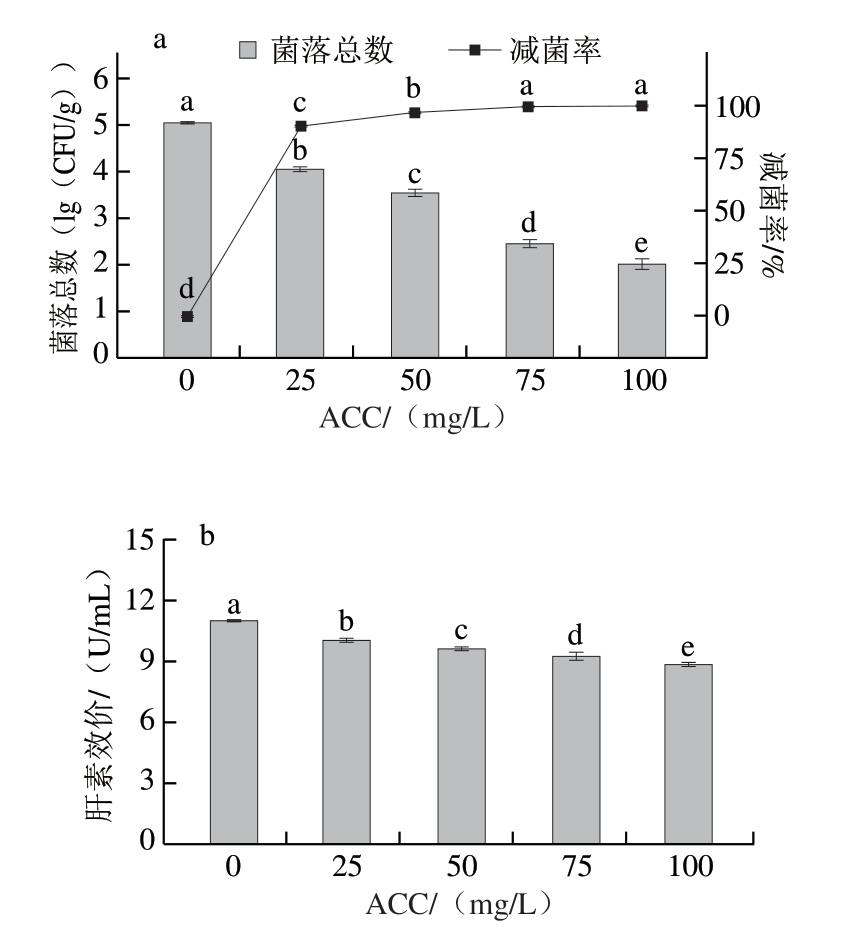
图1 直接浸泡ACC对猪小肠除菌效果(a)与肝素效价(b)的影响
Fig.1 Effect of available chlorine concentration on the direct immersion sterilization (a) and heparin titer (b) of porcine small intestine
小写字母不同表示差异显著(P<0.05)。图2~9、11同。
2.1.2 直接浸泡时间对猪小肠除菌效果及肝素效价的影响由图2a可知,随着浸泡时间的延长,猪小肠菌落总数显著减少(P<0.05),除菌效果显著增强,但减菌率在浸泡时间达到120 s后增加不显著(P>0.05),减菌率达到(99.77±0.04)%。与浸泡0 s相比,浸泡180、240 s时菌落总数分别减少2.89、3.03(lg(CFU/g)),减菌率分别为(99.87±0.04)%和(99.90±0.03)%,除菌效果好且减菌率相当。浸泡时间过长时,SAEW会与猪小肠中的其他污染物发生相互作用,消耗SAEW中的有效氯成分[21],但杀菌效果已不显著。因此,直接浸泡120 s即可实现猪小肠充分除菌。
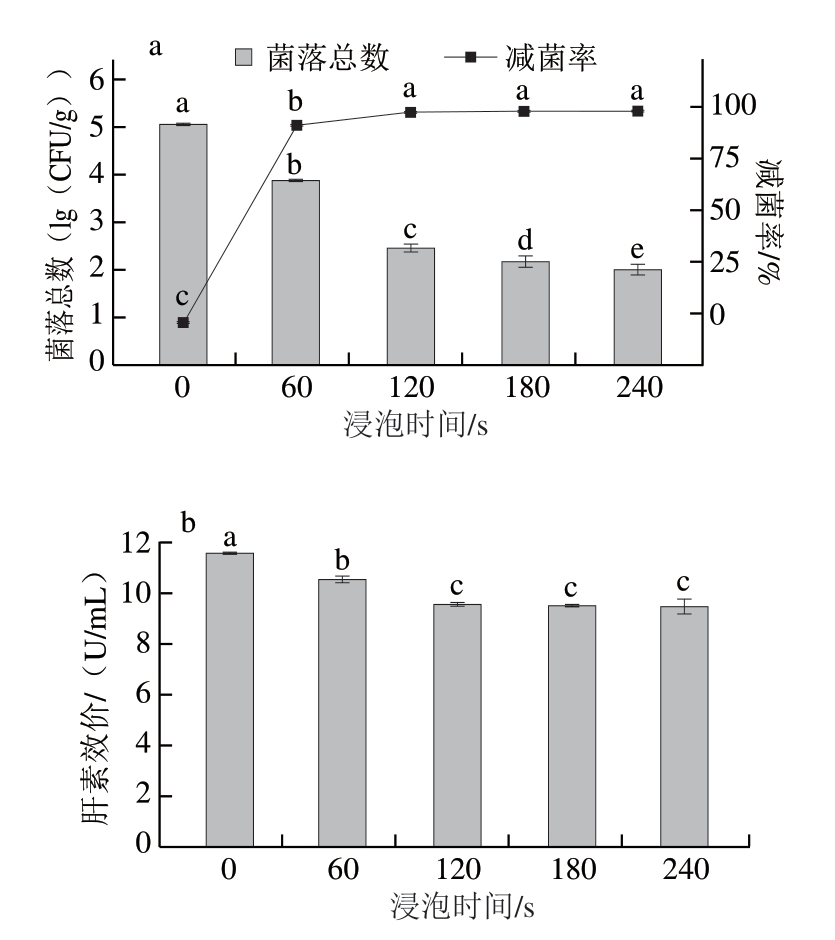
图2 直接浸泡时间对猪小肠除菌效果(a)与肝素效价(b)的影响
Fig.2 Effect of soaking time on the direct immersion sterilization (a)and heparin titer (b) of porcine small intestine
由图2b可知,随着浸泡时间的延长,肝素效价显著降低(P<0.05)。一方面,SAEW能破坏细胞形态与结构,促进细胞内容物释放[22]。另一方面,SAEW作为一种pH 5.0~6.5的功能水,其微酸性对肝素活性结构影响较小,可能导致少部分肝素-蛋白结合物溶解于SAEW[23-24]。浸泡时间越长,猪小肠与SAEW接触时间越长,这将促进更多肝素溶解于SAEW。直接浸泡120 s的肝素效价为(9.57±0.09)U/mL,与浸泡0 s相比(未经除菌处理),肝素效价减少1.98 U/mL。继续延长浸泡时间,肝素效价降低不显著(P>0.05),表明SAEW浸泡处理对肝素提取的影响有限,但处理时间延长可导致SAEW有效氯成分减少[25],SAEW对细菌细胞的破坏作用也随之降低。
2.2.1 超声浸泡ACC对猪小肠除菌效果及肝素效价的影响
由图3a可知,随着SAEW ACC的增加,猪小肠菌落总数显著减少(P<0.05),除菌效果显著提高。Liu Xiaofang等[26]使用SAEW联用超声处理金枪鱼,也发现ACC越高,除菌效果越好,与本研究结果一致。与ACC 0 mg/L相比,ACC 50 mg/L时菌落总数减少2.74(lg(CFU/g)),减菌率为(99.71±0.06)%,除菌效果优于直接浸泡方式。这可能是由于超声的空化效应导致细菌的细胞壁和细胞膜破裂,有效氯成分可加快通过细菌细胞膜进入细胞,发挥杀菌作用[27-28]。继续增加ACC,减菌率增加不显著(P>0.05)。综上,选择ACC 50 mg/L的SAEW进行超声浸泡除菌处理。
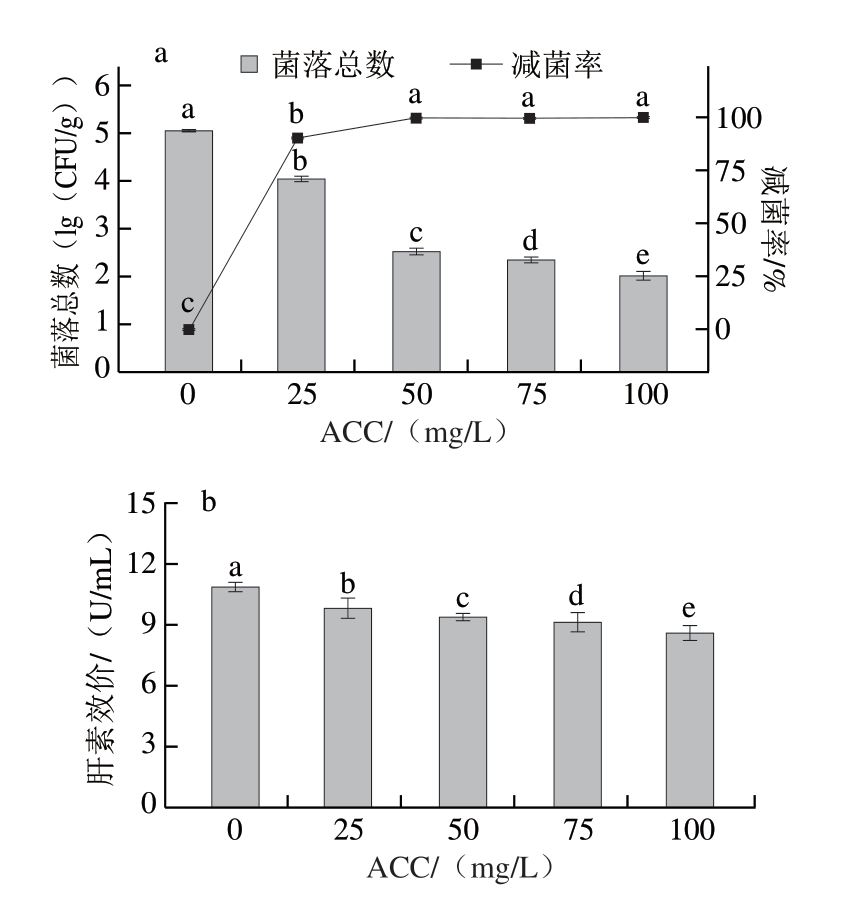
图3 超声浸泡ACC对猪小肠除菌效果(a)与肝素效价(b)的影响
Fig.3 Effect of available chlorine concentration on the ultrasonic assisted immersion sterilization (a) and heparin titer (b) of porcine small intestine
由图3b可知,ACC为0 mg/L时,超声浸泡猪小肠肝素效价为(10.88±0.19)U/mL,而直接浸泡猪小肠肝素效价为(11.00±0.07)U/mL,2 种除菌处理方式对肝素效价影响差异不明显。随着ACC的增加,SAEW对猪小肠细胞的破坏作用增强,肝素效价显著降低(P<0.05)。当ACC达到50 mg/L时,肝素效价为(9.37±0.15)U/mL,而直接浸泡肝素效价为(9.64±0.06)U/mL,超声浸泡除菌会损耗更多的肝素。
2.2.2 超声时间对猪小肠除菌效果及肝素效价的影响
超声波能够增加微生物细胞膜通透性,甚至破坏细胞膜结构,进而促进SAEW的有效氯成分渗透到微生物细胞内部,导致微生物死亡,而超声时间和超声功率是影响超声波破坏细胞膜程度的关键因素[29]。由图4a可知,随着超声时间的延长,猪小肠菌落总数显著减少(P<0.05),超声时间120 s时,猪小肠菌落总数减少2.76(lg(CFU/g)),减菌率为(99.82±0.03)%。继续延长超声时间至180、240 s时菌落总数分别减少2.96、3.09(lg(CFU/g)),菌落总数减少量高于直接浸泡处理,除菌效果更好,但是减菌率增加不显著(P>0.05)。综上,选择超声时间为120 s。
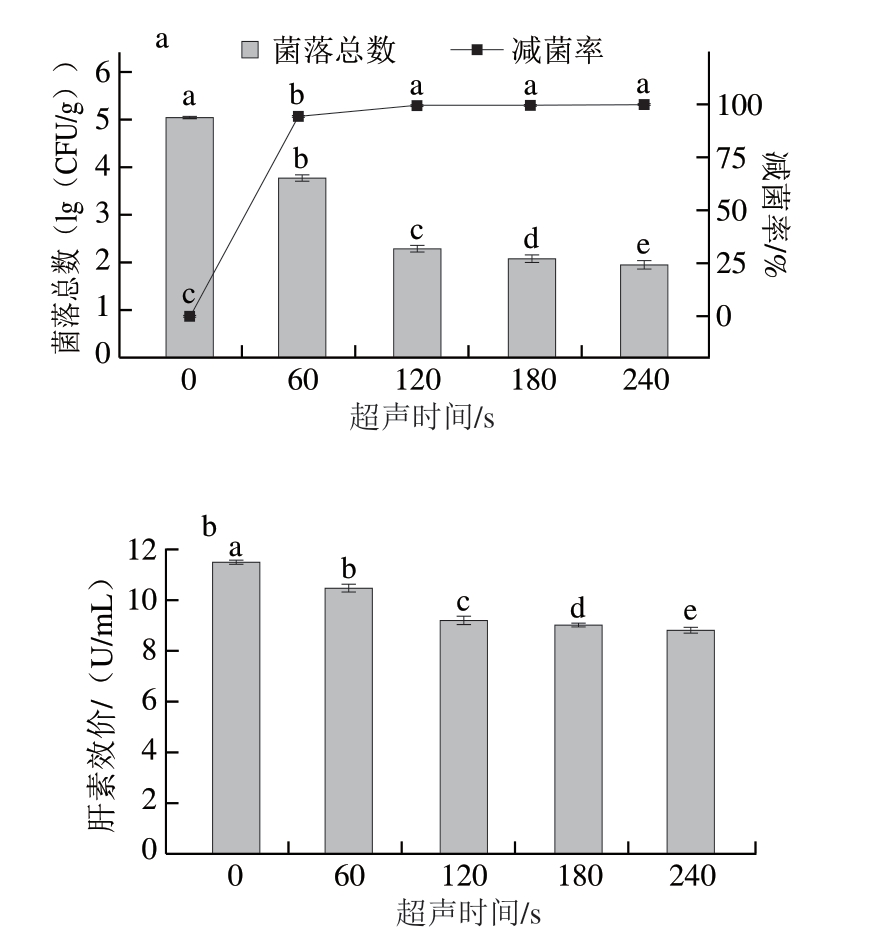
图4 超声时间对猪小肠除菌效果(a)与肝素效价(b)的影响
Fig.4 Effect of ultrasound time on the sterilization (a) and heparin titer (b) of porcine small intestine
由图4b可知,随着超声时间的延长,肝素效价显著降低(P<0.05)。与超声0 s相比,超声浸泡120 s时,肝素效价为(9.24±0.07)U/mL,减少2.69 U/mL,减少量高于直接浸泡(1.98 U/mL),这可能是由于超声可破坏细胞膜,超声时间延长可增加细胞膜破坏程度[30],进而促进SAEW的有效氯成分渗透,导致更多肝素-蛋白结合物溶解于SAEW。
2.2.3 超声功率对猪小肠除菌效果及肝素效价的影响
超声波主要通过空化效应、机械效应、热效应及自由基效应改变细胞膜通透性和破坏细胞膜结构[31]。由图5a可知,与超声功率0 W相比,超声功率25、50 W时菌落总数分别减少0.02、0.04(lg(CFU/g))(P>0.05),超声功率达到75 W后,菌落总数减少0.31(lg(CFU/g))且减菌率达到(99.77%±0.04)%(P<0.05)。超声功率越高,细胞膜结构破坏程度越高,进而促进SAEW的有效氯成分进入细胞,核酸和蛋白质等细胞膜内成分释放[32]。因此,选择超声功率为75 W。
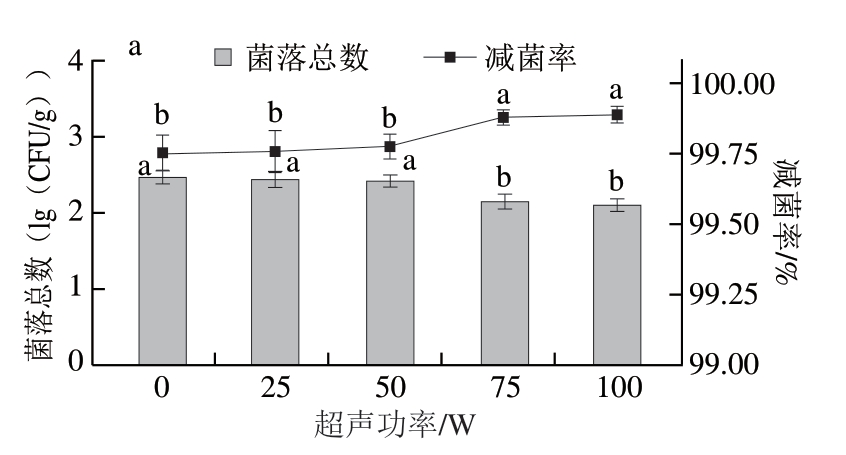
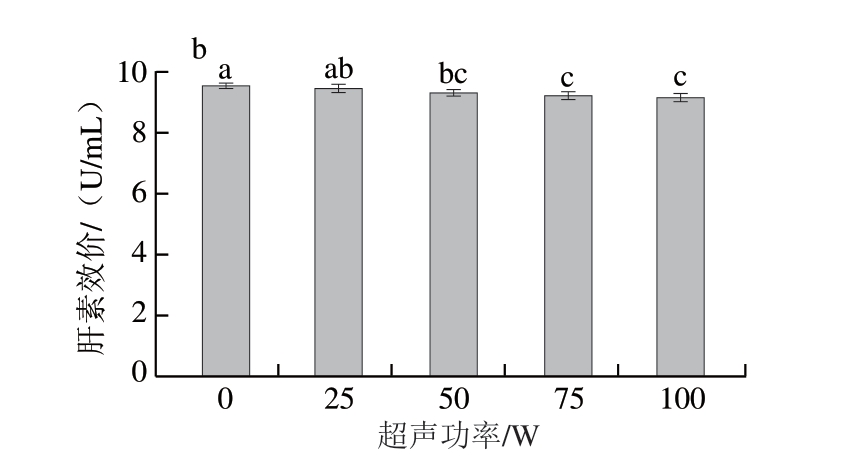
图5 超声功率对猪小肠除菌效果(a)与肝素效价(b)的影响
Fig.5 Effect of ultrasound power on the sterilization (a) and heparin titer (b) of porcine small intestine
超声功率增加会导致空化气泡数量增多,空化作用增强,细胞破坏程度增加[33],进而导致更多肝素-蛋白结合物溶出。由图5b可知,超声功率75 W时,肝素效价为(9.23±0.10)U/mL,与超声功率0 W相比减少0.33 U/mL,与未经除菌处理相比减少2.80 U/mL,表明超声能促进肝素溶解于SAEW。Zhang Liping等[34]研究发现,300 W超声处理2 h对猪小肠肝素提取效果较好。超声处理产生的局部高压与高温能够破坏猪小肠细胞膜,增加肝素提取得率,因此,超声浸泡处理可能导致更多肝素溶于SAEW而损耗,进而降低肝素效价。但总体上,0~100 W超声处理对肝素效价影响较小,可能是由于低超声功率对猪小肠的破坏程度较小。
2.3.1 喷雾ACC对猪小肠除菌效果及肝素效价的影响
由图6a可知,随着SAEW ACC的增加,猪小肠菌落总数显著减少(P<0.05)。但是,相同ACC下喷雾的除菌效果不及直接浸泡和超声浸泡除菌方式。这可能是因为浸泡方式可使SAEW与猪小肠充分接触,有效氯成分能够充分发挥杀菌作用。这与Liu Chang等[35]的研究结果相似,浸泡比喷雾具有更大的接触面积,浸泡除菌效果更好。但当ACC达到75 mg/L后,3 种除菌方式的除菌效果相差不大,喷雾、直接浸泡和超声浸泡减菌率分别达到(99.55±0.04)%、(99.75±0.06)%和(99.82±0.03)%。继续增加喷雾ACC,减菌率无显著变化(P>0.05)。因此,选择ACC为75 mg/L的SAEW进行喷雾处理。
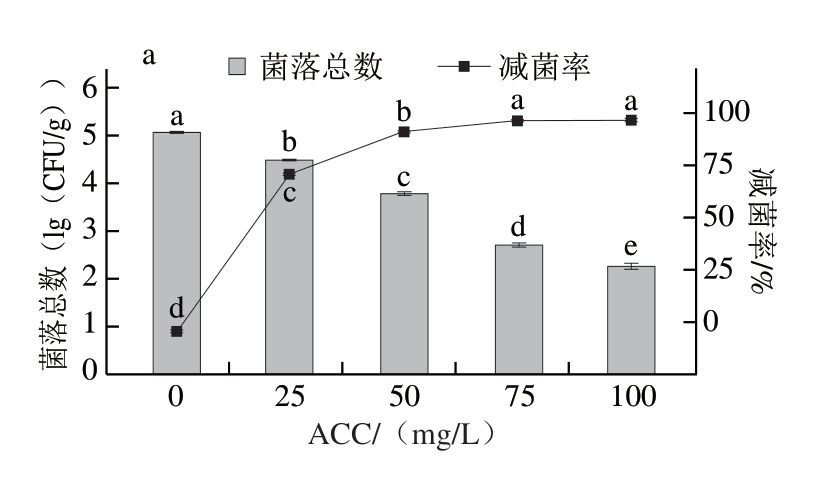
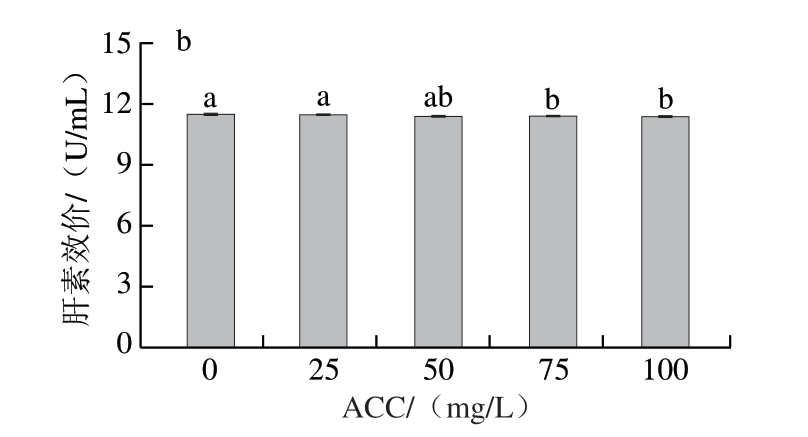
图6 喷雾ACC对猪小肠除菌效果(a)与肝素效价(b)的影响
Fig.6 Effect of available chlorine concentration on the spraying sterilization (a) and heparin titer (b) of porcine small intestine
由图6b可知,随着喷雾ACC的增加,肝素效价逐渐降低。与ACC为0 mg/L相比,喷雾ACC为75 mg/L时,肝素效价为(11.41±0.01)U/mL,降低0.07 U/mL。喷雾处理的肝素效价远高于直接浸泡的(9.26±0.18)U/mL和超声浸泡的(9.11±0.48)U/mL,表明喷雾除菌方式的肝素损耗最小。与浸泡相比,喷雾能够减少SAEW与猪小肠接触,进而避免肝素溶于SAEW而损耗。
2.3.2 喷雾时间对猪小肠除菌效果及肝素效价的影响
由图7a可知,与喷雾时间0 s相比,其余喷雾时间的菌落总数均显著减少(P<0.05),减菌率显著升高(P<0.05),除菌效果显著增加。Yuan Xingyun等[36]在不同喷雾时间,采用不同ACC的SAEW处理鸡蛋,发现肺炎链球菌等细菌的减少量与喷雾时间成正比,与本研究结果一致。延长喷雾时间有助于SAEW与猪小肠充分接触,其有效氯成分可充分作用于猪小肠中的细菌,达到更好的除菌效果。但当处理时间大于270 s后,减菌率升高不显著(P>0.05)。喷雾时间过长,SAEW可能与猪小肠污染物继续反应,消耗有效氯成分,导致除菌效果减弱。因此,选择喷雾时间为270 s。
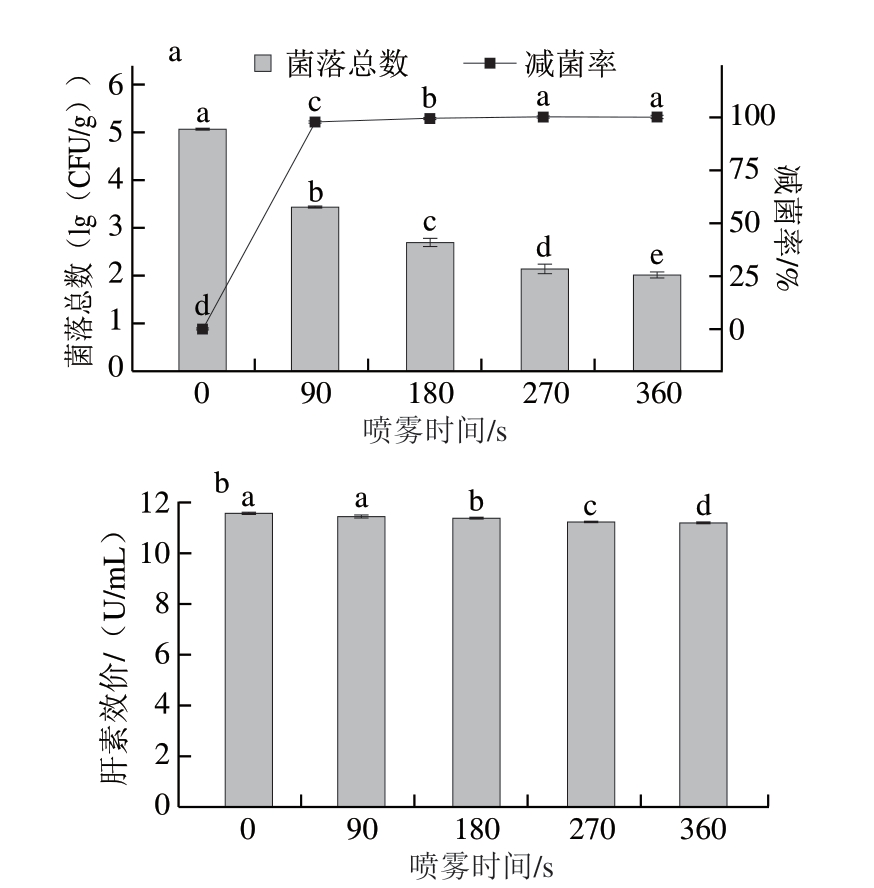
图7 喷雾时间对猪小肠除菌效果(a)与肝素效价(b)的影响
Fig.7 Effect of spraying time on the sterilization (a) and heparin titer (b) of porcine small intestine
由图7b可知,随着喷雾时间的延长,肝素效价显著降低(P<0.05)。与喷雾时间0 s相比,喷雾时间270 s时,肝素效价为(11.23±0.10)U/mL,减少0.34 U/mL。喷雾除菌过程中,喷雾时间是决定SAEW喷洒量、SAEW与猪小肠接触时间的关键因素,增加喷洒量和接触时间可加强SAEW对猪小肠的杀菌作用,但可导致肝素效价降低。然而,与浸泡相比,喷雾时间对肝素效价的影响较小,这可能是由于浸泡处理使SAEW与猪小肠的接触更充分,肝素-蛋白结合物因溶于浸泡液而导致肝素损耗更多。
2.3.3 喷雾压力对猪小肠除菌效果及肝素效价的影响
喷雾压力影响SAEW喷洒量及与猪小肠的接触面积,喷雾压力越大,喷洒出的SAEW粒径越小[37],在相同面积下,猪小肠能够接触更多SAEW,有效氯成分能够更充分作用于猪小肠中的细菌,达到更好的除菌效果。由图8a可知,随着喷雾压力的增大,菌落总数显著减少(P<0.05),当喷雾压力为110 MPa时,减菌率为(99.76±0.03)%,继续升高喷雾压力,减菌率升高不显著(P>0.05)。所以,选择喷雾压力为110 MPa。
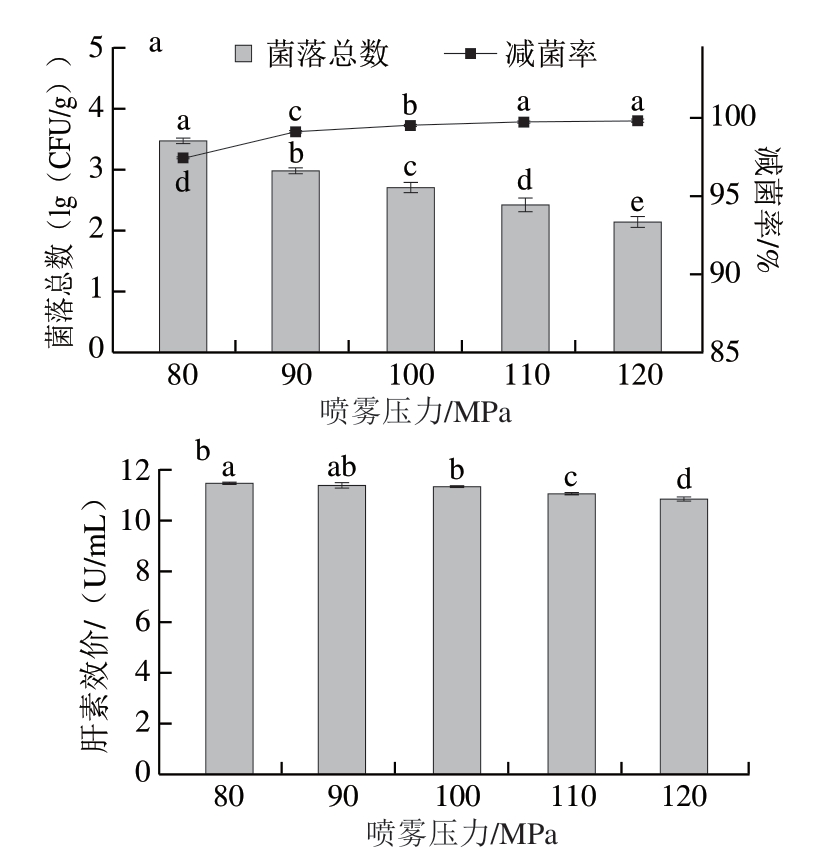
图8 喷雾压力对猪小肠除菌效果(a)与肝素效价(b)的影响
Fig.8 Effect of spraying pressure on the sterilization (a) and heparin titer (b) of porcine small intestine
由图8b可知,喷雾压力大于90 MPa后,肝素效价显著减少(P<0.05),表明喷雾压力能够显著影响肝素提取。喷雾压力110 MPa时,肝素效价为(11.09±0.11)U/mL,与喷雾压力80 MPa相比减少0.48 U/mL,与未经除菌处理相比减少0.84 U/mL。Zheng Weichao等[38]研究发现,喷雾压力越大,SAEW喷雾粒径越小,这导致SAEW单位面积接触量增加。另外,有效氯损耗也与粒径有关,粒径越小,损耗越小。所以,喷雾压力越大,猪小肠接触SAEW越多,肝素损失越多。
2.4.1 不同除菌方式对猪小肠肝素废水蛋白含量的影响
由图9可知,不同除菌方式对于肝素废水蛋白含量存在显著影响(P<0.05)。与未经除菌处理组对比,直接浸泡和超声浸泡对废水蛋白含量影响较大,蛋白质量浓度分别降低4.09、4.13 mg/mL;喷雾对废水蛋白含量影响相对较小,蛋白质量浓度降低0.38 mg/mL。猪小肠肝素废水蛋白主要是一类水溶性糖蛋白[39],与喷雾对比,浸泡能够使猪小肠与SAEW充分接触,使更多蛋白溶于浸泡液,导致肝素废水蛋白含量显著减少(P<0.05)。因此,喷雾方式更利于肝素废水蛋白回收。
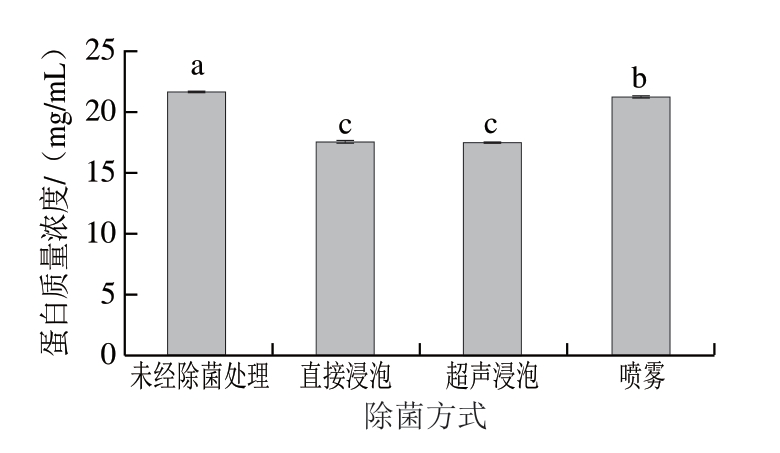
图9 不同除菌方式处理肝素废水的蛋白含量
Fig.9 Protein content of heparin wastewater treated by different sterilization methods
2.4.2 不同除菌方式对猪小肠肝素废水蛋白组成的影响
由图10可知,未经肝素提取处理的猪小肠黏膜原始样条带较为丰富,背景深,呈现弥散状态,但经酶解提取肝素后,条带数量明显减少或消失。未经除菌处理与经3 种除菌方式处理后的肝素废水样品在分子质量70 kDa处均有清晰条带,说明3 种除菌方式对废水蛋白组成无明显影响,在实际生产过程中可能不会对酶解废水中特定蛋白回收产生影响。综上,在最佳除菌条件下,3 种除菌方式的除菌效果相当。但是,喷雾处理对肝素效价和肝素废水蛋白含量影响相对较小。因此,猪小肠肝素提取前除菌处理采用喷雾除菌方式。
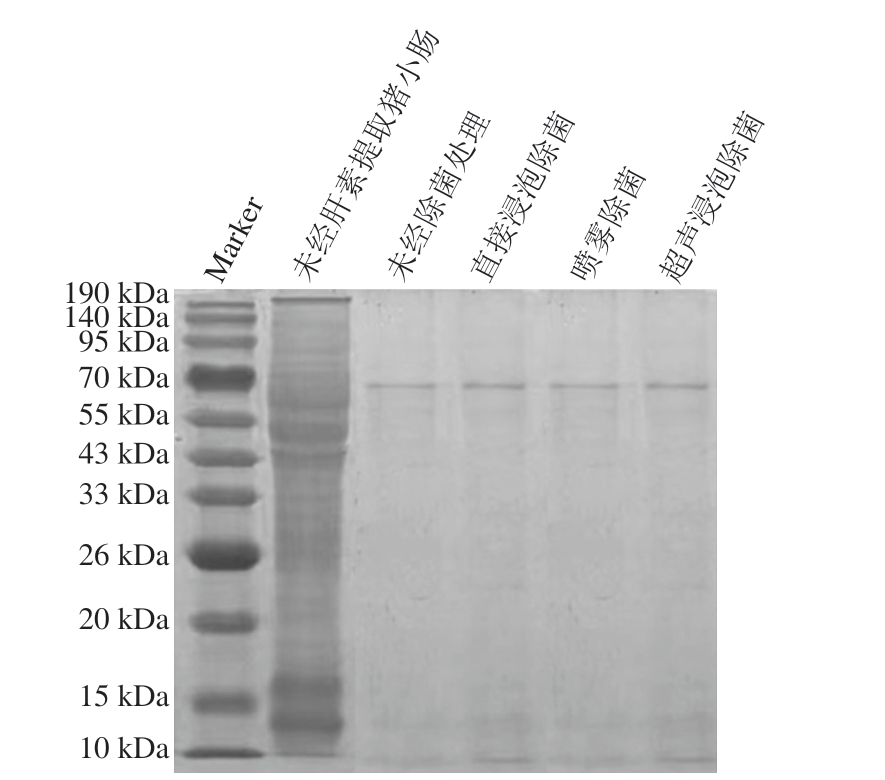
图10 不同除菌方式处理肝素废水中蛋白的SDS-PAGE图谱
Fig.10 SDS-PAGE patterns of proteins in heparin wastewater treated by different sterilization methods
采用16S rDNA高通量测序技术从不同ACC喷雾处理猪小肠微生物中共获得1 065 506 条有效序列,平均每个样品的序列数为71 034 条,测序深度在5 000~20 000之间。对测出的2 599 个OTU进行生物信息统计分析,获得不同ACC喷雾处理猪小肠菌群组成。
α-多样性可衡量样品中物种的多少、丰度和均匀度,其中,Chao1指数是衡量微生物丰度的关键指标之一,Shannon指数表示微生物多样性。由图11可知,与ACC 0 mg/L相比,ACC 25、50、75、100 mg/L处理猪小肠样品的Chao1指数和Shannon指数均显著降低(P<0.05),表明SAEW喷雾处理对猪小肠菌群丰富度和多样性存在显著影响,增加ACC可有效降低猪小肠菌群多样性和丰富度。但ACC 75 mg/L处理猪小肠样品的Shannon指数高于ACC 50 mg/L处理猪小肠样品,Shannon指数对丰度低的物种权重大,这可能导致ACC为75 mg/L时计算出的Shannon指数偏大。
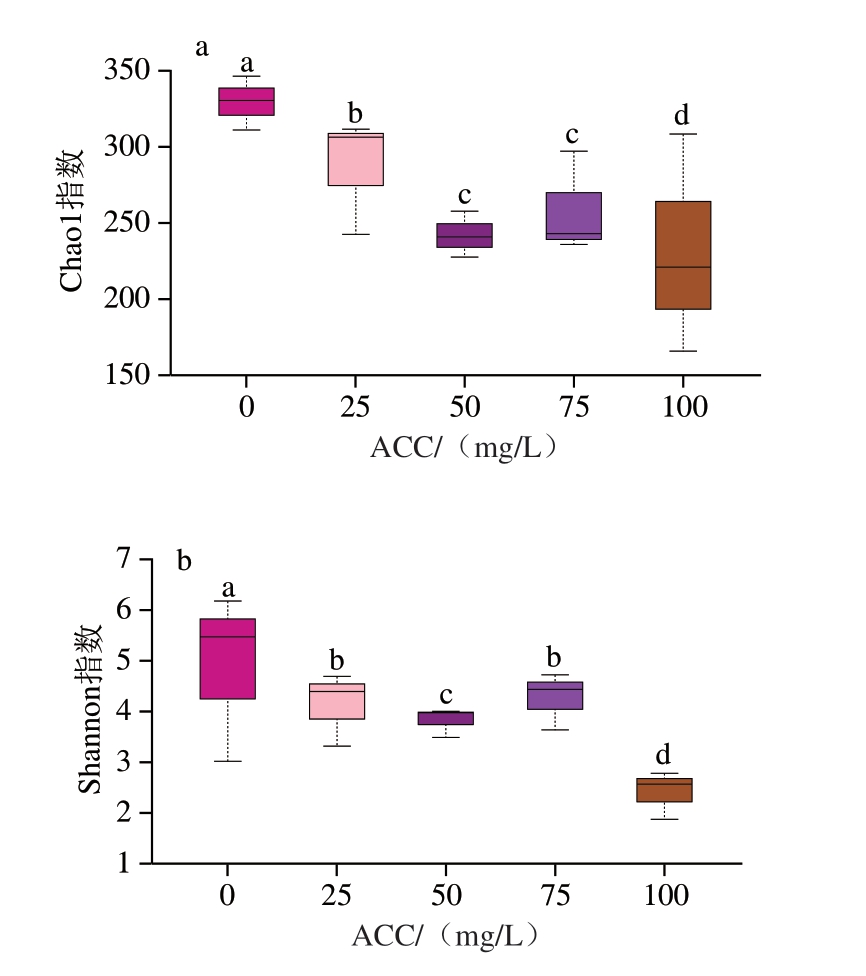
图11 不同ACC SAEW喷雾处理猪小肠微生物群落Chao1指数(a)与Shannon指数(b)变化
Fig.11 Variation in Chao1 index (a) and Shannon index (b) of microbial community of porcine small intestine microflora treated with different available chlorine concentrations from SAEW
β-多样性分析是了解不同群落物种组成差异的重要方法,用于研究群落之间的种多度关系。基于Bray-Curtis距离的主坐标分析(principal coordinate analysis,PCoA)是β-多样性分析的非限制性排序。由图12可知,ACC 0 mg/L处理猪小肠与ACC 25、50、75、100 mg/L处理猪小肠菌群组成存在显著差异(P<0.05),与ACC 100 mg/L处理猪小肠菌群组成差异最大,说明ACC 100 mg/L处理对猪小肠菌群组成影响最大。
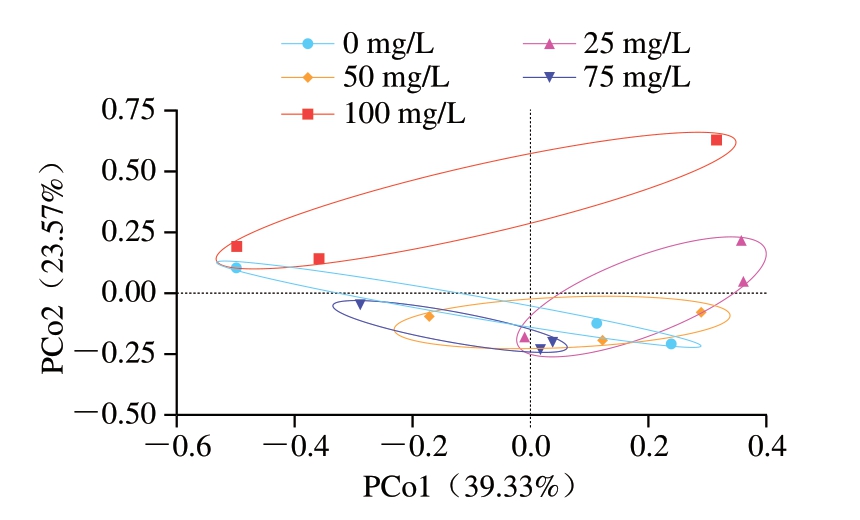
图12 不同ACC SAEW喷雾处理猪小肠微生物组成差异PCoA图
Fig.12 Principal coordinate analysis plot showing variations in the microbiome of porcine small intestine treated with different available chlorine concentrations from SAEW
目前,16S rRNA测序的片段通常只有300~500 bp,大多只在科水平和属水平得到较高可信度的注释,本研究在门水平和属水平展示不同ACC SAEW喷雾处理猪小肠微生物群落的物种组成丰度。由图13可知,ACC 0 mg/L时,猪小肠菌群主要由厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)构成,两者为猪小肠中常见的优势菌门[40-41]。此外,Li Chao等[42]发现,中国莱芜猪和市售三元杂交猪的肠道优势菌门也是厚壁菌门和变形菌门。当ACC达到25 mg/L时,变形菌门相对丰度明显下降,而厚壁菌门和疣微菌门(Verrucomicrobiota)相对丰度升高,说明ACC 25 mg/L的SAEW能够有效杀灭变形菌门细菌,但其对厚壁菌门的杀菌效果不如变形菌门;当ACC大于25 mg/L后,厚壁菌门相对丰度随ACC的增加而减小,疣微菌门则大幅增加。这表明,适当ACC的SAEW能够有效杀灭猪小肠中的优势菌门,但对疣微菌门的杀菌效果相对较差。
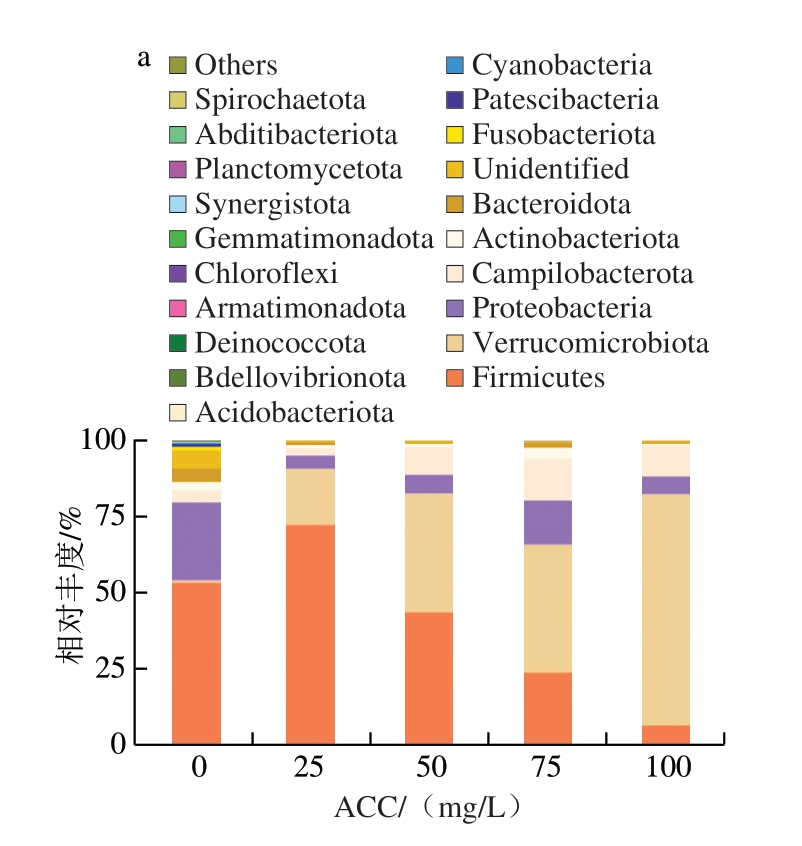
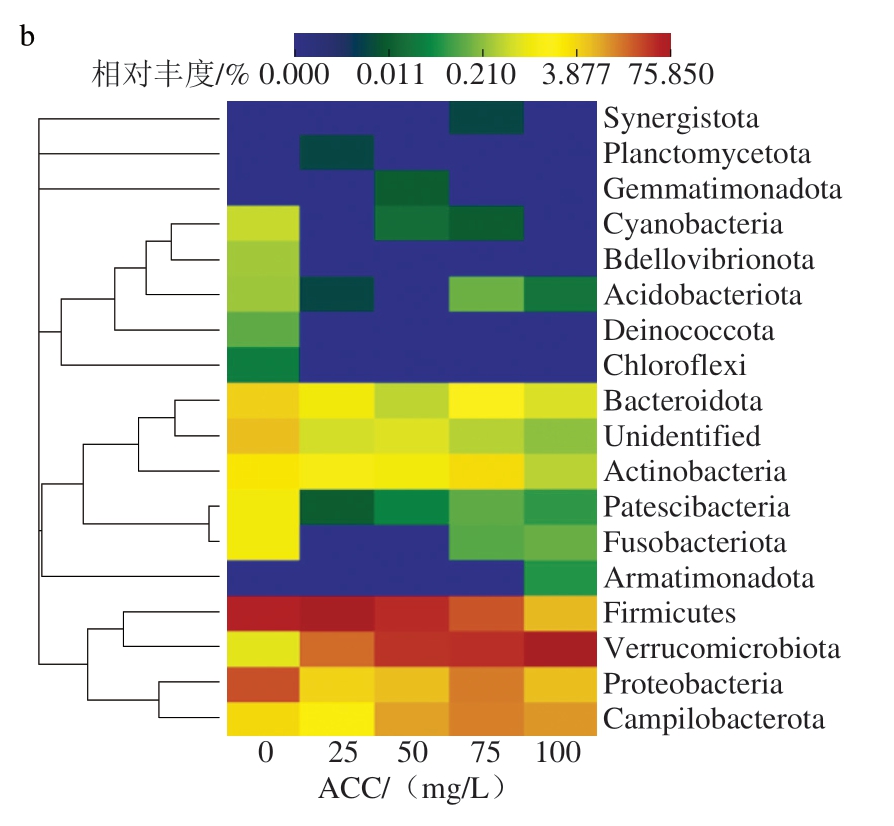
图13 不同ACC SAEW喷雾处理猪小肠菌群门水平相对丰度堆叠柱状图(a)与层级聚类热图(b)
Fig.13 Stacked bar chart (a) and hierarchical clustering heatmap (b) of phylum-level distribution of relative abundance of porcine small intestinal flora treated with SAEW at different available chlorine concentrations
不同ACC SAEW喷雾处理猪小肠微生物属水平变化如图14所示,ACC 0 mg/L时,猪小肠菌群主要为乳球菌属(Lactococcus)、漫游球菌属(Vagococcus)、链球菌属(Streptococcus)、不动杆菌属(Acinetobacter)和嗜冷杆菌属(Psychrobacter)。Crespo-Piazuelo[43]和Gryaznova[44]等的研究发现,乳杆菌属(Lactobacillus)和梭菌属(Clostridium)为猪小肠优势菌属。这与本研究结果存在差异。ACC 0 mg/L时,猪小肠中的嗜冷杆菌属是肉类冷冻贮藏过程中常见的菌属[45],可能由于样品冷冻时间过长导致其相对丰度增加。ACC达到25 mg/L时,SAEW对漫游球菌属、不动杆菌属和嗜冷杆菌属均具有较好的杀菌效果,其中不动杆菌属和嗜冷杆菌属属于变形菌门;而乳球菌属和衣原体属(Chlamydia)相对丰度明显升高。
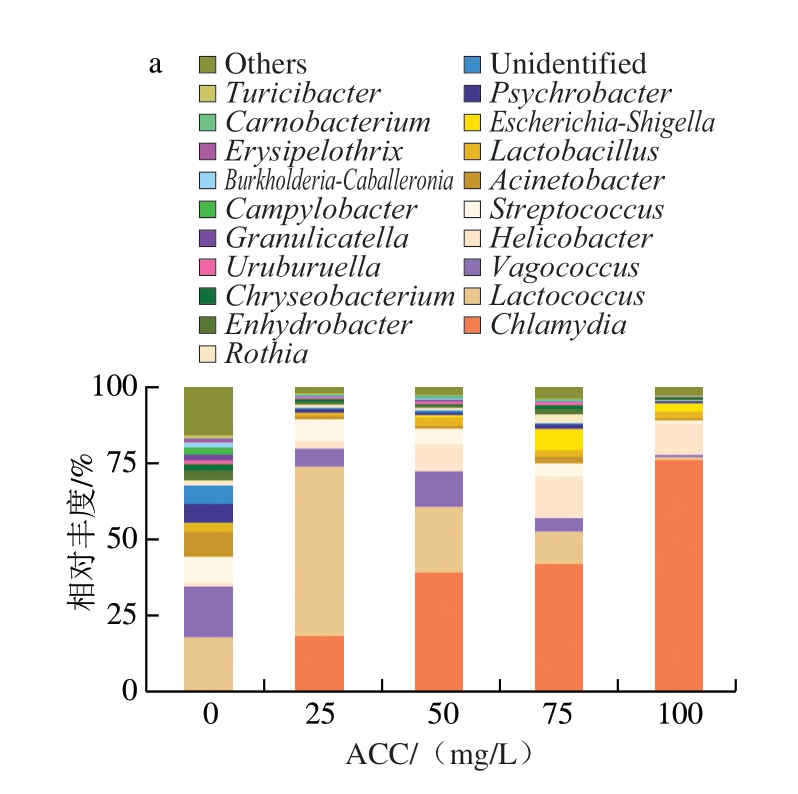
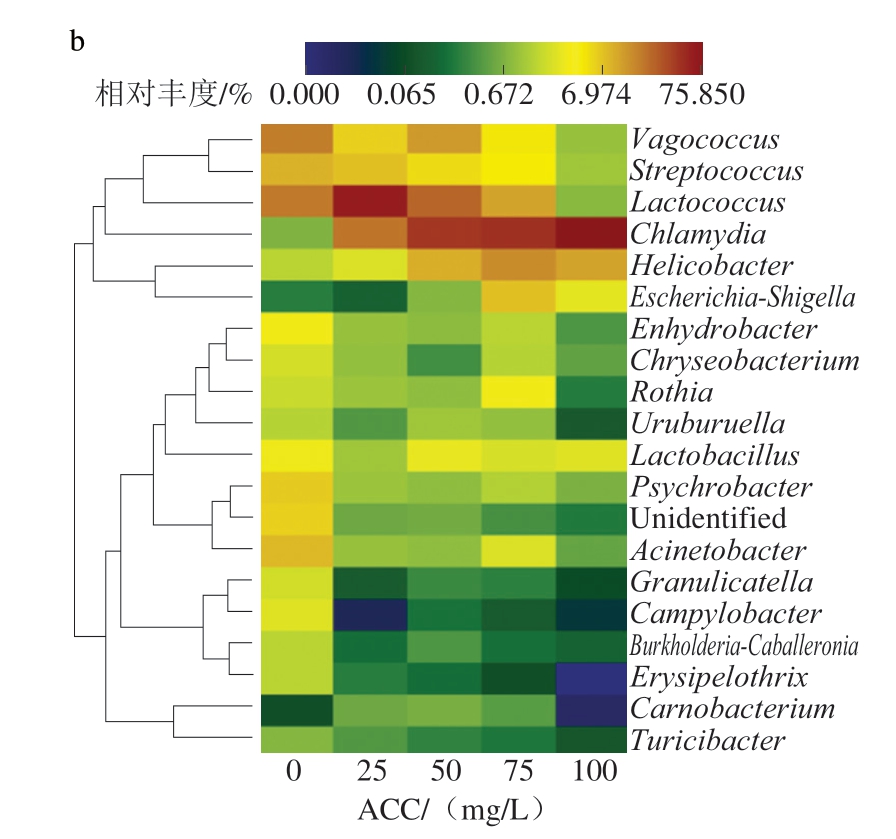
图14 不同ACC SAEW喷雾处理猪小肠菌群属水平相对丰度堆叠柱状图(a)与层级聚类热图(b)
Fig.14 Stacked bar chart (a) and hierarchical clustering heatmap (b) of genus-level distribution of relative abundance of porcine small intestinal flora treated with different available chlorine concentrations from SAEW
当ACC达到50 mg/L后,乳球菌属和链球菌属相对丰度降低,说明此时SAEW能够有效杀灭猪小肠部分优势菌属。ACC达到100 mg/L后,衣原体菌属相对丰度达到75%左右,表明此时SAEW对衣原体菌属的杀灭效果较弱。
本研究首先确定了直接浸泡、超声浸泡和喷雾3 种除菌方式的最佳除菌条件。其中,直接浸泡(ACC 75 mg/L)120 s,减菌率为(99.75±0.06)%,与未经除菌处理相比,肝素效价和废水蛋白质量浓度分别减少1.98 U/mL和4.09 mg/mL;超声浸泡(ACC 50 mg/L、超声功率75 W)120 s,减菌率为(99.77±0.04)%,与未经除菌处理相比,肝素效价和蛋白质量浓度分别减少2.80 U/mL和4.13 mg/mL;喷雾(AAC 75 mg/L、喷雾压力110 MPa)270 s,减菌率为(99.76±0.03)%,与未经除菌处理相比,肝素效价和蛋白质量浓度分别减少0.84 U/mL和0.38 mg/mL。喷雾除菌效果好且对肝素效价和废液蛋白含量影响小,选作猪小肠肝素提取前的除菌方式。
对不同ACC SAEW喷雾处理的猪小肠微生物进行16S rRNA高通量测序分析发现,喷雾处理后猪小肠初始菌群组成改变,其中厚壁菌门(乳球菌属、漫游球菌属、链球菌属)和变形菌门(不动杆菌属、嗜冷杆菌属)相对丰度明显降低,但衣原体属相对丰度明显增加。其中,乳球菌属、链球菌属、不动杆菌属和嗜冷杆菌属中的部分菌种具有致病性,喷雾除菌可有效减少这些细菌对肝素的感染,提高猪小肠肝素安全性。链球菌属、不动杆菌属和嗜冷杆菌属在感染过程中能够分泌蛋白酶,降解宿主组织蛋白,喷雾除菌处理能够有效杀灭这几种细菌,进而有效减少微生物对猪小肠肝素废水中蛋白质的降解。本研究可为SAEW在猪小肠除菌与肝素提取中的应用提供理论基础。
[1] DONG L, ZHONG X, AHMAD H, et al.Intrauterine growth restriction impairs small intestinal mucosal immunity in neonatal piglets[J].Journal of Histochemistry and Cytochemistry, 2014, 62(7):510-518.DOI:10.1369/0022155414532655.
[2] LEE D Y, LEE S Y, KANG H J, et al.Development of effective heparin extraction method from pig by-products and analysis of their bioavailability[J].Journal of Animal Science and Technology, 2020,62(6): 933-947.DOI:10.5187/jast.2020.62.6.933.
[3] 吴晓龙, 王钰堡, 刘容旭, 等.高静压酶解法制备猪小肠肝素及其稳定性研究[J].食品工业科技, 2024, 45(16): 209-219.DOI:10.13386/j.issn1002-0306.2023090028.
[4] SHENG X W, SHU D Q, TANG X J, et al.Effects of slightly acidic electrolyzed water on the microbial quality and shelf life extension of beef during refrigeration[J].Food Science & Nutrition, 2018, 6(7):1975-1981.DOI:10.1002/fsn3.779.
[5] 钟洪亮, 黄欣欣, 刘颖琳, 等.微酸性电解水在肉品及水产品杀菌保鲜中技术研究进展[J].食品与发酵工业, 2023, 49(9): 348-355.DOI:10.13995/j.cnki.11-1802/ts.032795.
[6] 宋欣坤, 庞柳欣, 牛玲玲, 等.微酸性电解水对空肠弯曲菌的杀灭特性及机制[J].食品科学, 2024, 45(8): 29-36.DOI:10.7506/spkx1002-6630-20230619-147.
[7] ZHANG W L, CAO J K, JIANG W B.Application of electrolyzed water in postharvest fruits and vegetables storage: a review[J].Trends in Food Science & Technology, 2021, 114: 599-607.DOI:10.1016/j.tifs.2021.06.005.
[8] 张建中, 王芳, 彭云, 等.微酸性电解水性能及其在消毒领域的应用价值[J].广州化工, 2021, 49(7): 130-133; 163.DOI:10.3969/j.issn.1001-9677.2021.07.043.
[9] 赵莉, 郭艳萍, 党彦学, 等.不同清洗方式对鲜食花生保鲜效果的研究[J].保鲜与加工, 2022, 22(11): 14-19; 28.DOI:10.3969/j.issn.1009-6221.2022.11.003.
[10] 姜晓东, 王颖, 侯富晟, 等.不同预处理方法对虹鳟保鲜品质的影响[J].渔业科学进展, 2024, 45(5): 234-244.DOI:10.19663/j.issn2095-9869.20240527002.
[11] KHADHRAOUI B, UMMAT V, TIWARI B K, et al.Review of ultrasound combinations with hybrid and innovative techniques for extraction and processing of food and natural products[J].Ultrasonics Sonochemistry, 2021, 76: 105625.DOI:10.1016/j.ultsonch.2021.105625.
[12] FENG Y B, SUO K, ZHANG Y, et al.Ultrasound synergistic slightly acidic electrolyzed water treatment of grapes: impacts on microbial loads, wettability, and postharvest storage quality[J].Ultrasonics Sonochemistry, 2024, 103: 106751.DOI:10.1016/j.ultsonch.2023.106751.
[13] BHAKTA B, YAMANE S, BHAKTA J N, et al.Microbial control in greenhouses by spraying slightly acidic electrolyzed water[J].Horticulturae, 2023, 9(1): 81.DOI:10.3390/horticulturae9010081.
[14] 王忠民.猪小肠生产肝素钠新工艺[J].农村经济与科技, 2000(5): 43.
[15] 郭明珠.低分子肝素制备及结构表征研究[D].天津: 天津科技大学,2017: 19-20.
[16] 张立娟, 姜瞻梅, 姚雪琳, 等.双缩脲法检测大豆分离蛋白中蛋白质的研究[J].食品工业科技, 2008, 29(7): 241-242.DOI:10.13386/j.issn1002-0306.2008.07.063.
[17] 唐嘉诚, 包建强, 陈彦婕, 等.大鲵黏液糖蛋白的提取工艺优化及纯化表征[J].食品工业科技, 2022, 43(21): 252-261.DOI:10.13386/j.issn1002-0306.2022030284.
[18] TANTRATIAN S, KAEPHEN K.Shelf-life of shucked oyster in epigallocatechin-3-gallate with slightly acidic electrolyzed water washing under refrigeration temperature[J].LWT-Food Science and Technology, 2020, 118: 108733.DOI:10.1016/j.lwt.2019.108733.
[19] 刘慧.微酸性电解水对草鱼冷藏期间保鲜效果影响的研究[D].哈尔滨: 东北农业大学, 2022: 56.
[20] SOQUETTA M B, TONATO D, QUADROS M M, et al.Ultrasound extraction of bioactive compounds from Citrus reticulata peel using electrolyzed water[J].Journal of Food Processing and Preservation,2019, 43(12): e14236.DOI:10.1111/jfpp.14236.
[21] JO H Y, TANGO C N, OH D H.Influence of different organic materials on chlorine concentration and sanitization of slightly acidic electrolyzed water[J].LWT-Food Science and Technology, 2018, 92:187-194.DOI:10.1016/j.lwt.2018.02.028.
[22] LIU L, LAN W Q, WANG Y B, et al.Antibacterial activity and mechanism of slightly acidic electrolyzed water against Shewanella putrefaciens and Staphylococcus saprophytic[J].Biochemical and Biophysical Research Communications, 2022, 592: 44-50.DOI:10.1016/j.bbrc.2022.01.013.
[23] 王国栋, 杨佳艺, 杨佳, 等.肝素提取纯化技术研究进展[J].食品工业科技, 2012, 33(9): 436-440.DOI:10.13386/j.issn1002-0306.2012.09.028.
[24] 葛庆丰, 丁祺祺, 陈胜, 等.酶解制备猪小肠黏膜蛋白粉工艺条件优化[J].食品工业科技, 2018, 39(7): 192-196; 231.DOI:10.13386/j.issn1002-0306.2018.07.035.
[25] CHANG G H, LIU Y, LUO Z H, et al.Response surface methodology to optimize the sterilization process of slightly acidic electrolyzed water for Chinese shrimp (Fenneropenaeus chinensis) and to investigate its effect on shrimp quality[J].Food Chemistry: X, 2024,21: 101180.DOI:10.1016/j.fochx.2024.101180.
[26] LIU X F, SUN X J, CHEN X Q, et al.Effect of slightly acidic electrolyzed water (SAEW) combined with ultrasound sterilization on quality of Bigeye tuna (Thunnus obesus) during cryogenic storage[J].Journal of Food Composition and Analysis, 2023, 115: 104999.DOI:10.1016/j.jfca.2022.104999.
[27] JIANG Q Y, ZHANG M, XU B G.Application of ultrasonic technology in postharvested fruits and vegetables storage: a review[J].Ultrasonics Sonochemistry, 2020, 69: 105261.DOI:10.1016/j.ultsonch.2020.105261.
[28] GOGATE P R, KABADI A M.A review of applications of cavitation in biochemical engineering/biotechnology[J].Biochemical Engineering Journal, 2009, 44(1): 60-72.DOI:10.1016/j.bej.2008.10.006.
[29] ZHANG C C, XIE J.Ultrasound-assisted slightly acidic electrolyzed water in aquatic product sterilization: a review[J].Foods, 2022, 11(23):3863.DOI:10.3390/foods11233863.
[30] OJHA K S, AZNAR R, O’DONNELL C, et al.Ultrasound technology for the extraction of biologically active molecules from plant, animal and marine sources[J].TrAC-Trends in Analytical Chemistry, 2020,122: 115663.DOI:10.1016/j.trac.2019.115663.
[31] CICHOSKI A J, FLORES D R M, DE MENEZES C R, et al.Ultrasound and slightly acid electrolyzed water application: an efficient combination to reduce the bacterial counts of chicken breast during pre-chilling[J].International Journal of Food Microbiology, 2019, 301:27-33.DOI:10.1016/j.ijfoodmicro.2019.05.004.
[32] LI L L, MU T H, ZHANG M.Contribution of ultrasound and slightly acid electrolytic water combination on inactivating Rhizopus stolonifer in sweet potato[J].Ultrasonics Sonochemistry, 2021, 73: 105528.DOI:10.1016/j.ultsonch.2021.105528.
[33] PAN H, ZHANG X H, NI J B, et al.Effects of ultrasonic power on the structure and rheological properties of skin collagen from albacore(Thunnus alalunga)[J].Marine Drugs, 2024, 22(2): 84.DOI:10.3390/md22020084.
[34] ZHANG L P, SONG D W, MA Z S.Process of heparin extraction using ultrasonic assisted salting out[J].Transactions of the Chinese Society of Agricultural Engineering, 2010, 26(5): 379-384.DOI:10.3969/j.issn.1002-6819.2010.05.065.
[35] LIU C, ZHENG W C, LI Z G, et al.Slightly acidic electrolyzed water as an alternative disinfection technique for hatching eggs[J].Poultry Science, 2022, 101(3): 101643.DOI:10.1016/j.psj.2021.101643.
[36] YUAN X Y, LI Y J, MO Q N, et al.A combined approach using slightly acidic electrolyzed water spraying and chitosan and pectin coating on the quality of the egg cuticle, prevention of bacterial invasion, and extension of shelf life of eggs during storage[J].Food Chemistry, 2022, 389: 133129.DOI:10.1016/j.foodchem.2022.133129.
[37] HADLOCON L S, MANUZON R B, ZHAO L Y.Optimization of ammonia absorption using acid spray wet scrubbers[J].Transactions of the ASABE, 2014, 57(2): 647-659.DOI:10.13031/trans.57.10481.
[38] ZHENG W C, NI L, HUI X, et al.Optimization of slightly acidic electrolyzed water spray for airborne culturable bacteria reduction in animal housing[J].International Journal of Agricultural and Biological Engineering, 2016, 9(4): 185-191.DOI:10.3965/j.ijabe.20160904.2366.
[39] 陈璇.猪小肠黏膜肝素加工废弃物中黏蛋白的提取分离、结构表征及免疫活性评价[D].青岛: 中国海洋大学, 2015: 45-46.
[40] ZHAO W J, WANG Y P, LIU S Y, et al.The dynamic distribution of porcine microbiota across different ages and gastrointestinal tract segments[J].PLoS ONE, 2015, 10(2): e0117441.DOI:10.1371/journal.pone.0117441.
[41] YANG G L, SHI C X, ZHANG S H, et al.Characterization of the bacterial microbiota composition and evolution at different intestinal tract in wild pigs (Sus scrofa ussuricus)[J].PeerJ, 2020, 8: e9124.DOI:10.7717/peerj.9124.
[42] LI C, ZHAO X Y, ZHAO G S, et al.Comparative analysis of structural composition and function of intestinal microbiota between Chinese indigenous laiwu pigs and commercial DLY pigs[J].Veterinary Sciences, 2023, 10(8): 524.DOI:10.3390/vetsci10080524.
[43] CRESPO-PIAZUELO D, ESTELLÉ J, REVILLA M, et al.Characterization of bacterial microbiota compositions along the intestinal tract in pigs and their interactions and functions[J].Scientific Reports, 2018, 8: 12727.DOI:10.1038/s41598-018-30932-6.
[44] GRYAZNOVA M V, DVORETSKAYA Y D, SYROMYATNIKOV M Y, et al.Changes in the microbiome profile in different parts of the intestine in piglets with diarrhea[J].Animals, 2022, 12(3) 320.DOI:10.3390/ani12030320.
[45] 左红, 吴周林, 张佳敏, 等.微酸性电解水处理对兔肉冷藏期间品质及微生物菌群的影响[J].食品与发酵工业, 2024, 50(10): 127-133.DOI:10.13995/j.cnki.11-1802/ts.036381.