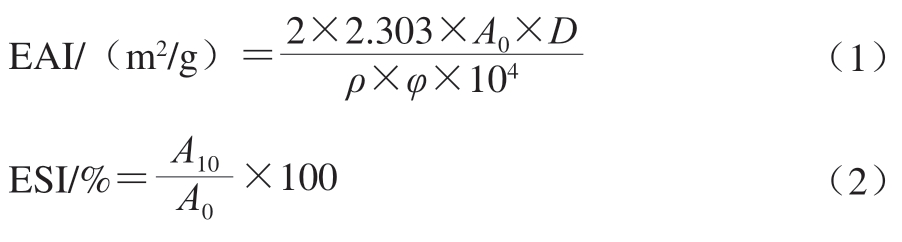
Effects of L-Arginine on Emulsifying Properties of Pork Sarcoplasmic Protein
王昱, 刘宁宁, 王家乐, 等.L-精氨酸对猪肉肌浆蛋白乳化特性的影响[J].肉类研究, 2025, 39(3): 1-7.DOI:10.7506/rlyj1001-8123-20240819-213.http://www.rlyj.net.cn
WANG Yu, LIU Ningning, WANG Jiale, et al.Effects of L-arginine on emulsifying properties of pork sarcoplasmic protein[J].Meat Research, 2025, 39(3): 1-7.DOI:10.7506/rlyj1001-8123-20240819-213.http://www.rlyj.net.cn
肌浆蛋白是一种可溶于水或低离子强度中性盐溶液的蛋白质,占肌肉蛋白总量的30%~35%,包含肌浆酶、肌红蛋白和肌质网蛋白等成分,对肌肉的保水性和色泽等品质具有重要影响[1]。在肉糜加工及畜禽肉冷藏期间,会损失大量肌浆蛋白[2]。为避免肌浆蛋白的资源浪费,有必要进一步挖掘其功能特性,拓展其在食品加工中的应用。乳化性是蛋白质的重要功能特性之一。然而,与肌原纤维蛋白相比,肌浆蛋白的乳化能力较弱[3]。因此,需要寻找有效措施改善肌浆蛋白的乳化性能,以满足其作为食品蛋白质的加工需要。
目前,物理加工技术和化学改性方法已被用于改善肌浆蛋白的乳化特性。例如,李可等[4]研究发现,使用20 kHz、300 W的超声处理类PSE(pale, soft, exudative)鸡肉肌浆蛋白15 min,可使其获得最高的乳化性能;Villamonte等[5]研究发现,超高压处理(200 MPa、6 min、20 ℃)能显著改善肌浆蛋白的乳化稳定性;Hemung等[6]研究表明,经pH值偏移处理后,肌浆蛋白的乳化活性显著提高。然而,以上方法均存在一定局限性。例如,超声波、超高压处理需要严格控制设备参数,且二者本身也会对肌浆蛋白的结构造成一定程度的破坏;pH值偏移处理需要消耗大量的酸碱,进而对环境造成负面影响。
近年来,碱性氨基酸处理作为一种绿色改性方式,对食品蛋白质功能特性的调控作用受到研究人员的广泛关注。L-精氨酸是一种典型碱性氨基酸,可有效改善肉制品的保水、质构、色泽等品质[7]。此外,有研究[8-10]指出,L-精氨酸能提高肌原纤维蛋白、豌豆分离蛋白、大豆分离蛋白等食品蛋白质的乳化活性和乳化稳定性。然而,目前关于L-精氨酸对肌浆蛋白乳化特性的影响鲜见报道。基于以上背景,本研究以猪肉肌浆蛋白为对象,探究L-精氨酸质量分数(0.0%、0.5%、1.0%、1.5%)对其乳化特性的影响规律,同时分析蛋白质界面性质及结构变化,以期揭示L-精氨酸对肌浆蛋白乳化特性的影响机制,为深加工利用肌浆蛋白提供参考。
新鲜猪里脊肉 市购;金龙鱼大豆油 益海嘉里金龙鱼粮油食品有限公司。
L-精氨酸(纯度>99.0%)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、8-苯胺基-1-萘磺酸、Florisil分子筛吸附剂 上海阿拉丁生化科技股份有限公司。
HM740绞肉机 青岛汉尚电器有限公司;CR-GIII高速冷冻离心机 日本日立公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;Lab-1-50冷冻干燥机 北京博医康实验仪器有限公司;Ultra T25高速匀浆机 德国IKA公司;LS13320激光粒度仪美国Beckman公司;Turbiscan光学法稳定性分析仪法国Formulaction公司;FV-31-SD激光共聚焦扫描显微镜 日本Olympus公司;F-7000荧光光度计日本日立有限公司;TRACKER-S全自动界面流变仪法国Teclis公司;Invia激光共聚焦显微拉曼光谱仪英国Renishaw公司;Gel Doc XR+凝胶成像仪 美国Bio-Rad公司。
1.3.1 肌浆蛋白提取
参考Du Feifei等[11]的方法,将新鲜猪里脊肉切成小块,在绞肉机中绞碎。向碎肉中以1∶4(g/mL)比例加入25 mmol/L磷酸盐缓冲液(pH 7.2),使用高速匀浆机10 000 r/min匀浆10 s。混合液随后于4 ℃离心(13 000×g、20 min),取上清液,使用3 层纱布过滤,得到的滤液即为肌浆蛋白。提取的肌浆蛋白于4 ℃保存备用。
1.3.2 L-精氨酸-肌浆蛋白复合体系制备
用25 mmol/L磷酸盐缓冲液(pH 7.2)将肌浆蛋白质量浓度调整至10 mg/mL,再向肌浆蛋白溶液中加入不同质量分数(0.0%、0.5%、1.0%、1.5%)的L-精氨酸(分别命名为LA-0、LA-0.5、LA-1、LA-1.5组),缓慢搅拌至溶解。处理好的蛋白溶液置于4 ℃过夜,使其充分水合。
1.3.3 肌浆蛋白乳液制备
参考李可等[4]的方法,将肌浆蛋白溶液(10 mg/mL)与大豆油以体积比8∶2混合,使用高速匀浆机10 000 r/min剪切2 min,整个剪切过程中,样品始终处于冰水浴中。
1.3.4 乳化活性和乳化稳定性测定
参考李伟伟[12]的方法,肌浆蛋白乳液制备结束后,立即从烧杯底部吸取50 µL乳液与5 mL 1 g/100 mL SDS溶液充分混合,于500 nm波长处测定吸光度(A0)。将上述制得的乳液静置10 min,重复上述操作,于500 nm波长处测定吸光度(A10)。乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)分别按式(1)、(2)计算:
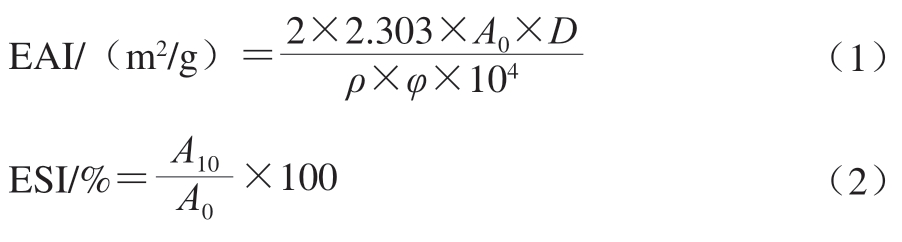
式中:D为样品稀释倍数;ρ为蛋白质量浓度/(g/mL);φ为油相比例(0.2);2.303为换算系数。
1.3.5 乳液粒径测定
参考Tao Ye等[13]的方法,采用静态光散射法测定,仪器参数设置为:分散相折光率1.330;颗粒折射率1.436;泵转速2 000 r/min;吸收系数0.001。
1.3.6 乳液Turbiscan稳定性指数(Turbiscan stability index,TSI)测定
参考Hu Li等[14]的方法,将20 mL新鲜肌浆蛋白乳液置于专用样品瓶中,使用光学法稳定性分析仪测定。测试条件:连续扫描时间3 600 s,每60 s扫描1 次。TSI通过仪器自带的软件获得。
1.3.7 乳液液滴微观结构观察
参考Li Jiao等[15]的方法,取1 mL新鲜肌浆蛋白乳液与20 µL尼罗红荧光染色剂(2 mg/mL)充分混合,避光染色30 min,然后使用激光共聚焦扫描显微镜观察肌浆蛋白乳液液滴微观结构。仪器参数:激发波长488 nm,发射波长600~700 nm,目镜10 倍,物镜20 倍。每组样品选取代表性区域进行拍照。
1.3.8 油相纯化
肌浆蛋白油-水界面压力测试前,需要对大豆油进行纯化,以避免大豆油中存在的少量表面活性成分对实验造成干扰。将大豆油与Florisil分子筛吸附剂充分混合后,将混合物5 000×g离心20 min,收集混合物的上层清液以测定界面张力,重复上述步骤,直至油的界面张力稳定。
1.3.9 肌浆蛋白油-水界面压力测定
参考Li Linxian等[16]的方法,在室温条件下,将经过纯化的大豆油转移到石英槽中,使用1 mL注射器吸取蛋白质溶液,并确保排除气泡。调整注射器针头的位置,使其位于油相的中央。通过软件自动控制,在注射器针尖处形成一个微小的蛋白质液滴,设定液滴体积为15 µL。等待一段时间以达到平衡状态,并记录液滴形状变化,检测时间为3 600 s。通过Young-Laplace方程计算界面张力。界面压力(π)按式(3)计算:
式中:σ0为磷酸盐缓冲液的界面张力/(mN/m);σ为t时刻蛋白质溶液的界面张力/(mN/m)。
1.3.10 表面疏水性测定
参考任中阳等[17]的方法,将肌浆蛋白溶液稀释为一系列质量浓度梯度(0.125、0.250、0.500、0.750、1.000 mg/mL)。向4 mL肌浆蛋白样品中加入20 μL 10 mmol/L 8-苯胺基-1-萘磺酸溶液(pH 7.0),涡旋,于暗处反应20 min。然后使用荧光光度计测定荧光强度,激发波长374 nm,发射波长485 nm,以蛋白质量浓度(mg/mL)为横坐标,以荧光强度为纵坐标作图,通过计算直线斜率得到蛋白质分子的表面疏水性。
1.3.11 紫外吸收光谱测定
参考Wang Yu等[18]的方法,将肌浆蛋白溶液稀释至0.5 mg/mL,使用紫外-可见分光光度计采集紫外吸收光谱。在220~400 nm波长范围进行光谱扫描,并以0.2 nm的间隔进行数据采集。对所得的紫外吸收光谱进行二阶求导处理,得到相应的紫外二阶导数光谱。
1.3.12 二级结构测定
参考Wang Yu等[19]的方法,使用拉曼光谱仪分析肌浆蛋白二级结构变化。测试参数:物镜50 倍,激发波长785 nm,光谱采集范围400~3 600 cm-1,扫描5 次,曝光时间20 s。通过定量分析酰胺I带(1 600~1 700 cm-1)结果,获得蛋白质二级结构的相对含量。
1.3.13 SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)
参考陈腊梅等[20]的方法稍作修改,将肌浆蛋白溶液稀释至1 mg/mL,以体积比1∶1与上样缓冲液混合,沸水浴5 min。电泳条件:浓缩胶5%;分离胶10%;上样量10 µL;先以80 V恒压电泳,待样品进入分离胶后,再以120 V恒压电泳。电泳结束后,使用考马斯亮蓝R-250染色,在摇床上脱色至背景清晰,使用凝胶成像仪拍照。
除特殊说明外,所有实验均重复3 次,结果表示为平均值±标准差。使用OriginPro 2021软件作图,采用SPSS v.21.0软件对数据进行单因素方差分析,采用Duncan’s多重比较法进行差异显著性分析,P<0.05表示差异显著。
EAI和ESI可用于评估蛋白质的乳化特性,EAI反映蛋白质吸附到油滴表面的能力,而ESI则反映蛋白质乳液抵抗相分离的能力,与乳液的连续相和分散相相关[21]。如图1所示,LA-0组的EAI和ESI最低,分别为8.13 m2/g和2 6.0 6%。与未添加L-精氨酸组相比,添加0.5%L-精氨酸对肌浆蛋白的EAI无显著影响,但显著提高了ESI(P<0.05);随着L-精氨酸质量分数增至1.0%~1.5%,肌浆蛋白的EAI和ESI均显著提高(P<0.05),表明添加适宜质量分数(≥1.0%)的L-精氨酸可有效改善肌浆蛋白的乳化特性。可能的原因是:一方面,L-精氨酸能增强蛋白质分子间的静电排斥作用,抑制蛋白质的聚集[22];另一方面,L-精氨酸可吸附到油滴表面,起到稳定油-水界面的作用[23]。
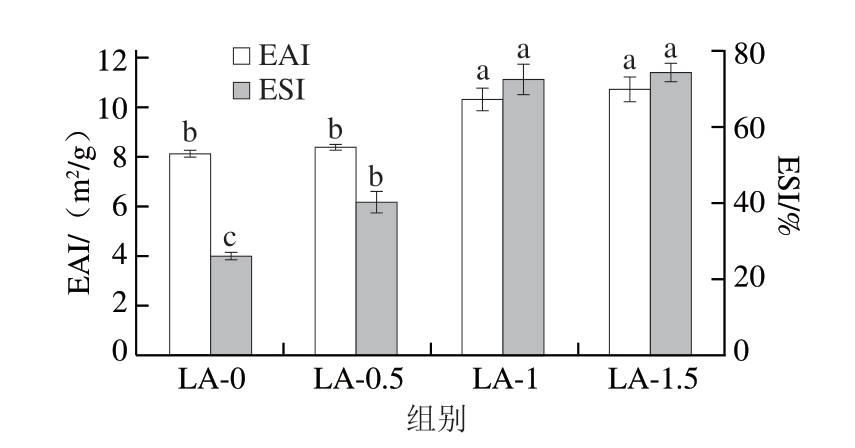
图1 L-精氨酸对肌浆蛋白EAI和ESI的影响
Fig.1 Effects of L-arginine on the emulsifying activity index and emulsifying stability index of sarcoplasmic protein
小写字母不同表示差异显著(P<0.05)。图6同。
乳液粒径能反映液滴的聚集程度,是决定乳液稳定性的一个重要指标[24]。如图2所示,对照组的粒径呈多峰分布,主峰位于47.94 µm处。与未添加L-精氨酸相比,添加0.5%、1.0%和1.5% L-精氨酸使肌浆蛋白乳液粒径主峰位置分别移至43.67、43.67、39.78 µm处。如表1所示,添加L-精氨酸可显著降低肌浆蛋白的乳液粒径(P<0.05),与未处理组相比,LA-1.5组的D4,3、D10、D50和D90分别降低19.16%、42.80%、18.03%和15.22%。乳液粒径的结果表明,L-精氨酸能有效减小肌浆蛋白乳液的粒径,降低液滴粒子的聚集程度。乳液液滴尺寸的减小有利于蛋白质在油-水界面上的吸附,阻止液滴的相分离、絮凝和团聚[25],进而提高乳液稳定性。
表1 L-精氨酸对肌浆蛋白乳液粒径的影响
Table 1 Effect of L-arginine on the particle size of sarcoplasmic protein-stabilized emulsionsµm

注:同列小写字母不同表示差异显著(P<0.05)。
组别D4,3D10D50D90 LA-038.12±0.08a 11.73±0.15b 37.98±0.08a 63.04±0.04a LA-0.534.81±0.09b 12.05±0.12a 35.29±0.07b 56.28±0.06c LA-132.64±0.12c8.43±0.01c31.65±0.04c 57.84±0.33b LA-1.530.82±0.01d6.71±0.06d31.13±0.01d 53.45±0.08d
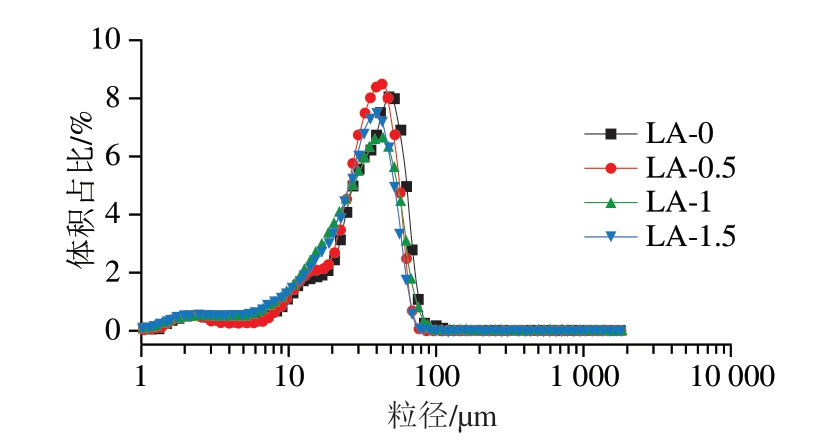
图2 含L-精氨酸的肌浆蛋白乳液粒径分布图
Fig.2 Particle distribution of sarcoplasmic protein-stabilized emulsions with added L-arginine
乳液的物理稳定性可通过TSI进行判定。一般来说,较低的TSI代表系统更稳定[26]。如图3所示,在扫描时间范围(0~3 600 s)内,LA-0组的TSI最高,说明未处理组乳液的物理稳定性最低。与LA-0组相比,LA-0.5、LA-1及LA-1.5组的TSI呈现减小的趋势,各组TSI的扫描终点值由大到小依次为LA-0>LA-0.5>LA-1>LA-1.5。因此,L-精氨酸可有效改善肌浆蛋白乳液的物理稳定性,并且这种改善作用随着L-精氨酸添加量的升高而增强,这与ESI的结果一致。L-精氨酸可促进蛋白质的解折叠,增加疏水基团的暴露,有利于蛋白质向油-水界面的扩散、吸附和定向重排,以此提高乳液的物理稳定性[27]。
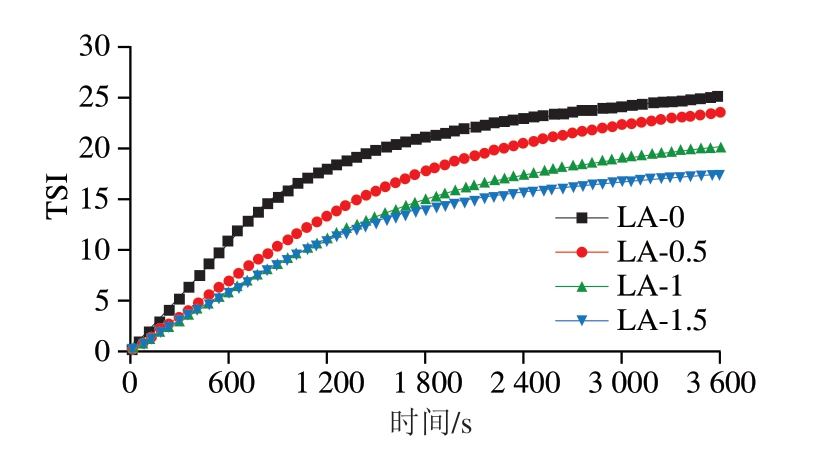
图3 L-精氨酸对肌浆蛋白乳液TSI的影响
Fig.3 Effects of L-arginine on the TSI of sarcoplasmic proteinstabilized emulsions
如图4所示,LA-0组乳液液滴尺寸较大,分布较不均匀,这容易导致液滴的聚集,形成尺寸更大的粒子,使乳液稳定性降低。与LA-0组相比,LA-0.5组乳液液滴尺寸有所减小,但部分液滴仍然存在絮凝现象;LA-1和LA-1.5组乳液液滴尺寸明显减小,分布更加均匀,这与乳液粒径的变化情况一致。Zhu Xiaoxu等[8]在研究L-精氨酸对肌原纤维蛋白乳液微观结构的影响时发现了类似的现象,L-精氨酸可促进蛋白质在油滴表面的吸附,能够更有效地提供空间位阻,进而抑制液滴的聚集。

图4 不同L-精氨酸添加量的肌浆蛋白乳液共聚焦激光扫描显微镜图
Fig.4 Confocal laser scanning microscopic images of sarcoplasmic protein-stabilized emulsions with added L-arginine
π值变化能反映蛋白质在油滴表面的吸附行为,是影响乳化性质的一个重要因素[13]。如图5所示,各组肌浆蛋白的π-时间曲线呈现相似的阶段性变化特征:首先是吸附初始阶段,π值无明显变化;随后是接近界面饱和阶段,π值急剧增加;最后是π值缓慢增加阶段。π值的增加与蛋白质从体相向油滴表面的扩散、吸附、定向和结构重排等有关[16]。在吸附阶段,LA-0.5、LA-1及LA-1.5组的π值始终高于LA-0组,表明L-精氨酸能增加肌浆蛋白油-水界面张力。蛋白质的分子柔性和表面疏水性是蛋白质向油滴表面吸附的主要影响因素[28]。L-精氨酸能促进蛋白质的去折叠,提高表面疏水性,从而有利于增强疏水氨基酸侧链残基与油滴的相互作用,最终增加肌浆蛋白的油-水界面张力[8-9]。界面压力的测定结果表明,L-精氨酸可促进肌浆蛋白向油滴表面迁移,提高蛋白质在油-水界面的吸附能力。
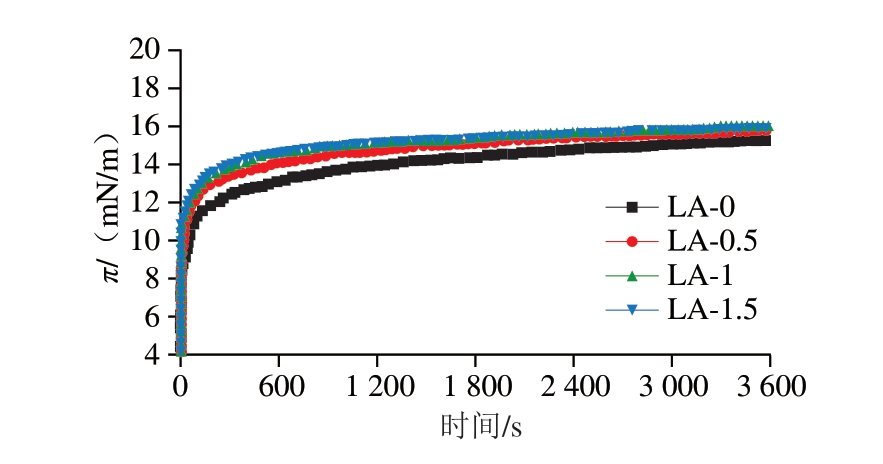
图5 L-精氨酸对肌浆蛋白油-水界面压力的影响
Fig.5 Effect of L-arginine on the oil-water π of sarcoplasmic protein-stabilized emulsions
蛋白质的疏水基团在乳化过程中起到关键作用,表面疏水性的变化能反映蛋白质疏水基团的暴露情况,与乳液的物理稳定性有密切联系[29]。如图6所示,随着L-精氨酸质量分数从0%增至1.5%,肌浆蛋白的表面疏水性依次显著增加(P<0.05)。与LA-0组相比,LA-0.5、LA-1和LA-1.5组的表面疏水性分别增加33.62%、44.66%和70.42%。表面疏水性的结果表明,L-精氨酸的加入能引起肌浆蛋白的去折叠,促使原先埋藏在蛋白质内部的疏水基团暴露到极性溶剂环境中,并且这种效应随着L-精氨酸质量分数的升高而增强。类似地,一些学者发现L-精氨酸能增加藜麦蛋白[30]、大豆分离蛋白[31]的表面疏水性。L-精氨酸能与蛋白质的带电氨基酸残基产生静电相互作用,进而破坏维持蛋白质构象稳定的分子内和分子间离子键,导致蛋白质结构的变化并促进疏水基团的暴露[32]。表面疏水性的增加有助于促进蛋白质在油滴表面的吸附,并减少油-水界面的能垒,从而提高乳化活性和乳化稳定性[9]。肌浆蛋白表面疏水性的结果与乳液EAI和ESI(图1)的变化趋势相一致。
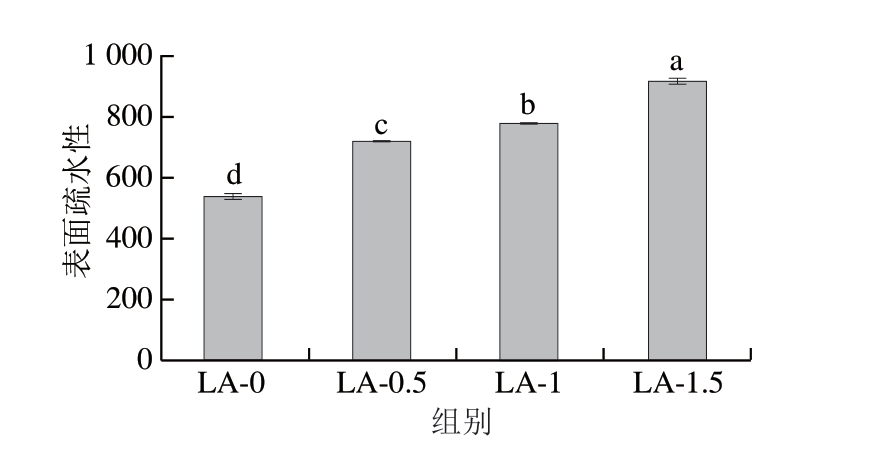
图6 L-精氨酸对肌浆蛋白表面疏水性的影响
Fig.6 Effect of L-arginine on the surface hydrophobicity of sarcoplasmic protein
紫外吸收光谱可用于监测蛋白质发色团(芳香族氨基酸侧链)的微环境变化,进而反映蛋白质的构象变化。如图7A所示,各组肌浆蛋白在270 nm左右出现紫外吸收峰,主要是肽键上的色氨酸和酪氨酸等芳香杂环化合物π-π*跃迁所致[33]。由于紫外吸收光谱存在多种芳香族氨基酸吸收峰信号叠加现象,因此难以获得吸收峰反映的准确信息,而紫外二阶导数光谱能减少芳香族氨基酸残基造成的谱图叠加现象的干扰,从而得到有效的特征性芳香族氨基酸的微环境信息。如图7B所示,各组肌浆蛋白在280~300 nm波长范围内呈现2 个明显的正吸收峰,分别位于288、297 nm附近,并且有2 个明显的负吸收峰,分别位于283、291 nm附近。其中,288 nm处的吸收峰是酪氨酸残基和色氨酸残基共同作用的结果,而297 nm处的吸收峰仅来自色氨酸残基的贡献。与LA-0组相比,添加L-精氨酸使色氨酸残基吸收峰发生不同程度的蓝移(向短波方向移动),其中LA-1.5组的蓝移程度最高,表明色氨酸残基由非极性环境向极性环境的暴露[34]。通过分析正、负吸收峰峰谷和峰顶之间距离之比(r),能够评估酪氨酸微环境变化。与LA-0组相比,LA-0.5、LA-1、LA-1.5组的r由0.37分别增至0.38、0.39和0.42,说明L-精氨酸的加入使肌浆蛋白中酪氨酸的微环境更加亲水[34],并且这种效应随着L-精氨酸含量的升高而增强。紫外二阶导数光谱和表面疏水性的结果共同表明,L-精氨酸能引起肌浆蛋白三级结构的变化,促进疏水基团的暴露。
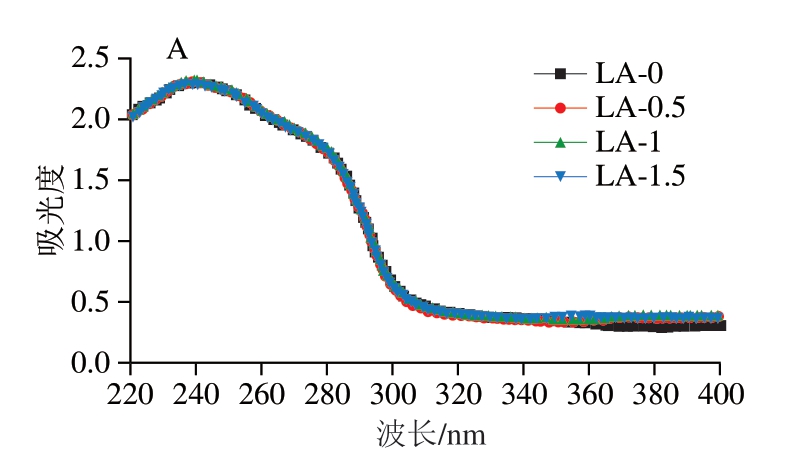
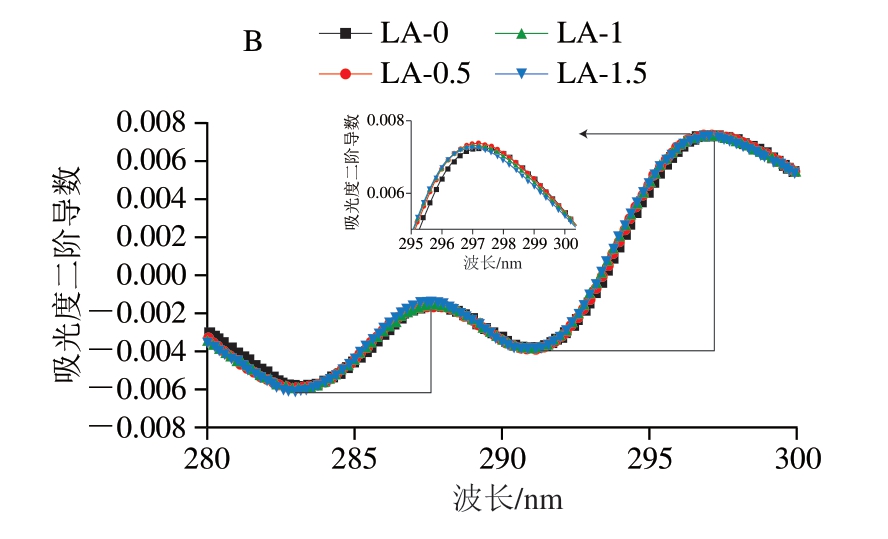
图7 肌浆蛋白紫外吸收光谱(A)及紫外二阶导数光谱(B)图
Fig.7 UV absorption spectrum (A) and second derivative spectrum (B) of sarcoplasmic protein in the absence and presence of L-arginine
拉曼光谱中的酰胺I带(1 600~1 700 cm-1)可提供蛋白质二级结构的信息,该区域谱带的振动峰主要是由肽键C=O的面内伸缩振动、C—N伸缩振动、C—C—N弯曲振动和N—H平面内弯曲振动引起的。如图8所示,与LA-0组相比,LA-0.5组的4 种二级结构相对含量无明显变化;LA-1和LA-1.5组的α-螺旋相对含量明显下降,β-转角相对含量明显升高,而β-折叠和无规卷曲的相对含量均无明显变化。拉曼光谱的结果表明,L-精氨酸(质量分数≥1%)可促进肌浆蛋白α-螺旋向β-转角的转变。Cao Yungang等[9]在研究L-精氨酸对豌豆分离蛋白二级结构影响时发现了类似的现象,说明适宜添加量的L-精氨酸能促进蛋白质二级结构的展开,增加蛋白质的分子柔性。肌浆蛋白分子间和分子内的静态平衡有助于维持蛋白质二级结构的稳定性,L-精氨酸的正电荷能与谷氨酸和天冬氨酸上带负电的羧基(COO-)形成离子键,这可能破坏了肌浆蛋白原有的静态平衡,进而导致二级结构的变化[8-9,16]。
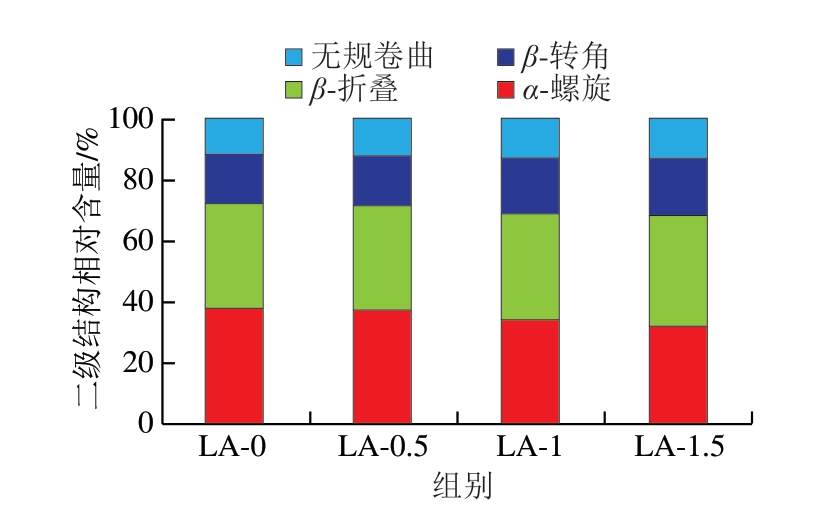
图8 L-精氨酸对肌浆蛋白二级结构相对含量的影响
Fig.8 Effect of L-arginine on the relative content of secondary structure of sarcoplasmic protein
如图9 所示,肌浆蛋白的主要电泳条带分布在15~100 kDa之间,这与Wang Tianze等[35]报道的肌浆蛋白电泳结果一致。肌浆蛋白是一种复杂的水溶性蛋白质,包含多种与糖酵解途径有关的酶类和肌红蛋白。各组样品均出现肌浆蛋白的特征条带,包括糖原磷酸化酶b、丙酮酸激酶、肌酸激酶、醛缩酶、磷酸甘油醛脱氢酶、乳酸脱氢酶A链、磷酸甘油酸变位酶、磷酸丙糖异构酶、谷胱甘肽S-转移酶、肌红蛋白。与未添加L-精氨酸的肌浆蛋白相比,添加L-精氨酸并未明显改变肌浆蛋白主要电泳条带的种类和含量,表明L-精氨酸不改变肌浆蛋白的基本组成。
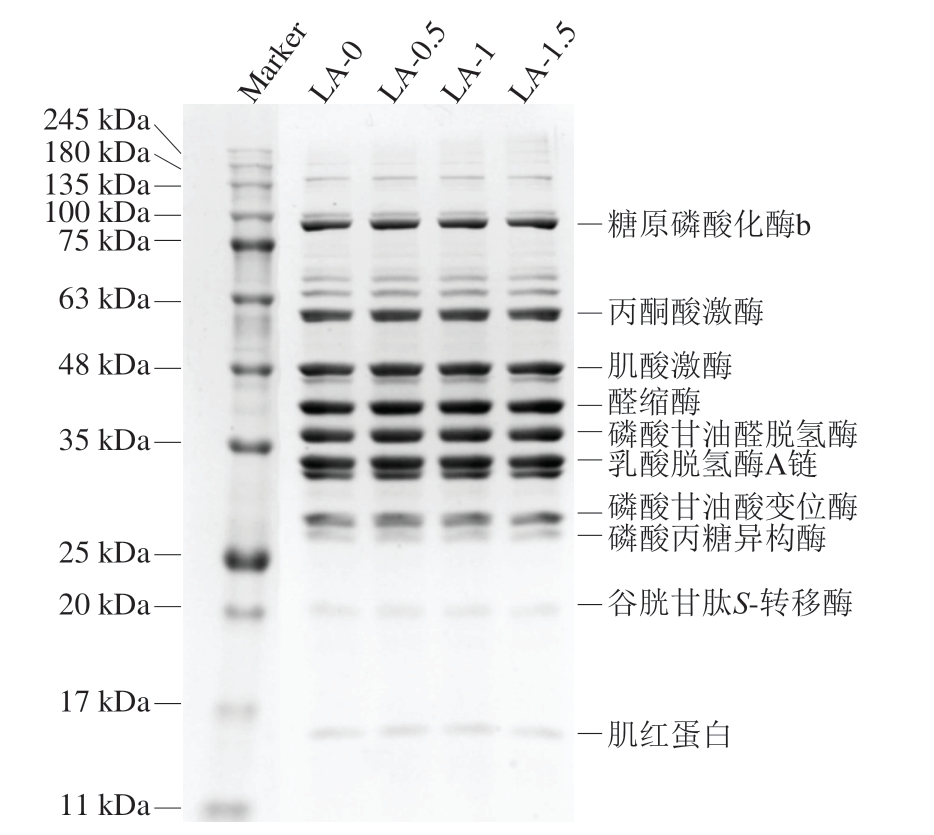
图9 肌浆蛋白SDS-PAGE图
Fig.9 The SDS-PAGE pattern of sarcoplasmic protein
在实验考察的L-精氨酸添加量范围内,质量分数0.5%的L-精氨酸对肌浆蛋白的EAI无显著影响,但显著提高了ESI(P<0.05)。随着L-精氨酸质量分数的升高(1.0%~1.5%),肌浆蛋白的EAI和ESI均显著增加(P<0.05)。L-精氨酸可减小肌浆蛋白乳液液滴的粒径,增加蛋白质的油-水界面压力,引起蛋白质二、三级结构的变化,由此促进肌浆蛋白向油滴表面的吸附,显著提高乳化性能。本研究表明,适宜添加量(质量分数≥1%)的L-精氨酸处理是改善肌浆蛋白乳化性能的有效策略,研究结果可以为新型高品质肉蛋白乳化剂的研发提供技术支持。
[1] MARCOS B, KERRY J P, MULLEN A M.High pressure induced changes on sarcoplasmic protein fraction and quality indicators[J].Meat Science, 2010, 85(1): 115-120.DOI:10.1016/j.meatsci.2009.12.014.
[2] 杜菲菲.肌浆蛋白与黄原胶的相互作用及稳定乳液效果研究[D].南京:南京农业大学, 2019: 1.DOI:10.27244/d.cnki.gnjnu.2019.002069.
[3] LI C L, PENG A, HE L C, et al.Emulsifying properties development of pork myofibrillar and sacroplasmic protein irradiated at different dose: a combined FT-IR spectroscopy and low-field NMR study[J].Food Chemistry, 2018, 252: 108-114.DOI:10.1016/j.foodchem.2018.01.104.
[4] 李可, 孙立雪, 王琳梦, 等.超声波处理对类PSE鸡肉肌浆蛋白的结构性质和乳化性能影响[J].食品科学, 2024, 45(12): 220-228.DOI:10.7506/spkx1002-6630-20231003-008.
[5] VILLAMONTE G, POTTIER L, DE LAMBALLERIE M.Influence of high-pressure processing on the physicochemical and the emulsifying properties of sarcoplasmic proteins from Hake (Merluccius merluccius)[J].European Food Research and Technology, 2016, 242(5): 667-675.DOI:10.1007/s00217-015-2574-z.
[6] HEMUNG B O, BENJAKUL S, YONGSAWATDIGUL J.pHdependent characteristics of gel-like emulsion stabilized by threadfin bream sarcoplasmic proteins[J].Food Hydrocolloids, 2013, 30(1):315-322.DOI:10.1016/j.foodhyd.2012.05.023.
[7] 张道静, 周存六.L-精氨酸和L-赖氨酸在肉及肉制品中的应用研究进展[J].肉类研究, 2020, 34(6): 96-102.DOI:10.7506/rlyj1001-8123-20200422-098.
[8] ZHU X X, LI L X, LI S Y, et al. L-Arginine/L-lysine improves emulsion stability of chicken sausage by increasing electrostatic repulsion of emulsion droplet and decreasing the interfacial tension of soybean oil-water[J].Food Hydrocolloids, 2019, 89: 492-502.DOI:10.1016/j.foodhyd.2018.11.021.
[9] CAO Y G, LI Z R, FAN X, et al.Multifaceted functionality of L-arginine in modulating the emulsifying properties of pea protein isolate and the oxidation stability of its emulsions[J].Food & Function,2022, 13(3): 1336-1347.DOI:10.1039/d1fo03372g.
[10] KANO H, SHIRAKI K.Heat treatment in the presence of arginine increases the emulsifying properties of soy proteins[J].Food Chemistry: X, 2023, 17: 100567.DOI:10.1016/j.fochx.2023.100567.
[11] DU F F, QI Y, HUANG H B, et al.Stabilization of O/W emulsions via interfacial protein concentrating induced by thermodynamic incompatibility between sarcoplasmic proteins and xanthan gum[J].Food Hydrocolloids, 2022, 124: 107242.DOI:10.1016/j.foodhyd.2021.107242.
[12] 李伟伟.高乳化性大豆蛋白的制备及其界面流变性质的研究[D].无锡: 江南大学, 2017: 15.
[13] TAO Y, CAI J M, WANG P, et al.Exploring the relationship between the interfacial properties and emulsion properties of ultrasoundassisted cross-linked myofibrillar protein[J].Food Hydrocolloids,2024, 146: 109287.DOI:10.1016/j.foodhyd.2023.109287.
[14] HU L, SHI L S, LIU S N, et al.Regulation mechanism of curcuminloaded oil on the emulsification and gelation properties of myofibrillar protein: emphasizing the dose-response of curcumin[J].Food Chemistry, 2023, 428: 136687.DOI:10.1016/j.foodchem.2023.136687.
[15] LI J, DAI Z C, CHEN Z H, et al.Improved gelling and emulsifying properties of myofibrillar protein from frozen shrimp (Litopenaeus vannamei) by high-intensity ultrasound[J].Food Hydrocolloids, 2023,135: 108188.DOI:10.1016/j.foodhyd.2022.108188.
[16] LI L X, CHEN L, NING C, et al.L-Arginine and L-lysine improve the physical stability of soybean oil-myosin emulsions by changing penetration and unfolding behaviors of interfacial myosin[J].Food Hydrocolloids, 2020, 98: 105265.DOI:10.1016/j.foodhyd.2019.105265.
[17] 任中阳, 龙斯宇, 康宁哲, 等.鲢鱼糜漂洗液中不同回收方式肌浆蛋白的结构和功能特性[J].食品科学, 2024, 45(7): 225-232.DOI:10.7506/spkx1002-6630-20230728-304.
[18] WANG Y, ZHOU Y, WANG X X, et al.Origin of high-pressure induced changes in the properties of reduced-sodium chicken myofibrillar protein gels containing CaCl2: physicochemical and molecular modification perspectives[J].Food Chemistry, 2020, 319:126535.DOI:10.1016/j.foodchem.2020.126535.
[19] WANG Y, YUAN J J, LI K, et al.Evaluation of chickpea protein isolate as a partial replacement for phosphate in pork meat batters: techno-functional properties and molecular characteristic modifications[J].Food Chemistry, 2023, 404: 134585.DOI:10.1016/j.foodchem.2022.134585.
[20] 陈腊梅, 唐善虎, 李思宁, 等.丙二醛氧化对牦牛肉肌原纤维蛋白结构及功能特性的影响[J].食品科学, 2023, 44(8): 46-54.DOI:10.7506/spkx1002-6630-20220627-299.
[21] ZOU H N, ZHAO N, SUN S, et al.High-intensity ultrasonication treatment improved physicochemical and functional properties of mussel sarcoplasmic proteins and enhanced the stability of oilin-water emulsion[J].Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2020, 589: 124463.DOI:10.1016/j.colsurfa.2020.124463.
[22] LI R, FAN X K, GAO X, et al.Injection of L-arginine or L-lysine before freezing delays the emulsifying and gelling properties deterioration of myofibrillar proteins of frozen porcine longissimus lumborum muscle[J].Food Chemistry, 2023, 427: 136736.DOI:10.1016/j.foodchem.2023.136736.
[23] 曹云刚, 梁光灿, 张鑫, 等.碱性氨基酸调控肌原纤维蛋白加工性能及肉品品质研究进展[J].食品科学, 2022, 43(21): 341-348.DOI:10.7506/spkx1002-6630-20210821-284.
[24] RAJASEKARAN B, SINGH A, PONNUSAMY A, et al.Ultrasound treated fish myofibrillar protein: physicochemical properties and its stabilizing effect on shrimp oil-in-water emulsion[J].Ultrasonics Sonochemistry, 2023, 98: 106513.DOI:10.1016/j.ultsonch.2023.106513.
[25] DENG X H, NI X X, HAN J H, et al.High-intensity ultrasound modified the functional properties of Neosalanx taihuensis myofibrillar protein and improved its emulsion stability[J].Ultrasonics Sonochemistry, 2023, 97: 106458.DOI:10.1016/j.ultsonch.2023.106458.
[26] BADAR I H, WANG Z Y, SUN F D, et al.Influence of varying oil phase volume fractions on the characteristics of flaxseed-derived diglyceride-based Pickering emulsions stabilized by modified soy protein isolate[J].Food Research International, 2024, 175: 113812.DOI:10.1016/j.foodres.2023.113812.
[27] ZHU B, YANG J J, DOU J J, et al.Comparison of the physical stability, microstructure and protein-lipid co-oxidation of O/W emulsions stabilized by L-arginine/L-lysine-modified soy protein hydrolysate[J].Food Chemistry, 2024, 447: 138901.DOI:10.1016/j.foodchem.2024.138901.
[28] SHI T, LIU H, SONG T, et al.Use of L-arginine-assisted ultrasonic treatment to change the molecular and interfacial characteristics of fish myosin and enhance the physical stability of the emulsion[J].Food Chemistry, 2021, 342: 128314.DOI:10.1016/j.foodchem.2020.128314.
[29] ZHANG G Y, BI X X, WANG R R, et al.Effects of catechin on the stability of myofibrillar protein-soybean oil emulsion and the adsorbed properties of myosin at the oil-water interface[J].Food Chemistry,2024, 442: 138478.DOI:10.1016/j.foodchem.2024.138478.
[30] CAO H W, WANG X X, RUAN Y X, et al.Alkaline amino acids present unique aggregation behavior for quinoa protein gelation under microwave irradiation[J].Food Hydrocolloids, 2023, 144: 108951.DOI:10.1016/j.foodhyd.2023.108951.
[31] LI J, YE S X, WEND-SOO ZONGO A, et al.Basic amino acids treatment prior to spray drying improved the functional properties and flavor attributes of soy protein isolate[J].LWT-Food Science and Technology, 2023, 188: 115447.DOI:10.1016/j.lwt.2023.115447.
[32] LI S Y, LI L X, ZHU X X, et al.Conformational and charge changes induced by L-arginine and L-lysine increase the solubility of chicken myosin[J].Food Hydrocolloids, 2019, 89: 330-336.DOI:10.1016/j.foodhyd.2018.10.059.
[33] WANG K Q, LUO S Z, ZHONG X Y, et al.Changes in chemical interactions and protein conformation during heat-induced wheat gluten gel formation[J].Food Chemistry, 2017, 214: 393-399.DOI:10.1016/j.foodchem.2016.07.037.
[34] WANG Y, ZHOU Y, LI P J, et al.Combined effect of CaCl2 and high pressure processing on the solubility of chicken breast myofibrillar proteins under sodium-reduced conditions[J].Food Chemistry, 2018,269: 236-243.DOI:10.1016/j.foodchem.2018.06.107.
[35] WANG T Z, HAN D, ZHAO L Y, et al.Binding of selected aroma compounds to myofibrillar protein, sarcoplasmic protein, and collagen during thermal treatment: role of conformational changes and degradation of proteins[J].Journal of Agricultural and Food Chemistry,2023, 71(46): 17860-17873.DOI:10.1021/acs.jafc.3c02618.