宰后成熟是提升牛肉嫩度、风味和多汁性的有效途径,常用的牛肉成熟方式分为湿式成熟和干式成熟。湿式成熟是将牛肉真空包装后置于低温条件下进行成熟,而干式成熟是将未经包装的胴体二分体、四分体或分割肉等直接置于严格控制温度、相对湿度和风速的环境中进行成熟。与湿式成熟牛肉(风味以血腥味和金属味为主)相比,干式成熟牛肉因具有坚果味、烧烤味等特征香气及鲜味[1-2],更为部分消费者所青睐[3-4]。但同时,由于成熟过程中牛肉直接暴露于生产环境且生产周期较长(至少14 d以上),干式成熟牛肉的微生物状况需要被特别关注。已有较多学者对不同生产条件下干式成熟牛肉的微生物状况和微生物作用进行了研究,但目前缺乏对已有研究结果的专题综述。
本文通过在中国知网(China National Knowledge Infrastructure,CNKI)和Web of Science 2 个文献数据库对干式成熟相关文献进行检索,在CNKI 中以“干式成熟”“干法成熟”为关键词进行主题检索,在Web of Science核心合集中以“Dry-aging”“Dry aging”“Beef”为关键词进行主题检索(以SCIE(science citation index expanded)为过滤条件),检索年限为1995—2025年,共检索到中文文献19 篇、英文文献293 篇。本文综合相关研究,总结干式成熟牛肉中微生物数量及常见类型,分析影响干式成熟牛肉中微生物状况的主要因素,阐述微生物对干式成熟牛肉特征品质形成的影响及干式成熟牛肉的微生物安全性及防治措施,以期为干式成熟牛肉中的微生物资源挖掘和微生物安全控制提供参考。
1 干式成熟牛肉中微生物数量及常见类型
在干式成熟过程中,牛肉表面的水分蒸发形成一层硬壳。由于表面硬壳中水分活度降低,且富含蛋白质和脂肪等营养物质,同时空气流动提供了充足的氧气,这一环境为酵母菌和霉菌的生长繁殖创造了有利条件。表面的微生物可能通过产生胞外酶或其他代谢物渗透入组织内部,甚至微生物可能通过迁移进入内部,进而影响牛肉内部的品质变化。因此,目前许多学者对干式成熟牛肉表面硬壳与修剪后牛肉的微生物状况进行了研究。
1.1 干式成熟牛肉中的常见微生物种类
干式成熟牛肉中的常见微生物如表1所示,不同研究报道的微生物种类存在一定差异,但总体而言,常见的细菌属包括假单胞菌属(Pseudomonas)、乳杆菌属(Lactobacillus)和索丝菌属(Brochothrix)等;常见的酵母菌属包括德巴利酵母属(Debaryomyces)、假丝酵母属(Candida)和木拉克属(Mrakia)等;常见的霉菌属包括青霉菌属(Penicillium)、毛霉菌属(Mucor)、卷梗霉属(Helicostylum)和枝孢菌属(Cladosporium)等。假单胞菌属和索丝菌属中的多个菌种是冷藏肉品中常见的腐败微生物,其代谢活动会导致黏液形成、异味产生等腐败现象[5]。汉逊德巴利酵母(Debaryomyces hansenii)和黄色毛霉(Mucor flavus)是传统发酵食品中常见的微生物,已被纳入《中国传统发酵食品用微生物菌种名单》,分别被应用于奶酪、发酵肉制品和腐乳等食品的生产中[6-7]。涎沫假丝酵母(Candida zeylanoides)在发酵火腿中常被检测到,但关于其对发酵肉制品品质的影响研究较少[8-9]。
表1 干式成熟牛肉中的常见微生物
Table 1 Common microorganisms in dry-aged beef
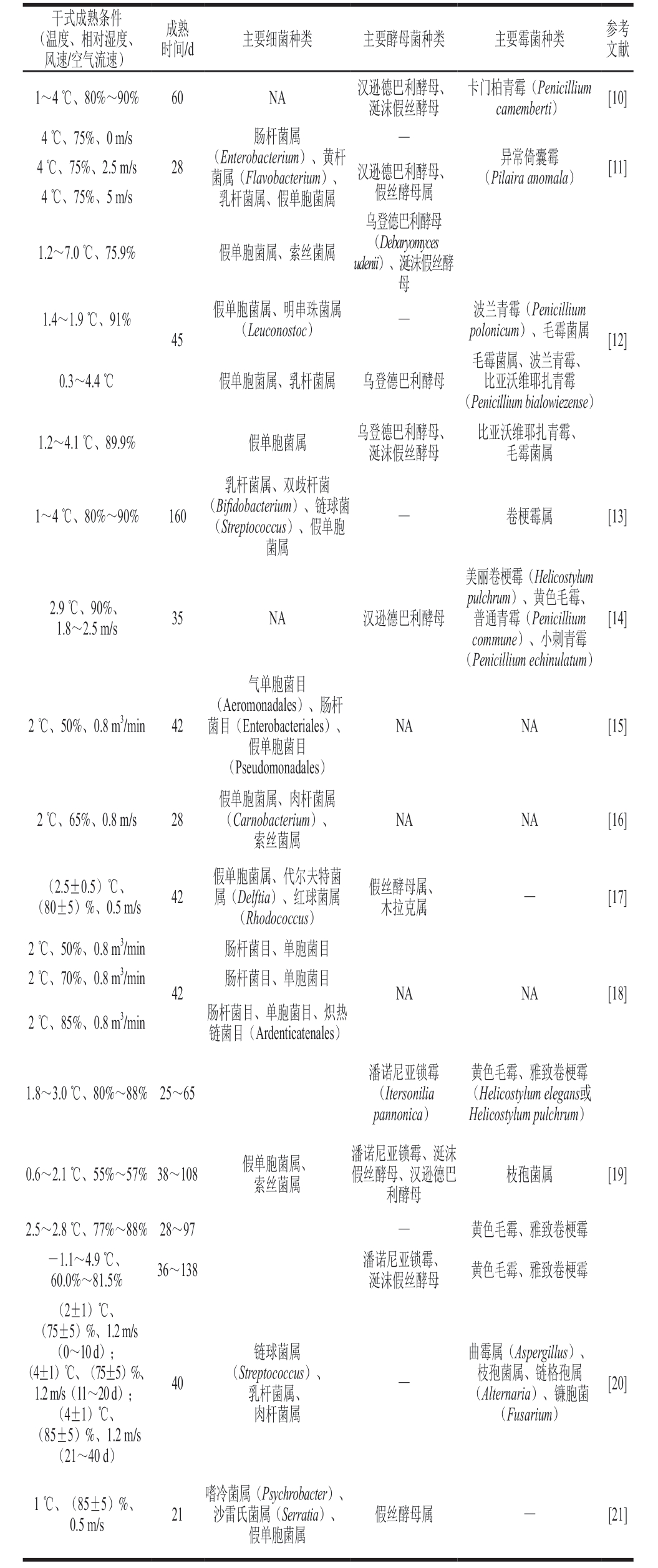
注:NA.未测定;—.此类微生物相对丰度低于1%。
(风温干速度式/、空成相气熟对流条湿速件度)、时成间熟/d主要细菌种类主要酵母菌种类主要霉菌种类参文考献1~4 ℃、80%~90%60 NA汉逊涎德沫巴假利丝酵酵母母、卡门柏ca青m霉e m(be Pr e ti n)i cillium[10]4 ℃、75%、0 m/s 肠杆菌属—44℃℃、、7755%%、、25.5mm/s/s28(菌乳E属n杆t(e r菌oFbl属aavc、ot ebr假ai uc单tme r)胞i u、m菌)黄属、杆汉逊假德丝巴酵利母酵属母、(Pi异lai常ra倚an囊om霉ala)[11]乌登德巴利酵母1.2~7.0 ℃、75.9%假单胞菌属、索丝菌属uden(ii)De、ba涎ryo沫m假y ce丝s酵母1.4~1.9 ℃、91%45假单胞(L菌eu属co、no明st串oc珠)菌属—p波olo兰ni青cu霉m)(、P e毛n ic霉ill菌ium属[12]毛霉菌属、波兰青霉、0.3~4.4 ℃假单胞菌属、乳杆菌属乌登德巴利酵母比亚沃维耶扎青霉(Penicillium bialowiezense)1.2~4.1 ℃、89.9%假单胞菌属乌登涎德沫巴假利丝酵酵母母、比亚沃毛维霉耶菌扎属青霉、乳杆菌属、双歧杆菌1~4 ℃、80%~90%160((BSi f tr ideopbt o accot ecrciuusm))、、假链单球胞菌—卷梗霉属[13]菌属美丽卷梗霉(Helicostylum 2.1 9. 8℃~、2.950m%/、s 35 NA汉逊德巴利酵母pcu普ol cm通hmr u青umn霉)e)(、、P黄e小n色i刺c毛i l青l霉iu霉m、[14](Penicillium echinulatum)气单胞菌目2 ℃、50%、0.8 m3/min42菌(目A(e ro E mn o te nraodbaalcetse)ria、les肠)杆、NANA[15]假单胞菌目(Pseudomonadales)假单胞菌属、肉杆菌属2℃、65%、0.8 m/s28(Carnobacterium)、NANA[16]索丝菌属((80 2±.55±)0%.5、)0℃.5、m/s42假属单((胞D eR菌lhf to属ia d)o、c、o代cc红尔us球夫)菌特属菌假丝木酵拉母克属属、—[17]2 ℃、50%、0.8 m3/min 肠杆菌目、单胞菌目2 ℃、70%、0.8 m3/min 42肠杆菌目、单胞菌目NANA[18]2 ℃、85%、0.8 m3/min肠链杆菌菌目目(、A r单de胞nti菌ca目ten、al炽es)热潘诺尼亚锁霉黄色毛霉、雅致卷梗霉1.8~3.0 ℃、80%~88% 25~65(Itersonilia(Helicostylum elegans或pannonica)Helicostylum pulchrum)0.6~2.1 ℃、55%~57% 38~108假单索胞丝菌菌属属、潘假诺丝尼酵亚母利锁、酵霉汉母、逊涎德沫巴枝孢菌属[19]2.5~2.8 ℃、77%~88% 28~97 —黄色毛霉、雅致卷梗霉-60 1..01%~~4.891 ℃.5%、36~138 潘涎诺沫尼假亚丝锁酵霉母、黄色毛霉、雅致卷梗霉(2±1)℃、(75±5)%、1.2 m/s(0~10 d);链球菌属曲霉属(Aspergillus)、(41±.2 1m)/s℃(、11(~7250±d 5));%、40(Str乳ep杆to菌coc属cu、s)、—(枝A孢lte菌rna属ri、a)链、格镰孢胞属菌[20](4±1)℃、肉杆菌属(Fusarium)(85±5)%、1.2 m/s(21~40 d)1 ℃、(0.855m±/s 5)%、21嗜沙冷雷菌氏属菌假(属单P s(胞y cSh菌er or属rbaatci a te)r)、、假丝酵母属—[21]
1.2 干式成熟牛肉中的微生物数量
近年来,不同国家学者对市售干式成熟牛肉中微生物的数量进行了调查研究。Gowda等[22]对比利时5 家生产商的30 块干式成熟牛排外表面微生物数量,结果显示,嗜冷菌数量<1.0~7.4(lg(CFU/cm2)),肠杆菌数量<1.0~7.4(lg(CFU/cm2)),假单胞菌<1.0~5.0(lg(CFU/cm2)),乳酸菌<1.0~5.0(lg(CFU/cm2)),酵母菌<1.0~3.7(lg(CFU/cm2)),霉菌<1.0~1.5(lg(CFU/cm2))。Coton等[19]对法国17 个生产商的58 份干式成熟牛肉外壳样品进行研究,细菌总数为1.97~10.91(lg(CFU/g)),肠道菌<4.00~8.86(lg(CFU/g)),假单胞菌为1.62~11.72(lg(CFU/g)),霉菌为1.70~7.74(lg(CFU/g)),酵母菌为2.69~9.40(lg(CFU/g))。Lancaster等[23]对比美国10 家生产商的干式成熟牛肉样品中的微生物状况,发现与Gowda[22]、Coton[19]等的结果相比,好氧菌数量较低,为0.18~4.00(lg(CFU/cm2))。这可能是由于Lancaster等[23]采用的细菌培养温度(35 ℃)较高,不适宜于干式成熟牛肉中嗜冷菌的生长,导致检测出的细菌数量较低。目前国内外尚未有标准规定干式成熟牛肉的微生物限量值,相关标准亟待建立,了解市售干式成熟牛肉的微生物情况对于建立相应标准具有指导意义[24]。目前国内的干式成熟牛肉产品主要在高档西餐厅或淘宝等线上平台销售,以小批量生产和消费为主,产品存在质量不稳定等问题,在我国开展干式成熟牛肉中微生物状况的相关调研亦十分必要。
2 影响干式成熟牛肉中微生物状况的因素
不同研究中微生物数量与种类的差异主要受到原料肉质量、干式成熟条件(如温度、湿度、气流速度等)、成熟时间、生产环境的卫生状况及操作规范等因素的综合影响。这些变量对微生物的数量和群落组成具有显著作用,进而影响研究结果的一致性和可比性。
2.1 原料肉
原料肉的卫生条件、pH值以及是否经历冷冻-解冻处理均对干式成熟牛肉的微生物状况产生一定影响。Ribeiro等[15]研究表明,宰后pH值分别为5.47(正常肉)和6.69(黑切肉)的牛肉在干式成熟过程中,其细菌和乳酸菌数量无显著差异,但菌群组成存在显著差异,其中黑切肉中气单胞菌目和肠杆菌目比例较高,而假单胞菌目比例较低。此外,与湿式成熟相比,干式成熟可以显著降低黑切肉中细菌和乳酸菌的数量。de Barros Silva Haddad等[25]以鲜牛肉和速冻(-20 ℃、7 d)-缓慢解冻(4 ℃、24 h)牛肉为原料,进行42 d的干式成熟,成熟结束后,2 组内部的菌落总数(分别为3.25、3.81(lg(CFU/g)))无显著差异,但解冻组的嗜冷菌(4.29(lg(CFU/g)))和乳酸菌(3.00(lg(CFU/g)))数量显著高于鲜肉组(3.16、2.30(lg(CFU/g)))。这种差异可能是由于冷冻过程中形成的冰晶破坏了肌肉细胞结构,导致细胞内汁液流出,为微生物的生长提供了更多营养物质。此外,经过冷冻处理后存活下来的细菌通常为耐冷菌,干式成熟过程中,温度和水分活度相较于冷冻阶段有所提高,这加速了微生物的生长繁殖[26-27]。然而,这一结果与da Silva Bernardo等[28]的研究结论有所不同。da Silva Bernardo等[28]以鲜牛肉、冷冻(-20 ℃、30 d)-快速解冻(20 ℃、15 h)牛肉和冷冻(-20 ℃、30 d)-缓慢解冻(4 ℃、48 h)牛肉为原料,进行28 d的干式成熟。成熟后表面硬壳中的细菌、嗜冷菌、肠杆菌科、真菌数量在不同组之间无显著差异。这2 项研究结果的差异可能与测定样品的差异有关,Ribeiro等[15]测定的是牛肉内部的微生物数量,而da Silva Bernardo等[28]测定的是表面硬壳中细菌数量,而不同组的表面硬壳水分活度均较低,限制了细菌的生长。
在我国,进口冷冻牛肉因价格较低且品质稳定,已成为许多干式成熟牛肉生产者的主要原料来源。这些进口牛肉通常以冷冻形式经过较长时间运输,解冻后再用于成熟生产。基于以上分析,以解冻的进口牛肉为原料可能会对干式成熟过程中微生物状况带来较大的安全隐患,这一问题有待进一步研究。
2.2 生产条件
生产条件主要包括生产环境、温度、相对湿度、风速等。在不同生产环境中,微生物状况存在差异,尤其是酵母菌和霉菌的种类,而空气流动对酵母菌和霉菌的传播影响较大,从而显著影响干式成熟牛肉的微生物群落。干式成熟通常在温度0~4 ℃、相对湿度75%~90%和风速0.5~2.5 m/s的条件下进行[29]。低温直接影响微生物的生长速率,并直接抑制一些致病菌的生长。相对湿度和风速则通过调节肉品表面的水分蒸发速率间接影响微生物的生长和菌群结构。Capouya等[12]对美国5 家工厂生产的干式成熟牛肉进行微生物菌群结构分析,发现产地是影响其菌群结构的关键因素。Coton等[19]对法国17 家干式成熟牛肉生产者的环境条件、细菌和真菌菌群进行测定和方差分析后发现,影响细菌和真菌菌群多样性和组成的主要因素是生产厂家、温度、相对湿度和表面硬壳的pH值。Lee等[11]研究温度4 ℃、相对湿度75%条件下,不同风速(0、2.5、5 m/s)对干式成熟牛肉菌群结构的影响,与0 m/s相比,2.5、5 m/s条件下异常倚囊霉相对丰度分别降低16.1%和14.6%,汉逊德巴利酵母相对丰度分别增加15.7%和14.5%,假单胞菌相对丰度分别减少6.4%和8.5%。Ribeiro等[18]研究发现,在相同温度和空气流速下,不同相对湿度(50%、70%和85%)对细菌、厌氧菌、乳酸菌和嗜冷菌的数量无显著影响,但对菌群结构有一定影响。随着相对湿度的增加,炽热链菌目的相对丰度增加,而肠杆菌目的相对丰度下降。由以上研究可见,温度、相对湿度、风速对干式成熟的微生物状况具有显著影响。然而,目前市面上大部分干式成熟柜存在温湿度波动大、控温控湿不准等问题,未来需在此方面改进干式成熟设备,实现精准控制温度和湿度,以优化生产条件,并确保产品的微生物安全性和品质稳定性。
此外,成熟过程是否使用紫外线处理、是否进行空气除菌,以及修剪过程的卫生规范也会影响干式成熟牛肉的微生物状况。紫外线处理可显著降低干式成熟牛肉表面硬壳和内部的细菌和真菌数量,但并未改变菌群组成[12,30]。修剪过程的卫生状况可能会引发微生物的交叉污染。Gowda等[22]研究显示,未修剪的干式成熟牛肉表面中肠杆菌科的检出率为31%,李斯特菌属(Listeria)的检出率为0%,细菌数量的最大值为4.3(lg(CFU/cm²));而修剪后的牛排表面,肠杆菌科和李斯特菌属检出率更高(分别为40%和10%),且细菌数量的最大值上升到7.4(lg(CFU/cm²)),这表明在修剪过程中可能发生了交叉污染。因此,在修剪环节严格遵守良好的卫生操作规范对于保障最终干式成熟牛肉产品的微生物安全具有重要作用。
2.3 成熟时间
随着干式成熟时间的延长,微生物数量逐渐增加,并在达到一定水平后趋于稳定或略微下降[31]。干式成熟时间对微生物菌群的动态变化也具有一定影响,由于牛肉中不同微生物对干式成熟环境的适应性存在差异,成熟过程微生物菌群结构会发生变化。Ryu等[10]研究表明,在牛肉干式成熟过程中,卡门柏青霉和汉逊德巴利酵母相对丰度不断增加。Ryu等[13]发现,经过12、30 d干式成熟,牛肉中的细菌以乳杆菌、双歧杆菌等乳酸菌为主;随着成熟时间延长,乳酸菌的相对丰度逐渐下降,而假单胞菌相对丰度显著增加。欧洲食品安全局生物危害小组也提出,在达到理想食用品质后,应尽量缩短成熟时间,以减少致病菌和腐败菌的繁殖[24]。目前关于干式成熟的研究大多采用14~45 d。
3 微生物对干式成熟牛肉品质的影响
关于微生物是否参与干式成熟牛肉特征品质的形成,不同学者之间存在一定分歧,这一争议的关键在于干式成熟牛肉中微生物的数量和种类。当微生物数量较低(<3.0(lg(CFU/g)))时,其对干式成熟牛肉品质的形成影响不显著[32]。而当微生物数量较高时,特定微生物可能通过其代谢活动对牛肉的风味、质地等品质特征产生一定作用[33-35]。主要作用机制如图1所示,主要包括以下3 个方面:1)微生物分泌的胞外蛋白酶可降解蛋白质,生成游离氨基酸和肽类物质,其中部分游离氨基酸和肽类可直接作为滋味物质,或作为风味前体物质进一步参与挥发性风味物质的形成;2)微生物分泌的脂肪酶可降解脂肪,产生游离脂肪酸;3)微生物通过代谢肉中氨基酸等底物,生成醛类等挥发性代谢产物[36-37]。
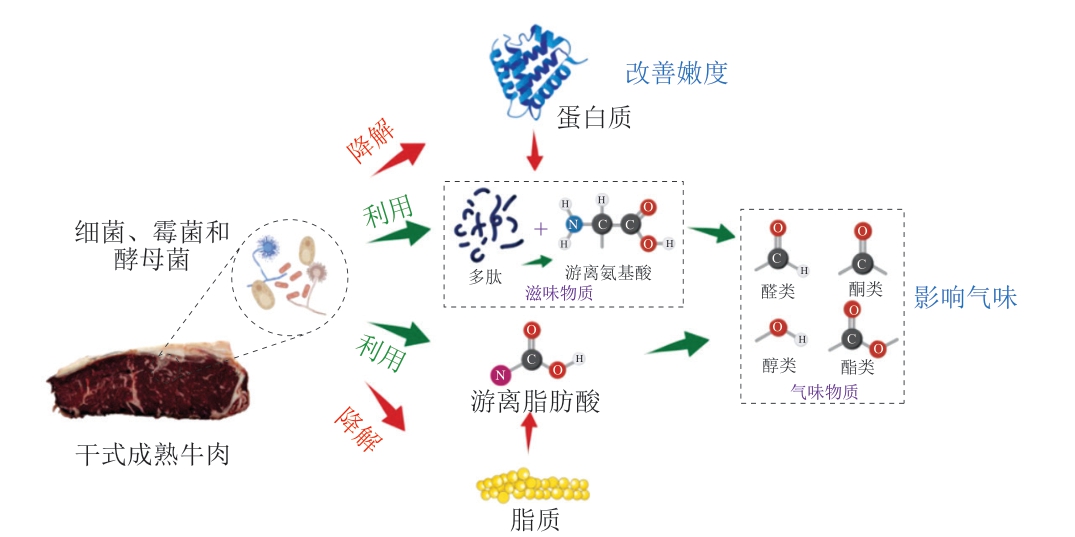
图1 微生物对干式成熟牛肉品质形成的主要作用
Fig. 1 Effects of microorganisms on the quality of dry-aged beef
目前,一些学者通过对干式成熟牛肉中分离的菌株进行回接实验,以分析这些菌株对干式成熟牛肉品质指标的影响。Hanagasaki等[38]将分离菌株黄色毛霉接种到牛肉表面后进行干式成熟,与未接菌牛肉相比,接菌组γ-氨基丁酸、天冬氨酸、脯氨酸含量显著提高,且肉香味更浓郁。Przybylski[39]、Jaworska等[40]对同一黄色毛霉菌株进行回接实验发现,与未接菌组相比,接菌组的肌球蛋白轻链水解程度增加,月桂酸、肉豆蔻酸、二十碳三烯酸、花生四烯酸、二十碳五烯酸含量显著增加,花生酸、山嵛酸含量显著降低,风味、多汁性和整体可接受度均有所提升。Oh等[41]从干式成熟牛肉中筛选出优势菌种波兰青霉和汉逊德巴利酵母,并回接至牛肉表面,干式成熟21 d后发现,2 种菌均可降解牛肉的肌原纤维蛋白,与未接菌组相比,波兰青霉组月桂酸、肉豆蔻酸、肉豆蔻脑酸、棕榈酸、棕榈烯酸、硬脂酸、油酸、亚麻酸、花生四烯酸、谷氨酸、甲硫氨酸、缬氨酸、苯丙氨酸、异亮氨酸、亮氨酸基酸含量显著增加,而汉逊德巴利酵母组游离脂肪酸和游离氨基酸含量与未接菌组无显著差异。Mikami等[42]采用直接涂抹干式成熟表面硬壳的方法进行接种实验,表面硬壳中含有较高数量的黄色毛霉、美丽卷梗霉和青霉菌属。结果表明,接菌组的干式成熟牛肉中油酸的占比显著增加,且1-己醇、1-辛烯-3醇、1-辛醇、3-甲基丁醛、庚醛、苯甲醛、辛醛、壬醛、2-壬烯醛共9 种挥发性风味物质含量显著增加。这些研究结果为挖掘干式成熟牛肉中的微生物资源提供了重要依据。
另有部分学者尝试将商业化常用的肉制品发酵菌株接种至干式成熟牛肉,以分析其对品质提升的作用。Lee等[43]研究接种商业菌种白色青霉菌(Penicillium candidum)和纳地青霉(Penicillium nalgiovense)对干式成熟牛肉品质的影响,结果表明,白色青霉菌主要通过增加醇类和醛类等挥发性风味物质的含量改善风味,而纳地青霉主要通过促进多种游离氨基酸(与甜味相关的丙氨酸和脯氨酸,以及与鲜味相关的天冬氨酸)的生成来优化风味,通过接菌可显著缩短成熟时间至7 d。徐琳[44]将汉逊德巴利酵母、肉葡萄球菌(Staphylococcus carnosus)和戊糖片球菌(Pediococcus pentosaceus)单独接种于干式成熟牛肉中,发现3 种菌株均可显著提高游离氨基酸和挥发性风味物质含量,并不同程度改变醛类、醇类、酮类和酯类物质的相对含量,特别是促进已酸乙酯等乙基酯类物质的生成。进一步研究显示,将以上3 种菌复配(1∶1∶1)接种于干式成熟牛肉后,显著提高了戊醇、己醛、庚醛、辛醛、壬醛、己酸乙酯、2-正戊基呋喃、1-辛烯-3-醇和己酸乙烯基酯等多种关键风味物质的含量,复配接菌还加速牛肉的成熟进程,将成熟时间显著缩短至14 d,同时接菌有效降低了假单胞菌等常见腐败菌的相对丰度[45]。
4 干式成熟牛肉的微生物安全性
影响干式成熟牛肉微生物安全性的因素主要包括致病菌和腐败菌。
4.1 干式成熟牛肉中的致病菌污染风险
研究[46-48]证明,干式成熟可显著降低大肠菌群及致病菌大肠杆菌(Escherichia coli)O157:H7和沙门氏菌(Salmonella)的数量。这可能与低温条件和水分活度下降不利于致病菌的生长有关。沙门氏菌、大肠杆菌和单增李斯特菌(Listeria monocytogenes)的最低生长温度分别为6、7、0~2 ℃[49],而干式成熟通常在低于4 ℃的条件下进行。已有研究表明,成熟温度、相对湿度及致病菌的血清型等因素对致病菌数量的下降速率有一定影响。Knudsen等[50]研究8 种不同血清型的15 株沙门氏菌在干式成熟过程中的数量下降情况,下降程度依血清型和菌株的不同而有所异,在温度(1±2)℃、相对湿度70%~100%的条件下,经过干式成熟14 d,沙门氏菌数量的下降速率在0.113~0.216(lg(CFU/d))之间,高于鼠伤寒沙门氏菌(Salmonella typhimurium)DT104、肠炎沙门氏菌(Salmonella enteritidis)PT4、肠炎沙门氏菌PT8和5 种野生型沙门氏菌菌株数量的下降速率。da Silva等[51]以无害李斯特菌(Listeria innocua)作为单增李斯特菌的替代指示菌,研究其在牛肉42 d干式成熟过程中的变化,在相对湿度75%、空气流速2 m/s、温度分别为2、8 ℃条件下,牛肉表面无害李斯特菌数量分别减少2.38、3.37(lg(CFU/g)),适当提高成熟温度可以加速无害李斯特菌的数量下降。但与沙门氏菌和大肠杆菌O157:H7相比,单增李斯特菌的数量降低速率更低[49]。尽管干式成熟能够降低沙门氏菌、大肠杆菌和单增李斯特菌的数量,但并不能完全消除这些致病菌的存在风险。Gowda等[22]报告,牛排表面凝固酶阳性葡萄球菌的检出率为10%,数量不超过2.0(lg(CFU/cm2))。Coton等[19]在干式成熟牛肉中检测到疑似大肠杆菌O157:H7的检出率为4%,其最大数量为1.67(lg(CFU/g))。
4.2 干式成熟牛肉中的常见腐败菌及控制措施
干式成熟牛肉中常见的腐败菌包括假单胞菌和索丝菌等,腐败菌可能会产生黏液、异味等腐败物质。抑制干式成熟牛肉中腐败菌的措施主要包括套袋成熟、涂膜成熟、益生菌接种、超高压处理,其中对干式成熟袋的研究最为广泛。干式成熟袋由柔性聚合物和刚性聚酰胺制成,具有优异的透水性能和透氧性能。如丹麦TUB-EX公司产的Tublin® 10商用干式成熟袋,在温度7 ℃、相对湿度50%的条件下,水蒸气透过率可达920 g/(50 μm·m²·24 h),氧气透过率为660 g/(m²·24 h),这些特性使其在干式成熟过程中能够有效调节水蒸气和氧气交换,同时减少微生物的污染。关于套袋对干式成熟过程中微生物的影响,不同研究的结论存在差异。Ahnström[52]和Degeer[53]等发现,使用套袋成熟对干式成熟中的微生物数量没有显著影响。而Li Xin等[54]则发现套袋成熟可减少细菌、肠杆菌科和酵母菌数量。Zhang Songshan等[17]研究表明,套袋成熟显著降低了假单胞菌的相对丰度。这些结果的差异可能与不同研究中使用的干式成熟袋的透水性和透氧性,以及成熟参数的差异有关。史颖悟[55]研究不同透湿率成熟袋(350、5 000、7 900、11 000 g/(m2·24h))对微生物数量的影响,结果显示,透湿率越低,乳酸菌数量、霉菌和酵母菌数量越低。
相较于干式成熟袋,以壳聚糖、明胶等为基质的生物膜具有绿色环保、成本低、透水性和透气率更高等优点,有研究尝试将其应用于干式成熟牛肉中,以作为商用干式成熟袋的替代品。Gudjónsdóttir等[56]发现,与传统干式成熟14、21 d相比,将静电纺丝壳聚糖膜应用于干式成熟牛肉后,菌落总数分别降低5.7、6.2(lg(CFU/mL))。Zhang Songshan等[17]将壳聚糖-胶原蛋白肽-肉桂皮精油涂膜应用于干式成熟牛肉,可显著降低假单胞菌的相对丰度。此外,接种益生菌植物乳植杆菌(Lactobacillus plantarum)可有效抑制干式成熟过程中假单胞菌、细菌总数和挥发性盐基氮含量的增长,接种量为1 倍最小抑菌浓度时,分别降低95.1%、95.3%和39.6%;接种量为2 倍最小抑菌浓度时,分别降低98.6%、98.9%和47.3%[57]。使用超高压(600 MPa持续3 min)处理干式成熟牛肉表面硬壳后,菌落总数、假单胞菌数、肠杆菌数和酵母菌数降幅超过3.0(lg(CFU/g))[58]。生物膜、接种益生菌及超高压处理均在干式成熟牛肉的微生物控制中展现了显著效果,为提升干式成熟牛肉的安全性提供了更多的技术选择,这些方法的进一步优化和实际应用值得深入研究。
5 结 语
尽管国内外关于干式成熟牛肉微生物状况的研究已取得一定进展,但仍有许多方向亟待完善。例如,对于干式成熟过程中常见真菌(如假丝酵母菌)对牛肉的具体影响,目前研究较为有限。这些真菌是否对牛肉风味具有积极作用,抑或可能引发腐败,尚需进一步深入探讨。在生产管理方面,干式成熟牛肉的产品分类仍需明确,例如,应厘清其究竟属于生鲜牛肉还是肉制品。基于这一分类,应进一步明确相关监管部门的职责划分,以确保行业管理的规范性和科学性。此外,为保障干式成熟牛肉的质量与安全,应尽快制定干式成熟牛肉标准化的生产规程及相应的微生物安全标准,这将有助于干式成熟牛肉的规范化生产过程、品质提升和安全性保障。
[1] CAMPBELL R E, HUNT M C, LEVIS P, et al. Dry-aging effects on palatability of beef longissimus muscle[J]. Journal of Food Science,2001, 66(2): 196-199. DOI:10.1111/j.1365-2621.2001.tb11315.x.
[2] SMITH R D, NICHOLSON K L, NICHOLSON J D W, et al.Dry versus wet aging of beef: retail cutting yields and consumer palatability evaluations of steaks from US choice and US select short loins[J]. Meat Science, 2008, 79(4): 631-639. DOI:10.1016/j.meatsci.2007.10.028.
[3] BERGER J, KIM Y H B, LEGAKO J F, et al. Dry-aging improves meat quality attributes of grass-fed beef loins[J]. Meat Science, 2018,145: 285-291. DOI:10.1016/j.meatsci.2018.07.004.
[4] ZHANG R Y, YOO M J Y, ROSS A B, et al. Mechanisms and strategies to tailor dry-aged meat flavour[J]. Trends in Food Science &Technology, 2022, 119: 400-411. DOI:10.1016/j.tifs.2021.12.023.
[5] SNYDER A B, MARTIN N, WIEDMANN M. Microbial food spoilage: impact, causative agents and control strategies[J]. Nature Reviews: Microbiology, 2024, 22(9): 528-542. DOI:10.1038/s41579-024-01037-x.
[6] 姚粟, 于学健, 白飞荣, 等. 中国传统发酵食品用微生物菌种名单研究[J]. 食品与发酵工业, 2017, 11(1): 92-105. DOI:10.13995/j.cnki.11-1802/ts.014768
[7] 姚粟, 王鹏辉, 白飞荣, 等. 中国传统发酵食品用微生物菌种名单研究(第二版)[J]. 食品与发酵工业, 2022, 48(1): 272-307.DOI:10.13995/j.cnki.11-1802/ts.029332.
[8] MENDOZA L M, PADILLA B, BELLOCH C, et al. Diversity and enzymatic profile of yeasts isolated from traditional llama meat sausages from North-Western Andean region of Argentina[J].Food Research International, 2014, 62: 572-579. DOI:10.1016/j.foodres.2014.04.008.
[9] BELLEGGIA L, FERROCINO I, REALE A, et al. Unfolding microbiota and volatile organic compounds of Portuguese Painho de Porco Preto fermented sausages[J]. Food Research International, 2022,155: 111063. DOI:10.1016/j.foodres.2022.111063.
[10] RYU S, PARK M R, MABURUTSE B E, et al. Diversity and characteristics of the meat microbiological community on dry aged beef[J]. Journal of Microbiology and Biotechnology, 2018, 28(1): 105-108. DOI:10.4014/jmb.1708.08065.
[11] LEE H J, YOON J W, KIM M, et al. Changes in microbial composition on the crust by different air flow velocities and their effect on sensory properties of dry-aged beef[J]. Meat Science, 2019, 153: 152-158.DOI:10.1016/j.meatsci.2019.03.019.
[12] CAPOUYA R, MITCHELL T, CLARK D I, et al. A survey of microbial communities on dry-aged beef in commercial meat processing facilities[J]. Meat and Muscle Biology, 2020, 4(1).DOI:10.22175/mmb.10373.
[13] RYU S, SHIN M, CHO S, et al. Molecular characterization of microbial and fungal communities on dry-aged beef of hanwoo using metagenomic analysis[J]. Foods, 2020, 9(11): 1571. DOI:10.3390/foods9111571.
[14] MIKAMI N, TOYOTOME T, YAMASHIRO Y, et al. Dry-aged beef manufactured in Japan: microbiota identification and their effects on product characteristics[J]. Food Research International, 2021, 140:110020. DOI:10.1016/j.foodres.2020.110020.
[15] RIBEIRO F A, LAU S K, FURBECK R A, et al. Ultimate pH effects on dry-aged beef quality[J]. Meat Science, 2021, 172: 108365.DOI:10.1016/j.meatsci.2020.108365.
[16] SETYABRATA D, VIERCK K, SHEETS T R, et al. Characterizing the flavor precursors and liberation mechanisms of various dryaging methods in cull beef loins using metabolomics and microbiome approaches[J]. Metabolites, 2022, 12(6): 472. DOI:10.3390/metabo12060472.
[17] ZHANG S S, SUN X B, LEI Y H, et al. Effects of chitosan/collagen peptides/cinnamon bark essential oil composite coating on the quality of dry-aged beef[J]. Foods, 2022, 11(22): 3638. DOI:10.3390/foods11223638.
[18] RIBEIRO F A, LAU S K, FURBECK R A, et al. Effects of relative humidity on dry-aged beef quality[J]. Meat Science, 2024, 213:109498. DOI:10.1016/j.meatsci.2024.109498.
[19] COTON E, DUBÉE M, PAWTOWSKI A, et al. Microbiota associated with commercial dry-aged beef in France[J]. Food Research International, 2024, 181: 114118. DOI:10.1016/j.foodres.2024.114118.
[20] WANG Y X, PENG A Q, ZHAO C C, et al. Analysis of microbial community succession and characteristic flavour during dry ageing of Yanbian beef[J]. International Journal of Food Science & Technology,2024, 59(5): 2998-3012. DOI:10.1111/ijfs.17029.
[21] CHENG Y L, MENG Y Y, XU L, et al. Study on the correlations between quality indicators of dry-aged beef and microbial succession during fermentation[J]. Foods, 2024, 13(10): 1552. DOI:10.3390/foods13101552.
[22] GOWDA T K G M, DE ZUTTER L, VAN ROYEN G, et al.Exploring the microbiological quality and safety of dry-aged beef: a cross-sectional study of loin surfaces during ripening and dry-aged beef steaks from commercial meat companies in Belgium[J]. Food Microbiology, 2022, 102: 103919. DOI:10.1016/j.fm.2021.103919.
[23] LANCASTER J M, SMART J H, VAN BUREN J, et al. Assessment of dry-aged beef from commercial aging locations across the United States[J]. International Journal of Gastronomy and Food Science,2022, 27: 100466. DOI:10.1016/j.ijgfs.2022.100466.
[24] EFSA Panel on Biological Hazards (BIOHAZ), KOUTSOUMANIS K,ALLENDE A, et al. Microbiological safety of aged meat[J]. EFSA Journal, 2023, 21(1): e07745. DOI:10.2903/j.efsa.2023.7745.
[25] DE BARROS SILVA HADDAD G, GOMES H B, BUCHILI A F M,et al. Accelerating the dry aging of bone-in beef from Nellore cattle by the freeze/thaw process[J]. Journal of Food Processing and Preservation, 2022, 46(7): e16573. DOI:10.1111/jfpp.16573.
[26] LEYGONIE C, BRITZ T J, HOFFMAN L C. Impact of freezing and thawing on the quality of meat: review[J]. Meat Science, 2012, 91(2):93-98. DOI:10.1016/j.meatsci.2012.01.013.
[27] COOMBS C E O, HOLMAN B W B, FRIEND M A, et al. Long-term red meat preservation using chilled and frozen storage combinations:a review[J]. Meat Science, 2017, 125: 84-94. DOI:10.1016/j.meatsci.2016.11.025.
[28] DA SILVA BERNARDO A P, DA SILVA A C M, FRANCISCO V C,et al. Effects of freezing and thawing on microbiological and physicalchemical properties of dry-aged beef[J]. Meat Science, 2020, 161:108003. DOI:10.1016/j.meatsci.2019.108003.
[29] 刘寅初, 高晓光, 张松山, 等. 干法成熟牛肉品质形成与增值途径研究进展[J]. 食品科学, 2023, 44(15): 321-328. DOI:10.7506/spkx1002-6630-20220915-139.
[30] SETYABRATA D, WAGNER A D, COOPER B R, et al. Effect of dry-aging on quality and palatability attributes and flavor-related metabolites of pork loins[J]. Foods, 2021, 10(10): 2503. DOI:10.3390/foods10102503.
[31] HULÁNKOVÁ R, KAMENÍK J, SALÁKOVÁ A, et al. The effect of dry aging on instrumental, chemical and microbiological parameters of organic beef loin muscle[J]. LWT-Food Science and Technology, 2018,89: 559-565. DOI:10.1016/j.lwt.2017.11.014.
[32] BISCHOF G, WITTE F, SIEKSMEYER T, et al. Metabolic and microbial analyses of the surface and inner part of wet-aged and dryaged beef[J]. Journal of Food Science, 2023, 88(11): 4375-4387.DOI:10.1111/1750-3841.16761.
[33] OH J, LEE H J, YOON J W, et al. Electrical resistance and mold distribution on beef surface as indicators of dry aging[J]. Journal of Food Process Engineering, 2019, 42(5): e13122. DOI:10.1111/jfpe.13122.
[34] KIM H C, BAEK K H, KO Y, et al. Dry-aged beef using 2D NMR spectroscopy[J]. Molecules, 2020, 25: 3087. DOI:10.3390/molecules25133087.
[35] LEE D, LEE H J, YOON J W, et al. Effect of different aging methods on the formation of aroma volatiles in beef strip loins[J]. Foods, 2021,10(1): 146. DOI:10.3390/foods10010146.
[36] 喻倩倩, 李诗萌, 程蓓, 等. 肉类宰后成熟机制及成熟进程监测研究进展[J]. 食品科学, 2023, 44(1): 337-344. DOI:10.7506/spkx1002-6630-20211104-060.
[37] 喻倩倩, 刘倩倩, 谷雪静, 等. 干法成熟肉类品质形成机制研究进展[J].食品科学, 2023, 44(13): 309-316. DOI:10.7506/spkx1002-6630-20221107-067.
[38] HANAGASAKI T, ASATO N. Changes in free amino acid content and hardness of beef while dry-aging with Mucor flavus: changes in the quality of beef while dry-aging with Mucor flavus[J]. Journal of Animal Science and Technology, 2018, 60: 19. DOI:10.1186/s40781-018-0176-6.
[39] PRZYBYLSKI W, JAWORSKA D, PŁECHA M, et al. Fungal biostarter effect on the quality of dry-aged beef[J]. Foods, 2023, 12(6):1330. DOI:10.3390/foods12061330.
[40] JAWORSKA D, PAWŁOWSKA J, KOSTYRA E, et al. Dry-aged beef quality with the addition of Mucor flavus: sensory, chemosensory and fatty acid analysis[J]. Meat Science, 2025, 220: 109691. DOI:10.1016/j.meatsci.2024.109691.
[41] OH H, LEE H J, LEE J, et al. Identification of microorganisms associated with the quality improvement of dry-aged beef through microbiome analysis and DNA sequencing, and evaluation of their effects on beef quality[J]. Journal of Food Science, 2019, 84(10):2944-2954. DOI:10.1111/1750-3841.14813.
[42] MIKAMI N, TOYOTOME T, TAKAYA M, et al. Direct rub inoculation of fungal flora changes fatty acid composition and volatile flavors in dry-aged beef: a preliminary study[J]. Animals, 2022,12(11): 1391. DOI:10.3390/ani12111391.
[43] LEE Y E, LEE H J, KIM C H, et al. Effect of Penicillium candidum and Penicillium nalgiovense and their combination on the physicochemical and sensory quality of dry-aged beef[J]. Food Microbiology, 2022, 107: 104083. DOI:10.1016/j.fm.2022.104083.
[44] 徐琳. 牛里脊强化干式熟成及应用研究[D]. 无锡: 江南大学, 2022.DOI:10.27169/d.cnki.gwqgu.2022.001107.
[45] CHENG Y L, YIN X N, XU L, et al. Correlation analysis on the quality indicators of intensified dry-aged beef and microbial succession during fermentation[J]. Food Bioscience, 2023, 56: 103439. DOI:10.1016/j.fbio.2023.103439.
[46] CUTTER C N, RIVERA-BETANCOURT M. Interventions for the reduction of Salmonella typhimurium DT 104 and non-O157:H7 enterohemorrhagic Escherichia coli on beef surfaces[J]. Journal of Food Protection, 2000, 63(10): 1326-1332. DOI:10.4315/0362-028X-63.10.1326.
[47] ALGINO R J, INGHAM S C, ZHU J. Survey of antimicrobial effects of beef carcass intervention treatments in very small state-inspected slaughter plants[J]. Journal of Food Science, 2007, 72(5): M173-M179.DOI:10.1111/j.1750-3841.2007.00386.x.
[48] TITTOR A W, TITTOR M G, BRASHEARS M M, et al. Effects of simulated dry and wet chilling and aging of beef fat and lean tissues on the reduction of Escherichia coli O157:H7 and Salmonella[J]. Journal of Food Protection, 2011, 74(2): 289-293. DOI:10.4315/0362-028X.JFP-10-295.
[49] VAN DAMME I, VARALAKSHMI S, DE ZUTTER L, et al. Decrease of Salmonella and Escherichia coli O157:H7 counts during dry-aging of beef but potential growth of Listeria monocytogenes under certain dry-aging conditions[J]. Food Microbiology, 2022, 104: 104000.DOI:10.1016/j.fm.2022.104000.
[50] KNUDSEN G M, SOMMER H M, SØRENSEN N D, et al. Survival of Salmonella on cuts of beef carcasses subjected to dry aging[J].Journal of Applied Microbiology, 2011, 111(4): 848-854. DOI:10.1111/j.1365-2672.2011.05094.x.
[51] DA SILVA A C M, DE OLIVEIRA PENA P, PFLANZER S B, et al.Effect of different dry aging temperatures on Listeria innocua as surrogate for Listeria monocytogenes[J]. Meat Science, 2019, 157:107884. DOI:10.1016/j.meatsci.2019.107884.
[52] AHNSTRÖM M L, SEYFERT M, HUNT M C, et al. Dry aging of beef in a bag highly permeable to water vapour[J]. Meat Science,2006, 73(4): 674-679. DOI:10.1016/j.meatsci.2006.03.006.
[53] DEGEER S L, HUNT M C, BRATCHER C L, et al. Effects of dry aging of bone-in and boneless strip loins using two aging processes for two aging times[J]. Meat Science, 2009, 83(4): 768-774. DOI:10.1016/j.meatsci.2009.08.017.
[54] LI X, BABOL J, BREDIE W L P, et al. A comparative study of beef quality after ageing longissimus muscle using a dry ageing bag,traditional dry ageing or vacuum package ageing[J]. Meat Science,2014, 97(4): 433-442. DOI:10.1016/j.meatsci.2014.03.014.
[55] 史颖悟. 透湿膜包装对牛肉成熟过程中品质的影响研究[D]. 南京:南京农业大学, 2020. DOI:10.27244/d.cnki.gnjnu.2020.001182.
[56] GUDJÓNSDÓTTIR M, GACUTAN M D, MENDES A C, et al.Effects of electrospun chitosan wrapping for dry-ageing of beef, as studied by microbiological, physicochemical and low-field nuclear magnetic resonance analysis[J]. Food Chemistry, 2015, 184: 167-175.DOI:10.1016/j.foodchem.2015.03.088.
[57] RAO W, WU J C, FANG Z Y, et al. Antibacterial mechanism of metabolites of Lactobacillus plantarum against Pseudomonas lundensis and their application in dry-aged beef preservation[J]. Food Chemistry, 2024, 460: 140463. DOI:10.1016/j.foodchem.2024.140463.
[58] WITTE F, SMETANA S, HEINZ V, et al. High-pressure processing of usually discarded dry aged beef trimmings for subsequent processing[J]. Meat Science, 2020, 170: 108241. DOI:10.1016/j.meatsci.2020.108241.