蜡样芽孢杆菌(Bacillus cereus)是一种兼性好氧革兰氏阳性菌,广泛存在于土壤、水、空气及动物肠道中[1-2]。蜡样芽孢杆菌是一种条件食源性致病菌,因其可形成耐高温、耐酸的内生孢子,对环境适应性较强[3-4],存活的孢子在营养生长过程中萌发,能够合成毒素与胞外酶,导致食物变质,甚至引起食物中毒[5]。此外,蜡样芽孢杆菌具有形成生物膜能力,使其对化学清洁剂和抗菌处理具有抗性。因此,其可以在加工与贮藏过程中持续污染食物[6]。蜡样芽孢杆菌中毒可导致人体局部或全身性感染,导致菌血症、脑膜炎、坏死性肠炎等,按照其中毒症状可以分为呕吐型和腹泻型2 种[7-8]。呕吐由蜡样芽孢杆菌产生的呕吐毒素引起,呕吐毒素的毒力基因(ces和cer)在蜡样芽孢杆菌中的检出率相对较低;导致腹泻的毒素是一种较为复杂的多元化毒素,包括细胞毒素K、溶血素、非溶血性肠毒素、肠毒素T和肠毒素FM[9]。各毒素相关的毒力基因有细胞毒素K基因(cytK)、溶血素基因(hblA、hblC和hblD)、非溶血性肠毒素基因(nheA、nheB、nheC)、肠毒素T基因(bceT)和肠毒素FM基因(entFM),在蜡样芽孢杆菌中检出率相对较高。
鸡肉肠是以鸡肉为原料,辅以淀粉、植物蛋白粉、香辛料、保水剂和护色剂等物质,采用腌制、斩拌和高温蒸煮等工艺制作而成[10],其口味独特、营养丰富,深受广大消费者喜爱。鸡肉在屠宰、分割、加工、包装、运输和贮藏等环节易受微生物污染,且鸡肉制品营养丰富、水分含量高,易发生腐败变质[11-12]。目前,蜡样芽孢杆菌在各国多类食品中均有检出[13-14],有研究[15]表明,我国肉制品中蜡样芽孢杆菌污染率达26.47%,这可能带来严重的食品安全问题。虽然鸡肉肠通常采取低温加工和贮藏,但一些嗜冷蜡样芽孢杆菌仍能够生长繁殖并产生毒素[16],并且蜡样芽孢杆菌在鸡肉制品中的相关研究较少。因此,对低温鸡肉肠中蜡样芽孢杆菌的污染情况和菌株携带毒力基因及耐药性情况进行分析对低温肉类食品安全评估具有重要意义。本研究对低温鸡肉肠生产环节和腐败样品中的蜡样芽孢杆菌进行分离鉴定,并对其生化特性、毒力基因和药敏性进行分析,以期为低温肉制品中蜡样芽孢杆菌研究提供参考。
1 材料与方法
1.1 材料与试剂
原料鸡肉(5 份)、香辛料(以辣椒粉、食用盐、胡椒粉、味精和白糖等混合制成的料包,5 份)、鸡肉肠加工过程环境样品(斩拌刀具、解冻车间、斩拌机、解冻台面、灌肠机)及低温鸡肉肠腐败样品(5 份)均取自山东某食品加工厂。
甘露醇卵黄多黏菌素琼脂基础(mannitol yolk polymyxin agar base,MYP)培养基(含多黏菌素B(10 000 IU)、50%卵黄乳液) 南京娇子藤科学器材有限公司;增强革兰氏染色液 上海源叶生物科技有限公司;细菌基因组DNA提取试剂盒 天根生化科技(北京)有限公司;平板计数琼脂、LB肉汤基础 南京翼飞雪生物科技有限公司;HBI蜡样芽孢杆菌生化鉴定条(VP试剂盒、硝酸盐还原剂试剂盒、无菌液体石蜡、卢戈氏碘液) 杭州捷程生物科技有限公司;抗生素试纸片百奥基(北京)生物科技有限公司;2×E s Ta q MasterMix、100 bp Ladder 生工生物工程(上海)股份有限公司;DNA Marker DL2000、琼脂糖 北京擎科生物科技股份有限公司。
1.2 仪器与设备
M124A电子分析天平 意大利BEL公司;TP600梯度升降温功能聚合酶链式反应(polymerase chain reaction,PCR)仪 日本TaKaRa公司;DYY-6C电泳仪北京六一生物科技有限公司;Tanon-1600凝胶成像系统上海天能有限公司;Centrifuge 5424 R离心机 德国Eppendorf公司;A20干式恒温器 杭州龙扬科学仪器有限公司;SPX-250B-Z生化培养箱 上海博讯实业有限公司;THZ-C台式恒温振荡器 太仓华美生化仪器厂。
1.3 方法
1.3.1 蜡样芽孢杆菌的分离计数
随机称取一定量样品,与无菌生理盐水按1∶1(g/mL)放入均质袋,振荡混匀后进行梯度稀释;用无菌棉球在5 cm×5 cm范围内擦拭鸡肉肠生产过程中直接接触的表面作为加工环境样品,将棉球放入装有225 mL无菌生理盐水的均质袋,振荡混匀后进行梯度稀释,均得到10-1~10-3稀释液。
参照GB 4789.14—2014《食品安全国家标准 食品微生物学检验 蜡样芽孢杆菌检验》[17],从各稀释液中吸取100 μL悬液均匀涂布到MYP平板上,待样品稀释液吸收后,将涂布好的平板倒置于(30±1)℃培养箱中培养(24±2)h。完成菌落计数后,从不同来源样品的MYP平板上挑取形态、大小等不同的至少4 个典型菌落划线接种到营养琼脂平板上,(30±1)℃下纯培养(24±2)h,所得分离菌株甘油保存于-80 ℃冰箱备用。
1.3.2 分离菌株的形态学观察
观察8 株分离菌株在MYP和LB肉汤固体平板上培养24 h后的菌落形态,随后将其接种于无菌载玻片,进行革兰氏染色镜检。
1.3.3 分离菌株的生化鉴定
采用HBI蜡样芽孢杆菌生化鉴定条对8 株分离菌株进行生化鉴定。将分离菌株分别接种于营养琼脂平板,(30±1)℃下纯培养18~24 h后,进行过氧化氢酶、西蒙氏枸椽酸盐、动力、V-P、硝酸盐还原、明胶、葡萄糖、甘露醇产酸、溶菌酶肉汤及淀粉水解试验。参照GB 4789.14—2014标准判断结果。
1.3.4 分离菌株的16S rDNA测序鉴定
挑取纯培养后的8 株分离菌株接种于LB肉汤培养基中,于台式恒温振荡器中(30±1)℃培养。使用细菌基因组D N A 提取试剂盒提取细菌基因组D N A 作为后续P C R 扩增模板。采用正向引物2 7 F(5’-AGAGTTTGATCMTGGCTCAG-3’)和反向引物1492R(5’-GGTTACCTTGTTACGACTT-3’)扩增16S rDNA。PCR扩增结束后将产物回收,经1.5%琼脂糖凝胶电泳后在凝胶成像系统中观察结果。PCR产物送往生工生物工程(上海)股份有限公司测序,并将测序结果在NCBI GenBank中进行BLAST比对。从数据库中获得蜡样芽孢杆菌相关属、种的16S rDNA基因序列,使用MEGA-X软件构建系统发育进化树,进行同源性分析鉴定。
1.3.5 分离菌株的gyrB和cry基因检测
gyrB基因常被用于细菌系统发育分析和鉴别,cry基因为苏云金芽孢杆菌(Bacillus thuringiensis)的特异基因,结合二者可对分离菌株作进一步鉴定,合成引物相关信息见表1。PCR扩增体系参考卢佳琦等[18]并稍作修改。2×Es Taq MasterMix 10 μL、上游引物0.4 μL(10 μmol/L)、下游引物0.4 μL(10 μmol/L)、分离菌株DNA模板1 μL,ddH2O补至总体系20 μL。PCR扩增程序:95 ℃预变性5 min、95 ℃变性1 min、55 ℃退火50 s、72 ℃延伸1 min,共32 个循环,72 ℃延伸10 min。PCR扩增产物经2%琼脂糖凝胶电泳后在凝胶成像系统中观察检测结果。
表1 蜡样芽孢杆菌检测及毒力基因引物信息
Table 1 Primer sequences used for detection of B. cereus and identification of virulence genes

名称引物序列(5’-3’)目的基因产物大小/bp hblAhblA-FATTAATGGGGATGGAGAAACTT237 hblA-RTGATCCTAATACTTCTTCTAGACGCTT hblChblC-FCCTATCAATACTCTCGCAACACCAAT386 hblC-RTTTTCTTGATTCGTCATAGCCATTTCT hblDhblD-FAGATGCTACAAGACTTCAAAGGGAAACT436 hblD-RTGATTAGCACGATCTGCTTTCATACTT nheAnheA-FATTACAGGGTTATTGGTTACAGCAGT475 nheA-RAATCTTGCTCCATACTCTСТТGGATGCT nheBnheB-FCTGCAGCAGCTGTAGGCGGT328 nheB-RATGTTTTTCCAGCTATCTTTCGCAAT nheCnheC-FGCGGATATTGTAAAGAATTTCTAAAATGAGGT557 nheC-RTTTCCAGCTATCTTTCGCTTGTATGTAAAT entFMentFM-FAAAGAAATTAATGGACAAACTCAAACTCA596 entFM-RGTATGTAGCTGGGCCTGTACGT cytKcytK-FCGACGTCACAAGTTGTAACA565 cytK-RCGTGTGTAAATACCCAGTT cesces-FGCATTTCGTGAAGCAGAGGT699 ces-RCCCTTTATCCCCTTCGATGT cercer-FGCTAAAACGTGTACTTAGCTTAGG103 cer-RTATATACATTATGCGTCATCAC bceTbceT-FGACTACATTCACGATTACGCAGAA701 bceT-RCTATGCTGACGAGCTACATCCATA crycry-FAAGATGGGCACGCAAGACTAG413 cry-RGTTCCAGCAGGATAAGCCATT gyrBgyrB-FATTGGTGACACCGATCAAACA365 gyrB-RTCATACGTATGGATGTTATTC基因名称引物
1.3.6 分离菌株的毒力基因检测
参考黄铭珊[19]、卢晓芸[20]等的方法合成hblA、hblC、hblD、nheA、nheB、nheC、entFM、cytK、bceT、ces和cer共计11 种与蜡样芽孢杆菌相关的毒力基因引物,由生工生物工程(上海)股份有限公司合成(表1)。单重PCR扩增体系参考黄铭珊[19]的方法并稍作修改。2×Es Taq MasterMix 10 μL、上下游引物各0.5 μL(10 μmol/L)、DNA模板1 μL,ddH2O补至总体系20 μL。单重PCR扩增程序:95 ℃预变性5 min、95 ℃变性40 s、55 ℃退火30 s、72 ℃延伸1 min,共35 个循环,72 ℃延伸10 min。多重PCR扩增体系参考姜菲菲等[21]的方法。2×Es Taq MasterMix 10 μL、上下游引物各0.5 μL(3 对,10 μmol/L)、DNA模板1 μL,ddH2O补至总体系20 μL。多重PCR扩增程序:96 ℃预变性5 min、96 ℃变性30 s、54 ℃退火30 s、72 ℃延伸30 s,30 个循环,72 ℃延伸10 min。PCR扩增产物经2%琼脂糖凝胶电泳后在凝胶成像系统中观察检测结果。
1.3.7 分离菌株的药敏试验
采用K-B纸片扩散法对8 株分离菌株进行药敏试验。药敏试验判定标准参考CLSI M100-S32(https://clsi.org/)中葡萄球菌属抑菌圈直径。蜡样芽孢杆菌药敏试验抑菌圈直径解释标准见表2。
表2 蜡样芽孢杆菌抑菌圈直径解释标准
Table 2 Interpretation criteria for inhibition zone diameter of B. cereus
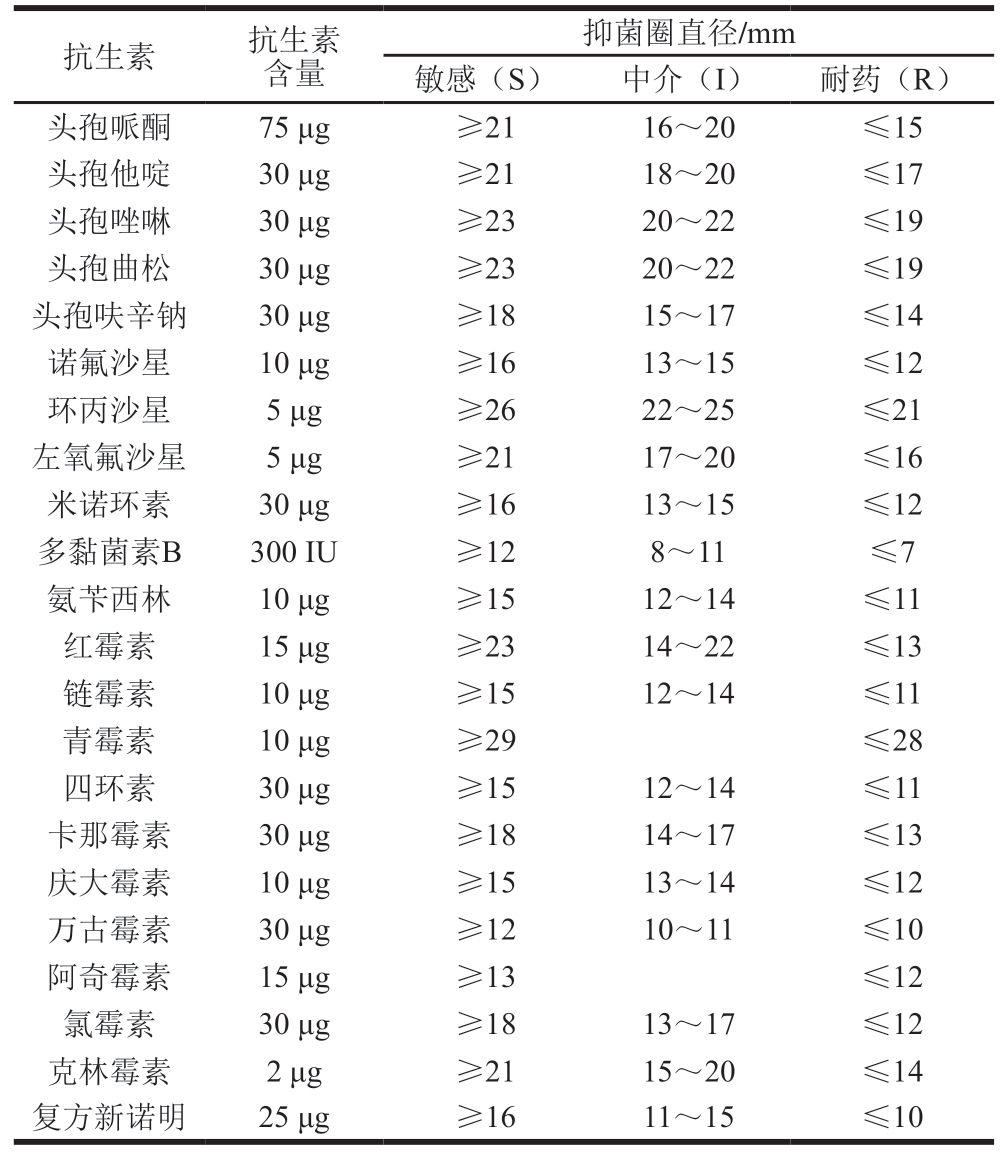
抑菌圈直径/mm敏感(S)中介(I)耐药(R)头孢哌酮75 μg≥2116~20≤15头孢他啶30 μg≥2118~20≤17头孢唑啉30 μg≥2320~22≤19头孢曲松30 μg≥2320~22≤19头孢呋辛钠30 μg≥1815~17≤14诺氟沙星10 μg≥1613~15≤12环丙沙星5 μg≥2622~25≤21左氧氟沙星5 μg≥2117~20≤16米诺环素30 μg≥1613~15≤12多黏菌素B300 IU≥128~11≤7氨苄西林10 μg≥1512~14≤11红霉素15 μg≥2314~22≤13链霉素10 μg≥1512~14≤11青霉素10 μg≥29≤28四环素30 μg≥1512~14≤11卡那霉素30 μg≥1814~17≤13庆大霉素10 μg≥1513~14≤12万古霉素30 μg≥1210~11≤10阿奇霉素15 μg≥13≤12氯霉素30 μg≥1813~17≤12克林霉素2 μg≥2115~20≤14复方新诺明25 μg≥1611~15≤10抗生素抗生素含量
使用的抗生素纸片包括多黏菌素B、氨苄西林、米诺环素、头孢哌酮、头孢他啶、头孢唑啉、诺氟沙星、环丙沙星、左氧氟沙星、红霉素、链霉素、氯霉素、四环素、青霉素、卡那霉素、头孢曲松、庆大霉素、万古霉素、阿奇霉素、复方新诺明、头孢呋辛钠和克林霉素共计22 种。分别吸取各分离菌株菌悬液均匀涂布在MYP平板上,抗生素纸片间隔放置于MYP平板上,将平板倒置于(30±1)℃培养箱中培养24 h。待培养完毕取出平板,用游标卡尺测量各抗生素的抑菌圈直径,记录耐药情况。
1.4 数据处理与分析
所有实验均重复3 次,结果以平均值±标准差表示。使用Excel 2021软件对数据进行整理和绘图;使用SPSS 26.0软件对数据进行统计和方差分析(P<0.05)。
2 结果与分析
2.1 蜡样芽孢杆菌的分离计数结果
蜡样芽孢杆菌在原料鸡肉及香辛料中未检出。如图1所示,加工过程中斩拌刀具上的蜡样芽孢杆菌污染量为1.108 7(lg(CFU/cm2))、解冻车间台面的蜡样芽孢杆菌污染量为2.573 5(lg(CFU/cm2))、斩拌过程中的蜡样芽孢杆菌污染量为0.778 2(lg(CFU/cm2))、解冻台面的蜡样芽孢杆菌污染量为4.230 5(lg(CFU/cm2))、灌肠过程中的蜡样芽孢杆菌污染量为5.376 3(lg(CFU/cm2))。这表明低温鸡肉肠在生产过程中极易受蜡样芽孢杆菌污染,在加工环节蜡样芽孢杆菌污染较为严重,尤以灌肠过程污染最为严重。在5 种腐败鸡肉肠样品中均检出蜡样芽孢杆菌,污染量分别为3.021 1、2.916 3、1.150 6、2.329 5、2.298 9(lg(CFU/g))。虽然其含量均低于我国对蜡样芽孢杆菌引起食物中毒的判定标准含量5(lg(CFU/g)),但有研究[22]表明,小于判定标准含量的蜡样芽孢杆菌也可能引起食物中毒,因此该结果也应引起重视。将检出蜡样芽孢杆菌样品编号并挑取菌株A3、A4、A6、B4、C2、D4、D7和E3进行下一步研究。
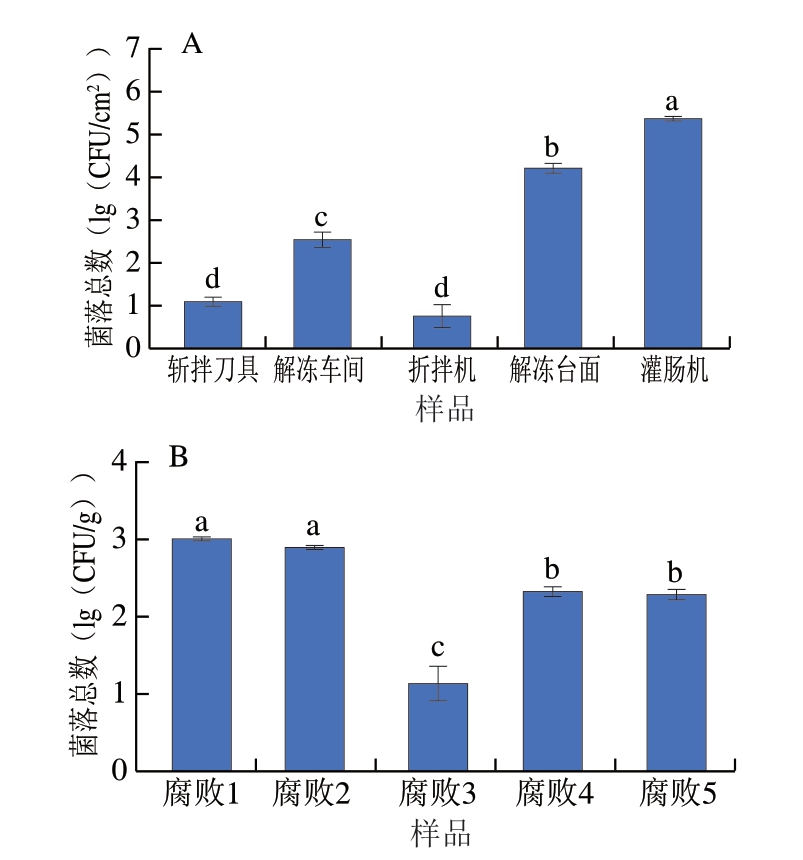
图1 蜡样芽孢杆菌的分离计数
Fig. 1 Isolation and counting of B. cereus
A.环境样品;B.腐败样品。小写字母不同表示组间差异显著(P<0.05)。
2.2 分离菌株的形态学观察结果
如图2所示,分离菌株在LB肉汤固体平板上培养24 h后形成的菌落呈乳白色、不透明、表面粗糙似毛玻璃状或融蜡状、边缘呈扩展状;在MYP平板上形成的菌落为微粉红色,周围有白色至淡粉色沉淀环。如图3所示,革兰氏染色后分离菌株为紫色的杆菌,菌体两端比较平整,呈链状排列。以上结果表明分离菌株与蜡样芽孢杆菌的形态特征符合,但仍需结合其他方法作进一步鉴定。
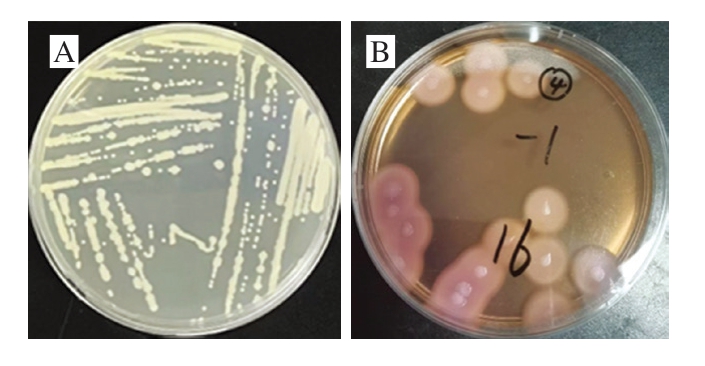
图2 分离菌株在LB肉汤固体平板(A)与MYP平板(B)上的菌落形态
Fig. 2 Colony morphology of isolated strains on LB broth solid plate (A) and MYP plate (B)
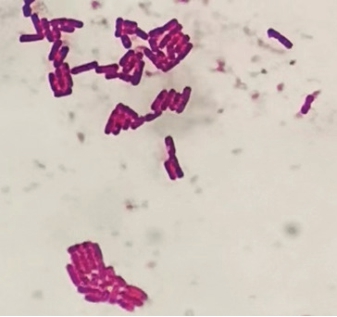
图3 分离菌株革兰氏染色镜检图
Fig. 3 Microscopic image of Gram-stained isolates
2.3 分离菌株的生化鉴定结果
由表3可知,8 株分离菌株的过氧化氢酶、西蒙氏枸椽酸盐、动力、V-P、硝酸盐还原、明胶、葡萄糖、溶菌酶肉汤和淀粉水解试验结果均呈阳性,甘露醇产酸试验结果为阴性,与蜡样芽孢杆菌生化特征一致,故可将8 株分离菌株判定为蜡样芽孢杆菌疑似菌株。
表3 分离菌株的生化试验结果
Table 3 Biochemical test results of isolated strains

注:+.阳性;-.阴性。
试验项目A3A4A6B4C2D4D7E3过氧化氢酶++++++++西蒙氏枸椽酸盐++++++++动力++++++++V-P++++++++硝酸盐还原++++++++明胶++++++++葡萄糖++++++++溶菌酶肉汤++++++++淀粉水解++++++++甘露醇产酸--------
2.4 分离菌株的16S rDNA测序鉴定结果及系统发育进化树分析
如图4所示,8 株分离菌株在1 500 bp处均出现清晰、明亮的条带。将8 株分离菌株的测序结果在NCBI进行BLAST比对,将相似度最高的序列在MEGA-X软件进行同源性比对并建立系统发育进化树。如图5所示,分离菌株与蜡样芽孢杆菌标准菌株的同源性可达95%以上。但是分离菌株与其他芽孢杆菌尤其是苏云金芽孢杆菌的同源性也较高,这表明蜡样芽孢杆菌与其他芽孢杆菌较难区分,仅凭16S rDNA测序结果无法对分离菌株进行准确、可靠的鉴定。
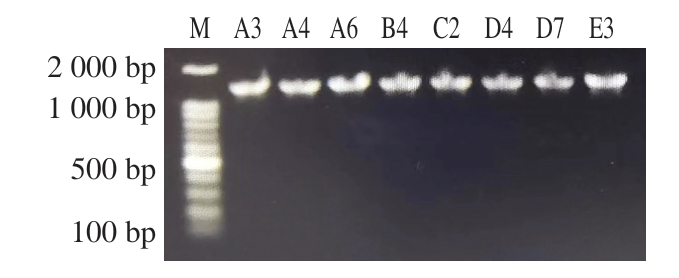
图4 分离菌株16S rDNA的PCR产物电泳图
Fig. 4 Electropherogram of PCR products of the 16S rDNA gene of isolated strains
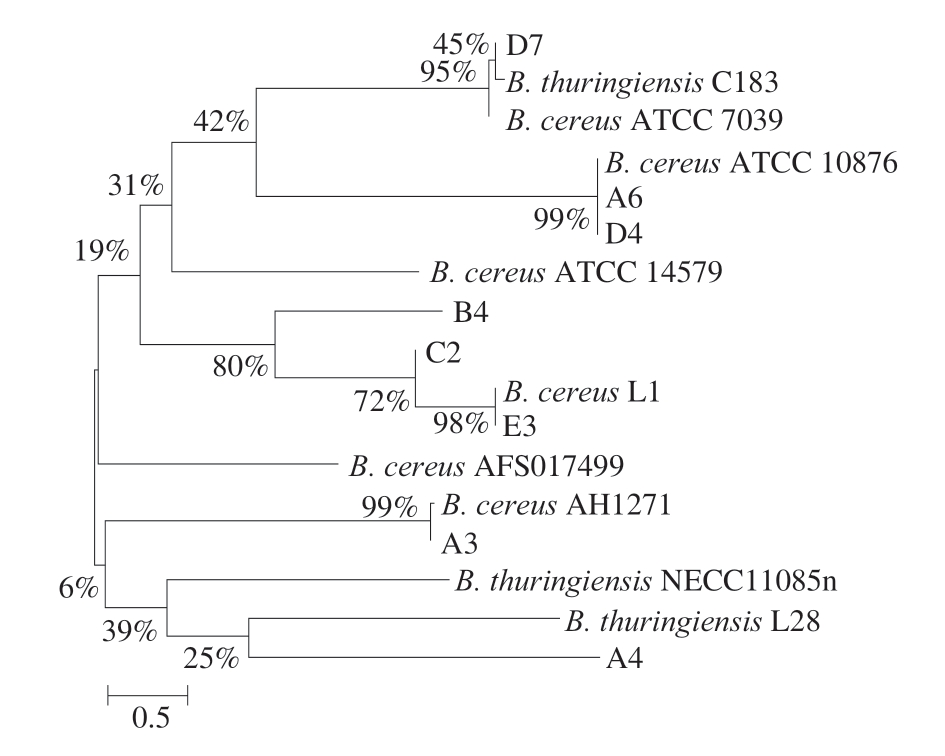
图5 分离菌株的16S rDNA系统发育进化树
Fig. 5 Phylogenetic tree based on 16S rDNA gene sequences of isolated strains
2.5 分离菌株gyrB和cry基因的检测结果及分析
由于16S rDNA具有高度保守性且分子质量较小,难以区分相似度极高的近缘亲属种,而gyrB基因进化速率比16S rDNA快,普遍存在于细菌中并且不会发生频繁的水平转移,在不同的蛋白及蛋白的不同位点,其氨基酸替代率也不同,故在区分鉴定近缘亲属种中具有优势[23-24]。苏云金芽孢杆菌与蜡样芽孢杆菌的鉴定存在许多争议,二者菌落形态相似、生化性状相近、全基因组相似性高(达90%以上),较难区分[25-26]。cry基因作为苏云金芽孢杆菌的特异性基因,可用于区分蜡样芽孢杆菌和苏云金芽孢杆菌。如图6所示,8 株分离菌株的管家基因gyrB检出率为100%;苏云金芽孢杆菌的特异性基因cry检出率为0%。结合生化鉴定试验结果、16S rDNA测序结果可将8 株分离菌株判定为蜡样芽孢杆菌。
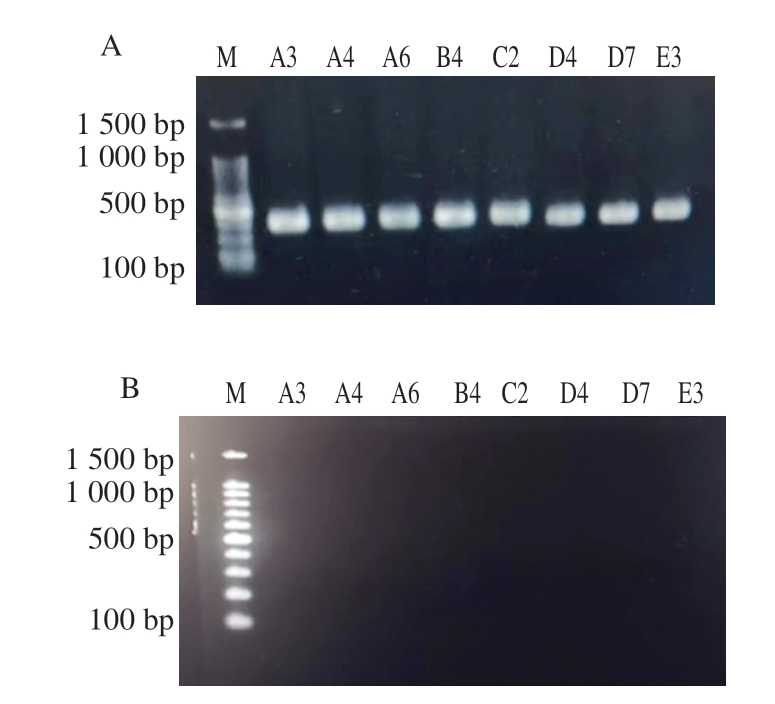
图6 分离菌株的管家基因gryB(A)和苏云金芽孢杆菌特异性基因cry(B)的PCR产物电泳图
Fig. 6 Eletropherograms of PCR products of the house-keeping gene gryB (A) and the B. thuringiensis specific gene cry (B) of isolated strains
2.6 分离菌株毒力基因的检测结果及分析
由表4和图7可知,8 株分离菌株均至少携带5 种以上的毒力基因。其中,菌株A3携带除呕吐毒素基因ces之外的所有毒力基因,表明其携带毒力基因种类众多,能够产生多种毒素。非溶血性肠毒素基因中,nheA、nheB和nheC检出率分别为62.5%、100%和100%,这和其他报道[27-29]中蜡样芽孢杆菌非溶血性肠毒素基因携带率最高较为一致。其中5 株菌株同时携带nheA、nheB、nheC基因,表明这5 株菌株有强致腹泻功能。溶血素基因中,hblA、hblC和hblD检出率分别为75%、50%和87.5%。林垲等[30]认为当蜡样芽孢杆菌同时携带hblA、hblC和hblD基因时可产生溶血素。其中3 株菌株同时携带hblA、hblC、hblD基因,表明这3 株菌株会产生溶血素。呕吐毒素基因ces检出率为0%,cer检出率为62.5%。孔丽[15]在176 株肉与肉制品源蜡样芽孢杆菌中仅检测到5 株(3%)携带呕吐毒素基因ces,这也表明肉制品中蜡样芽孢杆菌呕吐毒素基因ces携带率较低。虽然其检出率相对较低,但是呕吐毒素较难灭活,不容忽视。肠毒素T基因bceT和肠毒素FM基因entFM检出率分别为75%和100%,细胞毒素K基因cytK检出率为62.5%。白凤岚等[31]研究表明,食品中蜡样芽孢杆菌的非溶血性肠毒素基因、细胞毒素K基因、肠毒素FM基因和肠毒素T基因检出率较高,这与本研究结果相近。综上所述,低温鸡肉肠中蜡样芽孢杆菌携带的毒力基因种类较多,以非溶血性肠毒素基因为主,消费者食用后易引起腹泻、呕吐等症状。
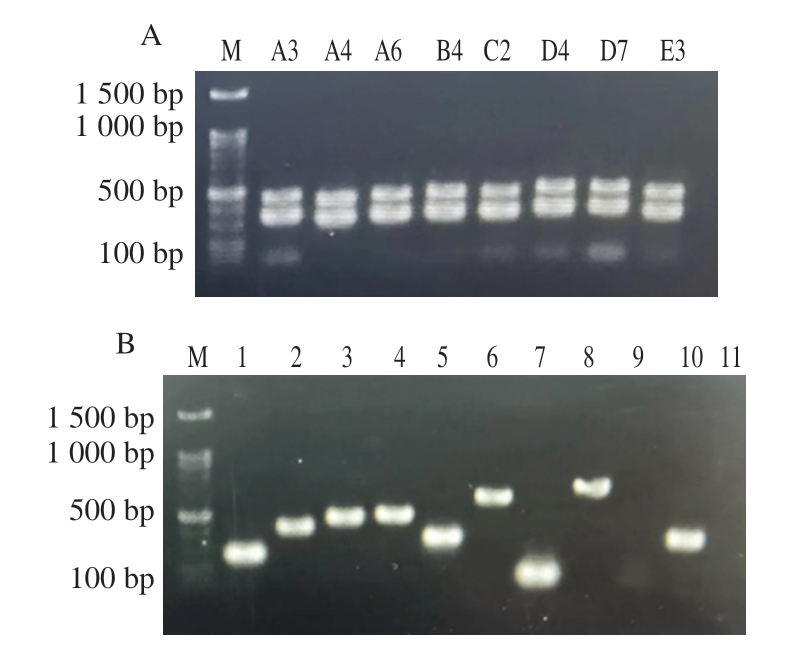
图7 分离菌株部分毒力基因的PCR产物电泳图
Fig. 7 Electropherograms of PCR products of some virulence genes of isolated strains
A.分离菌株的nheA、hblC和cer基因扩增结果;B.分离菌株C2的毒力基因扩增结果,泳道1. hblA;泳道2. hblC;泳道3.hblD;泳道4. nheA;泳道5. nheB;泳道6. nheC;泳道7. cer;泳道8. bceT;泳道9. cytK;泳道10. entFM;泳道11. ces。
表4 分离菌株的毒力基因检测结果
Table 4 Results of virulence gene detection in isolated strains
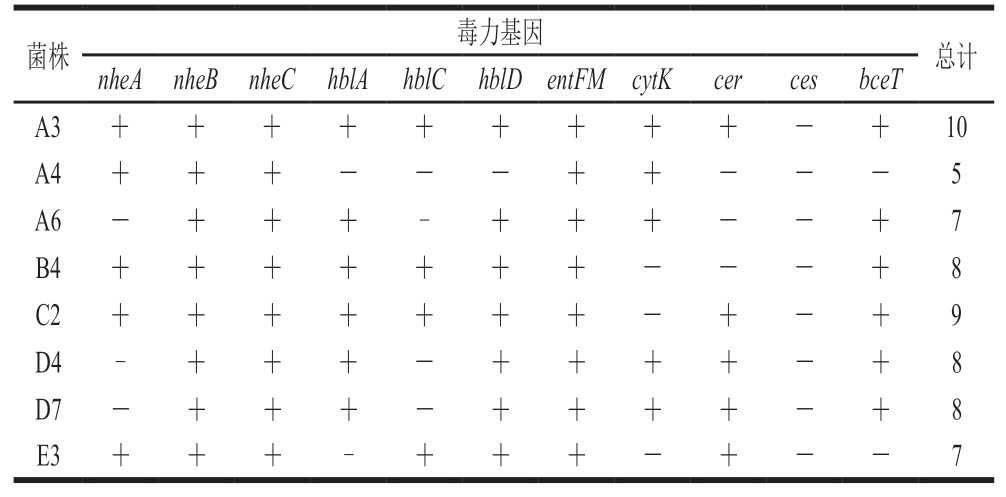
菌株毒力基因总计nheA nheB nheC hblA hblC hblD entFM cytKcercesbceT A3+++++++++-+10 A4+++---++---5 A6-+++-+++--+7 B4+++++++---+8 C2+++++++-+-+9 D4-+++-++++-+8 D7-+++-++++-+8 E3+++-+++-+--7
2.7 药敏性试验结果与分析
抗菌药物的使用可导致蜡样芽孢杆菌耐药性增强,具有多重耐药性的蜡样芽孢杆菌将更难杀灭。通过对蜡样芽孢杆菌菌株进行药敏试验可确定其耐药性现状,监测其耐药性变化趋势,确定抗菌药物的适用范围等。由表5可知,8 株分离菌株对头孢他啶、头孢唑啉、氨苄西林、链霉素、青霉素、卡那霉素、复方新诺明和头孢呋辛钠8 种抗生素均有耐药性;对诺氟沙星、环丙沙星、左氧氟沙星、多黏菌素B、红霉素、庆大霉素、万古霉素、阿奇霉素、氯霉素和克林霉素10 种抗生素敏感,表现出多重耐药性。其中,A3、A6、C2和E3菌株对米诺环素中度敏感,B4、D4和D7菌株对米诺环素敏感,A4菌株对米诺环素耐药;A4、A6、B4、C2、D4和D7菌株对头孢哌酮敏感,A3和E3菌株对头孢哌酮中度敏感;A3、A4、A6、C2、D4、D7和E3菌株对四环素中度敏感,B4菌株对四环素敏感;A6、B4、C2和D4菌株对头孢曲松中度敏感,A3、A4、D7和E3菌株对头孢曲松耐药。表明从鸡肉肠中分离出的蜡样芽孢杆菌耐药性较强,对多种抗生素均有不同程度的耐药性。
表5 分离菌株药敏性试验结果
Table 5 Drug susceptibility of isolated strains
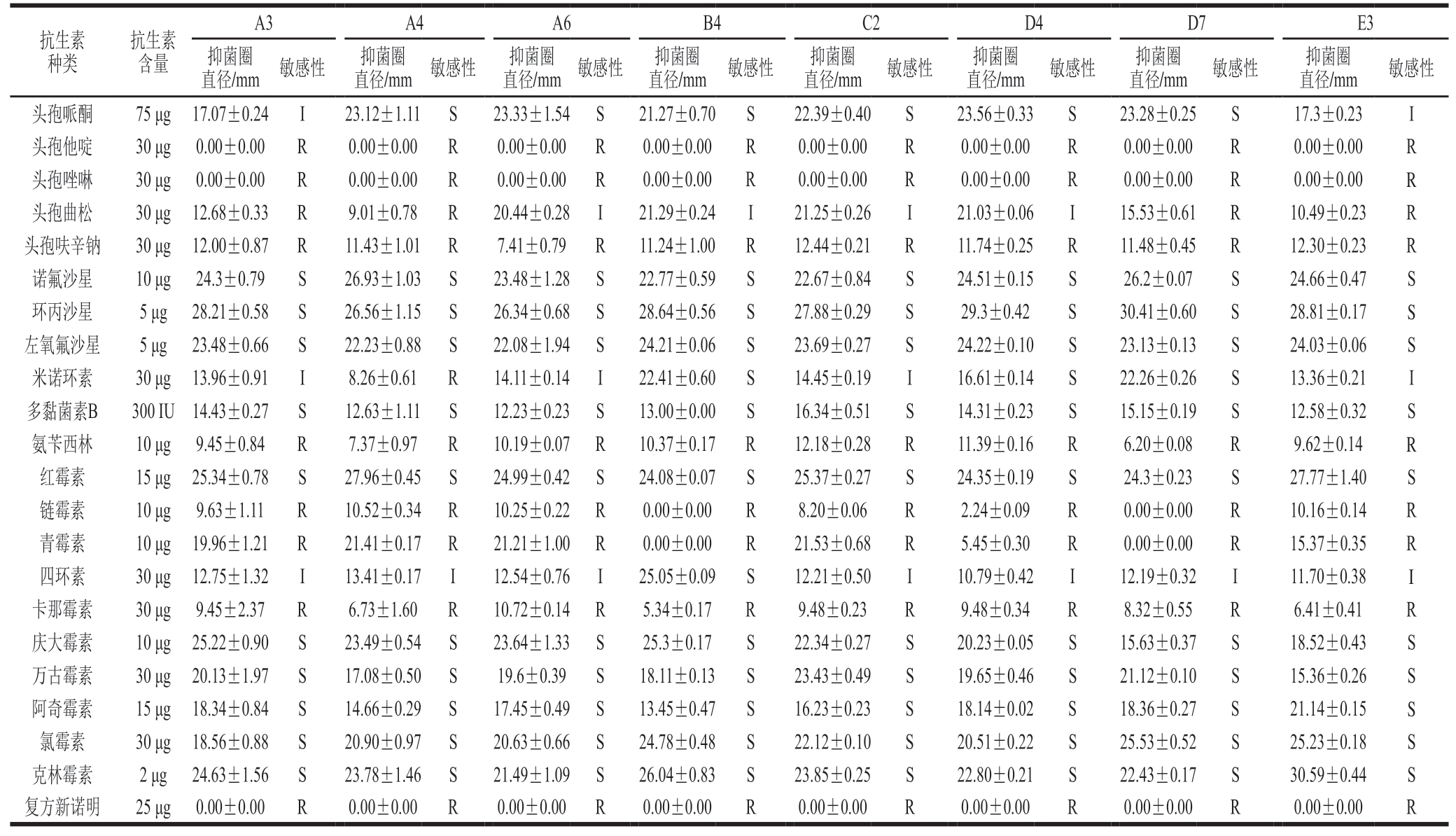
抗生素种类抗生素含量A3A4A6B4C2D4D7E3抑菌圈直径/mm 敏感性抑菌圈直径/mm 敏感性抑菌圈直径/mm 敏感性抑菌圈直径/mm 敏感性抑菌圈直径/mm 敏感性抑菌圈直径/mm 敏感性抑菌圈直径/mm 敏感性抑菌圈直径/mm敏感性头孢哌酮75 μg 17.07±0.24I23.12±1.11S23.33±1.54 S21.27±0.70S22.39±0.40S23.56±0.33S23.28±0.25S17.3±0.23I头孢他啶30 μg 0.00±0.00R0.00±0.00R0.00±0.00R0.00±0.00R0.00±0.00R0.00±0.00R0.00±0.00R0.00±0.00R头孢唑啉30 μg 0.00±0.00R0.00±0.00R0.00±0.00R0.00±0.00R0.00±0.00R0.00±0.00R0.00±0.00R0.00±0.00R头孢曲松30 μg 12.68±0.33R9.01±0.78R20.44±0.28I21.29±0.24I21.25±0.26I21.03±0.06I15.53±0.61R10.49±0.23R头孢呋辛钠30 μg 12.00±0.87R11.43±1.01 R7.41±0.79R11.24±1.00R12.44±0.21R11.74±0.25R11.48±0.45R12.30±0.23R诺氟沙星10 μg 24.3±0.79S26.93±1.03S23.48±1.28 S22.77±0.59S22.67±0.84S24.51±0.15S26.2±0.07S24.66±0.47S环丙沙星5 μg 28.21±0.58S26.56±1.15S26.34±0.68 S28.64±0.56S27.88±0.29S29.3±0.42S30.41±0.60S28.81±0.17S左氧氟沙星5 μg 23.48±0.66S22.23±0.88S22.08±1.94 S24.21±0.06S23.69±0.27S24.22±0.10S23.13±0.13S24.03±0.06S米诺环素30 μg 13.96±0.91I8.26±0.61R14.11±0.14I22.41±0.60S14.45±0.19I16.61±0.14S22.26±0.26S13.36±0.21I多黏菌素B300 IU 14.43±0.27S12.63±1.11S12.23±0.23 S13.00±0.00S16.34±0.51S14.31±0.23S15.15±0.19S12.58±0.32S氨苄西林10 μg 9.45±0.84R7.37±0.97R10.19±0.07 R10.37±0.17R12.18±0.28R11.39±0.16R6.20±0.08R9.62±0.14R红霉素15 μg 25.34±0.78S27.96±0.45S24.99±0.42 S24.08±0.07S25.37±0.27S24.35±0.19S24.3±0.23S27.77±1.40S链霉素10 μg 9.63±1.11R10.52±0.34 R10.25±0.22 R0.00±0.00R8.20±0.06R2.24±0.09R0.00±0.00R10.16±0.14R青霉素10 μg 19.96±1.21R21.41±0.17 R21.21±1.00 R0.00±0.00R21.53±0.68R5.45±0.30R0.00±0.00R15.37±0.35R四环素30 μg 12.75±1.32I13.41±0.17I12.54±0.76I25.05±0.09S12.21±0.50I10.79±0.42I12.19±0.32I11.70±0.38I卡那霉素30 μg 9.45±2.37R6.73±1.60R10.72±0.14 R5.34±0.17R9.48±0.23R9.48±0.34R8.32±0.55R6.41±0.41R庆大霉素10 μg 25.22±0.90S23.49±0.54S23.64±1.33 S25.3±0.17S22.34±0.27S20.23±0.05S15.63±0.37S18.52±0.43S万古霉素30 μg 20.13±1.97S17.08±0.50S19.6±0.39S18.11±0.13S23.43±0.49S19.65±0.46S21.12±0.10S15.36±0.26S阿奇霉素15 μg 18.34±0.84S14.66±0.29S17.45±0.49 S13.45±0.47S16.23±0.23S18.14±0.02S18.36±0.27S21.14±0.15S氯霉素30 μg 18.56±0.88S20.90±0.97S20.63±0.66 S24.78±0.48S22.12±0.10S20.51±0.22S25.53±0.52S25.23±0.18S克林霉素2 μg 24.63±1.56S23.78±1.46S21.49±1.09 S26.04±0.83S23.85±0.25S22.80±0.21S22.43±0.17S30.59±0.44S复方新诺明25 μg 0.00±0.00R0.00±0.00R0.00±0.00R0.00±0.00R0.00±0.00R0.00±0.00R0.00±0.00R0.00±0.00R
3 讨 论
鸡肉肠作为一种营养丰富、风味独特的食品备受欢迎,其安全性不容忽视。本研究对低温鸡肉肠中的蜡样芽孢杆菌进行分离计数,在原料鸡肉和香辛料辅料中并未检出蜡样芽孢杆菌,在各腐败样品和加工环境样品中均检出蜡样芽孢杆菌,表明鸡肉肠在加工过程中易受蜡样芽孢杆菌污染。这可能是因为蜡样芽孢杆菌的芽孢耐高温,常规热处理难以灭活,并且蜡样芽孢杆菌可产生生物膜,其附着在食品加工设备上可带来持续污染[32]。蜡样芽孢杆菌携带毒素与其毒力基因相关,毒力基因检测结果表明,8 株分离菌株均携带至少5 种毒力基因,其中从腐败样品1中分离得到的A3菌株携带10 种毒力基因,是检出毒力基因最多的1 株蜡样芽孢杆菌,表明该菌株可产生多种毒素,潜在致病能力较强。因此,在鸡肉肠生产过程中应加强卫生管理,严格执行食品安全管理制度、规范操作;相关部门应加大低温肉类食品中蜡样芽孢杆菌污染监管力度。
抗生素是治疗细菌感染的重要药物,然而,抗生素的过度使用可能导致细菌产生多重耐药性[33]。本研究发现8 株菌株对头孢他啶、头孢唑啉、氨苄西林、链霉素、青霉素、卡那霉素、复方新诺明和头孢呋辛钠8 种抗生素耐药;对诺氟沙星、环丙沙星、左氧氟沙星、多黏菌素B、红霉素、庆大霉素、万古霉素、阿奇霉素、氯霉素和克林霉素10 种抗生素敏感。这与杨高继等[34]的研究结果相似,但与四环素等抗生素耐药性结果存在一定的差异,可能与样品来源的地区、食物种类以及菌株基因突变、自身特性等因素有关。
4 结 论
鸡肉肠腐败样品中蜡样芽孢杆菌污染程度高,所含毒力基因情况复杂并且对多种抗生素具有耐药性,具有较高的食源性致病风险。本研究结果可为低温肉制品中蜡样芽孢杆菌研究及相关企业合理制定蜡样芽孢杆菌污染预防方案提供参考。
[1] 闫韶飞, 闫旭, 甘辛, 等. 我国市售婴儿配方乳粉中蜡样芽孢杆菌污染及其毒力基因调查[J]. 中国食品卫生杂志, 2015, 27(3): 286-291.DOI:10.13590/j.cjfh.2015.03.014.
[2] ELAFIFY M, ALSAYEQH A F, ALJASIR S F, et al. Occurrence and characterization of toxigenic Bacillus cereus in dairy products with an inactivation trial using D-tryptophan and ascorbic acid in the rice pudding[J]. LWT-Food Science and Technology, 2023, 175: 114485.DOI:10.1016/j.lwt.2023.114485.
[3] 许涵秋. 食品中蜡样芽孢杆菌检验方法验证结果分析[J]. 安徽农业科学, 2023, 51(9): 184-189. DOI:10.3969/j.issn.0517-6611.2023.
[4] KWON M J, LEE C L, YOON K S. Risk comparison of the diarrheal and emetic type of Bacillus cereus in Tofu[J]. Microorganisms, 2019,7(11): 536. DOI:10.3390/microorganisms7110536.
[5] NAVANEETHAN Y, EFFARIZAH M E. Post-cooking growth and survival of Bacillus cereus spores in rice and their enzymatic activities leading to food spoilage potential[J]. Foods, 2023, 12(3): 626.DOI:10.3390/foods12030626.
[6] LI Y M, LUO L, WANG W H, et al. Synergistic antibacterial activity of cell wall hydrolase Lys14579 combined with cinnamaldehyde against emetic Bacillus cereus and their application in foods[J]. Food Control, 2024, 164: 110562. DOI:10.1016/j.foodcont.2024.110562.
[7] 杨代泽. 内蒙古某地区奶牛乳腺炎源病原菌分离鉴定及蜡样芽孢杆菌耐药和毒力特性研究[D]. 扬州: 扬州大学, 2023: 6-10.DOI:10.27441/d.cnki.gyzdu.2023.000826.
[8] 金泽坤. 腐乳中蜡样芽孢杆菌的分离鉴定、毒性分析及大蒜精油的抑菌作用与机理研究[D]. 广州: 华南理工大学, 2021: 1-9.DOI:10.27151/d.cnki.ghnlu.2021.005074.
[9] 张明明, 梁美丹, 肖剑, 等. 即食米面制品中蜡样芽孢杆菌分离鉴定及毒力基因研究[J]. 食品工业科技, 2019, 40(22): 144-150.DOI:10.13386/j.issn1002-0306.2019.22.026.
[10] 曾沐芝. 大豆-鸡肉呈味基料的制备及其在鸡肉肠中应用研究[D].广州: 华南理工大学, 2022: 76-77. DOI:10.27151/d.cnki.ghnlu.2022.002382.
[11] 张志刚, 林祥木, 胡涛, 等. 即食肉制品微生物污染及其控制技术研究进展[J]. 肉类研究, 2020, 34(1): 94-102. DOI:10.7506/rlyj1001-8123-20191107-269.
[12] 杨舒然. 中国熟肉制品产销全程微生物污染研究[D]. 北京:中国疾病预防控制中心, 2019: 1-6. DOI:10.27511/d.cnki.gzyyy.2019.000011.
[13] 李玲, 刘耀, 魏元苗, 等. 食品中蜡样芽孢杆菌耐药性及其机制研究进展[J]. 微生物学通报, 2021, 48(12): 4943-4953. DOI:10.13344/j.microbiol.china.210251.
[14] XIAO D Y, TONG C H, YANG T M, et al. First insights into antimicrobial resistance, toxigenic profiles, and genetic diversity in Bacillus cereus isolated from Chinese sausages[J]. LWTFood Science and Technology, 2023, 181: 114717. DOI:10.1016/J.LWT.2023.114717.
[15] 孔丽. 肉与肉制品源蜡样芽孢杆菌的风险评估与防控技术研究[D]. 广州: 暨南大学, 2019: 18-29. DOI:10.27167/d.cnki.gjinu.2019.000051.
[16] KONG L, YU S B, YUAN X M, et al. An investigation on the occurrence and molecular characterization of Bacillus cereus in meat and meat products in China[J]. Foodborne Pathogens and Disease,2021, 18(5): 306-314. DOI:10.1089/fpd.2020.2885.
[17] 国家卫生和计划生育委员会. 食品安全国家标准 食品微生物学检验 蜡样芽孢杆菌检验: GB 4789.14—2014[S]. 北京: 中国标准出版社, 2014: 20.
[18] 卢佳琦, 李市场, 王大红, 等. 16S rDNA与gyrB序列联合法鉴定一株蜡样芽孢杆菌[J]. 河南科技大学学报(自然科学版), 2018, 39(1): 73-77; 83; 9. DOI:10.15926/j.cnki.issn1672-6871.2018.01.014.
[19] 黄铭珊. 蜡样芽孢杆菌多重PCR快速检测及PFGE分型[D]. 福州:福建医科大学, 2016: 20-25.
[20] 卢晓芸, 施怡茹, 吴丽珠, 等. 89 株蜡样芽孢杆菌食品分离株携带毒力基因情况及PFGE分型研究[J]. 检验医学与临床, 2023, 20(1): 18-21. DOI:10.3969/J.issn.1672-9455.2023.01.005.
[21] 姜菲菲, 李昊宇, 贾慧建, 等. 基于多重PCR技术检测蜡样芽孢杆菌3 种毒素基因方法的建立及评价[J]. 吉林大学学报(医学版), 2022,48(5): 1223-1228. DOI:10.13481/j.1671-587X.20220516.
[22] 李雁飞, 郭莹, 王蒋丽, 等. 学生午餐中蜡样芽孢杆菌污染状况毒力基因及耐药性分析[J]. 医学动物防制, 2023, 39(11): 1068-1071; 76.DOI:10.7629./yxdwfz202311011.
[23] 李献梅, 王小芬, 杨洪岩, 等. 促旋酶(gyrase)B亚单位基因gyrB在鉴别细菌近缘种中的应用[J]. 微生物学报, 2008(5): 701-706.DOI:10.13343/j.cnki.wsxb.2008.05.009.
[24] 安然, 易图永, 肖启明, 等. gyrB基因在细菌分类和检测中的应用[J]. 江西农业学报, 2010, 22(4): 18-20; 4. DOI:10.19386/j.cnki.jxnyxb.2010.04.006.
[25] 黄夏婵, 易子真知, 陈宝欣. 盒饭中蜡样芽孢杆菌的检测与鉴定研究[J]. 现代食品, 2019(4): 144-148. DOI:10.16736/j.cnki.cn41-1434/ts.2019.04.038.
[26] CHON J W, SEO K H. Evaluation of ceftazidime as an antibiotic supplement in mannitol-yolk-polymyxin B agar used for enumeration of Bacillus cereus in ready-to-eat vegetables[J]. Journal of Food Protection, 2021, 84(10): 1698-1703. DOI:10.4315/jfp-20-405.
[27] 张素, 方钰, 陈韵声, 等. 鸡蛋壳蜡样芽孢杆菌的分离鉴定及耐药性分析[J]. 中国畜牧兽医, 2022, 49(11): 4476-4484. DOI:10.16431/j.cnki.1671-7236.2022.11.039.
[28] 王萍, 陈琳, 乔勇升, 等. 2020—2022年泰州市售预包装糕点中蜡样芽孢杆菌毒力基因及耐药性[J]. 卫生研究, 2024, 53(1): 55-59.DOI:10.19813/j.cnki.weishengyanjiu.2024.01.008.
[29] SÁNCHEZ-CHICA J, CORREA M M, ACEVES-DIEZ A E, et al.A novel method for direct detection of Bacillus cereus toxin genes in powdered dairy products[J]. International Dairy Journal, 2020, 103:104625. DOI:10.1016/j.idairyj.2019.104625.
[30] 林垲, 雷婷, 吉俊芝, 等. 蜡样芽孢杆菌溶血素BL的表达及多克隆抗体的制备[J]. 黑龙江畜牧兽医, 2021(7): 81-85. DOI:10.13881/j.cnki.hljxmsy.2020.05.0027.
[31] 白凤岚, 陈松, 罗梦幽, 等. 食品中蜡样芽孢杆菌的分离及携带毒力基因的检测[J]. 现代食品科技, 2018, 34(10): 247-252; 4.DOI:10.13982/j.mfst.1673-9078.2018.10.033.
[32] 杨春晖, 王文平, 续丹丹. 腐乳及其生产过程中蜡样芽孢杆菌的防控及检测方法研究进展[J]. 中国调味品, 2023, 48(9): 214-220.DOI:10.3969/j.issn.1000-9973.2023.09.037.
[33] 秦希曦, 李文, 张雯, 等. 1 株食源性蜡样芽孢杆菌分离株的分子特征毒性及耐药性研究[J]. 中国食品卫生杂志, 2023, 35(8): 1183-1191. DOI:10.13590/j.cjfh.2023.08.008.
[34] 杨高继, 刘欢欢, 马艳, 等. 糙米中蜡样芽孢杆菌的分离鉴定及其毒力基因与药敏性检测[J]. 现代食品科技, 2020, 36(10): 290-299.DOI:10.13982/j.mfst.1673-9078.2020.10.0266.