热狗肠属于典型的低温熏煮类香肠制品,深受消费者喜爱,其生产工艺包括原料肉修整、绞制、斩拌(搅拌、乳化)、灌装、打结挂杆、热加工(熏煮)、冷却等[1]。由于灭菌温度低、食品介质干扰等因素易导致低温香肠腐烂变质,现已开发出多种保持肉制品品质的方法,如添加防腐剂、真空包装、冷藏等[2]。另外,通过拉伸膜真空包装和巴氏杀菌(95~110 ℃)技术,可保证热狗肠制品处于真空且商业无菌状态,也能提高产品货架期。虽然生产过程经过热加工和巴氏杀菌2 次杀菌工艺,但真空包装热狗肠中仍有一定数量的耐热型微生物存活[3]。例如,在冷藏(4 ℃左右)条件下,真空包装肉制品中的NaCl、NaNO2、低水分活度和低氧条件可以有效抑制革兰氏阴性腐败菌(包括假单胞菌、不动杆菌和肠杆菌)生长,但有利于乳酸菌生长[4-5],其中,乳杆菌属(Lactobacillus)、明串珠菌属(Leuconostoc)、乳球菌属(Lactococcus)、魏斯氏菌属(Weissella)及芽孢杆菌属(Bacillus)等均易引发真空包装肉制品发生腐败变质,如酸化、发黏、变色和产生不良风味等[6-7]。
在市场流通过程中,真空包装肉制品应贮藏于0~15 ℃中低温条件下,以降低微生物活性,但市场调查发现,真空包装肉制品实际通常处于室温或更高温度下,这为微生物生长繁殖创造有利条件,易导致产品出现涨袋、霉变等腐败变质问题[8]。与低温贮藏情况不同,室温贮藏条件下导致哈尔滨红肠腐败的主要细菌有葡萄球菌属(Staphylococcus)、假单胞菌属(Pseudomonas)和不动杆菌属(Acinetobacter)等[9]。然而,其他低温香肠制品在常温贮藏过程中的菌群结构变化却鲜有报道。因此,检测真空包装热狗肠在生产和贮藏过程(尤其是室温贮藏)中菌群结构动态变化,可为延长其货架期提供重要参考。
肉制品中微生物多样性分析主要依赖于微生物培养和分离纯化方法,然而,传统的微生物分离纯化技术仅能培养出0.1%~3.0%的细菌,并不能代表整个生境中的微生物菌落结构[10]。16S rDNA在原核细胞中保守性高、拷贝数高,通过设计相应引物扩增16S rDNA保守区域中单个或多个可变区,并对其进行测序即可获得样品菌群结构情况。基于16S rDNA测序已开发出多种检测生境中物种多样性的分子生物学方法,其中包括聚合酶链式反应(polymerase chain reaction,PCR)变性梯度凝胶电泳和16S rDNA高通量测序。PCR变性梯度凝胶电泳步骤较为繁琐,需要进行凝胶分析和条带测序,且对稀有种群的检测效率较低[11-12],而16S rDNA高通量测序技术直接对样品中的基因组片段进行测序,获得的reads数量高并且能够发掘一些低丰度的未知种群,目前,该技术已广泛应用于肉制品腐败过程菌群演替研究[13-16]。本研究基于16S rDNA高通量测序和传统的微生物分离纯化技术分析真空包装热狗肠在生产和贮藏过程中微生物群落的动态变化,揭示不同生产工艺流程对真空包装热狗肠微生物多样性的影响,同时确定对产品安全和品质有影响的生产工艺关键点及优势菌群,为产品质量改进提供理论指导。
1 材料与方法
1.1 材料与试剂
样品采集于河南省某肉联厂玉米热狗肠生产线同一批次不同时间点,包括鸡肉、乳化脂、斩拌物、玉米粒、肉馅、半成品1、半成品2、半成品3、半成品4、半成品5,样品信息详见表1。
表1 玉米热狗肠加工与贮藏过程中微生物样品来源
Table 1 Sources of microbial samples during the processing and storage of corn-added hot dog sausage
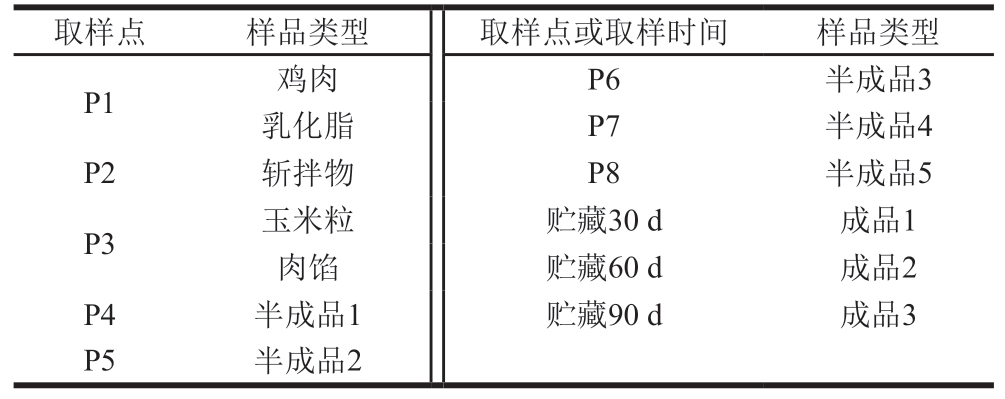
注:取样点与图1对应。
取样点样品类型取样点或取样时间样品类型P1鸡肉P6半成品3乳化脂P7半成品4 P2斩拌物P8半成品5 P3玉米粒贮藏30 d成品1肉馅贮藏60 d成品2 P4半成品1贮藏90 d成品3 P5半成品2
平板计数琼脂(plate count agar,PCA)培养基、0.9 g/100 mL NaCl溶液、细菌基因组DNA快速提取试剂盒、琼脂糖凝胶纯化回收试剂盒 北京博迈德基因技术有限公司;Phanta Flash高保真DNA聚合酶 南京诺唯赞生物科技股份有限公司;通用测序引物27F和1492R生工生物工程(上海)股份有限公司。
1.2 仪器与设备
BILON-09拍打式无菌均质机 上海比朗仪器制造有限公司;LRH-250F生化培养箱 上海一恒科学仪器有限公司;ETC 811 PCR仪 北京东胜创新生物科技有限公司;MINI Space凝胶图像分析系统 上海天能科技有限公司。
1.3 方法
1.3.1 玉米热狗肠制作工艺
玉米热狗肠的生产工艺见图1,原料有鸡肉、猪肉、白砂糖、味精、香辛料、胶原蛋白肠衣、食品添加剂(Nisin、亚硝酸钠、山梨酸钾、乳酸钠、双乙酸钠)。工艺流程主要包括原料肉经修整、绞制、斩拌后加玉米粒进行搅拌,经过罐装、蒸煮、烟熏、剪节和二次灭菌(95 ℃、15~20 min)等工艺,制得玉米热狗肠成品。
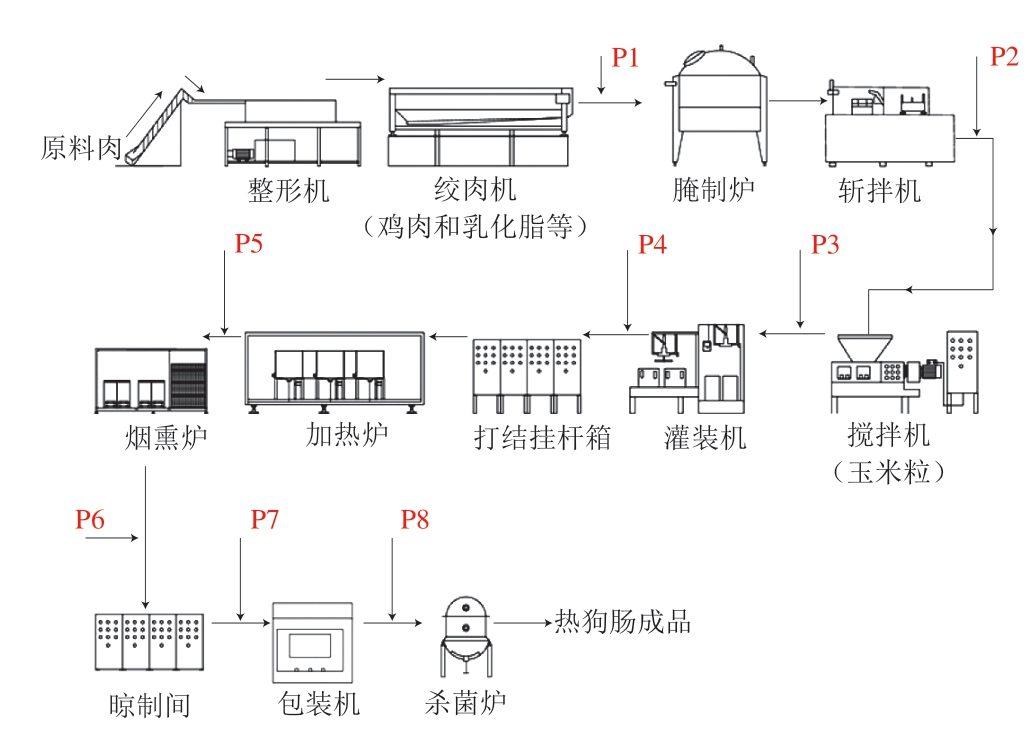
图1 玉米热狗肠的生产工艺流程
Fig. 1 Process flow chart for the production of corn-added hot dog sausage
1.3.2 样品收集
选择玉米热狗肠生产过程中的不同工艺点进行取样,分3 个批次取样,每批次取10 份样品,检测不同样品的菌群结构,分析其微生物多样性和优势菌群。此外,为模拟市场流通过程中玉米热狗肠的真实贮藏环境,将3 批次成品玉米热狗肠分别置于室温(25 ℃)贮藏90 d,每隔30 d取样检测样品菌群结构,分析其微生物多样性和优势菌群。
1.3.3 微生物多样性检测
提取各玉米热狗肠样品中微生物总基因组,采用Illumina平台对样品中微生物的16S rDNA基因V3~V4区域进行测序(二代测序),采用Pacbio三代测序平台对样品中微生物的16S rDNA基因全长进行测序(三代测序)。采用DADA2方法对测序所得原始序列去引物、质量过滤、去噪、去嵌合体、去除重复序列,获得扩增子序列变体(amplicon sequence variants,ASVs)。将二代测序获得的ASVs与Greengenes数据库(https://ftp.microbio.me/greengenes_release/current/)进行比对,三代测序获得的ASVs与美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)非冗余核酸序列数据库进行比对,进行分类学(界、门、纲、目、科、属、种)注释及组成分析。
1.3.4 优势菌群分离、纯化和鉴定
分别称取约25 g玉米热狗肠样品置于无菌均质袋中,添加225 mL无菌生理盐水,利用均质机混匀后进行梯度稀释,获得一系列稀释样品,选择适宜稀释度样品涂布于PCA固体平板,37 ℃培养至有菌落生成,进行平板划线分离纯化。
将单菌落接种到LB液体培养基中进行扩大培养后,采用细菌基因组DNA快速提取试剂盒提取基因组DNA,采用引物27F和1492R扩增16S rDNA序列,切胶回收后送生工生物工程(上海)股份有限公司测序,将测序结果提交至NCBI进行核酸BLAST比对,对细菌进行分类学鉴定。
1.4 数据处理
利用QIIME2软件对测序数据进行分析和绘图,采用SPSS 18.0软件对样品的α多样性指数(Chao1指数和Shannon指数)进行单因素方差分析,P<0.05表示差异显著。
2 结果与分析
2.1 高通量测序片段质量分析
采用DADA2方法处理二代测序原始序列,按照100%相似度聚类去除相似序列后,获得约593 052 条高质量ASVs,其中,约93% ASVs长度在407~430 bp之间。由图2A可知,二代测序注释到属水平的ASVs数量最高。为进一步从种水平上对玉米热狗肠菌群结构进行鉴定,利用DADA2方法处理三代测序原始序列,获得约163 724 条高质量ASVs,且大部分ASVs长度集中于1 400~1 500 bp之间。由图2B可知,三代测序主要从种水平上对物种进行注释。
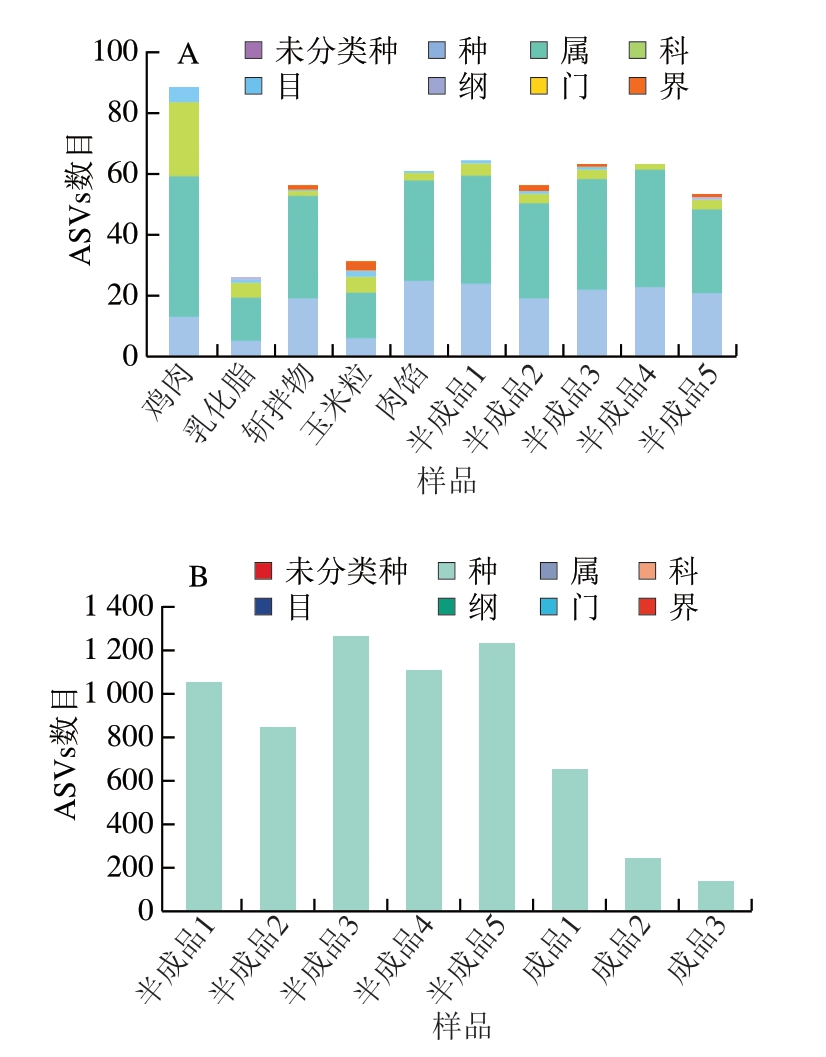
图2 基于二代测序(A)与三代测序(B)的物种分类学注释图
Fig. 2 Taxonomic annotation of microorganisms based on second- (A) and third- (B) generation sequencing
2.2 微生物多样性分析
α多样性指标中,Chao1指数和Shannon指数可以评估物种丰富度和多样性,Chao1指数越大,表明菌群的丰富度越高;Shannon指数越大,表明菌群的多样性越高[17]。肉制品中腐败菌主要来源于原辅料、加工过程及环境等[18-19]。由表2可知,鸡肉样品Chao1指数和Shannon指数均显著高于其他样品(P<0.05),说明鸡肉制品中物种丰富度和多样性最高。乳化脂和玉米粒中Chao1指数和Shannon指数显著低于其他样品(P<0.05),低温乳化香肠中食源性致病菌主要来源于原料肉和加工介质,尤其是绞肉、斩拌和灌装等工艺流程中的交叉污染[20]。综上,本研究中玉米热狗肠原料肉(鸡肉)中微生物多样性和丰富度显著高于其他样品,而混合玉米粒和灌装前后微生物多样性和丰富度并未发生显著变化,表明生产过程中对玉米热狗肠菌群结构有显著影响的为原料肉(鸡肉)。因此,降低鸡肉原料中腐败微生物数量是保证玉米热狗肠产品安全的关键控制点。三代测序α多样性中,玉米热狗肠成品Chao1指数和Shannon指数明显低于半成品,表明二次杀菌工艺能够有效降低玉米热狗肠细菌群落的物种丰富度。随着贮藏时间的延长,玉米热狗肠成品中的Chao1指数和Shannon指数出现显著下降(P<0.05),可能是由于该阶段腐败微生物大量增殖,从而抑制了其他微生物的生长,导致物种的丰富度和多样性显著降低,进而提高玉米热狗肠的腐败速率。
表2 二代测序与三代测序的α多样性指数
Table 2 α-Diversity indexes obtained from second- and third-generation sequencing
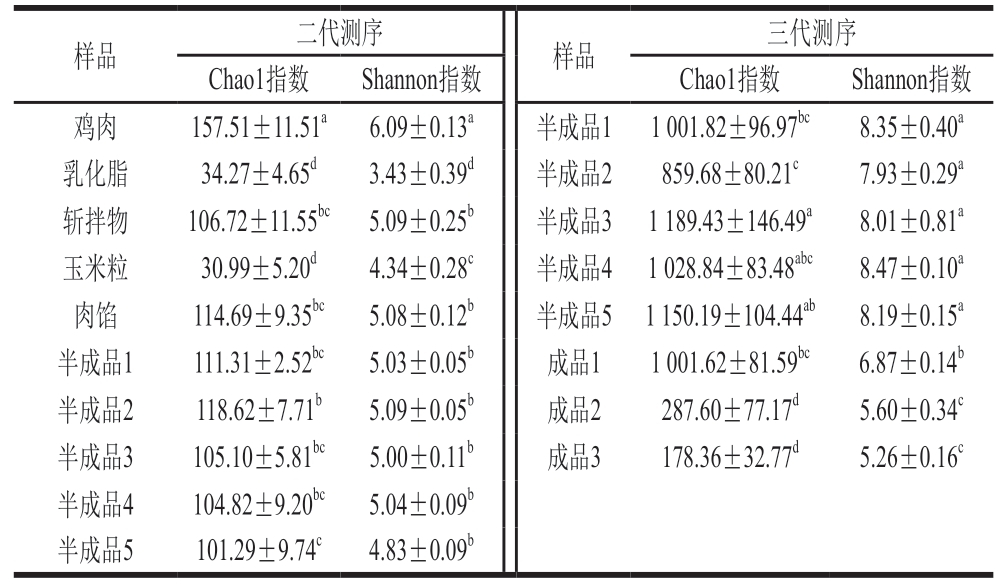
注:同列小写字母不同表示组间差异显著(P<0.05)。
样品二代测序样品三代测序Chao1指数Shannon指数Chao1指数Shannon指数鸡肉157.51±11.51a6.09±0.13a半成品1 1 001.82±96.97bc8.35±0.40a乳化脂34.27±4.65d3.43±0.39d半成品2859.68±80.21c7.93±0.29a斩拌物106.72±11.55bc 5.09±0.25b半成品3 1 189.43±146.49a8.01±0.81a玉米粒30.99±5.20d4.34±0.28c半成品4 1 028.84±83.48abc8.47±0.10a肉馅114.69±9.35bc5.08±0.12b半成品5 1 150.19±104.44ab8.19±0.15a半成品1111.31±2.52bc5.03±0.05b成品11 001.62±81.59bc6.87±0.14b半成品2118.62±7.71b5.09±0.05b成品2287.60±77.17d5.60±0.34c半成品3105.10±5.81bc5.00±0.11b成品3178.36±32.77d5.26±0.16c半成品4104.82±9.20bc5.04±0.09b半成品5101.29±9.74c4.83±0.09b
2.3 基于二代测序的菌群结构动态变化分析
肉制品腐败变质主要是由特定微生物的繁殖和代谢活动引起的肉制品感官特征的不良变化,分析玉米热狗肠在生产过程中的菌群动态变化,可为产品质量控制提供参考。由图3可知,鸡肉、乳化脂和玉米粒完全搅拌混合后获得的肉馅中菌群主要以厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)为主,从灌装到二次灭菌工艺之间,各样品的菌群在门水平并未发生明显变化。
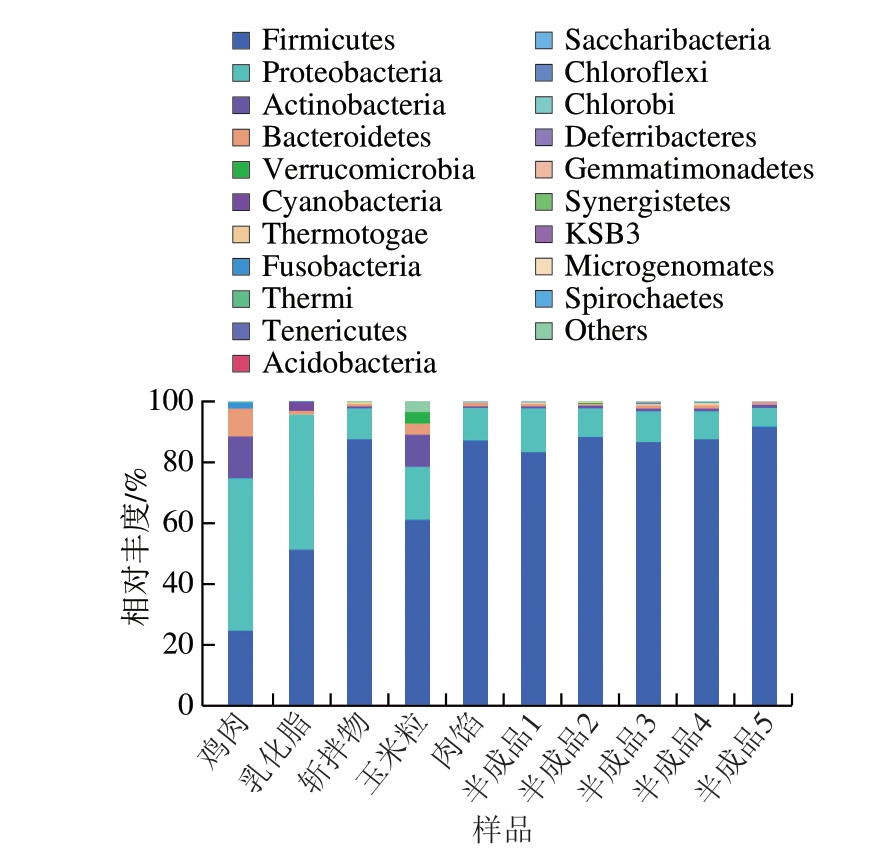
图3 玉米热狗肠生产过程中微生物种群的门水平变化规律
Fig. 3 Changes in relative abundance of microbial populations at the phylum level during the production process of corn-added hot dog sausage
由图4可知,鸡肉、乳化脂和玉米粒主要原料中菌群在属水平上的变化差异较大。有研究[21-22]指出,冷鲜鸡肉中的优势菌群主要有假单胞菌属、不动杆菌属、嗜冷杆菌属和环丝菌属,本研究中鸡肉原料中菌群则以不动杆菌属为主(相对丰度约为15.2%),乳化脂中菌群以链球菌属(Streptococcus)为主,两者混合后的斩拌物中菌群相对丰度由高到低分别为乳杆菌属(Lactobacillus)、链球菌属、不动杆菌属和魏斯氏菌属。斩拌物中乳杆菌属相对丰度突增现象表明食品加工介质和原料的相互接触可导致微生物(乳杆菌属)交叉污染,因此,在后续的生产过程中需将绞肉、斩拌和搅拌工具进行充分地消毒杀菌处理,以降低加工介质表面微生物数量,并抑制生物膜形成[23]。另外,添加玉米粒前后的样品及半成品中菌群组成均变化不大,表明玉米粒对热狗肠中菌群结构影响较小。
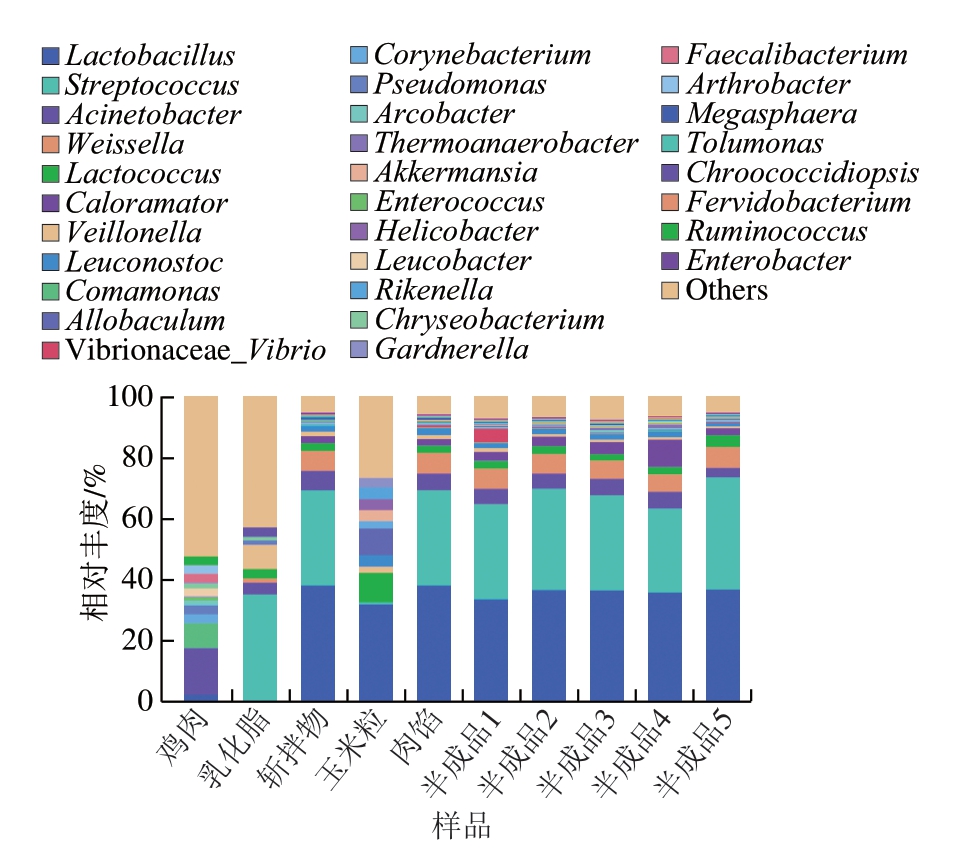
图4 玉米热狗肠生产过程中微生物种群的属水平变化规律
Fig. 4 Changes in relative abundance of microbial populations at the genus level during the production process of corn-added hot dog sausage
2.4 基于三代测序的菌群结构动态变化分析
因二代测序仅能在属水平上对微生物种群进行鉴定,本研究进一步采用三代测序技术对玉米热狗肠样品的微生物多样性进行检测。由图5可知,与二代测序结果类似,灌装后的半成品中菌群均以芽孢杆菌门(Bacillota)(也称厚壁菌门,二代测序和三代测序所用数据库不同,下同)和假单胞菌门(Pseudomonadota)(也称变形菌门)为主。在贮藏过程中,玉米热狗肠成品中菌群也以芽孢杆菌门和假单胞菌门为主,但相较于半成品来说,成品中芽孢菌门相对丰度明显下降,而假单胞菌门相对丰度有所上升。
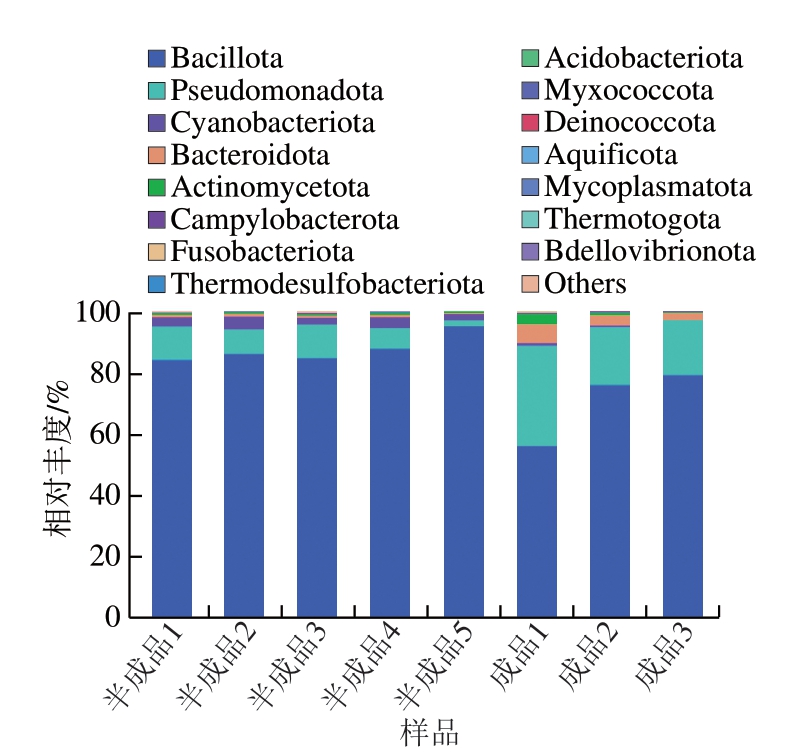
图5 玉米热狗肠生产和贮藏过程中微生物种群的门水平变化规律
Fig. 5 Changes in relative abundance of microbial populations at the phylum level during the production and storage process of corn-added hot dog sausage
由图6可知,二次灭菌工艺对玉米热狗肠中链球菌属影响较小,但能明显降低乳杆菌属和魏斯氏菌属的相对丰度,且两者在贮藏过程中相对丰度基本不变,这可能是由于真空包装的厌氧环境不适合好氧型乳杆菌属和微需氧型魏斯氏菌属细菌生长[24-25]。
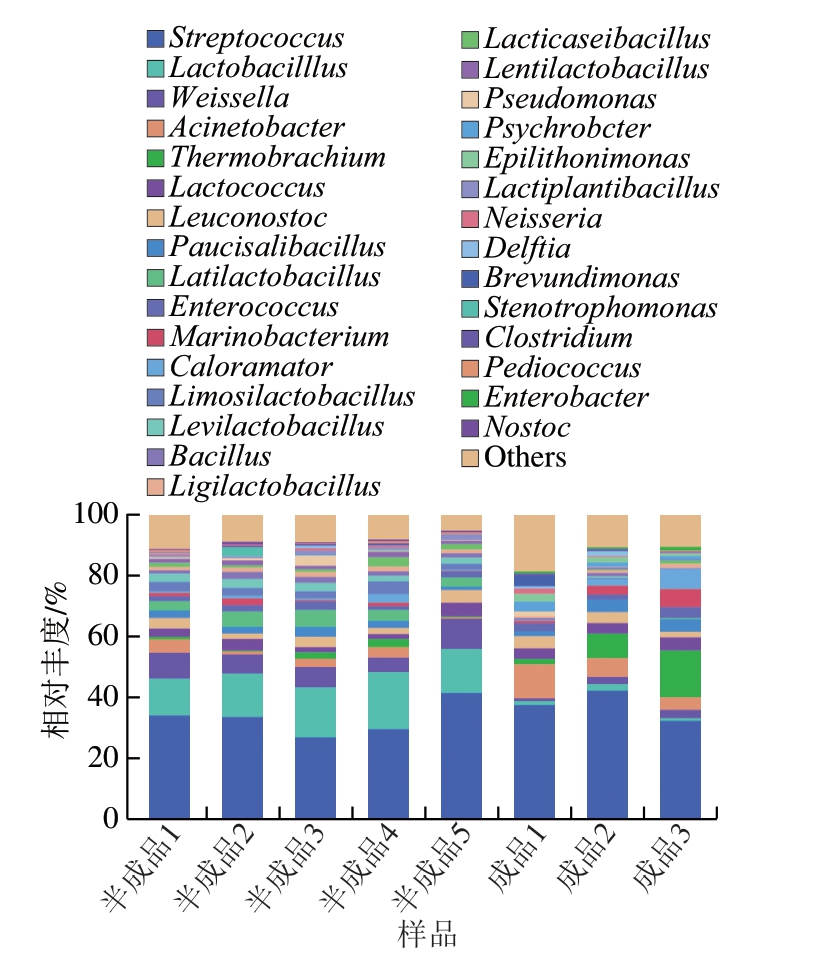
图6 玉米热狗肠生产和贮藏过程中微生物种群的属水平变化规律
Fig. 6 Changes in relative abundance of microbial populations at the genus level during the production and storage process of corn-added hot dog sausage
由图7可知,经二次灭菌后,玉米热狗肠种菌群相对丰度明显下降的均为乳酸菌类,如Lactobacillus sp. T17/4F、融合魏斯氏菌(Weissella confusa)、马肠链球菌(Streptococcus equinus)、府中广布乳杆菌(Latilactobacillus fuchuensis)、唾液链球菌(Streptococcus salivarius)、短乳杆菌(Levilactobacillus brevis)、格氏乳球菌(Lactococcus garvieae)、鼠李糖乳杆菌(Lacticaseibacillus rhamnosus)等,主要原因是乳酸菌耐热性差,高温加热可有效降低其菌株活性[26-27]。随着贮藏时间的延长,成品中不动杆菌属的相对丰度逐渐下降,而热分枝菌属(Thermobrachium)相对丰度逐渐上升。因此,在贮藏后期(90 d)时,成品中相对丰度较高的菌群分别为链球菌属(32.36%)和热分枝菌属(15.29%)(图6)。
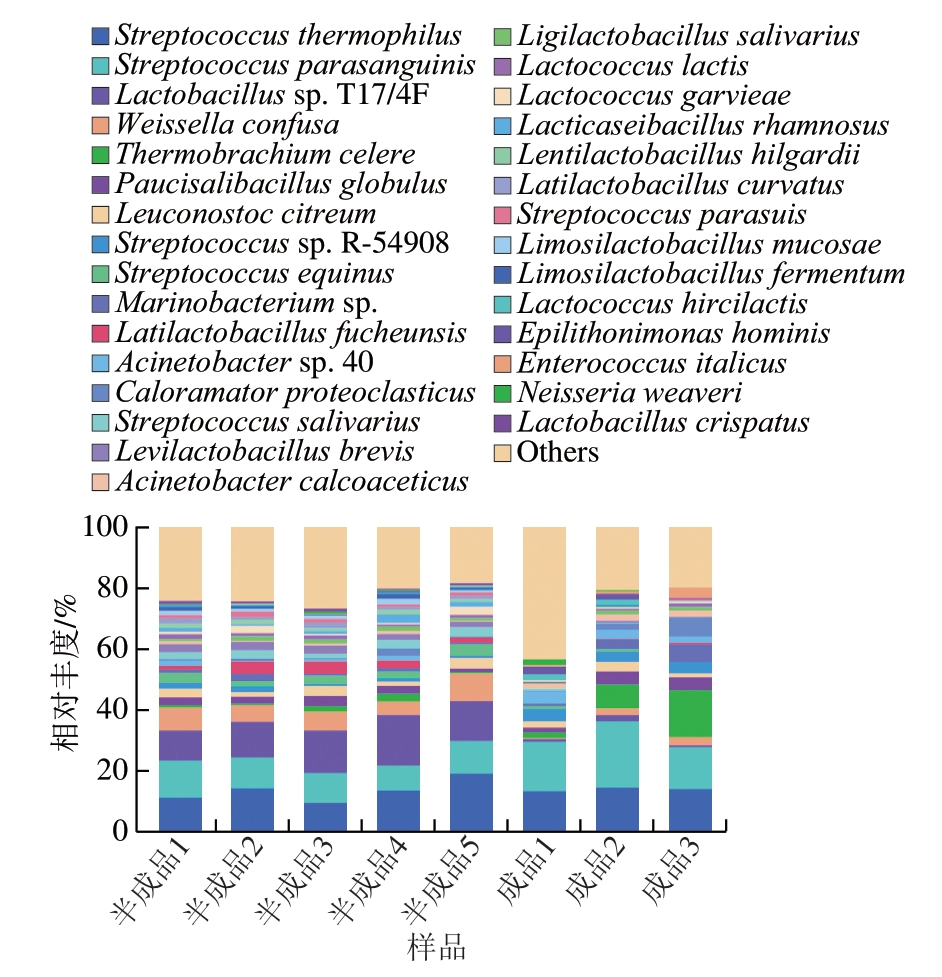
图7 玉米热狗肠生产和贮藏过程中微生物种群的种水平变化规律
Fig. 7 Changes in relative abundance of microbial populations at the species level during the production and storage process of corn-added hot dog sausage
与室温贮藏的未包装红肠制品中优势菌群(葡萄球菌属、假单胞杆菌和不动杆菌属)不同[9],真空包装热狗肠中优势菌群偏向于兼性厌氧和严格厌氧型微生物,如嗜热链球菌(Streptococcus thermophilus)、副血链球菌(Streptococcus parasanguinis)[28]和速生热分枝菌(Thermobrachium celere)[29]。由图7可知,在整个贮藏过程中,嗜热链球菌相对丰度(13%~14%)和副血链球菌相对丰度(13%~20%)比较稳定,且处于较高水平,但随着贮藏时间的延长,厌氧型细菌速生热分枝菌和解蛋白喜热菌(Caloramator proteoclasticus)相对丰度增加,其中,速生热分枝菌相对丰度变化最为明显,从2.0%(30 d)增至约15%(90 d),而解蛋白喜热菌相对丰度由0.2%增至6.5%。速生热分枝菌是一种快速生长的嗜热、耐碱、具有蛋白水解能力的专性厌氧菌,同时还能合成大量氢气[30-31]。解蛋白喜热菌为嗜热、具有蛋白水解能力的厌氧型细菌[32]。因此,在常温和真空条件下贮藏有利于玉米热狗肠中兼性厌氧型(嗜热链球菌)或厌氧型细菌(副血链球菌、速生热分枝菌、解蛋白喜热菌)生长产气,并且在贮藏后期蛋白水解菌繁殖能力增强,能加速产品出现腐败变质现象。
2.5 优势菌群分离与纯化
由表3可知,在烟熏工艺之前,分离鉴定出的细菌种类主要来源于假单胞菌属(如Pseudomonas gessardii)、芽孢杆菌属(如Bacillus mojavensis、Bacillus halotolerans、Bacillus stercoris、Bacillus licheniformis)、葡萄球菌属(如Staphylococcus saccharolyticus)、肠杆菌属(如Enterobacter cloacae、Lelliottia amnigenu)、乳植杆菌属(如Lactiplantibacillus plantarum)和沙雷氏菌属(如Serratia liquefaciens);但在烟熏工艺之后及贮藏期(60 d内),在实验室无法分离出具有活性的菌株。与二代高通量测序结果相比,实验室分离出的菌株在整个菌群中的相对丰度较低,如假单胞菌属在鸡肉和乳化脂样品中的相对丰度仅为2%左右,而芽孢杆菌属在所有样品中相对丰度均小于1%,进一步表明微生物分离纯化技术不能完全解析生境中的微生物多样性[33]。芽孢杆菌属是熟肉制品的主要耐热菌,且易形成生物膜而附着在生产设备中,巴氏杀菌工艺并不能灭活其芽孢,在后续的贮藏过程中,一旦环境条件适宜,芽孢便会萌发而导致产品腐败变质[34-35]。本研究利用微生物分离纯化技术共鉴定出4 种不同的芽孢杆菌,因此,在后续的生产控制中应开发合适的芽孢灭菌技术,控制芽孢菌数量和污染强度[36-37]。
表3 玉米热狗肠生产过程中分离纯化出的微生物种类
Table 3 Microbial species isolated and purified from corn-added hot dog sausage samples during production process

样品微生物种类鸡肉P. gessardii乳化脂E. cloacae、B. mojavensis混合物P. gessardii、S. liquefaciens、B. halotolerans、B. stercoris、B. mojavensis、Raoultella planticola、L. amnigenu玉米粒S. saccharolyticus、P. gessardii肉馅P. gessardii、B.halotolerans半成品1L. plantarum、B. licheniformis半成品2B. mojavensis、Rhodococcus sp.、S. liquefaciens、B. licheniformis
3 结 论
本研究利用高通量测序和传统微生物分离纯化技术分析市售玉米热狗肠生产和贮藏过程中菌群结构的动态变化,结果表明,在玉米热狗肠原料中,鸡肉的物种丰富度和多样性显著高于其他原料(乳化脂和玉米粒)(P<0.05)。在生产过程中,食品加工介质和原料之间的交叉污染显著影响玉米热狗肠的菌群结构,而玉米热狗肠样品中菌群相对丰度均以乳杆菌属、链球菌属、不动杆菌属和魏斯氏菌属为主,但对其真空包装制品进行二次灭菌之后,链球菌属相对丰度变化较小,而乳杆菌属和魏斯氏菌属的相对丰度明显降低。同时,利用微生物分离纯化技术在玉米热狗肠样品中鉴定出4 种不同的芽孢杆菌,说明其生产过程中存在芽孢污染风险。在贮藏过程中,玉米热狗肠中链球菌属的相对丰度一直维持在较高水平,其中主要以嗜热链球菌和副血链球菌为主,同时真空条件也促进了厌氧型蛋白分解菌速生热分枝菌与解蛋白喜热菌增殖,共同构成贮藏后期玉米热狗肠中的优势种群。并且,随着贮藏时间延长,玉米热狗肠中腐败菌增殖共同导致菌群物种丰富度和多样性显著下降(P<0.05),加速产品腐败。
[1] 费英敏, 姜旭德. 鸡肉复合热狗肠配方的研究[J]. 肉类工业, 2017(6):6-10. DOI:10.3969/j.issn.1008-5467.2017.06.002.
[2] HAN H J, LI M H, PENG Y Q, et al. Microbial diversity and nonvolatile metabolites profile of low-temperature sausage stored at room temperature[J]. Frontiers in Microbiology, 2021, 12: 711963.DOI:10.3389/fmicb.2021.711963.
[3] 潘晓倩, 赵燕, 张顺亮, 等. 中温乳化香肠中一株优势腐败菌的分离鉴定与生物学特性[J]. 食品科学, 2016, 37(7): 93-98. DOI:10.7506/spkx1002-6630-201607018.
[4] KHORSANDI A, ESKANDARI M H, AMINLARI M, et al. Shelf-life extension of vacuum packed emulsion-type sausage using combination of natural antimicrobials[J]. Food Control, 2019, 104: 139-146.DOI:10.1016/j.foodcont.2019.04.040.
[5] PEREZ-CHABELA M L, DIAZ-VELA J, REYES-MENENDEZ C V,et al. Improvement of moisture stability and textural properties of fat and salt reduced cooked sausages by inoculation of thermotolerant lactic acid bacteria[J]. International Journal of Food Properties, 2013,16(7/8): 1789-1808. DOI:10.1080/10942912.2011.608472.
[6] PELLISSERY A J, VINAYAMOHAN P G, AMALARADJOU M A R,et al. Spoilage bacteria and meat quality[M]//BISWAS A K, MANDAL P K, Meat quality analysis, Elsevier, 2020: 307-334. DOI:10.1016/B978-0-12-819233-7.00017-3.
[7] GUERRA C A, COSTA L M, DE OLIVEIRA V S, et al. Correlation between natural microbial load and formation of ropy slime affecting the superficial color of vacuum-packaged cooked sausage[J]. Meat Science, 2023, 201: 9. DOI:10.1016/j.meatsci.2023.109197.
[8] 潘晓倩, 张顺亮, 李素, 等. 杀菌温度对乳化香肠腐败菌群的影响与靶向抑制[J]. 肉类研究, 2018, 32(1): 1-8. DOI:10.7506/rlyj1001-8123-201801001.
[9] LÜ Y C, YIN X Y, WANG Y, et al. The prediction of specific spoilage organisms in Harbin red sausage stored at room temperature by multivariate statistical analysis[J]. Food Control, 2021, 123(5):107701. DOI:10.1016/j.foodcont.2020.107701.
[10] LI X F, LI C, YE H, et al. Changes in the microbial communities in vacuum-packaged smoked bacon during storage[J]. Food Microbiology, 2019, 77: 26-37. DOI:10.1016/j.fm.2018.08.007.
[11] ANDORRA I, LANDI S, MAS A, et al. Effect of oenological practices on microbial populations using culture-independent techniques[J].Food Microbiology, 2008, 25(7): 849-856. DOI:10.1016/j.fm.2008.05.005.
[12] BAYLE S, MARTINEZ-ARRIBAS B, JARRAUD S, et al. Development of a DGGE method to explore Legionella communities[J]. Heliyon, 2020,6(1): e03149. DOI:10.1016/j.heliyon.2019.e03149.
[13] ERCOLINI D. High-throughput sequencing and metagenomics:moving forward in the culture-independent analysis of food microbial ecology[J]. Applied & Environmental Microbiology, 2013, 79(10):3148-3155. DOI:10.1128/AEM.00256-13.
[14] JUSZCZUK-KUBIAK E, DEKOWSKA A, SOKOOWSKA B, et al.Evaluation of the spoilage-related bacterial profiles of vacuumpackaged chilled ostrich meat by next-generation DNA sequencing approach[J]. Processes, 2021, 9(5): 803. DOI:10.3390/pr9050803.
[15] HUANG J C, GUO Y C, HOU Q, et al. Dynamic changes of the bacterial communities in roast chicken stored under normal and modified atmosphere packaging[J]. Journal of Food Science, 2020,85(4): 1231-1239. DOI:10.1111/1750-3841.15038.
[16] YANG X Y, LUO X, ZHANG Y M, et al. Effects of microbiota dynamics on the color stability of chilled beef steaks stored in high oxygen and carbon monoxide packaging[J]. Food Research International, 2020, 151: 109215. DOI:10.1016/j.foodres.2020.109215.
[17] LIU N, ZHOU J L, HAN L J, et al. Role and multi-scale characterization of bamboo biochar during poultry manure aerobic composting[J]. Bioresource Technology, 2017, 241: 190-199.DOI:10.1016/j.biortech.2017.03.144.
[18] HULTMAN J, RAHKILA R, ALI J, et al. Meat processing plant microbiome and contamination patterns of cold-tolerant bacteria causing food safety and spoilage risks in the manufacture of vacuumpackaged cooked sausages[J]. Applied and Environmental Microbiology,2015, 81(20): 7088-7097. DOI:10.1128/AEM.02228-15.
[19] ZHU Y L, WANG W, LI M, et al. Microbial diversity of meat products under spoilage and its controlling approaches[J]. Frontiers in Nutrition,2022, 9: 1078201. DOI:10.3389/fnut.2022.1078201.
[20] 江荣花, 汪雯, 蔡铮, 等. 肉制品加工过程中食源性致病菌交叉污染及风险评估的研究进展[J]. 食品科学, 2018, 39(7): 305-311.DOI:10.7506/spkx1002-6630-201807045.
[21] 肖英平, 何祥祥, 戴宝玲, 等. 采样方法对冷鲜鸡表面细菌DNA提取及高通量测序结果的影响[J]. 食品科学, 2017, 38(24): 260-264.DOI:10.7506/spkx1002-6630-201724042.
[22] 黄柳娟, 冯博, 刘海燕, 等. 冷鲜鸡肉表面及内部细菌菌群的多样性分析[J]. 上海农业学报, 2021, 37(1): 104-109. DOI:10.15955/j.issn1000-3924.2021.01.18.
[23] 张婧男, 刘昊天, 陈倩, 等. 超声技术抑制微生物生物膜污染: 机制、影响因素及其在肉及肉制品中的应用[J]. 肉类研究, 2021,35(5): 50-59. DOI:10.7506/rlyj1001-8123-20210315-072.
[24] 陶兴玲, 詹亚斌, 王宁, 等. 耐热菌剂对堆肥有机质降解及细菌演替的影响[J]. 科学技术与工程, 2023, 23(14): 6264-6270. DOI:10.3969/j.issn.1671-1815.2023.14.048.
[25] 李巧玉, 方芳, 堵国成, 等. 魏斯氏菌在发酵食品中的应用[J]. 食品与发酵工业, 2017, 43(10): 241-247. DOI:10.13995/j.cnki.11-1802/ts.014934.
[26] SHIN Y J, KANG C H, KIM W, et al. Heat adaptation improved cell viability of probiotic Enterococcus faecium HL7 upon various environmental stresses[J]. Probiotics Antimicrob Proteins, 2019, 11(2):618-626. DOI:10.1007/s12602-018-9400-4.
[27] CHEN M J, TANG H Y, CHIANG M L. Effects of heat, cold, acid and bile salt adaptations on the stress tolerance and protein expression of kefir-isolated probiotic Lactobacillus kefiranofaciens M1[J]. Food Microbiology, 2017, 66: 20-27. DOI:10.1016/j.fm.2017.03.020.
[28] CHEN Q R, WU G J, CHEN H, et al. Quantification of human oral and fecal Streptococcus parasanguinis by use of quantitative real-time PCR targeting the groEL gene[J]. Frontiers in Microbiology, 2019, 10:2910. DOI:10.3389/fmicb.2019.02910.
[29] ENGLE M, LI Y, RAINEY F, et al. Thermobrachium celere gen. nov. sp. nov. a rapidly growing thermophilic, alkalitolerant,and proteolytic obligate anaerobe[J]. International Journal of Systematic and Evolutionary Microbiology, 1996, 46(4): 1025-1033.DOI:10.1099/00207713-46-4-1025.
[30] NHIM S, WAEONUKUL R, UKE A, et al. Biological cellulose saccharification using a coculture of Clostridium thermocellum and Thermobrachium celere strain A9[J]. Applied Microbiology and Biotechnology, 2022, 106(5): 2133-2145. DOI:10.1007/s00253-022-11818-0.
[31] CIRANNA A, SANTALA V, KARP M. Enhancing biohydrogen production of the alkalithermophile Thermobrachium celere[J].International Journal of Hydrogen Energy, 2012, 37(7): 5550-5558.DOI:10.1016/j.ijhydene.2011.12.105.
[32] TARLERA S, MUXÍ L, SOUBES M, et al. Caloramator proteoclasticus sp. nov. a new moderately thermophilic anaerobic proteolytic bacterium[J]. International Journal of Systematic & Evolutionary Microbiology, 1997, 47(3): 651-656.DOI:10.1099/00207713-47-3-651.
[33] 潘晓光, 张丽丽, 张怀强, 等. 基于整合宏组学技术认识腐生生境功能微生物区系[J]. 微生物学通报, 2017, 44(9): 2231-2238.DOI:10.13344/j.microbiol.china.170174.
[34] WANG N, JIN Y J, HE G Q, et al. Dynamic tracing of bacterial community distribution and biofilm control of dominant species in milk powder processing[J]. LWT-Food Science and Technology, 2022,154: 112855. DOI:10.1016/j.lwt.2021.112855.
[35] 李素, 曲超, 张顺亮, 等. 中温乳化肠中凝结芽孢杆菌芽孢萌发及热致死规律[J]. 肉类研究, 2017, 31(4): 10-16. DOI:10.7506/rlyj1001-8123-201704003.
[36] 李素, 张顺亮, 任双, 等. 芽孢诱导技术在中温香肠加工中的应用[J]. 肉类研究, 2017, 31(12): 6-10. DOI:10.7506/rlyj1001-8123-201712002.
[37] 崔肖爽, 梁栋, 李苗云, 等. 产气荚膜梭菌芽孢萌发剂筛选及其萌发特性研究[J]. 食品安全质量检测学报, 2023, 14(2): 191-197.