目前,发酵香肠中常用的发酵剂有乳酸菌和凝固酶阴性球菌(coagulase-negative cocci,CNC),其中,CNC主要包括凝固酶阴性葡萄球菌(Staphylococcus spp.)和考克氏菌(Kocuria spp.)[1]。研究[2]表明,以植物乳植杆菌(Lactiplantibacillus plantarum)为代表的乳酸菌能通过糖酵解产生有机酸,有利于产品风味产生和保证产品的安全性。CNC具有蛋白酶和脂肪酶活性,促进风味形成,还具有硝酸盐还原酶活性,能促进肉制品发色,具有过氧化氢酶活性,能缓解脂质氧化[3]。
发酵剂不仅可以提高发酵食品的感官特性,而且可以提升食品安全性和商品标准化。肉类发酵剂主要是由乳酸菌和CNC进行复配[4],利用两者间的协同作用改善发酵肉品质,能弥补单一菌种的局限性[3]。考克氏菌是食品发酵功能性CNC的重要成员,共26 个种[5],广泛存在于乳制品[6]、海鲜[7]和发酵肉制品[8]中。变异考克氏菌(Kocuria varians)是肉制品中报道最多的考克氏菌,可以改善发酵肉类的感官特征并减少生物胺的产生[9]。研究[10-11]表明,变异考克氏菌和清酒乳杆菌(Lactobacillus sakei)及嗜酸乳杆菌(Lactobacillus acidophilus)复配均可显著提高火腿中氨基酸含量并改善感官特性,和植物乳植杆菌复配可显著改善腊肠的颜色,减少生物胺生成[9]。嗜根考克氏菌(Kocuria rhizophila)常见于发酵乳肉制品中,且对发酵肉制品风味发挥积极作用[12-13],然而,目前关于该菌接种发酵香肠的研究严重不足,尚无嗜根考克氏菌作为辅助发酵剂发酵肉品的报道。目前,国内对CNC的研究仅限于凝固酶阴性葡萄球菌,2022年8月25日,国家卫生健康委员会发布的《可用于食品的菌种名单》中的CNC菌株仅有3 种(小牛动物球菌(Mammaliicoccus vitulinus)、木糖葡萄球菌(Staphylococcus xylosus)、肉葡萄球菌(Staphylococcus carnosus)),对考克氏菌的研究远远落后于欧美等西方国家,因此开展以考克氏菌为代表的新型发酵剂研究有利于挖掘并利用本土菌种资源、弥补国内该领域的空白、丰富肉类发酵菌剂种类。
本课题组前期从传统发酵诺邓火腿中分离出具有蛋白水解活性和硝酸还原酶活性、能改善发酵肉制品色泽、增强风味且安全的嗜根考克氏菌株[13],接种于发酵肉中能显著提高发酵肉的红度值(a*),改善发酵肉制品的色泽和整体风味[1]。本课题组前期通过发酵性能实验,从发酵肉制品中筛选得到低温生长性能好的植物乳植杆菌L和嗜根考克氏菌AP1,并设置不同比例进行复配(植物乳植杆菌L、嗜根考克氏菌AP1的体积比分别为3∶1、1∶1、1∶3),发现植物乳植杆菌L、嗜根考克氏菌AP1体积比为1∶1时,2 种菌长势较好且不会因微生物产酸过多导致香肠口感变差。在此基础上,本课题组将2 种菌株进行复配制成发酵菌剂,以自然发酵为对照,初步探究复配菌剂对发酵香肠品质和菌群的影响,为开发香肠专用菌剂提供一种新参考。
1 材料与方法
1.1 材料与试剂
生猪肉采自云南昆明本地市场三元猪后腿肉。所用菌株植物乳植杆菌L和嗜根考克氏菌AP1均由云南省农业科学院农产品加工研究所实验室保藏,来源于云南本地火腿样品,于-80 ℃保存。
亚铁氰化钾、氯化钠、盐酸、乙酸锌、酚酞、盐酸萘乙二胺、对氨基苯磺酸、亚硝酸钠、氢氧化钠(均为分析纯) 天津市致远化学试剂有限公司;胶原蛋白肠衣广西神冠胶原生物集团有限公司;食盐 云南省盐业有限公司;葡萄糖(食品级) 河南万邦实业有限公司;黑胡椒 上海味好美食品有限公司;单山蘸水 昆明市单山食品有限公司;复合磷酸盐(食品级) 徐州添安食品添加剂有限公司;亚硝酸钠(食品级) 天津市盛鑫源化工有限公司;DP812 DNA提取试剂盒 天根生化科技(北京)有限公司;Agencourt AMPure XP Beads试剂盒 Accelerating Answers生命有限公司;Qubi dsDNA HS Assay试剂盒 美国赛默飞世尔科技公司;建库试剂盒(SMRTbell prep kit 3.0) 美国Pacific Biosciences公司。
MRS培养基、甘露醇氯化钠琼脂(mannitol salt agar,MSA)培养基、营养肉汤(nutritional broth,NB)培养基、肉汤(lysogeny broth,LB)培养基 青岛海博生物技术有限公司。培养基均于118 ℃灭菌20 min。
1.2 仪器与设备
TMS-Touch质构仪 美国FTC公司;EXceed-ad-50纯水机 成都唐氏康宁科技发展有限公司;DW-86L626超低温冰箱(-80 ℃) 海尔智家股份有限公司;CM-5台式色差仪 日本柯尼卡-美能达公司;Multiskan GO酶标仪 美国Thermo公司;HR/T20MM冷冻离心机 湖南赫西仪器装备有限公司;DL-CJ-2NDI超净工作台 北京东联哈尔仪器制造有限公司;YXQ-75SL高压蒸汽灭菌锅 上海博讯实业有限公司;JA3003C电子天平 济南欧莱博电子商务有限公司;WPL-125BE电热恒温培养箱 天津泰斯特设备有限公司;S210 pH计梅特勒-托利多科技(中国)有限公司;HHWS-111-250恒温恒湿培养箱 上海跃进医疗器械有限公司。
1.3 方法
1.3.1 发酵菌株的活化与制备
将植物乳植杆菌L、嗜根考克氏菌AP1分别接种至MRS和NB液体培养基中,培养条件均为37 ℃、18 h,菌株活化培养2 次后,在6 399×g、4 ℃条件下离心10 min,去除上清液,用无菌生理盐水洗涤沉淀2 次,备用。
1.3.2 发酵香肠的制作
发酵香肠的制作参考巩洋[14]的工艺并稍作修改。
配方:选择饲养1 年后出栏的外三元母猪当天屠宰的新鲜后腿肉为原料,将后腿猪肉(肥瘦肉质量比2∶8)绞碎后,每1.00 kg肉中添加辅料:食盐20.00 g、葡萄糖10.00 g、亚硝酸钠0.10 g、复合磷酸盐0.03 g、单山蘸水10.00 g、黑胡椒粉10.00 g。其中,复合磷酸盐为商业产品,其主要成分如下:三聚磷酸钠24%、焦磷酸钠21%、六偏磷酸钠14%、磷酸三钠4%、聚磷酸二氢二钠3%、磷酸钠7%、磷酸铵钠8%、氯化钾3%、食用盐15%、食用葡萄糖1%(m/m)。接菌组的菌种总接种量为2%(以鲜肉质量计),确保最终在香肠中的总活菌数达到107 CFU/g。
工艺流程:原料肉→漂洗→绞肉→搅拌(发酵剂、辅料)→灌肠→发酵→成熟。
发酵条件:发酵初期(0~1 d):温度20 ℃,相对湿度75%;发酵中期(2~3 d):温度13 ℃,相对湿度60%;发酵后期(4~5 d):温度11 ℃,相对湿度60%。
处理组:分为AP1L和CK 2 组。CK组:不接种发酵剂的空白对照组;AP1L组:植物乳植杆菌L、嗜根考克氏菌AP1共同接种(体积比为1∶1),总接种量为2%(以鲜肉质量计)。接种菌液浓度:植物乳植杆菌1.3×109 CFU/mL、嗜根考克氏菌2.1×109 CFU/mL。
1.3.3 pH值测定
按照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》[15]进行测定。
1.3.4 水分含量测定
按照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》[16]中的直接干燥法进行测定。
1.3.5 水分活度测定
按照GB 5009.238—2016《食品安全国家标准 食品水分活度的测定》[17]中的水分活度仪扩散法进行测定。
1.3.6 亚硝酸盐含量测定
按照GB 5009.33—2016《食品安全国家标准 食品中亚硝酸盐和硝酸盐的测定》[18]中的分光光度法进行测定。所作标准曲线为y=0.004x+0.044 9(R2=0.999 0)。
1.3.7 色差测定
参考范鑫洋等[19]的方法并稍作修改,剥去肠衣,将香肠搅碎压成直径约为2 cm、厚度约为1 cm的薄片,选取6 个不同位置测定样品的亮度值(L*)、a*、黄度值(b*)。色差仪使用标准板Y=94.0、X=0.315 6、y=0.332 1校正,并引入色度值(C),按式(1)计算:
1.3.8 质构特性测定
参考王宁宁等[20]的方法并稍作修改,剥去肠衣后,将香肠切成边长1 cm的正方体,使用质构仪通过质地剖面分析模式测定样品硬度、弹性、内聚性、咀嚼性。测试条件:圆盘直径7.5 cm,探头P/36R,最大力500 N,起始力0.75 N,试样受压形变75%,探头回升高度15 mm,检测速率120 mm/min。
1.3.9 感官评定
选择12 名经验丰富的发酵肉类产品研发人员,对蒸煮后的发酵香肠外观、色泽、风味、口感和组织状态5 个方面进行感官评分,并在去除最高分与最低分后计算平均分,感官评价标准见表1[21]。
表1 感官评价标准
Table 1 Sensory evaluation criteria

感官属性评分标准评分外观(20 分)肠衣干燥,与肉馅结合紧密,不易撕裂,表面干净有光泽,无发软,有韧性 16~20肠衣稍有湿润或发黏,易与肉馅分离但不易撕裂,发软,无韧性6~15肠衣较湿润或发黏,肉馅易脱落,易撕裂,发软,无韧性1~5色泽(20 分)切面肉馅有光泽16~20部分肉馅有光泽6~15肉馅无光泽1~5风味(20 分)肉馅无异味,有肠的独特风味16~20肉馅有轻微酸味6~15肉馅酸味较重1~5口感(20 分)口感爽滑有弹性16~20口感较粗糙或弹性较弱6~15口感粗糙且难以下咽1~5组织状态(20 分)切面紧实,边缘无异样16~20切面齐整,边缘部分有软化现象6~15切面不齐,边缘部分软化严重1~5
1.3.10 氨基酸测定及营养价值评价
1.3.10.1 氨基酸的测定
按照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》[22]进行测定。
1.3.10.2 氨基酸呈味效果评价
滋味活性值(taste activity value,TAV)为样品中呈味物质含量与其阈值的比值,当TAV>1时,认为该物质对样品滋味有贡献,且数值越大,贡献越显著;TAV<1时,认为该物质对呈味贡献较小,由此确定主要呈味氨基酸。TAV按式(2)计算:
式中:C1为物质在样品中的含量/(mg/g);C2为该物质呈味阈值/(mg/g)。
1.3.11 细菌群落测定
1.3.11.1 活菌数测定
将植物乳植杆菌L稀释涂布于MRS固体培养基上进行菌落计数(培养条件:37 ℃、2 d);嗜根考克氏菌AP1稀释涂布于MSA固体培养基上进行菌落计数(培养条件:30 ℃、2 d)。
1.3.11.2 细菌多样性测定
使用TGuide S96 磁珠法DNA 提取试剂盒提取各样品的总DNA,检测DNA 浓度、纯度和提取质量。所用细菌16 Sr RNA 引物为通用引物27 F(5’-AGRGTTTGATYNTGGCTCAG-3’)和1492R(5’-TASGGHTACCTTGTTASGACTT-3’)。聚合酶链式反应(polymerase chain reaction,PCR)扩增程序:95 ℃预变性2 min,98 ℃变性10 s,55 ℃退火30 s,72 ℃延伸90 s,共30 个循环,72 ℃延伸7 min。PCR产物使用1.8%琼脂糖凝胶回收,用Agencourt AMPure XP Beads试剂盒进行回收产物纯化,并使用Qubit dsDNA HS Assay试剂盒进行定量。单个量化后将等量产物合并,通过建库试剂盒制备SMRTbell文库并进行测序。PCR扩增、PCR产物混合、纯化、文库构建及上机测序流程均由北京百迈客生物科技有限公司完成。
使用Trimmomatic软件(version 0.33)进行原始数据质量过滤,使用Cutadapt软件(version 1.9.1)进行引物序列的识别与去除,然后使用USEARCH软件(version 10)对双端reads进行拼接并去除嵌合体(UCHIME软件,version 8.1)。对原始下机数据subreads文件进行校正得到CCS(circular consensus sequencing)序列(SMRT Link软件,version 8.0),然后使用Lima软件(version 1.7.0)对CCS序列进行Barcode识别、长度过滤、去除嵌合体,得到有效CCS序列。
1.4 数据处理
细菌群落多样性及物种差异分析等一系列统计学及可视化分析均在百迈客云平台BMKCloud (www.biocloud.net)上完成。其他实验重复3 次,结果以平均值±标准差表示,并用IBM SPSS Statistics 26软件进行单因素方差分析,然后利用沃勒-邓肯方法分析数据的显著性,P<0.05被认为具有统计学差异;使用Graphpad Prism 8.2.1软件进行计算及绘图。
2 结果与分析
2.1 发酵菌株对香肠常规理化性质的影响
由图1可知,随着发酵过程的进行,2 组香肠的pH值均呈现先下降后维持的趋势,发酵开始时(0 d),AP1L组和CK组之间的pH值差异不显著;发酵结束时,AP1L组的pH值明显低于CK组。AP1L组在发酵初期,pH值迅速降至最低值(5.85);随后pH值略有上升,与冯美琴等[23]对复配植物乳植杆菌与模仿葡萄球菌混合发酵香肠的研究结果一致,这是由于菌株能产生有机酸,使香肠的pH值迅速下降,随着发酵的进行,微生物分解蛋白质产生一些游离氨基酸、胺、氨等碱性物质,使发酵香肠的pH值上升[24]。
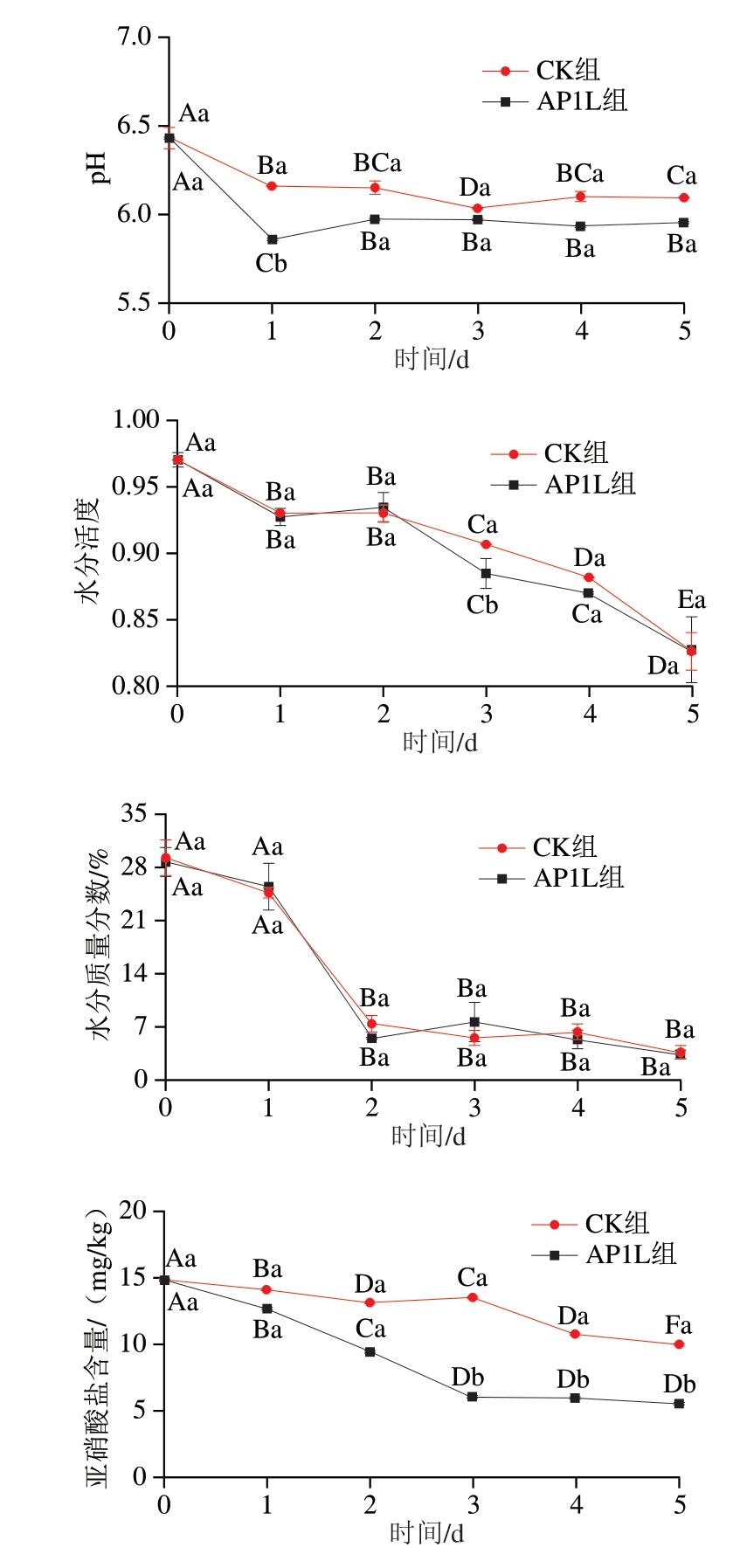
图1 香肠发酵过程中常规理化指标变化
Fig. 1 Changes in physicochemical indexes during sausage fermentation
大写字母不同表示同一处理、不同发酵时间之间差异显著(P<0.05);小写字母不同表示同一发酵时间、不同处理之间差异显著(P<0.05)。图2~3、5同。
较低的水分含量是确保发酵香肠保质期和安全性的关键,随着发酵的进行,2 组香肠水分含量和水分活度均显著降低(P<0.05),这可能是由于发酵过程中的水分蒸发[24-26],其中,AP1L组的水分含量和水分活度较低,除发酵过程中水分蒸发外,还因乳酸菌增殖导致酸的产生和pH值的降低,导致肌肉蛋白变性、肌束收缩和蛋白质网络的水分流失[27]。此外,发酵香肠在制作过程中,随着时间的延长,水分含量整体呈下降趋势,尤其是在发酵2 d后2 组香肠水分含量迅速降低且显著低于发酵0 d(P<0.05),可能是由于肠衣直径小,水分流失快[25]。接菌发酵可以降低香肠的水分含量和水分活度,从而抑制在发酵过程中的有害菌生长,为延长香肠的保质期提供了可能性。
随着发酵过程的进行,香肠亚硝酸盐含量呈下降趋势,发酵结束时,香肠样品的亚硝酸盐含量均远低于GB 2760—2024《食品安全国家标准 食品添加剂使用标准》[28]中规定的亚硝酸盐残留量上限30 mg/kg,且发酵5 d时,AP1L组的亚硝酸盐含量为5.51 mg/kg,显著低于CK组(10.00 mg/kg,P<0.05),说明接种植物乳植杆菌和嗜根考克氏菌有利于亚硝酸盐的降解。
2.2 发酵菌株对香肠颜色的影响
由图2可知,接种发酵对发酵香肠色差值有一定的影响,其中,香肠L*均呈降低趋势,这与植物乳植杆菌与其他CNC复配发酵香肠的变化一致[12,22],可能是由于在发酵过程中水分含量减少,导致香肠的L*减小[29];香肠a*、b*均呈现先升高后降低趋势,这与植物乳植杆菌与其他CNC复配发酵香肠的变化一致[7,22];香肠C总体略有降低趋势,发酵结束时,AP1L组的L*和C均显著高于CK组(P<0.05);b*显著低于CK组(P<0.05),表明接种复合发酵菌株有助于香肠形成良好的色泽,可能由于CNC具有发色功能,同时低pH值促进亚硝基肌红蛋白生成[30]。
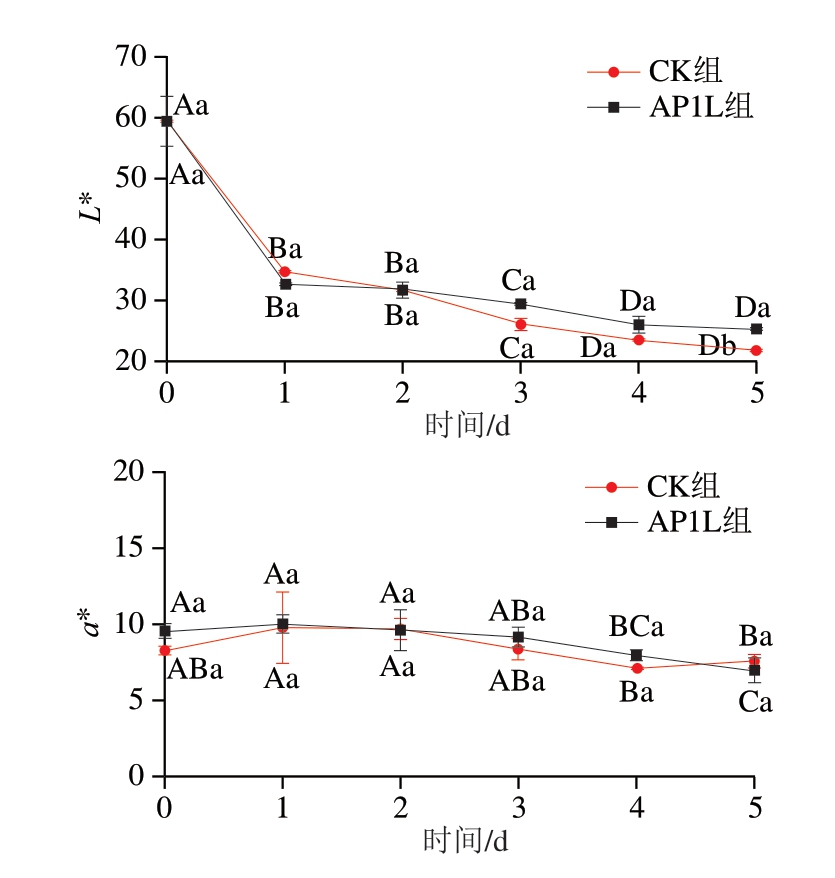
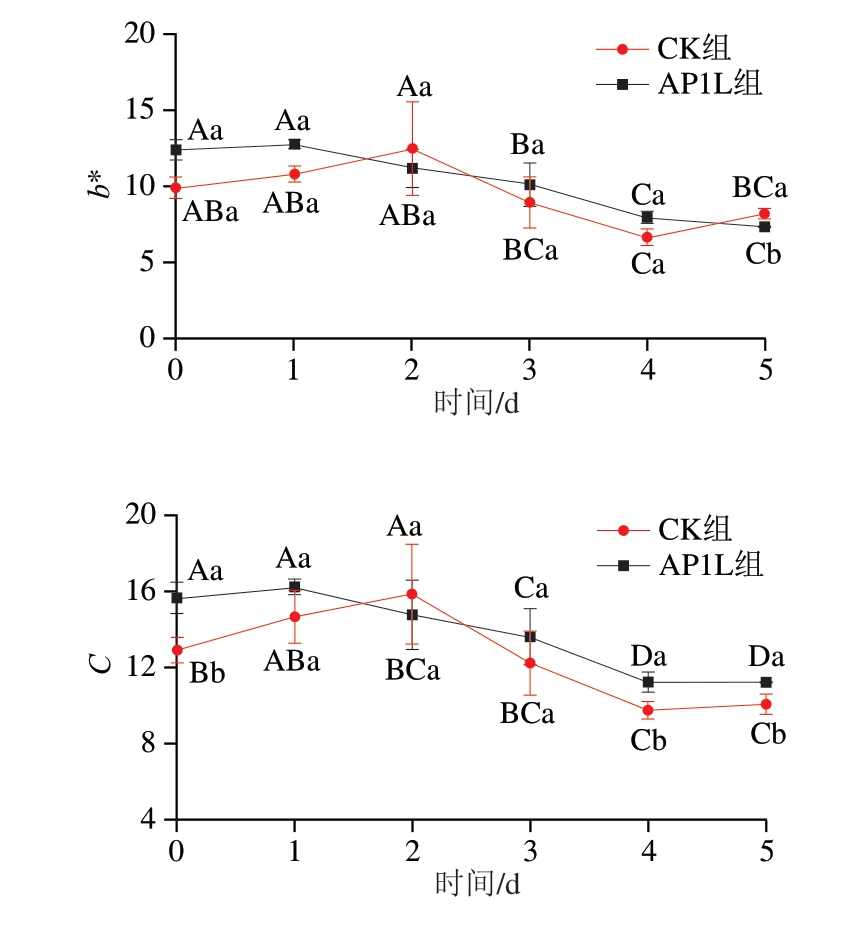
图2 香肠发酵过程中的颜色变化
Fig. 2 Changes in color during sausage fermentation
2.3 发酵菌株对香肠质构特性的影响
由图3可知,在发酵过程中,各组香肠的硬度、咀嚼性均有不同程度的上升,弹性变化不明显,内聚性呈下降趋势。发酵结束时,AP1L组的硬度和咀嚼性均显著高于CK组(P<0.05),表明接菌能显著提高香肠的硬度和咀嚼性,可能的原因为香肠水分含量减少,从而使香肠的结构更致密[29];在发酵过程中,pH值的降低导致蛋白质的展开和疏水性基团的暴露,促进疏水相互作用[31],并削弱蛋白质与水之间的相互作用。随着酸化程度的增加,疏水相互作用可能在接种香肠的蛋白凝胶网络结构中起主导作用,蛋白质分子通过疏水相互作用顺序连接形成弹性凝胶,增强了香肠的弹性和凝聚力[32]。
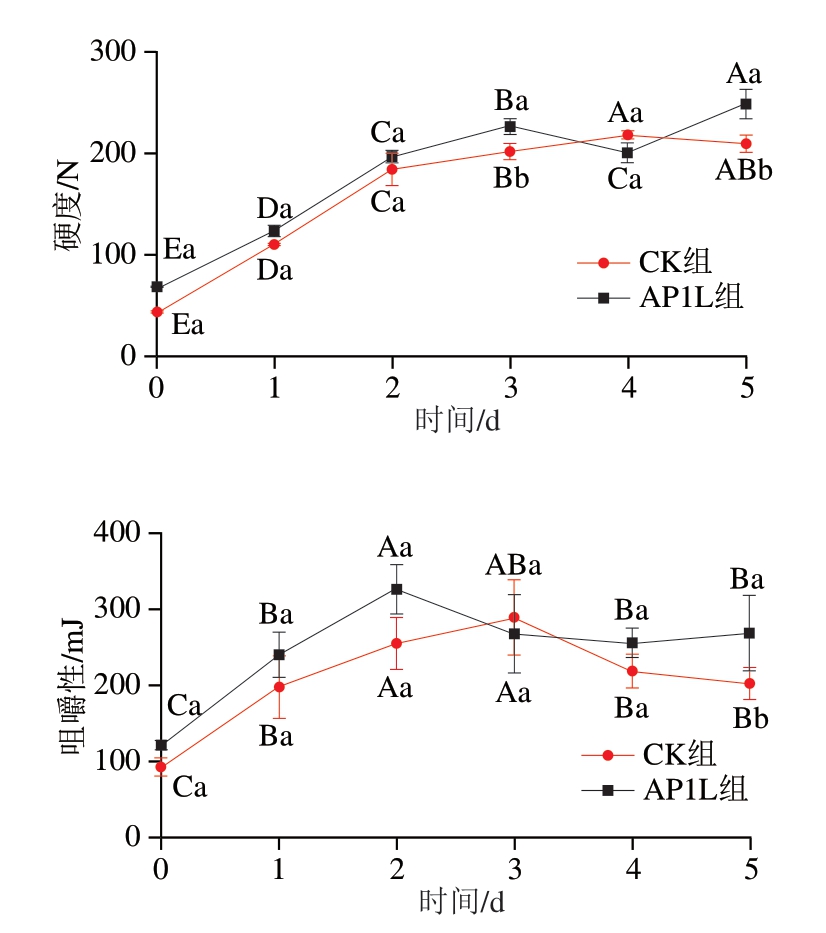
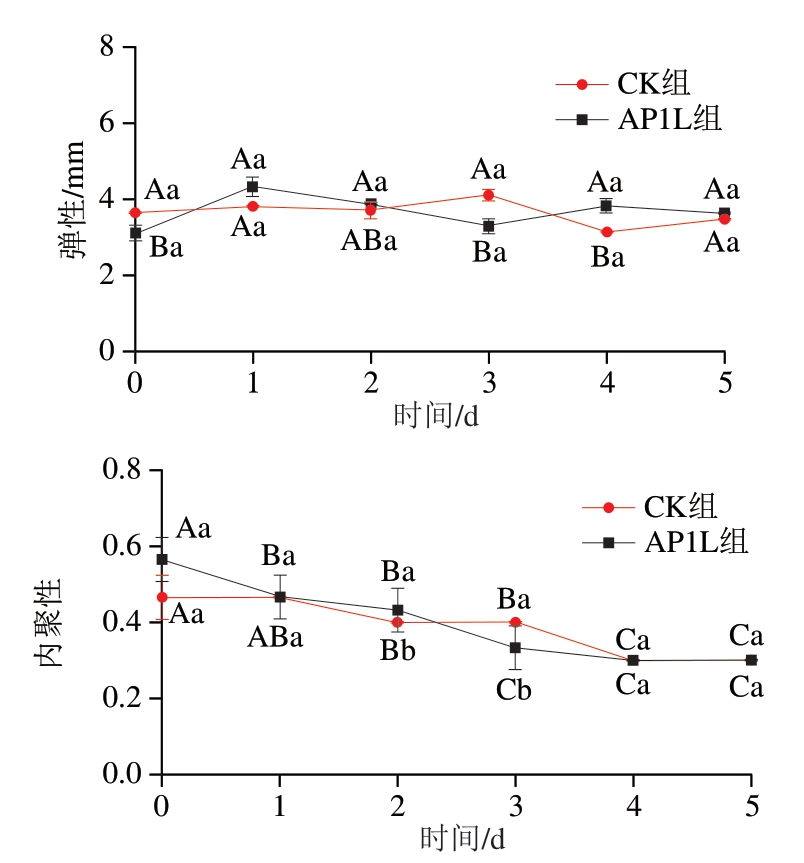
图3 香肠发酵过程中的质构特性变化
Fig. 3 Changes in texture during sausage fermentation
2.4 香肠感官评价
感官特性在决定最终产品的可接受性方面是至关重要的。香肠的感官特性容易受到发酵过程中pH值、水分含量和蛋白质水解变化的影响[33]。如图4所示,通过感官对发酵香肠的外观、色泽、风味、口感和组织状态进行评价,发现AP1L组均优于CK组,其中,AP1L色泽好可能是由于菌种组合具有较好的发色作用[1];口感好可能是由于其水分含量低且菌剂的加入增强了香肠的弹性和凝聚力;风味好可能是由于复合菌株组合通过蛋白质和脂质分解代谢产生游离氨基酸、醛、酮、酯类等风味化合物,有利于改善香肠的风味[34],且复配后不会导致过酸,影响口感。
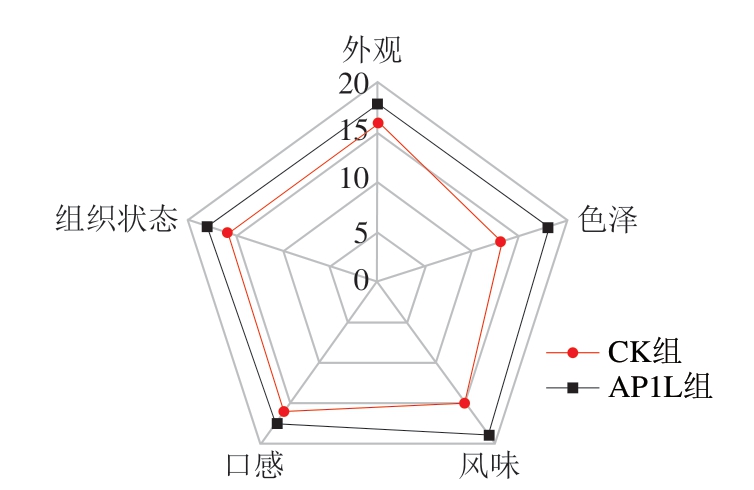
图4 发酵香肠的感官评价结果雷达图
Fig. 4 Radar map of the sensory evaluation of fermented sausages
2.5 发酵菌株对香肠游离氨基酸的影响
游离氨基酸来源于肉类内源性酶和微生物蛋白水解酶对肌肉蛋白的降解,在发酵肉制品的风味形成中起着重要作用[1]。为进一步研究复合菌株在发酵香肠感官特性和营养价值中起到的作用,对发酵成熟的CK组和AP1L组进行氨基酸测定。如表2所示,发酵香肠中共检测出17 种氨基酸,其中必需氨基酸8 种,且经过发酵后,AP1L组中11 种氨基酸和总氨基酸含量均显著高于CK组(P<0.05),这与植物乳植杆菌与CNC复配发酵香肠的报道[23,29]相似。AP1L组的氨基酸总含量为289.21 mg/g,显著高于CK组(P<0.05)。氨基酸总含量的增加可能与乳杆菌和CNC的蛋白水解活性有关[35],说明菌剂具有较高的蛋白酶活性。
表2 香肠游离氨基酸含量及TAV
Table 2 Contents and TAV of free amino acids in fermented sausages
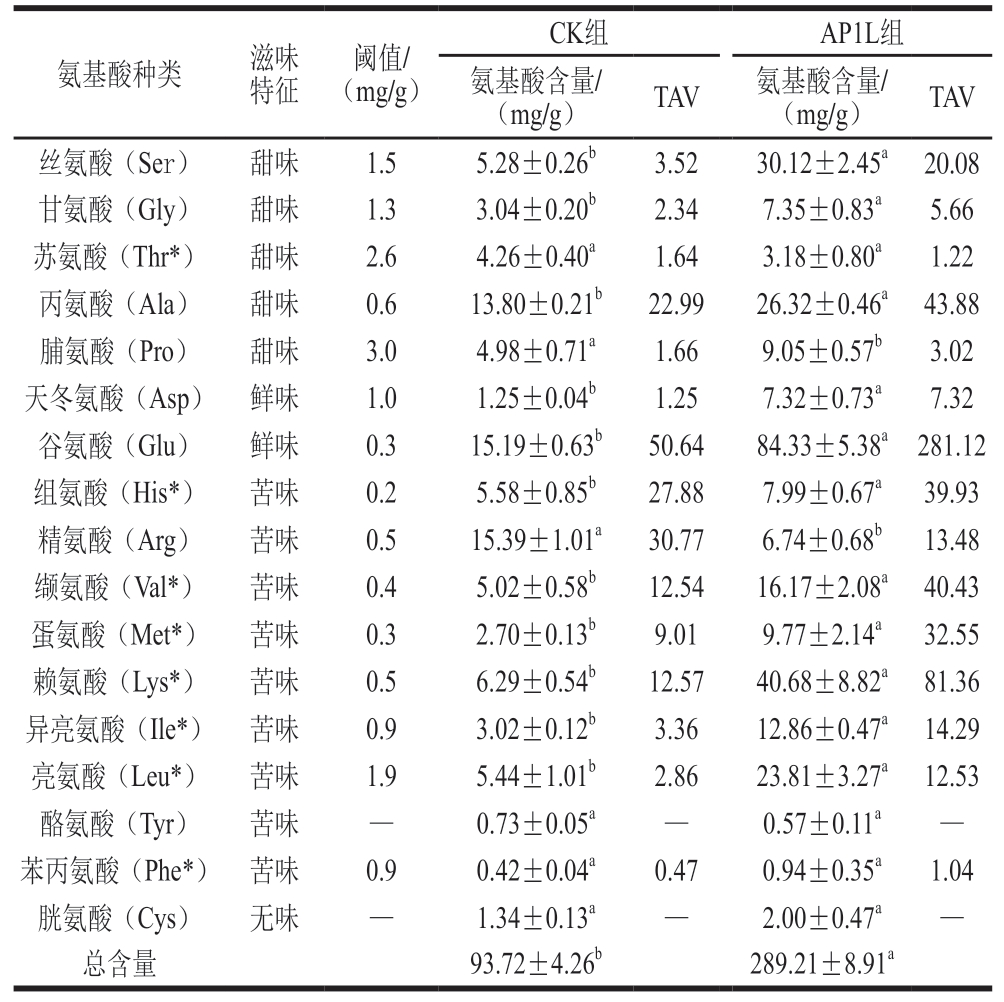
注:小写字母不同表示差异显著(P<0.05);—.未检出;*.必需氨基酸。
氨基酸种类滋味特征阈值/(mg/g)CK组AP1L组氨基酸含量/(mg/g)TAV氨基酸含量/(mg/g)TAV丝氨酸(Ser)甜味1.55.28±0.26b3.5230.12±2.45a 20.08甘氨酸(Gly)甜味1.33.04±0.20b2.347.35±0.83a5.66苏氨酸(Thr*)甜味2.64.26±0.40a1.643.18±0.80a1.22丙氨酸(Ala)甜味0.613.80±0.21b22.9926.32±0.46a 43.88脯氨酸(Pro)甜味3.04.98±0.71a1.669.05±0.57b3.02天冬氨酸(Asp) 鲜味1.01.25±0.04b1.257.32±0.73a7.32谷氨酸(Glu)鲜味0.315.19±0.63b50.6484.33±5.38a 281.12组氨酸(His*)苦味0.25.58±0.85b27.887.99±0.67a39.93精氨酸(Arg)苦味0.515.39±1.01a30.776.74±0.68b 13.48缬氨酸(Val*)苦味0.45.02±0.58b12.5416.17±2.08a 40.43蛋氨酸(Met*) 苦味0.32.70±0.13b9.019.77±2.14a32.55赖氨酸(Lys*)苦味0.56.29±0.54b12.5740.68±8.82a 81.36异亮氨酸(Ile*) 苦味0.93.02±0.12b3.3612.86±0.47a 14.29亮氨酸(Leu*)苦味1.95.44±1.01b2.8623.81±3.27a 12.53酪氨酸(Tyr)苦味—0.73±0.05a—0.57±0.11a—苯丙氨酸(Phe*) 苦味0.90.42±0.04a0.470.94±0.35a1.04胱氨酸(Cys)无味—1.34±0.13a—2.00±0.47a—总含量93.72±4.26b289.21±8.91a
游离氨基酸按照呈味特性可分为鲜味、甜味和苦味三大类[1]。经接菌发酵后,香肠中大部分的鲜、甜、苦味氨基酸含量均显著升高(P<0.05),其中,含量最高的是谷氨酸,其次是赖氨酸、丝氨酸和丙氨酸。AP1L组中除苏氨酸(甜味)、脯氨酸(甜味)、精氨酸(苦味)、酪氨酸(苦味)和苯丙氨酸(苦味)外,其余11 种呈味氨基酸均显著高于自然发酵的CK组(P<0.05)。
天冬氨酸和谷氨酸具有鲜味,这可能有助于香肠的整体味道[1]。AP1L组的天冬氨酸含量(7.32 mg/g)显著高于CK组(1.25 mg/g;P<0.05),表明接种菌株可能在增强香肠鲜味方面发挥了关键作用;AP1L组的谷氨酸含量(84.33 mg/g)显著高于CK组(15.19 mg/g,P<0.05),有助于鲜味的表达。AP1L组的精氨酸含量显著低于CK组(P<0.05),表明接种菌株可以降低苦味氨基酸的含量。此外,某些支链氨基酸,如亮氨酸、异亮氨酸和缬氨酸,可以转化为甲基支醇、醛和酸,从而形成干香肠的独特风味[10]。
香肠经过发酵处理后,绝大多数氨基酸对香肠的滋味形成做出了贡献(TAV>1),AP1L组中15 种氨基酸对滋味形成均有贡献,其中,谷氨酸、赖氨酸、丙氨酸、缬氨酸、组氨酸和蛋氨酸对香肠滋味的贡献较大;CK组中对滋味贡献较大的是谷氨酸、精氨酸。研究[36-37]表明,含有植物乳植杆菌的发酵剂可以利用缬氨酸、亮氨酸和异亮氨酸分别生成在腌制肉制品中产生成熟香气的2-甲基丙醛、3-甲基丁醛和2-甲基丁醛。乳酸菌具有通过转氨酶活性将缬氨酸和亮氨酸转化为各自的α-酮酸的能力,而α-酮酸可形成多种产香化合物,从而赋予发酵香肠特征风味[27]。因此,接菌发酵可促进呈味氨基酸的释放,影响发酵香肠的风味和口感。氨基酸除本身呈味外,部分还可作为风味化合物的前体,进一步转化为更多的挥发性风味成分,从而增强发酵香肠的风味。
2.6 发酵过程中的细菌演化
2.6.1 乳酸菌、CNC的活菌数分析
由图5可知,发酵过程中接菌组的乳酸菌数显著高于CK组(P<0.05),说明植物乳植杆菌的接种可使乳酸菌在香肠中迅速成为优势菌。AP1L组发酵前期(0~2 d),乳酸菌菌落总数显著上升至7.60(lg(CFU/g))(P<0.05),对抑制发酵香肠内不良微生物的生长繁殖具有积极作用。AP1L组的CNC菌落数均显著高于CK组(P<0.05),且在整个发酵过程中CNC数量维持在较高水平;在发酵后期略有降低,一方面可能是由于CNC活性受到营养物质缺乏、代谢产物积累、水分流失等不利因素影响;另一方面可能是由于植物乳植杆菌具有较强的竞争能力,产生的乳酸抑制了其他微生物的生长[38]。CK组中能检测出少量的乳酸菌和CNC,这可能是由于鲜肉中含有微球菌、葡萄球菌和乳酸菌等多种细菌。
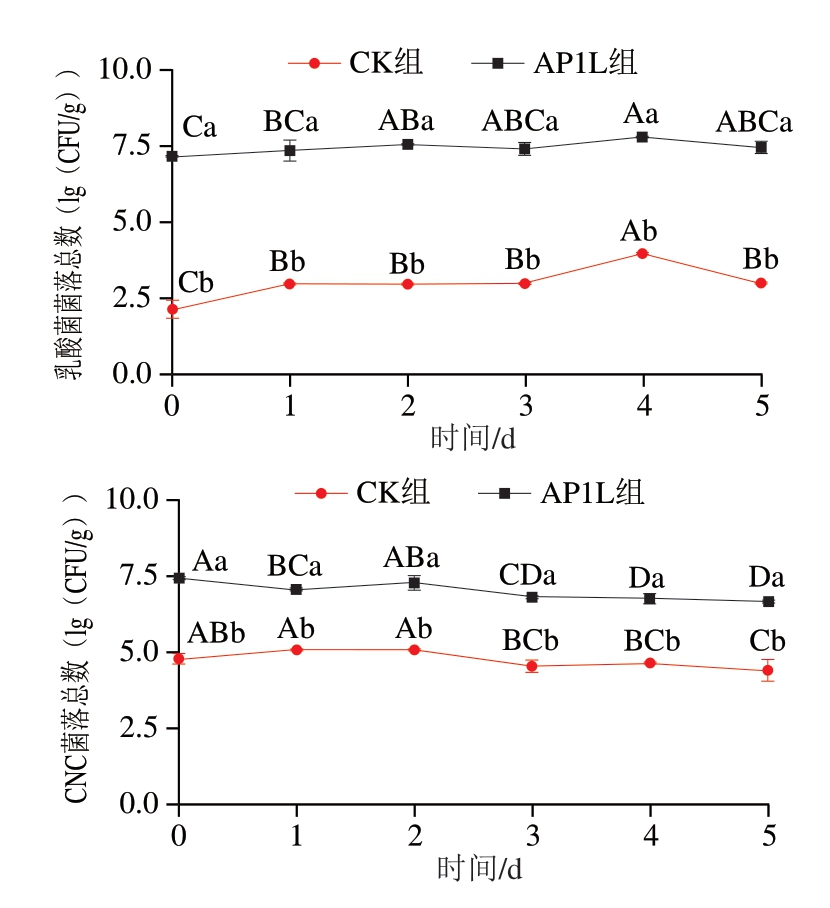
图5 香肠发酵过程中的菌落数变化
Fig. 5 Changes in viable bacterial count during sausage fermentation
2.6.2 微生物多样性分析
2.6.2.1 样品测序数据统计和细菌α多样性分析
对原始测序数据进行双端剪接、质量控制和去除嵌合体,共得到211 702 条CCS序列,平均序列长度为1 479 bp。共获分类注释14 门、20 纲、60 目、112 科、204 属、279 种。与自然发酵香肠[39]相比,发酵剂明显降低了发酵香肠中细菌群落的多样性,这与Xiao Yaqing等[40]的研究结果一致。
由图6可知,样品稀释曲线趋于平缓,样品序列充分,样品中已包含绝大多数细菌物种信息。等级丰度曲线在横轴上的范围较大,在垂直方向渐进平缓,表明所测样品中物种丰富度较高且分布均匀。根据97%相似性水平下的操作分类单元(operational taxonomic unit,OTU)信息,采用α多样性指标中的ACE指数、Chao1指数、Shannon指数和Simpson指数表示样品中细菌的多样性和丰富度。由表3可知,发酵0 d样品的ACE指数、Chao1指数和Shannon指数最高,说明发酵0 d时,细菌物种多样性和丰富度最高。各样品的覆盖率均为1,表明测序结果可以代表样品中微生物的真实情况。
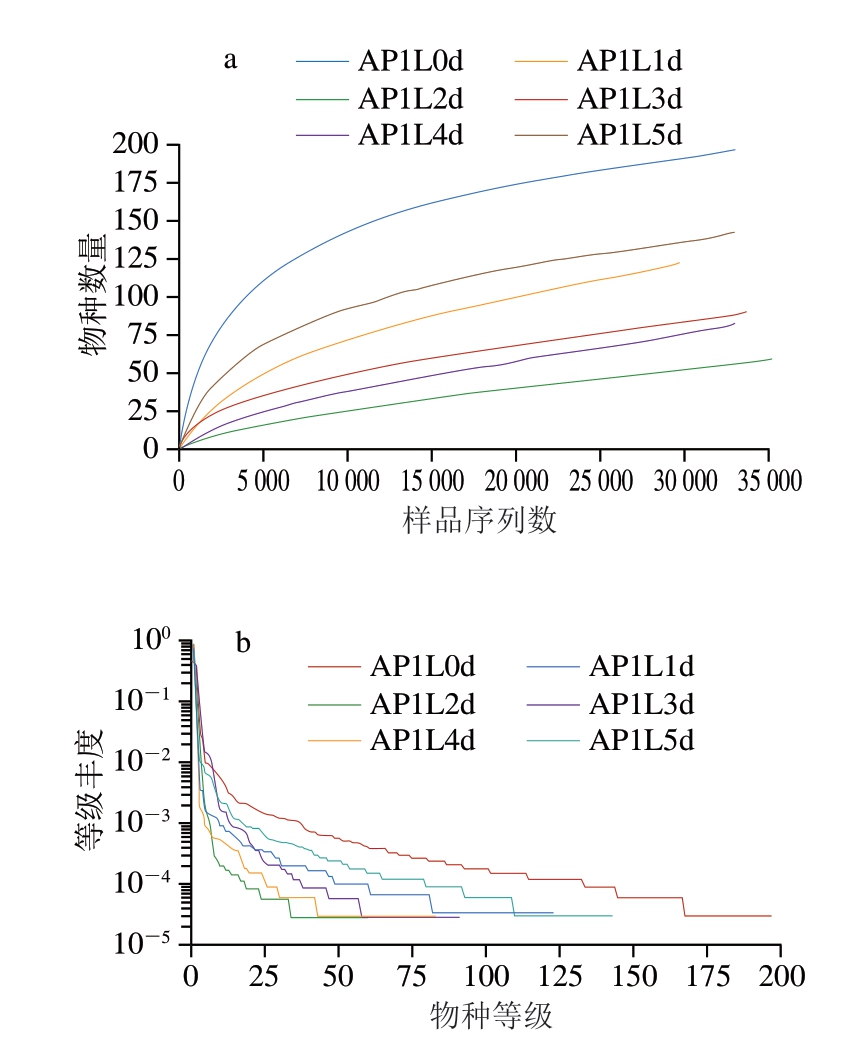
图6 发酵香肠样品稀释曲线(a)和等级丰度曲线(b)
Fig. 6 Rarefaction curves (a) and rank abundance curves (b) of fermented sausages during fermentation
AP1L0d、AP1L1d、AP1L2d、AP1L3d、AP1L4d、AP1L5d分别表示AP1L组发酵0、1、2、3、4、5 d的样品。图7同。
表3 不同发酵样品中细菌OTU数和α多样性指数
Table 3 Number of bacterial OTUs and α-diversity indexes in fermented sausages during fermentation
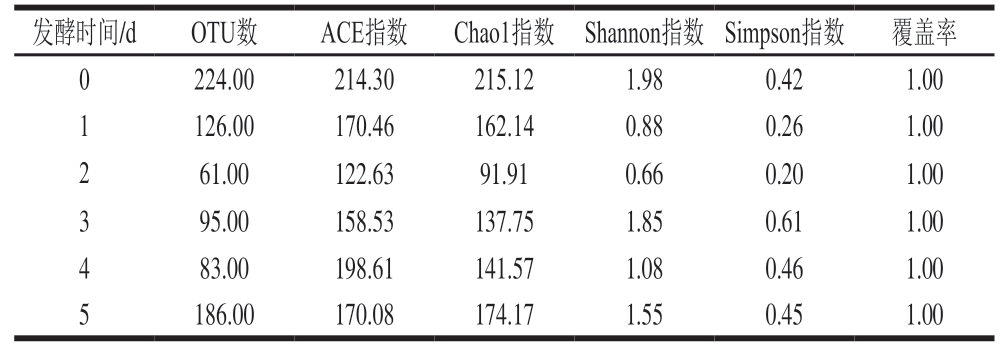
发酵时间/dOTU数ACE指数Chao1指数 Shannon指数 Simpson指数覆盖率0224.00214.30215.121.980.421.00 1126.00170.46162.140.880.261.00 261.00122.6391.910.660.201.00 395.00158.53137.751.850.611.00 483.00198.61141.571.080.461.00 5186.00170.08174.171.550.451.00
2.6.2.2 接种发酵香肠过程中细菌群落变化
如图7所示,在属水平上,接种的乳植杆菌属和考克氏菌属在整个发酵过程中始终处于主导地位(相对丰度高于1%),这表明复合发酵剂的使用改变了香肠中的微生物群落结构[23]。发酵剂通过对腐败菌、致病菌的抑制,有效提高了发酵香肠的安全性,延长了发酵香肠的保质期。整个发酵过程中,乳杆菌属随发酵的进行先增加后减少,考克氏属呈先减少后增加并稳定的趋势。接种的香肠中乳杆菌属和考克氏属的相对丰度明显高于其他属,这可能表明发酵剂在发酵的香肠中生长良好并且发酵剂可导致细菌群落构成的显著变化[41]。与这些细菌相比,其他大多数细菌(如葡萄球菌属、魏斯氏菌属(Weissella)等)在发酵前期较为丰富,而随着发酵的进行,细菌种类和丰度逐渐减少。考克氏菌与植物乳植杆菌组合的适应性与其他葡萄球菌和植物乳植杆菌复合菌剂相类似[40-41]。假单胞菌是与腐败有关的微生物,会产生不良代谢物和异味化合物[42],其在接种的香肠中被抑制,这可能是发酵剂产生的抗菌代谢物及对营养物质的竞争加剧所致,与Xiao Yaqing等[40]的研究结果一致。
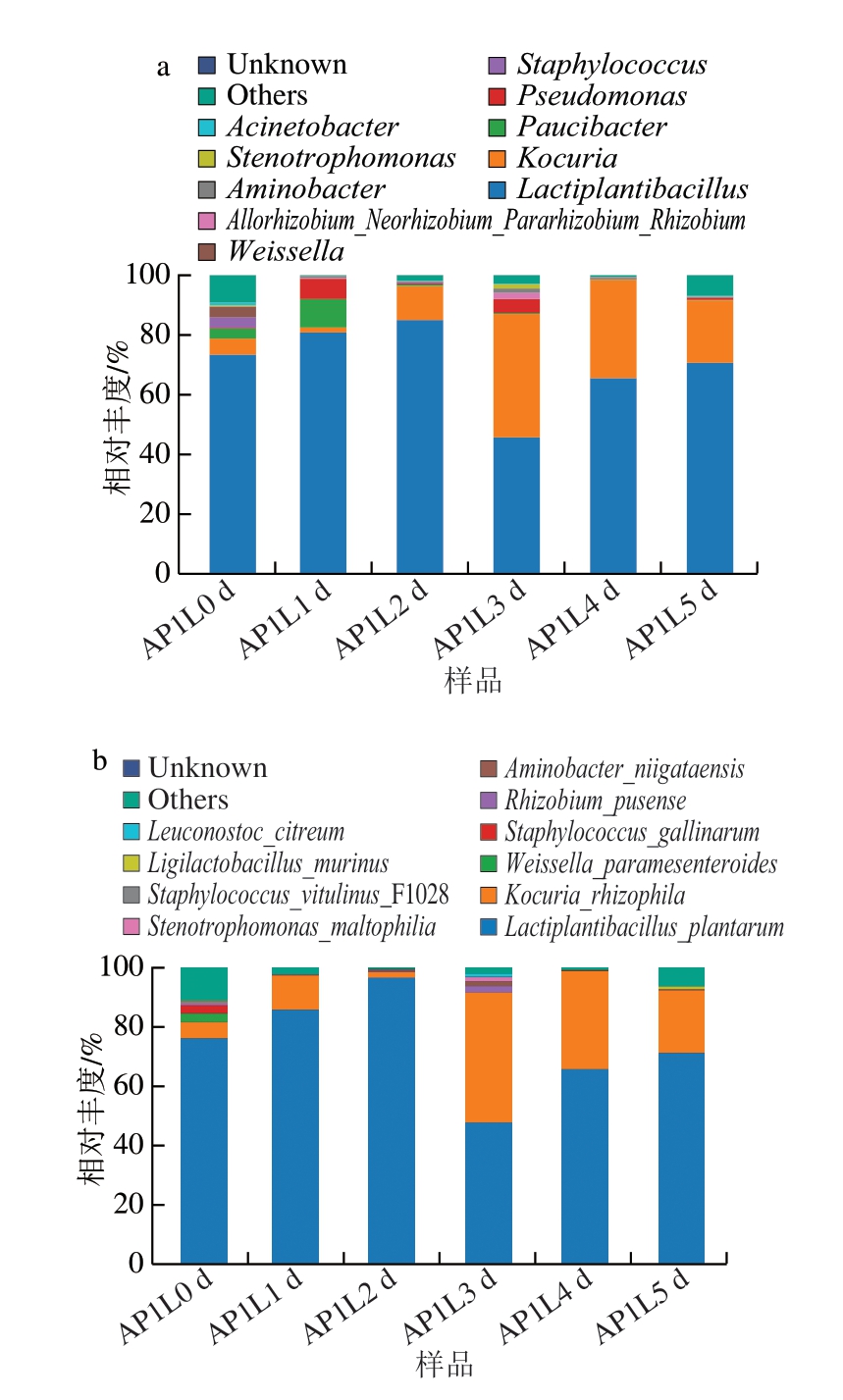
图7 发酵香肠不同阶段细菌属水平(a)、种水平(b)相对丰度变化
Fig. 7 Relative abundance of bacterial genera (a) and species (b) in fermented sausages during fermentation
在种水平上,接种的植物乳植杆菌和嗜根考克氏菌在整个发酵过程中始终处于主导地位(相对丰度高于1%),表明两者在混合发酵时,仍然具有很强的生长性能。在发酵过程中,植物乳植杆菌相对丰度随着发酵时间延长先上升再下降,发酵2 d时,样本中相对丰度占比最高,达到96.54%,发酵结束(发酵5 d)时达到71.24%;嗜根考克氏菌随着发酵时间的变化波动较大,发酵3 d时样本中相对丰度占比最高,达到41.73%,发酵结束(发酵5 d)时达到21.06%。此外,类肠膜魏斯氏菌(Weissella paramesenteroides)、鸡葡萄球菌(Staphylococcus gallinarum)、小牛葡萄球菌(Staphylococcus vitulinus)等广泛存在于早期发酵阶段[43],随着发酵的进行,其会被其他乳酸菌所取代。结合图5可知,随着香肠发酵的进行,温度、水分均不再适宜微生物的生长,但发酵结束时仍然能维持较高的活菌数,表明嗜根考克氏菌AP1与植物乳植杆菌L组合在整个发酵过程中维持较高活性。微生物分析结果表明,接种处理通过增强优势菌(植物乳植杆菌和嗜根考克氏菌)的竞争能力和限制有害菌(致病菌和腐败菌)的生长,改善了香肠中的细菌群落构成,这可能有助于香肠在成熟过程中风味的发展。
2.6.3 接种发酵香肠优势菌种与氨基酸的相关性分析
为了进一步探索香肠优势微生物与游离氨基酸的关系,将发酵过程中的AP1L组样品中优势微生物(前5 种)与游离氨基酸进行相关性分析(图8)。在整个发酵过程中,不同的细菌与游离氨基酸的相关性存在差异,其中,嗜根考克氏菌与16 种氨基酸呈正相关,与2 种氨基酸(赖氨酸、异亮氨酸)呈高度显著正相关(P<0.001),与1 种氨基酸(酪氨酸)呈负相关;植物乳植杆菌与1 种氨基酸(酪氨酸)呈正相关,与11 种氨基酸呈负相关,与2 种氨基酸(赖氨酸、异亮氨酸)呈高度显著负相关(P<0.001),表明在发酵过程中,嗜根考克氏菌对于香肠中游离氨基酸的积累起积极作用,促进香肠风味的形成,与本课题组前期对考克氏菌在发酵肉制品中产香的研究结果[1,13]一致。
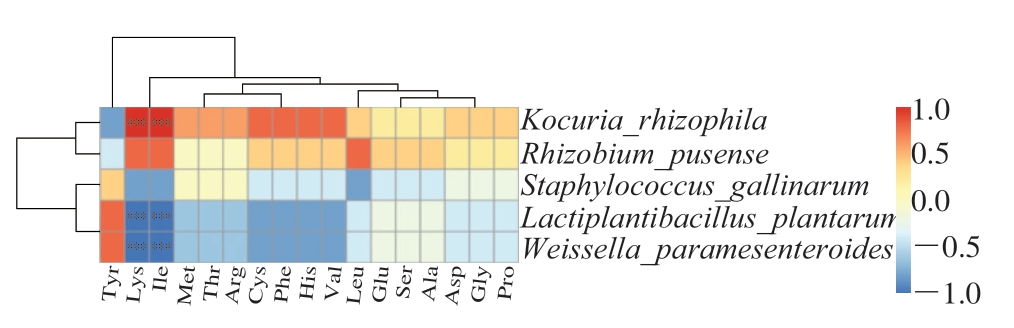
图8 优势菌群(前5 种)与游离氨基酸的相关性热图
Fig. 8 Correlation heatmap between dominant bacteria (top 5) and free amino acids
***.高度显著相关(P<0.001)。
3 结 论
以自然发酵香肠为空白对照组,主要研究嗜根考克氏菌AP1和植物乳植杆菌L复配发酵香肠在发酵周期内(0~5 d)pH值、水分含量、水分活度、亚硝酸盐含量、质构特性、游离氨基酸含量、活菌数及多样性等指标的变化。研究发现,随着发酵过程的进行,嗜根考克氏菌AP1与植物乳植杆菌L复配发酵香肠的品质得到提升。发酵结束时(5 d),AP1L组较CK组亚硝酸盐含量减少44.87%;C较CK组提高11.04%;硬度、咀嚼性和感官得分也优于CK组,表明嗜根考克氏菌AP1和植物乳植杆菌L复配可以有效提升发酵香肠的安全性、色泽、质构及感官特性。对发酵香肠中游离氨基酸含量的研究结果表明,嗜根考克氏菌AP1和植物乳植杆菌L复配可显著提高总游离氨基酸含量(P<0.05),增强发酵香肠的风味。活菌数及细菌多样性分析结果表明,接种处理通过增强优势菌(尤其是对香肠中游离氨基酸的积累起积极作用的嗜根考克氏菌)的竞争能力和限制有害菌(致病菌和腐败菌)的生长,改善了香肠中的细菌群落构成,促进香肠风味的形成,验证了肉制品中常见的考克氏菌作为肉制品发酵辅助菌种的可行性。
[1] 刘毕琴, 李宏, 陈骏飞, 等. 嗜根考克氏菌K45对发酵猪肉品质的影响[J]. 中国酿造, 2023, 42(3): 101-108. DOI:10.11882/j.issn.0254-5071.2023.03.018.
[2] 张新斌, 胡炜东, 李君冉, 等. 植物乳杆菌对发酵肉制品风味影响研究进展[J]. 肉类研究, 2023, 37(9): 70-75. DOI:10.7506/rlyj1001-8123-20230529-052.
[3] VAN DER VEKEN D, LEROY F. Prospects for the applicability of coagulase-negative cocci in fermented-meat products using omics approaches[J]. Current Opinion in Food Science, 2022, 48: 100918.DOI:10.1016/j.cofs.2022.100918.
[4] 杨淳淋, 周辉, 甄宗圆, 等. 肉品发酵剂及其对肉制品影响的研究进展[J]. 肉类研究, 2024, 38(2): 56-62. DOI:10.7506/rlyj1001-8123-20240123-028.
[5] RAMOS G L, VIGODER H C, NASCIMENTO J S. Kocuria spp. in foods: biotechnological uses and risks for food safety[J]. Applied Food Biotechnology, 2021, 8(2): 79-88. DOI:10.1080/07373937.2024.2340050.
[6] CENTENO J A, GARABAL J I, DOCAMPO F, et al. Recovering traditional raw-milk Tetilla cheese flavour and sensory attributes by using Kocuria varians and Yarrowia lipolytica adjunct cultures[J].International Journal of Food Microbiology, 2017, 251: 33-40.DOI:10.1016/j.ijfoodmicro.2017.03.014.
[7] UZAIR B, MENAA F, KHAN B A, et al. Isolation, purification,structural elucidation and antimicrobial activities of kocumarin, a novel antibiotic isolated from actinobacterium Kocuria marina CMG S2 associated with the brown seaweed Pelvetia canaliculata[J].Microbiological Research, 2018, 206: 186-197. DOI:10.1016/j.micres.2017.10.007.
[8] TREMONTE P, SUCCI M, REALE A, et al. Interactions between strains of Staphylococcus xylosus and Kocuria varians isolated from fermented meats[J]. Journal of Applied Microbiology, 2007, 103(3):743-751. DOI:10.1111/j.1365-2672.2007.03315.x.
[9] COLORETTI F, CHIAVARI C, ARMAFORTE E, et al. Combined use of starter cultures and preservatives to control production of biogenic amines and improve sensorial profile in low-acid salami[J]. Journal of Agricultural and Food Chemistry, 2008, 56(23): 11238-11244.DOI:10.1021/jf802002z.
[10] SCANNELL A G M, KENNEALLY P M, ARENDT E K.Contribution of starter cultures to the proteolytic process of a fermented non-dried whole muscle ham product[J]. International Journal of Food Microbiology, 2004, 93(2): 219-230. DOI:10.1016/j.ijfoodmicro.2003.11.007.
[11] GOGOI P, BORPUZARI R N, BORPUZARI T, et al. Effect of starter cultures and packaging methods on amino acid profile and eating quality characteristics of pork ham[J]. Journal of Food Science and Technology, 2015, 52(8): 5329-5334. DOI:10.1007/s13197-014-1532-2.
[12] IACUMIN L, OSUALDINI M, BOVOLENTA S, et al. Microbial,chemico-physical and volatile aromatic compounds characterization of Pitina PGI, a peculiar sausage-like product of North East Italy[J]. Meat Science, 2020, 163: 108081. DOI:10.1016/j.meatsci.2020.108081.
[13] SHI Q, WANG X R, JU Z J, et al. Technological and safety characterization of Kocuria rhizophila isolates from traditional ethnic dry-cured ham of Nuodeng, Southwest China[J]. Frontiers in Microbiology, 2021, 12: 761019. DOI:10.3389/fmicb.2021.761019.
[14] 巩洋. 低酸度川式萨拉米香肠的工艺优化及其品质变化研究[D].雅安: 四川农业大学, 2015.
[15] 国家卫生和计划生育委员会. 食品安全国家标准 食品pH值的测定: GB 5009.237—2016[S]. 北京: 中国标准出版社, 2017: 1-4.
[16] 国家卫生和计划生育委员会. 食品安全国家标准 食品中水分的测定: GB 5009.3—2016[S]. 北京: 中国标准出版社, 2017: 1-4.
[17] 国家卫生和计划生育委员会. 食品安全国家标准 食品水分活度的测定: GB 5009.238—2016[S]. 北京: 中国标准出版社, 2017: 1-4.
[18] 国家卫生和计划生育委员会. 食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定: GB 5009.33—2016[S]. 北京: 中国标准出版社,2016: 1-4.
[19] 范鑫洋, 张香美, 康晶, 等. 不同比例克鲁维酵母对低盐发酵香肠品质特征的影响[J]. 食品与发酵工业, 2025, 51(2): 227-233.DOI:10.13995/j.cnki.11-1802/ts.038789.
[20] 王宁宁, 冯美琴, 孙健. 低钠复合盐对发酵香肠理化特性及风味的影响[J]. 食品科学, 2021, 42(16): 1-7. DOI:10.7506/spkx1002-6630-20210409-116.
[21] 黄春阳, 王哲, 王灵娟, 等. 添加非肉蛋白对南京香肠品质特性的影响[J]. 食品工业科技, 2023, 44(21): 91-96. DOI:10.13386/j.issn1002-0306.2023010002.
[22] 国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品中氨基酸的测定: GB 5009.124—2016[S]. 北京:中国标准出版社, 2017: 1-4.
[23] 冯美琴, 张杰, 孙健. 模仿葡萄球菌接种对发酵香肠品质及氧化稳定性的影响[J]. 食品科学, 2022, 43(4): 105-112. DOI:10.7506/spkx1002-6630-20210805-062.
[24] TIAN Z Q, ZHOU J, ZHU Q J. Effect on characterization of microbial community and sensory based on Staphylococcus simulans ZF4 and Lactobacillus plantarum SJ4 as starter in fermented pork loin[J].Food Science of Animal Products, 2023, 1: 9240015. DOI:10.26599/FSAP.2023.9240015.
[25] WANG H P, ZHANG H W, LIU S T, et al. Analysis of biogenic amine in dry sausages collected from Northeast China: from the perspective of free amino acid profile and bacterial community composition[J].Food Research International, 2022, 162: 112084. DOI:10.1016/j.foodres.2022.112084.
[26] SUN Q X, CHEN Q, LI F F, et al. Biogenic amine inhibition and quality protection of Harbin dry sausages by inoculation with Staphylococcus xylosus and Lactobacillus plantarum[J]. Food Control,2016, 68: 358-366. DOI:10.1016/j.foodcont.2016.04.021.
[27] HU Y Y, CHEN Q, WEN R X, et al. Quality characteristics and flavor profile of Harbin dry sausages inoculated with lactic acid bacteria and Staphylococcus xylosus[J]. LWT-Food Science and Technology, 2019,114: 108392. DOI:10.1016/j.lwt.2019.108392.
[28] 国家卫生健康委员会, 国家市场监督管理总局. 食品安全国家标准食品添加剂使用标准: GB 2760—2024[S]. 北京: 中国标准出版社,2024: 121.
[29] 冯美琴, 龚瑶, 孙健. 植物乳杆菌和模仿葡萄球菌复配对发酵羊肉香肠理化性质、风味及多肽抗氧化能力的影响[J]. 食品科学, 2024,45(12): 116-124. DOI:10.7506/spkx1002-6630-20231007-031.
[30] 冯美琴, 李天翊, 孙健. 复合发酵剂对发酵鱼肉香肠品质、风味及其多肽抗氧化活性的影响[J]. 食品科学, 2023, 44(24): 138-145.DOI:10.7506/spkx1002-6630-20230906-044.
[31] DU X, ZHAO M N, PAN N, et al. Tracking aggregation behaviour and gel properties induced by structural alterations in myofibrillar protein in mirror carp (Cyprinus carpio) under the synergistic effects of pH and heating[J]. Food Chemistry, 2021, 362: 130222. DOI:10.1016/j.foodchem.2021.130222.
[32] LIU M Y, LUO H T, XIAO Q, et al. Effect of Latilactobacillus sakei and Staphylococcus xylosus on the textural characteristics of dry fermented sausages[J]. Food Bioscience, 2024, 59: 103972.DOI:10.1016/j.fbio.2024.103972.
[33] SELESHE S, KANG S N. Effect of different Pediococcus pentosaceus and Lactobacillus plantarum strains on quality characteristics of dry fermented sausage after completion of ripening period[J]. Food Science of Animal Resources, 2021, 41(4): 636-649. DOI:10.5851/kosfa.2021.e21.
[34] 张香美, 卢涵, 叶翠, 等. 不同发酵剂对发酵香肠菌相、挥发性风味成分及品质的影响[J]. 东北农业大学学报, 2021, 52(3): 45-53.DOI:10.19720/j.cnki.issn.1005-9369.2021.03.006.
[35] CHEN X, LI J P, ZHOU T, et al. Two efficient nitrite-reducing Lactobacillus strains isolated from traditional fermented pork(Nanx Wudl) as competitive starter cultures for Chinese fermented dry sausage[J]. Meat Science, 2016, 121: 302-309. DOI:10.1016/j.meatsci.2016.06.007.
[36] SØNDERGAARD A K, STAHNKE L H. Growth and aroma production by Staphylococcus xylosus, S. carnosus and S. equorum: a comparative study in model systems[J]. International Journal of Food Microbiology,2002, 75(1/2): 99-109. DOI:10.1016/S0168-1605(01)00729-2.
[37] WANG D B, ZHAO L H, SU R N, et al. Effects of different starter culture combinations on microbial counts and physico-chemical properties in dry fermented mutton sausages[J]. Food Science &Nutrition, 2019, 7(6): 1957-1968. DOI:10.1002/fsn3.989.
[38] HERRANZ B, DE LA HOZ L, HIERRO E, et al. Improvement of the sensory properties of dry-fermented sausages by the addition of free amino acids[J]. Food Chemistry, 2005, 91(4): 673-682. DOI:10.1016/j.foodchem.2004.06.040.
[39] JI L L, ZHOU Y N, NIE Q, et al. The potential correlation between bacterial diversity and the characteristic volatile flavor compounds of Sichuan sauce-flavored sausage[J]. Foods, 2024, 13(15): 2350.DOI:10.3390/foods13152350.
[40] XIAO Y Q, LIU Y N, CHEN C G, et al. Effect of Lactobacillus plantarum and Staphylococcus xylosus on flavour development and bacterial communities in Chinese dry fermented sausages[J].Food Research International, 2020, 135: 109247. DOI:10.1016/j.foodres.2020.109247.
[41] SHAO X F, WANG H H, SONG X Y, et al. Effects of different mixed starter cultures on microbial communities, taste and aroma compounds of traditional Chinese fermented sausages[J]. Food Chemistry: X,2024, 21: 101225. DOI:10.1016/j.fochx.2024.101225.
[42] GIELLO M, LA STORIA A, DE FILIPPIS F, et al. Impact of Lactobacillus curvatus 54M16 on microbiota composition and growth of Listeria monocytogenes in fermented sausages[J]. Food Microbiology, 2018, 72: 1-15. DOI:10.1016/j.fm.2017.11.003.
[43] FUSCO V, CHIEFFI D, FANELLI F, et al. The Weissella and Periweissella genera: up-to-date taxonomy, ecology, safety,biotechnological, and probiotic potential[J]. Frontiers in Microbiology,2023, 14: 1289937. DOI:10.3389/fmicb.2023.1289937.