利尿剂是一类通过调节肾脏功能、增加尿液排泄的药物或化学物质,根据作用机制和化学结构的不同,其可分为渗透性利尿剂、袢利尿剂、保钾利尿剂等。利尿剂可用于控制体重项目的快速减重,也可通过稀释尿液掩盖其他兴奋剂代谢痕迹,是世界反兴奋剂机构(World Anti-Doping Agency,WADA)发布的《禁用清单》中的S5类禁用物质。从药理作用来看,利尿剂能够增加尿量、促进体内多余水分和电解质排出,广泛应用于治疗水肿、高血压、心力衰竭等多种疾病[1],但长期使用可导致脱水、电解质紊乱、肾功能损伤甚至心脏骤停等严重风险。利尿剂常被用于治疗动物的水肿、心衰等症状[2-5],或用于促进生长和提高瘦肉率,可能造成残留风险。
利尿剂的检测方法主要包括薄层色谱法[6-8]、循环伏安法[9-11]、液相色谱法[12-16]、液相色谱-串联质谱法(如超高效液相色谱-串联质谱(ultra-high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)法等)[17-22]、气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)法[23-26]等。这些方法各有优缺点,GC-MS和UPLC-MS/MS是其中较为常用的2 种技术。GC-MS虽然具有较高的灵敏度,但由于其GC检测原理需要目标分析物具备挥发性,因此在利尿剂样品前处理过程中需进行复杂的衍生化处理。相比之下,UPLCMS/MS在利尿剂检测时展现出显著优势,其无需衍生化处理,有效简化前处理流程,同时具备更高的检测灵敏度和准确度,能够实现利尿剂残留的快速、精准检测。
在畜肉食品中,利尿剂通常以低含量水平存在,且样品蛋白质、脂类含量高,基质复杂,易对检测结果造成干扰。因此,在仪器分析前,样品前处理过程至关重要。有效的前处理能够去除杂质、降低基质效应,从而提高检测的灵敏度和准确度,确保分析结果的可靠性。传统的利尿剂净化方法主要包括液-液萃取(liquidliquid extraction,LLE)和多步固相萃取(solid-phase extraction,SPE)[27-30]。这些方法虽然具有一定的净化效果,但也存在明显的局限性。例如,LLE操作较为繁琐且对极性物质的提取效率偏低;SPE则需要使用大量的吸附剂和溶剂,不仅增加了检测成本和时间,还可能导致样品损失或污染,进而影响检测结果的准确性和可靠性。基于此,改进前处理方法以提升检测效率和准确性已成为当前利尿剂检测方法研究的重要方向。本研究以WADA发布的《禁用清单》中的12 种利尿剂类药物作为研究对象,结合自主开发的QuEChERS净化提取技术,拟开发一种适用于大批量猪肉中利尿剂快速测定的方法,为猪肉市场监管及进出口猪肉利尿剂检测提供技术支撑。
1 材料与方法
1.1 材料与试剂
猪肉 市购。
乙腈、甲醇、甲酸、甲酸铵(均为色谱纯)美国TEDIA公司;无水硫酸镁(MgSO4)、乙二胺-N-丙基硅烷(primary secondary amine,PSA)、C18(均为分析纯)、0.22 μm有机相微孔滤膜、利尿剂标准品(表1) 上海安谱实验科技股份有限公司;实验用水均为超纯水。
表1 利尿剂标准品信息
Table 1 Information of diuretic standards
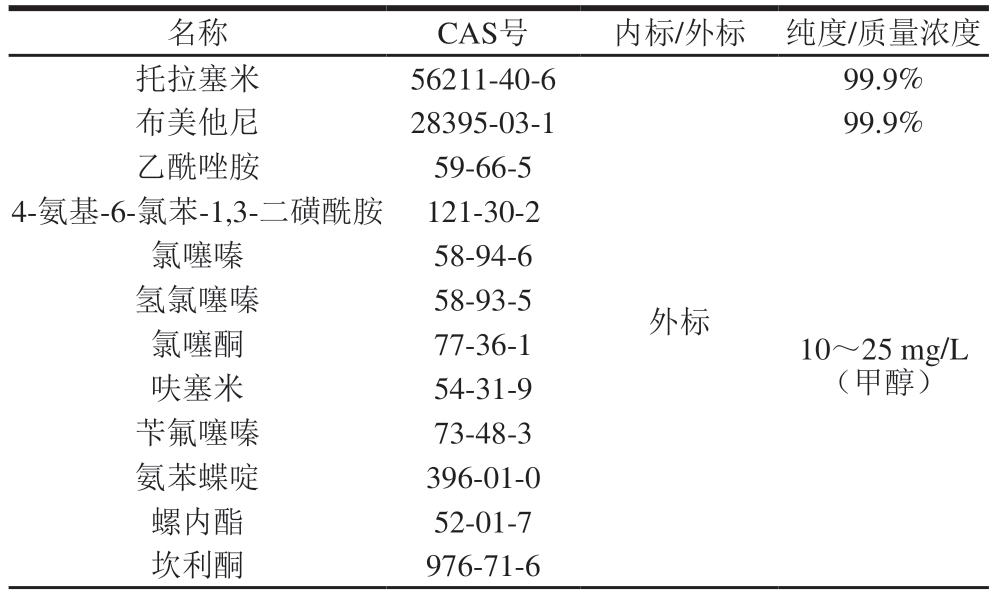
名称CAS号内标/外标 纯度/质量浓度托拉塞米56211-40-6 99.9%布美他尼28395-03-199.9%乙酰唑胺59-66-5 4-氨基-6-氯苯-1,3-二磺酰胺 121-30-2氯噻嗪58-94-6氢氯噻嗪58-93-5氯噻酮77-36-1呋塞米54-31-9苄氟噻嗪73-48-3氨苯蝶啶396-01-0螺内酯52-01-7坎利酮976-71-6外标10~25 mg/L(甲醇)
续表1

名称CAS号内标/外标 纯度/质量浓度坎利酮-D6976-71-6氢氯噻嗪-13C-D21190006-03-1呋塞米-D51189482-35-6乙酰唑胺-D31189904-01-5氯噻酮-D41794941-44-8苄氟噻嗪-D51330183-13-5氨苯蝶啶-D51189922-23-3氯噻嗪-13C15N21189440-79-6 4-氨基-6-氯苯-1,3-二磺酰胺-15N2内标10 mg/L(甲醇)446877-58-3
1.2 仪器与设备
6500 UPLC-MS/MS仪 美国AB SCIEX公司;Eclipse Plus C18色谱柱(100 mm×2.1 mm,1.8 μm) 美国Agilent公司;ME2002E电子天平(精度0.01 g) 梅特勒-托利多科技(中国)有限公司;Sorvall ST 16R高速冷冻离心机 美国赛默飞世尔科技公司;KS-7200DE超声波清洗器 昆山洁力美超声仪器有限公司;UPR-I-20TNP+ULPHW-IV超纯水系统 西安优普仪器设备有限公司;EFAA-DC-24-RT氮吹仪 上海安谱实验科技股份有限公司。
1.3 方法
1.3.1 标准溶液配制
分别称取12 种利尿剂及其9 种内标标准品,使用甲醇充分溶解并定容于10 mL棕色容量瓶,得到质量浓度100 μg/mL的单标储备液和100 μg/mL的内标储备液,-20 ℃保存备用。准确移取适量利尿剂单标储备液,用甲醇稀释成质量浓度1 μg/mL的混合标准工作液,以相同方法配制1 μg/mL的内标混合标准工作液,4 ℃保存备用。
1.3.2 样品前处理
准确称取2.00 g制备均匀的猪肉样品于离心管,加入100 μL 1 μg/mL内标混合标准工作液,再加入10 mL乙腈作为提取溶剂,混合均匀,超声(频率40 kHz)提取约20 min,9 000 r/min离心8 min,将上层提取液转移至含有200 mg PSA、150 mg C18和600 mg MgSO4的离心管,充分混和均匀,9 000 r/min离心8 min,上清液氮气吹至近干(40 ℃水浴),采用1.0 mL 40%乙腈溶液将其溶解,经0.22 μm微孔滤膜过滤,用于UPLC-MS/MS分析。
1.3.3 UPLC-MS/MS条件
UPLC条件:Eclipse Plus C18色谱柱(100 mm×2.1 mm,1.8 μ m),柱温3 5 ℃,流速0.3 m L/m i n,进样体积10 μL。流动相A为3 mmol/L甲酸铵-0.1%甲酸溶液,流动相B为乙腈。洗脱程序:0~2 min 4% B,2~5.5 min 18% B,5.5~9 min 55% B,9~10 min 80% B,10~12 min 98% B,12 min 3% B;重新平衡时间3 min。MS条件:电喷雾电离源;正/负离子扫描模式;离子源电压5 500 V/-4 500 V;离子源温度600 ℃;气帘气压力30 psi;碰撞气压力9 psi;雾化气压力50 psi;辅助雾化气压力55 psi,选择多反应监测(multiple reaction monitoring,MRM)模式。
1.4 数据处理
采用UPLC-MS/MS配套的Sciex OS数据采集与处理一体化软件采集数据并进行自动处理。
2 结果与分析
2.1 样品前处理条件优化
2.1.1 提取溶剂优化
鉴于12 种利尿剂中多数同时含有酸性基团与碱性基团,且理化性质差异显著,故选用通用性强的甲醇和乙腈作为提取溶剂进行样品提取。由表2可知,以乙腈为提取溶剂时,12 种利尿剂的加标回收率为93.4%~108.0%,相对标准偏差为2.8%~7.2%;以甲醇为提取溶剂时,12 种利尿剂的加标回收率为64.9%~121.0%,相对标准偏差为0.3%~18.1%。对比可知,乙腈提取效果更佳。因此,选择乙腈作为提取溶剂。
表2 不同提取溶剂对12 种利尿剂的提取效果
Table 2 Efficiencies of different solvents for extraction of 12 diuretics
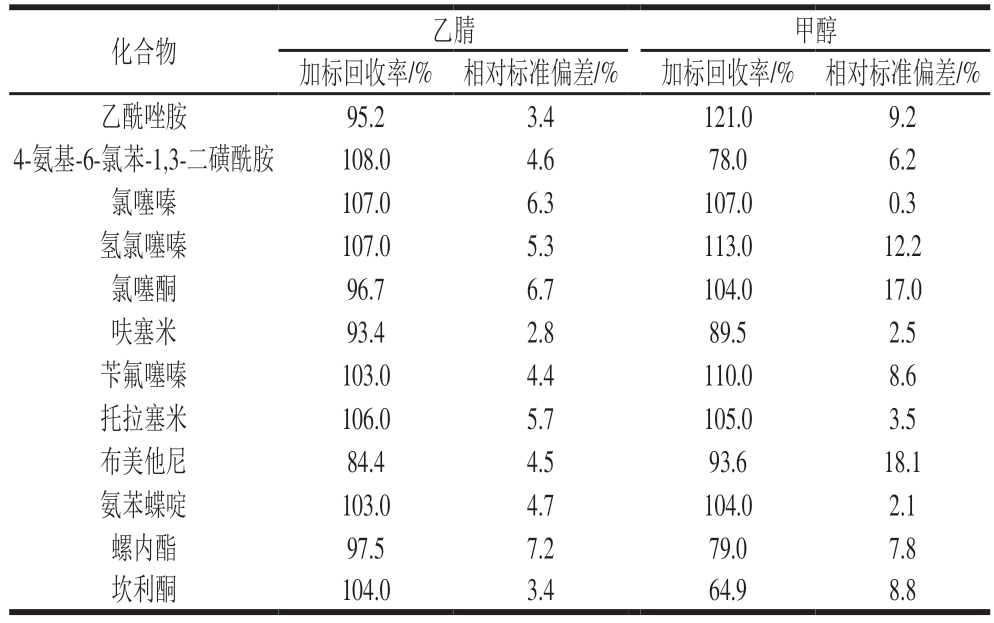
化合物乙腈甲醇加标回收率/% 相对标准偏差/%加标回收率/% 相对标准偏差/%乙酰唑胺95.23.4121.09.2 4-氨基-6-氯苯-1,3-二磺酰胺108.04.678.06.2氯噻嗪107.06.3107.00.3氢氯噻嗪107.05.3113.012.2氯噻酮96.76.7104.017.0呋塞米93.42.889.52.5苄氟噻嗪103.04.4110.08.6托拉塞米106.05.7105.03.5布美他尼84.44.593.618.1氨苯蝶啶103.04.7104.02.1螺内酯97.57.279.07.8坎利酮104.03.464.98.8
对比不同体积(5、10、15 mL)乙腈对目标物加标回收率的影响。由图1可知,乙腈体积为10 mL时,12 种利尿剂在猪肉样品中的加标回收率为96.0%~103.5%,因此,选择乙腈体积为10 mL。
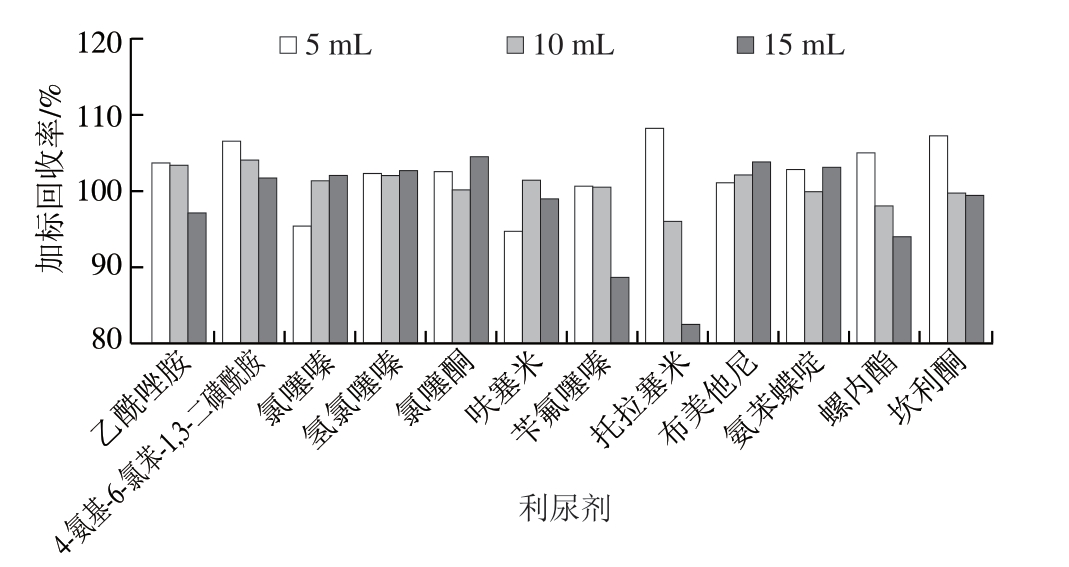
图1 不同乙腈体积对12 种利尿剂加标(5 μg/kg)回收率的影响
Fig.1 Effect of different acetonitrile volumes on spiked (5 μg/kg)recoveries of 12 diuretics
2.1.2 净化条件优化
在动物源性食品检测中,利尿剂的常用净化方法主要为SPE。然而,SPE操作流程复杂,通常涉及样品加载、淋洗和洗脱等多个步骤,耗时且人工操作需求量大。为简化操作流程、提高样品前处理效率,本研究参考兽药残留相关检测文献[31-38],改用QuEChERS净化方法,并基于文献[18]报道进行优化。针对油脂含量较高的猪肉样品,将文献中用于去除有机酸、糖类及色素的氨丙基吸附剂替换为能有效吸附脂肪酸类和有机酸类杂质的PSA。同时,对PSA、C18及MgSO4(除水)配比进行优化。由图2可知,采用200 mg PSA、150 mg C18和600 mg MgSO4作为填料时,净化效果显著提升,加标回收率为94.6%~104.1%。结合未净化与改良QuEChERS前后净化提取液对比图(图3)可知,采用改良后QuEChERS净化时,提取液更加澄清透明,油脂挂壁现象有效减少,净化效果提升。
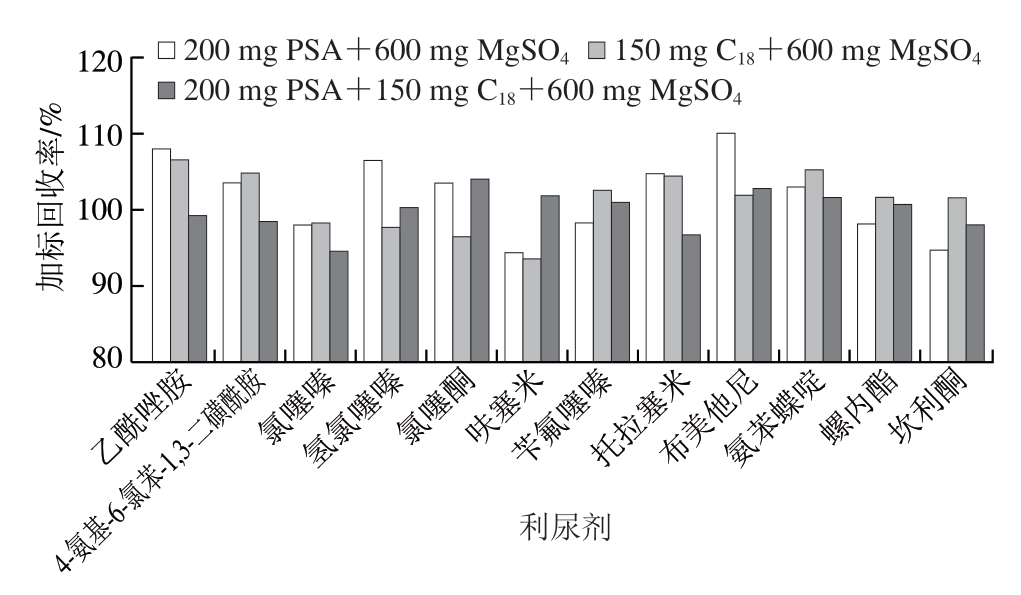
图2 不同净化填料配比对12 种利尿剂加标(5 μg/kg)回收率的影响
Fig.2 Effect of column filler composition on spiked (5 μg/kg)recoveries of 12 diuretics

图3 未净化与改良QuEChERS前后净化提取液
Fig.3 Visual appearance of unpurified and purified extracts before and after modification of QuEChERS method
A.未净化;B.改良QuEChERS前净化效果;C.改良QuEChERS后净化效果。
2.2 仪器条件选择
采用针泵恒流进样方式对12 种化合物进行全扫描,确定母离子和子离子m/z并组建MRM离子对,对去簇电压和碰撞能量进行优化。首先,在采集的数据中观察母离子丰度随去簇电压变化趋势,选择信号强度最高的参数区间;然后,在固定去簇电压和其他参数的条件下,选择子离子信号强度最大的碰撞能量。确定扫描模式后,依次优化其他MS参数,获得碎片离子信息。12 种利尿剂的部分MRM参数和保留时间见表3。图4为12 种利尿剂标准溶液(2 μg/L)的MRM色谱图。
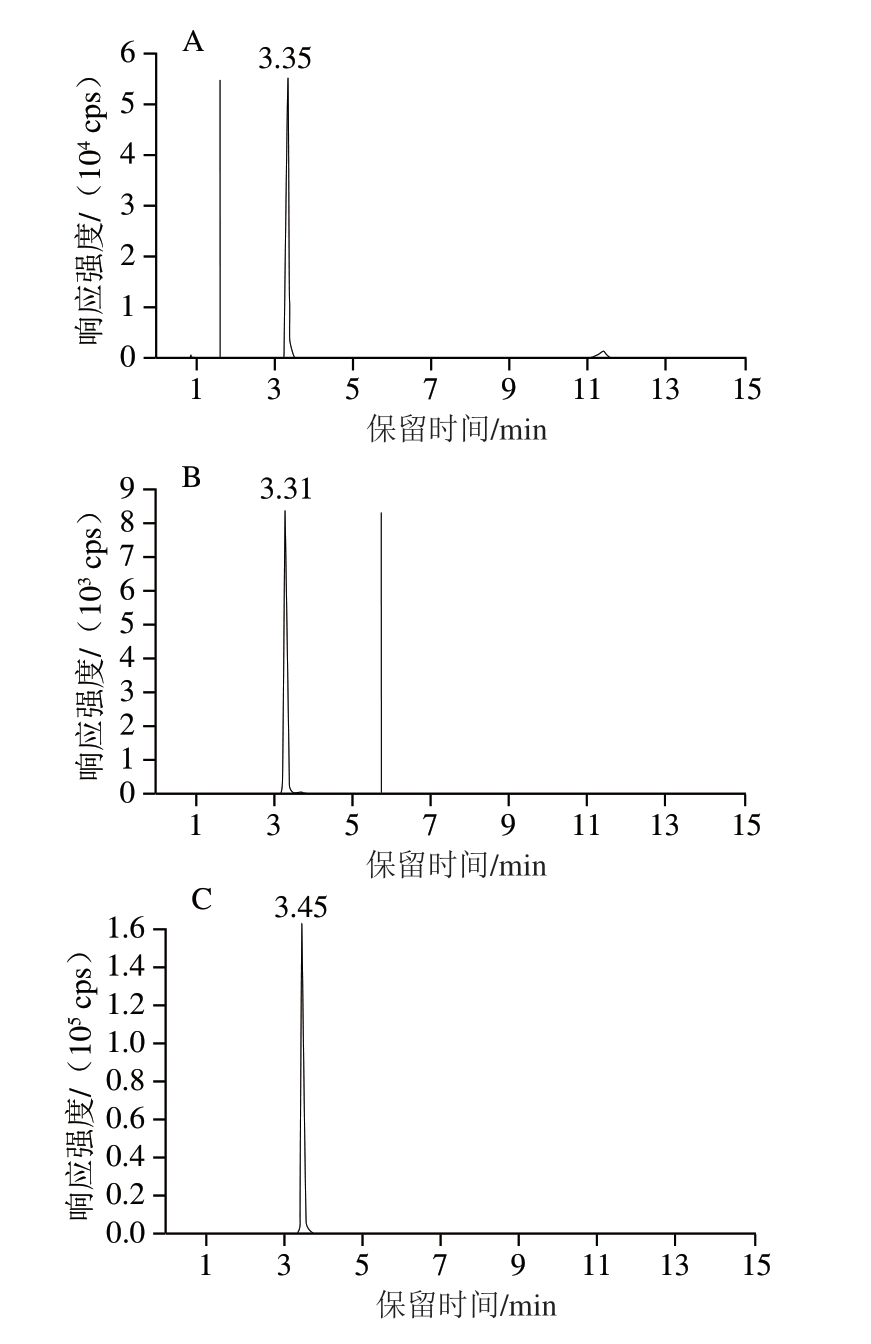
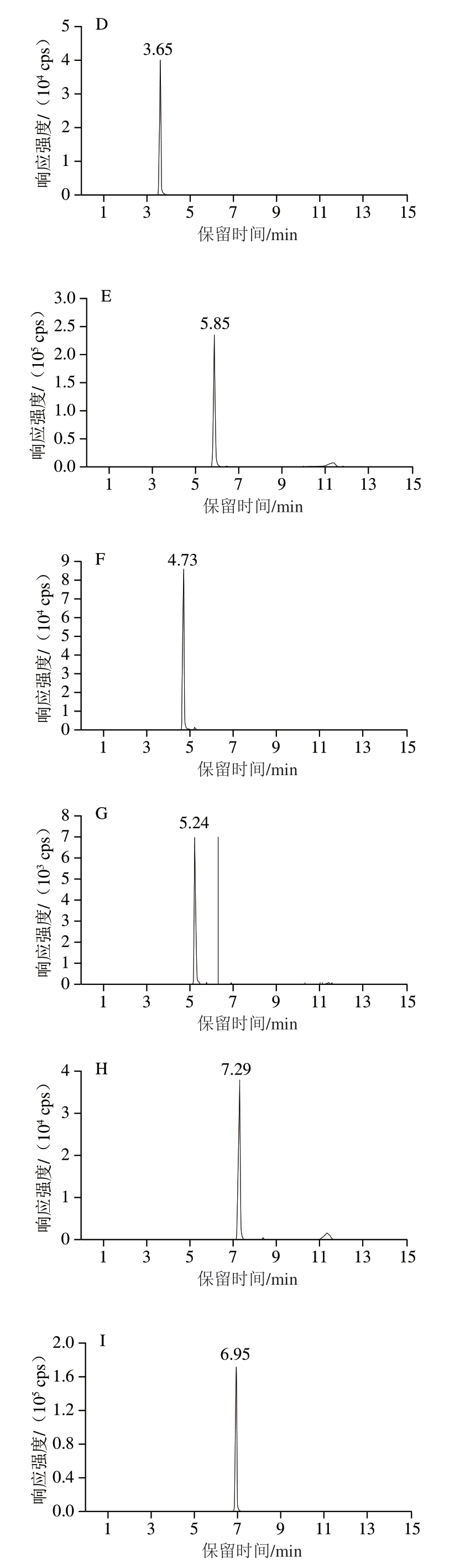

图4 12 种利尿剂MRM色谱图
Fig.4 MRM chromatograms of 12 diuretics
A.乙酰唑胺;B.4-氨基-6-氯苯-1,3-二磺酰胺;C.氯噻嗪;D.氢氯噻嗪;E.呋塞米;F.氯噻酮;G.托拉塞米;H.布美他尼;I.苄氟噻嗪;J.氨苯蝶啶;K.螺内酯;L.坎利酮。
表3 12 种利尿剂的名称、分子式、保留时间及部分MS参数
Table 3 Names, molecular formulae, retention times, and selected MS parameters of 12 diuretics
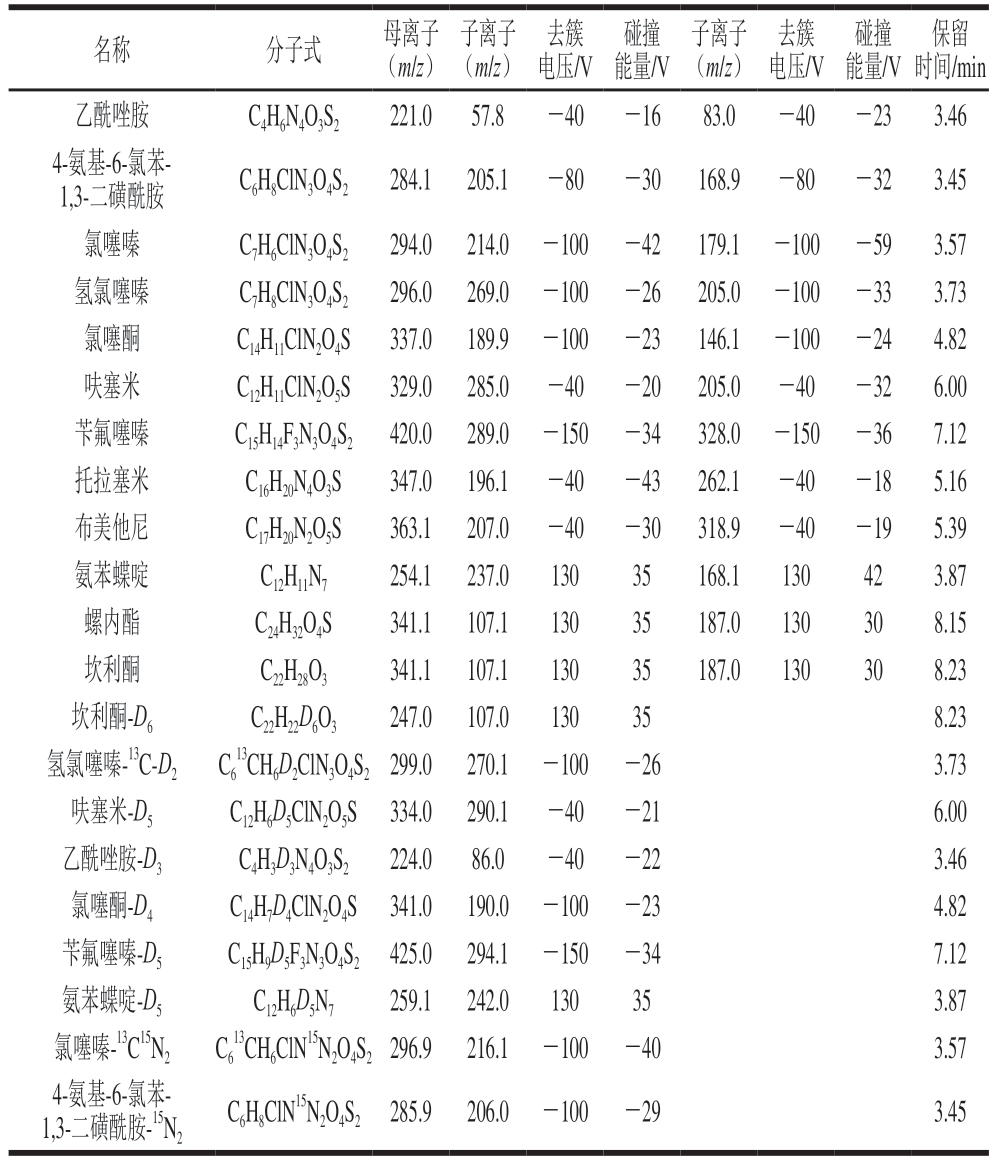
名称分子式母离子(m/z)子离子(m/z)去簇电压/V碰撞能量/V子离子(m/z)去簇电压/V碰撞能量/V保留时间/min乙酰唑胺C4H6N4O3S2221.057.8-40-1683.0-40-233.46 4-氨基-6-氯苯-1,3-二磺酰胺C6H8ClN3O4S2284.1 205.1-80-30168.9-80-323.45氯噻嗪C7H6ClN3O4S2294.0 214.0 -100 -42179.1 -100 -593.57氢氯噻嗪C7H8ClN3O4S2296.0 269.0 -100 -26205.0 -100 -333.73氯噻酮C14H11ClN2O4S337.0 189.9 -100 -23146.1 -100 -244.82呋塞米C12H11ClN2O5S329.0 285.0-40-20205.0-40-326.00苄氟噻嗪C15H14F3N3O4S2420.0 289.0 -150 -34328.0 -150 -367.12托拉塞米C16H20N4O3S347.0 196.1-40-43262.1-40-185.16布美他尼C17H20N2O5S363.1 207.0-40-30318.9-40-195.39氨苯蝶啶C12H11N7254.1 237.013035168.1130423.87螺内酯C24H32O4S341.1 107.113035187.0130308.15坎利酮C22H28O3341.1 107.113035187.0130308.23坎利酮-D6C22H22D6O3247.0 107.0130358.23氢氯噻嗪-13C-D2C6 13CH6D2ClN3O4S2 299.0 270.1 -100 -263.73呋塞米-D5C12H6D5ClN2O5S 334.0 290.1-40-216.00乙酰唑胺-D3C4H3D3N4O3S2224.086.0-40-223.46氯噻酮-D4C14H7D4ClN2O4S 341.0 190.0 -100 -234.82苄氟噻嗪-D5C15H9D5F3N3O4S2 425.0 294.1 -150 -347.12氨苯蝶啶-D5C12H6D5N7259.1 242.0130353.87氯噻嗪-13C15N2C6 13CH6ClN15N2O4S2 296.9 216.1 -100 -403.57 4-氨基-6-氯苯-1,3-二磺酰胺-15N2 C6H8ClN15N2O4S2 285.9 206.0 -100 -293.45
2.3 线性范围、检出限(limit of detection,LOD)和定量限(limit of quantitation,LOQ)
以猪肉空白基质溶液配制标准工作溶液,以目标物峰面积(y)为纵坐标,标准工作溶液质量浓度(x)为横坐标绘制标准曲线。由表4可知,12 种利尿剂在其质量浓度范围内线性关系良好,相关系数(R2)为0.991 2~0.999 9。基于3 倍信噪比和10 倍信噪比,通过逐级稀释确定方法的LOD和LOQ,12 种利尿剂的检出限为1~2.5 μg/kg,定量限为2~5 μg/kg。
表4 12 种利尿剂的线性范围、相关系数、LOD和LOQ
Table 4 Linear ranges, correlation coefficients, limits of detection, and LOQs of 12 diuretics
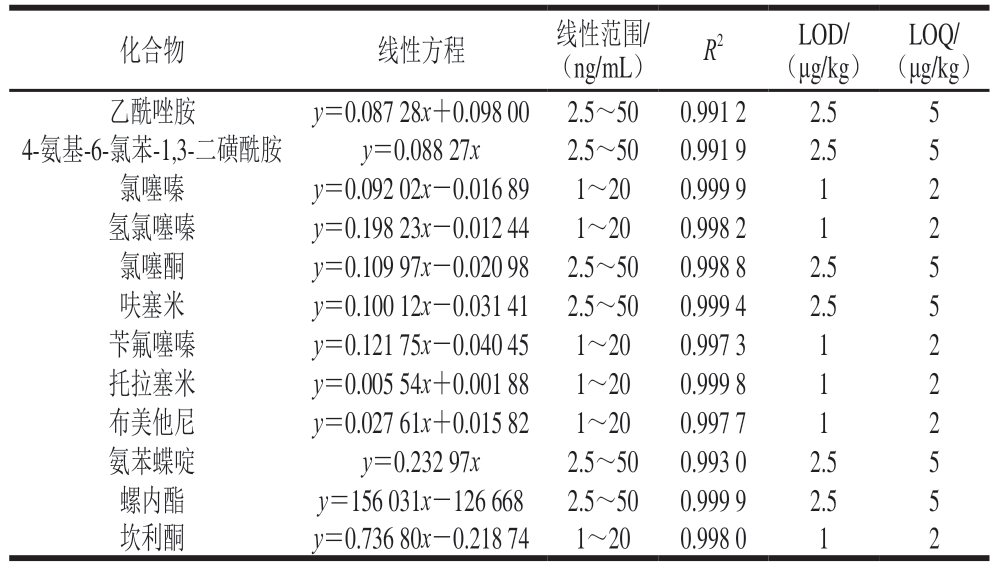
LOQ/(μg/kg)乙酰唑胺y=0.087 28x+0.098 00 2.5~500.991 22.55 4-氨基-6-氯苯-1,3-二磺酰胺y=0.088 27x2.5~500.991 92.55氯噻嗪y=0.092 02x-0.016 891~200.999 912氢氯噻嗪y=0.198 23x-0.012 441~200.998 212氯噻酮y=0.109 97x-0.020 98 2.5~500.998 82.55呋塞米y=0.100 12x-0.031 41 2.5~500.999 42.55苄氟噻嗪y=0.121 75x-0.040 451~200.997 312托拉塞米y=0.005 54x+0.001 881~200.999 812布美他尼y=0.027 61x+0.015 821~200.997 712氨苯蝶啶y=0.232 97x2.5~500.993 02.55螺内酯y=156 031x-126 6682.5~500.999 92.55坎利酮y=0.736 80x-0.218 741~200.998 012化合物线性方程线性范围/(ng/mL)R2LOD/(μg/kg)
2.4 准确度与精密度
取2.00 g空白猪肉样品,进行LOQ、2 LOQ和10 LOQ 3 个水平的加标回收实验,每个加标水平重复6 次,采用内标法进行定量分析。由表5可知,12 种利尿剂的平均加标回收率均在85.8%~112.0%之间,相对标准偏差(0.5%~5.1%)均小于20%,能够满足猪肉中利尿剂残留的定性和定量分析要求。
表5 12 种利尿剂的平均加标回收率及相对标准偏差(n =6)
Table 5 Average spiked recoveries and RSDs of 12 diuretics (n = 6)
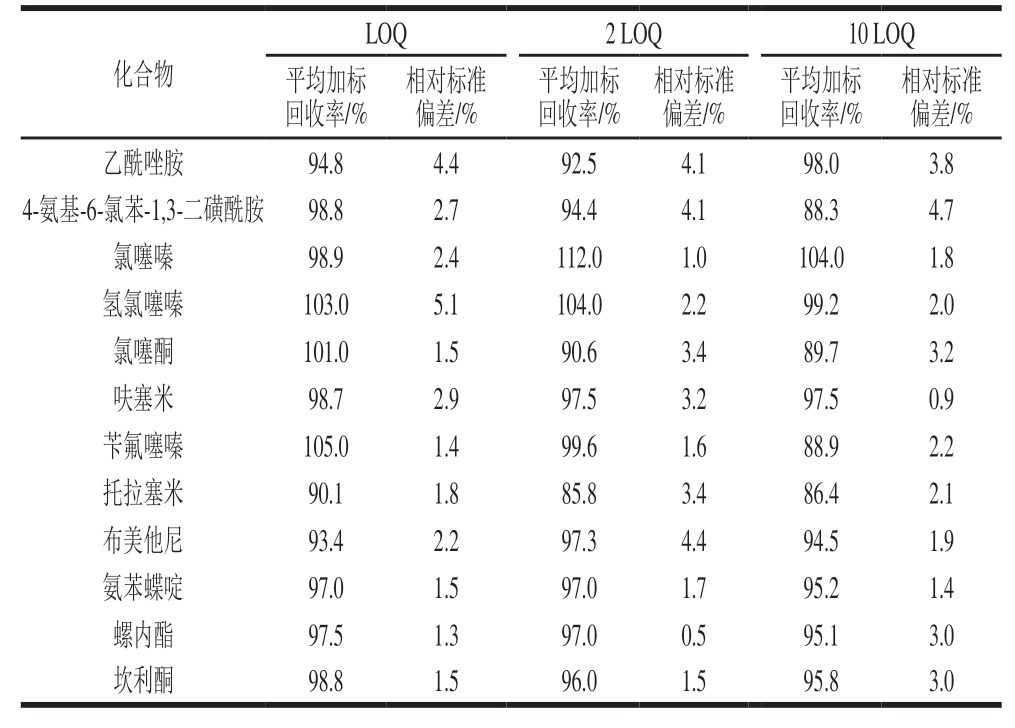
化合物LOQ2 LOQ10 LOQ平均加标回收率/%相对标准偏差/%乙酰唑胺94.84.492.54.198.03.8 4-氨基-6-氯苯-1,3-二磺酰胺98.82.794.44.188.34.7氯噻嗪98.92.4112.01.0104.01.8氢氯噻嗪103.05.1104.02.299.22.0氯噻酮101.01.590.63.489.73.2呋塞米98.72.997.53.297.50.9苄氟噻嗪105.01.499.61.688.92.2托拉塞米90.11.885.83.486.42.1布美他尼93.42.297.34.494.51.9氨苯蝶啶97.01.597.01.795.21.4螺内酯97.51.397.00.595.13.0坎利酮98.81.596.01.595.83.0相对标准偏差/%平均加标回收率/%相对标准偏差/%平均加标回收率/%
2.5 实际样品检测
在市场随机采购6 份猪肉样品,采用本方法检测12 种利尿剂残留,结果均未检出。
3 结 论
本研究基于改良QuEChERS-UPLC-MS/MS建立了猪肉中12 种利尿剂残留的检测方法。通过优化吸附剂配比和用量改良QuEChERS净化方法,有效去除样品中的杂质,降低猪肉样品的基质效应,进而有效提高检测准确性和灵敏度。该方法操作简便,能够显著缩短前处理时间,其快速、高效特性适用于猪肉中利尿剂的快速、准确定性与定量分析,可为提高进出口肉类通关效率、减少贸易延误,以及猪肉市场监管与规范运营提供技术支持。未来,该方法有望拓展应用于多种动物源性食品的检测,为肉制品质量安全提供更全面的技术支持。
[1] 李涛, 杨庆懿, 王亮亮, 等.分散固相萃取-超高效液相色谱-质谱法检测保健茶中6 种利尿类兴奋剂[J].中国食品添加剂, 2025, 36(4):108-113.DOI:10.19804/j.issn1006-2513.2025.4.015.
[2] BLOWEY D L.Diuretics in the treatment of hypertension[J].Pediatric Nephrology, 2016, 31(12): 2223-2233.DOI:10.1007/s00467-016-3334-4.
[3] ELLISON D H.Clinical pharmacology in diuretic use[J].Clinical Journal of the American Society of Nephrology, 2019, 14(8): 1248-1257.DOI:10.2215/cjn.09630818.
[4] 张孟孟, 赵福成, 任伟华, 等.益气活血、温阳利水法治疗慢性心力衰竭合并利尿剂抵抗的Meta分析[J].中医研究, 2024, 37(12): 79-86.DOI:10.3969/j.issn.1001-6910.2024.12.19.
[5] 李玉鹏, 张效生, 王丽, 等.肉鸡腹水综合征的发病原因及防治研究进展[J].天津农业科学, 2021, 27(7): 33-37.DOI:10.3969/j.issn.1006-6500.2021.07.008.
[6] WESLEY-HADZIJA B, MATTOCKS A M.Thin-layer chromatographic determination of furosemide and 4-chloro-5-sulfamoyl anthranilic acid in plasma and urine[J].Journal of Chromatography B: Biomedical Sciences and Applications, 1982,229(2): 425-432.DOI:10.1016/S0378-4347(00)84285-1.
[7] ABDELHAMID N S, ABDELALEEM E A, LASHIEN A, et al.The improvement of routine drug quality control analysis of some antihypertensive drugs using high-performance thin-layer chromatography densitometry method with greenness profile evaluation[J].Journal of Separation Science, 2024, 47(1): 2300608.DOI:10.1002/jssc.202300608.
[8] SULLIVAN C, SHERMA J.Development and validation of a method for determination of caffeine in diuretic tablets and capsules by highperformance thin-layer chromatography on silica gel plates with a concentration zone using manual spotting and ultraviolet absorption densitometry[J].Journal of AOAC International, 2005, 88(5): 1537-1543.DOI:10.1093/jaoac/88.5.1537.
[9] 潘向阳, 张嘉捷.利尿剂的循环伏安法检测[J].浙江教育学院学报,2003(4): 15-17.DOI:10.3969/j.issn.2095-2074.2003.04.003.
[10] BUKKITGAR S D, SHETTI N P.Electrochemical oxidation of loop diuretic furosemide in aqueous acid medium and its analytical application[J].Cogent Chemistry, 2016, 2(1): 1152784.DOI:10.1080/23312009.2016.1152784.
[11] RADI A.Stripping voltammetric determination of indapamide in serum at castor oil-based carbon paste electrodes[J].Journal of Pharmaceutical and Biomedical Analysis, 2001, 24(3): 413-419.DOI:10.1016/S0731-7085(00)00457-X.
[12] 秦旸, 朱绍棠, 王超, 等.利尿剂的胶束色谱分析[J].分析测试学报,2002, 21(5): 85-87.DOI:10.3969/j.issn.1004-4957.2002.05.027.
[13] FORREST G, MCINNES G T, FAIRHEAD A P, et al.Simple highperformance liquid chromatographic method for the measurement of amiloride in body fluids[J].Journal of Chromatography B: Biomedical Sciences & Applications, 1988, 428(1): 123-130.DOI:10.1016/S0378-4347(00)83896-7.
[14] 秦晻, 朱绍棠, 王超, 等.十三种利尿剂的高效液相色谱测定方法[J].分析测试学报, 2003, 22(1): 41-44.DOI:10.3969/j.issn.1004-4957.2003.01.013.
[15] LINGAMANENI K, ANNAPURNA M.Development and validation of a new stability indicating liquid chromatographic method for the simultaneous quantification of hydrochlorthiazide and telmisartan[J].Research Journal of Pharmacy and Technology, 2021, 14(4): 2081-2088.DOI:10.52711/0974-360x.2021.00369.
[16] GÖRGENS C, GUDDAT S, THOMAS A, et al.Simplifying and expanding analytical capabilities for various classes of doping agents by means of direct urine injection high performance liquid chromatography high resolution/high accuracy mass spectrometry[J].Journal of Pharmaceutical and Biomedical Analysis, 2016, 131: 482-496.DOI:10.1016/j.jpba.2016.09.015.
[17] 杨旺火.高效液相色谱串联质谱法测定饲料中8 种利尿剂药物[J].粮食与饲料工业, 2019(4): 57-61.DOI:10.7633/j.issn.1003-6202.2019.04.015.
[18] 梁杨, 王小玲, 郭礼强.基于QuEChERS提取的HPLC-MS/MS法检测人血浆中6 种常用利尿剂[J].药物分析杂志, 2019, 39(9): 1590-1596.DOI:10.16155/j.0254-1793.2019.09.07.
[19] 赵晓亚, 陈新艳, 王晗, 等.分散固相萃取-高效液相色谱-串联质谱法同时测定猪肉中的10 种利尿剂[J].分析科学学报, 2021, 37(5):643-648.DOI:10.13526/j.issn.1006-6144.2021.05.012.
[20] 薛颖, 花锦, 高浩, 等.超高效液相色谱-串联质谱法测定鸡肉和猪肉中利尿剂残留量[J].食品工业科技, 2021, 42(3): 230-235.DOI:10.13386/j.issn1002-0306.2020050206.
[21] THEVIS M, SCHÄNZER W.Examples of doping control analysis by liquid chromatography-tandem mass spectrometry: ephedrines,β-receptor blocking agents, diuretics, sympathomimetics, and crosslinked hemoglobins[J].Journal of Chromatographic Science, 2005,43(1): 22-31.DOI:10.1093/chromsci/43.1.22.
[22] 赵君, 董颖, 张丽娟, 等.超高效液相色谱-三重四极杆质谱法同时检测人尿中5 种利尿剂[J].分析试验室, 2016, 35(11): 1274-1277.DOI:10.13595/j.cnki.issn1000-0720.2016.0287.
[23] 王培龙, 范理, 宋荣, 等.气相色谱-质谱法确证分析饲料中6 种利尿剂的研究[J].分析试验室, 2009, 28(12): 31-34.DOI:10.3969/j.issn.1000-0720.2009.12.008.
[24] GRADEEN C Y, BILLAY D M, CHAN S C.Analysis of bumetanide in human urine by high-performance liquid chromatography with fluorescence detection and gas chromatography/mass spectrometry[J].Journal of Analytical Toxicology, 1990(2): 123-126.DOI:10.1093/jat/14.2.123.
[25] 刘薇, 邱丽君, 上官良敏, 等.气相色谱-质谱联用技术用于利尿剂的快速初筛和确证[J].分析化学, 2008, 36(11): 1465-1470.DOI:10.3321/j.issn:0253-3820.2008.11.003.
[26] 张建丽, 徐友宣, 邸欣, 等.LC/MS/MS与GC/MS法分析鉴定小鼠尿中沙美特罗的代谢产物[J].中国新药杂志, 2004, 13(5): 424-428.DOI:10.3321/j.issn:1003-3734.2004.05.014.
[27] ZHANG Z M, WANG D P, ZHANG L, et al.Determination of diuretics in human urine by hollow fiber-based liquid-liquidliquid microextraction coupled to high performance liquid chromatography[J].Analyst, 2008, 133(9): 1187-1194.DOI:10.1039/b802679c.
[28] TSAI F Y, LUI L F, CHANG B.Analysis of diuretic doping agents by HPLC screening and GC-MSD confirmation[J].Journal of Pharmaceutical and Biomedical Analysis,1991, 9(10/12): 1069-1076.DOI:10.1016/0731-7085(91)80046-c.
[29] GOEBEL C, TROUT G J, KAZLAUSKAS R.Rapid screening method for diuretics in doping control using automated solid phase extraction and liquid chromatography-electrospray tandem mass spectrometry[J].Analytica Chimica Acta, 2004, 502(1): 65-74.DOI:10.1016/j.aca.2003.09.062.
[30] KOLMONEN M, LEINONEN A, KUURANNE T, et al.Hydrophilic interaction liquid chromatography and accurate mass measurement for quantification and confirmation of morphine, codeine and their glucuronide conjugates in human urine[J].Journal of Chromatography B: Analytical Technologies in the Biomedical & Life Sciences, 2010,878(29): 2959-2966.DOI:10.1016/j.jchromb.2010.08.047.
[31] 陈燕秋, 林浩, 肖全伟, QuEChERS-超高效液相色谱-串联质谱法测定牛乳中的氟吡呋喃酮及其代谢物[J].食品科学, 2024, 45(12):285-291.DOI:10.7506/spkx1002-6630-20231116-120.
[32] 李红丽, 贺超, 苏敏, 等.QuEChERS-超高效液相色谱-串联三重四极杆质谱法同时测定猪肉中24 种兽药残留[J].食品安全质量检测学报, 2025, 16(4): 86-96.DOI:10.19812/j.cnki.jfsq11-5956/ts.20241218004.
[33] 张丽姬, 邱小元, 黄鑫, 等.QuEChERS-超高效液相色谱-串联质谱法测定动物源性食品中8 种糖皮质激素残留量[J].食品安全质量检测学报, 2024, 15(22): 211-219.DOI:10.19812/j.cnki.jfsq11-5956/ts.20240911003.
[34] 洪妍妍, 陈海玲, 王翠玲, 等.样品前处理QuEChERS法及新型吸附材料在水产品中抗生素残留分析中的应用进展[J].食品安全质量检测学报, 2022, 13(21): 6898-6906.DOI:10.19812/j.cnki.jfsq11-5956/ts.2022.21.009.
[35] 吴彦蕾, 苏敏, 周纯洁, 等.QuEChERS-超高效液相色谱-串联质谱法同时检测猪肉中76 种兽药及其代谢物[J].食品工业科技, 2023,44(20): 311-321.DOI:10.13386/j.issn1002-0306.2022110330.
[36] 许旭, 吕佳, 杨澜瑞, 等.基于还原氧化石墨烯改性三聚氰胺海绵的改良QuEChERS-超高效液相色谱-串联质谱法快速测定鸡蛋中32 种兽药残留[J].分析化学, 2024, 52(1):121-129; 38; 43.DOI:10.19756/j.issn.0253-3820.231318.
[37] 朱万燕, 张鸿伟, 车立志, 等.超高效液相色谱-串联质谱法同时测定禽蛋中31 种产蛋期禁用兽药[J].色谱, 2024, 42(5): 420-431.DOI:10.3724/SP.J.1123.2023.11015.
[38] 黄大亮, 苏敏, 周纯洁, 等.QuEChERS-超高效液相色谱-串联质谱法同时测定火锅食材中62 种兽药残留[J].食品科技, 2024, 49(12):314-321.DOI:10.13684/j.cnki.spkj.2024.12.038.