骆驼肉具有高水分、高蛋白、低脂肪、低胆固醇和丰富的氨基酸等营养特点,如骆驼肉的水分质量分数((74.72±2.45)%)高于牛肉((71.25±2.05)%)和羊肉((7 3.5 1±2.0 5)%),粗蛋白质量分数((21.83±1.33)%)也高于牛肉((20.64±1.03%))和羊肉((21.62±1.77%)),而粗脂肪质量分数((1.51±0.05)%)远低于牛肉((6.83±0.33)%)和羊肉((4.56±0.67)%)[1],骆驼肉胆固醇含量(57.56 mg/100 g)也低于牛肉(74.5 mg/100 g)[2],因此骆驼肉逐渐成为肉类市场上的新兴品类,如骆驼肉发酵香肠[3]、骆驼肉汉堡[4]等新产品层出不穷。虽然肉用骆驼的成规模标准化养殖尚未形成,但针对骆驼肉的加工工艺已是近年的研究热点,如孙树远等[5]利用正交试验得出了高压和酶处理嫩化骆驼肉的最佳条件,曹慎怡等[6]通过单因素和响应面试验确定了风干骆驼肉的最佳工艺条件。冷冻贮藏作为一种经济、实用的贮藏方法,能够延长肉类产品货架期,减少浪费,其主要机制包括抑制微生物繁殖与减缓化学和酶促反应的速率。
紧致的肌肉纤维结构有利于保持良好的食用品质。肌原纤维蛋白(myofibrillar protein,MP)是肌肉纤维的主要成分,是以肌球蛋白和肌动蛋白为主体组成的可支撑肌肉运动的结构蛋白质,与肌肉运动密切相关[7],还与肉制品的流变学特性(如保水性、黏结性、质地和弹性等)密切相关。其中,MP的热诱导凝胶特性对肉制品的结构特性起关键作用。因此,MP的功能特性变化是反映肉制品组织微观结构变化的直观指标[8]。
目前已有一些关于MP的报道,如Zhang Xiaodi等[9]研究冷冻贮藏时间对鱼糜MP的影响,发现低温能显著延缓MP的降解。Zhu Mingming等[10]研究不同低温对猪肉MP的影响,发现-12 ℃与-18 ℃下的MP降解情况接近。Li Ke等[11]研究不同功率和时间的超声波对鸡肉MP的影响,发现超声处理可以提高MP溶液的稳定性。这些研究为理解MP在肉类加工贮藏中的变化规律提供了重要参考,但其在骆驼肉中的适用性尚待验证,且目前鲜见有关长期冷冻贮藏对骆驼肉MP影响的报道。
因此,本研究以骆驼肉MP为研究对象,探究冷冻贮藏(-20 ℃)时间(0、30、60、90、150 d)对骆驼肉MP的影响,通过测定不同的MP指标(溶解性、表面疏水性、羰基含量、总巯基含量、活性巯基含量、二级结构、Zeta电位、平均粒径、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE))和MP凝胶指标(色泽、保水性和微观结构),以探究骆驼肉MP在冷冻条件下的变化规律。本研究可为延长骆驼肉冷冻贮藏货架期和改善骆驼肉加工性能提供理论参考依据。
1 材料与方法
1.1 材料与试剂
双峰驼后腿肉采自内蒙古自治区阿拉善盟,在冬季寒冷干燥的室外进行宰杀,气温低于-18 ℃,宰杀后立即对胴体进行分割并用塑封袋排气密封,置于液氮中,于24 h内运回位于内蒙古呼和浩特市的实验室,并放置于-80 ℃医用低温保存箱备用。移至-20 ℃冰箱,根据实验设计的时间抽取各组样品3 块用于MP的提取及各类指标的测定。
蛋白Marker(11~245 kDa)、SDS-PAGE制胶试剂盒、双缩脲试剂、Tris-HCl(分析纯) 北京索莱宝科技有限公司;溴酚蓝 日本关东化学工业株式会社;无水乙醇(分析纯)、乙酸乙酯(分析纯)、三氯乙酸(trichloroacetic acid,TCA,分析纯) 天津新技术产业园区科茂化学试剂有限公司;Triton X-100、尿素(分析纯) 北京酷来搏科技有限公司;盐酸胍(分析纯)、乙二醇双(2-氨基乙基醚)四乙酸(ethylene glycol bis(2-aminoethylether)-N,N,N’,N’-tetraacetic acid,EGTA)上海源叶生物科技有限公司;5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis(2-nitrobenzoic acid),DTNB,分析纯) 上海阿拉丁生化科技股份有限公司;乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA,分析纯) 美国赛默飞世尔科技公司;2,4-二硝基苯肼国药集团化学试剂有限公司。
1.2 仪器与设备
T6新锐可见分光光度计 北京普析通用仪器有限责任公司;UV1102II紫外分光光度计 上海天美科学仪器有限公司;FM200A高剪切分散乳化机 上海弗鲁克科技发展有限公司;IRSpiri-T傅里叶变换红外光谱仪 日本岛津制作所;Centrifuge 5810R台式高速冷冻离心机德国Eppendorf公司;E221JO08K蛋白染色仪 南京金斯瑞生物科技股份有限公司;DYY-6C电泳仪 北京六一生物科技有限公司;Synergy-H1酶标仪 美国BioTek仪器有限公司;TM4000 Plus电子显微镜 日本日立制作所;90Plus Zeta电位及粒径分析仪 美国布鲁克海文仪器公司;GelDoc-It2凝胶成像仪 德国耶拿分析仪器股份公司;WSC-S色差仪 上海仪电物理光学仪器有限公司。
1.3 方法
1.3.1 MP提取及其凝胶制备
MP的提取:参考Parsons等[12]的方法提取MP,称取一定质量的肉样,切除筋膜与脂肪,加入10 倍体积的1号缓冲液(0.1 mol/L KCl、0.002 mol/L MgCl2、0.002 mol/L EGTA、0.02 mol/L K2HPO4,pH 6.8),2 000×g、4 ℃下离心15 min后取沉淀,然后用8 倍体积的2号缓冲液(0.1 mol/L KCl、0.002 mol/L MgCl2、0.002 mol/L EGTA、0.02 mol/L K2HPO4、10% Triton X-100,pH 6.8)洗涤2 次,再用相同体积的0.1 mol/L KCl溶液洗涤2 次,得到的沉淀为MP,在磷酸盐缓冲液(0.02 mol/L KH2PO4、0.6 mol/L NaCl,pH 6.0)中溶解、稀释后,用双缩脲法测定蛋白质量浓度,在48 h内测完相应指标。
MP凝胶的制备:将上述MP溶液调整为质量浓度40 mg/mL,搅拌均匀后移入50 mL离心管中,然后将其于40 ℃条件下加热30 min,然后立即转移至80 ℃条件下加热30 min,加热结束后立即置于冰水中快速冷却至室温,放置于4 ℃冰箱中保存过夜后进行相关指标测定。
1.3.2 MP溶解性测定
参考Dai Hongjie等[13]的方法。用磷酸盐缓冲液制备稀释样品,分散均匀后,用双缩脲法测定蛋白质量浓度(ρ1/(mg/mL)),然后在4 100×g、4 ℃下离心15 min,取上清液测定蛋白质量浓度(ρ2/(mg/mL))。溶解度按式(1)计算:
1.3.3 MP表面疏水性测定
根据Chelh等[14]的方法进行测定。用蒸馏水配制1 mg/mL的溴酚蓝(bromophenol blue,BPB)溶液。样品组为1 mL MP分散液(5 mg/mL)中加入200 μL溴酚蓝溶液,空白组则是将1 mL样品用20 mmol/L、pH 6.0的磷酸盐缓冲液替代。加样完毕后充分振荡,反应10 min,在25 ℃下2 000×g离心15 min。上清液稀释10 倍后在595 nm处测定吸光度。每组样品平行测定3 次,结果取平均值。表面疏水性以溴酚蓝结合量表示,按式(2)计算:
式中:A样品、A空白分别为样品组上清液和空白组上清液在595 nm处的吸光度。
1.3.4 MP羰基含量测定
参照Oliver等[15]的方法。将MP样品稀释至5 mg/mL,分别取2 份于离心管中,其中1 份加入1 600 μL 2 mol/L HCl溶液(含0.002 g/mL 2,4-二硝基苯肼),记为处理组;另1 份加入1 600 μL 2 mol/L HCl溶液,记为空白组。将处理组和空白组溶液在室温下反应30 min后,加入800 μL 0.4 g/mL TCA溶液沉淀蛋白质,4 ℃、8 700×g离心15 min,去除上清液。然后加入2 mL乙醇-乙酸乙酯混合液(1∶1,V/V)洗涤3 次以除去未反应的2,4-二硝基苯肼,加入3 mL磷酸盐缓冲液(20 mmol/L,pH 6.5,含6 mol/L盐酸胍)溶解沉淀。放置过夜后,于370 nm处测定吸光度。羰基含量按式(3)计算:
式中:A370 nm为样品在370 nm处的吸光度;ρ为MP质量浓度/(mg/mL)。
1.3.5 MP总巯基和活性巯基含量测定
根据韩柯颖[16]的方法稍作修改。
总巯基含量测定:取0.5 mL样品(1 mg/mL)与5 mL总巯基试剂(20 mmol/L Tris-HCl、10 mmol/L EDTA、8 mol/L尿素,pH 6.0)、100 μL Ellman试剂(10 mmol/L DTNB、10 mmol/L K2HPO4,pH 6.0)振荡混匀,混合溶液在40 ℃水浴锅中恒温加热25 min。取适量样品放置在光程为10 mm的比色皿中,在紫外分光光度计中于412 nm处测定吸光度。使用磷酸盐缓冲液作为空白对照,各处理组进行3 次平行测定。
活性巯基含量测定:取5.5 mL样品(1 mg/mL)与100 μL Ellman试剂振荡混匀,混合溶液在4 ℃下静置1 h。取适量样品放置在光程为10 mm的比色皿中,在紫外分光光度计中于412 nm处测定样品吸光度。使用磷酸盐缓冲液作为空白对照,各处理组进行3 次平行测定。巯基含量按式(4)计算:
式中:A412 nm为样品在412 nm处的吸光度;D为稀释倍数;ρ为MP质量浓度/(mg/mL)。
1.3.6 MP二级结构测定
用傅里叶变换红外光谱测定MP二级结构,扫描范围400~4 000 cm-1,光谱分辨率4 cm-1,扫描次数32 次,完成以后进行衰减全反射校正和归一化,并用PeakFit v4.12软件拟合检测所得光谱图,进行基线校正、傅里叶去卷积和二阶导数峰拟合,从而通过各峰面积计算出各构象的相对含量。
1.3.7 MP平均粒径和Zeta电位测定
将1 mg/mL MP溶液放置于比色皿中,再放入测量池内,用Zeta电位及粒径分析仪分别测定平均粒径和Zeta电位。
1.3.8 MP SDS-PAGE测定
根据Laemmli[17]的方法稍作修改,将MP溶液调至2 mg/mL,以体积比4∶1与蛋白上样缓冲液混合,并于100 ℃金属浴煮沸变性10 min,制得变性蛋白样品。
SDS-PAGE条件:12%分离胶,4%浓缩胶,蛋白上样量14 μg,先以80 V电压电泳直到指示条带迁移至浓缩胶与分离胶界限处,然后以120 V电压电泳直到指示条带迁移至距底端1 cm处结束,用考马斯亮蓝法染色,再用脱色液(无水乙醇∶冰乙酸∶蒸馏水=2∶1∶17,V/V)进行脱色,最后用凝胶成像系统进行拍照。
1.3.9 MP凝胶色泽测定
使用标准白板和黑板校准色差仪,用滤纸拭干凝胶表面的水分后,测定凝胶表面的亮度值(L*)、红度值(a*)和黄度值(b*),白度(W)按式(5)计算:
1.3.10 MP凝胶保水性测定
参照Chen Zhaohui等[18]的方法。准确称取离心管的质量(m0/g)。将10 g样品放入50 mL试管中,记录离心管和凝胶的总质量(m1/g),在4 ℃下6 000×g离心20 min。除去水分,准确称量装有样品的离心管质量(m2/g)。凝胶保水性按式(6)计算:
1.3.11 MP凝胶微观结构观察
从MP凝胶中心区域切下3 mm×3 mm×3 mm的立方体放入质量分数2.5%的戊二醇溶液中,在4 ℃冰箱中过夜,取出后用0.1 mol/L的磷酸缓冲液(pH 7.0)漂洗3 次,每次15 min,以洗去戊二醇;再依次用体积分数30%、50%、70%、80%、90%的乙醇进行梯度脱水,每次15 min,最后再使用无水乙醇脱水30 min,每次脱水时在摇床上进行振荡。将脱水后的样品进行冷冻干燥,镀膜后置于电子显微镜下观察。放大倍数2 000 倍,电压5 kV。
1.4 数据处理
实验数据采用平均值±标准差表示,所有实验处理均独立重复3 次以确保结果的可靠性。数据的统计和平均值与标准差的计算用Microsoft Excel 2019软件完成,图表绘制通过OriginPro 2021软件实现,显著性差异分析借助SPSS Statistics 25软件进行,以P<0.05作为差异显著性判断标准。
2 结果与分析
2.1 骆驼肉MP水合特性在冷冻贮藏期间的变化
MP的水合特性包括溶解性和疏水性,其值分别由MP的亲水基团和疏水基团决定。溶解性是影响肉品质的关键因素,高溶解度通常与保水性、嫩度及加工性能优异相关。MP表面疏水性是一种非共价键相互作用,能够说明MP内部疏水基团暴露的程度,从而反映MP构象的变化。如图1所示,骆驼肉MP的溶解性由(87.15±2.86)%逐渐显著下降至贮藏150 d的(64.01±1.98)%(P<0.05),与相同贮藏条件下猪肉MP溶解性变化趋势一致[19]。贮藏初始骆驼肉MP的溶解性高于牛肉MP(约62%)[20],低于黑山羊肉MP(约90%)[21]。同时,表面疏水性从0 d的(8.37±1.30)μg显著上升至150 d的(12.91±1.76)μg(P<0.05),与相同贮藏温度下猪肉MP变化趋势一致[19]。骆驼肉MP的初始表面疏水性低于牛肉MP(约10 μg)[20]。MP的变性和氧化导致疏水基团暴露,促进分子间交联与聚集,从而降低溶解性并增加表面疏水性[22]。Liu Ru等[23]用超声波处理MP使之小片化,发现MP粒径变小和溶解性增加,也验证了水合作用与粒径大小的关联机制。
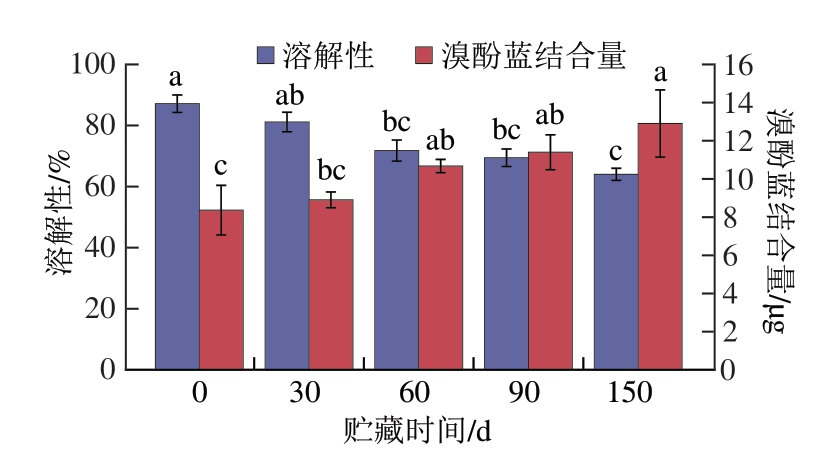
图1 骆驼肉MP水合特性在冷冻贮藏期间的变化
Fig.1 Changes in the hydration properties of camel meat MP during frozen storage
小写字母不同表示差异显著(P<0.05)。图2、3、5、7同。
2.2 骆驼肉MP羰基含量在冷冻贮藏期间的变化
羰基可通过氨基酸氧化、非蛋白羰基结合或糖基化反应生成,其含量是MP氧化程度的重要标志。如图2所示,随着贮藏时间的延长,骆驼肉MP的羰基含量由0 d的(1.55±0.22)nmol/mg显著增加至150 d的(5.35±1.04)nmol/mg(P<0.05),其初始羰基含量略低于牛肉的(1.72±0.11)nmol/mg[24],与同样贮藏条件下的猪肉MP变化趋势相同[25],表明长期的冷冻贮藏导致蛋白质氧化损伤的累积。但是随贮藏时间的进一步延长,羰基含量有可能下降,因为羰基化合物会进行后续反应,例如,醛基被氧化成羧酸,或者生成醇醛缩合化合物[26]。Estévez等[27]发现,猪肉MP的羰基化合物含量在冷冻120 d后开始下降,本实验没有观察到羰基含量的下降,但其增速在后期减缓,这也可能是由于密封袋中的O2趋于耗尽。
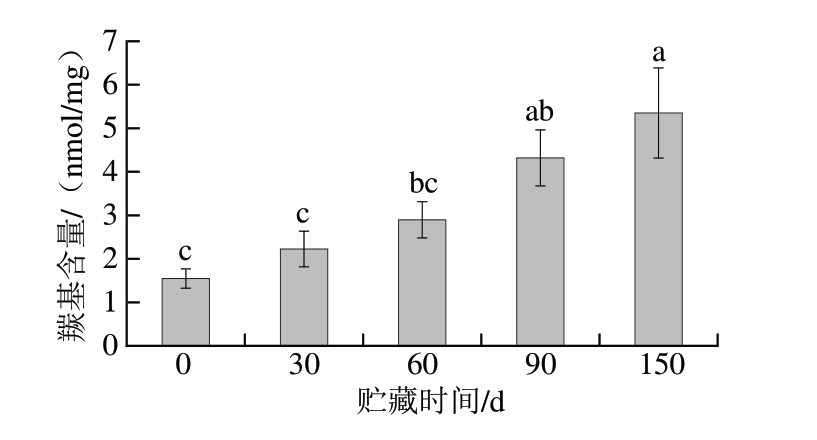
图2 骆驼肉MP羰基含量在冷冻贮藏期间的变化
Fig.2 Changes in the carbonyl content of camel meat MP during frozen storage
2.3 骆驼肉MP巯基含量在冷冻贮藏期间的变化
巯基是半胱氨酸残基侧链上的基团,是一种亲水基团,半胱氨酸的巯基活性较强,是MP中活性最强的基团[28],MP中的总巯基包括其表面的活性巯基和深埋于分子内部的巯基,当蛋白质变性展开,埋在蛋白内部的巯基暴露到表面,就成为了活性巯基。如图3所示,随着贮藏时间的延长,骆驼肉MP的总巯基含量和活性巯基含量分别由0 d的(116.51±4.84)、(22.45±0.56)μmol/g显著下降至150 d的(33.65±6.87)、(3.63±1.13)μmol/g(P<0.05),骆驼肉MP初始总巯基含量略低于猪肉MP((125.27±3.63)nmol/g),活性巯基含量高于猪肉MP((13.68±0.40)nmol/g)[29],这与Nguyen等[30]对相同贮藏条件下的鳕鱼研究结果相同,表明长期的冷冻贮藏导致MP结构破坏和功能丧失。这种变化的原因可能与冷冻贮藏过程中MP的氧化和聚集有关。巯基氧化会造成多肽间形成二硫键和磺酸类等氧化产物,从而导致蛋白质分子间产生交联、聚合,同时巯基含量的变化也会引起MP空间结构的改变及MP溶解性的降低[31]。同时,低温会导致肌球蛋白聚集,致使盐溶性蛋白被氧化[32]。
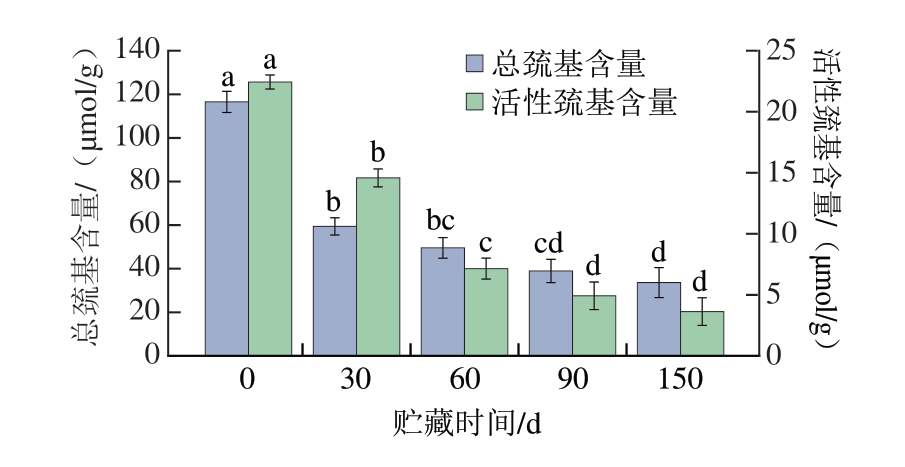
图3 骆驼肉MP巯基含量在冷冻贮藏期间的变化
Fig.3 Changes in the total and free sulfhydryl contents of camel meat MP during frozen storage
2.4 骆驼肉MP二级结构在冷冻贮藏期间的变化
蛋白质二级结构指分子局部多肽链经氢键等作用形成的规则构象,α-螺旋依靠MP分子内氢键形成,β-折叠依靠蛋白质分子间氢键形成,蛋白质分子间的展开程度和聚集程度可分别由α-螺旋和β-折叠体现[33]。α-螺旋和β-转角有利于构建稳定、有序的二级结构,无规卷曲含量越多,蛋白质结构越无序。如图4所示,在贮藏初期,β-转角(相对含量36.75%)和α-螺旋(28.91%)是骆驼肉MP二级结构的主要形式。李思蕾等[34]发现,β-转角(39.18%)和β-折叠(26.87%)是羊肉MP二级结构的主要形式,Xue Liangyu等[24]发现,无规卷曲(约32%)和β-折叠(约30%)是牛肉MP主要二级结构。除了物种之间的差异外,水分含量的不同可能也是原因之一。水分子能够与蛋白质表面的极性基团形成氢键。当体系中水分含量增加时,更多的水分子可以参与到这种相互作用中,这可能会竞争性地干扰MP间氢键的形成。因此,过高的水分含量可能导致β-折叠含量降低。而α-螺旋的稳定性更多依赖于链内氢键,受体系水分含量的影响较小,因此保持稳定或略有上升。这解释了不同肉类的水分含量与MP二级结构之间的相关性和差异性。随着贮藏时间的延长,α-螺旋相对含量由(28.91±0.32)%显著下降至(17.81±0.98)%(P<0.05),β-转角由(36.75±0.34)%显著下降至(20.25±0.06)%(P<0.05),β-折叠由(20.59±0.45)%显著上升至(36.10±0.94)%(P<0.05),无规卷曲由(13.75±0.45)%显著上升至(25.85±0.09)%(P<0.05)。MP结构在被破坏和降解的过程中,有序的α-螺旋结构转变为无规卷曲结构,这也解释了MP疏水性上升的原因。此外,MP分子间的交联和氧化也可能导致二级结构的改变,如Wang Bo等[35]用低O2环境抑制MP氧化后,保持了良好的二级结构。
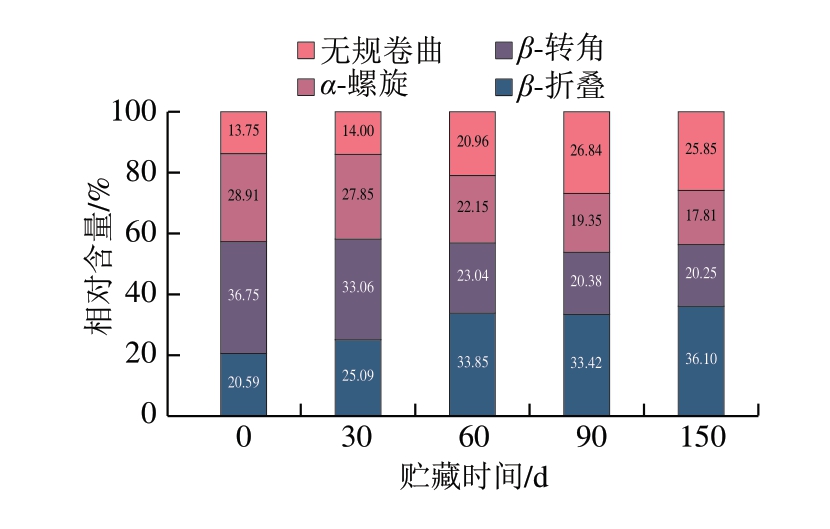
图4 骆驼肉MP二级结构相对含量在冷冻贮藏期间的变化
Fig.4 Changes in the relative contents of secondary structure of camel meat MP during frozen storage
2.5 骆驼肉MP Zeta电位和平均粒径在冷冻贮藏期间的变化
MP的Zeta电位反映了蛋白表面的有效电荷,是评估其溶液稳定性的重要指标。Zeta电位的绝对值大小与蛋白粒子间的静电相互作用力相关,Zeta电位绝对值越小,表明蛋白粒子间的静电斥力减弱,聚集倾向增加。如图5所示,骆驼肉MP的Zeta电位绝对值由0 d的(13.02±0.16)mV显著下降至150 d的(5.16±0.81)mV(P<0.05),这可能是因为氧化导致MP去折叠,暴露出带电荷的氨基酸残基,并与氧化产物反应生成电中性物质,从而削弱了MP间的静电相互作用[36],MP颗粒之间的吸引力相对上升,发生聚集,导致MP平均粒径增大。骆驼肉MP的平均粒径由0 d的(333.85±11.63)nm显著增大至150 d的(909.00±25.40)nm(P<0.05)。类似地,Li Fangfei等[37]发现猪肉MP在180 d冷冻期间,Zeta电位绝对值由15.23 mV下降至9.56 mV,对应体积平均直径和面积平均粒径分别增加41.82%和41.55%,本实验的变化幅度与之相比较大。少量MP聚集体可以作为“晶核”快速吸附单体蛋白,形成大尺寸聚集体[38]。骆驼肉MP初始平均粒径较猪肉MP更大,因此,更容易快速吸附单体蛋白,形成更大的聚集体,且骆驼肉MP的α-螺旋相对含量((28.91±0.32)%)相较于猪肉MP(约60%)更低,结构更不稳定。
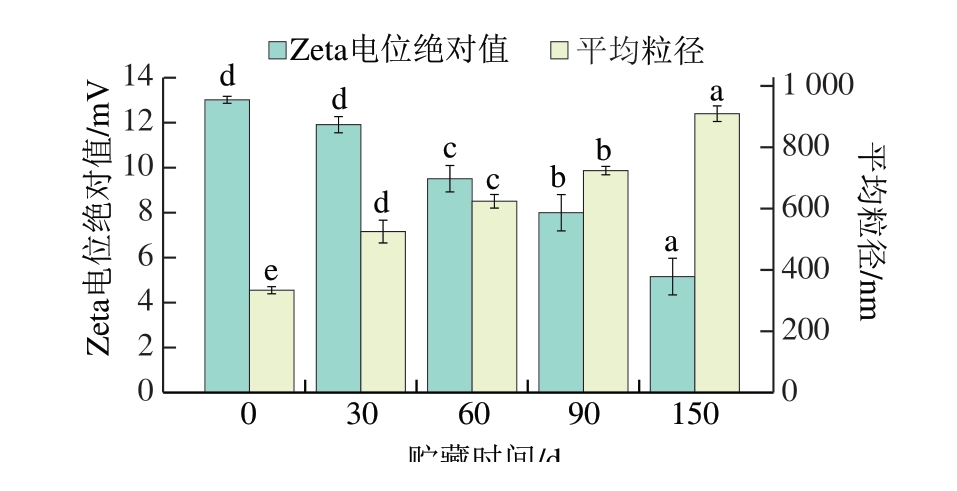
图5 骆驼肉MP Zeta电位和平均粒径在冷冻贮藏期间的变化
Fig.5 Changes in the zeta potential and average particle size of camel meat MP during frozen storage
2.6 骆驼肉MP SDS-PAGE图谱在冷冻贮藏期间的变化
如图6所示,MP的分子质量分布广,主要分布在11~245 kDa之间,含有肌球蛋白重链(myosin heavy chain,MHC)、肌动蛋白、原肌球蛋白、肌原蛋白、副肌球蛋白和肌球蛋白轻链(myosin light chain,MLC)。
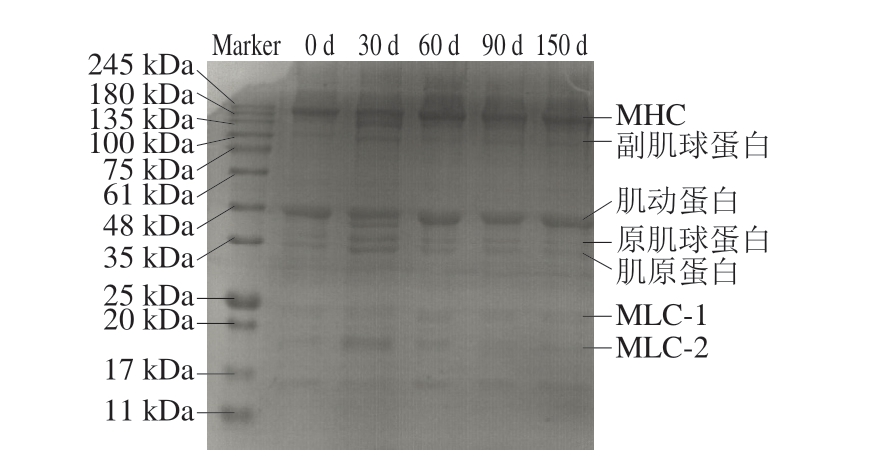
图6 骆驼肉MP SDS-PAGE图谱在冷冻贮藏期间的变化
Fig.6 Changes in the SDS-PAGE pattern of camel meat MP during frozen storage
可以发现,骆驼肉MP贮藏30 d以后在30 kDa处出现新条带,同时条带数在30 d时达到最多,随后逐渐变淡,此处条带可能是肌钙蛋白T(35 kDa)降解后产生的多肽;与贮藏30 d相比,贮藏中后期(60~150 d)的MLC和肌原蛋白条带逐渐变淡,与0 d相比,150 d的MHC条带较宽,这一方面可能是由于半胱氨酸侧链的硫原子被氧化形成二硫键(—S—S—),促使蛋白质分子之间或内部发生交联和聚集,同时大分子质量蛋白质的条带结合了更多的染色剂,从而使小分子蛋白质条带较淡,另一方面可能是多肽进一步降解为氨基酸,杜琪等[39]也发现冷藏期间的细点圆趾蟹MP有大分子聚集的情况。
2.7 骆驼肉MP凝胶色泽、保水性及微观结构在冷冻贮藏期间的变化
MP凝胶色泽不仅与肉品质的感官品质相关联,还间接反映了MP凝胶的微观结构和被氧化程度。如表1所示,随着贮藏时间的延长,骆驼肉MP凝胶的色泽参数发生显著变化。在贮藏初期,凝胶的L*为57.18±0.39,a*为-2.17±0.09,b*为4.39±0.14,W为56.90±0.38。随着贮藏时间延长至150 d,L*逐渐下降至52.92±0.21,a*上升至-0.52±0.25,b*增加至9.64±0.10,W逐渐下降至51.94±0.22,均有显著差异(P<0.05),这与Zhang Huiyun等[19]的研究结果大致相同。L*的下降可能与MP的氧化有关,氧化导致MP变性,肌红蛋白被氧化为高铁肌红蛋白,使得凝胶颜色变暗、变棕。而b*上升可能是MP氧化生成羰基化合物的结果。W的下降是L*、a*、b*变化的综合结果。
表1 骆驼肉MP凝胶色泽在冷冻贮藏期间的变化
Table 1 Changes in the color of camel meat MP gel during frozen storage

注:同列小写字母不同表示差异显著(P<0.05)。
贮藏时间/dL*a*b*W 057.18±0.39a -2.17±0.09d 4.39±0.14d 56.90±0.38a 3056.43±0.35a -2.02±0.02cd 5.41±0.36c 56.05±0.31a 6055.37±0.61b -1.75±0.06c 5.78±0.17c 54.97±0.63b 9054.76±0.54b -1.08±0.25b 6.71±0.07b 54.25±0.54b 15052.92±0.21c -0.52±0.25a 9.64±0.10a 51.94±0.22c
MP凝胶通过三维网络结构赋予肉制品弹性、硬度和咀嚼性。保水性是评估蛋白质凝胶功能特性的重要指标,其变化反映了蛋白质贮藏过程中的结构稳定性和持水能力。如图7所示,随着贮藏时间的延长,骆驼肉MP凝胶的保水性由0 d的(90.60±0.48)%显著下降至150 d的(83.99±0.57)%(P<0.05)。如图8所示,MP凝胶在0 d时结构较为均匀且致密,表面光滑,随着贮藏的进行,MP凝胶出现更多的孔隙和裂缝,整体结构变得不规则,贮藏150 d时,MP凝胶已经出现较大的孔隙。这与Zhang Huiyun等[19]对猪肉MP凝胶的研究结果相同。
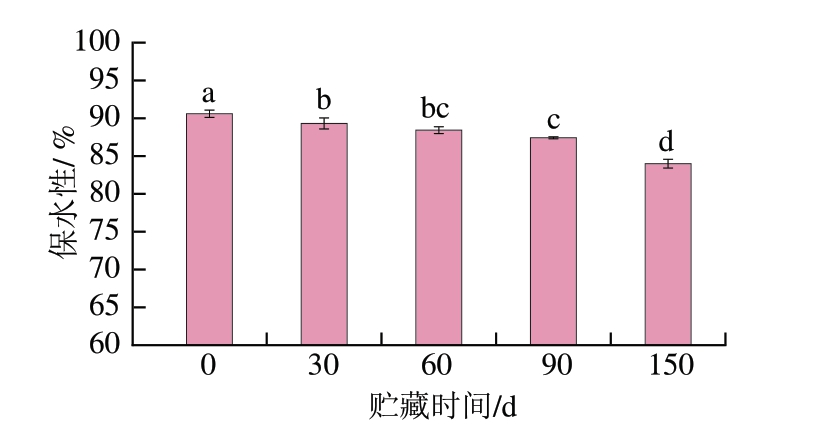
图7 骆驼肉MP凝胶保水性在冷冻贮藏期间的变化
Fig.7 Changes in the water-holding capacity of camel meat MP gel during frozen storage

图8 骆驼肉MP凝胶微观结构在冷冻贮藏期间的变化(×2 000)
Fig.8 Changes in the microstructure of camel meat MP gel during frozen storage (×2 000)
A~E.分别为贮藏0、30、60、90、150 d。
这些结果表明,MP凝胶的结构开始发生破坏,持水能力减弱。在冷冻贮藏过程中,氧化引发的MP结构展开和冰晶生长造成的机械损伤会使蛋白质分子内部的二硫键和巯基暴露,并进一步氧化成二硫键,进而破坏蛋白质的结构。过度氧化会导致无序交联,形成大分子聚集体,削弱加热时蛋白质之间的相互作用,阻碍热诱导凝胶形成有序网络。羰基化合物会破坏蛋白表面电荷分布,削弱其与水分子结合能力。同时,大冰晶的存在会破坏原有的三维网络结构,导致MP凝胶结构不规则和强度下降。相较于平滑、紧致的凝胶结构,多孔、多缝凝胶结构的光散射能力较弱,也导致L*的下降(表1)。
2.8 相关性分析
骆驼肉MP及其凝胶在贮藏过程中不同指标变化的相关性如图9所示,多项指标之间存在显著相关性,说明MP的各项指标变化紧密相关。
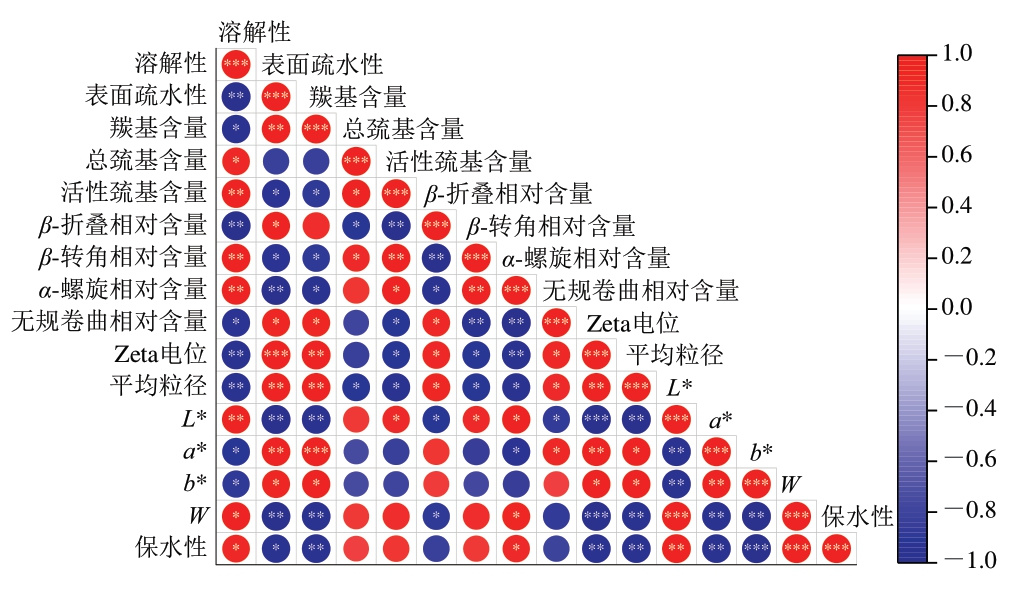
图9 骆驼肉MP及其凝胶在冷冻贮藏期间不同指标的相关性分析
Fig.9 Correlation analysis among different indices of camel meat MP and its gel during frozen storage
*.显著相关(P <0.0 5);**.极显著相关(P<0.01);***.高度显著相关(P<0.001)。
MP溶解性与表面疏水性和平均粒径呈极显著负相关(P<0.01),表面疏水性和平均粒径呈极显著正相关(P<0.01),表明随着MP疏水基团暴露的增加及由此导致的MP聚集成大分子,MP溶解性下降。此外,羰基含量与活性巯基含量呈显著负相关(P<0.05),总巯基含量和活性巯基含量分别与溶解性呈显著正相关(P<0.05)和极显著正相关(P<0.01),这直接反映了MP氧化反应中巯基的消耗,二硫键作为活性巯基的氧化产物,对MP溶解度产生了影响,虽然活性巯基的暴露有利于增强MP的亲水性,从而提高MP的溶解性,但疏水基团的暴露削弱了这一作用,且活性巯基被过度氧化形成的二硫键会使MP交联、聚集,导致溶解性下降。同时,低温也会导致肌球蛋白聚集,致使盐溶性蛋白被氧化[32]。
MP二级结构中,α-螺旋相对含量与β-折叠相对含量呈显著负相关(P<0.05),与无规卷曲相对含量呈极显著负相关(P<0.01),在贮藏过程中,原本有序的α-螺旋可能部分解折叠,转化为β-折叠,而相邻区域的肽链因失去氢键约束呈现无规卷曲状态,这种相关性表明蛋白质从有序结构向无序结构的转变。β-折叠相对含量与MP表面疏水性呈显著正相关(P<0.05),与MP溶解性呈极显著负相关(P<0.01),这是因为β-折叠通过链间氢键维持刚性结构,其稳定性依赖于疏水氨基酸残基的侧链堆积[40]。同时,部分氢键断裂可能导致β-折叠片段间的连接区域解折叠为无规卷曲,从而在统计上表现为β-折叠相对含量与无规卷曲相对含量呈显著正相关(P<0.05)。
MP凝胶中,W与L*、保水性均呈高度显著正相关(P<0.001),a*和b*呈极显著正相关(P<0.01),L*和a*、b*均呈极显著负相关(P<0.01)。从W计算公式可知,W由L*主导,高W意味着高反射率,即光滑致密的凝胶网状结构也就意味着高保水性。MP氧化产物的累积推动a*和b*的同步上升及L*的下降。
3 结 论
本研究表明,冷冻贮藏时间对骆驼肉MP及其凝胶功能特性影响显著。在冷冻贮藏过程中,氧化和冰晶造成的机械损伤致使分子构象改变。具体表现为疏水基团暴露、表面疏水性增加和Zeta电位绝对值下降导致平均粒径上升,最终导致MP溶解性下降。二级结构从有序的α-螺旋和β-转角向无序的β-折叠和无规卷曲转变。氧化还造成了羰基含量上升,总巯基和活性巯基含量下降。这些变化使MP热诱导凝胶的三维网络结构遭到破坏,持水能力减弱,凝胶保水性和W显著下降。这会进一步影响骆驼肉的食用品质和加工性能。因此,在实际生产中,需合理控制骆驼肉的冷冻贮藏时间,以保障其品质和功能特性。
[1] MOHAMMED H H H, JIN G F, MA M H, et al.Comparative characterization of proximate nutritional compositions, microbial quality and safety of camel meat in relation to mutton, beef, and chicken[J].LWT-Food Science and Technology, 2020, 118: 108714.DOI:10.1016/j.lwt.2019.108714.
[2] BABA W N, RASOOL N, SELVAMUTHUKUMARA M, et al.A review on nutritional composition, health benefits, and technological interventions for improving consumer acceptability of camel meat: an ethnic food of Middle East[J].Journal of Ethnic Foods, 2021, 8(1):1-13.DOI:10.1186/s42779-021-00089-1.
[3] KARGOZARI M, MOINI S, BASTI A A, et al.Development of Turkish dry-fermented sausage (sucuk) reformulated with camel meat and hump fat and evaluation of physicochemical, textural,fatty acid and volatile compound profiles during ripening[J].LWTFood Science and Technology, 2014, 59(2): 849-858.DOI:10.1016/j.lwt.2014.05.033.
[4] OSAILI T M, HASAN F, DHANASEKARAN D K, et al.Thermal inactivation of Escherichia coli O157:H7 strains and Salmonella spp.in camel meat burgers[J].LWT-Food Science and Technology, 2020,120: 108914.DOI:10.1016/j.lwt.2019.108914.
[5] 孙树远, 陈琪, 何静, 等.木瓜蛋白酶与超高压技术嫩化驼肉的研究[J].中国食品学报, 2023, 23(4): 239-250.DOI:10.16429/j.1009-7848.2023.04.023.
[6] 曹慎怡, 艾合买提江·艾海提, 郑力, 等.风干驼肉工艺优化及脂质水解氧化研究[J].食品与发酵工业, 2024, 50(12): 185-194.DOI:10.13995/j.cnki.11-1802/ts.036260.
[7] ROUSSEL O P, PIGNANELLI C, HUBBARD E F, et al.Effects of intensified training with insufficient recovery on joint level and single muscle fibre mechanical function: the role of myofibrillar Ca2+sensitivity[J].Applied Physiology, Nutrition, and Metabolism, 2024,49(12): 1646-1657.DOI:10.1139/apnm-2024-0189.
[8] ZOU Y, SHI H B, XU P P, et al.Combined effect of ultrasound and sodium bicarbonate marination on chicken breast tenderness and its molecular mechanism[J].Ultrasonics Sonochemistry, 2019, 59:104735.DOI:10.1016/j.ultsonch.2019.104735.
[9] ZHANG X D, ZHANG Y Q, DONG Y, et al.Study on the mechanism of protein hydrolysate delaying quality deterioration of frozen surimi[J].LWT-Food Science and Technology, 2022, 167: 113767.DOI:10.1016/j.lwt.2022.113767.
[10] ZHU M M, XING Y, LI H J, et al.Analysis of the changes in structural modification, physicochemical properties, and water distribution of porcine myofibrillar proteins induced by sub-freezing short storage (-6 ℃and -12 ℃, 7 d)[J].LWT-Food Science and Technology, 2023, 190:115587.DOI:10.1016/j.lwt.2023.115587.
[11] LI K, FU L, ZHAO Y Y, et al.Use of high-intensity ultrasound to improve emulsifying properties of chicken myofibrillar protein and enhance the rheological properties and stability of the emulsion[J].Food Hydrocolloids, 2020, 98: 105275.DOI:10.1016/j.foodhyd.2019.105275.
[12] PARSONS N, KNIGHT P.Origin of variable extraction of myosin from myofibrils treated with salt and pyrophosphate[J].Journal of the Science of Food and Agriculture, 1990, 51(1): 71-90.DOI:10.1002/jsfa.2740510108.
[13] DAI H J, SUN Y, XIA W Y, et al.Effect of phospholipids on the physicochemical properties of myofibrillar proteins solution mediated by NaCl concentration[J].LWT-Food Science and Technology, 2021,141: 110895.DOI:10.1016/j.lwt.2021.110895.
[14] CHELH I, GATELLIER P, SANTE-LHOUTELLIER V.Technical note: a simplified procedure for myofibril hydrophobicity determination[J].Meat Science, 2006, 74(4): 681-683.DOI:10.1016/j.meatsci.2006.05.019.
[15] OLIVER C N, AHN B W, MOERMAN E J, et al.Age-related changes in oxidized proteins[J].Journal of Biological Chemistry, 1987,262(12): 5488-5491.DOI:10.1016/S0021-9258(18)45598-6.
[16] 韩柯颖.添加山茶油与物理处理方式对肌原纤维蛋白凝胶与乳化特性的影响[D].南京: 南京财经大学, 2022.DOI:10.27705/d.cnki.gnjcj.2022.000163.
[17] LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature, 1970, 227: 680-685.DOI:10.1038/227680a0.
[18] CHEN Z H, DAI Z C, LIU C H, et al.Microbial transglutaminase promotes cross-linking for enhancing gelation of myofibrillar protein in frozen Litopenaeus vannamei through deamination reaction[J].Food Hydrocolloids, 2024, 147: 109332.DOI:10.1016/j.foodhyd.2023.109332.
[19] ZHANG H Y, LI X L, SUN S S, et al.Effects of carboxymethyl chitosan on the oxidation stability and gel properties of myofibrillar protein from frozen pork patties[J].International Journal of Biological Macromolecules, 2023, 234: 123710.DOI:10.1016/j.ijbiomac.2023.123710.
[20] LI J G, SUN C H, YUE X N, et al.Ultrasound-assisted immersion freezing improves the digestion properties of beef myofibrillar protein[J].Food Chemistry: X, 2025, 25: 102144.DOI:10.1016/j.fochx.2024.102144.
[21] 王晓君, 王晓香, 林静, 等.大足黑山羊宰后成熟过程中肌原纤维蛋白功能性质的变化[J].食品科学, 2015, 36(21): 79-84.DOI:10.7506/spkx1002-6630-201521016.
[22] MUTILANGI W A M, PANYAM D, KILARA A.Functional properties of hydrolysates from proteolysis of heat-denatured whey protein isolate[J].Journal of Food Science, 1996, 61(2): 270-275.DOI:10.1111/j.1365-2621.1996.tb14174.x
[23] LIU R, LIU Q, XIONG S B, et al.Effects of high intensity ultrasound on structural and physicochemical properties of myosin from silver carp[J].Ultrasonics Sonochemistry, 2017, 37: 150-157.DOI:10.1016/j.ultsonch.2016.12.039.
[24] XUE L Y, WEI W S, FU F T, et al.Riboflavin-mediated ultraviolet photosensitive oxidation of beef myofibrillar proteins with different storage times[J].Food Chemistry, 2025, 471: 142788.DOI:10.1016/j.foodchem.2025.142788
[25] YU L G, LI Q, LI Y, et al.Impact of frozen storage duration of raw pork on the formation of advanced glycation end-products in meatballs[J].LWT-Food Science and Technology, 2021, 146: 111481.DOI:10.1016/j.lwt.2021.111481.
[26] SELL D R, STRAUCH C M, SHEN W, et al.2-Aminoadipic acid is a marker of protein carbonyl oxidation in the aging human skin: effects of diabetes, renal failure and sepsis[J].Biochemical Journal, 2007,404(2): 269-276.DOI:10.1042/BJ20061645.
[27] ESTÉVEZ M, VENTANAS S, HEINONEN M, et al.Protein carbonylation and water-holding capacity of pork subjected to frozen storage: effect of muscle type, premincing, and packaging[J].Journal of Agricultural and Food Chemistry, 2011, 59(10): 5435-5443.DOI:10.1021/jf104995j.
[28] 董智铭, 么紫瑶, 姜萩婉, 等.超声功率对牛肉干品质及牛肉肌原纤维蛋白结构的影响[J].食品科学, 2023, 44(19): 27-34.DOI:10.7506/spkx10026630-20221018-174.
[29] JIANG S, ZHAO D, NIAN Y Q, et al.Ultrasonic treatment increased functional properties and in vitro digestion of actomyosin complex during meat storage[J].Food Chemistry, 2021, 352: 129398.DOI:10.1016/j.foodchem.2021.129398.
[30] NGUYEN H T, SVEINSDÓTTIR H I, ARASON S, et al.Quality changes in cod (Gadus morhua) and redfish (Sebastes marinus) loins and tails during frozen storage[J].Journal of Food Composition and Analysis, 2024, 130: 106188.DOI:10.1016/j.jfca.2024.106188.
[31] 邓思杨, 王博, 李海静, 等.冻融次数对镜鲤鱼肌原纤维蛋白功能和结构特性变化的影响[J].食品科学, 2019, 40(11): 95-101.DOI:10.7506/spkx1002-6630-20180606-079.
[32] RAMIAREZ J A, MARTIAN-POLO M O, BANDMAN E.Fish myosin aggregation as affected by freezing and initial physical state[J].Journal of Food Science, 2000, 65(4): 556-560.DOI:10.1111/j.1365-2621.2000.tb16047.x.
[33] ZHOU Y, WANG Y, HE J, et al.Evaluating the profile of myofibrillar proteins and its relationship with tenderness among five styles of dry-cured hams[J].International Journal of Food Science and Technology, 2021,56(1): 259-268.DOI:10.1111/ijfs.14627.
[34] 李思蕾, 王守伟, 赵冰, 等.Mg2+对羊肉肌原纤维蛋白结构和凝胶特性的影响[J].食品科学, 2023, 44(8): 109-117.DOI:10.7506/spkx1002-6630-20211220-230.
[35] WANG B, KONG B H, LI F F, et al.Changes in the thermal stability and structure of protein from porcine longissimus dorsi induced by different thawing methods[J].Food Chemistry, 2020, 316: 126375.DOI:10.1016/j.foodchem.2020.126375.
[36] 李保玲, 李颖, 朱振宝, 等.氧化亚油酸对肌原纤维蛋白胶凝行为及热诱导凝胶体外消化率的影响[J].食品与发酵工业, 2021, 47(19):111-119.DOI:10.13995/j.cnki.11-1802/ts.026253.
[37] LI F F, DU X, REN Y M, et al.Impact of ice structuring protein on myofibrillar protein aggregation behavior and structural property of quick-frozen patty during frozen storage[J].International Journal of Biological Macromolecules, 2021, 178: 136-142.DOI:10.1016/j.ijbiomac.2021.02.158.
[38] ZHANG H Z, ZHANG W Y, ZHAO X, et al.The determination of aggregation size on the emulsion properties of myofibrillar protein[J].Food Hydrocolloids, 2023, 144: 109015.DOI:10.1016/j.foodhyd.2023.109015.
[39] 杜琪, 廖月琴, 吴盈茹, 等.冷藏过程中细点圆趾蟹肌肉品质变化研究[J].核农学报, 2023, 37(5): 1012-1021.DOI:10.11869/j.issn.1000-8551.2023.05.1012.
[40] ZHANG Y M, BAI G P, WANG Y, et al.Exploring the potential of fibrinogen hydrolysates as enhancers for myofibrillar protein gelation:insights into molecular assembly behavior[J].Food Chemistry, 2025,464: 141587.DOI:10.1016/j.foodchem.2024.141587.