淡水鱼因其丰富的营养成分尤其是蛋白质和不饱和脂肪酸而广受消费者欢迎[1]。然而,高含量的蛋白质和不饱和脂肪酸也是导致鲜鱼保质期短的主要原因,其在微生物和酶的作用下易被氧化或降解,产生一系列醛类、酮类和胺类化合物[2-3]。鱼肉的高水分活度和接近中性的酸碱环境可为微生物的快速生长和繁殖提供适宜条件。因此,抑制微生物生长是延缓鲜鱼腐败变质的关键。冷藏是最常用的鱼类保鲜技术之一,但冷藏鱼保质期远不及冷冻鱼,冷藏鱼特定腐败菌如革兰氏阴性菌(如希瓦氏菌、假单胞菌等)能产生水解酶、脂肪酶和蛋白酶,加速鱼肉品质劣变[4]。因此,增加防腐剂使用以增强抗菌、防腐效果十分必要。合成防腐剂存在潜在的安全风险、微生物交叉耐药性及消费者对化学防腐剂的担忧等问题,源自植物、动物或微生物的天然防腐剂因其安全性更高而受到更多关注。
壳聚糖是天然多糖甲壳素脱除乙酰基后的产物,具有生物降解性、无毒性、广谱抑菌性等多种特性。在酸性条件下,带正电荷的特性使其能与细菌细胞膜带负电荷组分结合,破坏细胞结构,从而发挥抑菌作用[5]。由于兼具抗菌活性、生物降解性和安全性,壳聚糖被认为是一种极具应用前景的天然防腐剂[6]。然而,壳聚糖实际防腐效果受溶解度和分散性限制[7]。单一天然防腐剂通常需要较高浓度才能达到有效的保鲜效果,这可能导致食品产生不良风味和气味。因此,2 种及以上天然防腐剂复合处理以拓宽抗菌谱、增强抗氧化活性成为当前研究热点。绿原酸是从杜仲、山银花等植物中提取的天然酚酸类化合物,具有抗氧化、抗菌活性,对革兰氏阳性菌和革兰氏阴性菌均具有较好的抑制效果[8]。研究[9]表明,绿原酸不仅能用于果蔬保鲜,其提供的酸性条件还能协同增强壳聚糖的抑菌效果。
鮰鱼肉质鲜嫩不肥腻、鱼刺较少、口感细腻,具有营养价值高、价格低廉等特点,深受消费者喜爱[10]。目前相关研究主要聚焦于鮰鱼食用品质[11],关于鮰鱼保鲜的研究较少。本研究以冷鲜鮰鱼片为研究对象,通过测定冷藏过程中鮰鱼片理化指标与安全性指标,探究壳聚糖-绿原酸复合处理对冷鲜鮰鱼货架期和品质的影响,综合评价该复合防腐剂对鮰鱼片的保鲜效果,为开发有效的冷鲜鮰鱼保鲜方法提供理论支持。
1 材料与方法
1.1 材料与试剂
鲜活斑点叉尾鮰 市购。
绿原酸 陕西新湃生物科技有限公司;壳聚糖上海麦克林生化科技股份有限公司; 丙二醛(malondialdehyde,MDA)检测试剂盒 南京建成生物工程研究所;细菌DNA提取试剂盒 安诺伦(北京)生物科技有限公司;TruSeq Nano DNA LT文库制备试剂盒美国Illumina公司。
1.2 仪器与设备
CR-400/410色彩色差计 美能达(中国)投资有限公司;TA.XT Plus质构分析仪 英国Stable Micro Systems公司;UltiMate 3000高效液相色谱仪 美国Thermo Fisher Scientific公司;ECLIPSE Ci倒置荧光显微镜 日本尼康株式会社;DL-CJ-2NDII洁净工作台北京科誉兴业科技发展有限公司;K9860全自动凯氏定氮仪 山东海能科学仪器有限公司;NMI20-025V低场核磁共振分析仪 苏州纽迈分析仪器股份有限公司;PB-10 pH计 德国Sartorius公司;K-15离心机 美国Sigma公司。
1.3 方法
1.3.1 鮰鱼片的前处理
鲜活斑点叉尾鮰宰杀后,去皮、去内脏,用流水洗净,鱼肉切成2 cm×3 cm×2 cm大小、质量15 g的鱼块,分别用无菌水(CK组)、3.0 mg/mL绿原酸溶液(CGA组)、1.0 mg/mL壳聚糖溶液(CTS组)、1.0 mg/mL壳聚糖-3.0 mg/mL绿原酸混合溶液(C+组)浸泡处理15 min。以上壳聚糖与绿原酸质量浓度为实验室前期通过体外抗菌实验确定,该质量浓度对冷藏腐败鱼中常见腐败希瓦氏菌具有协同抑制效果。经浸泡处理后,将各组鮰鱼片沥干,分装于经辐照灭菌的聚乙烯真空包装袋中,抽真空,4 ℃贮藏0、2、4、6、8、10、12 d取样并进行相关指标测定。
1.3.2 pH值测定
根据夏雨婷等[12]的方法测定pH值。称取1.0 g剁碎鱼肉放入离心管,加入9 mL蒸馏水,4 ℃静置30 min,用pH计测定上层清液pH值。
1.3.3 离心失水率测定
根据Li Fangfei等[13]的方法测定鱼肉样品的离心失水率。称取2 g左右鱼肉(m1/g),用纱布(m2/g)包裹,再用滤纸包裹3 层,4 ℃、4 000 r/min离心10 min,取出称质量(m3/g)。按下式计算离心失水率:
1.3.4 水分分布测定
根据周俊鹏等[14]的方法,使用低场核磁共振分析仪分析鱼肉样品的水分分布情况。核磁共振分析参数:共振频率21.3 MHz、磁场强度0.55 T、线圈直径60 mm、磁体温度32 ℃。
1.3.5 总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量测定
利用自动凯氏定氮仪测定鱼肉TVB-N含量。称取5.0 g切碎鱼肉,参照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》中的半微量定氮法测定TVB-N含量。
1.3.6 硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值测定
以MDA含量表示TBARS值,按照MDA试剂盒说明书测定MDA含量,单位为mg/kg。
1.3.7 K值测定
根据Shao Ying等[15]描述的方法,采用高效液相色谱仪测定鱼肉样品K值。色谱条件:VP-ADS C18色谱柱(250 mm×4.6 mm,5 μm),以0.02 mol/L磷酸盐缓冲液作为流动相,进样量10 μL,流速1 mL/min,检测波长254 nm。
1.3.8 生物胺含量测定
参照GB 5009.208—2016《食品安全国家标准 食品中生物胺含量的测定》进行生物胺的提取与净化,参照Zhuang Shuai等[16]的高效液相色谱法进行生物胺的衍生化处理与分析。
1.3.9 菌落总数(total viable counts,TVC)测定
根据Qian Yunfang等[17]的平板计数法测定鱼肉样品的TVC。
1.3.10 微生物组成分析
采用细菌DNA提取试剂盒提取贮藏0、6、12 d鮰鱼片细菌DNA。使用TruSeq Nano DNA LT文库制备试剂盒制作并构建测序文库后,基于Illumina MiSeq平台,通过16S rRNA基因V3~V4区通用引物338F/806R进行高通量测序(上海美吉生物医药科技有限公司)。
1.4 数据处理
每个参数重复测定3 次,所有数据均以平均值±标准差表示。采用IBM SPSS Statistics 26软件进行方差分析,以P<0.05表示差异显著。用GraphPad Prism 8.0.2软件进行图表绘制。采用Mothur、Excel 2016和SPSS Statistics 26软件对高通量测序结果进行生物信息学分析。
2 结果与分析
2.1 贮藏过程中鮰鱼片pH值变化
如图1所示,贮藏0 d各组鮰鱼片pH值均在7左右,随着贮藏时间的延长,各组pH值均呈先下降后上升的变化趋势,贮藏6 d达到最低。贮藏前期鱼肉pH值下降与鱼肉中的糖原和ATP分解为乳酸和磷酸等物质有关;贮藏后期鱼肉pH值升高主要是因为微生物活动引起鱼肉蛋白质降解,产生碱性挥发性物质[18]。贮藏过程中,经绿原酸处理的鮰鱼片pH值普遍低于其他组,这可能是由于绿原酸能通过抑制腐败菌生长延缓微生物代谢引起的碱性物质积累,且绿原酸本身作为酸性酚类化合物对体系pH值存在直接影响。此外,未处理鮰鱼片pH值最高,而添加绿原酸和壳聚糖后,pH值普遍降低,这可能是由于二者抑制了鱼机体内相关酶活性和无氧酵解过程[19],促使pH值下降。相比之下,壳聚糖处理鮰鱼片pH值降幅较小,推测与其酸性代谢产物积累减少有关。随着贮藏时间的延长,各组pH值上升速率较CK组缓慢,这是由于绿原酸和壳聚糖能够有效抑制鱼肉中微生物生长与繁殖,减少碱性代谢产物积累[20]。值得注意的是,贮藏6、10、12 d后,CGA组pH值显著低于CTS组(P<0.05),一方面是因为绿原酸本身的酸性特性;另一方面是因为CGA组鮰鱼片在贮藏6 d累积的酸性物质较多。与CGA组相比,虽然贮藏末期C+组pH值略高,但两组pH值差异随贮藏时间延长而逐渐缩小,说明复合处理对鱼肉具有较好的协同保鲜效应。
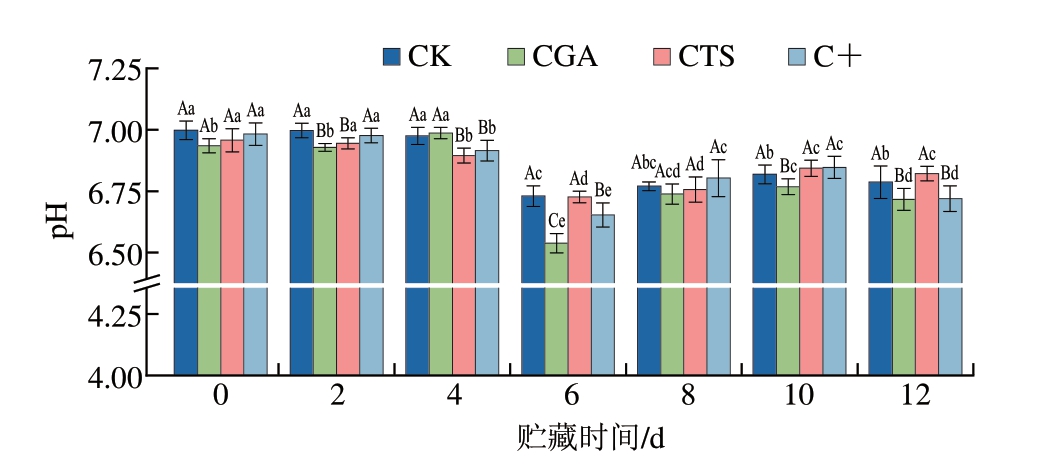
图1 冷藏条件下鮰鱼片pH值变化
Fig.1 Changes in pH of channel catfish fillets during storage at 4 ℃
小写字母不同表示同一处理组、不同贮藏时间差异显著(P<0.05);大写字母不同表示同一贮藏时间、不同处理组差异显著(P<0.05)。图2、4~8同。
2.2 贮藏过程中鮰鱼片离心失水率变化
离心失水率是衡量鱼肉样品持水能力(waterholding capacity,WHC)的重要指标。离心失水率升高通常反映肌肉组织WHC下降和微观结构损伤。如图2所示,各组鮰鱼片在贮藏过程中的离心失水率均呈持续上升趋势,这种变化主要归因于冷藏条件下肌原纤维蛋白的变性和聚集。贮藏期间,各处理组离心失水率普遍低于CK组,尤其是贮藏后期,以C+组效果最为显著,表明壳聚糖和绿原酸能有效抑制鮰鱼片水分流失。贮藏结束时,C+组离心失水率为34.11%,显著低于CK组(38.06%)与单一处理组(P<0.05)。一方面,壳聚糖和绿原酸分子中的羟基可通过氢键与水分子结合,增强肌肉水分束缚能力;另一方面,两者能通过抗菌作用减少微生物代谢对肌肉组织的分解破坏[9,21-22],协同发挥保鲜作用。
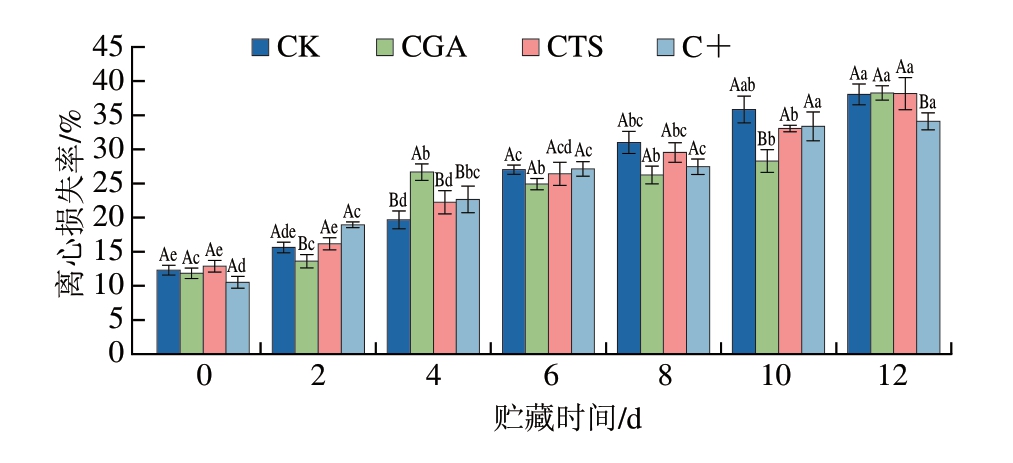
图2 冷藏条件下鮰鱼片离心失水率变化
Fig.2 Changes in centrifugal loss rate of channel catfish fillets during storage at 4 ℃
2.3 贮藏过程中鮰鱼片水分分布变化
低场核磁共振技术被广泛应用于测定肉制品中的水分分布[23]。一般来说,水分子横向弛豫时间(T2)越短,则其与大分子的结合程度越紧密[24]。根据T2可将样品中的水分为3 类:T21(0~10 ms)、T22(10~100 ms)、T23(>100 ms)。其中,T21表示与蛋白质侧链和亲水基团紧密结合的结合水;T22表示存在于原纤维、肌原纤维和肌肉细胞膜间的不可移动水[25];T23表示存在于纤维束间的自由水[23]。
由表1可知,贮藏0~10 d,CK组和CTS组T21随贮藏时间延长呈现上升趋势,这可能与贮藏期间蛋白质结构变化导致亲水基团暴露有关[26]。值得注意的是,与贮藏前期相比,贮藏后期T23变化幅度增大,表明水分子逐渐变得活跃,肌肉组织与水分子的结合能力变弱,可能是因为微生物代谢加速了鮰鱼肌纤维结构破坏,削弱了其水分束缚能力[27]。贮藏12 d,各处理组T23增幅小于CK组,表明壳聚糖和绿原酸有助于延缓样品持水力下降。P2表征特定T2区间的质子信号积分面积占总面积的百分比,反映样品中不同束缚状态水分的相对含量[28]。由表1可知,整个贮藏期间,P22超过总面积的95%,表明鮰鱼片中的水分主要以不可移动水形态存在,其次为自由水与结合水。
表1 冷藏条件下鮰鱼片水分T2与P2变化
Table 1 Changes in transverse relaxation times and the proportion of corresponding peak area in channel catfish fillets during storage at 4 ℃

注:同行小写字母不同表示不同贮藏时间差异显著(P<0.05);同列大写字母不同表示不同处理组差异显著(P<0.05)。
指标组别贮藏时间/d 0 2 4 6 8 1012 T21/ms CK1.01±0.13Ac1.13±0.14ABbc 1.27±0.09Aabc 1.27±0.10Aabc1.43±0.12Aab1.54±0.31Aa1.61±0.37Aa CGA1.08±0.11Ac1.10±0.09ABc1.27±0.20Abc1.40±0.22Abc1.33±0.14Aa1.45±0.22Aa1.39±0.11Aa CTS0.96±0.28Ab1.03±0.07Bb1.12±0.16Ab1.33±0.12Aa1.41±0.11Aa1.48±0.10Aa1.46±0.12Aa C+1.03±0.30Ab1.21±0.10Aab1.17±0.19Aab1.30±0.27Aab1.39±0.12Aab1.33±0.14Aa1.38±0.10Aa T22/ms CK61.51±4.70Abc 58.45±3.24Bc 61.29±1.12Abc 66.43±0.96Aa 62.94±4.29Aab 64.85±2.86Aab 62.94±4.29BCab CGA 60.86±4.05Aab 62.94±4.29Aab 60.09±4.29Ab 64.85±2.86Aa 62.94±4.29Aab 61.04±4.52ABab 63.89±3.78ABab CTS61.43±5.02Ab 62.94±4.29Aab 54.74±3.73Bc 59.13±3.78Cb 63.35±4.19Aab 62.94±4.29Aab 66.78±0.51Aa C+59.37±4.29Aa 60.09±4.29ABa 61.78±2.02Aa 61.51±4.59BCa 59.13±3.78Aa 58.45±3.24Ba60.09±4.29Ca T23/ms CK 597.61±35.75ABc 581.63±43.78Ac 546.58±52.35Ac 573.64±42.72Ac 593.62±39.97Ac 731.90±52.83Ab 813.77±71.94Aa CGA 610.94±13.83Ab 571.51±66.25Abcd 534.98±40.01Acd 510.50±34.76Bd 505.87±38.08Bd 593.62±39.97Bbc 775.92±61.00ABa CTS 636.57±45.95Ab 573.64±43.78Ab 468.69±71.19Bc 498.92±40.14Bc 586.96±41.28Ab 590.76±39.00Bb 747.75±57.87ABa C+ 547.00±32.63Bbc 542.56±26.65Abc 493.95±37.16ABc 498.92±38.08Bc 573.64±46.15Ab 560.32±46.15Bb 707.78±62.57Ba P21/%CK2.57±0.03Aa2.60±0.20Aa2.55±0.36Aa2.68±0.55Aa2.70±0.27Aa2.68±0.31Aa2.74±0.25Aa CGA2.56±0.20Aa2.61±0.13Aa2.63±0.44Aa2.70±0.33Aa2.72±0.32Aa2.67±0.41Aa2.74±0.39Aa CTS2.57±0.26Aa2.47±0.21Aa2.63±0.18Aa2.63±0.62Aa2.62±0.28Aa2.71±0.41Aa2.79±0.29Aa C+2.56±0.29Aa2.58±0.19Aa2.66±0.28Aa2.56±0.18Aa2.55±0.42Aa2.63±0.32Aa2.70±0.59Aa P22/%CK96.83±0.05Aa 96.71±0.18Aab 96.56±0.33Aabc 96.33±0.51Aabc 96.29±0.32Abc 96.08±0.37Bc 96.05±0.36Ac CGA 96.80±0.21Aa 96.64±0.11Aab 96.58±0.43Aabc 96.50±0.32Aabcd 96.36±0.34Abcd 96.23±0.37ABcd 96.15±0.37Ad CTS96.81±0.26Aa 96.69±0.19Aab 96.66±0.22Aab 96.62±0.61Aab 96.46±0.28Aab 96.37±0.29ABab 96.35±0.29Ab C+96.81±0.29Aa 96.76±0.17Aa 96.82±0.28Aa 96.69±0.18Aa 96.70±0.50Aa 96.55±0.26Aa 96.50±0.56Aa P23/%CK0.62±0.03Ac0.70±0.12Abc0.90±0.12Aabc1.01±0.10Aab1.02±0.18Aab1.25±0.58Aa1.23±0.44Aa CGA0.66±0.02Ac0.77±0.04Ac0.80±0.26Abc0.81±0.19Bbc0.96±0.04Ab1.11±0.13Aa1.12±0.09ABa CTS0.63±0.07Ab0.86±0.14Aab0.73±0.11ABab0.76±0.06Bab0.94±0.46Aab0.94±0.21Aa0.88±0.14BCa C+0.64±0.14Aab0.68±0.23Aab0.54±0.02Bb0.76±0.23Bab0.74±0.05Aab0.84±0.33Aab0.82±0.05Ca
由图3可知,贮藏时间和防腐剂处理对鱼片中水分分布与迁移存在影响。贮藏0 d,鮰鱼片呈现高强度的红黄色信号,表明其具有较高的初始水分含量和均匀的水分分布。随着贮藏时间的延长,各组图像逐渐向绿色信号过渡,显示水分流失的动态过程。贮藏10 d,C+组仍呈现较为明显的黄色信号,优于CTS组和CGA组,而CK组呈现更广泛的绿色信号,表明其水分流失更为严重。贮藏12 d,除C+组外,其他3 组基本完全转变为绿色信号。这与蛋白质氧化程度密切相关:C+组绿原酸与壳聚糖协同抑制蛋白质氧化变性,交联程度较低,从而有效降低水分迁移与流失程度,这与离心失水率结果一致。

图3 冷藏条件下鮰鱼片核磁共振成像
Fig.3 Magnetic resonance images of channel catfish fillets during storage at 4 ℃
2.4 贮藏过程中鮰鱼片TVB-N含量变化
TVB-N含量是衡量鱼类腐败程度的重要指标,其积累主要源于微生物和酶对蛋白质和非蛋白质含氮化合物(如氨基酸、核苷酸等)的降解作用[29-30]。如图4所示,鮰鱼片TVB-N含量初始值为7.23 mg/100 g。贮藏初期(0~4 d),各处理组TVB-N含量均呈缓慢上升趋势。随着贮藏时间的延长,CK组TVB-N含量迅速上升,这种快速积累归因于腐败菌增殖,其分泌的蛋白酶将大分子含氮物质分解为氨、三甲胺等挥发性碱性小分子化合物[31]。贮藏10 d,CK组TVB-N含量已达22.34 mg/100 g,超过GB 2733—2015《食品安全国家标准 鲜、冻动物性水产品》规定的可接受限值(20 mg/100 g),此时,CGA、CTS及C+组TVB-N含量分别为19.86、18.26、13.01 mg/100 g,均显著低于CK组(P<0.05)。随后,CGA组与CTS组TVB-N含量逐渐上升并超过可接受限值,而C+组TVB-N含量在整个贮藏期间均未超过20 mg/100 g,表明壳聚糖-绿原酸复合处理可有效延缓TVB-N含量增长。这与壳聚糖和绿原酸的抗菌活性密切相关,两者通过协同作用有效抑制鮰鱼片贮藏过程中的微生物生长与繁殖,从而有效延缓含氮化合物的分解速率[32]。
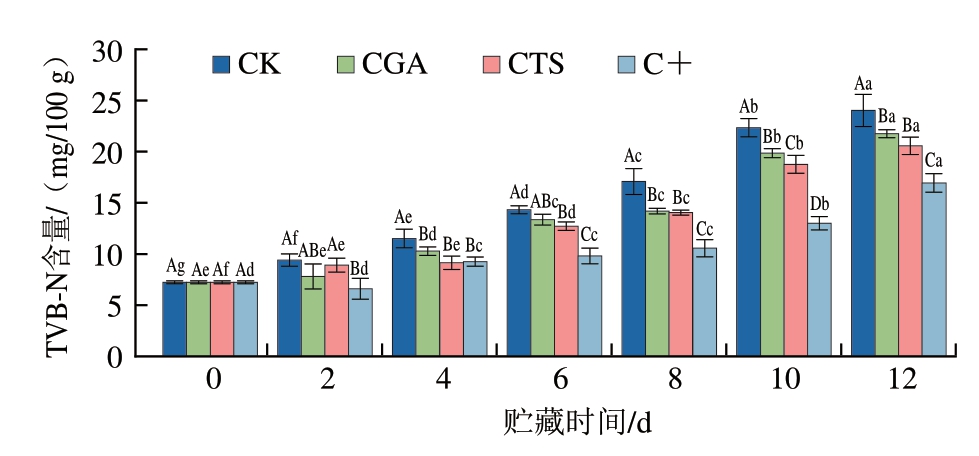
图4 冷藏条件下鮰鱼片TVB-N含量变化
Fig.4 Changes in TVB-N content of channel catfish fillets during storage at 4 ℃
2.5 贮藏过程中鮰鱼片TBARS值变化
如图5 所示,贮藏0 d,C K 组、C G A 组、C T S组和C +组T B A R S 值分别为0.2 7、0.1 9、0.2 1、0.19 mg/kg。贮藏0~8 d,CK组、CGA组和CTS组鮰鱼片TBARS值呈缓慢上升趋势,以CK组上升速率稍快;贮藏8 d后,TBARS值出现快速上升。C+组T B A R S 值在整个贮藏过程中呈缓慢波动上升趋势。贮藏12 d,CGA组、CTS组、C+组TBARS值分别为0.59、0.56、0.43 mg/kg,均显著低于CK组(0.69 mg/kg)(P<0.05),表明壳聚糖和绿原酸处理均能抑制鮰鱼片脂质氧化,两者复合处理可产生协同效应。Zarandona[33]、Lee[34]等的研究也发现,没食子酸、抗坏血酸与壳聚糖在抑制脂质氧化方面表现出良好的协同效应。
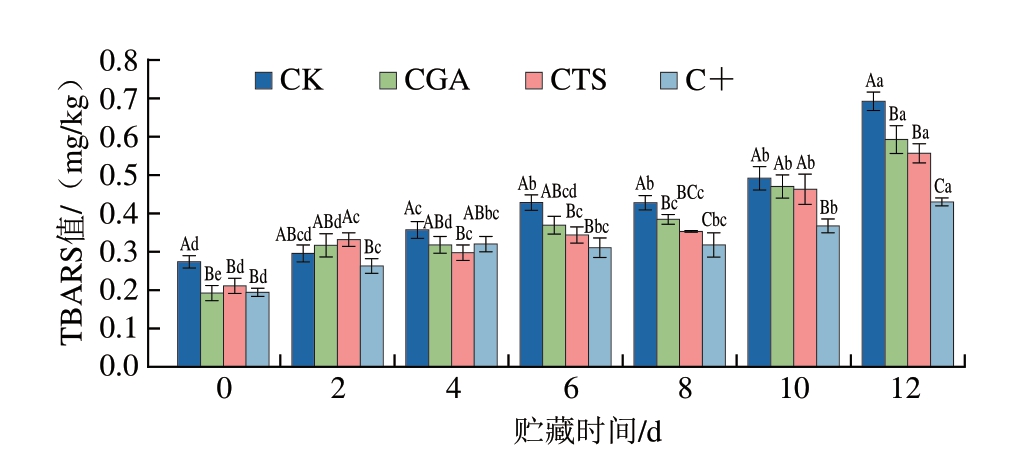
图5 冷藏条件下鮰鱼片TBARS值变化
Fig.5 Changes in TBARS value of channel catfish fillets during storage at 4 ℃
2.6 贮藏过程中鮰鱼片K值变化
K值是表征ATP降解情况和鱼肌肉新鲜度的重要指标之一。K值<20%时,鱼肉较新鲜,K值<50%时,鱼肉中等新鲜,K值>70%时,鱼肉不新鲜,已不可食用[35-36]。如图6所示,鮰鱼片初始K值在9.25%左右,组间无显著差异(P>0.05)。贮藏0~2 d,鮰鱼片K值上升缓慢;贮藏4 d时,各组K值迅速上升,其中CK组K值达56.88%,鱼肉已呈中等新鲜状态,CGA组、CTS组和C+组K值分别为48.18%、39.86%、32.33%,组间差异显著(P<0.05),贮藏8 d时差异缩小,贮藏10、12 d时差异进一步缩小,CTS组和C+组之间已无显著差异(P>0.05),各组K值在87.42%左右。Wang Xinyun等[27]研究发现,贮藏3 d鮰鱼片K值无显著变化,对照组K值在贮藏3 d后开始迅速增加,而曲酸处理组、茶多酚处理组和两者复合处理组K值增加明显滞后于对照组,与本研究K值变化趋势一致。K值变化与ATP降解酶活性与腐败菌代谢活动密切相关[37]。壳聚糖和绿原酸均能有效抑制微生物生长,且具有良好的协同作用,因此,两者复合处理能在一定程度上延缓鮰鱼片新鲜度下降。

图6 冷藏条件下鮰鱼片K值变化
Fig.6 Changes in K value of channel catfish fillets during storage at 4 ℃
2.7 贮藏过程中鮰鱼片生物胺含量变化
生物胺主要由蛋白水解和微生物介导的氨基酸脱羧反应生成[37]。其中,腐胺和尸胺被认为是鱼类新鲜度或微生物腐败的关键指示物,是腐败鱼肉异味的主要来源,酪胺由酪氨酸脱羧产生,其含量升高与鱼肉质地软化、腥味加重等感官劣变密切相关[38-39]。如图7所示,贮藏6 d后,腐胺和尸胺含量开始迅速升高,主要归因于微生物适应环境后进入对数生长期,氨基酸脱羧酶活性增加,从而加速生物胺生成与积累[40]。CK组腐胺和尸胺含量上升最快,其次为CGS组、CTS组、C+组,这与假单胞菌的生长与繁殖密切相关,假单胞菌具有较强的脱羧酶活性,是鱼片中腐胺和尸胺的主要生产菌,而壳聚糖和绿原酸可通过抑制假单胞菌生长有效延缓鱼片腐败变质进程[41]。贮藏8 d后,酪胺含量开始迅速升高,C+组较CK组上升更为缓慢。类似地,添加香芹酚能抑制部分革兰氏阴性菌产生酪胺[42]。壳聚糖和绿原酸可通过双重机制降低酪胺含量:一方面通过调控微生物群落结构、抑制微生物生长与增殖减少酪胺的生成;另一方面通过抑制脱羧酶活性进一步减少酪胺的生成。
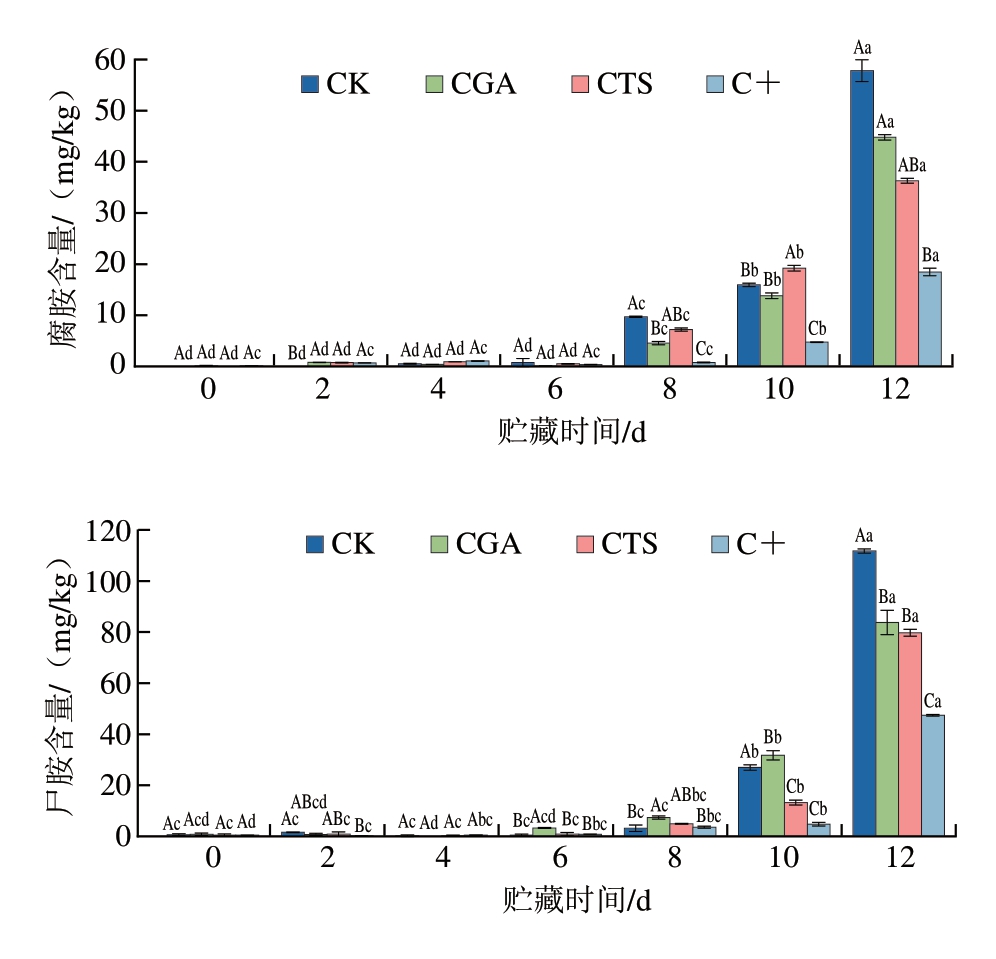
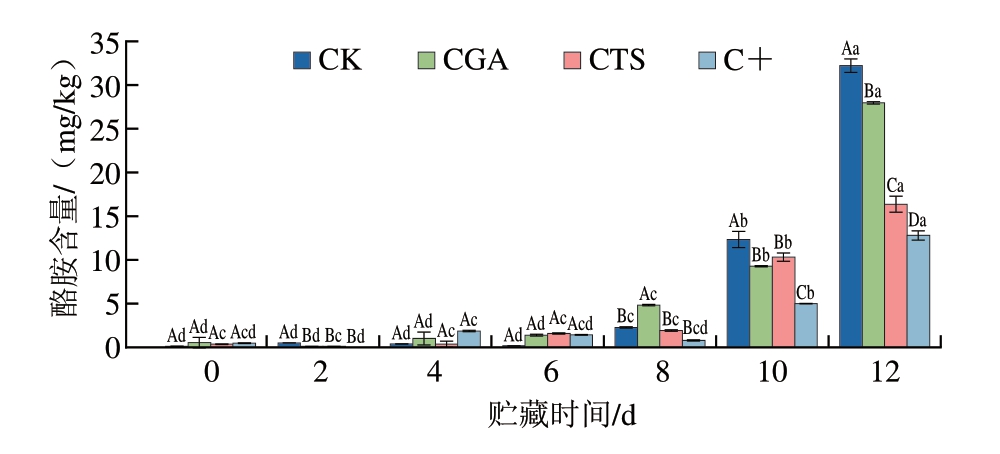
图7 冷藏条件下鮰鱼片腐胺、尸胺和酪胺含量变化
Fig.7 Changes in putrescine, cadaverine, and tyramine contents of channel catfish fillets during storage at 4 ℃
2.8 贮藏过程中鮰鱼片TVC变化
如图8所示,贮藏0 d,CK组、CGA组、CTS组和C+组TVC分别为4.31、4.32、3.10、3.45(lg(CFU/g)),C T S 组和C +组T V C 显著低于C K 组和C G A 组(P<0.05),壳聚糖在贮藏初期表现出较好的抑菌效果。值得注意的是,贮藏2~8 d,各组TVC虽均随贮藏时间延长而上升,但除贮藏2 d的CTS组外,各处理组TVC均显著低于CK组(P<0.05),C+组TVC上升最慢,表明壳聚糖和绿原酸均能有效抑制鮰鱼片贮藏过程中微生物的生长,且具有协同抑菌活性。壳聚糖的抑菌活性主要涉及其与腐败菌细胞膜的相互作用,壳聚糖通过破坏细胞膜完整性,导致细胞内容物外泄,进而扰乱细胞内环境稳态,从而发挥抑制微生物生长的作用[5]。此外,壳聚糖在酸性条件下质子化带正电荷,可与细菌细胞膜表面带负电荷的组分通过静电吸附结合,从而增强对细胞膜的破坏效应[9]。绿原酸通过破坏微生物细胞膜完整性、抑制核酸合成与能量代谢关键酶活性,并螯合铁离子阻断营养摄取,多靶点协同发挥抗菌作用。基于上述协同机制,壳聚糖与绿原酸复合处理表现出比单一处理更强的抑菌效果。
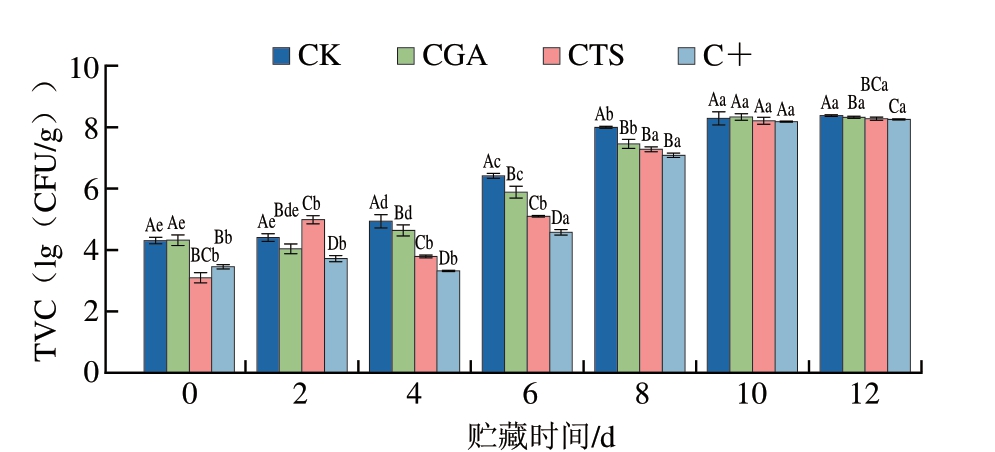
图8 冷藏条件下鮰鱼片TVC变化
Fig.8 Changes in TVC of channel catfish fillets during storage at 4 ℃
2.9 贮藏过程中鮰鱼片的微生物组成
由表2可知,菌群测序覆盖率均大于0.999,可满足对鮰鱼片物种多样性的分析。各组操作分类单元(operational taxonomic units,OTUs)数量及Shannon、ACE、Chao1、Simpson和Sobs指数均随贮藏时间延长而下降,表明微生物群落的多样性和丰度随贮藏时间延长而降低。
表2 冷藏条件下鮰鱼片菌群α-多样性变化
Table 2 Changes in α-diversity of bacterial community in channel catfish fillets during storage at 4 ℃
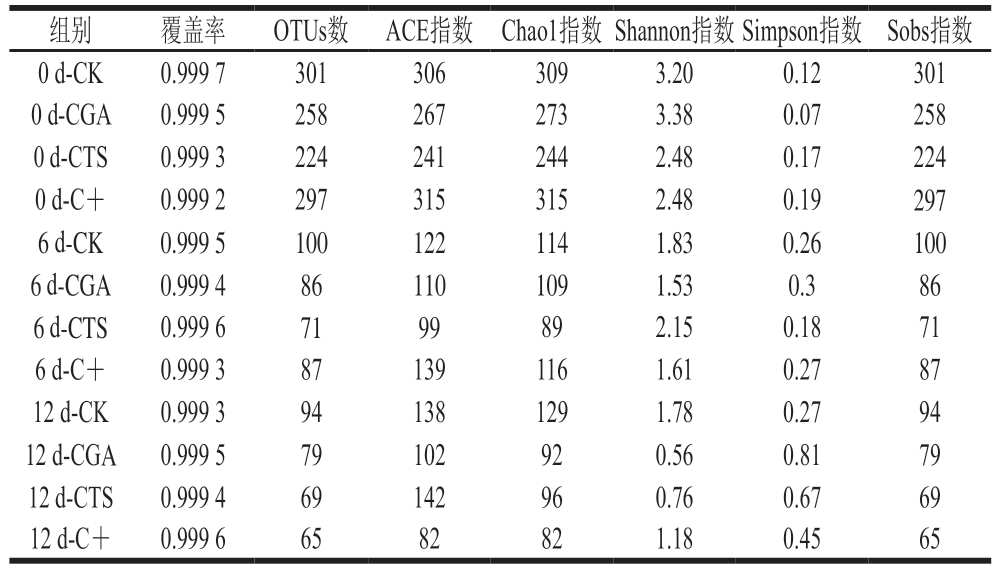
组别覆盖率OTUs数 ACE指数 Chao1指数Shannon指数Simpson指数 Sobs指数0 d-CK0.999 73013063093.200.12301 0 d-CGA0.999 52582672733.380.07258 0 d-CTS0.999 32242412442.480.17224 0 d-C+0.999 22973153152.480.19297 6 d-CK0.999 51001221141.830.26100 6 d-CGA0.999 4861101091.530.386 6 d-CTS0.999 67199892.150.1871 6 d-C+0.999 3871391161.610.2787 12 d-CK0.999 3941381291.780.2794 12 d-CGA0.999 579102920.560.8179 12 d-CTS0.999 469142960.760.6769 12 d-C+0.999 66582821.180.4565
由图9可知,贮藏0 d,CK组物种数量最多,CTS组最少。与CK组相比,绿原酸和壳聚糖处理均能有效降低物种数量。随着贮藏时间的延长,蛋白质分解和水分流失,微生物群落中优势菌大量生长,其他菌种生长空间减少,导致物种多样性快速下降。

图9 冷藏条件下鮰鱼片菌群的Venn图
Fig.9 Venn diagram of bacterial communitiy in channel catfish fillets during storage at 4 ℃
如图10 所示, 在门水平上, 变形菌门(Proteobacteia)占据绝对优势,包括假单胞菌、大肠杆菌、弧菌等多种病原菌[43]。贮藏0 d,CK组、CGA组、CTS组和C+组变形菌门相对丰度分别为90.14%、72.15%、94.96%和92.76%,以CGA组相对丰度最低,表明绿原酸能够有效抑制冷藏鮰鱼片中的变形菌门,变形菌门相对丰度随贮藏时间延长而增加,并稳定在98%以上。此外,冷藏鮰鱼片菌群还包括拟杆菌门(Bacteroidota)、梭杆菌门(Fusobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteriota)、黏细菌门(Myxococcota)、硝化螺旋菌门(Nitrospirota)等。沐楠智等[44]分析保鲜中华管鞭虾菌群多样性发现,其优势菌群为变形菌门和厚壁菌门,与本研究结果相似。
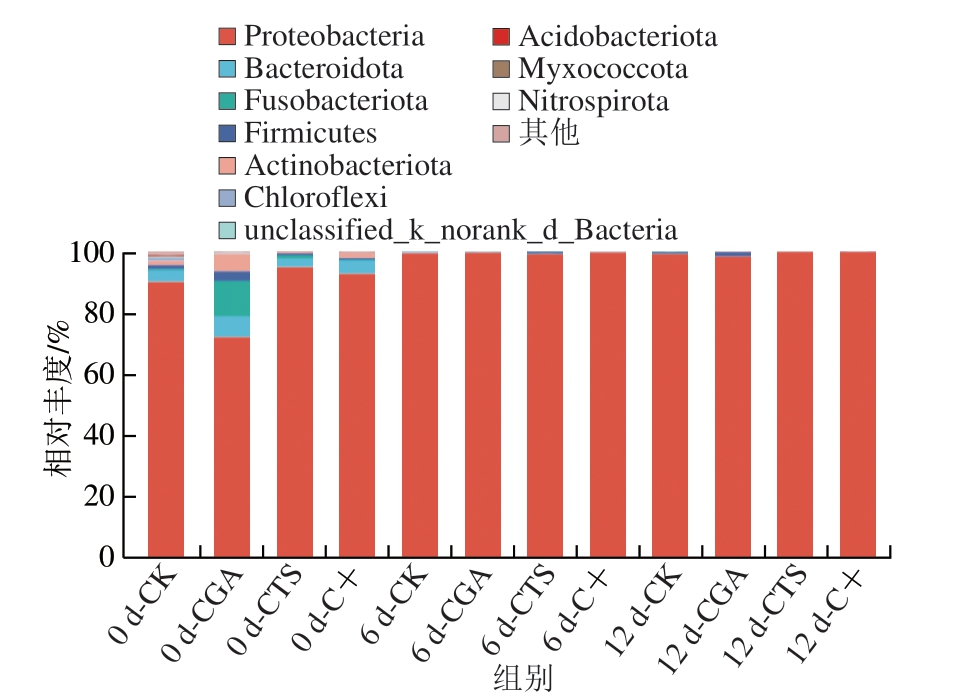
图10 冷藏条件下鮰鱼片门水平菌群相对丰度变化
Fig.10 Changes in relative abundance of bacterial community at the phylum level in channel catfish fillets during storage at 4 ℃
如图11所示,在属水平上,贮藏0 d优势菌属为假单胞菌属(Pseudomonas)、马赛菌属(Massilia)、不动杆菌属(Acinetobacter)和气单胞菌属(Aeromonas),其在CK组的相对丰度分别为39.80%、6.36%、20.75%和2.92%。值得注意的是,绿原酸处理与绿原酸-壳聚糖复合处理能够有效降低贮藏初期假单胞菌属相对丰度,改变鮰鱼片菌群组成比例。贮藏6 d,不动杆菌属相对丰度明显降低,冷藏环境中具有生存竞争优势的菌属所占比例增加,其中,假单胞菌属相对丰度相对升高,可认为是引起鮰鱼腐败的特定腐败菌,CGA组和C+组假单胞菌属相对丰度依然较CK和CTS组高,CTS组出现气单胞菌属。贮藏12 d,CGA组、CTS组和C+组假单胞菌属相对丰度相对降低,而耶尔森菌属(Yersinia)相对丰度大幅升高,占据绝对优势,表明贮藏后期壳聚糖和绿原酸能够有效抑制假单胞菌属生长与繁殖,延缓鮰鱼品质劣变。Zhao Wenyu等[45]研究也发现,壳聚糖与不同水溶性多酚提取物真空浸渍涂膜可有效抑制草鱼片中的细菌生长,尤其是假单胞菌属腐败菌,而Yang Xin等[46]研究发现,腐败活性最高的假单胞菌属对绿原酸接枝壳聚糖的耐受性最弱。综上,壳聚糖和绿原酸可有效降低贮藏中期不动杆菌属和贮藏末期假单胞菌相对丰度。
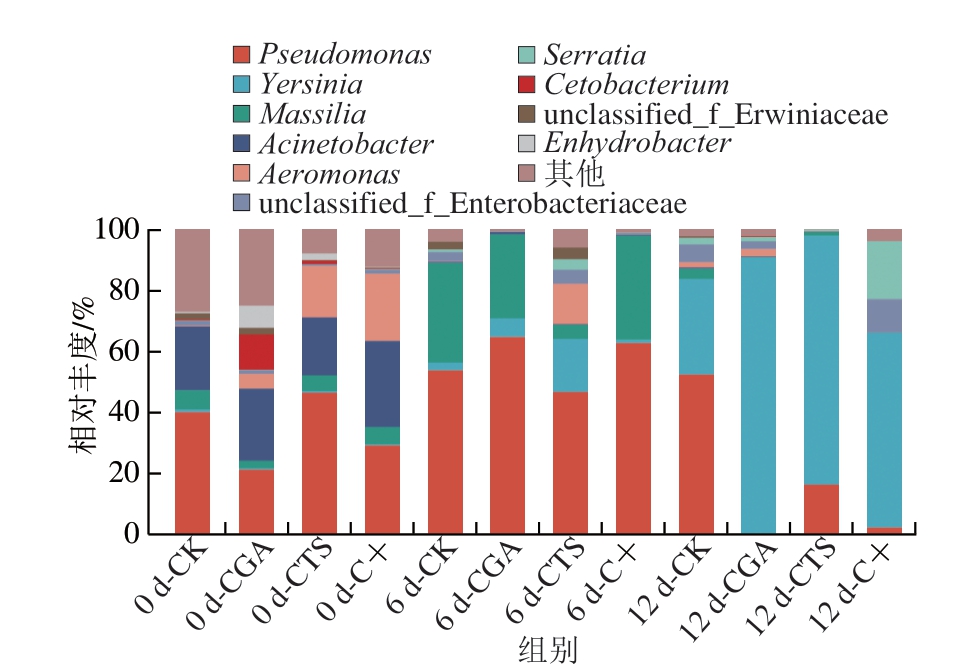
图11 冷藏条件下鮰鱼片属水平菌群相对丰度变化
Fig.11 Changes in relative abundance of bacterial community at the genus level in channel catfish fillets during storage at 4 ℃
如图12所示,约90%菌属仅在新鲜鮰鱼片中相对丰度较高,在冷藏过程中逐渐消亡,优势菌属发生更替。贮藏0 d以不动杆菌属、气单胞菌属和假单胞菌属为主;贮藏6 d以假单胞菌属为主;贮藏12 d,CGA组假单胞菌属相对丰度较低,CTS组气单胞菌属相对丰度较低,表明防腐剂对不同菌属具有选择性抑制作用。绿原酸和壳聚糖分别对假单胞菌属和气单胞菌属腐败菌表现出特异性抑制作用。其中,壳聚糖通过其氨基和羟基与微生物细胞壁发生静电相互作用产生吸附,绿原酸具有广谱抗菌特性且能够有效抑制微生物酶系统,由于二者的协同作用,C+组假单胞菌属和气单胞菌属相对丰度均较低。
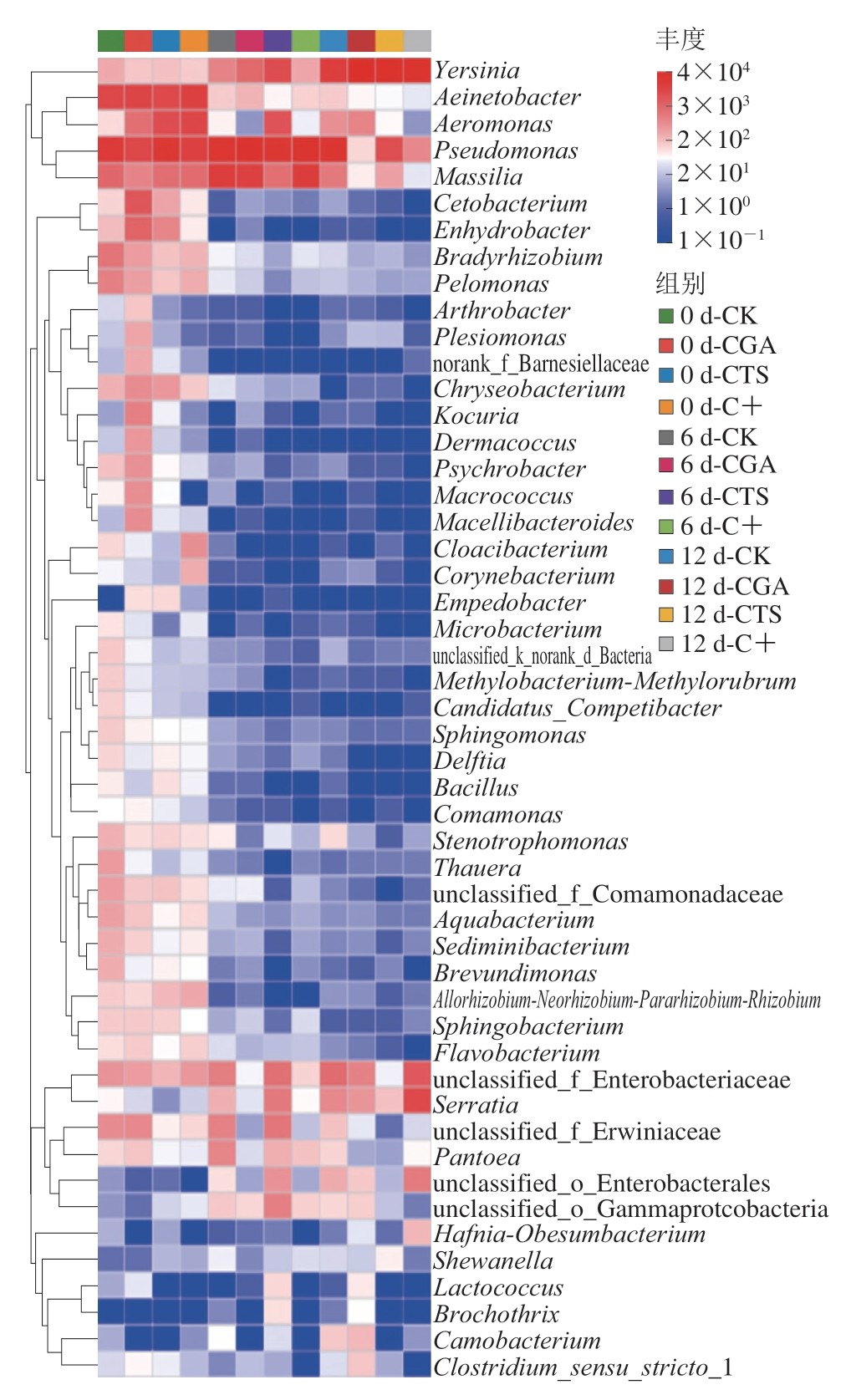
图12 冷藏条件下鮰鱼片属水平菌群热图
Fig.12 Heatmap of bacterial community at the genus level in channel catfish fillets during storage at 4 ℃
3 结 论
冷藏过程中,鮰鱼片pH值、离心损失率、鲜度(K值)、生物胺含量及微生物数量均随贮藏时间延长而呈现不同程度的增加,壳聚糖、绿原酸处理能够有效延缓相关指标的升高,以壳聚糖-绿原酸复合处理增加幅度最小,表明壳聚糖绿-原酸复合保鲜效果良好,能有效减缓鱼肉腐败变质。群落结构分析表明,贮藏末期未处理鮰鱼片中的假单胞菌属相对丰度较高,而壳聚糖和绿原酸处理鮰鱼片中的假单胞菌属相对丰度明显降低,表明壳聚糖、绿原酸能抑制假单胞菌生长,延缓鱼肉品质劣变进程。综上,壳聚糖-绿原酸复合处理是一种可行的鮰鱼片保鲜方案,可为加工及贮藏过程中保持鱼肉品质提供参考。
[1] CHEN J H, WEI W Y, LIANG C, et al.Protective effect of cinnamaldehyde on channel catfish infected by drug-resistant Aeromonas hydrophila[J].Microbial Pathogenesis, 2022, 167: 105572.DOI:10.1016/j.micpath.2022.105572.
[2] HATAB S, KODDY J K, MIAO W H, et al.Atmospheric cold plasma:a new approach to modify protein and lipid properties of myofibrillar protein isolate from hairtail (Trichiurus lepturus) fish[J].Journal of the Science of Food and Agriculture, 2022, 102(5): 2041-2049.DOI:10.1002/jsfa.11543.
[3] UCAR Y, OZOGUL Y, DURMUŞ M, et al.The effects of nisin on the growth of foodborne pathogens and biogenic amine formation:in vivo and in vitro studies[J].Food Bioscience, 2021, 43: 101266.DOI:10.1016/j.fbio.2021.101266.
[4] 刘亚楠, 李欢, 蒋凡, 等.基于活性包装视角下的水产品保鲜机制研究进展[J].食品科学, 2022, 43(13): 285-291.DOI:10.7506/spkx1002-6630-20220214-088.
[5] 王继业, 张明宇, 霍倩, 等.壳聚糖的性能及应用[J].纺织科学与工程学报, 2020, 37(3): 110-116.DOI:10.3969/j.issn.2096-5184.2020.03.016.
[6] 张小敏, 郭全友, 周国燕, 等.壳聚糖协同乳酸链球菌素抗轻腌大黄鱼源特定腐败菌抑制效应研究[J].中国食品学报, 2022, 22(5): 259-270.DOI:10.16429/j.1009-7848.2022.05.028.
[7] SABET-BOKATI Z, SABET-BOKATI K, RUSSELL Z, et al.Anticorrosion shape memory-assisted self-healing coatings: a review[J].Progress in Organic Coatings, 2024, 188: 108193.DOI:10.1016/j.porgcoat.2023.108193.
[8] 刘杰, 马翔, 赵韬, 等.绿原酸的生理功能及其在畜禽生产中的应用[J].饲料工业, 2024, 45(19): 13-19.DOI:10.13302/j.cnki.fi.2024.19.003.
[9] 倪乙丹, 周泉城, 李娅婕, 等.基于酪氨酸酶交联的豌豆蛋白-绿原酸-壳聚糖复合膜的构建及相关品质分析[J].食品科学, 2024,45(21): 271-279.DOI:10.7506/spkx1002-6630-20240401-008.
[10] 杨冰, 王舒瀚, 许瑞红, 等.鮰鱼肉冷藏过程中新鲜度变化[J].食品安全质量检测学报, 2022, 13(20): 6474-6481.DOI:10.19812/j.cnki.jfsq11-5956/ts.2022.20.008.
[11] 段炳双, 李陈晓东, 蔡骏昊, 等.预制粉蒸鮰鱼菜品研制及复合保水剂处理后冷冻对鮰鱼品质的影响[J].农产品加工, 2024(17): 30-34.DOI:10.16693/j.cnki.1671-9646(X).2024.17.008.
[12] 夏雨婷, 吴伟伦, 章蔚, 等.真空辅助加压腌制对草鱼块品质的影响[J].食品科学, 2023, 44(1): 70-77.DOI:10.7506/spkx1002-6630-20211115-176.
[13] LI F F, WANG B, LIU Q, et al.Changes in myofibrillar protein gel quality of porcine longissimus muscle induced by its stuctural modification under different thawing methods[J].Meat Science, 2019,147: 108-115.DOI:10.1016/j.meatsci.2018.09.003.
[14] 周俊鹏, 朱萌, 章蔚, 等.不同冷冻方式对淡水鱼品质的影响[J].食品科学, 2019, 40(17): 247-254.DOI:10.7506/spkx1002-6630-20180913-137.
[15] SHAO Y, WANG L, CHEN C S, et al.Antioxidant capacity of fermented soybeans and their protective effect on protein oxidation in largemouth bass (Micropterus salmoides) during repeated freezingthawing (FT) treatments[J].LWT-Food Science and Technology, 2018,91: 213-221.DOI:10.1016/j.lwt.2018.01.048.
[16] ZHUANG S, LI Y, JIA S L, et al.Effects of pomegranate peel extract on quality and microbiota composition of bighead carp (Aristichthys nobilis) fillets during chilled storage[J].Food Microbiology, 2019, 82:445-454.DOI:10.1016/j.fm.2019.03.019.
[17] QIAN Y F, XIE J, YANG S P, et al. In vivo study of spoilage bacteria on polyphenoloxidase activity and melanosis of modified atmosphere packaged Pacific white shrimp[J].Food Chemistry, 2014, 155: 126-131.DOI:10.1016/j.foodchem.2014.01.031.
[18] 朱雨, 杜美智, 艾节晴, 等.不同贮藏温度和时间对草鱼肌肉品质的影响[J].食品安全导刊, 2024(21): 51-53.DOI:10.16043/j.cnki.cfs.2024.21.039.
[19] YU D W, ZHAO W Y, DONG J L, et al.Multifunctional bioactive coatings based on water-soluble chitosan with pomegranate peel extract for fish flesh preservation[J].Food Chemistry, 2022, 374:131619.DOI:10.1016/j.foodchem.2021.12.131619.
[20] FENG L F, JIANG T J, WANG Y B, et al.Effects of tea polyphenol coating combined with ozone water washing on the storage quality of black sea bream (Sparus macrocephalus)[J].Food Chemistry, 2012,135(4): 2915-2921.DOI:10.1016/j.foodchem.2012.07.078.
[21] 沈永康, 朱峰, 冯雪锋, 等.壳聚糖基保鲜膜/涂层的制备及应用[J].包装工程, 2025, 46(1): 79-88.DOI:10.19554/j.cnki.1001-3563.2025.01.010.
[22] 王岚, 王梦莹, 王丽敏, 等.基于AHP-CRITIC的D-最优混料设计优化金银花泡腾片配方[J].食品研究与开发, 2024, 45(15): 132-137.DOI:10.13981/j.cnki.spkx.20240428-002.
[23] SUN Q X, SUN F D, XIA X F, et al.The comparison of ultrasoundassisted immersion freezing, air freezing and immersion freezing on the muscle quality and physicochemical properties of common carp (Cyprinus carpio) during freezing storage[J].Ultrasonics Sonochemistry, 2019, 51: 281-291.DOI:10.1016/j.ultsonch.2018.10.006.
[24] HUANG Z, JIA S L, ZHANG L T, et al.Inhibitory effects and membrane damage caused to fish spoilage bacteria by cinnamon bark(Cinnamomum tamala) oil[J].LWT-Food Science and Technology,2019, 112: 108195.DOI:10.1016/j.lwt.2019.05.093.
[25] LI D P, QIN N, ZHANG L T, et al.Degradation of adenosine triphosphate, water loss and textural changes in frozen common carp(Cyprinus carpio) fillets during storage at different temperatures[J].International Journal of Refrigeration, 2019, 98: 294-301.DOI:10.1016/j.ijrefrig.2018.11.014.
[26] 刘洒洒.臭鳜鱼自然及接菌发酵过程中微生物菌落演化与品质变化规律研究[D].大连: 大连工业大学, 2018.DOI:10.26992/d.cnki.gdlqc.2018.000313.
[27] WANG X Y, GENG L J, XIE J, et al.Relationship between water migration and quality changes of yellowfin tuna (Thunnus albacares)during storage at 0 ℃ and 4 ℃ by LF-NMR[J].Journal of Aquatic Food Product Technology, 2018, 27(1): 35-47.DOI:10.1080/10498850.2017.1400630.
[28] ZHANG Q Q, LI W, LI H K, et al.Low-field nuclear magnetic resonance for online determination of water content during sausage fermentation[J].Journal of Food Engineering, 2017, 212: 291-297.DOI:10.1016/j.jfoodeng.2017.05.021.
[29] YU D W, REGENSTEIN J M, ZANG J H, et al.Inhibition of microbial spoilage of grass carp (Ctenopharyngodon idellus) fillets with a chitosan-based coating during refrigerated storage[J].International Journal of Food Microbiology, 2018, 285: 61-68.DOI:10.1016/j.ijfoodmicro.2018.07.010.
[30] LIU D S, LIANG L, XIA W S, et al.Biochemical and physical changes of grass carp (Ctenopharyngodon idella) fillets stored at -3 and 0 ℃[J].Food Chemistry, 2013, 140(1/2): 105-114.DOI:10.1016/j.foodchem.2013.02.034.
[31] HUANG Z, LIU X C, JIA S L, et al.Antimicrobial effects of cinnamon bark oil on microbial composition and quality of grass carp(Ctenopharyngodon idellus) fillets during chilled storage[J].Food Control, 2017, 82: 316-324.DOI:10.1016/j.foodcont.2017.07.017.
[32] 黄昱梵.绿原酸-壳聚糖共聚物基乳液体系的构建及其应用研究[D].漳州: 闽南师范大学, 2024.DOI:10.27726/d.cnki.gzzsf.2024.000121.
[33] ZARANDONA I, LÓPEZ-CABALLERO M E, MONTERO M P, et al.Horse mackerel (Trachurus trachurus) fillets biopreservation by using gallic acid and chitosan coatings[J].Food Control, 2021, 120: 107511.DOI:10.1016/j.foodcont.2020.107511.
[34] LEE J S, JAHURUL M H A, PUA V C, et al.Effects of chitosan and ascorbic acid coating on the chilled tilapia fish (Oreochromis niloticus)fillet[J].Journal of Physics: Conference Series, 2019, 1358(1): 012009.DOI:10.1088/1742-6596/1358/1/012009.
[35] GAO M S, FENG L F, JIANG T J, et al.The use of rosemary extract in combination with nisin to extend the shelf life of pompano (Trachinotus ovatus) fillet during chilled storage[J].Food Control, 2014, 37: 1-8.DOI:10.1016/j.foodcont.2013.09.010.
[36] SAITO T, ARAI K I, MATSUYOSHI M.A new method for estimating the freshness of fish[J].Bullein of the Japanese Society of Scientific Fisheries, 1959, 24(9): 749-750.DOI:10.2331/suisan.24.749.
[37] LI D P, ZHANG L T, SONG S J, et al.The role of microorganisms in the degradation of adenosine triphosphate (ATP) in chill-stored common carp (Cyprinus carpio) fillets[J].Food Chemistry, 2017, 224:347-352.DOI:10.1016/j.foodchem.2016.12.056.
[38] MENG J, YANG Q, WAN W, et al.Physicochemical properties and adaptability of amine-producing Enterobacteriaceae isolated from traditional Chinese fermented fish (Suan yu)[J].Food Chemistry, 2022,369: 130885.DOI:10.1016/j.foodchem.2021.130885.
[39] 张敏, 赵晓娟, 曾晓房, 等.食品中腐胺和尸胺检测方法研究及应用进展[J].食品工业, 2019, 40(4): 215-219.DOI:10.3969/j.issn.1002-6630.2019.04.052.
[40] MOHAMMADI M, HOSSEINI H, SHAHRAZ F, et al.Effect of sage seed gum film incorporating Zataria multiflora Boiss essential oil on the storage quality and biogenic amine content of refrigerated Otolithes ruber fillets[J].International Journal of Biological Macromolecules,2023, 238: 123711.DOI:10.1016/j.ijbiomac.2023.123711.
[41] HAO R Y, LIU Y, SUN L M, et al.Sodium alginate coating with plant extract affected microbial communities, biogenic amine formation and quality properties of abalone (Haliotis discus hannai Ino) during chill storage[J].LWT-Food Science and Technology, 2017, 81: 1-9.DOI:10.1016/j.lwt.2017.03.031.
[42] ÖZOGUL F, KACAR Ç, HAMED I.Inhibition effects of carvacrol on biogenic amines formation by common food-borne pathogens in histidine decarboxylase broth[J].LWT-Food Science and Technology,2015, 64(1): 50-55.DOI:10.1016/j.lwt.2015.05.027.
[43] 孔秋莲, 郑琦, 颜伟强, 等.不同辐照工艺对牛肉糜杀菌效果及感官品质的影响[J].上海农业学报, 2023, 39(4): 131-139.DOI:10.15955/j.issn1000-3924.2023.04.19.
[44] 沐楠智, 谢超, 吴玉婷, 等.基于低压静电场及高通量测序技术对中华管鞭虾(Solenocera crassicornis)保鲜过程中微生物群落影响分析[J].海洋与湖沼, 2024, 55(1): 193-201.DOI:10.13981/j.cnki.hyyhz.20240100.
[45] ZHAO W Y, YU D W, XIA W S.Vacuum impregnation of chitosan coating combined with water-soluble polyphenol extracts on sensory,physical state, microbiota composition and quality of refrigerated grass carp slices[J].International Journal of Biological Macromolecules,2021, 193: 847-855.DOI:10.1016/j.ijbiomac.2021.10.190.
[46] YANG X, LAN W Q, SUN X H.Effect of chlorogenic acid grafted chitosan on microbiological compositions of sea bass (Lateolabrax japonicus) fillets: dominant spoilage bacteria, inhibition activity and membrane damage mechanisms[J].International Journal of Food Microbiology, 2024, 411: 110540.DOI:10.1016/j.ijfoodmicro.2023.110540.