肉类是人类膳食中重要的动物性蛋白质来源,富含脂质、维生素和矿物质,对维持人体生长发育、免疫功能及代谢过程至关重要[1]。近年来,我国肉类消费需求持续增长[2],《国际统计年鉴2024》数据显示,2024年中国禽肉产量约为10 000万 t,占全球总产量的27%,较2023年增长约3.7%(约370万 t)。在肉品消费中,风味是影响消费者购买决策的关键因素,肉品风味的形成受多种因素调控,包括动物品种、年龄、性别、肉部位、烹饪方式及屠宰加工工艺等。风味的形成机制涉及复杂的生物化学与加工工艺调控网络,内源蛋白酶则是这一网络的关键“调控者”。
肌肉组织细胞降解过程受多种酶的调控,钙蛋白酶特异性切割肌原纤维蛋白,引发蛋白初级降解,溶酶体破坏细胞结构后释放出组织蛋白酶,进一步降解肌球蛋白、肌动蛋白等,最终由氨肽酶和羧肽酶等外肽酶降解,释放出多种风味前体物质,包括肌肽、鹅肌肽、甲硫氨酰组氨酸等小肽,以及由酪蛋白或肌动蛋白降解产生的多肽;此外,还释放谷氨酸、天冬氨酸、甘氨酸等游离氨基酸[3]。这些前体物质不仅直接赋予肉品鲜味、甜味等基础滋味,还可通过Maillard反应、脂质氧化等途径生成醛类、酮类及含硫化合物,形成多层次挥发性风味[4]。因此,严格控制宰后成熟过程中酶的活性可使肉品风味达到最佳状态[5],而内源蛋白酶活性过强可能导致肉质过度嫩化,产生不良风味,进而降低肉品的感官品质[6]。内源蛋白酶对肉品的影响已被广泛关注,Toldrá等[7]系统介绍了肌肉内源蛋白酶和脂肪酶在干腌火腿风味发展过程中的关键作用,详细分析了不同酶类对蛋白质和脂类降解的贡献,但仅分析了其对猪肉的影响,对其他种类肉品的影响并未提及,存在一定的局限性。李琳等[8]进一步综述内源蛋白酶对肉类食品风味的影响,强调了其在非挥发性风味物质生成中的关键性作用,但对挥发性风味物质的贡献及其与多种酶的协同作用的总结较为有限。
本文基于国内外关于内源蛋白酶在肉制品风味形成中的研究进展和研究动态,对内源蛋白酶的影响因素、作用机理及肉制品风味形成的机理进行阐述,同时分析内源蛋白酶对风味呈味成分形成的作用,探讨其机制和影响因素,总结并展望多种内源蛋白酶对肉品加工过程中风味的协同调控,以期为研究肉品风味的形成与改善提供理论依据和研究方向。
1 内源蛋白酶
肉品加工过程中的蛋白酶按来源可分为内源蛋白酶和外源蛋白酶,前者由机体自身合成,如组织蛋白酶、钙蛋白酶和胰蛋白酶;后者来自外部加入,如胃蛋白酶、木瓜蛋白酶和碱性蛋白酶等。在肉品的加工过程中,内源蛋白酶和外源蛋白酶共同作用形成各类肉品的独有风味[9]。内源蛋白酶按其水解多肽的方式可分为内肽酶和外肽酶,内肽酶作用于蛋白质内部的肽键,降解释放出短肽,其中只有分子质量为200~5 000 Da的肽才具有呈味特性[10];外肽酶则作用于肽链的C端或N端,水解末端肽键释放呈味游离氨基酸[11]。内肽酶包括组织蛋白酶、钙蛋白酶、Caspase和基质金属蛋白酶等;外肽酶则包括二肽酶、氨肽酶和羧肽酶等[12]。蛋白酶体虽然不属于传统内/外肽酶,但其在肌肉成熟过程中可以降解肌肉纤维蛋白,促进风味成分的释放。
1.1 组织蛋白酶
组织蛋白酶存在于肌肉细胞溶酶体内[13],溶酶体膜破损后被释放,主要参与肉类成熟与加工过程中的蛋白质降解。迄今已分离提取出20余种组织蛋白酶,在宰后肌肉蛋白质降解过程中,组织蛋白酶B、L、H和D起主导作用[14],其中组织蛋白酶B、L、H属于半胱氨酸蛋白酶,组织蛋白酶D为天冬氨酸蛋白酶。Cai Zhulan等[13]研究发现,组织蛋白酶B和L主要降解肌肉纤维中的肌球蛋白重链、肌钙蛋白、伴肌动蛋白和肌联蛋白等;组织蛋白酶H具有内切酶和外切酶特性,主要降解肌动蛋白、肌球蛋白重链、肌钙蛋白I亚基及原肌球蛋白等;组织蛋白酶D则主要作用于肌球蛋白、肌联蛋白、C蛋白和M蛋白,其水解产生的肽类大部分为短链水溶性肽,能够表现出特定的风味特性[15]。
近年来,组织蛋白酶在肉制品加工和风味形成中的作用受到广泛关注,研究表明,组织蛋白酶在鸡肉汤[16]、干腌火腿[17]、风干鸭[18]和风干牛肉[19]等产品的风味形成过程中均起着关键作用,其降解产物可直接影响肉品的风味特性。然而,组织蛋白酶的降解能力受环境pH值和温度的严格调控,组织蛋白酶B和L的最适pH值为6~8,且其活性随pH值升高而下降[13];温度超过20 ℃时,pH值升高显著抑制其活性。组织蛋白酶活性的最佳条件因动物种类而异,牛胰脏的组织蛋白酶L在pH 6.5、50 ℃时活性最高[20];而Matsuishi等[21]从兔骨骼肌溶酶体中提取的组织蛋白酶H在pH 4.0时可降解肌球蛋白重链、肌动蛋白、原肌球蛋白和肌钙蛋白I,但在pH 5.0~5.6时其作用范围受到限制,仅能轻度降解肌钙蛋白I。太湖白鱼中的组织蛋白酶D在pH值为5.00和5.50时能显著降解肌球蛋白重链和肌动蛋白,而在pH值约为6.89时,其活性显著下降[22]。在腊肉加工的整个周期中,组织蛋白酶H活性较为稳定,其始终具有活性,且蛋白降解速率明显大于组织蛋白酶B[23]。
1.2 钙蛋白酶
钙蛋白酶是一类依赖钙离子激活的中性半胱氨酸蛋白酶,钙蛋白酶家族目前已知有14 个成员[24],其中钙蛋白酶1(μ-calpain)和钙蛋白酶2(m-calpain)为最重要的组成部分,在肌肉嫩化过程中起关键作用。钙蛋白酶的活性受细胞内钙离子浓度变化的严格调控,通过催化亚基的自溶发挥活性[25],当细胞内钙离子浓度达到激活阈值时,钙蛋白酶自溶,催化亚基逐步降解[26]。在肌肉组织中,钙蛋白酶主要水解结构蛋白,包括肌联蛋白、伴肌动蛋白和肌间线蛋白等[27],使肌节结构解离,从而显著提升肉品嫩度。钙蛋白酶对pH值和温度敏感,在pH值约7.5时活性最高,pH值下降,其活性逐渐降低[28]。钙蛋白酶发生自溶后,对钙离子的要求降低,但其稳定性大幅下降,尤其在高离子强度环境下,尤其是肉品的腌制中会迅速失活[29],这一特性限制了其在高浓度离子条件下的应用。可以通过调控加工环境或酶工程手段提升其稳定性,以增强其在肉品嫩化中的应用效果。钙蛋白酶对肉品风味的直接贡献较小,其主要作用于结构蛋白,产生分子质量为5~30 kDa的多肽,这类多肽本身不具挥发性或呈味特性[10]。然而,这些多肽可进一步被其他内源蛋白酶降解,释放出具有呈味特性的小肽和游离氨基酸,从而间接影响肉品风味。
1.3 Caspase
Caspase是一种半胱氨酸蛋白酶,在细胞凋亡中被激活,根据其功能和激活方式,Caspase可分为两大类[30]:启动C as pase和效应Cas pase,其中启动Caspase,如Caspase-2、Caspase-8、Caspase-9负责接收死亡信号并激活下游效应Caspase;而效应Caspase,如Caspase-3、Caspase-6、Caspase-7则直接通过切割细胞内的底物,导致细胞形态学变化并执行凋亡过程[31-32]。Caspase在肌原纤维蛋白降解及肉品品质形成中发挥重要作用,研究[33]表明,Caspase能降解骨骼肌中的多个肌原纤维蛋白,如肌联蛋白、肌动蛋白、肌钙蛋白I、肌钙蛋白T、肌球蛋白轻链等。Caspase通过对特定氨基酸残基(如Asp)的切割,降解多种关键蛋白质,从而破坏细胞和组织结构。此外,Caspase还会与其他内源酶进行协同作用,组织蛋白酶B和D通过溶酶体-线粒体途径促进细胞凋亡,增强Caspase的激活作用[34]。Huang Ming等[35]的研究进一步揭示了Caspase-3在肌原纤维降解中的作用,其不仅能降解伴肌动蛋白和伴肌球蛋白等结构蛋白,还可破坏肌节I线和Z线的结合,从而削弱肌原纤维结构的稳定性。此外,已有研究[36]表明,Caspase能有效降解猪肉、牛肉和鸡肉肌肉纤维中的蛋白质,这也说明其在肉类蛋白质降解中发挥关键作用,并对肉品风味的形成具有促进作用。
1.4 二肽基肽酶(dipeptidyl peptidase,DPP)
DPP是一类重要的蛋白水解酶,根据底物性质、亚细胞定位和分子质量分为4 类:DPP-I、DPP-II、DPP-III和DPP-IV,其中DPP-I和DPP-II位于溶酶体,DPP-III存在于细胞质中,DPP-IV位于细胞膜上[37]。DPP的主要功能是从肽链N端释放二肽,并表现出一定的底物特异性。例如,DPP-I对N端倒数第2个氨基酸为碱性残基的肽链具有较高亲和力,而DPP-IV则更倾向于识别N端倒数第2个氨基酸为Pro的肽链[38]。不同类型的DPP在不同pH值和温度条件下表现出不同的酶学特性:DPP-I最适pH值为5.0~6.5,最适温度为45~55 ℃;DPP-II最适pH值为5.5,最适温度为65 ℃;DPP-III最适pH值和温度分别为8.0和40 ℃,且对pH值变化敏感;DPP-IV在pH 6.5~8.0和45 ℃时活性最强[39],研究表明,DPP-I和DPP-II对温度和pH值的适应性较高,而DPP-III和DPP-IV则相对敏感。此外,盐分对DPP的活性也有显著影响,例如腌制过程中,DPP-II和DPP-III受到较强抑制,尤其是在pH值低于6.0时,DPP-III的活性几乎完全丧失[40]。DPP不仅能进一步降解小肽分子,还能为氨肽酶和羧肽酶提供主要的降解底物,生成更小的肽段和游离氨基酸,这些降解产物在Maillard反应和酶促反应中进一步转化,显著影响肉品的香气和风味[41]。
1.5 氨肽酶与羧肽酶
氨肽酶主要存在于细胞质中,有糖基化修饰,但不含脂蛋白。X射线结晶学研究[42-43]表明,牛晶状体氨肽酶属于金属酶,其活性中心含有2 个锌离子。根据对底物N端氨基酸的特异性,氨肽酶可分为6 种类型:丙氨酰氨肽酶、精氨酰氨肽酶、亮氨酰氨肽酶、甲硫氨酰氨肽酶、谷氨酰氨肽酶和赖氨酰氨肽酶,其中亮氨酰氨肽酶、精氨酰氨肽酶和丙氨酰氨肽酶在风味物质形成中起主要作用。羧肽酶按结构类型主要分为羧肽酶A和羧肽酶B[44],二者均为金属酶,每个酶分子含有1 个锌离子辅基。羧肽酶A主要存在于哺乳动物胰脏,其催化活性中心由Arg145、Glu270和Tyr248构成,负责与底物C末端的羧基和肽键结合[45]。氨肽酶和羧肽酶均能特异性识别多肽的N端或C端氨基酸并催化其水解,其中氨肽酶对末端含有芳香族、脂肪族和碱性氨基酸的肽链亲和力较高,羧肽酶B则更倾向于作用于N端或C端含有Lys和Arg的多肽[46-47]。氨肽酶的活性受pH值、温度和水分等因素的调控,通常最适pH值为7.0~8.5,最适温度范围为35~65 ℃。Nishimura等[48]从鸡肉中提取的氨肽酶最适pH值为6.5,Ye Xiujuan等[49]从牛肉中提取的氨肽酶最适pH值为8.0。鸡肉氨肽酶的相对活力在37~39 ℃达到最大,低于6 ℃或高于60 ℃时几乎无活性[50]。研究表明,氨肽酶活性与游离氨基酸含量增长呈正相关[51],且游离氨基酸含量的提高主要归因于羧肽酶的作用,羧肽酶A和羧肽酶B能降解肽链,释放出Gly、Glu、Asp、Lys、Ala、Phe、Tyr、Trp、Ile、Leu和Val等疏水性氨基酸[52]。此外,在肉品加工贮藏后期,氨肽酶和羧肽酶对风味物质的贡献大于加工贮藏初期。
1.6 蛋白酶体
蛋白酶体是一类具有多种酶解功能的复合体[53],是细胞主要的蛋白水解途径之一。26S蛋白酶体是蛋白酶体的主要形式[54],由2 个19S粒子和1 个20S核心粒子组成。19S调节颗粒负责识别并去除泛素链,同时展开底物蛋白并转移至20S核心颗粒,而20S核心颗粒则负责催化底物蛋白的降解[55]。泛素-蛋白酶体降解途径(ubiquitinproteasome pathway,UPP)是细胞内选择性蛋白降解的关键途径之一,主要负责降解衰老、损伤或错误折叠的蛋白质,以维持细胞稳态[56]。UPP由泛素、泛素活化酶(E1)、泛素结合酶(E2)、泛素连接酶(E3)、26S蛋白酶体和泛素解离酶等共同完成[57-58],其中泛素作为标记物指示靶蛋白的降解[59]。该途径包括2 个主要步骤:首先是靶蛋白的泛素化,E1激活泛素,活化过程消耗ATP,活化的泛素与E2结合,通过E2和E3转移到目标蛋白上[60];其次,泛素化蛋白被转运到26S蛋白酶体进行降解,在蛋白酶体内,靶蛋白被解旋并切割成小肽段。UPP不仅能精确降解不需要或受损的蛋白质,还在调控细胞周期、信号转导和基因表达等方面发挥重要作用[61]。蛋白酶体的最适pH值范围为7.0~8.0,接近中性或微碱性,且在37 ℃条件下活性最高,稳定性良好,在宰后冷藏的第7天仍保持活性。蛋白酶体通过降解钙蛋白酶和组织蛋白酶,将大分子蛋白分解为更小的蛋白或肽链,主要作用于肌肉纤维中的肌联蛋白、肌动蛋白、肌球蛋白和原肌球蛋白等[54],为风味物质的形成提供前体物质。蛋白酶体的亚基X/β5、Z/β2和Y/β1分别能切断中性、碱性、酸性氨基酸羧基端的肽键[62],从而表现出类似胰凝乳蛋白酶、胰蛋白酶、胱天蛋白酶的活性,这不仅直接影响肉品风味形成,还在一定程度上延缓风味劣变[63]。
2 内源蛋白酶对肉品风味的影响
风味是由味觉、嗅觉和感官神经等受到食物刺激而产生的感觉,包括挥发性和非挥发性风味。肉制品的风味是评价其食用品质的关键因素,直接影响消费者的偏好。在冷藏和加工过程中,肉的颜色、质地等物理特性发生变化,热诱导造成的蛋白质变性、脂质氧化及Maillard反应等也会影响肉品的最终风味和食用品质[64]。肉制品风味的形成是热反应、风味前体物质和风味化合物相互作用的综合结果。
2.1 内源蛋白酶对肉品非挥发性风味的影响
2.1.1 非挥发性风味呈味成分
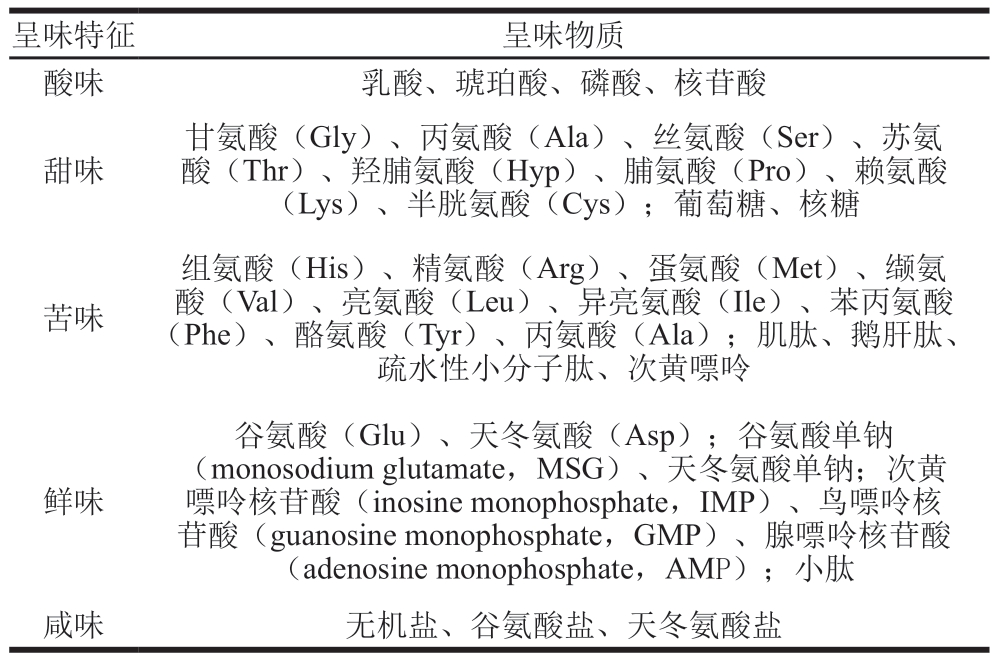
肉品中的非挥发性风味呈味物质主要包括游离氨基酸、小肽、核苷酸、有机酸、矿物元素及其代谢产物[4]。这些物质通常无挥发性或挥发性较低,但具有水溶性,能溶于水后刺激口腔味蕾,经味觉受体细胞传递,最终传递至中枢神经,产生非挥发性风味感知[65]。常见的非挥发性风味类型包括酸、甜、苦、鲜和咸味,不同呈味物质呈现的非挥发性风味如表1所示。
表1 肉品中非挥发性风味的主要呈味物质
Table 1 Main non-volatile flavor components in meat products
?
酸味物质经离子通道传导,作用于III型受体,形成酸味感知[66]。肉品的酸味主要来源于2 类物质:一是蛋白质初步分解产生的酸味肽,如Glu-γ-A1a、Glu-γ-Gly等,以及多肽分子进一步降解产生的酸味氨基酸,如Asp、His和Ile等;二是肌肉代谢产生的有机酸,如乳酸、草酸和琥珀酸等[67]。目前对肉品甜味呈味物质的研究较为成熟,遵循夏伦贝尔的“ AH/B生甜学说”[68],通过T1R2和T1R3受体传递形成甜味感知。甜味呈味物质主要分为2 类:第1类为宰后尸僵阶段通过糖酵解和核苷酸分解产生的糖类物质;第2类为蛋白质降解产生的小肽和Gly、Ala、Ser等氨基酸。肉品的苦味不仅与苦味呈味物质相关,还与游离氨基酸的疏水性有关。蛋白质水解产生的苦味氨基酸,如Arg、Leu、Phe、Met等[69],通常位于肽链末端,其疏水残基是苦味受体的结合位点。蛋白质水解度与苦味强度呈“钟形”关系[70],研究[70]表明,蛋白质降解产生的三肽和T2R1受体结合能力更强,苦味更为明显。肉品的鲜味由鲜味氨基酸、呈味核苷酸、有机碱类、盐类、有机酸类和鲜味肽共同作用实现[71]。Glu、Gly和Asp是主要的鲜味氨基酸,不仅赋予肉类鲜味,还能缓解咸味和酸味,基础作用明显,其中,Glu是最重要的鲜味氨基酸,但只有L-Glu及其钠盐才能展现鲜味[72]。核苷酸如IMP、GMP、AMP等能与氨基酸协同增强鲜味,产生放大效应。核苷酸通过降低氨基酸的感知阈值增强鲜味,而氨基酸是通过与味蕾受体结合直接感知鲜味[73]。咸味通过阿米洛利分子通道传递[74],电离的阳离子通过钠通道进入味觉细胞,释放传导介质,增强神经元兴奋,最终产生咸味的感知。肉品的咸味主要源自咸味肽、氨基酸钠盐及外部添加NaCl等无机盐。已知的咸味肽主要为二肽类,如Orn-Tau·HCl和Lys-Tau·HCl等,氨基酸钠盐主要有MSG和天冬氨酸单钠等。
2.1.2 内源蛋白酶对非挥发性风味的贡献
在肉类食品贮藏与加工过程中,参与反应的蛋白酶主要包括肉类自身的内源酶和微生物产生的外源酶,其中内源蛋白酶发挥主要作用[38]。钙蛋白酶、组织蛋白酶和蛋白酶体等首先将肌纤维中的大分子蛋白降解成多肽,随后由DPP将多肽切割成小分子肽,最后再由氨肽酶和羧肽酶降解小肽,释放出分子质量更小的氨基酸。此过程中不同序列的肽链和不同种类的氨基酸呈现出不同的风味,赋予肉品不同的非挥发性风味特征,其机理如图1所示。
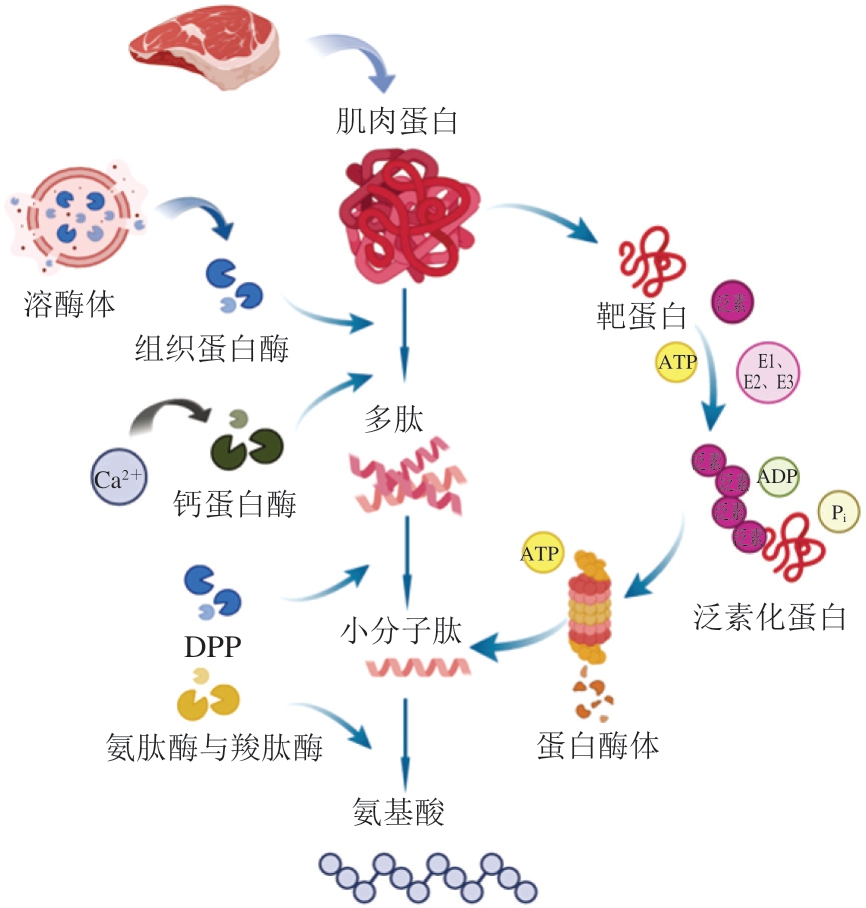
图1 内源蛋白酶对肉类食品风味的影响机理
Fig. 1 Potential mechanism of the effects of endogenous proteases on the flavor of meat products
内肽酶分别降解肌肉纤维中的特定蛋白质,释放多肽和小分子肽,对肉品的风味形成具有重要作用。在火腿非挥发性风味形成过程中,内肽酶为风味形成提供重要的前体物质,在金华火腿的加工中,钙蛋白酶的活性在腌制结束时降至生火腿的40%[75],进一步证明加工过程中钙蛋白酶发挥降解蛋白质的作用。此外,研究[76]发现,宣威火腿的加工过程中,组织蛋白酶B和L始终保持活性,蛋白质斑点数持续下降,呈味性小肽含量上升。Hu Shiqi等[77]通过研究火腿加工过程中的蛋白酶水解指数发现,组织蛋白酶B和L对蛋白降解效果显著,蛋白酶水解指数提高约20%,38、36 kDa的片段含量减少,即蛋白酶从溶酶体中大量释放,促进了蛋白质降解和风味形成。Zhou Changyu等[78]研究证明,钙蛋白酶在风干鹅的腌制过程中对风味形成有重要贡献,腌制结束时,钙蛋白酶的活性约为生鹅肉的50%,游离氨基酸含量增加约33.5%。Wang Daoying等[79]也证实了组织蛋白酶B、D和L在风干鸭加工过程中的重要作用,进一步证明组织蛋白酶降解肌肉纤维蛋白,促进游离氨基酸释放的关键作用。
此外,Huang Feng等[80]研究发现,牛骨骼肌中的Caspase-3能诱导肌动蛋白降解,通过观察到的肌原纤维蛋白降解和降解片段,推测Caspase与其他内源性蛋白酶一起参与肌肉蛋白的降解,促进风味成分的释放。由此可见,在贮藏和加工过程中,组织蛋白酶、钙蛋白酶、Caspase和蛋白酶体能有效降解肌肉纤维蛋白,释放多肽和小肽,为风味物质的形成提供前体物质。
在肉品加工的后期阶段,外肽酶发挥主要作用,与关键风味物质之间存在密切关系,Wu Yanyan等[81]研究发现,在干腌鱼的整个加工过程中,DPP-I始终具有活性且呈显著下降趋势,成品中DPP-I的残留活性约为原始样品的50%。Zhu Chaozhi等[82]对金华火腿肽谱的研究表明,在DDP的作用下,Glu-Glu-Glu-Leu-Lys、Thr-His-Ala-Phe-Ala-Ser-Glu-Leu-Lys-Leu-Lys、Val-Gly-Thr-Gly-Ser-Glu等不具有风味特性的肽链被切割成Leu-Lys、Ser-Glu、Ala-His和Phe-Glu等二肽,这些二肽具有呈味特性。Li Mingming等[83]研究干腌猪肩胛肉加工过程中内源蛋白酶的动态变化,发现组织蛋白酶B、D,DPP-II、DPP-IV及精氨酰氨肽酶在风味物质形成中发挥重要作用。相关性分析表明,Glu、Lys、Val、Ala和Leu等关键游离氨基酸的积累与多种氨肽酶活性具有显著相关性,表明这些酶通过参与蛋白质降解过程调控风味氨基酸的释放。尤其是精氨酰氨肽酶,不仅调控氨基酸的积累,还影响关键挥发性风味物质的生成。Zhou Changyu等[84]则认为,丙氨酰氨肽酶是干腌培根中Glu、Ala和Lys等风味成分产生的主要酶,组织蛋白酶和氨肽酶通过降解肌球蛋白和肌动蛋白为甜味和鲜味氨基酸的生成提供主要来源。
在干腌火腿的加工过程中,氨肽酶具有较高的活性,周昌瑜[40]研究证明,在火腿加工的后期阶段,氨肽酶的活性约为原料肉原始活性的12%,Glu、Lue、Arg和Ala等多种游离氨基酸的含量显著增加。Zhu Chaozhi等[82]在对金华火腿的肽谱研究中发现,羧肽酶能从肽链Glu-Glu-Glu-Leu和Leu-Leu-Ala-His-Leu中水解出Leu,从肽链Leu-Lys-Glu和Val-Glu-Glu中水解出Glu。这些研究表明,在后期加工过程中,外肽酶不仅影响肽链的降解,还直接与风味物质的生成紧密相关。
大部分研究表明,内源蛋白酶在肉品加工过程中对风味物质的生成具有关键作用[38],但Zhang Xicai等[85]提出了不同观点,认为微生物分泌的外源蛋白酶对石斑鱼片风味物质的变化起到更大作用,他们的研究发现,冷藏石斑鱼片的风味变化与内源蛋白酶的相关性不大,这可能是因为低温限制了内源蛋白酶的活性,此外,研究还证实,碘乙酸溶液能有效抑制石斑鱼片中组织蛋白酶B、L和钙蛋白酶的活性,从而延缓风味物质的释放。
2.2 内源蛋白酶对肉品挥发性风味的影响
2.2.1 挥发性风味呈味成分及形成机制
挥发性风味是肉品品质的重要感官特征,主要由醛类、酸类、酮类、碳氢化合物、醇类、含氮和含硫化合物等挥发性成分构成。醛类、酸类和醇类是主要的风味贡献者,占挥发物总量的94.95%,其中醛类物质因其阈值较低,对风味影响显著[83]。挥发性风味前体物质分为水溶性和脂溶性2 类,如图2所示。水溶性前体物质来源于动物自体合成及屠宰后肌肉糖原酵解、蛋白质和脂质水解过程[86],包括游离氨基酸、多肽、呈味核苷酸、还原糖和硫胺素等;脂溶性前体物质则主要来源于脂质和脂肪酸。挥发性风味呈味形成机制如图3所示。
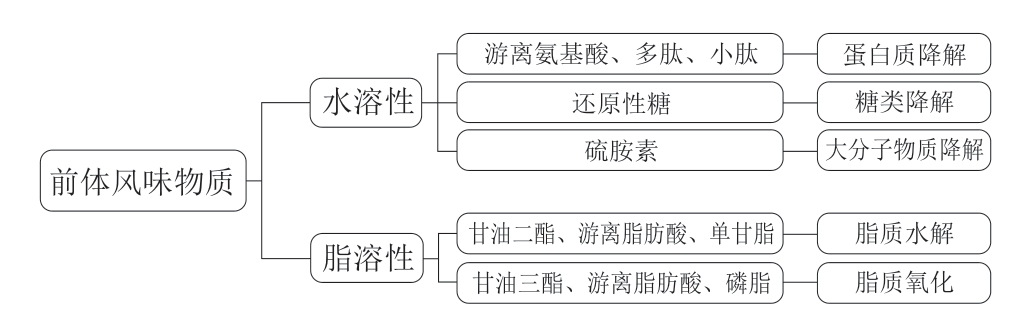
图2 前体风味物质的分类及来源
Fig. 2 Classification and sources of precursor flavor substances
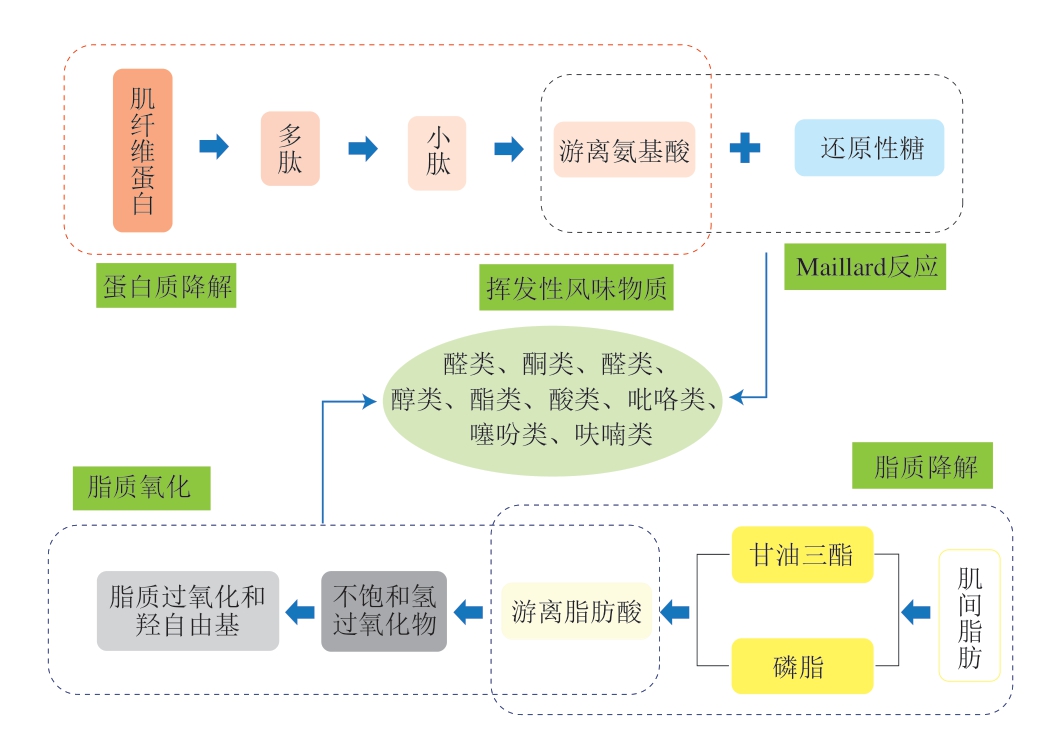
图3 挥发性风味呈味形成机制
Fig. 3 Formation mechanism of volatile flavor substances
在肉品加工过程中,甘油三酯和磷脂在高温下分解释放短链脂肪酸,进而氧化转化为挥发性羰基化合物[87]。亚油酸的氢过氧化物降解生成具有香草味的己醛[88]和具有油脂香味的2-癸二烯醛[89],这与肉品的油炸香味和脂肪香味形成相关。醛类化合物的阈值低,对风味的整体影响显著,还能与其他风味物质发生重叠效应[90];酮类则主要来源于脂肪酸的β氧化和脱羧过程,如花生四烯酸氧化产生1-辛烯-3-酮[91]。酯类主要是酯化反应生成或外部添加的成分,短链的酸酯具有水果香味,但长链酸酯具有轻微的油脂味,因此酯类对风味形成具有一定贡献[10]。
游离氨基酸是风味前体物质的重要来源,主要由蛋白质降解生成,不仅本身具有风味,还能通过Maillard反应生成烃、醛和胺等挥发性化合物[92]。氨基酸通过Strecker反应形成硫醇,进而生成含硫化合物、2-甲基丁醛和2-甲基丙醛等[93]。Zhu Chaozhi等[82]研究表明,Lys和His可与葡萄糖和乙醛反应生成具有呈味性质的己醛、壬醛、辛醛和苯甲醛。还原性糖与蛋白质降解产物中的游离氨基酸发生Maillard反应,形成醛、二酮、呋喃及衍生物等中间产物,最终生成如吡嗪、呋喃、噻唑及环烯硫化物等挥发性有机化合物[87]。硫胺素降解产生多种含硫和氮的挥发性有机化合物,包括硫化氢、硫醇、噻吩、噻唑等,进一步参与Maillard反应,产生具有熟肉、烤肉香气的物质。脂质氧化与Maillard反应相互作用,增强肉类风味的复杂性和多样性,从而构成肉品的独特风味[94-95]。
2.2.2 内源蛋白酶对挥发性风味的贡献
肉品挥发性风味的形成主要通过前体物质的转化及后期加工过程中的化学反应实现,关键在于蛋白质、脂肪和糖类等成分的降解与转化[96]。内源蛋白酶在腌制、熏制等加工过程中,对挥发性风味的形成发挥重要作用,有研究[97]证明,在干腌肉品中,约13%的挥发性化合物与内源蛋白酶水解蛋白质有关。Li Mingming等[83]的研究指出,己醛、壬醛、辛醛、苯甲醛、3-甲基丁酸、2-甲基丙酸和辛酸乙酯等关键挥发性物质对干腌猪肉的风味特征贡献较大,且肉品中的癸酸乙酯和辛酸乙酯等酯类含量与DPP-II活力呈正相关,精氨酰氨肽酶通过调节辛酸和Lue的积累,进而影响辛酸乙酯、2,3-戊二酮和2,3-辛二酮的积累。Li Yuan等[98]研究表明,蛋白酶通过破坏组织结构、促进脂类释放、增加游离氨基酸积累、调节微环境等方式间接促进醛类物质的生成,蛋白酶活性与己醛、壬醛、(E)-2-壬烯醛、(E,E)-2,4-壬二烯醛等10 种醛类风味物质呈显著正相关,说明蛋白酶在风味醛类的形成过程中发挥了重要的催化推动作用。
在加工过程中,盐的添加可与内源蛋白酶协同作用,促进挥发性风味物质的释放,Yang等[99]报道了钙蛋白酶系统在熟牛肉挥发性化合物形成中的作用,发现注射氯化钙、氯化钠和氯化锌显著改变牛肉中23 种挥发性化合物的含量,特别是吡嗪类,如甲基吡嗪、二甲基吡嗪、2-乙基-2,5-二甲基吡嗪和含硫化合物,如二甲基二硫醚和2-乙酰噻唑含量显著增加。Guo Xin等[100]阐明肉品中氨基酸与风味物质之间的潜在关系,Phe、Tyr、Trp通过蛋白酶的作用可转化为乙醛和乙酸,Cys和谷胱甘肽可与2,4-癸二醛反应生成己醛[97]。此外,组织蛋白酶L、DPP-II、DPP-III、丙氨酰氨肽酶及精氨酰氨肽酶与肌肉中2-甲基丙酸和3-甲基丁酸的含量密切相关,Val和Ile进一步被降解生成2-甲基丙醛和3-甲基丁醛,最终氧化成酸[101]。这些研究表明,在后期加工过程中,内源蛋白酶能有效影响肉品中挥发性风味物质的生成。
然而,由于肉品挥发性风味形成机制的复杂性及多种因素的影响,关于挥发性风味与内源蛋白酶直接关系的研究相对较少,部分研究尝试通过建立数学模型探讨规律,但发现3 种组织蛋白酶与蛋白降解产物之间无法建立有效的回归方程,且与挥发性风味化合物也未能构建二维空间图[102],因此内源蛋白酶在挥发性风味形成中的具体作用仍需进一步研究。在目前的研究中,通过添加外源蛋白酶,如木瓜蛋白酶、胰蛋白酶等可有效改善肉品的风味,Zhao Di等[103]研究发现,在牛背最长肌中添加木瓜蛋白酶能显著提高氨基酸的含量,并且风味蛋白酶和菠萝蛋白酶的加入也能显著增加酮类和其他挥发性风味物质的含量。然而,木瓜蛋白酶和蛋白酶K的添加则会导致酯类和醛类物质含量的下降。因此,除了通过调控内源蛋白酶的活性和含量改善挥发性风味的形成外,还可以适当结合外源蛋白酶的添加进行调控,以实现风味的优化。
3 结 语
内源蛋白酶在肉品风味形成中发挥重要作用,通过水解肌肉蛋白释放多肽、小肽和游离氨基酸等风味前体物质影响非挥发性和挥发性风味的形成。组织蛋白酶、钙蛋白酶、氨肽酶、羧肽酶等在不同阶段协同作用,不仅影响肉品的鲜味、甜味、苦味和咸味等基本味觉特征,还通过促进Maillard反应、Strecker降解等化学反应进一步丰富挥发性风味物质的种类和浓度。酶活性受pH值、温度、离子强度等因素调控,适当的调控可优化肉品风味,而过度水解可能导致肉品质地下降或产生不良风味。目前的研究主要集中于组织蛋白酶、钙蛋白酶和部分外肽酶对风味的影响,而对蛋白酶体和Caspase在风味形成中的作用研究和报道较少。此外,已有研究深入探讨了内源蛋白酶对非挥发性风味形成的影响,但其在挥发性风味物质生成中的具体作用机制仍待进一步阐明。因此,未来研究应加强对不同内源蛋白酶协同作用机制的解析,并结合现代生物技术优化肉品加工工艺,以实现风味和肉品质量的精准调控,为肉制品风味的改善及创新提供科学依据。
[1] BO S, FADDA M, FEDELE D, et al. A critical review on the role of food and nutrition in the energy balance[J]. Nutrients, 2020, 12(4):1161. DOI:10.3390/nu12041161.
[2] XU W D, HE Y C, LI J H, et al. Robotization and intelligent digital systems in the meat cutting industry: from the perspectives of robotic cutting, perception, and digital development[J]. Trends in Food Science &Technology, 2023, 135: 234-251. DOI:10.1016/j.tifs.2023.03.018.
[3] KONG Y, ZHOU C C, ZHANG L L, et al. Comparative analysis of taste components of three seasoning bases prepared via stir-frying,enzymatic hydrolysis, and thermal reaction[J]. Journal of Food Processing and Preservation, 2021, 45(9): e15652. DOI:10.1111/jfpp.15652.
[4] LIANG L, DUAN W, ZHANG J C, et al. Characterization and molecular docking study of taste peptides from chicken soup by sensory analysis combined with nano-LC-Q-TOF-MS/MS[J]. Food Chemistry, 2022, 383: 132455. DOI:10.1016/j.foodchem.2022.132455.
[5] 徐娜, 石金明, 何伟俊, 等. 宰后成熟对鸡肉风味的影响研究进展[J].食品安全质量检测学报, 2021, 12(2): 727-732. DOI:10.19812/j.cnki.jfsq11-5956/ts.2021.02.057.
[6] 王渝琪, 吴继红, 廖小军, 等. 畜禽类预制菜异味来源及其抑制掩蔽技术研究进展[J]. 食品工业科技, 2024, 45(15): 369-379.DOI:10.13386/j.issn1002-0306.2023080170.
[7] TOLDRÁ F, FLORES M. The role of muscle proteases and lipases in flavor development during the processing of dry-cured ham[J].Critical Reviews in Food Science and Nutrition, 1998, 38(4): 331-352.DOI:10.1080/10408699891274237.
[8] 李琳, 王正全, 张晶晶, 等. 内源蛋白酶对肉类食品风味的影响[J]. 食品与发酵工业, 2015, 41(2): 237-241. DOI:10.13995/j.cnki.11-1802/ts.201502042.
[9] 陈圆. 金华火腿风味料研发及其风味物质变化规律研究[D]. 杭州:浙江工商大学, 2010. DOI:10.7666/d.Y1736608.
[10] 李敏. 腊鱼腌制过程中内源酶的变化及其对品质的影响[D]. 武汉:华中农业大学, 2014. DOI:10.7666/d.Y2565997.
[11] MOURABIT S, RÖMER S, BONNER E R, et al. Exopeptidase combination enhances the degradation of isotopically labelled gluten immunogenic peptides in humans[J]. Frontiers in Immunology, 2024,15: 1425982. DOI:10.3389/fimmu.2024.1425982.
[12] EWERT J, SCHLIERENKAMP F, NESENSOHN L, et al. Improving the colloidal and sensory properties of a caseinate hydrolysate using particular exopeptidases[J]. Food & Function, 2018, 9(11): 5989-5998.DOI:10.1039/c8fo01749b.
[13] CAI Z L, XU S Y, LIU C. Cathepsin B in cardiovascular disease:underlying mechanisms and therapeutic strategies[J]. Journal of Cellular and Molecular Medicine, 2024, 28(17): e70064. DOI:10.1111/jcmm.70064.
[14] 段立昆. 接菌发酵及强化高温工艺在风鹅加工中的应用研究[D].扬州: 扬州大学, 2019. DOI:10.27441/d.cnki.gyzdu.2019.001017.
[15] DOMINGUEZ-HERNANDEZ E, ERTBJERG P. Effect of LTLT heat treatment on cathepsin B and L activities and denaturation of myofibrillar proteins of pork[J]. Meat Science, 2021, 175: 108454.DOI:10.1016/j.meatsci.2021.108454.
[16] 侯佰慧, 夏杨毅, 周涛, 等. 鸡肉酶解液制备鸡汤热反应过程中呈味物质的变化[J]. 食品科学, 2017, 38(14): 175-180. DOI:10.7506/spkx1002-6630-201714027.
[17] GILLES G. Dry cured ham quality as related to lipid quality of raw material and lipid changes during processing: a review[J]. Grasas y Aceites, 2009, 60(3): 297-307. DOI:10.3989/gya.130908.
[18] 程珂萌, 周昌瑜, 潘道东, 等. 低温风干型酱鸭加工过程中脂质氧化特性[J]. 食品科学, 2018, 39(12): 219-225. DOI:10.7506/spkx1002-6630-201812034.
[19] LIU Q Q, GU X J, WEN R X, et al. Changes in meat quality and volatile flavor compounds profile in beef loin during dry-aging[J].LWT-Food Science and Technology, 2024, 205: 116500. DOI:10.1016/j.lwt.2024.116500.
[20] 崔昱清, 王复龙, 崔保威, 等. 牛胰脏组织蛋白酶L的纯化和酶学性质[J]. 食品科学, 2015, 36(15): 142-146. DOI:10.7506/spkx1002-6630-201515026.
[21] MATSUISHI M, SAITO G, OKITANI A, et al. Purification and some properties of cathepsin H from rabbit skeletal muscle[J]. The International Journal of Biochemistry & Cell Biology, 2003, 35(4):474-485. DOI:10.1016/S1357-2725(02)00279-0.
[22] 刘小莉, 王荣, 王帆, 等. 温度和pH值条件对白鱼内源性蛋白酶活性的影响[J]. 江苏农业科学, 2020, 48(2): 188-192. DOI:10.15889/j.issn.1002-1302.2020.02.034.
[23] 李明明. 干腌肉加工过程中关键内源蛋白酶影响形成的肽及其功能评价[D]. 贵阳: 贵州大学, 2023. DOI:10.27047/d.cnki.ggudu.2023.000550.
[24] BAUDRY M, BI X N. Revisiting the calpain hypothesis of learning and memory 40 years later[J]. Frontiers in Molecular Neuroscience,2024, 17: 1337850. DOI:10.3389/fnmol.2024.1337850.
[25] 杜曼婷. 蛋白质磷酸化介导的μ-钙蛋白酶活性变化机理[D]. 北京:中国农业科学院, 2018.
[26] COLLE M J, DOUMIT M E. Effect of extended aging on calpain-1 and -2 activity in beef longissimus lumborum and semimembranosus muscles[J]. Meat Science, 2017, 131: 142-145. DOI:10.1016/j.meatsci.2017.05.014.
[27] BHAT Z F, MORTON J D, MASON S L, et al. Role of calpain system in meat tenderness: a review[J]. Food Science and Human Wellness,2018, 7(3): 196-204. DOI:10.1016/j.fshw.2018.08.002.
[28] ZHANG X, YANG J N, GAO H, et al. Substituting sodium by various metal ions affects the cathepsins activity and proteolysis in drycured pork butts[J]. Meat Science, 2020, 166: 108132. DOI:10.1016/j.meatsci.2020.108132.
[29] CAMOU J P, MARCHELLO J A, THOMPSON V F, et al. Effect of postmortem storage on activity of μ- and m-calpain in five bovine muscles[J]. Journal of Animal Science, 2007, 85(10): 2670-2681.DOI:10.2527/jas.2007-0164.
[30] CHAUDHARY P, SURYAKUMAR G, PRASAD R, et al. Chronic hypobaric hypoxia mediated skeletal muscle atrophy: role of ubiquitinproteasome pathway and calpains[J]. Molecular and Cellular Biochemistry, 2012, 364(1/2): 101-113. DOI:10.1007/s11010-011-1210-x.
[31] BHAT A A, THAPA R, AFZAL O, et al. The pyroptotic role of caspase-3/GSDME signalling pathway among various cancer: a review[J]. International Journal of Biological Macromolecules, 2023,242(Pt 2): 124832. DOI:10.1016/j.ijbiomac.2023.124832.
[32] SUN G P. Death and survival from executioner caspase activation[J].Seminars in Cell & Developmental Biology, 2024, 156: 66-73.DOI:10.1016/j.semcdb.2023.07.005.
[33] 杨致昊, 刘畅, 窦露, 等. Caspases的研究进展及其与肉嫩度的关联机制[J]. 食品与发酵工业, 2021, 47(17): 277-282. DOI:10.13995/j.cnki.11-1802/ts.026985.
[34] ZHANG J Y, LI M Q, YU Q L, et al. Effects of lysosomalmitochondrial apoptotic pathway on tenderness in post-mortem bovine longissimus muscle[J]. Journal of Agricultural and Food Chemistry,2019, 67(16): 4578-4587. DOI:10.1021/acs.jafc.9b00894.
[35] HUANG M, HUANG F, XUE M, et al. The effect of active caspase-3 on degradation of chicken myofibrillar proteins and structure of myofibrils[J]. Food Chemistry, 2011, 128(1): 22-27. DOI:10.1016/j.foodchem.2011.02.062.
[36] LI S, XU X, ZHOU G. The roles of the actin-myosin interaction and proteolysis in tenderization during the aging of chicken muscle[J].Poultry Science, 2012, 91(1): 150-160. DOI:10.3382/ps.2011-01484.
[37] MURAMATSU H, HARADA T, SUGIHARA D, et al. Enzymatic determination of carnosine in meat and fish using β-Ala-Xaa dipeptidase and histidine ammonia-lyase derived from Pseudomonas putida NBRC100650[J]. Analytical Sciences, 2022, 38(2): 331-338.DOI:10.2116/analsci.21P239.
[38] 陈敬敬. 传统陇西腊肉加工过程中内源性蛋白酶和肉品质的相关性研究[D]. 兰州: 甘肃农业大学, 2023. DOI:10.27025/d.cnki.ggsnu.2023.000255.
[39] HERES A, YOKOYAMA I, GALLEGO M, et al. Antihypertensive potential of sweet Ala-Ala dipeptide and its quantitation in dry-cured ham at different processing conditions[J]. Journal of Functional Foods,2021, 87: 104818. DOI:10.1016/j.jff.2021.104818.
[40] 周昌瑜. 基于现代工艺金华火腿蛋白降解及其滋味物质形成机制的研究[D]. 南京: 南京农业大学, 2020. DOI:10.27244/d.cnki.gnjnu.2020.000016.
[41] TOLDRÁ F. Biotechnology of flavor generation in fermented meats[M]//TOLDRÁ F. Meat biotechnology. New York: Springer New York, 2008: 199-215. DOI:10.1007/978-0-387-79382-5_9.
[42] OMAR M N, RAJA ABD RAHMAN R N Z, MUHD NOOR N D,et al. Structure-function and industrial relevance of bacterial aminopeptidase P[J]. Catalysts, 2021, 11(10): 1157. DOI:10.3390/catal11101157.
[43] XU L L, MA M, LI J K, et al. Exploration of aminopeptidase N as new biomarker for early diagnosis of thyroid cancer[J]. Biosensors and Bioelectronics, 2024, 244: 115808. DOI:10.1016/j.bios.2023.115808.
[44] ATIAKSHIN D, KOSTIN A, TROTSENKO I, et al. Carboxypeptidase A3-a key component of the protease phenotype of mast cells[J]. Cells,2022, 11(3): 570. DOI:10.3390/cells11030570.
[45] HAREENDRAN S, YANG X Y, SHARMA V K, et al.Carboxypeptidase E and its splice variants: key regulators of growth and metastasis in multiple cancer types[J]. Cancer Letters, 2022, 548:215882. DOI:10.1016/j.canlet.2022.215882.
[46] YADAV P, GOYAL V D, GAUR N K, et al. Carboxypeptidase in prolyl oligopeptidase family: unique enzyme activation and substratescreening mechanisms[J]. Journal of Biological Chemistry, 2019,294(1): 89-100. DOI:10.1074/jbc.RA118.004254.
[47] MORA L, GONZÁLEZ-ROGEL D, HERES A, et al. Iberian dry-cured ham as a potential source of α-glucosidase-inhibitory peptides[J].Journal of Functional Foods, 2020, 67: 103840. DOI:10.1016/j.jff.2020.103840.
[48] NISHIMURA T, KATO Y, OKITANI A, et al. Purification and properties of aminopeptidase C from chicken skeletal muscle[J].Agricultural and Biological Chemistry, 1991, 55(7): 1771-1778.
[49] YE X J, NG T B. Purification and characterisation of an alanine aminopeptidase from bovine skeletal muscle[J]. Food Chemistry, 2011,124(2): 634-639. DOI:10.1016/j.foodchem.2010.06.087.
[50] 田甜, 魏延玲, 何立超, 等. 火鸡肌肉丙氨酰氨肽酶的酶学特性[J]. 食品科学, 2013, 34(9): 205-209. DOI:10.7506/spkx1002-6630-201309042.
[51] 田甜. 火鸡肌肉中丙氨酰氨肽酶酶学特性及风干成熟工艺对其活性调控研究[D]. 南京: 南京农业大学, 2012.
[52] TOLDRÁ F, GALLEGO M, REIG M, et al. Bioactive peptides generated in the processing of dry-cured ham[J]. Food Chemistry,2020, 321: 126689. DOI:10.1016/j.foodchem.2020.126689.
[53] KANDEL R, JUNG J, NEAL S. Proteotoxic stress and the ubiquitin proteasome system[J]. Seminars in Cell & Developmental Biology,2024, 156: 107-120. DOI:10.1016/j.semcdb.2023.08.002.
[54] WANG X Y, MEUL T, MEINERS S. Exploring the proteasome system: a novel concept of proteasome inhibition and regulation[J].Pharmacology & Therapeutics, 2020, 211: 107526. DOI:10.1016/j.pharmthera.2020.107526.
[55] PEPELNJAK M, ROGAWSKI R, ARKIND G, et al. Systematic identification of 20S proteasome substrates[J]. Molecular Systems Biology, 2024, 20(4): 403-427. DOI:10.1038/s44320-024-00015-y.
[56] BARD J A M, GOODALL E A, GREENE E R, et al. Structure and function of the 26S proteasome[J]. Annual Review of Biochemistry,2018, 87: 697-724. DOI:10.1146/annurev-biochem-062917-011931.
[57] MEVISSEN T E T, KOMANDER D. Mechanisms of deubiquitinase specificity and regulation[J]. Annual Review of Biochemistry, 2017,86: 159-192. DOI:10.1146/annurev-biochem-061516-044916.
[58] PARK J E, MILLER Z, JUN Y, et al. Next-generation proteasome inhibitors for cancer therapy[J]. Translational Research, 2018, 198:1-16. DOI:10.1016/j.trsl.2018.03.002.
[59] 周天, 涂琦, 何庭, 等. 蛋白酶体抑制剂在胶质母细胞瘤治疗中的应用进展[J]. 中国现代医生, 2024, 62(29): 120-124.
[60] CLAGUE M J, URBÉ S, KOMANDER D. Breaking the chains:deubiquitylating enzyme specificity begets function[J]. Nature Reviews. Molecular Cell Biology, 2019, 20(6): 338-352. DOI:10.1038/s41580-019-0099-1.
[61] ROTH P, MASON W P, RICHARDSON P G, et al. Proteasome inhibition for the treatment of glioblastoma[J]. Expert Opinion on Investigational Drugs, 2020, 29(10): 1133-1141. DOI:10.1080/135437 84.2020.1803827.
[62] TATSUMI K, KITAHATA S, KOMATANI Y, et al. Modulation of proteasome subunit selectivity of syringolins[J]. Bioorganic &Medicinal Chemistry, 2024, 106: 117733. DOI:10.1016/j.bmc.2024.117733.
[63] HE Y J, ZHOU C Y, LI C B, et al. Effect of incubation temperature on the binding capacity of flavor compounds to myosin[J]. Food Chemistry, 2021, 346: 128976. DOI:10.1016/j.foodchem.2020.128976.
[64] 王兴伟. 基于炒制猪肉风味质构形成机制的微波加工及调控方法[D]. 无锡: 江南大学, 2023. DOI:10.27169/d.cnki.gwqgu.2023.002570.
[65] 覃芳丽, 邹宇晓, 王思远, 等. 发酵食品的滋味特性及其形成机制研究进展[J]. 食品与发酵工业, 2024, 50(10): 388-396. DOI:10.13995/j.cnki.11-1802/ts.036406.
[66] TU Y H, COOPER A J, TENG B C, et al. An evolutionarily conserved gene family encodes proton-selective ion channels[J]. Science, 2018,359: 1047-1050. DOI:10.1126/science.aao3264.
[67] DASHDORJ D, AMNA T, HWANG I. Influence of specific tasteactive components on meat flavor as affected by intrinsic and extrinsic factors: an overview[J]. European Food Research and Technology,2015, 241(2): 157-171. DOI:10.1007/s00217-015-2449-3.
[68] 张文博, 覃凯华, 贾雨鑫, 等. 甜味觉信息的产生、传递与调控机制[J]. 神经解剖学杂志, 2021, 37(2): 215-220. DOI:10.16557/j.cnki.1000-7547.2021.02.015.
[69] SUN X R, ZHENG J Y, LIU B Y, et al. Characteristics of the enzymeinduced release of bitter peptides from wheat gluten hydrolysates[J].Frontiers in Nutrition, 2022, 9: 1022257. DOI:10.3389/fnut.2022.1022257.
[70] LIU B Y, LI N N, CHEN F S, et al. Review on the release mechanism and debittering technology of bitter peptides from protein hydrolysates[J]. Comprehensive Reviews in Food Science and Food Safety, 2022, 21(6): 5153-5170. DOI:10.1111/1541-4337.13050.
[71] MA X Y, YU M, LIU Z C, et al. Effect of amino acids and their derivatives on meat quality of finishing pigs[J]. Journal of Food Science and Technology, 2020, 57(2): 404-412. DOI:10.1007/s13197-019-04077-x.
[72] 张宁龙. 养殖河鲀鱼特征性滋味组分及呈味肽的研究[D]. 上海:上海海洋大学, 2019. DOI:10.27314/d.cnki.gsscu.2019.000509.
[73] ISHIDA H, YASUI N, YAMASHITA A. Chemical range recognized by the ligand-binding domain in a representative amino acid-sensing taste receptor, T1r2a/T1r3, from medaka fish[J]. PLoS ONE, 2024, 19(3):e0300981. DOI:10.1371/journal.pone.0300981.
[74] ROEBBER J K, ROPER S D, CHAUDHARI N. The role of the anion in salt (NaCl) detection by mouse taste buds[J]. The Journal of Neuroscience, 2019, 39(32): 6224-6232. DOI:10.1523/jneurosci.2367-18.2019.
[75] ZHOU C Y, WU J Q, TANG C B, et al. Comparing the proteomic profile of proteins and the sensory characteristics in Jinhua ham with different processing procedures[J]. Food Control, 2019, 106: 106694.DOI:10.1016/j.foodcont.2019.06.020.
[76] 周洋, 刘姝韵, 谷大海, 等. 宣威火腿加工过程中的蛋白质降解规律[J]. 现代食品科技, 2018, 34(8): 57-63; 74. DOI:10.13982/j.mfst.1673-9078.2018.8.009.
[77] HU S Q, ZHOU G H, XU X L, et al. Contribution of cathepsin B and L to endogenous proteolysis in the course of modern Jinhua ham processing[J]. Food Control, 2022, 135: 108584. DOI:10.1016/j.foodcont.2021.108584.
[78] ZHOU C Y, WANG Y, CAO J X, et al. The effect of dry-cured salt contents on accumulation of non-volatile compounds during drycured goose processing[J]. Poultry Science, 2016, 95(9): 2160-2166.DOI:10.3382/ps/pew128.
[79] WANG D Y, ZHANG M H, BIAN H, et al. Proteolysis and cathepsin activities in the processing of dry-cured duck[J]. Poultry Science,2014, 93(3): 687-694. DOI:10.3382/ps.2013-03335.
[80] HUANG F, HUANG M, ZHOU G H, et al. In vitro proteolysis of myofibrillar proteins from beef skeletal muscle by caspase-3 and caspase-6[J]. Journal of Agricultural and Food Chemistry, 2011,59(17): 9658-9663. DOI:10.1021/jf202129r.
[81] WU Y Y, CAO S M. Study on endogenous protease and protein degradation of dry-salted Decapterus maruadsi[J]. CyTA-Journal of Food, 2018, 16(1): 350-356. DOI:10.1080/19476337.2017.1406006.
[82] ZHU C Z, ZHAO J L, TIAN W, et al. Contribution of histidine and lysine to the generation of volatile compounds in Jinhua ham exposed to ripening conditions via Maillard reaction[J]. Journal of Food Science, 2018, 83(1): 46-52. DOI:10.1111/1750-3841.13996.
[83] LI M M, ZHU Q J, QU C, et al. Elucidation of potential relationship between endogenous proteases and key flavor substances in dry-cured pork coppa[J]. Food Science and Human Wellness, 2024, 13(4): 2152-2160. DOI:10.26599/FSHW.2022.9250179.
[84] ZHOU C Y, WU X Y, PAN D D, et al. TMT-labeled quantitative proteomic reveals the mechanism of proteolysis and taste improvement of dry-cured bacon with Staphylococcus co-inoculation[J]. Food Chemistry, 2024, 436: 137711. DOI:10.1016/j.foodchem.2023.137711.
[85] ZHANG X C, XIE J. The differential effects of endogenous cathepsin and microorganisms on changes in the texture and flavor substances of grouper (Epinephelus coioides) fillets[J]. RSC advances, 2020, 10(18):10764-10775. DOI:10.1039/d0ra01028f.
[86] 关海宁, 徐筱君, 孙薇婷, 等. 肉汤中特征风味体系的形成机理及分析方法研究进展[J]. 肉类研究, 2021, 35(1): 66-73. DOI:10.7506/rlyj1001-8123-20210106-004.
[87] SUN A, WU W, SOLADOYE O P, et al. Maillard reaction of food-derived peptides as a potential route to generate meat flavor compounds: a review[J]. Food Research International, 2022, 151:110823. DOI:10.1016/j.foodres.2021.110823.
[88] ZHANG J, WANG Y, PAN D D, et al. Effect of black pepper essential oil on the quality of fresh pork during storage[J]. Meat Science, 2016,117: 130-136. DOI:10.1016/j.meatsci.2016.03.002.
[89] 刘欢. 北京烤鸭关键挥发性风味物质鉴别及其形成机制研究[D]. 北京:中国农业科学院, 2020. DOI:10.27630/d.cnki.gznky.2020.000156.
[90] 丁丽丽, 吴燕燕, 李来好, 等. 咸带鱼加工过程挥发性风味成分的变化[J]. 食品科学, 2011, 32(24): 208-212.
[91] 王卫, 刘文龙, 凌梦婷, 等. 养殖模式对固始鸡氨基酸及其组成的影响研究[J]. 饲料工业, 2018, 39(6): 26-31. DOI:10.13302/j.cnki.fi.2018.06.006.
[92] 王虎虎, 邵良婷, 秦岳, 等. 热鲜与冷鲜黄羽鸡肉中风味前体物比较[J]. 核农学报, 2020, 34(4): 824-830. DOI:10.11869/j.issn.100-8551.2020.04.0824.
[93] FU Y H, CAO S Y, YANG L, et al. Flavor formation based on lipid in meat and meat products: a review[J]. Journal of Food Biochemistry,2022, 46(12): e14439. DOI:10.1111/jfbc.14439.
[94] DIEZ-SIMON C, MUMM R, HALL R D. Mass spectrometry-based metabolomics of volatiles as a new tool for understanding aroma and flavour chemistry in processed food products[J]. Metabolomics, 2019,15(3): 41. DOI:10.1007/s11306-019-1493-6.
[95] 卜宁霞, 陈娟, 李永琴. 发酵肉制品风味物质的研究进展[J].宁夏农林科技, 2020, 61(11): 65-68. DOI:10.3969/j.issn.1002-204x.2020.11.022.
[96] 张莺莺, 刁玉段, 张佳杰, 等. 风味前体物质在肉类风味形成中的作用及其影响因素[J]. 上海畜牧兽医通讯, 2024(4): 1-9; 89.DOI:10.14170/j.cnki.cn31-1278/s.2024.04.008.
[97] PICON A, NUÑEZ M. Volatile compounds in high-pressure-treated dry-cured ham: a review[J]. Meat Science, 2022, 184: 108673.DOI:10.1016/j.meatsci.2021.108673.
[98] LI Y, ZHANG Q, ZHAO F, et al. Dynamic changes and correlation analysis of protease activities, texture and flavour compounds during fish fermentation (suanyu) using mixed culture (Enterococcus rivorum and Enterococcus lactis)[J]. International Journal of Food Science and Technology, 2023, 58(5): 2312-2324. DOI:10.1111/ijfs.16360.
[99] YANG J, DASHDORJ D, HWANG I. Effect of the calpain system on volatile flavor compounds in the beef longissimus lumborum muscle[J]. Korean Journal for Food Science of Animal Resources,2018, 38(3): 515-529. DOI:10.5851/kosfa.2018.38.3.515.
[100] GUO X, WANG Y Q, LU S L, et al. Changes in proteolysis, protein oxidation, flavor, color and texture of dry-cured mutton ham during storage[J]. LWT-Food Science and Technology, 2021, 149: 111860.DOI:10.1016/j.lwt.2021.111860.
[101] CHEN L, LIU R, WU M G, et al. A review on aroma-active compounds derived from branched-chain amino acid in fermented meat products: flavor contribution, formation pathways, and enhancement strategies[J]. Trends in Food Science & Technology,2024, 145: 104371. DOI:10.1016/j.tifs.2024.104371.
[102] 陆应林. 南京板鸭加工过程中蛋白降解及风味物质的研究[D].南京: 南京农业大学, 2012: 6-9.
[103] ZHAO D, LI H, HUANG M X, et al. Influence of proteolytic enzyme treatment on the changes in volatile compounds and odors of beef longissimus dorsi[J]. Food Chemistry, 2020, 333: 127549.DOI:10.1016/j.foodchem.2020.127549.