牛肉含有丰富的营养成分,这为腐败微生物的增殖提供了适宜环境[1-2]。宰后牛肉中发生的多种复杂生化和代谢反应受贮藏条件影响,因此选择适当的贮藏条件对保持牛肉品质和安全至关重要。低温贮藏是维持牛肉品质、延长其货架期的常用方法。冷藏和冻藏是目前主流的肉类低温贮藏方法,近年来冰温保鲜技术也受到广泛关注。
冰温保鲜是指在0 ℃以下、冻结点以上的温度范围内贮藏,使食品保持低温但不冻结的状态[3]。在此条件下,微生物生长繁殖和酶活性均受到抑制,同时能较好维持肉色稳定性、抑制脂肪氧化、减少汁液损失。与冷藏相比,冰温贮藏可将肉品货架期延长1.4~4.0 倍[4]。与冷冻相比,冰温贮藏可避免冰晶对肉品的损伤。因此,冰温贮藏不仅能延长牛肉货架期,还能有效维持其品质和新鲜度[5]。
近年来,研究[6]发现,-1 ℃贮藏牛肉的嫩度需要较长时间才能达到理想嫩度,表明冰温条件能够显著延缓肌肉成熟进程,这对保持远途运输牛肉的新鲜度具有重要作用。冰温条件延缓肌肉成熟可能与钙激活酶系统、肌原纤维及其骨架蛋白、小热休克蛋白有关[7-9]。同时,冰温贮藏能有效延缓蛋白质氧化,但蛋白质和脂质氧化仍不可避免。另外,冰温贮藏还能较好地维持肉色。对比不同贮藏温度下的保水性发现,冰温(-1.5 ℃)条件可有效降低牛肉汁液损失[10]。研究[11]显示,真空包装牛肉在冰温(-1 ℃)条件下贮藏26 周仍能被消费者接受,该条件下微生物代谢活力低、增殖慢,可有效延长货架期。
综上所述,冰温贮藏能有效保持牛肉品质,且因温度在冻结点以上,牛肉更接近鲜肉口感,具有广阔的应用前景。冰温虽能有效延缓牛肉品质劣变,但贮藏过程中食用品质(如嫩度、色泽、多汁性等)的动态变化及货架期仍需要进一步探讨,贮藏过程中产生的挥发性有机化合物(volatile organic compounds,VOCs)对牛肉整体风味的影响也有待进一步探究。因此,本研究通过监测长期冰温贮藏(-1 ℃、12 周)条件下牛肉pH值、色泽、剪切力、贮藏损失率、蒸煮损失率、VOCs、蛋白质与脂肪氧化、菌落总数等指标的动态变化,结合包装开启前后的感官评价,系统探究长期冰温贮藏牛肉品质的影响规律,完善冰温贮藏牛肉品质动态变化数据库,为我国牛肉贮藏方式选择和贮藏条件优化提供理论依据,对推动冰温保鲜技术应用、提升我国牛肉市场竞争力具有重要意义。
1 材料与方法
1.1 材料与试剂
随机从山东某肉牛屠宰企业选取6 头鲁西黄牛(体质量550~600 kg、18~24月龄),宰后48 h取背最长肌。
正己烷(色谱纯)、无水甲醇(色谱纯)、三氯乙酸、无水碳酸钠、盐酸、硼酸、氧化镁、甲基红、溴甲酚绿、冰乙酸、氯化钾、石油醚、硫酸、乙酸乙酯、5,5′-二硫代双(2-硝基苯甲酸)(5,5′-dithiobis-(2-nitrobenzoic acid),DTNB)、2,4-二硝基苯肼(dinitrophenylhydrazine,DNPH)、盐酸萘乙二胺(均为分析纯) 天津凯通化学试剂有限公司;硫代巴比妥酸(thiobarbituric acid,TBA)、1,1,3,3-四乙氧基丙烷、氯化钠、95%乙醇、无水乙醇、磷酸二氢钠(均为分析纯)国药集团化学试剂有限公司;平板计数琼脂、蛋白胨(均为分析纯) 北京陆桥技术股份有限公司;BCA蛋白浓度测定试剂盒、十二烷基硫酸钠、盐酸胍、尿素(均为分析纯) 北京索莱宝科技有限公司;聚乙烯真空包装袋(氧气透过率4 cm3/(m2·24 h·atm))升辉新材料股份有限公司。
1.2 仪器与设备
Seven Go便携式pH计 瑞士Mettler Toledo公司;MOT-U403电子温度标签 秒秒测科技(北京)有限公司;SP62便携式色差计 美国X-Rite公司;5804R离心机 德国Eppendorf公司;G15DWS蒸汽压力灭菌锅致微(厦门)仪器有限公司;T A.X T 2 i 质构仪英国Stable Micro System公司;C200真空包装机 德国Multivac公司;GCMS-TQ8040三重四极杆气相色谱-质谱(gas chromatography-mass spectrography,GC-MS)联用仪日本岛津公司;Epoch2酶标仪 北京伯腾仪器有限公司;Nano Drop™ 1000分光光度计 美国赛默飞世尔科技公司。
1.3 方法
1.3.1 实验设计
在0~4 ℃条件下将牛肉切分为厚5.0 cm左右的牛排,真空包装(真空度1 500 Pa)后于-1 ℃条件下贮藏,贮藏期间使用电子温度标签持续监测冷藏间温度,保证温度波动范围在(-1±0.5)℃。贮藏0、5、8、10、12 周取样,对打开包装前后的牛排进行感官评定后,测定菌落总数、贮藏损失率,将牛排切分为2 块(各约2.5 cm),其内侧切面在0~4 ℃下发色1 h后测定色泽,然后测定pH值、蒸煮损失率、剪切力。各贮藏时间点样品分装后置于-40 ℃冰箱保存,用于测定VOCs、总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量等品质指标。
1.3.2 pH值测定
将校准后的pH计探头直接插入牛肉样品中约3 cm深度,每块牛肉样品测定6 次,取平均值。
1.3.3 色泽测定
避开筋腱脂肪,随机选取6~8 个点,使用经黑白校正的色差计测定牛肉切面亮度值(L*)、红度值(a*)、黄度值(b*),取平均值。
1.3.4 剪切力测定
避开筋腱脂肪,沿肌纤维方向用直径为1.27 cm的圆形空心取样器取6 个以上肉柱,使用质构仪测定剪切力,取平均值。
1.3.5 贮藏损失率测定
牛排包装前称质量(m1/g),将各贮藏时间点样品包装打开后,用滤纸吸干表面汁液,称质量(m2/g)。贮藏损失率按式(1)计算:
1.3.6 蒸煮损失率测定
用滤纸吸干牛排表面汁液,称质量(m1/g)后装袋,在牛排中心处插入数字温度计,80 ℃恒温水浴加热至其中心温度达70 ℃,冷却至室温,倒出汁液,置于0~4 ℃冷库过夜,用滤纸吸干表面汁液,称质量(m2/g),蒸煮损失率按式(2)计算:
1.3.7 VOCs测定
采用顶空固相微萃取提取VOCs,并采用GC-MS测定VOCs。将牛肉样品(10 g)置于20 mL顶空瓶中,加入10 mL 25 g/100 mL NaCl溶液和10 μL内标(1 000 μg/L 4-甲基-1-戊醇)。GC-MS参数:色谱柱为DB-5毛细管柱(30 m×0.25 mm,0.25 μm),载气(He,纯度≥99.999%)流速1 mL/min,升温程序:初始温度40 ℃,保持5 min,以4 ℃/min升至150 ℃,再以30 ℃/min升至250 ℃,保持5 min,电子电离源能量7 0 e V。萃取条件:4 0 ℃平衡3 0 m i n 后,采用50/30 μm DVB/CAR/PDMS萃取头顶空萃取30 min,随后将萃取头在进样口(250 ℃、不分流模式)立即解吸5 min。以标准溶液梯度稀释法,按信噪比3∶1和10∶1分别计算检出限(limit of detection,LOD)和定量限。
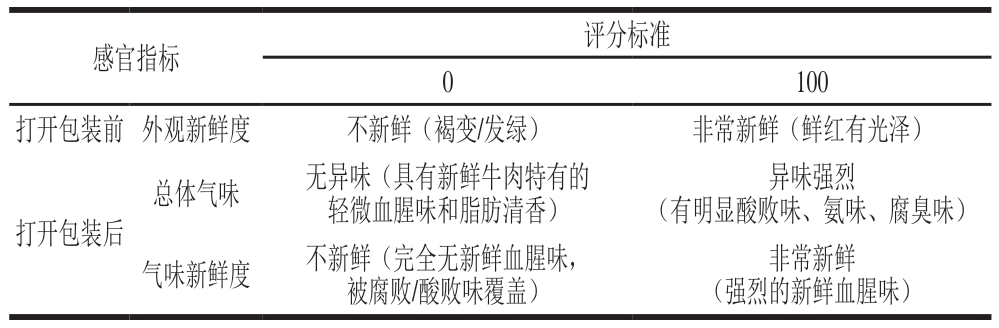
1.3.8 感官评定
参照ISO 13299—2016制定感官评定标准(表1)。感官评定小组由10 名经过专业培训的评定员组成,评定包括3 个部分:包装开启前的外观新鲜度、包装开启后的总体气味与气味新鲜度。评定员按表1标准对各贮藏时间点牛肉样品进行感官评定,整体气味评分高于40视为不可接受,外观新鲜度和气味新鲜度评分低于60视为不可接受。
表1 冰鲜牛肉感官评定标准
Table 1 Sensory evaluation criteria for superchilled beef
?
1.3.9 蛋白质氧化测定
1.3.9.1 羰基含量测定
准确称取0.5 g牛肉样品,加入5 mL 20 mmol/L磷酸盐缓冲液,低温均质(4 ℃、50 Hz、45 s)后离心(4 ℃、5 000×g、15 min),采用BCA法测定上清液蛋白含量。取2 份上述蛋白样品,实验组加入1 mL 10 mol/L DNPH溶液,空白组加入1 mL 2 mol/L HCl溶液,混匀后迅速置于37 ℃培养箱避光反应1 h(每20 min混匀1 次)。反应结束后,实验组与对照组各加入0.5 mL 20 g/100 mL三氯乙酸溶液,混匀,离心(4 ℃、10 000×g、15 min),弃上清。向沉淀中加入1 mL乙醇-乙酸乙酯混合液(1∶1,V/V),离心(4 ℃、12 000×g、15 min),重复洗涤3 次。最后加入1.5 mL 6 mol/L盐酸胍溶液溶解沉淀,测定370 nm波长处的吸光度。根据朗伯-比尔定律计算羰基含量(摩尔吸光系数为22 000 L/(mol·cm)),单位为nmol/mg。
1.3.9.2 巯基含量测定
取1.3.9.1节制备的蛋白样品0.1 mL,加入0.9 mL含8 mol/L尿素的50 mmol/L磷酸盐缓冲液、0.04 mL 0.1 g/100 mL DTNB溶液。对照组以等体积20 mmol/L磷酸盐缓冲液替代蛋白样品,混匀后3 7 ℃避光孵育3 0 m i n,测定4 1 2 n m 波长处的吸光度,根据朗伯-比尔定律计算总巯基含量(摩尔吸光系数为13 600 L/(mol·cm)),单位为nmol/mg。活性巯基含量测定方法同上,但0.9 mL 50 mmol/L磷酸盐缓冲液中不含尿素,混匀后4 ℃避光孵育1 h。
1.3.10 脂质氧化测定
以硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值表征脂肪氧化程度。准确称取1 g剔除筋腱和脂肪的牛肉样品,置于5 mL研磨管中,加入4 mL去离子水,用全自动研磨仪充分研磨(50 Hz、45 s、3 次)后,转移至10 mL离心管,加入4 mL 10 g/100 mL三氯乙酸溶液,振荡混匀后采用Whatman 1#滤纸过滤。取1 mL滤液与0.25 mL 0.06 mol/L TBA溶液混合,80 ℃金属浴加热90 min,使其充分反应。反应完成后取出并冷却至室温,使用酶标仪测定5 3 2 n m 波长处吸光度,同时设置空白对照(0.5 mL纯水和0.5 mL 10 g/100 mL三氯乙酸溶液)。采用0、0.05、0.1、0.15、0.2、0.3、0.4、0.6、0.8、1 μmol/L 1,1,3,3-四乙氧基丙烷标准溶液建立标准曲线(y=0.096 1+0.041 1,R2=0.999 5)并计算丙二醛(malondialdehyde,MDA)含量,TBARS值以MDA含量计,单位为mg/kg。
1.3.11 菌落总数测定
准确称取10 g牛排表面样品装入无菌拍打袋,加入90 mL 0.85 g/100 mL氯化钠溶液,室温下拍打混匀2 min,取1 mL进行10 倍梯度稀释,选择3 个适宜稀释度接种于平板计数琼脂,37 ℃培养48 h后计数,每个稀释度设2 个平行。
1.3.12 TVB-N含量测定
准确称取10 g剔除筋腱和脂肪的牛肉样品(m/g),加入75 mL蒸馏水后搅匀,室温浸泡30 min。加入1 g氧化镁,蒸馏3 min,馏出液用30 mL 20 g/L硼酸溶液吸收,滴加3~5 滴甲基红-溴甲酚绿混合指示剂,用盐酸标准溶液(c=0.01 mol/L)滴定至终点,消耗体积记为V1/mL。以蒸馏水作为空白对照,消耗盐酸体积记为V2/mL。TVB-N含量按式(3)计算:
1.4 数据处理
采用SAS 9.0软件对数据进行单因素方差分析,以贮藏时间作为固定效应,以牛胴体个体差异作为随机效应,P<0.05表示差异显著,采用Origin 2021软件和SigmaPlot 14.0软件进行作图。
2 结果与分析
2.1 冰温贮藏过程中牛肉pH值变化
如图1 所示,贮藏时间对牛肉p H 值影响显著(P<0.05)。贮藏期间,pH值整体呈先升高后下降的趋势。贮藏8 周后,pH值出现下降趋势。冰温贮藏前期pH值的升高可能与内源酶催化和微生物活动产生的碱性物质有关,后期pH值的下降可能与真空包装下的优势菌(乳酸菌)代谢有关。陈雪等[12]在研究冰温条件对长期贮藏牛肉品质影响时也得出同样的结果。值得注意的是,整个贮藏期间牛肉pH值均维持在5.64~5.79,仍在鲜肉范围内[13]。
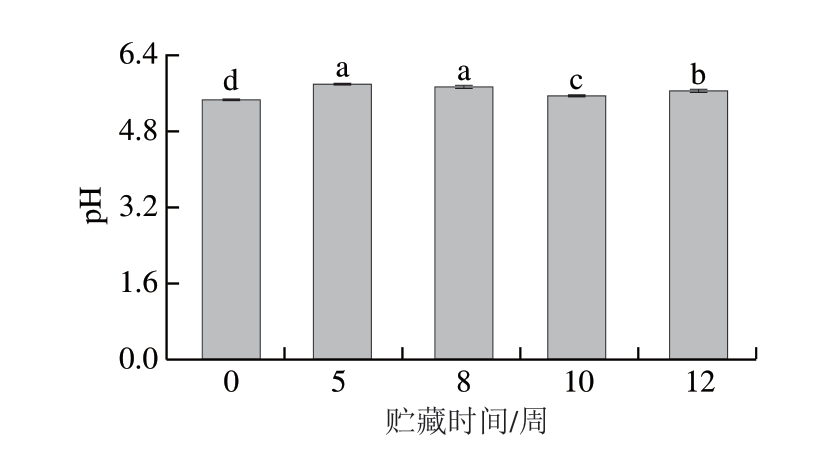
图1 冰温贮藏对牛肉pH值的影响
Fig. 1 Effects of superchilled storage on the pH value of beef
小写字母不同表示组间差异显著(P<0.05)。图2~6同。
2.2 冰温贮藏过程中牛肉色泽变化
由表2所示,贮藏时间对牛肉L*、a*、b*存在显著影响(P<0.05)。贮藏期间,牛肉L*呈先增加后降低的趋势,随着贮藏时间的延长,自由水含量增多引起的折光率变化[14]可导致L*波动。随着贮藏时间的延长,牛肉a*、b*整体均呈增加趋势,在贮藏5 周时达到最高水平,贮藏后期也一直保持在较高水平,保持着稳定的鲜红色。
表2 冰温贮藏对牛肉色泽的影响
Table 2 Effects of superchilled storage on the color of beef
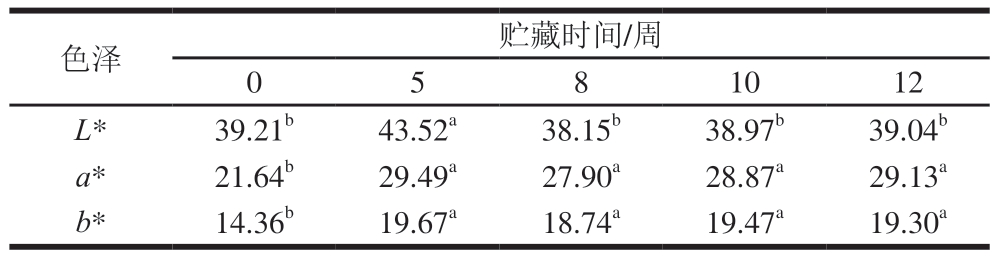
注:同行小写字母不同表示差异显著(P<0.05)。表3、5同。
?
2.3 冰温贮藏过程中牛肉剪切力变化
嫩度是影响肉制品食用品质的关键指标之一。如图2所示,剪切力受贮藏时间的影响显著,随着贮藏时间的延长,剪切力呈显著降低趋势(P<0.05),嫩度逐渐改善。贮藏初期(0 周),牛肉剪切力最高,嫩度不佳,贮藏5 周时,剪切力降至52.24 N,低于我国消费者牛肉嫩度接受度阈值(55.43 N)[15]。这表明冰温贮藏条件下牛肉需成熟至少5 周方可达到消费者可接受嫩度。
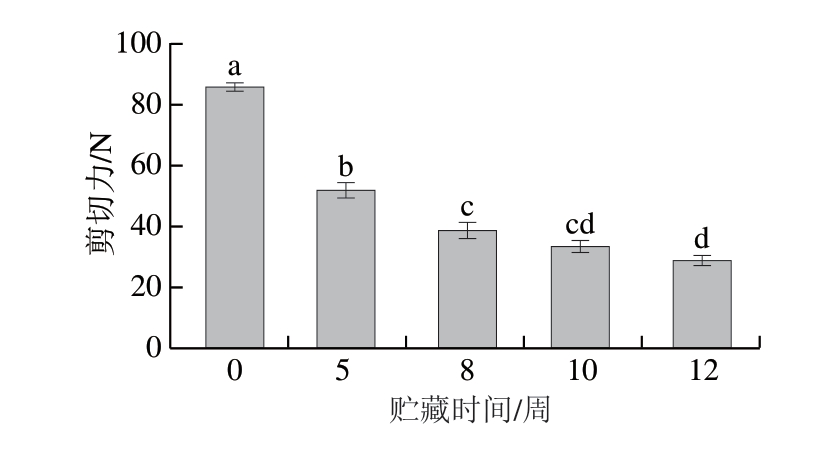
图2 冰温贮藏对牛肉剪切力的影响
Fig. 2 Effects of superchilled storage on the shear force of beef
2.4 冰温贮藏过程中牛肉保水性变化
保水性作为影响肉制品食用品质(滋味、香气、嫩度、多汁性等)及经济价值的关键因素。如图3所示,贮藏时间对牛肉贮藏损失率、蒸煮损失率均存在显著影响(P<0.05)。随着贮藏时间的延长,贮藏5~10 周,牛肉贮藏损失率无显著变化(P>0.05),贮藏12 周显著升高(P<0.05)。蒸煮损失率在贮藏8 周时出现显著下降(P<0.05),随后趋于稳定,该趋势与文献[16]报道相符。
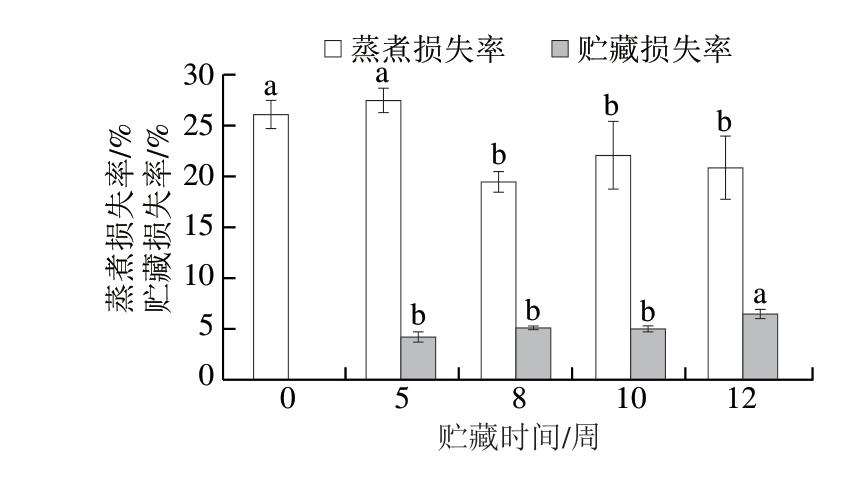
图3 冰温贮藏对牛肉贮藏损失率和蒸煮损失率的影响
Fig. 3 Effects of superchilled storage on the purge loss rate and cooking loss rate of beef
2.5 冰温贮藏过程中牛肉VOCs变化
牛肉冷藏过程中,VOCs的形成主要来源于新鲜牛肉本身含有的特征性挥发性成分、内源酶作用产物及微生物代谢产物等。牛肉因其适宜的水分活度和pH值易受微生物污染,而微生物代谢产物是导致其贮藏后期异味和品质劣化的主要原因,包装方式和贮藏温度通过调控微生物群落结构和酶活性等直接影响牛肉VOCs的动态变化趋势[17]。
如表3所示,贮藏期间从牛肉中共检出12 种VOCs,包括醇类、醛类、酸类。其中,11 种VOCs含量随着贮藏时间的延长而显著增加(P<0.05)。贮藏初期(0 周),只检出6 种VOCs,包括正辛醇、1-辛烯-3-醇、2-乙基己醇、壬醛、癸醛和乙酸。贮藏5 周时,除初期检出的6 种VOCs外,还检出正己醇、己醛、辛醛和庚醛。其中,正己醇含量在贮藏8 周时显著升高(P<0.05),随后趋于稳定。庚醛含量在贮藏10 周时显著升高,随后又显著下降(P<0.05)。贮藏8 周时,正庚醇被检出,贮藏10 周时,其含量显著升高,随后趋于稳定。贮藏后期(12 周)检出异戊醇,表明其或许可作为真空包装下冰温贮藏后期牛肉的特征VOCs,并可作为肉品品质劣变的潜在指示物。随着贮藏时间的延长,VOCs的种类和含量均呈上升趋势,其原因可能有二:其一,微生物分泌的蛋白酶催化蛋白分解生成胺类、硫醇类等化合物;其二,脂肪酶介导的脂肪水解反应产生游离脂肪酸及其次级氧化产物(醛类、酮类等)。
表3 冰温贮藏对牛肉VOCs含量的影响
Table 3 Effects of superchilled storage on VOCs contents of beef μg/g
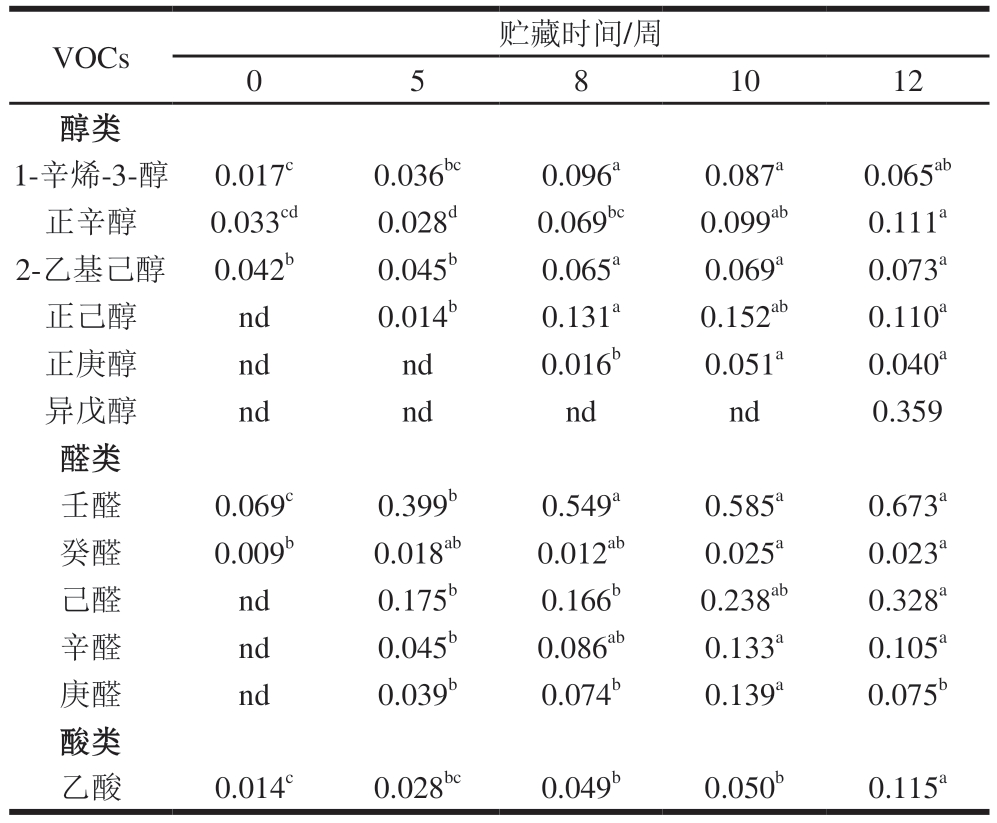
注:nd.检测值低于LOD。
?
2.6 冰温贮藏过程中牛肉感官评定
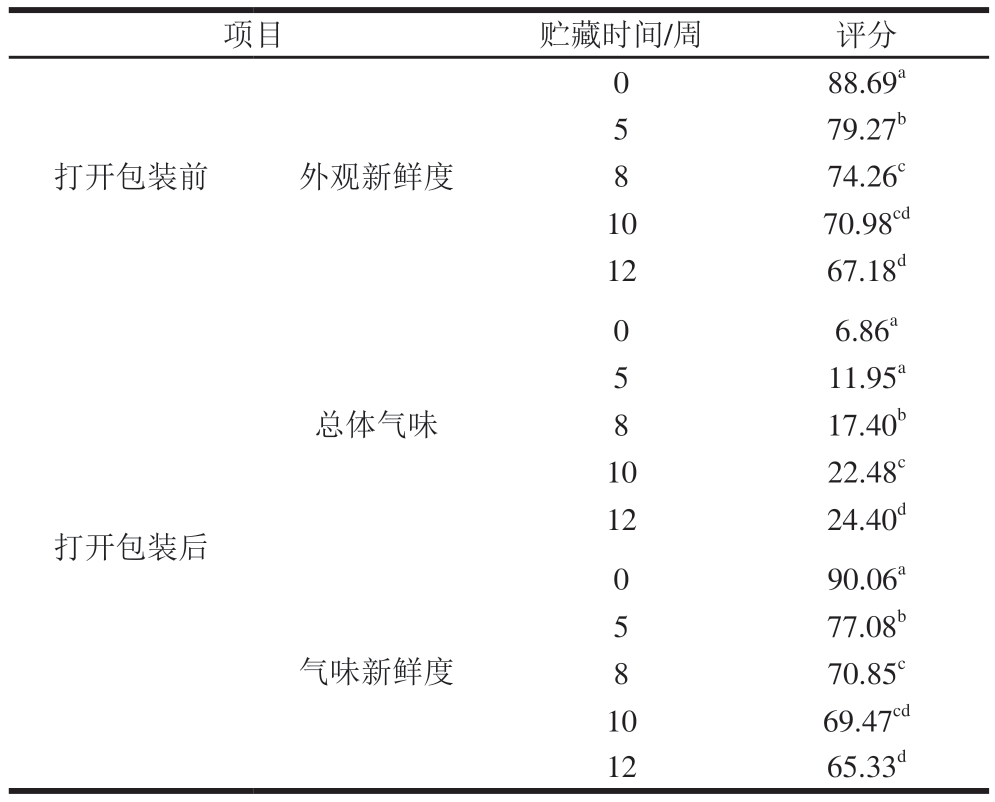
如表4所示,贮藏时间对牛肉外观新鲜度、总体气味和气味新鲜度均具有显著影响(P<0.05)。随着贮藏时间的延长,牛肉外观新鲜度和气味新鲜度评分均逐渐降低,总体气味评分逐渐增加。从外观新鲜度和气味新鲜度来看,贮藏前期(0~5 周)评分迅速下降。就总体气味而言,贮藏前期(0~5 周)评分变化并不显著(P>0.05),贮藏中期(5~8 周)评分出现显著增加趋势(P<0.05)。贮藏后期(12 周),虽然各项指标评分仍在消费者可接受范围(外观新鲜度>60、气味新鲜度>60、总体气味<30),但已接近不可接受阈值,表明该冰温贮藏条件虽可将感官货架期延长至12 周,但长期贮藏仍会导致牛肉品质出现一定程度的劣变。
表4 冰温贮藏对牛肉感官评分的影响
Table 4 Effects of superchilled storage on the sensory score of beef
注:同列小写字母不同表示组间差异显著(P<0.05)。
?
2.7 冰温贮藏过程中牛肉蛋白质氧化情况
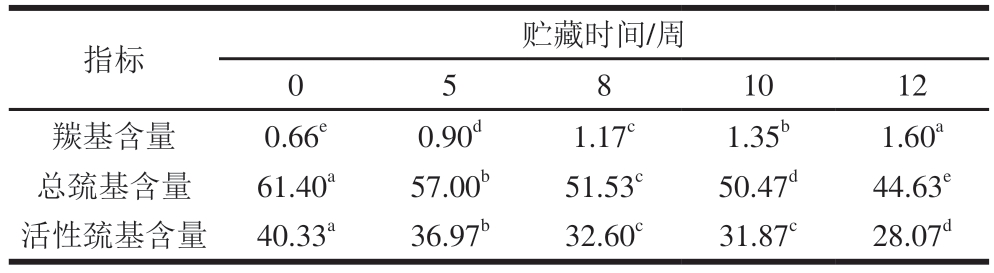
羰基是蛋白质氧化的主要产物,其含量可有效表征肌肉蛋白质的氧化程度[18-19]。如表5所示,羰基含量随贮藏时间延长而显著增加(P<0.05),由初始的0.66 nmol/mg增至1.60 nmol/mg,表明在冰温贮藏期间,蛋白质发生持续性氧化变性。
表5 冰温贮藏对牛肉羰基、总巯基、活性巯基含量的影响
Table 5 Effects of superchilled storage on the carbonyl, total sulfhydryl and free sulfhydryl contents of beef nmol/mg
?
肌原纤维蛋白(肌球蛋白和肌动蛋白)中的巯基作为易氧化位点,其氧化形成的二硫键会导致蛋白质分子交联[20]。因此巯基损失也可反映蛋白质氧化程度。贮藏时间对总巯基和活性巯基含量均存在显著影响(P<0.05)。其中,总巯基含量从61.40 nmol/mg降至44.63 nmol/mg,活性巯基含量从40.33 nmol/mg降至28.07 nmol/mg,进一步验证了冰温贮藏过程中蛋白质的持续性氧化进程。
2.8 冰温贮藏过程中牛肉脂质氧化情况
牛肉中的脂质在贮藏过程中易发生氧化反应[21],适度的脂质氧化有利于肉品特征风味的生成,但是脂质过度氧化生成的醛类、酮类等物质会产生酸败味等不良气味,同时促进高铁肌红蛋白形成,进而对肉色产生负面影响。TBARS值是评价脂肪氧化程度的常用指标。如图4所示,TBARS值随贮藏时间的延长而显著升高(P<0.05),由0.26 mg/kg增至0.47 mg/kg,表明脂质氧化程度持续加深。
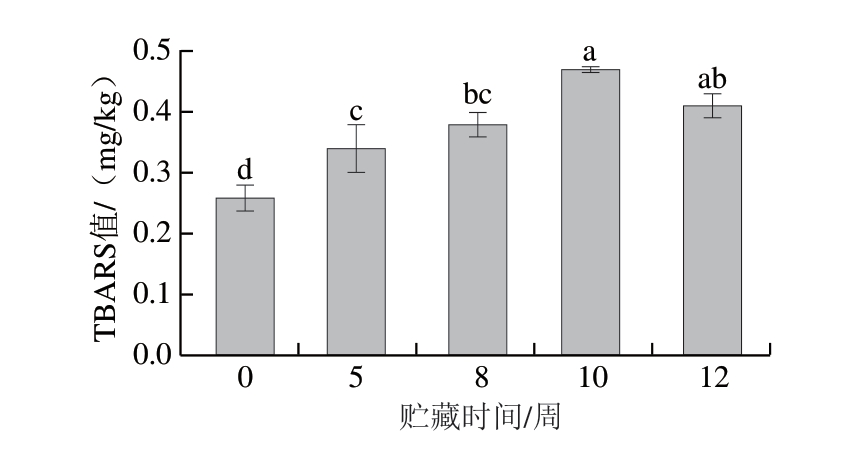
图4 冰温贮藏对牛肉TBARS值的影响
Fig. 4 Effects of superchilled storage on the TBARS value of beef
2.9 冰温贮藏过程中牛肉菌落总数变化
菌落总数是评估肉品货架期的关键指标,新鲜肉品的腐败限值为7.00(lg(CFU/g)),超过此限值表明肉品已发生腐败[22]。如图5所示,贮藏时间对牛肉菌落总数具有显著影响(P<0.05)。初始菌落总数为2.25(lg(CFU/g)),贮藏12 周时达6.86(lg(CFU/g)),但始终未超过微生物安全限量。
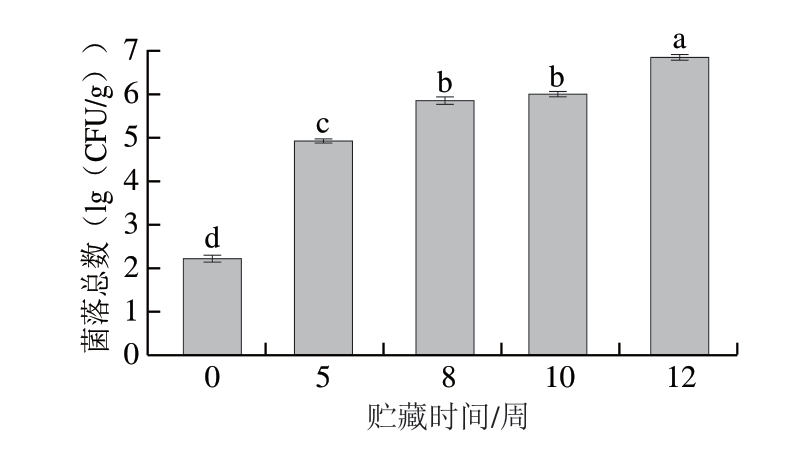
图5 冰温贮藏对牛肉菌落总数的影响
Fig. 5 Effects of superchilled storage on the total viable count of beef
2.10 冰温贮藏过程中牛肉TVB-N含量变化
TVB-N含量是评价肉品新鲜度的关键指标之一[23]。作为与菌落总数同等重要的腐败评价参数,TVB-N含量直接反映肉品蛋白质降解程度,其升高表明腐败进程的发展,也是评定货架期的重要指标之一。如图6所示,贮藏时间对TVB-N含量影响显著(P<0.05)。初始TVB-N含量为10.64 mg/100 g,随贮藏时间延长持续上升至贮藏12 周的14.28 mg/100 g,与菌落总数变化趋势类似,但整个贮藏过程均未超过GB 2707—2016《食品安全国家标准 鲜(冻)畜、禽产品》规定的新鲜肉TVB-N含量限值(15 mg/100 g)。相关研究[24]证实,冰温贮藏可有效抑制TVB-N含量增加,这与本研究结果相一致。
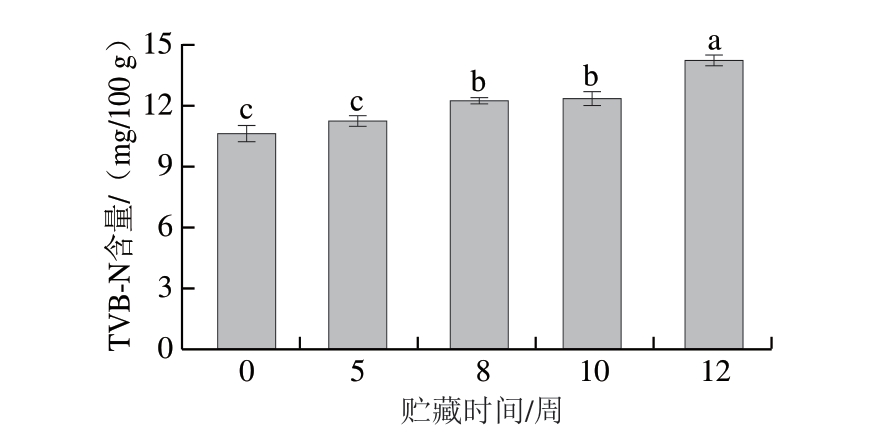
图6 冰温贮藏对牛肉TVB-N含量的影响
Fig. 6 Effects of superchilled storage on the TVB-N content of beef
3 讨 论
3.1 冰温贮藏对牛肉食用品质的影响
近年来,高品质牛肉需求不断增加,进口冰温牛肉凭借优良品质占据较高市场份额。冰温保鲜技术可以较好地维持牛肉品质并延长货架期,但长期贮藏可能对牛肉品质产生潜在影响。
本研究发现,随着贮藏时间的延长,牛肉pH值呈先升高后下降的趋势,但始终维持在新鲜肉的正常pH值范围内,贮藏中期pH值上升可能归因于内源酶作用和微生物代谢产生的碱性物质(如氨等),后期pH值下降可能与真空包装下的优势菌(乳酸菌)代谢有关。已有研究[25]证实,真空包装结合冰温贮藏可使牛肉pH值保持相对稳定。
贮藏温度是影响肉品色泽的重要因素之一。有研究[26]发现,随着贮藏温度(-1.5、2、5 ℃)的升高,牛肉a*逐渐降低。接近冰温的贮藏温度更有利于保持较高的a*,还有研究[27]发现冰温条件下真空包装牛肉的L*、a*、b*较稳定,未出现显著降低趋势。本研究有类似结果,a*在贮藏5 周时显著升高(P<0.05),之后一直保持在较高水平。Jacob[28]也发现冰温贮藏前期肉色有改善趋势,这可能是由于肉品中的线粒体结构完整性和功能逐渐遭到破坏,导致氧气消耗速率降低,更多的氧气与还原态肌红蛋白结合形成氧合肌红蛋白,a*增加[29]。过长的成熟时间会对肉色及其稳定性造成负面影响,这与高铁肌红蛋白的形成与积累有关[30],但本研究贮藏后期a*未出现显著下降趋势,且整个贮藏过程中,牛肉a*均始终高于消费者可接受度阈值(14.5),维持着相对稳定的鲜红色泽,证明冰温贮藏能够有效降低高铁肌红蛋白的形成速率,维持肉色稳定,进而延长肉色货架期[22]。
嫩度是决定牛肉食用品质的关键因素。贮藏期间剪切力持续下降,贮藏5 周时降至消费者可接受水平(55.43 N)[15],达到较好的嫩度水平。该变化主要源于微生物代谢和内源酶对肌肉结构的降解作用[25],表明该冰温条件下需要至少5 周成熟时间才能达到消费者所接受的嫩度。刘文轩等[31]研究发现,冷藏条件下牛肉需要7 d即可达到消费者可接受阈值,但本研究表明冰温贮藏条件下需要更长的成熟时间,这可能是因为冰温贮藏温度更低,能更有效抑制内源酶活性,从而减缓对骨架蛋白降解速率。由此可见,冰温贮藏会延缓牛肉成熟进程,延长达到消费者可接受嫩度所需时间。
贮藏期间,贮藏损失率在贮藏12 周显著增加,蒸煮损失率在贮藏8 周显著降低(P<0.05)。贮藏损失率的增加可能是由于肌纤维结构损伤导致的水分流失加剧[32]。整体而言,冰温贮藏条件下的贮藏损失率相对较小。这可能得益于冰温贮藏的低温环境对微生物与酶活性的抑制作用,从而减缓蛋白质水解速率,延缓肌肉成熟进程,有效维持细胞结构完整性。此外,冰温条件下不易流动水含量变化较小,自由水含量增幅有限,这将进一步降低水分流失。
气味是消费者购买肉品时关注的重要品质指标。不同贮藏条件下优势微生物代谢所产生的醇类、醛类、有机酸类等VOCs是表征贮藏期间气味变化的关键标记物。贮藏后期品质劣变的特征性标志可能表现为特定VOCs(如异戊醇)的显著增加。本研究贮藏条件下,贮藏中、后期新检出的VOCs(正己醇、正庚醇、异戊醇、己醛、辛醛、庚醛)也可作为品质劣变的重要标志物。真空包装贮藏后期,乳酸菌、梭状芽孢杆菌等厌氧菌的生长代谢活动会产生大量醇类等VOCs。研究[33]发现,贮藏期间VOCs的变化与甘油三酯水解、不饱和脂肪酸β氧化或脂质自动氧化及氨基酸转氨作用等代谢途径密切相关,这些反应可能导致脂肪酸败气味的产生。通过解析这些气味物质的形成机制并结合检测手段,可为利用VOCs标记物监测包装肉品品质提供理论依据。
感官评定能够反映消费者对肉品新鲜度、气味等品质特征的接受程度,本研究结果表明,包装开启前的外观新鲜度、包装开启后的气味新鲜度评分随贮藏时间延长而逐渐降低,异味逐渐变得强烈,导致总体气味评分逐渐升高。虽然整个贮藏期间的感官评分均在可接受范围(外观新鲜度>60、气味新鲜度>60、总体气味<30),但已接近不可接受阈值下限,这也表明长期贮藏虽未导致牛肉感官品质超出安全标准,但已出现可察觉的品质劣变现象。
3.2 冰温贮藏对牛肉货架期的影响
动物屠宰后内源性抗氧化系统被破坏,肌肉组织中不饱和脂肪酸、血红蛋白、金属离子及活性氧等促氧化组分易诱发氧化反应,导致肉质劣变。蛋白质与脂肪氧化是仅次于微生物腐败的肉品品质劣变因素。研究[34]表明,贮藏温度与蛋白质氧化速率呈负相关,低温可显著抑制羰基含量上升与巯基含量下降。本研究中羰基含量随着贮藏时间的延长而不断增加,巯基含量随着贮藏时间的延长而不断降低,说明贮藏期间蛋白质发生持续氧化。这不仅与参与蛋白质氧化的酶的活性有关,还与肌原纤维结构破坏有关[10,35]。同样地,脂质氧化程度也随贮藏时间延长而增加,这可能与细胞膜完整性丧失、超微结构损伤及酶促氧化增强等有关[10]。这种现象在之前的研究中也已得到证实:冰温贮藏结合真空包装对于提高肉品的脂质氧化稳定性具有协同优势[36-37]。值得注意的是,该贮藏条件虽可有效减缓肉品氧化,但无论是蛋白质还是脂质氧化均无法被完全抑制。Greene等[38]研究发现,消费者对牛肉T B A R S 值的接受阈值为0.6~2.0 mg/kg。Campo等[39]也发现TBARS值与牛肉总体接受度呈正相关,牛肉氧化可接受的极限阈值为2.28 mg/kg。本研究TBARS值最高为0.47 mg/kg,均低于以上阈值,表明贮藏12 周并未引发牛肉风味劣变。
微生物活动会引发肉品蛋白质降解、糖酵解和脂肪酸败等一系列生化反应,导致肉品品质劣变甚至腐败。本研究通过监测菌落总数和TVB-N含量变化评估微生物污染程度,结果显示,贮藏过程中菌落总数和TVB-N含量均不断增加,但始终未超出限值(7.00(lg(CFU/g))[22]和15 mg/100 g),这表明真空包装后冰温贮藏可将牛肉货架期至少延长至12 周。与本研究结果相似,有研究[8]也发现稳定的冰温条件可有效控制微生物生长与繁殖,更好地保持产品品质。温度是影响微生物生长的重要因素,一方面,低温可有效抑制微生物细胞内的酶活性,延缓代谢反应,影响营养物质的吸收和能量合成[40],另一方面,低温可诱导微生物细胞膜中的磷脂双分子层由液态转变为凝胶态,流动性降低,膜转运蛋白功能受阻,从而抑制其营养吸收[41]。此外,低温能够抑制蛋白质合成、阻碍细胞分裂[42]。因此,冰温条件(-1 ℃)可显著降低微生物代谢活性和增殖速率,从而延缓肉品腐败进程。
4 结 论
冰温长期贮藏有助于维持牛肉的食用品质,保持其较高的肉品色泽(a*≥14.5),并能够有效改善其嫩度,但需至少5 周的成熟期才能达到消费者可接受水平。尽管贮藏期间VOCs种类和含量均呈增加趋势,可能产生不良气味,但感官评定结果显示新鲜度和气味仍在可接受范围内。冰温贮藏虽然能延长牛肉货架期,但仍无法避免其蛋白稳定性下降及蛋白质与脂质氧化,长期贮藏仍会对牛肉品质产生不利影响。本研究为冰温保鲜技术在肉品保鲜中的应用提供了理论依据。
[1] SHAO L T, CHEN S S, WANG H D, et al. Advances in understanding the predominance, phenotypes, and mechanisms of bacteria related to meat spoilage[J]. Trends in Food Science & Technology, 2021, 118:822-832. DOI:10.1016/j.tifs.2021.11.007.
[2] 孙歌, 武桐煊, 毛衍伟, 等. 细菌主导的红肉腐败机制研究进展[J].肉类研究, 2024, 38(8): 63-71. DOI:10.7506/rlyj1001-8123-20240603-134.
[3] WANG L, LIU Z Y, YANG H C, et al. Optimal modified atmosphere for packaging and its effects on quality and shelf-life of Pacific white shrimp (Litopenaeus vannamei) under controlled freezing-point storage at -0.8 ℃[J]. Food Science and Technology Research, 2016,22(2): 173-183. DOI:10.3136/fstr.22.173.
[4] MAGNUSSEN O M, HAUGLAND A, HEMMINGSEN A K T, et al.Advances in superchilling of food: process characteristics and product quality[J]. Trends in Food Science & Technology, 2008, 19(8): 418-424. DOI:10.1016/j.tifs.2008.04.005.
[5] CHOE J, STUART A, KIM Y H B. Effect of different aging temperatures prior to freezing on meat quality attributes of frozen/thawed lamb loins[J]. Meat Science, 2016, 116: 158-164.DOI:10.1016/j.meatsci.2016.02.014.
[6] CAO Y J, HAO R, GUO Z L, et al. Combined effects of superchilling and natural extracts on beef preservation quality[J]. LWT-Food Science and Technology, 2022, 153: 112520. DOI:10.1016/j.lwt.2021.112520.
[7] 李培迪, 李欣, 李铮, 等. 冰温贮藏对宰后肌肉成熟进程的影响[J]. 中国农业科学, 2016, 49(3): 554-562. DOI:10.3864/j.issn.0578-1752.2016.03.013.
[8] QIAN S Y, HU F F, MEHMOOD W, et al. The rise of thawing drip:freezing rate effects on ice crystallization and myowater dynamics changes[J]. Food Chemistry, 2022, 373: 131461. DOI:10.1016/j.foodchem.2021.131461.
[9] 吴佳琪, 熊欣, 罗永康. Caspase-3的调控因素及其对宰后肌肉嫩化影响的研究进展[J]. 肉类研究, 2024, 38(10): 59-65. DOI:10.7506/rlyj1001-8123-20240702-170.
[10] TAO Y, GUO Y P, LI J W, et al. Effect of temperature fluctuation during superchilling storage on the microstructure and quality of raw pork[J]. Meat Science, 2023, 198: 109096. DOI:10.1016/j.meatsci.2023.109096.
[11] SMALL A H, JENSON I, KIERMEIER A, et al. Vacuum-packed beef primals with extremely long shelf life have unusual microbiological counts[J]. Journal of Food Protection, 2012, 75(8): 1524-1527.DOI:10.4315/0362-028X.JFP-12-042.
[12] 陈雪, 罗欣, 梁荣蓉, 等. 不同冰温条件对长期贮藏牛肉品质和货架期的影响[J]. 农业工程学报, 2019, 35(23): 305-311. DOI:10.11975/j.issn.1002-6819.2019.23.037.
[13] ZHAO Y, KONG X, YANG X Y, et al. Effect of energy metabolism and proteolysis on the toughness of intermediate ultimate pH beef[J]. Meat Science, 2022, 188: 108798. DOI:10.1016/j.meatsci.2022.108798.
[14] KIM Y H B, FRANDSEN M, ROSENVOLD K. Effect of ageing prior to freezing on colour stability of ovine longissimus muscle[J]. Meat Science, 2011, 88(3): 332-337. DOI:10.1016/j.meatsci.2010.12.020.
[15] LIANG R R, ZHU H, MAO Y W, et al. Tenderness and sensory attributes of the longissimus lumborum muscles with different quality grades from Chinese fattened yellow crossbred steers[J]. Meat Science,2016, 112: 52-57. DOI:10.1016/j.meatsci.2015.10.004.
[16] KAALE L D, EIKEVIK T M, RUSTAD T, et al. Changes in water holding capacity and drip loss of Atlantic salmon (Salmo salar) muscle during superchilled storage[J]. LWT-Food Science and Technology,2014, 55(2): 528-535. DOI:10.1016/j.lwt.2013.10.021.
[17] 杨啸吟, 张一敏, 梁荣蓉, 等. 包装冷却肉中微生物腐败及其挥发性气味的研究进展[J]. 食品科学, 2021, 42(1): 285-293. DOI:10.7506/spkx1002-6630-20200207-046.
[18] AL-DALALI S, LI C, XU B C. Effect of frozen storage on the lipid oxidation, protein oxidation, and flavor profile of marinated raw beef meat[J]. Food Chemistry, 2022, 376: 131881. DOI:10.1016/j.foodchem.2021.131881.
[19] BAO Y L, ERTBJERG P. Effects of protein oxidation on the texture and water-holding of meat: a review[J]. Critical Reviews in Food Science and Nutrition, 2018, 59(22): 3564-3578. DOI:10.1080/104083 98.2018.1498444.
[20] BASTIOĞLU A Z. Protein oxidation in meat and meat products[J].Scientific Web Journals, 2016, 2(4): 171-183. DOI:10.3153/JFHS16018.
[21] 邱月, 张宝芳, 宋纪璇, 等. 微冻贮藏冷鲜牛肉挥发性成分变化及与蛋白质和脂质氧化的相关性[J]. 食品与发酵工业, 2025, 51(11):273-282. DOI:10.13995/j.cnki.11-1802/ts.040234.
[22] LI X, ZHANG Y, LI Z, et al. The effect of temperature in the range of-0.8 to 4 ℃ on lamb meat color stability[J]. Meat Science, 2017, 134:28-33. DOI:10.1016/j.meatsci.2017.07.010.
[23] QIAO L, TANG X Y, DONG J. A feasibility quantification study of total volatile basic nitrogen (TVB-N) content in duck meat for freshness evaluation[J]. Food Chemistry, 2017, 237: 1179-1185.DOI:10.1016/j.foodchem.2017.06.031.
[24] 李建雄, 谢晶, 潘迎捷, 等. 冰温结合不同比例二氧化碳气调对冷却肉保鲜的影响[J]. 山西农业科学, 2009, 37(10): 66-71. DOI:10.3969/j.issn.1002-2481.2009.10.019.
[25] MATARNEH S K, SILVA S L, GERRARD D E. New insights in muscle biology that alter meat quality[J]. Annual Review of Animal Biosciences, 2021, 9(1): 355-377. DOI:10.1146/annurevanimal-021419-083902.
[26] JEREMIAH L, GIBSON L. The influence of storage temperature and storage time on color stability, retail properties and case-life of retailready beef[J]. Food Research International, 2001, 34(9): 815-826.DOI:10.1016/S0963-9969(01)00104-1.
[27] FRANK D, ZHANG Y, LI Y, et al. Shelf life extension of vacuum packaged chilled beef in the Chinese supply chain. A feasibility study[J]. Meat Science, 2019, 153: 135-143. DOI:10.1016/j.meatsci.2019.03.006.
[28] JACOB R. Implications of the variation in bloom properties of red meat: a review[J]. Meat Science, 2020, 162: 108040. DOI:10.1016/j.meatsci.2019.108040.
[29] TANG J L, FAUSTMAN C, HOAGLAND TA, et al. Postmortem oxygen consumption by mitochondria and its effects on myoglobin form and stability[J]. Journal of Agricultural and Food Chemistry,2005, 53(4): 1223-1230. DOI:10.1021/jf048646o.
[30] SUMAN S P, HUNT M C, NAIR M N, et al. Improving beef color stability: practical strategies and underlying mechanisms[J]. Meat Science, 2014, 98(3): 490-504. DOI:10.1016/j.meatsci.2014.06.032.
[31] 刘文轩, 梁荣蓉, 罗欣, 等. 不同品种牛和部位肌肉在成熟过程中品质差异比较研究[J]. 肉类研究, 2021, 35(9): 7-12. DOI:10.7506/rlyj1001-8123-20210518-143.
[32] LIN H X, HE X X, LIU C H, et al. Static magnetic field-assisted supercooling preservation enhances water-holding capacity of beef during subzero storage[J]. Innovative Food Science & Emerging Technologies, 2022, 80: 103106. DOI:10.1016/j.ifset.2022.103106.
[33] FRANK D, HUGHES J, PIYASIRI U, et al. Volatile and non-volatile metabolite changes in 140-day stored vacuum packaged chilled beef and potential shelf life markers[J]. Meat Science, 2020, 161: 108016.DOI:10.1016/j.meatsci.2019.108016.
[34] 孙圳. 牛肉亚冻结保藏品质变化与水分迁移机制[D]. 北京: 中国农业科学院, 2017: 30-32.
[35] CUI H X, KARIM N, JIANG F, et al. Assessment of quality deviation of pork and salmon due to temperature fluctuations during superchilling[J]. Journal of Zhejiang University-Science B, 2022,23(7): 578-586. DOI:10.1631/jzus.B2200030.
[36] WEN S Y, ZHOU G H, LI L, et al. Effect of cooking on in vitro digestion of pork proteins: a peptidomic perspective[J]. Journal of Agricultural and Food Chemistry, 2015, 63(1): 250-261. DOI:10.1021/jf505323g.
[37] ZHANG S S, CHEN X, DUAN X X, et al. The retail color characteristics of vacuum-packaged beef M. longissimus lumborum following long-term superchilled storage[J]. Meat Science, 2023, 196:109050. DOI:10.1016/j.meatsci.2022.109050.
[38] GREENE B E, CUMUZE T H. Relationship between TBA numbers and inexperienced panelists’ assessments of oxidized flavor in cooked beef[J]. Journal of Food Science, 1982, 47(1): 52-54. DOI:10.1111/j.1365-2621.1982.tb11025.x.
[39] CAMPO M M, NUTE G R, HUGHES S I, et al. Flavour perception of oxidation in beef[J]. Meat Science, 2006, 72(3): 303-311.DOI:10.1016/j.meatsci.2005.07.015.
[40] RUSSELL N J. Bacterial membranes: the effects of chill storage and food processing. An overview[J]. International Journal of Food Microbiology, 2002, 79(1/2): 27-34. DOI:10.1016/S0168-1605(02)00176-9.
[41] CHINTALAPATI S, KIRAN M D, SHIVAJI S. Role of membrane lipid fatty acids in cold adaptation[J]. Cellular and Molecular Biology,2004, 50(5): 631. DOI:10.1002/cm.20010.
[42] PHADTARE S. Recent developments in bacterial cold-shock response[J]. Current Issues in Molecular Biology, 2004, 6(2): 125-136.DOI:10.2174/1389202043490014.