小龙虾,学名克氏原螯虾,原产自北美洲,经由日本传入我国,因其强大的适应性和繁殖力,已逐渐成为我国重要的经济水产品之一。近年来,我国小龙虾产业蓬勃发展,《中国小龙虾产业发展报告》显示,2023年,全国小龙虾年加工量140.23万 t,同比增长15.24%,小龙虾产业已成为我国渔业产业链最完整、综合产值最高的产业之一,而即食小龙虾在加工、运输及贮藏过程中极易发生胀包现象,给商家、消费者及小龙虾产业造成不同程度的经济损失。
研究[2]表明,胀包多是微生物作用的结果,常见的产气微生物包括芽孢杆菌、酵母菌、肠杆菌等。目前,关于食品中产气微生物的报道有很多。Huang Guoping等[3]使用糖发酵试验确定了龙舌兰芽孢杆菌(Bacillus tequilensis)等6 种来自固态发酵醋的产气菌;Zhang Xiangdi等[4]采用平板技术、发酵管产气验证试验和16S rDNA分析,鉴定出解淀粉芽孢杆菌(Bacillus amyloliquefaciens)等3 种产气菌;Wang Xingjie等[5]使用传统分离培养鉴定法结合醋的菌群结构进行分析,结果表明,金山醋酸乳杆菌(Acetilactobacillus jinshanensis)是麸皮醋产气腐败的主要原因;Qu Aiyu等[6]研究发现,能够产CO2的融合魏斯氏菌(Weissella confusa)和韩国魏斯氏菌(Weissella koreensis)是引起腐乳产气变质的主要微生物。然而,对于即食小龙虾中特定产气微生物的报道较少。
有研究表明,小龙虾中微生物种类繁多且随冷藏过程发生数量增长[7],而高通量测序技术具有高通量、低成本和高准确率等优势[8]。因此,本研究以即食小龙虾中的产气微生物为研究对象,采用高通量测序结合传统培养法,探究胀包即食小龙虾中的优势菌属,有效溯源导致即食小龙虾胀包的主要微生物,并对这些产气微生物进行理化特性和产气特性分析。
1 材料与方法
1.1 材料与试剂
正常未胀包小龙虾、胀包小龙虾均取自江苏南京某小龙虾加工企业的同一生产线,并于4 ℃冷库贮藏。
平板计数琼脂(plate count agar,PCA)培养基、LB肉汤培养基 南京翼飞雪生物科技有限公司;MRS培养基、甘露醇氯化钠琼脂(mannitol salt agar,MSA)培养基 北京奥博星生物科技有限责任公司;真菌培养基、假单胞菌CFC选择性琼脂(Pseudomonas CFC selective agar,CFC)培养基、结晶紫中性红胆盐葡萄糖琼脂(violet red bile dextrose agar,VRBDA)培养基、STAA培养基、醋酸盐琼脂培养基、硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂(thiosulfate citrate bile salts sucrose agar,TCBS)培养基 青岛高科技工业园海博生物技术有限公司;细菌基因组DNA提取试剂盒 天根生化科技(北京)有限公司。
1.2 仪器与设备
GI100T高压灭菌锅 厦门致微仪器有限公司;SW-CJ-1FD无菌操作台 苏州净化设备有限公司;SPX-250B-Z生化培养箱 上海博讯实业有限公司医疗设备厂;SPX-260H生化培养箱 宁波杨辉仪器有限公司;Centrifuge 5810R离心机、Centrifuge 5424R离心机 德国Eppendorf公司;DYY-12电泳仪 北京市六一生物科技有限公司;TGradient梯度聚合酶链式反应(polymerase chain reaction,PCR)仪 德国Biometra公司;A20干式恒温器 杭州龙扬科学仪器有限公司;Gen5全波长酶标仪 美国BioTek公司;HADBM400P均质器 北京恒奥德仪器仪表有限公司;TSQ8000EVO气相色谱-串联质谱(gas chromatography-tandem mass spectrometry,GC-MS/MS)仪 美国赛默飞世尔科技有限公司。
1.3 方法
1.3.1 未胀包和胀包小龙虾的微生物多样性分析
取未胀包小龙虾汤汁和胀包小龙虾汤汁各50 mL,4 ℃无菌条件下,用纱布过滤筛除样品中的固体杂质,4 ℃、10 000 r/min离心10 min,去除上清液,并用pH 4的0.02 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗管壁,4 ℃、10 000 r/min离心10 min,去除上清液,收集菌体沉淀,并保存于-20 ℃冰箱中,每组样品进行2 个重复。
取未胀包小龙虾汤汁菌体样品,记为bc1、bc2;取胀包小龙虾汤汁菌体样品,记为ac1、ac2,其中1、2表示来自同一份样品的2 个重复。将4 份样品委托北京奥维森基因科技有限公司对16S rDNA的V3~V4区域进行MiSeqPE300测序及分析。首先,抽提基因组DNA并进行1%琼脂糖凝胶电泳和PCR扩增,在V3~V4区域合成带有Barcode的特异引物,或合成带有错位碱基的融合引物,随后构建文库并上机测序。
1.3.2 未胀包和胀包小龙虾的微生物分离与纯化
无菌条件下,吸取充分均质后的小龙虾汤汁,分别稀释涂布于9 种选择性培养基中,分别为PCA培养基、MRS培养基、MSA培养基、真菌培养基、CFC培养基、VRBDA培养基、醋酸盐琼脂培养基、TCBS培养基和STAA培养基,除STAA培养基放入30 ℃培养箱培养,其余均放入37 ℃培养箱培养。48 h后,参照GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》中的方法,对各选择性培养基中的微生物进行计数,并根据菌落形态分别挑取若干典型菌落在对应的培养基中多次纯化,随后将MRS培养基和醋酸盐琼脂培养基的典型菌落接种到MRS液体培养基中培养,其余培养基的典型菌落均接种到LB肉汤培养基中培养,加入等体积的50%(V/V)甘油,-80 ℃保藏。
1.3.3 产气微生物验证
无菌条件下,将活化分离好的菌以2%接种量接种到倒置有杜氏小管的对应MRS液体培养基或LB肉汤培养基中(杜氏小管中无气泡),30 ℃静置培养,观察24 h时内杜氏小管中是否有气泡产生,测定气体高度并记录。
1.3.4 产气微生物的鉴定
使用细菌基因组D N A 提取试剂盒提取产气菌D N A 作为后续P C R 反应模板。利用引物2 7 F(5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)扩增16S rDNA。PCR扩增条件为:PCR扩增体系60 μL,其中纯水24 μL、模板3 μL、两端引物27F、1492R(均为10 μmol/L)各2.5 μL、2×Taq Master Mix 30 μL。PCR反应程序:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸90 s,共30 次循环,最后72 ℃延伸10 min。将PCR扩增产物进行琼脂糖凝胶电泳,使用凝胶成像分析仪确定扩增情况,将亮度清晰、条带长度为1 500 bp的扩增产物送至生工生物工程(上海)股份有限公司进行测序。测序结果通过NCBI数据库进行BLAST比对,确定菌种类型,并使用MEGA11软件构建系统发育树。
1.3.5 产气微生物产气速率的比较
活化产气微生物,测定其在600 nm波长处的光密度(OD600 nm),在其OD600 nm达到1.0时,以2%接种量接种到倒置有杜氏小管的液体培养基中,每隔2 h测定气体高度并记录。
1.3.6 可挥发性产物的分析
使用GC-MS/MS对产气的绿色魏斯氏菌(Weissella viridescens)M3菌悬液进行可挥发性成分分析。GC条件:TG-5MS弹性石英毛细管柱(30 m×0.25 mm,0.25 μm);载气为高纯氦气(纯度99.999%);载气流速1 mL/min;不分流进样;进样口温度250 ℃;升温程序:初始温度40 ℃保持1 min,然后以6 ℃/min升温至280 ℃,保持3 min。MS条件:电子电离源,传输线温度280 ℃,离子源温度300 ℃;电子能量70 eV;扫描范围m/z 33~400,全扫描采集模式。定性分析:通过Xcalibur工作站与NIST17质谱库提供的标准质谱图对照,统计匹配度大于800的成分作为鉴定结果。定量分析:利用NIST谱图库数据处理系统,按峰面积归一化法进行定量分析,求得各化合物在样品挥发性成分中的相对含量。
1.3.7 产气微生物的理化特性测定
pH值实验:选取6 个不同pH值进行实验,分别为2.5、4.5、6.5、8.5、10.5和6.9(对照),温度25 ℃,不加NaCl。温度实验:选取4 个不同温度进行实验,分别为4(家用冰箱的一般温度[9])、10(高于1~8 ℃鲜肉冷藏温度,为小龙虾保存常用条件[10])、25(室温)、30 ℃(乳酸菌培养的最适温度[11]),不调节pH值,不加NaCl。NaCl含量实验:选取6 个不同NaCl含量进行实验,分别为质量分数2%、4%、6%、8%、10%和0%(对照),不调节pH值,温度25 ℃。在无菌条件下,将产气微生物菌液以2%的接种量接种于上述培养条件的液体培养基中,分别于0、2、4、6、8、10、12、14、16、18、20、22、24、32、40、48 h各吸取200 μL菌液于96 孔板中,测定其OD600 nm。
1.3.8 产气微生物产气特性的测定
pH值、温度和NaCl含量实验条件同1.3.7节。在无菌条件下,将产气微生物菌液以2%的接种量接种于上述培养条件的含有倒置杜氏小管的液体培养基中,分别于0、2、4、6、8、10、12、14、16、18、20、22、24、32、40、48 h测定气体高度并记录。
1.4 数据处理
使用SPSS软件进行数据分析,所有分析均使用最小显著差异检验,显著性水平为0.05,所有结果均表示为平均值±标准差。使用Origin 2021软件进行数据分析和作图。
2 结果与分析
2.1 未胀包与胀包小龙虾汤汁中微生物多样性
2.1.1 未胀包与胀包小龙虾汤汁菌群结构分析
将4 份小龙虾汤汁样品中获得的操作分类单元序列从科和属2 个水平进行分析和注释。使用统计学的分析方法,观测样品在不同分类水平上的群落结构。将多个样品的群落结构分析一同对比时,可以观测到其变化情况。由图1A可知,在科水平,小龙虾汤汁微生物种群的主要组成按相对丰度优势依次为李斯特氏菌科(Listeriaceae)、明串球菌科(Leuconostocaceae)、弧菌科(Vibrionaceae)等。由图1B可知,在属水平上,胀包后的微生物物种组成发生了一些变化。小龙虾汤汁微生物种群的主要组成按相对丰度优势依次为索丝菌属(Brochothrix)、明串珠菌属(Leuconostoc)、弧菌属(Vibrio)、魏斯氏菌属(Weissella)等。胀包后小龙虾汤汁中的索丝菌属相对丰度超过50%,具有很大的数量优势。索丝菌属是水产品中发现的重要的腐败菌,生长温度范围广,能够在好氧和厌氧条件下生长。而该属中的热杀索丝菌(Brochothrix thermosphacta)是一种杆状革兰氏阳性菌,常见于气调或真空包装的鲜肉中,热杀索丝菌具有很强的碳水化合物、蛋白质和脂质代谢能力,并会产生一些诱导腐败的化合物,可能是导致其所属的索丝菌属占主导地位的原因。相对丰度排名第2的明串珠菌属可适应的生存环境十分广泛,是一类兼性厌氧的革兰氏阳性菌,明串珠菌属所包含的大部分菌株最适生长温度为20~30 ℃,呈异型发酵,在植物、乳制品和发酵食品中均较为常见,是可疑的产气细菌菌属。而弧菌属是常见的水产品食源性致病菌,在海洋环境中广泛存在,尤其是其中的副溶血弧菌,感染人体后可引起胃肠炎[20]。
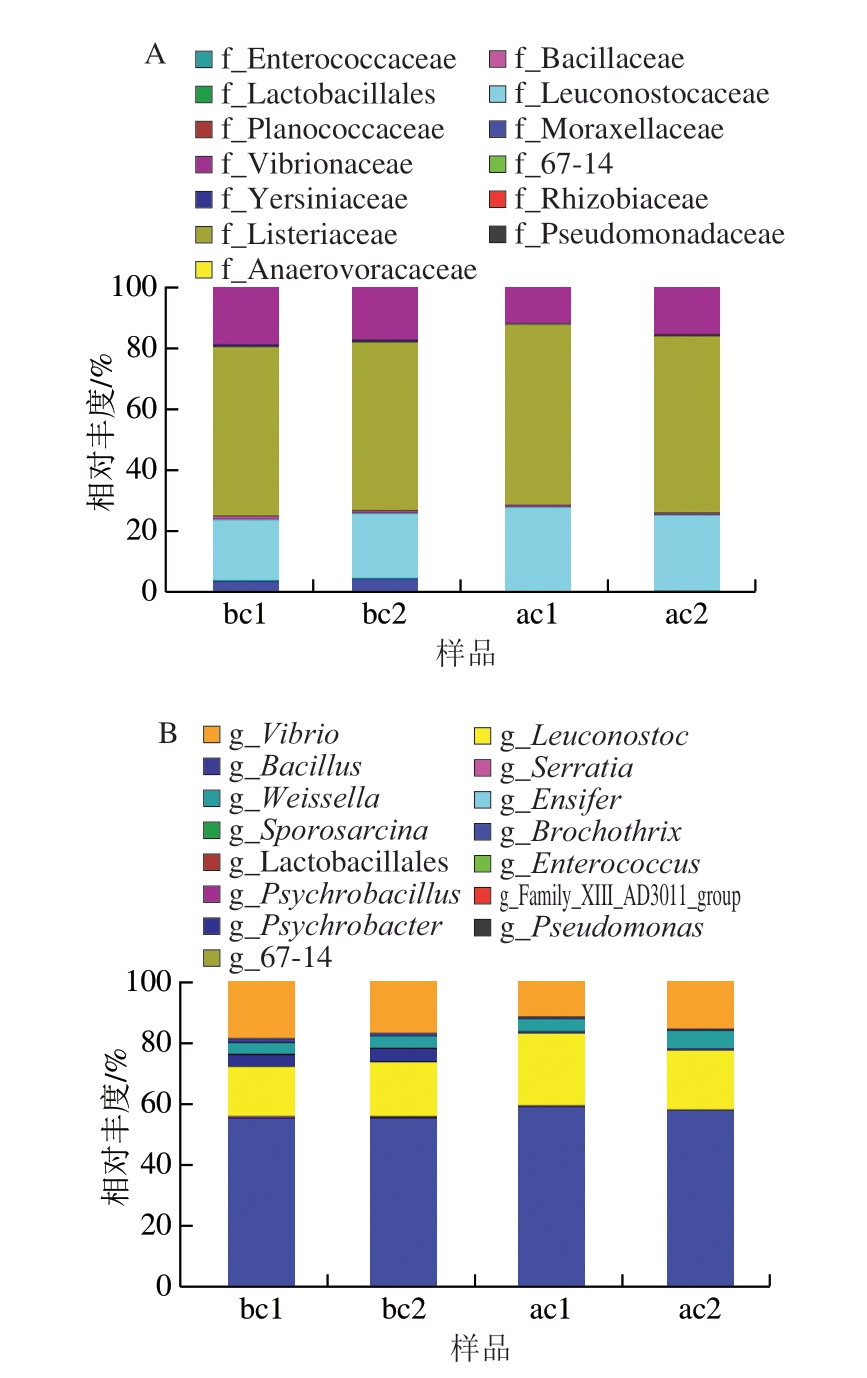
图1 基于科水平(A)和属水平(B)的小龙虾汤汁微生物组成分析
Fig. 1 Composition of bacterial community at the family level (A) and genus level (B) in crayfish soup
2.1.2 菌群变化的热图分析
热图可以用颜色变化反映二维矩阵或表格中的数据信息,能够直观地将数值大小以定义的颜色冷暖表示出来,反映物种在不同样品或分组间的相对丰度变化。常根据需要将数据进行物种或样品间丰度相似性聚类,可将高丰度和低丰度的物种分块聚集,通过颜色梯度及相似程度反映多个样品在门、纲、目、科、属、种水平上群落组成的相似性和差异性[21]。由图2可知,同组不同样品之间的整体差异较小,胀包小龙虾汤汁的微生物群落有明显聚集,明串珠菌属、索丝菌属、魏斯氏菌属等愈发占据优势地位,这些结果为后续菌种的确定提供了一定的参考。
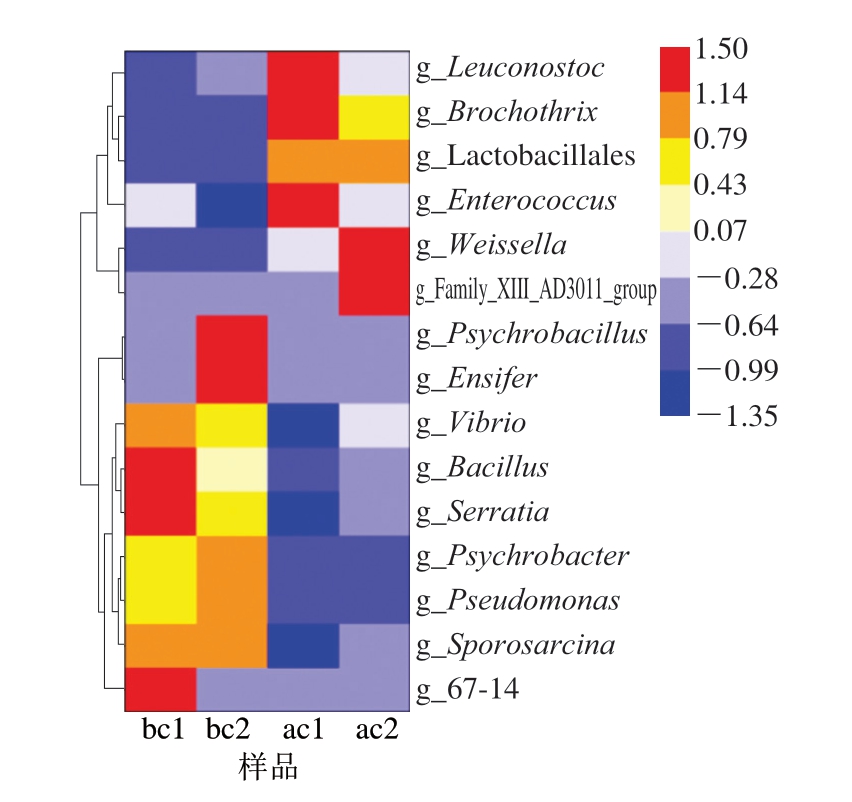
图2 基于属水平的小龙虾汤汁微生物变化热图
Fig. 2 Heatmap of variation in bacterial community at the genus level in crayfish soup
2.2 产气微生物的分离
2.2.1 菌落总数
如图3所示,胀包腐败后的小龙虾汤汁中微生物菌落总数均有明显增长,而其中的产气微生物数量可能也随之增长,从而导致产气量变大,胀包现象明显。
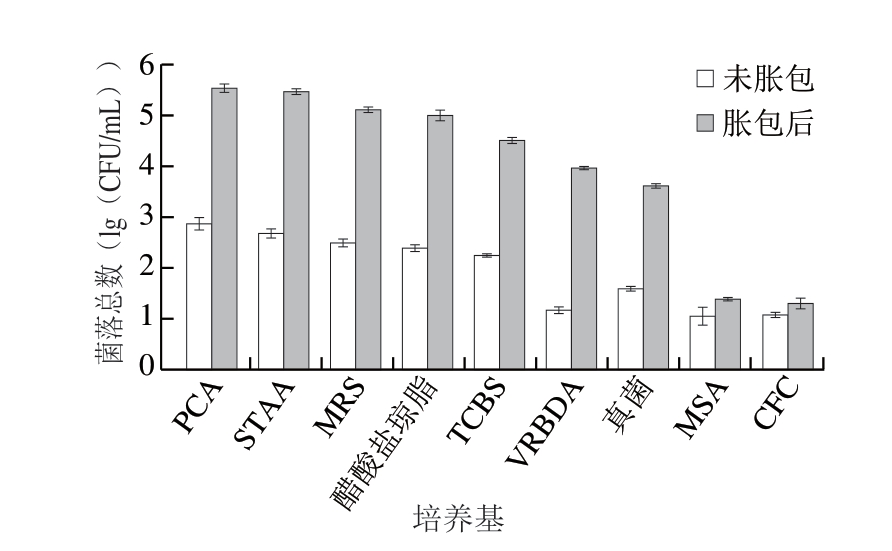
图3 胀包前后小龙虾汤汁的微生物菌落总数
Fig. 3 Total viable count before and after blown pack spoilage in crayfish soup
2.2.2 产气微生物的筛选
通过PCA、MRS、MSA、真菌、VRBDA、醋酸盐琼脂、STAA、TCBS和CFC培养基分离小龙虾汤汁中的微生物,初步分离筛选得到不同形态的菌落共52 株,其中PCA培养基7 株、MRS培养基10 株、MSA培养基2 株、真菌培养基10 株、VRBDA培养基10 株、醋酸盐琼脂培养基4 株、STAA培养基4 株、TCBS培养基4 株、CFC培养基1 株,分别记为P1~P7、M1~M10、J1~J2、F1~F10、C1~C10、Z1~Z4、R1~R4、U1~U4、CF1。如表1所示,M1~M10和Z1~Z4表现为强产气,U1~U4为弱产气,其余菌株均不产气。
表1 微生物产气情况
Table 1 Gas production capacity of isolates
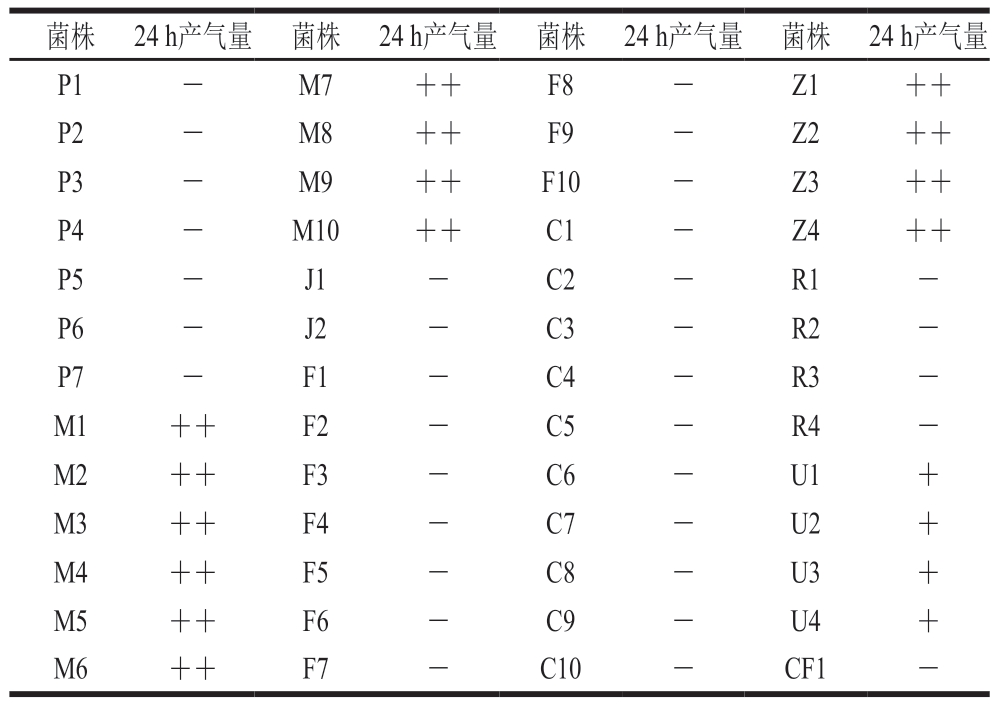
注:—.不产气;+.弱产气(气体高度0~15 mm);++.强产气(气体高度15~30 mm)。
?
2.3 产气微生物和腐败微生物的鉴定
由于索丝菌属是小龙虾微生物中最主要的组成,因此将分离得到的4 株索丝菌属菌株(R1~R4)及产气的M1~M10、Z1~Z4、U1~U4菌株一同进行微生物鉴定。如图4所示,18 株菌的DNA扩增产物电泳亮度清晰,条带长度为1 500 bp。通过对扩增产物进行测序,共从胀包即食小龙虾中筛选出3 种不同的产气细菌,分别为强产气的M3、弱产气的U1和在物种组成中占据优势地位的R1,对其构建系统发育树。如图5所示,M3是魏斯氏菌的分支,属于乳酸菌,与绿色魏斯氏菌最接近;U1是沙雷氏菌(Serratia)的分支;R1是索丝菌的分支,与热杀索丝菌最接近。结合《伯杰氏系统细菌学手册》[22]和《常见细菌系统鉴定手册》中对细菌形态的描述及对物种组成和物种变化热图的分析,说明胀包即食小龙虾中主要的产气微生物为绿色魏斯氏菌,主要的腐败微生物为热杀索丝菌。
图4 分离菌株的16S rDNA扩增电泳图
Fig. 4 Electropherogram of 16S rDNA amplified products of isolates
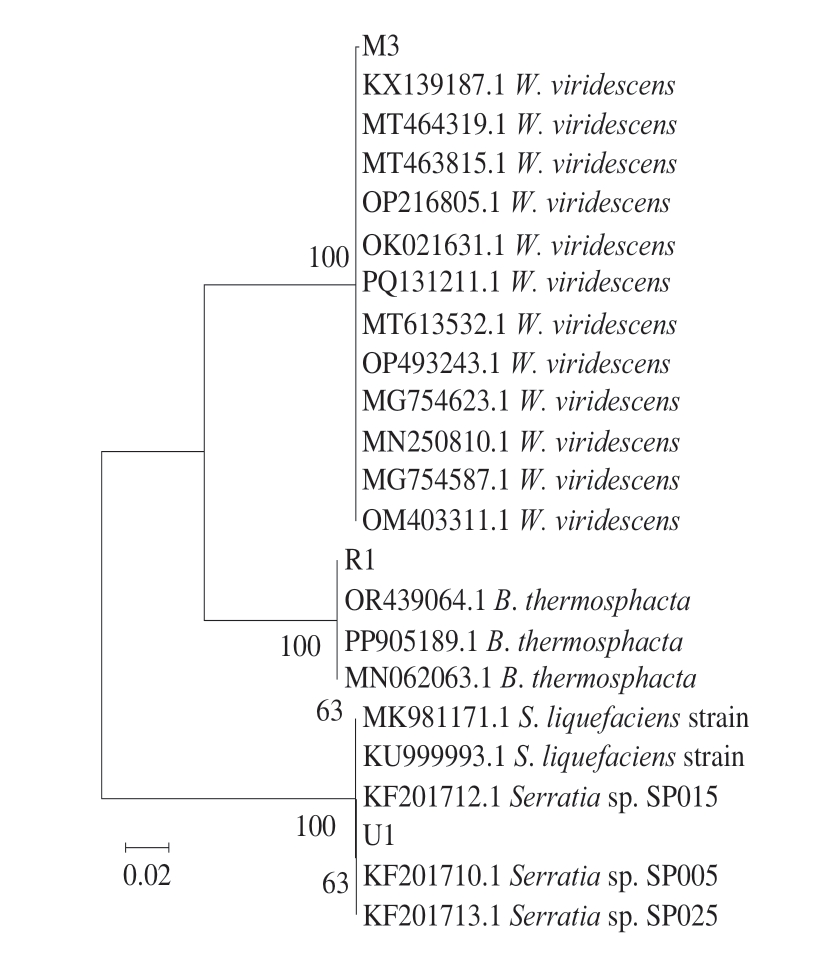
图5 基于绿色魏斯氏菌、热杀索丝菌和沙雷氏菌的系统发育树
Fig. 5 Phylogenetic tree of W. viridescens, B. thermosphacta, and Serratia sp.
2.4 绿色魏斯氏菌不同菌株之间产气速率的比较
筛选出的绿色魏斯氏菌共1 4 株,分别为M1~M10、Z1~Z4,通过NCBI数据库进行比对,除去相似度高的菌株,选出4 个菌株,分别为M 1(W. viridescens strain TSGB 1197)、M3(W. viridescens strain SourdoughF_13)、M6(W. viridescens strain SA22R1)、M7(W. viridescens strain TMPC47511)。由图6可知,M3的产气速率较快,可能是由于不同菌株的产气能力存在差异。故将产气活性较好的M3作为后续实验菌株。
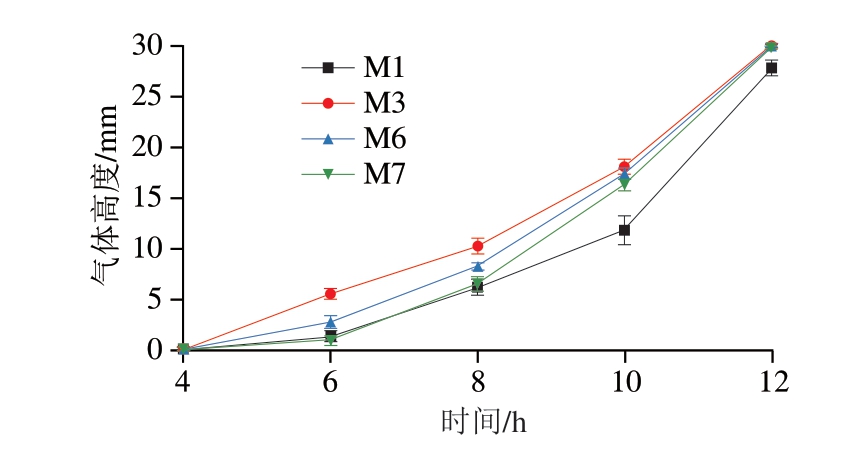
图6 不同绿色魏斯氏菌菌株之间的产气速率比较
Fig. 6 Comparison of gas production rate between different strains of W. viridescens
2.5 绿色魏斯氏菌M3菌悬液中挥发性成分分析
如图7所示,在保留时间1.53、1.75 min处有2 个明显的峰,质谱分析显示,2 个峰对应的均为CO2,这与丁珊珊[24]、Diez[25]等得到的绿色魏斯氏菌分解糖类产生CO2的结论一致。
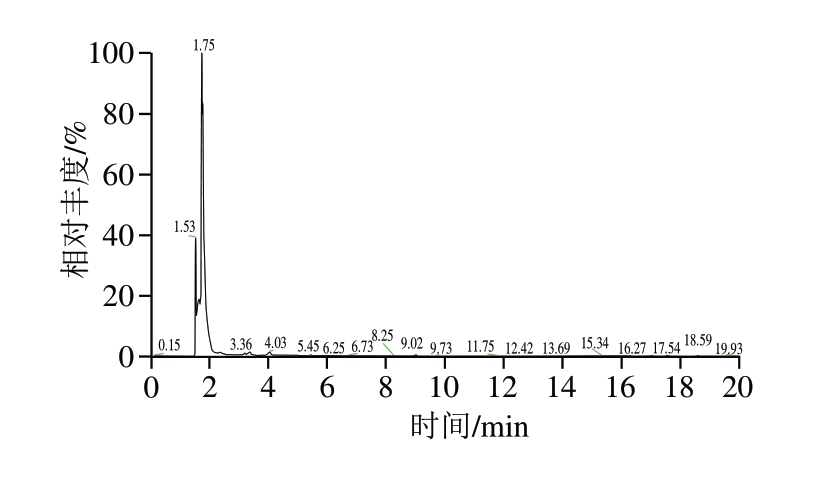
图7 绿色魏斯氏菌M3菌悬液挥发性成分分析
Fig. 7 Analysis of volatile components of W. viridescens M3 suspension
2.6 不同环境刺激下绿色魏斯氏菌M3的理化特性
2.6.1 不同pH值对绿色魏斯氏菌M3生长的影响
如图8A所示,在pH值为2.5和4.5时,OD600 nm在48 h内几乎没有变化,在pH 10.5时,OD600 nm增长缓慢,初始OD600 nm较高,可能是由于其颜色加深导致光密度升高。pH 6.5、pH 8.5和对照组有十分明显的迟滞期和对数生长期,对数生长期紧接在短暂的迟滞期后出现,维持6~8 h,表明绿色魏斯氏菌M3在pH 6.5~10.5条件下能够存活,尤其是在pH 6.5~8.5生长状态良好。这与姜静等[26]发现融合魏斯氏菌在pH 9.5时存活率很低的结论不一致,这可能是因为同一菌属的不同菌株对pH值的耐受范围有所差异。
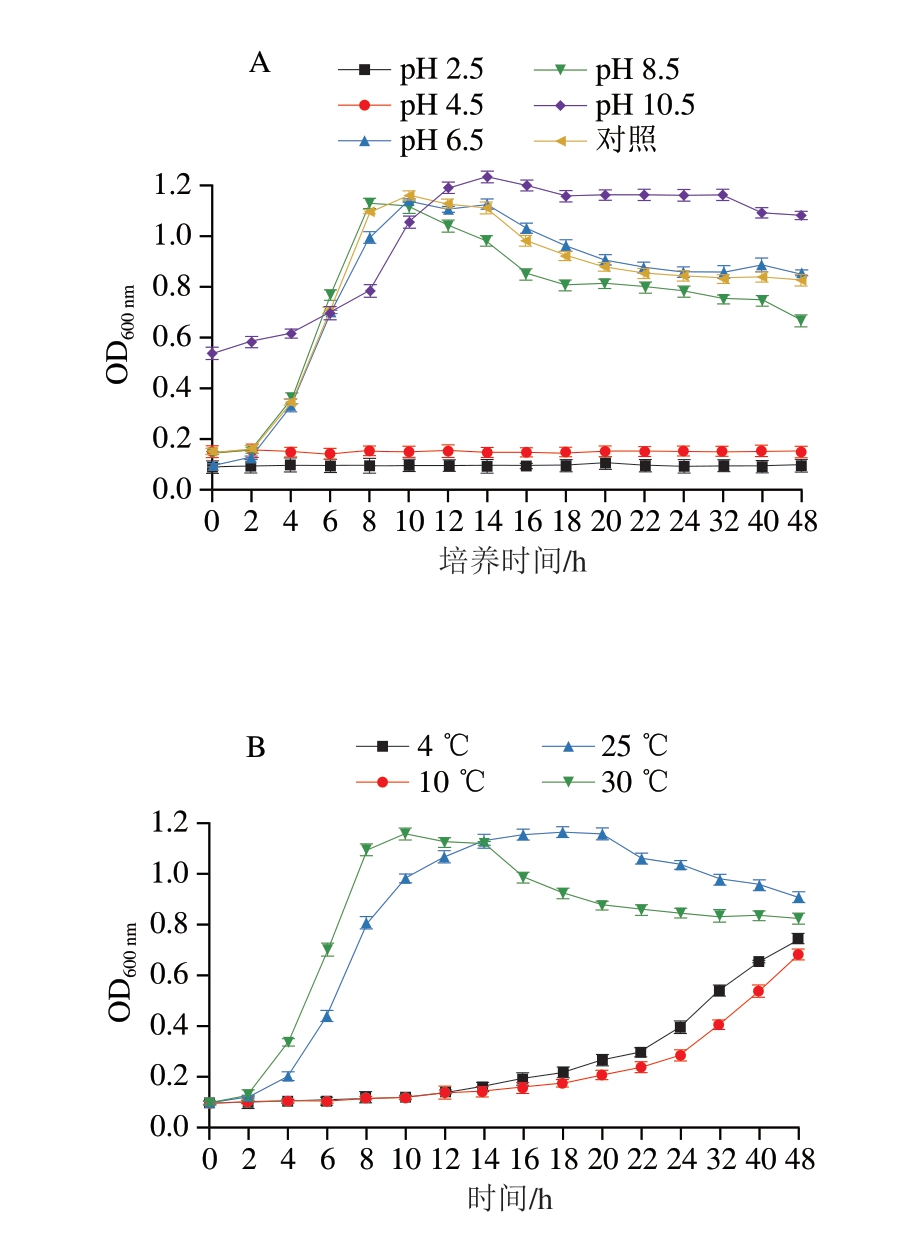
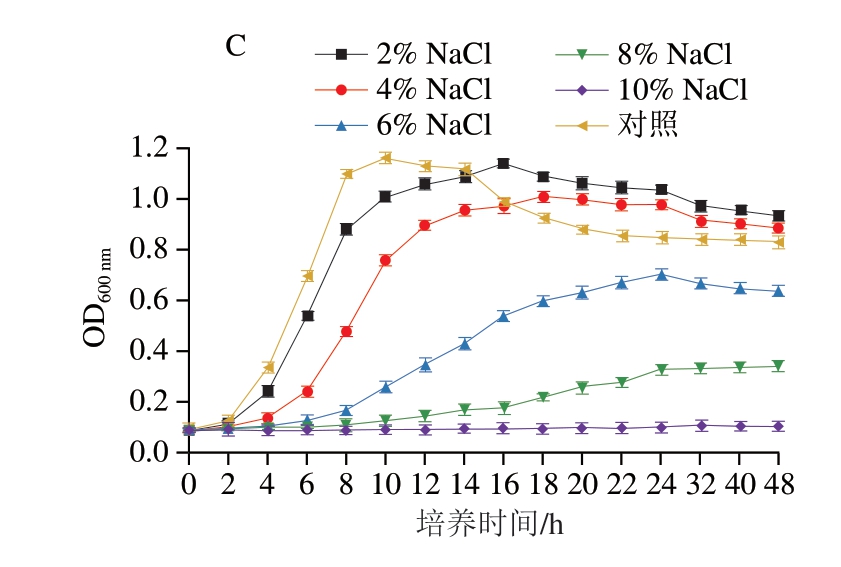
图8 绿色魏斯氏菌M3在不同环境刺激下的生长能力
Fig. 8 Growth curves of W. viridescens M3 under different environmental stimulations
A. pH值;B.温度;C. NaCl含量。图9、10同。
2.6.2 不同温度对绿色魏斯氏菌M3生长的影响
如图8B所示,在温度为4、10 ℃时,绿色魏斯氏菌M3生长较为缓慢。在温度为30 ℃时,该菌生长速率最快,这与Fusco等[11]报道的大多数乳酸菌的最适生长温度相吻合,而在接近室温的25 ℃下,绿色魏斯氏菌M3生长速率依然较快,故即食小龙虾不应长时间放置在室温下,以防绿色魏斯氏菌迅速繁殖、产气,引起胀包。
2.6.3 不同NaCl含量对绿色魏斯氏菌M3生长的影响
如图8C所示,随着NaCl含量的增加,绿色魏斯氏菌M3的生长速率逐渐减慢,未添加NaCl的对照组生长速率最快,而NaCl质量分数达到10%时,该菌的生长几乎停滞。这与张艺鸽[27]的研究结果一致。有报道[28]称,在NaCl质量分数为10%~14%的盐水中检出绿色魏斯氏菌,可能是由于其较好的耐盐性或菌株不同所带来的差异所致。
2.7 不同环境刺激下绿色魏斯氏菌M3的产气能力
2.7.1 不同pH值对绿色魏斯氏菌M3产气情况的影响
如图9A、10A所示,在pH 2.5时,绿色魏斯氏菌M3不产生任何气体。在pH 6.5、8.5和对照组中,其开始产气的时间早,产气速率快。而在pH值为4.5和10.5时,该菌开始产气的时间晚且产气速率较慢。
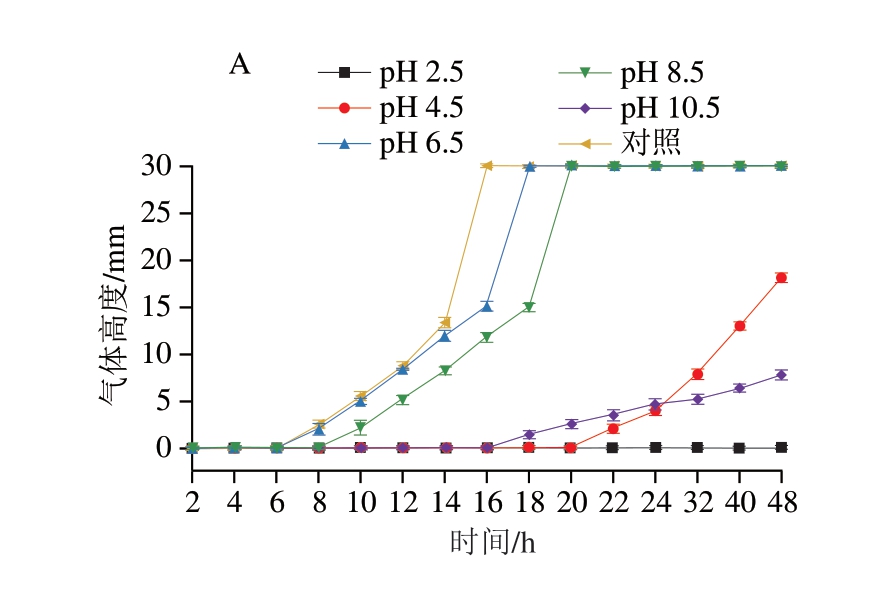
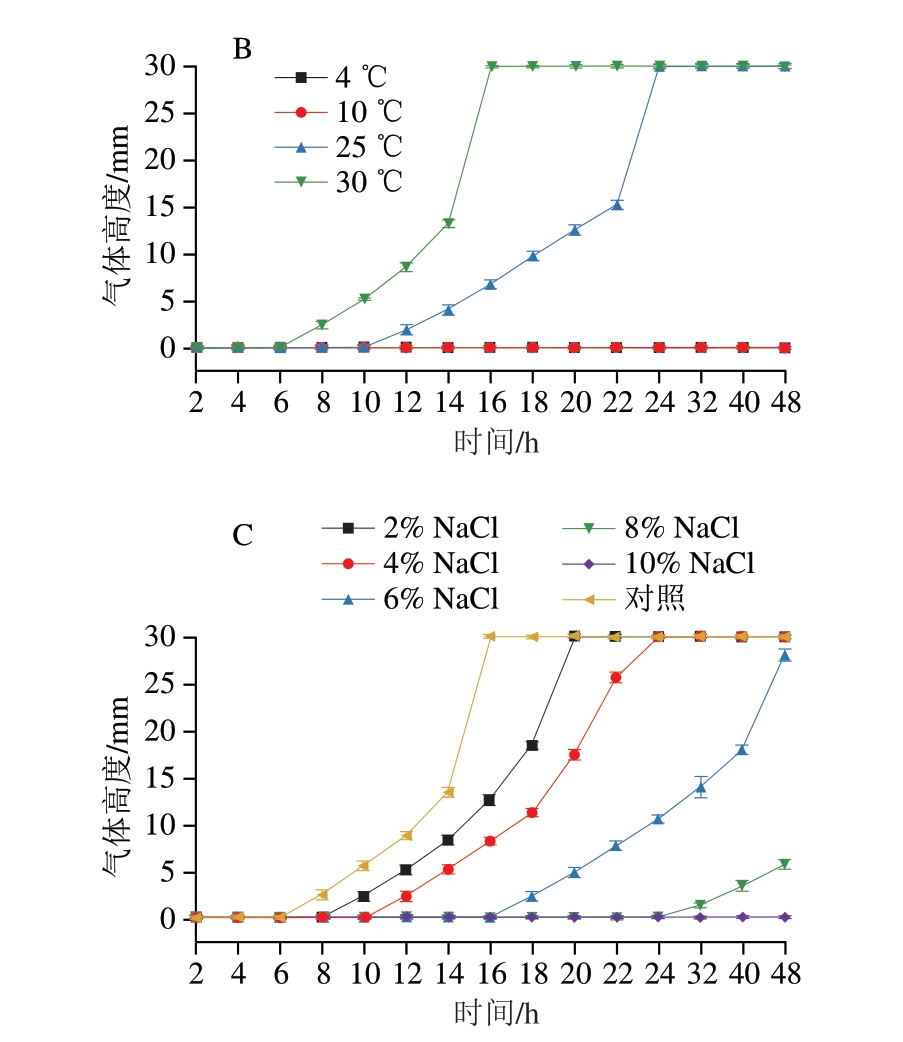
图9 绿色魏斯氏菌M3在不同环境刺激下的产气能力
Fig. 9 Gas production capacity of W. viridescens M3 under different environmental stimulations
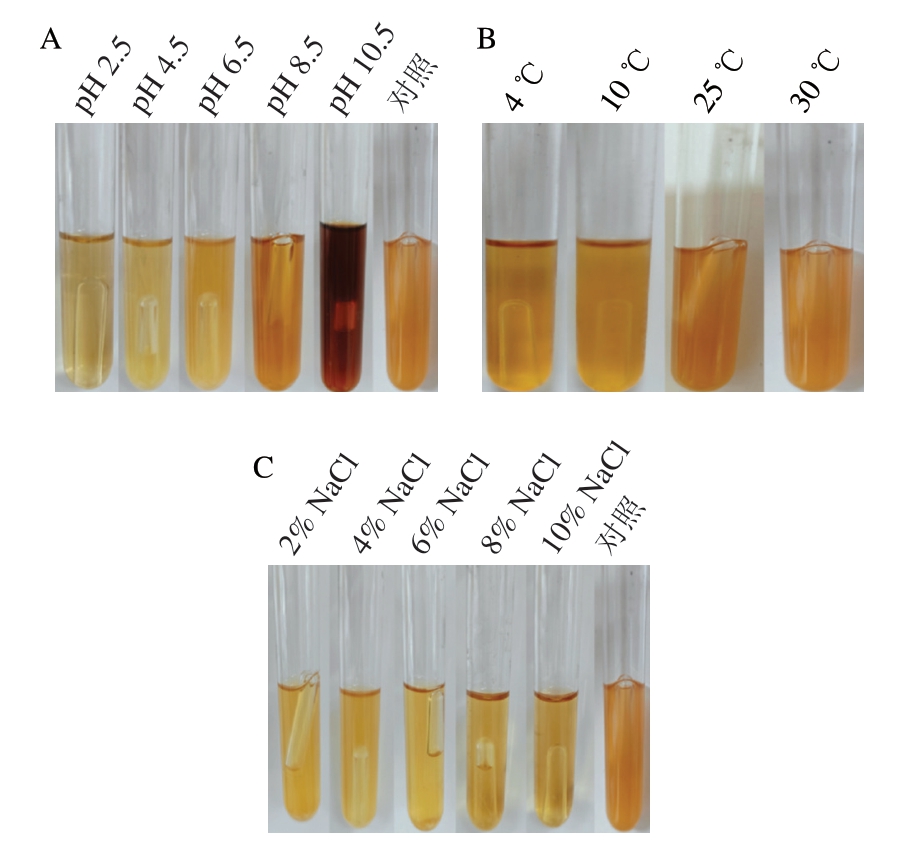
图10 绿色魏斯氏菌M3在不同环境刺激下培养48 h的产气情况
Fig. 10 Gas production of W. viridescens M3 after 48 h culture under different environmental stimulations
2.7.2 不同温度对绿色魏斯氏菌M3产气情况的影响
如图9B、10B所示,温度为4、10 ℃时,绿色魏斯氏菌M3几乎不产气。在温度为30 ℃时,其开始产气的时间最早且速率最快。而在温度为25 ℃时,该菌开始产气的时间较晚且速率相对较慢。
2.7.3 不同NaCl含量对绿色魏斯氏菌M3产气情况的影响
如图9C、10C所示,随着NaCl含量的升高,绿色魏斯氏菌M3开始产气的时间延长且产气速率降低。当NaCl质量分数为10%时,该菌不产生任何气体。
3 结 论
本研究对引起即食小龙虾胀包腐败的微生物进行分离、鉴定与理化特性研究。采用高通量测序结合传统分离培养法,揭示胀包小龙虾中的特定产气菌为绿色魏斯氏菌、特定腐败菌为热杀索丝菌,并分析绿色魏斯氏菌的理化特性和产气特性。结果表明,绿色魏斯氏菌在pH 2.5以下、10 ℃以下及NaCl质量分数10%以上时生长被抑制且几乎不产气,这一结果为小龙虾加工生产中抑制绿色魏斯氏菌生长、控制小龙虾胀包腐败、延长产品保藏期并改善其感官品质提供了一定的参考。但由于小龙虾加工环境的复杂性和保持即食小龙虾口感和风味的重要性,应对小龙虾产气腐败微生物的控制技术展开深入研究,进一步优化即食小龙虾的生产加工工艺。
[1] 王茜, 王利强. 即食小龙虾杀菌及保藏技术的研究进展[J]. 包装工程, 2022, 43(23): 98-105. DOI:10.19554/j.cnki.1001-3563.2022.23.012.
[2] 邓扬龙. 郫县豆瓣中产气微生物的分离、鉴定及其生物特性研究[D].成都: 西华大学, 2020. DOI:10.27411/d.cnki.gscgc.2020.000316.
[3] HUANG G P, SUN W L, DAI C H, et al. Sterilization of Bacillus tequilensis isolated from aerogenic vinegar by intense pulsed light[J].LWT-Food Science and Technology, 2020, 118: 108811. DOI:10.1016/j.lwt.2019.108811.
[4] ZHANG X D, ZHANG Y X, WANG L L, et al. Identification and control of gas-producing bacteria isolated from the swollen bagged soy sauce[J]. International Journal of Food Microbiology, 2023, 407:110396. DOI:10.1016/j.ijfoodmicro.2023.110396.
[5] WANG X J, HU K D, LIU F, et al. Isolation and characterization of a gas-producing and acid-resistant bacterium from spoiled vinegar[J].International Journal of Food Microbiology, 2023, 394: 110167.DOI:10.1016/j.ijfoodmicro.2023.110167.
[6] QU A Y, ZHANG Y J, SHI H Q, et al. Investigation of gas-producing bacteria in sufu and its effective method to control their growth[J].LWT-Food Science and Technology, 2022, 155: 112919. DOI:10.1016/j.lwt.2021.112919.
[7] 孟凌云, 戴泽川, 李娇, 等. 冷藏小龙虾优势腐败菌的筛选鉴定及细菌群落结构和多样性分析[J]. 肉类研究, 2022, 36(6): 16-22.DOI:10.7506/rlvj1001-8123-20220505-050.
[8] ZHAO Y M, HUANG F, WANG W X, et al. Application of highthroughput sequencing technologies and analytical tools for pathogen detection in urban water systems: progress and future perspectives[J].Science of The Total Environment, 2023, 900: 165867. DOI:10.1016/j.scitotenv.2023.165867.
[9] HASSAN H F, DIMASSI H, EL AMIN R. Survey and analysis of internal temperatures of Lebanese domestic refrigerators[J].International Journal of Refrigeration, 2015, 50: 165-171.DOI:10.1016/j.ijrefrig.2014.10.026.
[10] DORN-IN S, FÜHRER L, GAREIS M, et al. Cold-tolerant microorganisms causing spoilage of vacuum-packed beef under time-temperature abuse determined by culture and qPCR[J]. Food Microbiology, 2023, 109: 104147. DOI:10.1016/j.fm.2022.104147.
[11] FUSCO V, QUERO G M, CHO G S, et al. The genus Weissella:taxonomy, ecology and biotechnological potential[J]. Frontiers in Microbiology, 2015, 6: 155. DOI:10.3389/fmicb.2015.00155.
[12] 李成. 腌制生食蟹糊菌相分析及防腐保鲜研究[D]. 南京: 南京师范大学, 2019. DOI:10.27245/d.cnki.gnjsu.2019.001768.
[13] 王昕霞. 负载紫苏醛的纳米纤维抗菌膜的制备及其在冷鲜鸡肉保鲜中的应用研究[D]. 镇江: 江苏大学, 2023. DOI:10.27170/d.cnki.gjsuu.2023.001764.
[14] ILLIKOUD N, GOHIER R, WERNER D, et al. Transcriptome and volatilome analysis during growth of Brochothrix thermosphacta in food: role of food substrate and strain specificity for the expression of spoilage functions[J]. Frontiers in Microbiology, 2019, 10: 2527.DOI:10.3389/fmicb.2019.02527.
[15] 周彬静, 刘小花, 彭菁, 等. 荧光假单胞菌和热杀索丝菌对低温贮藏期间猪肉品质变化的影响[J]. 食品科学, 2022, 43(19): 208-216.DOI:10.7506/spkx1002-6630-20211010-093.
[16] NYCHAS G E, SKANDAMIS P N, TASSOU C C, et al. Meat spoilage during distribution[J]. Meat Science, 2008, 78(1/2): 77-89.DOI:10.1016/j.meatsci.2007.06.020.
[17] 杨啸吟, 张一敏, 梁荣蓉, 等. 包装冷却肉中微生物腐败及其挥发性气味的研究进展[J]. 食品科学, 2021, 42(1): 285-293. DOI:10.7506/spkx1002-6630-20200207-046.
[18] 崔亮, 岳媛媛, 乌日娜. 明串珠菌应用研究进展[J]. 乳业科学与技术,2018, 41(5): 28-34. DOI:10.15922/j.cnki.jdst.2018.05.007.
[19] 张志霞. 青藏高原部分地区不同分离样品肠膜明串珠菌的多位点序列分型研究[D]. 郑州: 郑州大学, 2016.
[20] YANG W Q, LIU S L, LIU X Q, et al. Novel quorum-sensing inhibitor peptide SF derived from Penaeus vannamei myosin inhibits biofilm formation and virulence factors in Vibrio parahaemolyticus[J]. LWTFood Science and Technology, 2025, 218: 117542. DOI:10.1016/j.lwt.2025.117542.
[21] FOUTS D E, SZPAKOWSKI S, PURUSHE J, et al. Next generation sequencing to define prokaryotic and fungal diversity in the bovine rumen[J]. PLoS ONE, 2012, 7(11): e48289. DOI:10.1371/journal.pone.0048289.
[22] GARRITY G M, BRENNER D J, KRIEG N R, et al. Bergey’s manual of systematic bacteriology[M]. New York: Springer, 2009.
[23] 东秀珠. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
[24] 丁珊珊. 绿色魏斯氏菌NJ100的腐败潜能及其对真空包装低温火腿的致腐效应研究[D]. 南京: 南京农业大学, 2019. DOI:10.27244/d.cnki.gnjnu.2019.001307.
[25] DIEZ A M, BJÖRKROTH J, JAIME I, et al. Microbial, sensory and volatile changes during the anaerobic cold storage of morcilla de Burgos previously inoculated with Weissella viridescens and Leuconostoc mesenteroides[J]. International Journal of Food Microbiology, 2009, 131(2/3): 168-177. DOI:10.1016/j.ijfoodmicro.2009.02.019.
[26] 姜静, 郭尚旭, 张鑫, 等. 融合魏斯氏菌(Weissella confusa)XG-3的分离鉴定及其胞外多糖性质初步研究[J]. 黑龙江大学自然科学学报,2020, 37(1): 71-80. DOI:10.13482/j.issn1001-7011.2019.12.121.
[27] 张艺鸽. 绿色魏斯氏菌的分离鉴定及特性研究[D]. 新乡: 河南师范大学, 2019. DOI:10.27118/d.cnki.ghesu.2019.000082.
[28] DUŠKOVÁ M, KAMENÍK J, KARPÍŠKOVÁ R. Weissella viridescens in meat products: a review[J]. Acta Veterinaria Brno, 2013,82(3): 237-241. DOI:10.2754/avb201382030237.