南湾湖素有“中原第一湖”之美称,有着得天独厚的地理位置和优良的水源,南湾鱼肉质细嫩、味道鲜美,成为名副其实的无公害绿色食品。南湾鱼是一种富含蛋白质、脂肪、维生素及稀有元素的鱼类,其中有抗癌元素之称的“硒”含量是普通鱼类的3~5 倍以上[1]。南湾鱼经过预处理并添加一定的调料就可以制成鱼糜制品,且营养结构合理、安全卫生、食用方便,适合工业化生产,也可以手工制作[2-3]。
鱼糜最为常见的贮藏方式为冷冻保藏,可以有效保持鱼糜品质。解冻是冷冻鱼糜在加工和烹调之前必须进行的一道工序,解冻会使鱼糜制品的物理及化学特性发生改变,因此会影响鱼糜制品的品质,若采用不当的解冻方法,会导致鱼肉的质地和风味被破坏,影响鱼糜的凝胶特性[4-5]。Cai Luyun等[6]研究发现,微波真空解冻与远红外解冻相结合可以很好地保持鲈鱼的质量,是一种较好的解冻方法。刘富康等[7]研究表明,鱼糜经空气解冻、微波解冻和射频解冻都能够保持较佳的品质,其中微波解冻鱼糜效率较高,但是鱼糜品质较差。
本研究对冷冻15 d的鱼糜采用空气、流水、微波、热水和低温5 种解冻方式,对比不同解冻方式对鱼糜的流变学特性、水分分布、鱼糜凝胶的质构特性、色泽、硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值、解冻损失率和鱼丸的水分分布、质构特性、色泽、TBARS值、蒸煮失水率、水分含量、pH值、感官品质的影响,通过对其指标进行分析,得到最佳鱼糜解冻方式,为冷冻鱼糜制品的解冻提供数据参考。
1 材料与方法
1.1 材料与试剂
南湾鳙鱼:捕捞于信阳南湾湖。
绵白糖 河北新得力食品股份有限公司;海盐唐山市唐丰盐业有限公司;味精 长沙市桂花味精厂;料酒 佛山市海天调味食品股份有限公司;玉米淀粉滨州金汇玉米开发有限公司;鸡蛋、葱、姜 市购。
硫代巴比妥酸(分析纯) 天津市科密欧化学试剂有限公司;三氯乙酸(分析纯)、甲基红(分析纯)上海源叶生物科技有限公司。
1.2 仪器与设备
QJ-128强劲绞肉切肉机 广州百轮食品机械有限公司;FE-28-Standard台式酸度计 谱质分析检测技术有限公司;JCS-11002B电子天平 哈尔滨众汇衡器有限公司;TMS-PRO质构仪 北京盈盛恒泰科技有限责任公司;MCR102e流变仪 安东帕(上海)商贸有限公司;HW远红外干燥箱 北京科伟永兴仪器有限公司;XMTD-7000电热水浴锅 北京市永光明医疗仪器有限公司;BX-08超低温速冻冰箱 上海江凯机械有限公司;ZG-8010电子温度计 宁波赵记电器有限公司;LG-SY6D食品加工机(绞肉机) 中山市力果电器有限公司;Tcc-16c离心机 上海安亭科学仪器厂;NMI20-040V-1核磁共振成像分析仪 苏州纽迈分析仪器股份有限公司。
1.3 方法
1.3.1 鱼糜样品制备及冻藏
参考阳胜男等[8]的方法稍作修改,将新鲜购回的南湾鱼宰杀,去头、尾、内脏,分离鱼皮、骨刺,获得鱼肉,用蒸馏水将其血污清洗干净,立即覆冰。鱼肉漂洗后放入电动绞肉机中400 r/min、3 min后制得鱼糜,分成5 组,每组3 份,先置于-65 ℃超低温冰箱速冻至鱼糜中心温度为-18 ℃后,放置于-18 ℃的低温冰箱中贮藏15 d,测定鱼糜动态流变学特性和水分分布。
为方便测定鱼糜的其他指标,将其制作为鱼糜凝胶进行进一步测定。
1.3.2 鱼糜凝胶制备
鱼糜凝胶制备工艺:鱼糜解冻(不同解冻方式处理,0.25 kg)→擂溃(空擂5 min)→盐擂(2.5%食盐、20 min)→入肠衣定型(长度10 cm/根)→85 ℃水浴加热1 h→冷却至室温。
将鱼糜凝胶于4 ℃冰箱保存12 h后解冻,进行指标测定,包括质构特性、色泽、TBARS值、解冻损失率。
1.3.3 鱼丸制作
鱼丸制作工艺:鱼糜解冻(不同解冻方式处理)→打浆(加入玉米淀粉6%、蛋清5%、葱姜水60%,400 r/min搅拌1 min)→加盐打浆(2.5%食盐、400 r/min搅拌1 min,加入白糖0.5%、料酒2%、鸡精1%,搅拌4 min)→搅拌成型→加热凝胶化(40 ℃、30 min)→熟化(90 ℃、10 min)→冷却(25 ℃)→鱼丸(直径为2 cm)。
对制得的鱼丸进行指标测定,包括水分分布、质构特性、色泽、TBARS值、蒸煮失水率、水分含量、pH值及感官评价。
1.3.4 解冻方式
参考盛倩茹等[9]方法,分别采用表1中5 种方式进行解冻。
表1 鱼糜解冻方式及其操作方法
Table 1 Operating conditions of five thawing methods

解冻方式操作方法解冻时间 中心温度/℃微波解冻微波功率700 W,频率2 450 MHz5 min0热水解冻置于50 ℃恒温水浴锅中解冻23 min0流水解冻 置于恒定流速的自来水中解冻,水温约为27 ℃1.05 h0空气解冻置于室温(23~25 ℃)环境下解冻4.75 h0低温解冻置于4 ℃冰箱中解冻11.7 h0
1.3.5 鱼糜动态流变学特性测定
取3 g鱼糜样品均匀涂抹在测试台上,用硅油进行密封,避免样品在加热过程中水分挥发流失。设置频率扫描间距为1 mm,应变为1%,以0.1~20 Hz进行扫描;温度扫描间距为1 mm,应变为1%,样品从1 ℃上升到128 ℃[10]。
1.3.6 鱼糜和鱼丸低场核磁共振分析
切取1 g鱼糜、鱼丸样品放置于直径为25 mm的核磁管中,然后用探头密封。检测样品点数80 010,回波个数6 000,样品检测时间4 000 ms;重复次数64。将测得的数据进行反演,得到各状态水分对应的弛豫时间及峰积分面积[11]。
1.3.7 鱼糜凝胶和鱼丸质构特性测定
鱼糜凝胶质构特性测定:将鱼糜凝胶切成高2.5 cm的小段,选用球形探头进行测定,测试参数为:测前速率2 mm/s,测试速率5 mm/s,测后速率5 mm/s;压缩程度50%;2 次压缩之间停留时间5 s;触发类型自动;触发力10 g。
鱼丸质构特性测定:选用P/36R圆柱形探头,测前速率2 mm/s,测试速率5 mm/s,测后速率5 mm/s;压缩程度50%;2 次压缩之间停留时间5 s,每个指标测定3 次,取平均值[12]。
1.3.8 鱼糜凝胶和鱼丸色泽测定
将鱼糜凝胶和鱼丸切成0.5 cm的切片,用色差仪测定切面的亮度值(L*)、红度值(a*)和黄度值(b*),白度按式(1)[13]计算:
1.3.9 鱼糜凝胶和鱼丸TBARS值测定
参照GB 5009.181—2016《食品安全国家标准 食品中丙二醛的测定》中的分光光度法进行测定。
1.3.10 鱼糜凝胶解冻损失率和鱼丸蒸煮损失率测定
对解冻前的鱼糜凝胶进行精确称质量,解冻后用吸水纸擦干再次称质量;精确称取解冻后的鱼丸,将其放入水浴锅中,直到鱼丸的中心温度为70 ℃,再将其冷却,用吸水纸擦干再次称质量,鱼糜凝胶解冻损失率和鱼丸蒸煮损失率按式(2)计算,每组实验3 个平行,结果取平均值。
式中:m1为解冻前鱼糜质量或蒸煮前鱼丸质量/g;m2为解冻后鱼糜质量或蒸煮后鱼丸质量/g。
1.3.11 鱼丸水分含量测定参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》(恒温干燥法)。
1.3.12 鱼丸pH值测定
将5.0 g鱼丸样品研磨粉碎,然后加入50 mL蒸馏水,搅拌30 s,浸泡30 min。用滤纸过滤后取滤液,用酸度计进行测定。
1.3.13 鱼丸感官评定
选10 位食品专业人员,对鱼丸的色泽、滋味、气味、弹性、组织状态5 个方面进行打分,取3 次平均分,具体评分标准见表2[14]。
表2 鱼丸感官评定标准
Table 2 Sensory evaluation criteria for fish balls
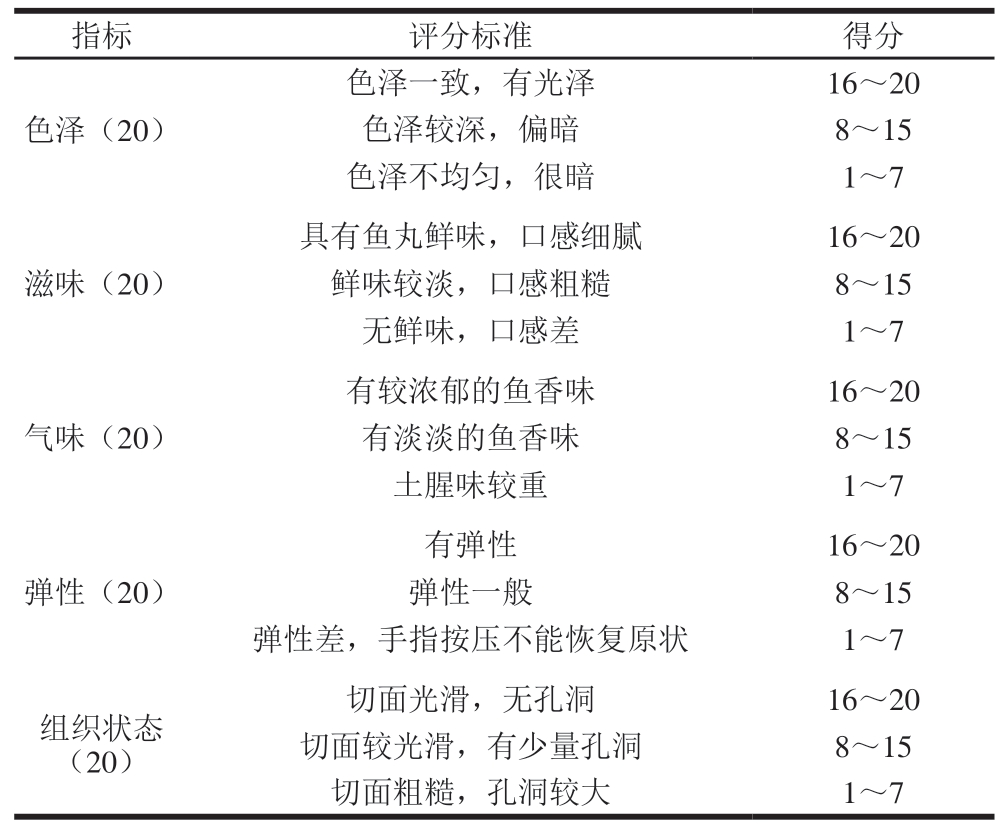
指标评分标准得分色泽(20)色泽一致,有光泽16~20色泽较深,偏暗8~15色泽不均匀,很暗1~7滋味(20)具有鱼丸鲜味,口感细腻16~20鲜味较淡,口感粗糙8~15无鲜味,口感差1~7气味(20)有较浓郁的鱼香味16~20有淡淡的鱼香味8~15土腥味较重1~7弹性(20)有弹性16~20弹性一般8~15弹性差,手指按压不能恢复原状1~7组织状态(20)切面光滑,无孔洞16~20切面较光滑,有少量孔洞8~15切面粗糙,孔洞较大1~7
1.4 数据处理
实验均重复3 次,使用Excel 2010软件对数据进行分析,并计算标准差;使用Origin 2022和SPSS软件绘图,并进行数据差异显著性比较。
2 结果与分析
2.1 不同解冻方式对鱼糜流变学特性的影响
2.1.1 频率扫描
储能模量(G′)是样品的弹性特征,G′较大时,表明鱼糜具有较好的弹性;损耗模量(G″)是样品的黏度特性,G″越大,其交联度越高,且易形成凝胶[15]。由图1可知,随着扫描频率不断增大至20 Hz,低温解冻鱼糜的G′和G″最高,分别为9 171.4和2 216.2,这是由于低温解冻过程缓慢,解冻时间较长,解冻分布均匀,使得鱼糜凝胶组织受到较小损害,凝胶网络稳定,因此弹性较佳。微波解冻鱼糜的G′和G″最低,分别为5 681.8和1 393.7,微波解冻较为迅速,使得鱼糜组织受到较大破坏,凝胶网络断裂不稳定,因此在频率扫描中G′最低。在快速解冻模式下,鱼糜体系中存在大量化学键,在不同的时间发生不同程度的交联,严重影响鱼糜的凝胶特性[16]。
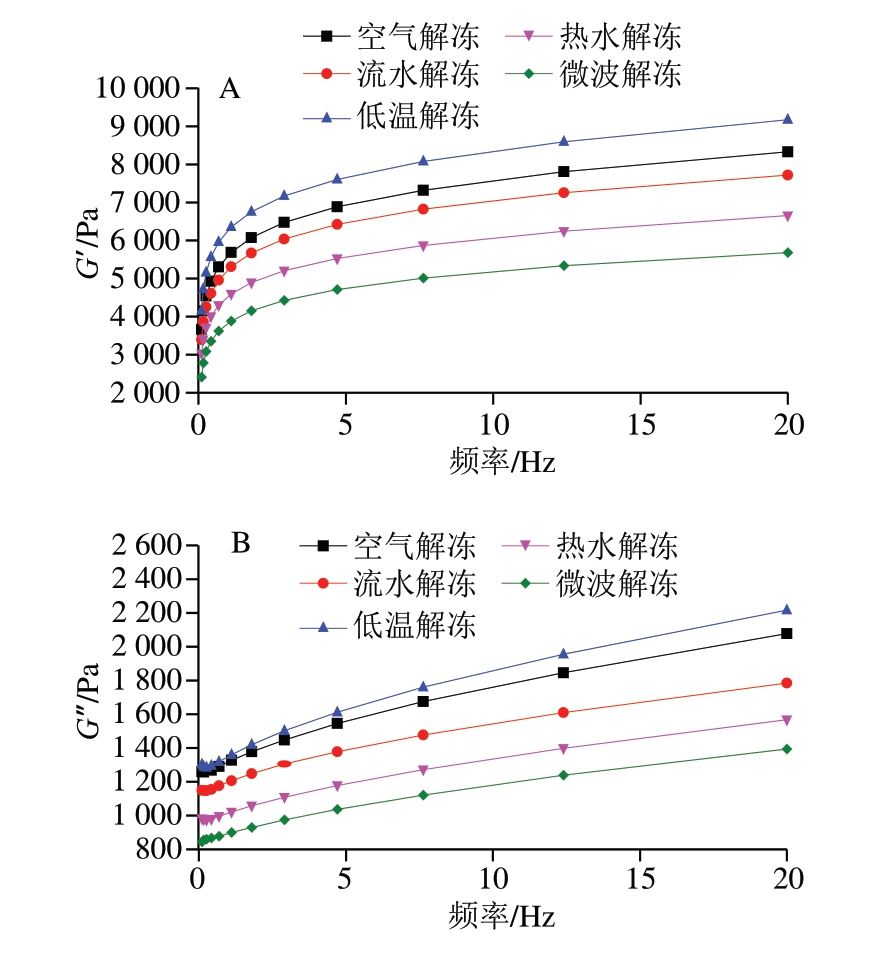
图1 不同解冻方式对鱼糜G′(A)和G″(B)的影响
Fig. 1 Influence of different thawing methods on the storage modulus(G′) (A) and loss modulus (G″) (B) of surimi
2.1.2 温度扫描
随着温度上升,G′变化的主要原因是鱼糜受热后会出现蛋白的解链、变性和凝聚等变化,因此鱼糜G′的变化均有相同的趋势[17]。如图2所示,鱼糜G′和G″随着温度增加而先增大后减小,25~40 ℃时,肌球蛋白双螺旋解离,形成更疏松的网状结构,但由于微波解冻在解冻过程中双螺旋结构过早解离,因此鱼糜的G′和G″较低。当温度升高到40~70 ℃时,不同解冻方式的鱼糜开始呈现凝胶劣化现象,当温度为70 ℃时,不同解冻方式的鱼糜凝胶弹性差异较为明显,此时空气解冻鱼糜的G′最高,微波解冻鱼糜最低,这可能是因为微波解冻能量较高,在鱼糜中传递的过程中发生局部聚集,部分肌球蛋白变性,鱼糜凝胶网状结构致密性较差,当温度为70 ℃时,鱼糜中的蛋白网络结构破坏严重,导致鱼糜的弹性和凝胶性降低较快,低于其他解冻方式[18]。
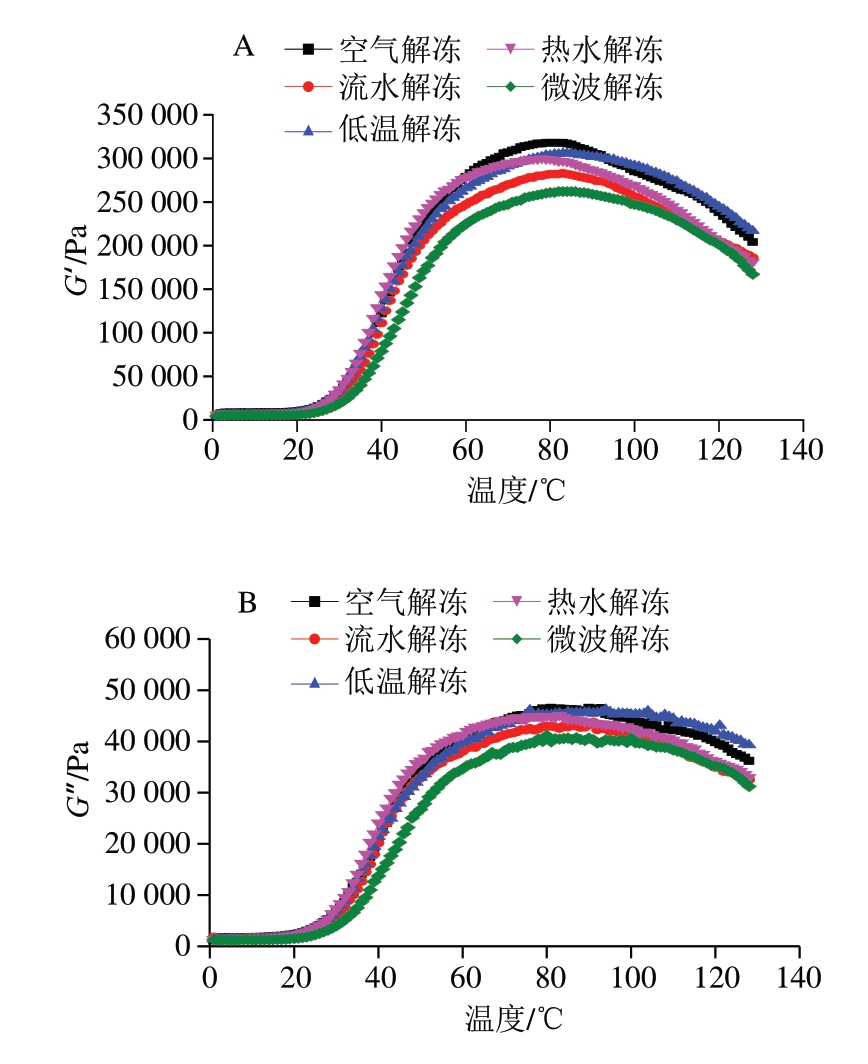
图2 不同解冻方式对鱼糜升温过程中G′(A)和G″(B)的影响
Fig. 2 Effects of different thawing methods on the G′ (A) and G″ (B) of surimi during the heating process
2.2 不同解冻方式对鱼糜和鱼丸水分迁移特性的影响
不同解冻方式会导致鱼糜、鱼丸的蒸煮损失率和水分含量发生变化,同时水分分布也发生变化,因此通过横向弛豫时间(T2)的变化可以进一步了解不同解冻方式后的鱼糜、鱼丸水分迁移特性,其中T21(0~2 ms)表示深层结合水,T22(2~10 ms)表示弱结合水,T23(10~100 ms)表示不易流动水,T24(100~1 000 ms)表示自由水[19]。由图3A可知,不同解冻方式鱼糜的T21、T22无明显变化,T23差异较大。经微波解冻鱼糜凝胶的T23峰值最高,热水解冻的T23峰值最低,在微波解冻下,鱼糜中自由水的流动性较大,水分含量较高,且与蛋白网络间的结合力较弱,这主要是因为微波加热使蛋白质发生变性,失去对水分子的束缚,因此自由水含量增加[20]。空气解冻和低温解冻能有效保持蛋白质不受破坏,蛋白质能够很好地锁住水分,导致自由水流动性较低。不同解冻方式下,鱼糜中的蛋白质分解速率会加快,冰晶也会变大,这样会造成更多的水分损失,与解冻损失率结果一致。
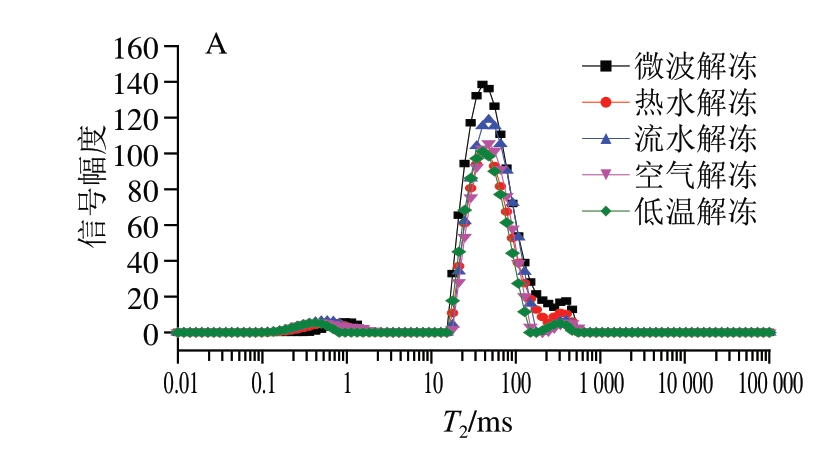
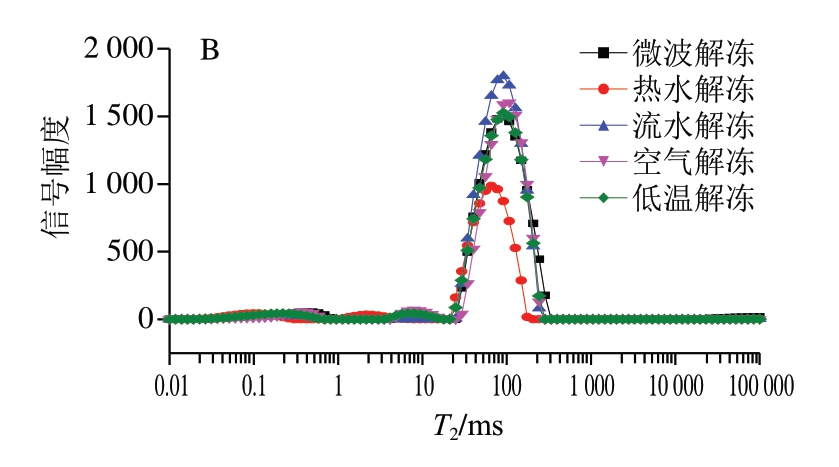
图3 不同解冻方式对鱼糜(A)和鱼丸(B)水分迁移的影响
Fig. 3 Effects of different thawing methods on water migration of surimi (A) and fish balls (B)
由图3B可知,不同解冻方式的鱼糜制作出的鱼丸整体总峰面积高于鱼糜凝胶,其中流水解冻组最高,为16 206.181,说明鱼丸品质最佳。
2.3 不同解冻方式对鱼糜凝胶和鱼丸质构特性的影响
质构特性是影响鱼丸品质的关键参数,可以反映不同解冻方式的鱼糜对鱼丸品质的影响[21]。由表3可知,不同解冻方式鱼糜凝胶的硬度差异显著(P<0.05),低温解冻鱼糜凝胶硬度最高,为35.10 N,微波解冻鱼糜凝胶硬度最低,为21.00 N。不同解冻方式鱼糜凝胶的胶着性和咀嚼性呈上升趋势,差异显著(P<0.05)。其中低温解冻鱼糜凝胶胶着性为21.10 mJ,咀嚼性为104.58 mJ。微波解冻鱼糜凝胶胶着性为1 2.6 0 m J,咀嚼性为55.62 mJ。微波解冻比低温解冻咀嚼性下降48.91%,胶着性下降41.99%。低温解冻鱼糜凝胶硬度和咀嚼性较高,这些差别主要是由于水分损失、蛋白质变性、交联降解、解冻时间和温度的影响[22]。微波解冻的鱼糜凝胶胶着性、硬度和咀嚼性较低,可能是因为在解冻过程中,微波解冻破坏了鱼糜内部组织结构,导致鱼糜内部松散,从而导致鱼糜的胶着性、硬度、咀嚼性较差。流水解冻后的鱼糜凝胶具有较高的弹性,采用流水解冻可以使鱼糜均匀地解冻,防止部分溶解过快或不彻底[23]。总体来看,解冻后鱼糜凝胶的弹性、胶着性、咀嚼性都有明显变化,其中以流水解冻鱼糜凝胶弹性最高,而低温解冻鱼糜凝胶的咀嚼性、硬度、胶着性较佳。
表3 不同解冻方式对鱼糜凝胶和鱼丸质构特性的影响
Table 3 Effects of different thawing methods on the texture characteristics of surimi gels and fish balls
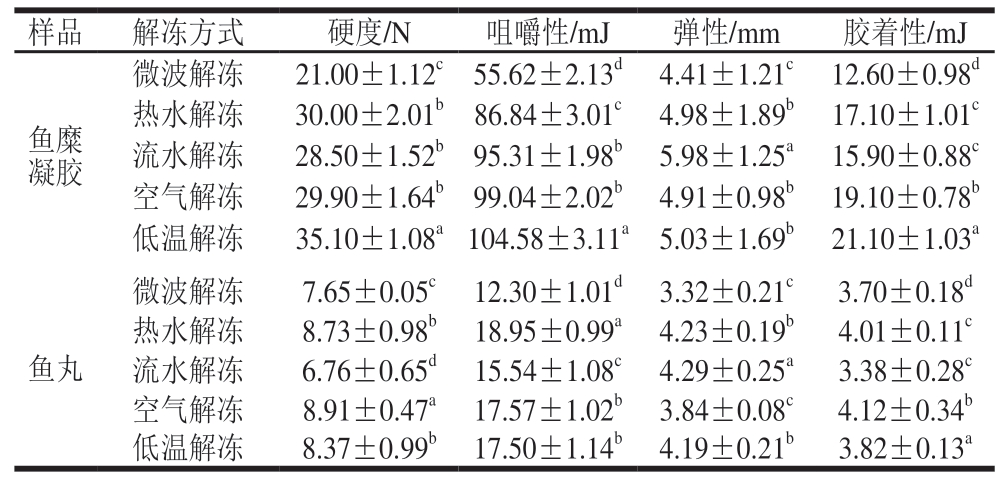
注:同列小写字母不同表示组间差异显著(P<0.05)。
样品解冻方式硬度/N咀嚼性/mJ弹性/mm胶着性/mJ鱼糜凝胶微波解冻21.00±1.12c 55.62±2.13d 4.41±1.21c 12.60±0.98d热水解冻30.00±2.01b 86.84±3.01c 4.98±1.89b 17.10±1.01c流水解冻28.50±1.52b 95.31±1.98b 5.98±1.25a 15.90±0.88c空气解冻29.90±1.64b 99.04±2.02b 4.91±0.98b 19.10±0.78b低温解冻35.10±1.08a 104.58±3.11a 5.03±1.69b 21.10±1.03a微波解冻7.65±0.05c 12.30±1.01d 3.32±0.21c 3.70±0.18d热水解冻8.73±0.98b 18.95±0.99a 4.23±0.19b 4.01±0.11c流水解冻6.76±0.65d 15.54±1.08c 4.29±0.25a3.38±0.28c空气解冻8.91±0.47a 17.57±1.02b 3.84±0.08c 4.12±0.34b低温解冻8.37±0.99b 17.50±1.14b 4.19±0.21b 3.82±0.13a鱼丸
经过不同解冻方法处理鱼糜后制作的鱼丸硬度、咀嚼性和胶着性均有显著变化(P<0.05),但弹性差异较小。空气解冻组鱼丸硬度最大,为8.91 N,流水解冻组硬度最小,为6.76 N。微波解冻组弹性最低,为3.32 mm,流水解冻组最高,为4.29 mm。低温解冻和空气解冻后鱼糜制作的鱼丸弹性和硬度适中,胶着性接近。微波解冻组鱼丸具有较低的硬度,弹性、胶着性和咀嚼性较差,其主要原因是在高温下的解冻过程中,会引起鱼糜的过度熟化,使其内部的蛋白质结构遭到破坏,从而影响后续鱼丸的品质,与盛倩茹等[9]研究结果一致,该研究结果表明,微波解冻后鱼丸的硬度低、弹性差、回复性小,质地不佳。
2.4 不同解冻方式对鱼糜凝胶和鱼丸色泽的影响
由图4A可知,不同解冻方式的鱼糜凝胶L*呈现明显差异,空气解冻后的鱼糜凝胶L*最大,热水解冻组L*最小,这可能是由于空气解冻速率慢,冰晶在缓慢融化过程中,水分能够被细胞重新吸收,保留了鱼糜本身色泽,同时维持了蛋白质的胶体特性,蛋白质结构的完整性能保持鱼糜质地细腻,L*高于其他解冻方式。微波解冻导致鱼糜损失率最大,其主要原因是在解冻过程中损失的水分最多,使其表面反射能力明显增强,从而造成白度增加。热水解冻鱼糜凝胶L*最低,这可能是由于热水解冻的温度导致鱼糜颜色变深,所以L*最低。不同解冻方式的鱼糜白度无明显差异,空气解冻组白度最高,为91.24。流水解冻后鱼糜的白度较低,主要原因是在水流的作用下,鱼糜中的蛋白质被氧化,生成的自由基与游离氨基酸发生反应,从而产生较暗的物质,在某种程度上降低了白度。热水解冻速率较快,使鱼糜与空气接触的时间缩短,从而降低了鱼糜中脂肪的氧化程度,提高了产品的白度。
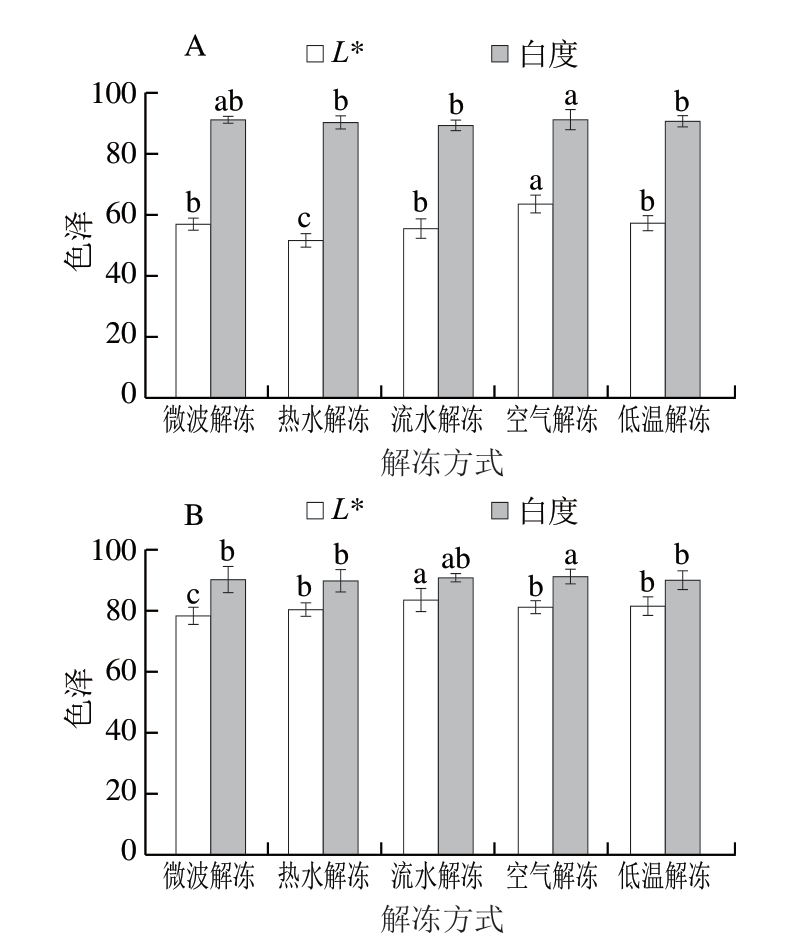
图4 不同解冻方式对鱼糜凝胶(A)和鱼丸(B)色泽的影响
Fig. 4 Effect of different thawing methods on the color of surimi gels (A) and fish balls (B)
由图4B可知,微波解冻组鱼丸白度高于热水解冻组,这是由于在微波解冻下,鱼糜损失率较高,使鱼丸表面光反射增强,随着微波能量的增加,鱼丸表面温度也随之升高,从而导致鱼丸的L*下降。微波解冻能使鱼丸表面光反射增强,因此白度较高。流水解冻组鱼丸白度为91.08,说明流水解冻过程中冰晶会逐渐融化,导致白度升高。空气解冻组L*较低,仅为81.24,可能是由于在解冻的过程中时间较长,发生氧化反应,使其L*降低。解冻速率较快,冰晶形成较小,可能会减少对鱼丸组织的损伤,从而使鱼丸保持较好的L*。鱼糜的总体L*低于鱼丸,白度无明显差异,这可能是由于鱼丸制作过程中添加的蛋清和淀粉使鱼丸的L*和白度整体提高。
2.5 不同解冻方式对鱼糜凝胶和鱼丸TBARS值的影响
TBARS值越大,鱼糜的氧化酸败程度越大,鱼糜中含有较多的脂肪,容易发生氧化,尤其是经过长时间的冷冻保藏,容易造成腐败,损坏鱼糜品质[24-25]。由图5可知,不同解冻方式对鱼糜凝胶和鱼丸TBARS值有一定的影响,差异显著(P<0.05)。鱼糜凝胶在冻藏后进行热水解冻,TBARS值为0.474 mg/kg,这可能是由于热水解冻的水温为50 ℃,这种水温与鱼糜内部温度中和适于脂肪的氧化,从而导致TBARS值增大。低温解冻鱼糜凝胶的TBARS值为0.388 mg/kg,这可能是由于低温解冻长时间处于低温状态,鱼糜在解冻过程中长时间处于不利于油脂氧化的环境中,所以受到的影响最小[24]。由于鱼糜解冻后经过加工制作鱼丸,因此TBARS值变化趋势一致,热水解冻后鱼糜制作的鱼丸TBARS值最大,为0.469 mg/kg,微波解冻组最低,为0.434 mg/kg。总体来说,微波解冻比其他4 种解冻方式能够更有效地降低油脂氧化速率,大大延缓鱼糜腐败进程。
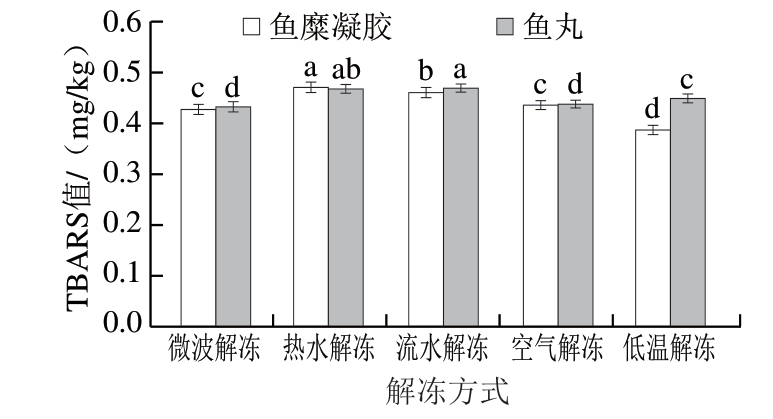
图5 不同解冻方式对鱼糜凝胶和鱼丸TBARS值的影响
Fig. 5 Effects of different thawing methods on the TBARS value of surimi gels and fish balls
2.6 不同解冻方式对鱼糜凝胶解冻损失率和鱼丸蒸煮损失率的影响
由图6可知,不同解冻方式鱼糜凝胶解冻损失率有显著差异(P<0.05),微波解冻鱼糜凝胶解冻损失率最高,为16.9%,低温解冻鱼糜凝胶最低,为8.17%。这可能是由于微波解冻会引起鱼糜凝胶对微波热能吸收不均匀,高温会使蛋白质结构破坏,导致鱼糜凝胶解冻损失率较大[26-27]。低温解冻过程中,鱼糜中的冰晶溶解速率慢,不会对鱼糜组织产生损伤。鱼丸的蒸煮损失率与鱼糜凝胶解冻损失率存在差异,低温解冻组鱼丸的蒸煮损失率为34.93%,显著高于其他各解冻方式(P<0.05)。这可能是由于鱼糜在解冻过程中存在大量的冰水残留,导致鱼丸本身较高的水分含量,制作过程中二次升温又使鱼肉中的水分损失比其他解冻方式较多。热水解冻鱼糜时,水分与鱼糜中的胶质发生结合,因此在二次加热过程中水分损失较小。微波解冻组鱼丸蒸煮损失率为26.5%,由于鱼糜前期解冻破坏了蛋白质结构,造成后期制作的鱼丸中肌原纤维结构性损伤,导致保水性降低,与Backi[28]的结论相似。
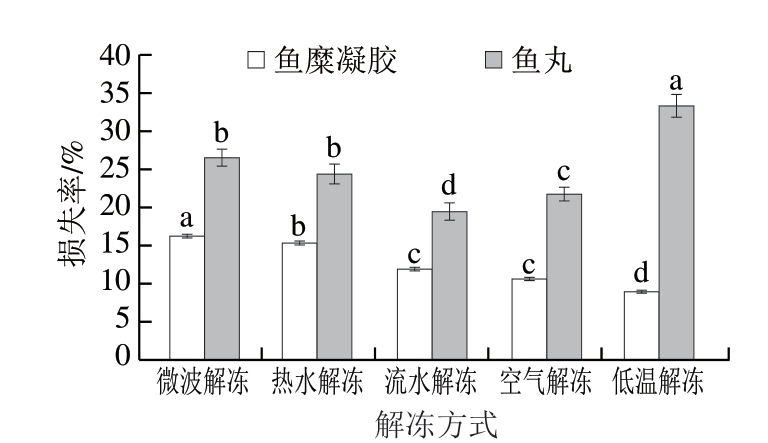
图6 不同解冻方式对鱼糜凝胶解冻损失率和鱼丸蒸煮损失率的影响
Fig. 6 Influence of different thawing methods on the thawing loss rate of surimi gels and the cooking loss rate of fish balls
2.7 不同解冻方式对鱼丸水分含量和pH值的影响
由图7可知,不同解冻方式下制作的鱼丸水分含量差异显著(P<0.05),低温解冻组鱼丸水分质量分数为80.2%,显著高于其他解冻方式(P<0.05),这是由于鱼糜在低温融化后,内部冰晶体会逐渐融化,使其具有较高的水分含量,制作鱼丸过程中又加入适量的葱姜水,并且低温没有破坏鱼糜内部结构,使鱼丸大量吸收水分,水分含量较高。微波解冻组水分质量分数最低,为70.13%,可能是因为鱼糜解冻过程中经过微波的高功率输出损失了较多水分,并且破坏了内部结构,导致鱼丸无法吸收大量水分,致使水分含量低于其他解冻方式。
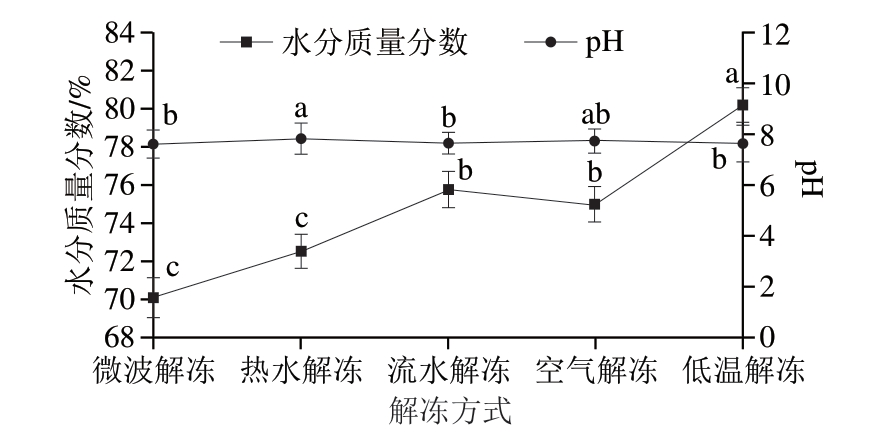
图7 不同解冻方式对鱼丸水分含量和pH值的影响
Fig. 7 Effects of different thawing methods on the water content and pH value of fish balls
热水解冻组鱼丸pH值为7.82,高于空气解冻、微波解冻和低温解冻组。热水解冻过程中会导致蛋白质变性和结构发生变化,使氢离子从液体中逸散[29]。低温解冻组鱼丸pH值为7.63,鱼糜处于较低温度状态下,抑制解冻过程中鱼肉组织细胞中酶的活性,从而维持鱼丸的pH值。
2.8 不同解冻方式对鱼丸感官品质的影响
由图8可知,不同解冻方式对鱼丸感官评分影响较大,差异显著(P<0.05)。低温解冻组感官评分最高,为80,这可能由于在解冻时,鱼糜保留汁液最多,营养成分中鲜味物质流失较少,从而在口感上弹性、滋味最佳,从感官方面气味、组织状态最佳。低温解冻组鱼丸的色泽评价不突出,这可能是由于解冻时间用时最久,在长时间解冻过程中,其难免与空气发生氧化反应,从而降低其色泽。热水解冻组感官评分仅为75,这是由于在解冻过程中,由于水温的上升,使鱼糜中的蛋白质发生变化,并且损失了大量汁液,影响了鱼肉本身的味道。微波解冻组感官评分最低,为72.2,但其色泽在不同解冻方式中最为突出,评分为16.6,这可能是由于微波解冻时间较短,鱼糜与空气接触较少,氧化反应相比较而言也较少。
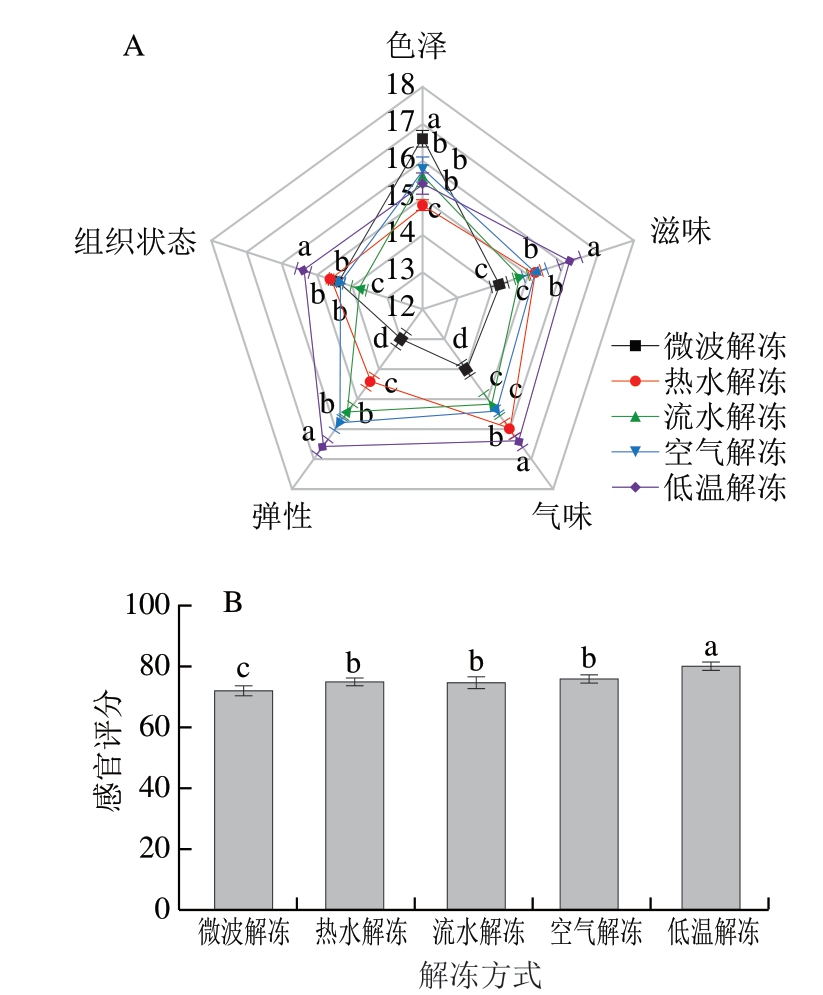
图8 不同解冻方式对鱼丸感官品质的影响
Fig. 8 Effects of different thawing methods on the sensory quality of fish balls
A.感官评分雷达图;B.感官评价总分。
3 结 论
比较微波解冻、热水解冻、流水解冻、空气解冻和低温解冻5 种解冻方式对鱼糜的流变学特性、水分分布、鱼糜凝胶的质构特性、色泽、TBARS值、解冻损失率和鱼丸的水分分布、质构特性、色泽、TBARS值、蒸煮失水率、水分含量、pH值、感官品质的影响,结果表明,微波能实现鱼糜快速解冻,但是会造成大量汁液流失、局部过热,导致鱼糜凝胶的弹性和咀嚼性较差,解冻损失率较高,质地不佳,制作的鱼丸硬度低、弹性差,质地不佳,亮度变暗,pH值和水分含量较低,感官评分最低;低温解冻能够很好地维持鱼糜的凝胶网络结构,有效保持蛋白质不受破坏,蛋白质能够很好地锁住水分,导致自由水流动性较低,解冻损失率和TBARS值较低,鱼糜凝胶质构特性较好。制作的鱼丸弹性和硬度较佳,蒸煮损失率较低,感官评价总分最高;流水解冻可以使鱼糜均匀地解冻,防止部分溶解过快或不彻底,鱼糜凝胶具有较高的弹性,但白度较低,制作的鱼丸弹性较高但其他指标较差,品质一般。因此,通过综合比较,低温解冻是本实验所用的方法中比较适合鱼糜解冻的,制作出的鱼丸品质较佳,但是解冻时间较长,在实际工厂中有一定的应用可能性。
[1] 周枫, 曹蒙, 任梦茹, 等. 基于原花青素-溶菌酶复合保鲜剂对南湾鳙鱼鱼糜贮藏特性分析[J]. 食品科技, 2023, 48(3): 155-161.DOI:10.13684/j.cnki.spkj.2023.03.017.
[2] 杨玲玲, 李飞, 朱静, 等. 茶多酚对南湾鱼肉肠品质的影响[J].现代食品, 2021(7): 200-203. DOI:10.16736/j.cnki.cn41-1434/ts.2021.07.055.
[3] HONG J L, WU J Y, CHEN Y H, et al. Effect of black tea powder on antioxidant activity and gel characteristics of silver carp fish balls[J].Gels, 2023, 9(3): 215. DOI:10.3390/gels9030215.
[4] ZHU J Y, LI S S, YANG L, et al. Effect of multiple freeze-thaw cycles on water migration, protein conformation and quality attri-butes of beef longissimus dorsi muscle by real-time low field nuclear magnetic resonance and Raman spectroscopy[J]. Food Research International,2023, 166: 112644. DOI:10.1016/j.foodres.2023.112644.
[5] LÜ Y, XIE J. Quality of cuttlefish as affected by different thawing methods[J]. International Journal of Food Properties, 2022, 25(1): 33-52. DOI:10.1080/10942912.2021.2019269.
[6] CAI L Y, WAN J L, LI X X, et al. Effects of different thawing methods on physicochemical properties and structure of largemouth bass(Micropterus salmoides)[J]. Journal of Food Science, 2020, 85(3):582-591. DOI:10.1111/1750-3841.15029.
[7] 刘富康, 张柔佳, 李锋, 等. 解冻方式对冷冻鱼糜解冻效果和凝胶特性的影响[J]. 山东农业大学学报(自然科学版), 2019, 50(4): 681-685. DOI:10.3969/j.issn.1000-2324.2019.04.030.
[8] 阳胜男, 牟黠, 赵世林, 等. 电场辅助漂洗对鲢鱼糜组分溶出及凝胶性能的影响[J]. 食品工业科技, 2024, 45(24): 233-242.DOI:10.13386/j.issn1002-0306.2024020072.
[9] 盛倩茹, 王娟. 解冻方式对冷冻鱼丸理化与质构性质的影响[J]. 现代食品科技, 2024, 40(1): 224-232. DOI:10.13982/j.mfst.1673-9078.2024.1.1410.
[10] ZHOU Y G, LIU J J H, KANG Y, et al. Effects of acid and alkaline treatments on physicochemical and rheological properties of tilapia surimi prepared by pH shift method during cold storage[J].Food Research International, 2021, 145: 110424. DOI:10.1016/j.foodres.2021.110424.
[11] JIN H B, CHEN J H, ZHAGN J, et al. Impact of phosphates on heatinduced egg white gel properties: texture, water state, micro-rheology and microstructure[J]. Food hydrocolloids, 2021, 110: 106200.DOI:10.1016/j.foodhyd.2020.106200.
[12] 薛山, 林靖娟. 菊苣多糖对蓝圆鲹鱼丸质构与贮藏品质的影响[J]. 食品与机械, 2024, 40(9): 106-115. DOI:10.13652/j.spjx.1003.5788.2023.80719.
[13] 刘骁, 王营娟, 赵电波, 等. 鹰嘴豆分离蛋白对黄河鲤鱼鱼丸凝胶品质的影响[J]. 食品工业科技, 2020, 41(22): 8-13. DOI:10.13386/j.issn1002-0306.2020050154.
[14] 唐劲松, 陈玉勇, 董志俭, 等. 不同乳化剂对草鱼鱼丸品质及抗冻性能的影响[J]. 食品与生物技术学报, 2019, 38(11): 151-159.DOI:10.3969/j.issn.1673-1689.2019.11.021.
[15] TANG Q, MIAO S, ROOS Y H. Comparative studies of structural and thermal gelation behaviours of soy, lentil and whey protein: a pHdependency evaluation[J]. Food Hydrocolloids, 2024, 146: 109240.DOI:10.1016/j.foodhyd.2023.109240.
[16] 王缓, 王乐姣, 祝媛, 等. 外源添加剂及加工方式对鱼糜凝胶特性的影响研究进展[J]. 粮食科技与经济, 2023, 48(4): 103-108.DOI:10.16465/j.gste.cn431252ts.20230423.
[17] 陈茹. 鲢鱼鱼丸加工过程中品质变化及货架期模型的研究[D].重庆: 西南大学, 2022. DOI:10.27684/d.cnki.gxndx.2022.000290.
[18] LUO H B, GUO C X, LIN L. Combined use of rheology, LF-NMR,and MRI for characterizing the gel properties of hairtail surimi with potato starch[J]. Food and Bioprocess Technology, 2020, 13(4): 637-647. DOI:10.1007/s11947-020-02423-y.
[19] CAO Y, ZHAO L Y, HUANG Q L, et al. Water migration, ice crystal formation, and freeze-thaw stability of silver carp surimi as affected by inulin under different additive amounts and polymerization degrees[J]. Food Hydrocolloids, 2022, 124: 107267. DOI:10.1016/j.foodhyd.2021.107267.
[20] FENG H Y, JIN H, GAO Y, et al. Effects of freeze-thaw cycles on the structure and emulsifying properties of peanut protein isolates[J]. Food Chemistry, 2020, 330: 127215. DOI:10.1016/j.foodchem.2020.127215.
[21] ZHAO X Y, WANG X F, LI X X, et al. Effect of oil modification on the multiscale structure and gelatinization properties of crosslinked starch and their relationship with the texture and microstructure of surimi/starch composite gels[J]. Food Chemistry, 2022, 391: 133236.DOI:10.1016/j.foodchem.2022.133236.
[22] KONG D W, QUAN C L, XI Q, et al. Study on the quality and myofibrillar protein structure of chicken breasts during thawing of ultrasound-assisted slightly acidic electrolyzed water (SAEW)[J].Ultrasonics Sonochemistry, 2022, 88: 106105. DOI:10.1016/j.ultsonch.2022.106105.
[23] 张晓頔. 鱼糜加工副产物水解物改善鱼糜品质及机制研究[D]. 杭州:浙江工商大学, 2022. DOI:10.27462/d.cnki.ghzhc.2022.000539.
[24] SHI R, LI Y, LIU L. Synergistic anti-oxidative and antimicrobial effects of oat phenolic compounds and ascorbate palmitoyl on fish balls during cold storage[J]. Journal of Food Science, 2021, 86(10):4628-4636. DOI:10.1111/1750-3841.15922.
[25] EUGENIOS K, KONSTANTINA Z. Development of a novel steam distillation TBA test for the determination of lipid oxidation in meat products[J]. Foods, 2023, 12(2): 359. DOI:10.3390/foods12020359.
[26] 梁雯雯, 杨天, 郑志红, 等. 升温方式对二段加热鲢鱼糜水分分布和品质的影响[J]. 大连海洋大学学报, 2021, 36(4): 646-652.DOI:10.16535/j.cnki.dlhyxb.2020-221.
[27] LI D N, ZHAO H H, MUHAMMAD A I, et al. The comparison of ultrasound-assisted thawing, air thawing and water immersion thawing on the quality of slow/fast freezing bighead carp (Aristichthys nobilis) fillets[J]. Food Chemistry, 2020, 320: 126614. DOI:10.1016/j.foodchem.2020.126614.
[28] BACKI C J. Methods for (industrial) thawing of fish blocks: a review[J]. Journal of Food Process Engineering, 2018, 41(1): e12598.DOI:10.1111/jfpe.12598.
[29] 牛改改, 秦成丰, 游刚, 等. 解冻方式对近江牡蛎肉感官特征和理化指标的影响[J]. 食品工业科技, 2020, 41(16): 271-278.DOI:10.13386/j.issn1002-0306.2020.16.043.