鱼糜制品具有蛋白质含量高和脂肪含量低等特点,是一类营养价值高、口味多样且低胆固醇食品。鱼糜凝胶性能对于评价鱼糜制品的品质至关重要。然而,鱼糜凝胶在加工和贮藏过程中易出现凝胶强度下降、持水性差和微观结构松散等问题[1]。因此,通过添加外源物质改善鱼糜凝胶的特性已成为提升鱼糜制品品质的关键策略[2]。
天然或改性淀粉已被广泛应用于提高鱼糜产品的凝胶强度、改善质构特性、增强贮藏稳定性和降低成本[3]。淀粉的类型及添加比例对鱼糜凝胶的特性和品质有重要影响。改性淀粉是一系列通过物理、化学或酶加工法获得的淀粉衍生物,其不仅保留了天然淀粉安全、无毒和易降解的特性,还具备改善凝胶性能、增强持水能力和减缓原生淀粉回生的特性[4]。改性淀粉可以更有效地改善鱼糜制品的凝胶性能[5-6]。例如,羟丙基淀粉通过引入亲水基团,增强了淀粉分子和水分子的结合能力,提升了其水合作用,从而改善了鱼丸的持水性[7]。交联淀粉通过提高淀粉糊的黏度,改善了鱼糜制品的凝胶网络结构[8]。
多孔淀粉又称有孔淀粉或微孔淀粉,是指经过物理、化学或酶法制备的一类改性淀粉,其内部具有多孔结构。多孔淀粉的孔洞结构赋予其较大的比表面积和孔体积,进而使多孔淀粉表现出优良的吸水和吸油能力[9]。近年来,这种独特的物理特性使多孔淀粉在提高食品品质方面得到了广泛关注,尤其是在营养物质吸附运载[10]、脂肪替代[11],以及作为食品活性包装成分载体用于抗氧化和抗菌物质的负载[12]等方面。而在众多可制备多孔淀粉的原料中,高直链玉米淀粉作为清洁标签成分,不仅无添加限制,还具有健康益处,且已被证明是制备多孔淀粉的理想原料[13]。高直链玉米淀粉是一种富含膳食纤维的天然原料,它有助于维持肠道健康,降低血糖和胆固醇[14]。在功能性应用方面,高直链玉米淀粉可用于制作低脂食品和功能性食品,改善食品口感和品质,还能作为药物递送的新型载体[15]。然而,目前关于多孔高直链玉米淀粉对鱼糜凝胶性能的影响尚鲜见报道。目前,多种改性方法可被用于制备多孔淀粉,且多孔淀粉的理化性质与其制备方法密切相关。其中,酶法因其温和的反应条件、高催化效率和底物特异性而成为最常用的方法之一[16]。
本研究选择高直链玉米淀粉作为原料,通过预糊化和超声辅助酶解工艺制备多孔高直链玉米淀粉,为深入理解多孔高直链玉米淀粉的微观结构和分子特性,采用激光扫描共聚焦显微镜(用于观察淀粉基质的微观结构)、傅里叶变换红外(Fourier transform infrared,FTIR)光谱(用于探明淀粉分子结构的变化)、X射线衍射(X-ray diffraction,XRD,用于测定淀粉基质的晶体结构)、差示扫描量热仪(differential scanning calorimeter,DSC,用于探究淀粉热特性变化)对制备的多孔高直链玉米淀粉进行表征。此外,将高直链玉米淀粉应用于鱼糜制品的加工过程中,系统探讨添加不同水平的多孔高直链玉米淀粉对鱼糜凝胶的持水性、凝胶强度、质构特性和水分分布的影响,以评估多孔高直链玉米淀粉对鱼糜制品品质的改善效果。旨在为制备高直链淀粉提供新的见解,对设计和开发高直链淀粉及其在食品工业中的高值化应用具有重要意义。
1 材料与方法
1.1 材料与试剂
高直链玉米淀粉(碘比色法测得直链淀粉质量分数为67.1%) 上海科赫生物科技有限公司;磷酸盐缓冲液德国默克集团;α-淀粉酶(酶活力1.6 U/mg) 上海易恩化学技术有限公司;鲢鱼鱼糜 洪湖市井力水产食品股份有限公司;异硫氰酸荧光素(fluorescein isothiocyanate,FITC) 西格玛奥德里奇(上海)贸易有限公司;所用化学试剂均为分析纯;实验用水均为去离子水。
1.2 仪器与设备
TCS SP5激光扫描共聚焦显微镜 德国Carl Zeiss AG公司;Nicolet is50 FTIR光谱仪 美国Thermo Fisher Scientific公司;D8 ADVANCE XRD仪(配备波长0.154 05 nm的Cu Kα1辐射源(电压30 kV、电流40 mA)) 德国Bruker公司;3500 DSC 德国Netzsch公司;TA.XT Plus食品物性测试仪 英国Stable Micro Systems公司;NMI20-060VJS-I低场核磁共振分析仪苏州纽迈分析仪器股份有限公司;CR-400色差仪 日本柯尼卡美能达株式会社。
1.3 方法
1.3.1 多孔高直链玉米淀粉的制备
参考Wang Hualin等[17]的方法并稍作修改。将高直链玉米淀粉(4.0 g)与20 mL水(95 ℃)混匀,置于50 mL试管,并将其置于水浴锅中(200 r/min、95 ℃)预糊化20 min。预糊化完成后,将试管冷却至室温,离心(3 000 r/min、10 min)去除上清液,然后加入19 mL磷酸盐缓冲液(pH 7.0~7.2),混合均匀,接着加入1 mL淀粉酶溶液(1 000 mg α-淀粉酶溶解在4 mL磷酸盐缓冲液中),再次混合均匀。将混合的淀粉和淀粉酶溶液超声(180 W)分散10 min,随后45 ℃、200 r/min磁力搅拌1.5 h。酶解结束后,加入10 mL 0.5 mol/L碳酸钠溶液以灭活α-淀粉酶,然后离心(3 000 r/min、5 min),弃上清液,接着向试管中加入10 mL去离子水,3 000 r/min离心5 min进行洗涤,洗涤步骤重复3 次。最后,将样品在-20 ℃预冻,并进行冷冻干燥,得到多孔高直链玉米淀粉。
1.3.2 淀粉的激光扫描共聚焦显微镜观察
使用激光扫描共聚焦显微镜观察多孔高直链玉米淀粉的形态。制备0.2 g/100 mL的FITC-乙醇溶液,加入0.1 mL上述染料溶液至10 mg淀粉样品中,室温下染色2 h。染色后的淀粉样品5 000 r/min离心1 min,随后用去离子水冲洗,去除多余的染料。最后,在488 nm激发波长下进行观察。
1.3.3 淀粉的FTIR光谱测定
参考Warren等[18]的方法,使用内置ATR附件的FTIR光谱仪分析多孔高直链玉米淀粉样品。扫描次数128,扫描范围4 000~400 cm-1,分辨率1 cm-1。在标准正态变量归一化后绘制光谱。计算1 047、1 022 cm-1处的吸收峰强度之比(R1047/1022),以表示淀粉的短程有序结构[19]。
1.3.4 淀粉的XRD测定
使用XRD仪,在室温下以0.6 s/步的扫描速率、2θ 3°~32°的衍射角范围和0.01°的步距进行测定。使用Jade 6.5程序分析衍射图案并计算总峰面积和结晶区面积,以结晶区面积与总峰面积的比表示相对结晶度[20]。
1.3.5 淀粉的DSC测定
将淀粉样品(5.0 mg,干质量)置于铝锅中,加入10 μL水,混合并密封。加热程序:以5 ℃/min从20 ℃升温至120 ℃(该温度范围内可使淀粉完全糊化)。
1.3.6 淀粉的吸水性测定
参照Li Peilong等[21]的方法并稍作修改。将1.0 g淀粉样品(m1/g)置于15 mL离心管,加入10 mL去离子水并充分搅拌,确保淀粉均匀分散。将该混合溶液离心(4 000 r/min、10 min)后,小心地倒出上清液,或用移液枪沿试管侧壁缓慢吸出水分,称量沉淀物质量(m2/g),淀粉样品吸水性按式(1)计算:
1.3.7 鱼糜凝胶制备
参考闫丹等[22]的方法,将41.2 g食盐溶于325 mL蒸馏水中制成溶液,放置于4 ℃冰箱预冷一夜,称取1 000 g鱼糜放置于4 ℃冰箱解冻一夜。称取200 g鱼糜,于斩拌机中空斩1 min,加入65 mL食盐溶液盐斩2 min,分别添加质量分数为1%的高直链玉米淀粉及质量分数为1%、2%、3%的多孔高直链玉米淀粉,根据原料的水分含量补充适量蒸馏水调节水分质量分数为78%,斩拌2 min后进行抽真空、塑料肠衣灌肠和密封。二段式加热形成凝胶(40 ℃水浴加热30 min,90 ℃水浴加热20 min),于冰水中冷却,随后将凝胶样品置于4 ℃冰箱保存备用。整个斩拌过程中,温度控制在5 ℃以下。以不添加淀粉样品的鱼糜凝胶作为空白组。
1.3.8 鱼糜凝胶质构特性测定
将鱼糜凝胶平衡至室温后,吸干表面水分,切成20 mm×20 mm×20 mm的正方体,用食品物性测试仪测定其质构特性。参数设定:探头类型P/50,测前速率1.5 mm/s,测试速率1.5 mm/s,测后速率4.5 mm/s,测试距离5 mm,2 次压缩间隔时间5.0 s,触发类型为自动,触发力5 g,每组设置3 个平行,每个样品重复测定3 次,取平均值。
1.3.9 鱼糜凝胶强度测定
参考张雅琦等[23]的方法,将制备的鱼糜凝胶样品在室温下平衡30 min,并切成2.5 cm高的圆柱体。使用食品物性测试仪进行测定,探头型号P/5S,压缩距离10.0 mm,触发力10.0 g,记录样品凝胶强度。每组样品设置3 个平行。
1.3.10 鱼糜凝胶持水性测定
参照张雅琦等[23]的方法并稍加修改。将鱼糜凝胶样品切成5 mm的厚片,用3 层滤纸包裹,5 000 r/min离心15 min。鱼糜凝胶离心前质量记为m3/g,离心后质量记为m4/g。每组样品平行测定3 次,结果取平均值。持水性按式(2)计算:
1.3.11 鱼糜凝胶白度测定
将样品切成直径2 cm的圆柱体,采用色差仪测定凝胶色度[24],记录亮度值(L*)、红度值(a*)、黄度值(b*)。白度按式(3)计算:
1.3.12 鱼糜凝胶低场核磁共振测定
参考Zhang Chang等[25]的方法并稍加修改。取鱼糜凝胶切成直径20 mm的圆柱体,擦干其表面水分,用无核磁弛豫信号的保鲜膜包裹后放置于70 mm磁体线圈管中测定,每个测试至少进行3 个重复。质子共振频率为21 MHz,磁体温度为32 ℃。利用CPMG(Carr-Purcell-Meiboom-Gill)脉冲序列测定样品横向弛豫时间(T2)。CPMG脉冲序列参数:采样频率200 kHz,模拟增益20,脉冲宽度1=18 μs,数字增益3,脉冲重复间隔2 μs,重复采样间隔时间2 500 ms,累加次数8,脉冲宽度2=36 μs,回波时间0.3 ms,回波个数8 000。
1.4 数据处理
所有实验中,每个样品至少测定3 次。使用SPSS 19.0软件对数据进行方差分析,采用Duncan多重比较检验差异显著性,P<0.05为差异显著。采用Excel软件作图。
2 结果与分析
2.1 淀粉的表征
2.1.1 淀粉的微观形态
激光扫描共聚焦显微镜图像可以反映淀粉颗粒的形态和内部结构。如图1所示,天然高直链玉米淀粉为球状或椭状的颗粒,表面较光滑,具有细小孔隙。这些孔隙与酶促反应过程中酶与淀粉颗粒的相互作用有关[26]。经α-淀粉酶水解后,淀粉颗粒表面出现破损,内部孔洞尺寸增加,颗粒损伤程度加剧,最终使淀粉颗粒内部区域被水解,形成较大的空腔结构。这一现象可归因于酶解作用导致部分淀粉发生深度水解,进而在颗粒表面形成较大的孔洞。这表明高直链玉米淀粉在α-淀粉酶的作用下可以制备出多孔高直链玉米淀粉。随着孔洞的扩大和相互连通,引发淀粉颗粒结构的部分坍塌。有研究[26]指出,α-淀粉酶作为一种内切淀粉酶,主要作用于淀粉分子内部的α-1,4-糖苷键,尤其是那些距离α-1,6-糖苷键较远的键。该酶能够任意切断淀粉分子链上的α-1,4-糖苷键,改变淀粉颗粒上的孔隙大小。这与Han Xiuying等[27]的研究结果类似。尽管如此,淀粉颗粒的整体完整性仍得以保持,这很可能是由于淀粉颗粒在预糊化过程中发生了溶胀,从而缓解了结构坍塌倾向。相较于天然淀粉,具有这些孔隙结构的多孔高直链玉米淀粉将展现出显著提升的吸附性能。

图1 高直链玉米淀粉(A)和多孔高直链玉米淀粉(B)的激光扫描共聚焦显微镜图像
Fig. 1 Laser scanning confocal micrographs of high-amylose maize starch (A) and porous high-amylose maize starch (B)
下标1.荧光通道;下标2.光学通道;虚线框表示有多孔裂缝的淀粉颗粒。
2.1.2 淀粉的短程有序结构
由图2A可知,多孔高直链玉米淀粉的FTIR光谱图与天然淀粉相似,在特征吸收峰上未发现明显差异,这表明,糊化和酶解处理没有改变淀粉的基本化学结构。1 047、1 022 cm-1处的吸收峰与淀粉的有序结构和无序结构相关,R1047/1022可以反映淀粉分子的短程有序度[28]。与天然淀粉(0.920 0±0.001 9)相比,多孔高直链玉米淀粉R1047/1022(0.900 00±0.000 76)明显降低,这说明多孔高直链玉米淀粉的短程有序度下降。这可能与淀粉在糊化过程中晶体结构被部分破坏有关,也可能是因为酶解过程中淀粉表面产生的孔隙导致淀粉颗粒致密度降低[29]。这与Wang Hualin等[17]通过预糊化酶解制备的多孔高直链玉米淀粉R1047/1022也呈现下降趋势的结果相似。
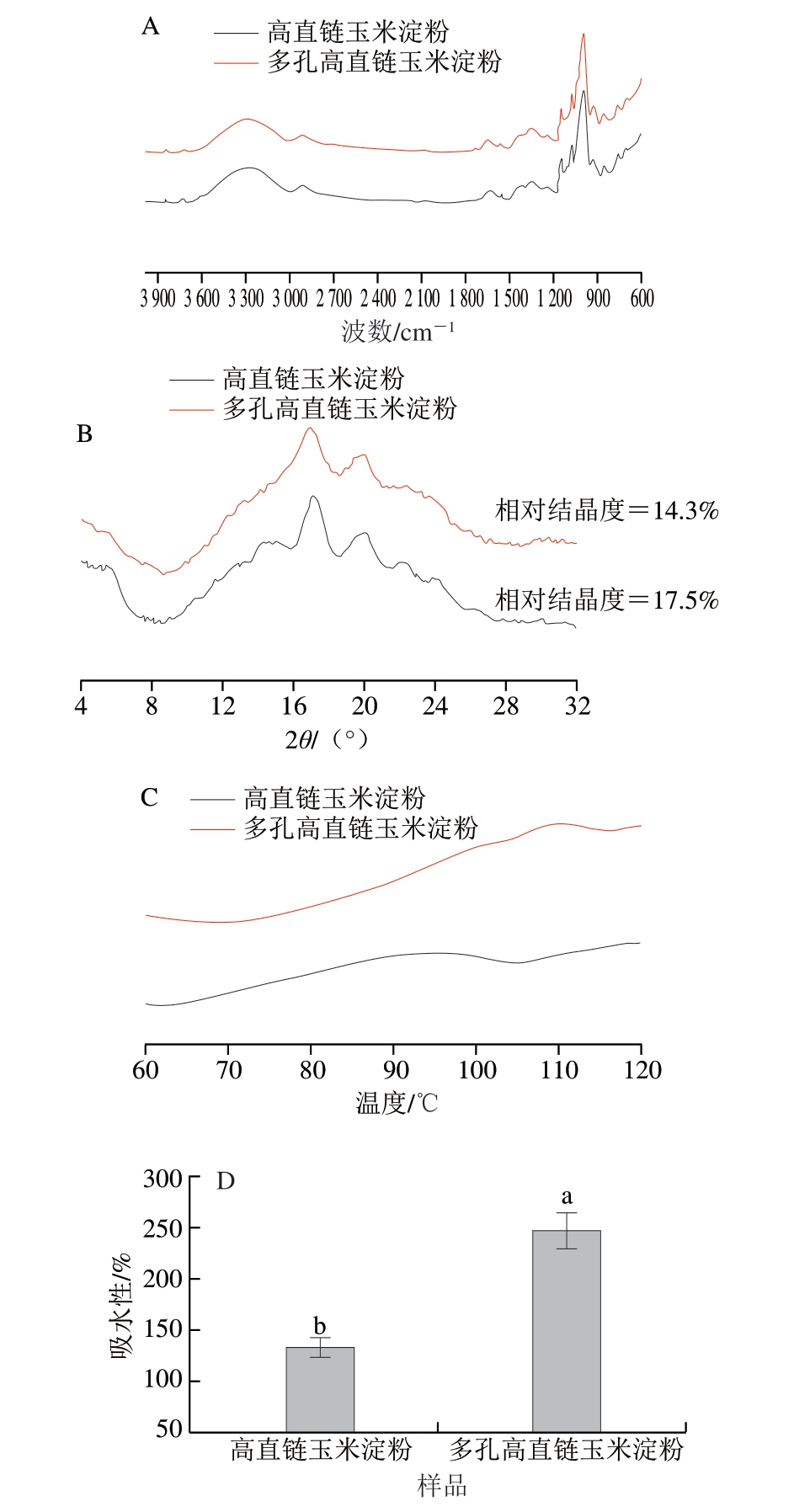
图2 高直链玉米淀粉和多孔高直链玉米淀粉的结构和理化性质
Fig. 2 Structure and physicochemical properties of high-amylose maize starch and porous high-amylose maize starch
A. FTIR光谱图;B. XRD图;C. DSC图;D.吸水性。小写字母不同表示差异显著(P<0.05)。图3同。
2.1.3 淀粉的晶体结构
如图2B所示,高直链玉米淀粉XRD图谱在2θ 5.5°、15°、17°、20°和23°处表现出强烈的衍射峰,这是典型的B型结晶结构。改性后获得的多孔高直链玉米淀粉样品的XRD曲线2θ 5.5°、15°和24°处衍射峰的消失,并伴随其相对结晶度从未改性淀粉的17.5%降至14.3%。预糊化和酶解改性后,淀粉的相对结晶度下降,这一结果与FTIR光谱分析结果相符。多孔高直链玉米淀粉相对结晶度的降低可能是由于淀粉预糊化处理时,淀粉颗粒受热导致结晶结构被破坏,晶体有序化程度降低,导致淀粉由晶态向非晶态转变[30]。也可能是由于在超声酶解过程中,水分子进入淀粉颗粒并导致其膨胀,这一行为可能对淀粉颗粒的相邻微晶施加张力,淀粉分子的邻近晶体区域在张力作用下易发生扭曲,导致双螺旋区域展开或解离,从而破坏淀粉的晶体结构[31]。
2.1.4 淀粉的热特性
如图2C所示,在测试温度范围内,高直链玉米淀粉的曲线相对平稳,没有明显的放热或吸热峰,这可能表明其在测试条件下具有较好的热稳定性。相比之下,多孔高直链玉米淀粉样品在高温下显示出更明显的热流变化,这可能表明它在高温下更容易发生热转变。这种差异可能与糊化及酶解过程引起的相对结晶度降低有关。与天然淀粉相比,多孔高直链玉米淀粉的热吸收峰后移,这一结果表明多孔高直链玉米淀粉的热稳定性提高。这可能是由于淀粉分子间的相互作用或分子重组作用增强,导致熔融温度升高。
2.1.5 淀粉的吸水性
由图2D可知,相较于高直链玉米淀粉,多孔高直链玉米淀粉的吸水性提升至247.4%。这一结果可能是由于酶解作用改变了淀粉颗粒的结构,增加了颗粒的孔隙率和表面积,有利于水分子进入多孔高直链玉米淀粉表面,从而提高了其吸水性。Nadaf等[32]的研究同样制备了多孔高直链玉米淀粉,其吸水性也呈增加趋势。预糊化时,有限的溶胀促进水分子扩散到淀粉基质中[17],因此多孔高直链玉米淀粉表现出比未改性淀粉更强的吸水性。
2.2 鱼糜凝胶的质构特性和凝胶强度
如表1所示,添加了高直链玉米淀粉和多孔高直链玉米淀粉鱼糜凝胶的凝胶强度均明显高于空白组。当多孔高直链玉米淀粉的添加量为3%时,鱼糜凝胶的凝胶强度达到最大值,相较于空白组提高约11.2%。当淀粉加热时,许多变化(包括颗粒膨胀、黏度增加和颗粒碎片化)同时或连续发生[33]。Kim[34]、Verrez-Bagnis[35]等将鱼糜凝胶中淀粉颗粒的凝胶增强作用归因于其溶胀能力,这种溶胀能力对蛋白质基质施加压力,使鱼糜凝胶中的网络结构更加紧密,凝胶强度增加。因此,淀粉的溶胀能力与其对鱼糜凝胶质地特性的影响之间可能存在相关性。一般来说,淀粉颗粒的溶胀会导致凝胶基质更紧凑,凝胶强度增加。已有研究[34]表明,添加淀粉的鱼糜凝胶强度的变化可能与蛋白质基质密度的差异有关,这一结论已通过光学显微镜和电子显微镜的观察得到证实。多孔高直链玉米淀粉由于其更多的孔隙结构而具备更大的表面积,可能会增加其与鱼糜中蛋白质分子之间的交联作用。这种交联作用能够促进凝胶网络的形成,从而增加凝胶的强度。
表1 高直链玉米淀粉和多孔高直链玉米淀粉对鱼糜凝胶强度和质构特性的影响
Table 1 Effects of high-amylose maize starch and porous high-amylose maize starch on gel strength and texture properties of surimi
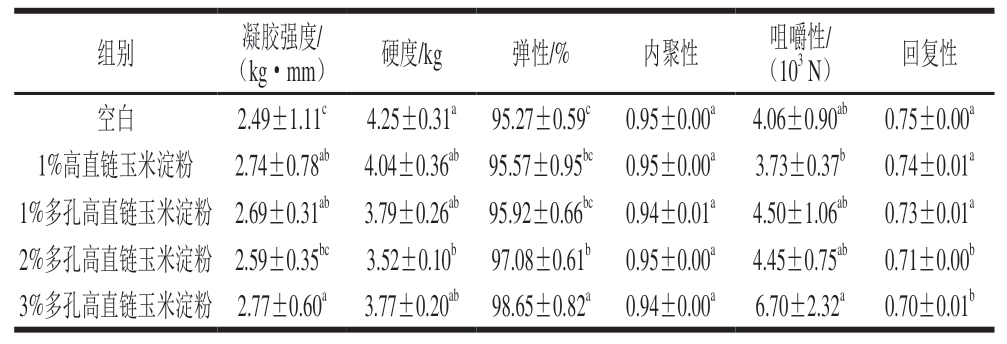
注:同列小写字母不同表示差异显著(P<0.05)。
组别凝胶强度/(kg·mm)硬度/kg弹性/%内聚性咀嚼性/(103 N)回复性空白2.49±1.11c4.25±0.31a 95.27±0.59c 0.95±0.00a4.06±0.90ab0.75±0.00a 1%高直链玉米淀粉2.74±0.78ab 4.04±0.36ab 95.57±0.95bc 0.95±0.00a3.73±0.37b0.74±0.01a 1%多孔高直链玉米淀粉 2.69±0.31ab 3.79±0.26ab 95.92±0.66bc 0.94±0.01a4.50±1.06ab0.73±0.01a 2%多孔高直链玉米淀粉 2.59±0.35bc3.52±0.10b 97.08±0.61b 0.95±0.00a4.45±0.75ab0.71±0.00b 3%多孔高直链玉米淀粉 2.77±0.60a3.77±0.20ab 98.65±0.82a 0.94±0.00a6.70±2.32a0.70±0.01b
添加高直链玉米淀粉和多孔高直链玉米淀粉后,鱼糜凝胶的硬度较空白组降低。与空白组相比,添加多孔高直链玉米淀粉鱼糜凝胶的咀嚼性和弹性均有提高。具体而言,当添加量为3%时,鱼糜凝胶的咀嚼性和弹性均达到最大值,分别比空白组提高65.0%和3.5%。随着多孔高直链玉米淀粉含量的增加,凝胶的弹性和咀嚼性有不同程度的增强,这可能是因为多孔高直链玉米淀粉添加量的增加导致每单位体积淀粉分子间氢键含量增加,从而产生牢固而致密的网络结构[36]。这可能是由于多孔高直链玉米淀粉的多孔结构有助于蛋白质网络的弹性恢复,从而提高了凝胶的弹性。高直链玉米淀粉和多孔高直链玉米淀粉对鱼糜凝胶的内聚性无显著影响,但添加2%和3%多孔高直链玉米淀粉鱼糜凝胶的回复性显著低于空白组(P<0.05),这可能是由于多孔高直链玉米淀粉的高吸水性导致凝胶网络结构中的水分含量增加,使网络结构在受力后更难恢复到原始状态[37]。先前的研究[6]也表明,添加淀粉可以产生更致密的网络结构并改善鱼糜凝胶的质构特性。此外,有研究[38]发现,鱼糜凝胶质构特性的改善可能是由于水胶体通过静电相互作用在鱼糜蛋白中起到黏结或填充作用。质构特性分析结果表明,不同添加比例的多孔高直链玉米淀粉对鱼糜凝胶质构特性的影响不同。其中,添加3%多孔高直链玉米淀粉对鲢鱼鱼糜凝胶品质的改善效果最为明显。
2.3 鱼糜凝胶的持水性
持水性是衡量鱼糜凝胶品质的一个重要物理参数,主要反映宏观尺度下鱼糜凝胶的水分保持能力。凝胶的持水能力与其结构有关,凝胶网络结构越致密,其固定的水分越多。由图3可知,添加多孔高直链玉米淀粉提高了鱼糜凝胶的持水性。这可能是因为多孔高直链玉米淀粉的高吸水性促进鱼糜凝胶形成更加致密和均匀的网络结构,从而进一步增强其持水性。有研究[39]指出,添加淀粉的鱼糜在加热形成凝胶时,鱼糜中的蛋白质与水分子相互作用,同时淀粉吸收水分后膨胀,两者协同构建形成更加稳固的凝胶网络。这一过程有助于锁住凝胶网络结构内的水分,从而提升鱼糜凝胶的持水性。因此,在鱼糜中添加淀粉可以提高其凝胶持水性,获得良好的保水效果,从而改善鱼糜凝胶的品质。这与先前的研究[40]结果相似,即通过添加天然或改性淀粉可以提高鱼糜凝胶的持水性。鱼糜凝胶的持水性与其微观结构密切相关。一般表现为持水性好的鱼糜凝胶具有更致密和稳定的微观网络结构,这种结构特性能够增强其抵抗外界压力的能力。
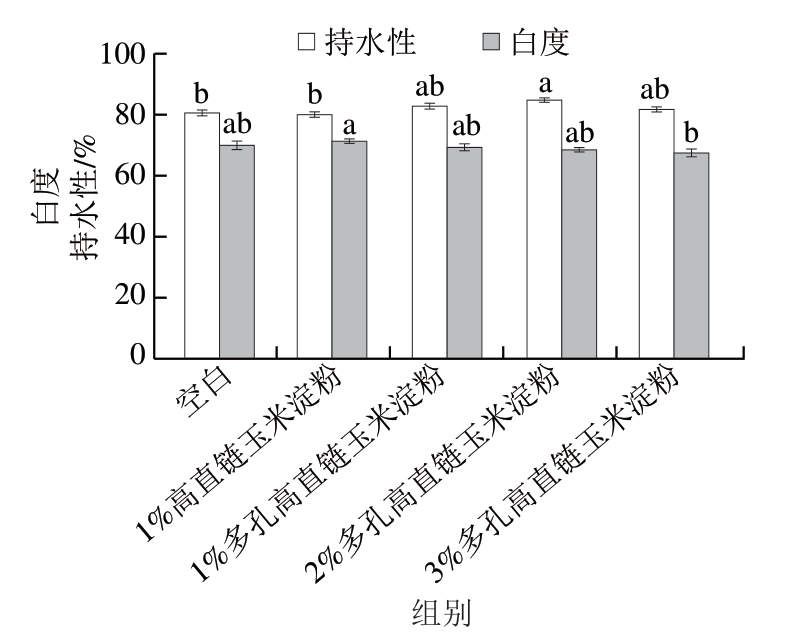
图3 高直链玉米淀粉和多孔高直链玉米淀粉对鱼糜凝胶持水性和白度的影响
Fig. 3 Effect of high-amylose maize starch and porous high-amylose maize starch on water-holding capacity and whiteness of surimi gels
2.4 鱼糜凝胶的白度
如图3所示,当向鱼糜凝胶中添加1%高直链玉米淀粉时,鱼糜凝胶的白度明显高于空白组。白度作为重要的感官指标之一,其提升可提高鱼糜产品的消费者接受度。然而,随着多孔高直链玉米淀粉添加量的增加,其对鱼糜凝胶白度的负面影响增加。当多孔高直链玉米淀粉的添加量增加至3%,与空白组相比,鱼糜凝胶的白度明显降低。原因可能有以下几点:首先,多孔高直链玉米淀粉是经过酶解处理获得的,相较于未改性淀粉,其白度可能较低;其次,鲢鱼鱼糜本身白度较高,添加多孔高直链玉米淀粉可能对鱼糜凝胶的白度产生负面影响;此外,多孔淀粉具有较高的比表面积,能够更有效地分散和吸附色素或其他影响白度的物质,从而降低凝胶的白度。
2.5 鱼糜凝胶的水分分布
如图4所示,在T2范围内出现2 个峰,其中,T22位于10~150 ms之间,代表鱼糜凝胶中存在于蛋白组织结构中的水分,属于不易流动水,T23位于150~1 250 ms之间,代表在凝胶网络结构外的水分,属于自由水[41]。
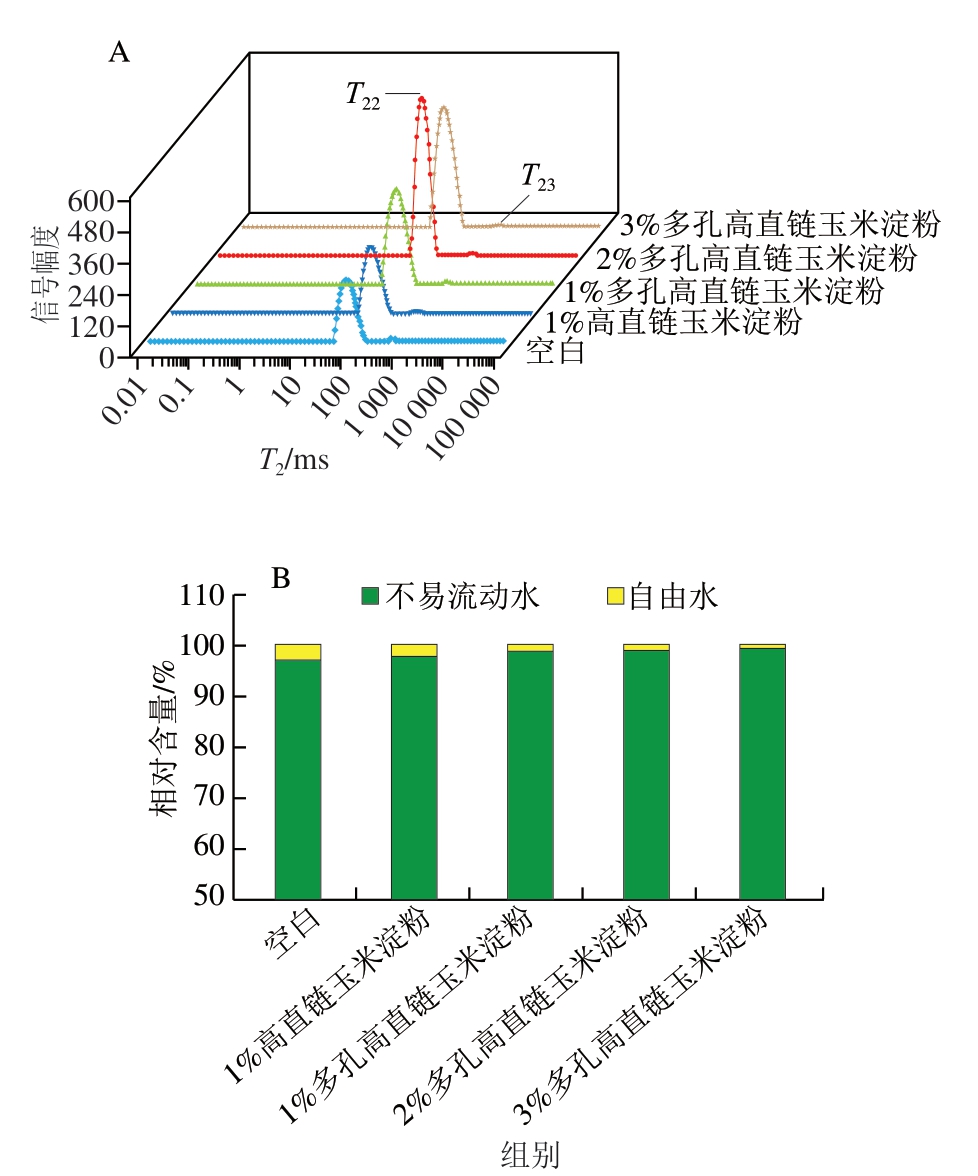
图4 高直链玉米淀粉和多孔高直链玉米淀粉对鱼糜凝胶水分分布(A)和水分相对含量(B)的影响
Fig. 4 Effects of high-amylose maize starch and porous high-amylose maize starch starch on water distribution (A) and water relative content (B) of surimi gels
添加高直链玉米淀粉及多孔高直链玉米淀粉后,鱼糜凝胶中不易流动水相对含量均明显增加。添加1%高直链玉米淀粉后,鱼糜凝胶的不易流动水相对含量从空白组的97.08%增加至97.76%。值得注意的是,当添加1%多孔高直链玉米淀粉时,其不易流动水相对含量进一步提升至98.75%,且在添加量为3%时达到最大值,为99.38%。这可能归因于淀粉颗粒在加热糊化过程中吸收水分并膨胀,填充于鱼糜凝胶的网络结构中,从而增强了凝胶网络结构的紧密性[41]。这种结构的致密化有助于截留更多的水分,使原本自由流动的水分子转变为与凝胶基质结合更紧密的不易流动水。此外,添加3%多孔高直链玉米淀粉对鱼糜凝胶中不易流动水相对含量的增加效果更为显著,表明多孔高直链玉米淀粉的加入抑制了组织中的不易流动水向自由水转化,减少鱼糜的水分流失,说明在该条件下形成的凝胶网络中,蛋白质和水分子的相互作用更加紧密,进而减弱了水分子的流动性。不易流动水相对含量的增加有助于提高鱼糜凝胶的稳定性、改善其质构特性,使凝胶结构更为致密,从而提升鱼糜制品的整体品质。Mi Hongbo等[42]的研究也得到相似的结论,添加高直链玉米淀粉鱼糜凝胶的凝胶网络更加均匀、紧凑和致密,这种结构特性导致凝胶体系中不易流动水相对含量增加。与添加多孔高直链玉米淀粉相比,加入高直链玉米淀粉的鱼糜凝胶不易流动水相对含量变化较小,与持水性结果相符。
3 结 论
本研究通过预糊化和酶解处理制备了多孔高直链玉米淀粉。结构表征结果表明,与高直链玉米淀粉相比,多孔高直链玉米淀粉的短程有序度和相对结晶度降低,同时吸水性提升至247.4%。将高直链玉米淀粉和多孔高直链玉米淀粉应用于鲢鱼鱼糜凝胶,发现与空白组相比,添加1%高直链玉米淀粉明显提升了凝胶强度和不易流动水相对含量;与添加1%高直链玉米淀粉组相比,添加1%多孔高直链玉米淀粉进一步提升了鱼糜凝胶的不易流动水相对含量,同时咀嚼性和持水性也呈上升趋势。此外,当多孔高直链玉米淀粉添加量为3%时,鱼糜凝胶的咀嚼性达到最大值,与空白组相比,咀嚼性提高约65.0%。本研究结果不仅为鱼糜凝胶的品质改良提供了新的策略,也为高直链淀粉的高值化利用开辟了新途径。未来的研究可进一步优化多孔高直链玉米淀粉的制备工艺,并评估其在多样化食品系统中的潜在应用。
[1] 高翔, 王蕊, 刘后祥. 低值淡水鱼鱼糜制品凝胶强度的研究[J]. 食品与发酵工业, 2010, 36(6): 53-56. DOI:10.13995/j.cnki.11-1802/ts.2010.06.035.
[2] 王丽丽, 杨文鸽, 徐大伦, 等. 外源添加物对鱼糜及其制品凝胶性能影响的研究[J]. 核农学报, 2015, 29(10): 1985-1990.
[3] 柳丽宁, 翁武银, 大迫一史. 淀粉和鱼糜品质对鱼糜凝胶性质的影响[J]. 食品工业科技, 2016, 37(11): 80-84; 88. DOI:10.13386/j.issn1002-0306.2016.11.008.
[4] 肖志刚, 邵晨, 杨柳, 等. 淀粉改性方法的研究现状及进展[J].农产品加工, 2020(3): 81-84; 88. DOI:10.16693/j.cnki.1671-9646(X).2020.02.021.
[5] 周秀琴. 马铃薯淀粉和玉米淀粉混合能提高水产制品的凝胶强度[J].食品研究与开发, 1988, 9(1): 62.
[6] 周蕊, 曾庆孝, 朱志伟, 等. 淀粉对罗非鱼鱼糜凝胶品质的影响[J].现代食品科技, 2008, 24(8): 759-762; 772.
[7] 孔刘娟, 梁艳, 檀琮萍, 等. 羟丙基木薯淀粉对冷冻鱼丸水分特性的影响[J]. 中国食品添加剂, 2016, 27(4): 122-126.
[8] 米红波, 王聪, 仪淑敏, 等. 淀粉在鱼糜制品中的应用研究进展[J]. 食品与发酵工业, 2018, 44(1): 291-295. DOI:10.13995/j.cnki.11-1802/ts.014480.
[9] LIN Y J, LIU L, LI L X, et al. Properties and digestibility of a novel porous starch from Lotus seed prepared via synergistic enzymatic treatment[J]. International Journal of Biological Macromolecules,2022, 194: 144-152. DOI:10.1016/j.ijbiomac.2021.11.196.
[10] JIANG S W, YU Z Y, HU H L, et al. Adsorption of procyanidins onto chitosan-modified porous rice starch[J]. LWT-Food Science and Technology, 2017, 84: 10-17. DOI:10.1016/j.lwt.2017.05.047.
[11] 钱和, 朱仁宏, 姚卫蓉, 等. 多孔淀粉在低脂贡丸中的代脂研究[J]. 食品科技, 2005, 30(2): 67-70. DOI:10.3969/j.issn.1005-9989.2005.02.022.
[12] MIAO Z K, ZHANG Y F, LU P F. Novel active starch films incorporating tea polyphenols-loaded porous starch as food packaging materials[J]. International Journal of Biological Macromolecules,2021, 192: 1123-1133. DOI:10.1016/j.ijbiomac.2021.09.214.
[13] LI Z T, QIU D, WANG Y J, et al. Preparation and characterization of porous high-amylose corn starch[J]. Starch-Stärke, 2024, 76(3/4):2300091. DOI:10.1002/star.202300091.
[14] ZHU Z J, BAO S N, DU K, et al. Controlling high amylose corn starch modulates the structural features and digestive properties of rice noodles[J]. LWT-Food Science and Technology, 2024, 209: 116731.DOI:10.1016/j.lwt.2024.116731.
[15] 潘雯丽, 梁倩, 高群玉. 高直链玉米淀粉在食品、食品材料及保健食品中的应用进展[J]. 食品工业科技, 2022, 43(21): 396-404.DOI:10.13386/j.issn1002-0306.2021100231.
[16] HJ LATIP D N, SAMSUDIN H, UTRA U, et al. Modification methods toward the production of porous starch: a review[J]. Critical Reviews in Food Science and Nutrition, 2021, 61(17): 2841-2862.DOI:10.1080/10408398.2020.1789064.
[17] WANG H L, LÜ J, JIANG S W, et al. Preparation and characterization of porous corn starch and its adsorption toward grape seed proanthocyanidins[J]. Starch-Stärke, 2016, 68(11/12): 1254-1263.DOI:10.1002/star.201600009.
[18] WARREN F J, GIDLEY M J, FLANAGAN B M. Infrared spectroscopy as a tool to characterise starch ordered structure: a joint FTIR-ATR, NMR, XRD and DSC study[J]. Carbohydrate Polymers,2016, 139: 35-42. DOI:10.1016/j.carbpol.2015.11.066.
[19] ZHANG B, WANG K, HASJIM J, et al. Freeze-drying changes the structure and digestibility of B-polymorphic starches[J]. Journal of Agricultural and Food Chemistry, 2014, 62(7): 1482-1491.DOI:10.1021/jf405196m.
[20] KOMIYA T, NARA S. Changes in crystallinity and gelatinization phenomena of potato starch by acid treatment[J]. Starch-Stärke, 1986,38(1): 9-13. DOI:10.1002/star.19860380104.
[21] LI P L, KIERULF A, ABBASPOURRAD A. Application of granular cold-water-swelling starch as a clean-label oil structurant[J].Food Hydrocolloids, 2021, 112: 106311. DOI:10.1016/j.foodhyd.2020.106311.
[22] 闫丹, 孔云菲, 孙英明, 等. 动物肝脏均质液的添加对鱼糜凝胶特性的影响[J]. 食品工业科技, 2023, 44(12): 55-61. DOI:10.13386/j.issn1002-0306.2022080278.
[23] 张雅琦, 徐万军, 詹帅, 等. 鱼肉僵直阶段及盐含量对白鲢鱼糜凝胶特性的影响[J]. 肉类研究, 2025, 39(1): 18-24. DOI:10.7506/rlyj1001-8123-20240819-212.
[24] 刘钰琪, 陈澄, 陈周, 等. 酵母提取物对鱼糜凝胶品质的影响[J]. 肉类研究, 2019, 33(5): 1-6. DOI:10.7506/rlyj1001-8123-20190313-053.
[25] ZHANG C, HE Y, ZHENG Y, et al. Effect of carboxymethyl cellulose(CMC) on some physico-chemical and mechanical properties of unrinsed surimi gels[J]. LWT-Food Science and Technology, 2023,180: 114653. DOI:10.1016/j.lwt.2023.114653.
[26] JUNG Y S, LEE B H, YOO S H. Physical structure and absorption properties of tailor-made porous starch granules produced by selected amylolytic enzymes[J]. PLoS ONE, 2017, 12(7): e0181372.DOI:10.1371/journal.pone.0181372.
[27] HAN X Y, WEN H L, LUO Y, et al. Effects of α-amylase and glucoamylase on the characterization and function of maize porous starches[J]. Food Hydrocolloids, 2021, 116: 106661. DOI:10.1016/j.foodhyd.2021.106661.
[28] LU H, M A R R, CHANG R R, et al. Evaluation of starch retrogradation by infrared spectroscopy[J]. Food Hydrocolloids, 2021,120: 106975. DOI:10.1016/j.foodhyd.2021.106975.
[29] ZHANG B, CUI D P, LIU M Z, et al. Corn porous starch: preparation,characterization and adsorption property[J]. International Journal of Biological Macromolecules, 2012, 50(1): 250-256. DOI:10.1016/j.ijbiomac.2011.11.002.
[30] WANG S J, ZHANG X, WANG S, et al. Changes of multi-scale structure during mimicked DSC heating reveal the nature of starch gelatinization[J]. Scientific Reports, 2016, 6: 28271. DOI:10.1038/srep28271.
[31] ZHU J J, SUN W Z, MENG Z Y, et al. Preparation and characterization of a new type of porous starch microspheres (PSM) and effect of physicochemical properties on water uptake rate[J]. International Journal of Biological Macromolecules, 2018, 116: 707-714.DOI:10.1016/j.ijbiomac.2018.05.059.
[32] NADAF S, JADHAV A, KILLEDAR S. Mung bean (Vigna radiata) porous starch for solubility and dissolution enhancement of poorly soluble drug by solid dispersion[J]. International Journal of Biological Macromolecules, 2021, 167: 345-357. DOI:10.1016/j.ijbiomac.2020.11.172.
[33] 罗志刚, 高群玉, 杨连生. 湿热处理对淀粉性质的影响[J]. 食品科学,2005, 26(2): 50-54. DOI:10.3321/j.issn:1002-6630.2005.02.007.
[34] KIM J M, LEE C M. Effect of starch of textural properties of surimi gel[J]. Journal of Food Science, 1987, 52(3): 722-725. DOI:10.1111/j.1365-2621.1987.tb06711.x.
[35] VERREZ-BAGNIS V, BOUCHET B, GALLANT D J. Relationship between the starch granule structure and the textural properties of heat-induced surimi gels[J]. Food Structure, 1993, 12(3): 309-320.DOI:10.1088/0954-3899/19/4/013.
[36] HUANG X B, LIU Q G, WANG P K, et al. Tapioca starch improves the quality of Virgatus nemipterus surimi gel by enhancing molecular interaction in the gel system[J]. Foods, 2024, 13(1): 169. DOI:10.3390/foods13010169.
[37] ZHU S C, WANG Y Y, DING Y C, et al. Improved texture properties and toughening mechanisms of surimi gels by double network strategies[J]. Food Hydrocolloids, 2024, 152: 109900. DOI:10.1016/j.foodhyd.2024.109900.
[38] PETCHARAT T, BENJAKUL S. Effect of gellan incorporation on gel properties of bigeye snapper surimi[J]. Food Hydrocolloids, 2018, 77:746-753. DOI:10.1016/j.foodhyd.2017.11.016.
[39] 刘璐, 洪鹏志, 周春霞, 等. 不同种类淀粉对罗非鱼鱼糜凝胶品质的影响[J]. 食品科学, 2023, 44(6): 82-89. DOI:10.7506/spkx1002-6630-20220522-279.
[40] HAN M Y, ZHANG Y J, FEI Y, et al. Effect of microbial transglutaminase on NMR relaxometry and microstructure of pork myofibrillar protein gel[J]. European Food Research and Technology,2009, 228(4): 665-670. DOI:10.1007/s00217-008-0976-x.
[41] 张晓慧, 郭全友, 郑尧, 等. 变性淀粉协同非肌肉蛋白对鱿鱼鱼糜制品凝胶特性及其蛋白构象的影响[J]. 食品科学, 2023, 44(20): 43-52.DOI:10.7506/spkx1002-6630-20221219-194.
[42] MI H B, SU Q, CHEN J X, et al. Starch-fatty acid complexes improve the gel properties and enhance the fatty acid content of Nemipterus virgatus surimi under high-temperature treatment[J]. Food Chemistry,2021, 362: 130253. DOI:10.1016/j.foodchem.2021.130253.