食盐是维持人体正常生命活动所必需的基本物质,其主要成分是NaCl,食盐约贡献了人们日常膳食钠总摄入量的90%[1]。在肉制品加工中,食盐发挥着重要作用,不仅能够增强风味、改善色泽、提高保水性,还能通过降低水分活度有效延长产品保质期[2]。目前市售肉制品的食盐添加量通常为2%~3%,钠含量普遍偏高[3]。调查显示,中国居民的日均食盐摄入量已达10.5 g,远超世界卫生组织推荐的5 g标准[4]。过量摄入食盐与高血压、心血管疾病及部分癌症等发生风险增加有关[5]。数据显示,肉制品约占膳食钠总摄入量的20%[6]。因此,降低肉制品中的钠含量已成为公众关注的重要议题。
肉制品加工中常见的减盐方法包括直接减少钠盐、改变盐的物理形态、使用天然香料或增味剂等,这些方法往往会对肉制品的口感、质地等产生不良影响。外源性碱性氨基酸,如L-赖氨酸(L-lysine,Lys)、L-组氨酸(L-histidine,His)和L-精氨酸(L-arginine,Arg)等,能够通过促进肌肉蛋白溶解有效改善蛋白质功能特性(如乳化性和凝胶性等)[7]。当pH值为7时,碱性氨基酸由于额外的氨基而带有正电荷,其侧链能够与带有相反电荷的基团形成离子键或盐桥,从而增强其功能特性[8]。此外,碱性氨基酸还可缓解高含量(>40%)KCl替代NaCl而产生的感官缺陷[9],并能够通过调整肌球蛋白结构提高其在低盐溶液中的溶解性,进而改善低盐肉制品的整体品质[10-11]。食品级Arg、Lys是已实现规模化生产、易于获得的调味品和营养强化剂,可作为品质改良剂用于减盐肉制品加工。
乳化香肠又称肉糜类香肠,是以畜禽肉为主要原料,经绞肉、腌制、斩拌、灌装、烘烤或蒸煮及冷却等工艺制作而成的肉制品。乳化香肠能够最大程度保留肉的营养和风味、质地细腻、食用方便、便于携带,广受消费者喜爱[12]。目前市售乳化香肠的盐质量分数通常为2%~4%[13]。长期摄入高盐食品可能对健康产生不利影响。因此,开发低盐香肠对于肉制品行业尤为重要。本研究以猪肉乳化肠为对象,通过分析保水性、质构特性、感官特性及蛋白与脂肪氧化等指标变化,探究Lys和Arg添加对减盐乳化肠品质的影响,为健康减盐肉制品开发提供理论参考。
1 材料与方法
1.1 材料与试剂
猪肉为炮台山溜达猪外脊,屠宰后48 h内于当地屠宰场取样。
食盐(食品级) 大连新春多品种盐有限公司;Lys、Arg(均为食品级) 河北华阳生物科技有限公司;胶原蛋白肠衣(食品级) 梧州神冠蛋白肠衣有限公司;三氯乙酸(trichloroacetic acid,TCA)(分析纯)北京宝希迪科技有限公司; 2 , 4 - 二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、盐酸胍、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)(均为分析纯) 生工生物工程(上海)股份有限公司;乙酸乙酯(分析纯) 天津东丽区天大化学试剂厂。
1.2 仪器与设备
MR9402A摩飞绞肉机 广东新宝电器股份有限公司;C100真空包装机 莫迪维克包装设备(上海)有限公司;Ultra Scan Pro测色仪 美国HunterLab公司;TA.XT Plus质构仪 英国Stable Micro System公司;PB-10 pH计 德国Testo公司;MesoMR23-060H核磁共振分析仪苏州纽迈分析仪器股份有限公司;CR22N台式冷冻离心机日本日立公司;Infinite M200微量光吸收酶标仪、SU8100冷场发射扫描电子显微镜 日本Hitachi公司;T18IKEA匀浆机 德国IKA公司;Discovery HR-1流变仪 深圳泰立仪器仪表有限公司;UV-5100B紫外-可见分光光度计上海元析仪器有限公司;AB4000QTRAP液相色谱-质谱联用仪 岛津企业管理(中国)有限公司。
1.3 方法
1.3.1 乳化肠制备工艺
乳化肠制备工艺流程:猪外脊→分离肥瘦肉→去除膜筋→预绞肉→混合斩拌→灌肠→蒸煮→冷却→成品。
基础配方:基础配方由50%瘦肉、20%肥膘及30%冰水组成。采用完全随机设计,以含1.6%食盐(以原料肉质量计,下同)乳化肠为常盐对照组(C)、含0.8%食盐乳化肠为低盐对照组(CR),在低盐组基础上分别添加0.5%、1.0%、2.0% Lys(L0.5、L1.0、L2.0)和Arg(A0.5、A1.0、A2.0),作为实验组,进行3 次重复实验,每次实验各组均设置3 个重复。具体配方见表1。
表1 乳化肠配方
Table 1 Emulsified sausage formula%
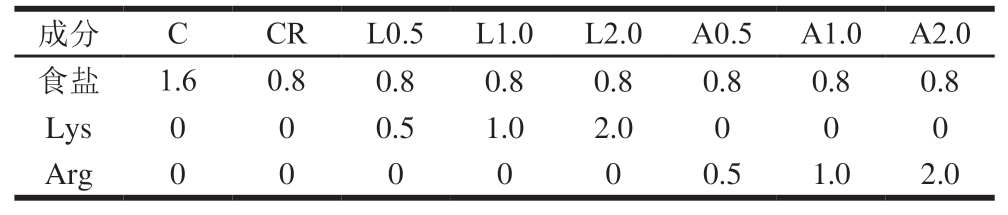
成分CCRL0.5L1.0L2.0A0.5A1.0A2.0食盐1.60.80.80.80.80.80.80.8 Lys000.51.02.0000 Arg000000.51.02.0
操作要点:将猪外脊肥瘦肉分离、去除结缔组织,绞肉机预斩拌30 s,绞至肉质变得细腻、无较大肉块后,4 ℃冷藏1 h。按比例称取猪瘦肉,采用冰水总量的2/3将食盐、Lys、Arg等溶解,倒入绞肉机,绞肉机置于冰盆中,斩拌30 s,暂停2 min,再斩拌30 s,加入肥肉肉糜和剩余冰水,斩拌30 s,暂停2 min,再斩拌30 s,斩拌过程中将温度控制在14 ℃以下。使用灌肠机将斩拌后的肉糜灌入24 mm胶原蛋白肠衣。将乳化肠放入75 ℃水浴锅中煮制30 min,取出后流水冷却30 min,取样测定水分含量,其余乳化肠真空包装,90 ℃水浴杀菌3~4 s,4 ℃贮藏。贮藏1 d取样测定离心失水率、观察微观结构;贮藏3、20 d分别取样并测定质构特性、色泽、核磁共振成像(magnetic resonance imaging,MRI)、脂肪与蛋白氧化等指标。
1.3.2 感官评价
取当天制备的乳化肠(未包装)进行感官评价,取各组乳化肠样品,用切片机切成2 mm的切片,随机编号为3 位数,置于白盘中。由10 名食品专业研究生独立进行评定,评价过程中禁止交流。样品以随机顺序呈递,每完成一组评价后,评价人员需用清水漱口以消除残留影响。评价指标包括色泽、气味、组织状态、口感、咸度和综合评价[14],各指标满分均为9,1表示最不喜欢,9表示最喜欢。乳化肠感官评价标准见表2。
表2 乳化肠感官评价标准
Table 2 Sensory evaluation criteria of emulsified sausage
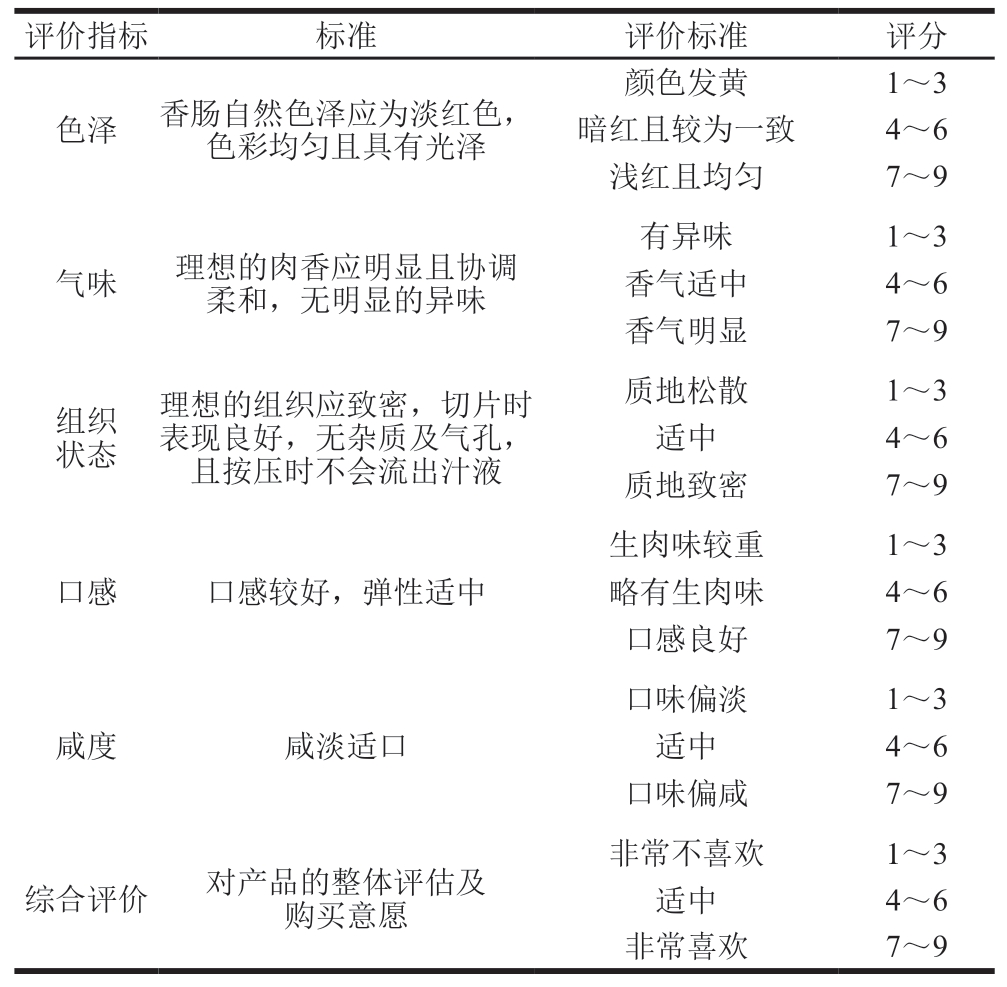
评价指标标准评价标准评分色泽 香肠自然色泽应为淡红色,色彩均匀且具有光泽颜色发黄1~3暗红且较为一致4~6浅红且均匀7~9气味理想的肉香应明显且协调柔和,无明显的异味有异味1~3香气适中4~6香气明显7~9组织状态理想的组织应致密,切片时表现良好,无杂质及气孔,且按压时不会流出汁液质地松散1~3适中4~6质地致密7~9口感口感较好,弹性适中生肉味较重1~3略有生肉味4~6口感良好7~9咸度咸淡适口口味偏淡1~3适中4~6口味偏咸7~9综合评价对产品的整体评估及购买意愿非常不喜欢1~3适中4~6非常喜欢7~9
1.3.3 色泽测定
根据张鑫等[15]的方法并稍作修改。将乳化肠样品切分为高度2 cm的圆柱形,确保切面光滑且无孔洞。测定时,采用4 mm测量孔径,去除镜面反射后,测定亮度值(L*)、红度值(a*)、黄度值(b*)。
1.3.4 蒸煮损失率测定
称取乳化肠样品蒸煮前后的质量,分别记为m1/g、m2/g,蒸煮损失率按式(1)计算:
1.3.5 离心失水率测定
将3 g乳化肠样品(m1/g)包裹在滤纸中,放置于50 mL离心管内,4 ℃、8 000×g离心10 min后,擦干样品表面液体,称取样品质量(m2/g),离心失水率按式(2)[16]计算:
1.3.6 水分含量测定
将乳化肠样品在105 ℃恒温干燥箱中干燥至恒质量,每3 h称取一次质量,直至2 次质量差小于0.002 g,水分含量按式(3)[17]计算:
式中:m1为样品与称量瓶总质量/g;m2为恒质量后样品与称量瓶总质量/g;m3为称量瓶质量/g。
1.3.7 pH值测定
将校正后的pH计直接插入斩拌完成的肉糜内部,测定pH值。
1.3.8 低场核磁共振测定
将乳化肠样品用保鲜膜密封包裹后,置于核磁共振分析仪样品腔中,采用CPMG(Carr-Purcell-Meiboom-Gill)脉冲序列测定横向弛豫时间(T2)。测试条件:质子共振频率22.6 MHz、温度32 ℃、90°与180°脉冲间隔时间300 μs。在4 次重复扫描中共获取10 000 个回波数据,2 次连续扫描时间间隔3 s,每次测定设置3 次重复。采用Multi Exp-Inv软件中的同步迭代重建技术对CPMG衰减曲线进行多指数拟合分析[17]。
1.3.9 MRI测定
参考Li Shuang等[18]的方法并稍作修改,采用核磁共振分析仪获取乳化肠样品的MRI。具体地,将约9 g乳化肠样品包裹在聚乙烯薄膜中,置于核磁共振分析仪腔室(直径60 mm)。扫描参数:回波时间20 ms、重复时间2 000 ms。
1.3.10 质构特性测定
将乳化肠样品切分成2 cm×2 cm×2 cm的正方体,利用质构仪的质地剖面分析模式测定乳化肠的硬度、咀嚼度和弹性,使用P50探头,测前速率为2 mm/s,测中、测后速率均为1 mm/s。触发力5 g、压缩比30%、时间间隔5 s[17]。
1.3.11 流变学特性测定
将肉糜样品放置在经过校准的流变仪平台上,采用石蜡密封。以直径50 mm平行板为夹具,板间距1 mm。动态测量模式下,在肉糜样品上施加10 Pa周期性应力,温度范围25~80 ℃,频率1 Hz。实时记录应变响应,以储能模量(G′)表征肉糜样品在升温过程中的流变学特性[19]。
1.3.12 扫描电子显微镜观察
将乳化肠样品切为10 mm×10 mm×2 mm的薄片,利用2.5%(V/V)戊二醛溶液固定12 h,采用梯度脱水法,使用30%、50%、70%、90%、95%(V/V)乙醇各处理10 min,然后采用丙酮脱水3 次,每次持续15 min。冷冻干燥并镀金,在扫描电子显微镜下观察其微观结构[20]。
1.3.13 硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBRAS)值测定
参照Botsoglou等[21]的方法并稍作修改,将乳化肠样品搅碎,取1 g,加入0.5 mL 0.2 g/100 mL二叔丁基对甲酚溶液和5 mL 10 g/100 mL TCA溶液,13 500 r/min均质5 min。取1 mL上清液,加入1 mL 0.02 mmol/L硫代巴比妥酸溶液,涡旋,85 ℃水浴加热45 min,在水中冷却至室温,500 r/min离心10 min。取上清液,采用酶标仪在532 nm波长处测定吸光度(A532nm),按式(4)计算TBARS值:
1.3.14 总巯基含量测定
取1 g乳化肠样品,加入25 mL 5 g/100 mL SDS溶液,8 000 r/min均质30 s后,80 ℃水浴加热30 min,3 000 r/min离心20 min,取上清液,采用BCA法测定蛋白质含量,并参照Lund等[22]的方法测定总巯基含量。
1.3.15 总羰基含量测定
参照王守印等[23]的方法并稍作修改,取100 μL 1.3.13节制备的上清液并将蛋白质量浓度稀释至2 mg/mL,加入1 mL 10 g/100 mL TCA溶液,4 ℃、5 000×g离心5 min,将沉淀与400 μL 5 g/100 mL SDS溶液混合,溶解后加入0.8 mL 0.3 g/100 mL DNPH溶液(DNPH溶解于3 mol/L HCl溶液),室温下避光孵育30 min后,添加400 μL 40 g/100 mL TCA溶液以分离蛋白沉淀,4 ℃、10 000×g离心5 min,采用1 mL乙酸乙酯-乙醇(1∶1,V/V)溶液洗涤沉淀3 次,将沉淀加入1.5 mL含20 mmol/L复合磷酸盐缓冲液(pH 6.5)的6 mol/L盐酸胍溶液中,4 ℃孵育过夜。取上清液,采用紫外-可见分光光度计在280 nm和370 nm波长处测定吸光度,并基于摩尔消光系数(22 000 L/(mol·cm))计算总羰基含量。
1.3.16 α-氨基己二酸(2-aminoadipic acid,AAS)含量测定
参照Guo Xiuxia等[11]的方法测定AAS含量。
1.4 数据处理
使用SPSS 16.0软件进行数据分析,并采用Origin 2022软件绘图。
2 结果与分析
2.1 Lys、Arg添加量对低盐乳化肠感官评价的影响
感官评价是评估肉制品质量的重要指标,良好的色泽、香气和口感能够显著提升肉制品的感官评分,因此,这些感官属性是影响消费者接受度的关键因素。由表3可知,CR组色泽、气味、组织状态、口感、咸度、综合评分均低于C组,而与CR组相比,添加Lys、Arg后,各组色泽、组织状态、口感和综合评分均显著提高(P<0.05)。值得注意的是,各组气味得分无显著差异(P>0.05),当Lys添加量达到2.0%时,气味评分降低,且随着Lys、Arg添加量的增加,乳化肠综合评分均呈下降趋势。李俊[24]研究表明,Lys添加量过高会对乳化肠的感官特性产生负面影响,可能是由于Lys作为香精成分的特性,过量使用会干扰风味。因此,适量添加Lys和Arg能够提高低盐乳化肠的接受度。
表3 不同Lys、Arg添加量对低盐乳化肠感官评分的影响
Table 3 Effect of different Lys and Arg additions on the sensory score of
low-salt emulsified sausages
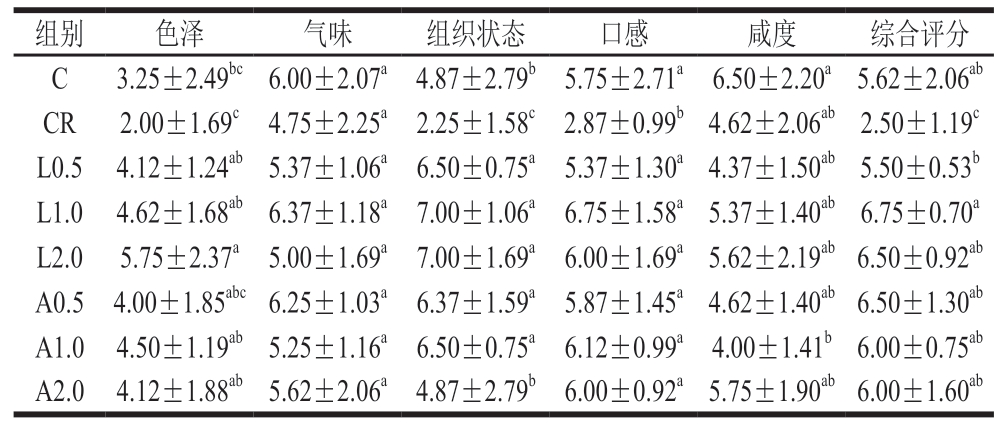
注:同列小写字母不同表示差异显著(P<0.05)。表4、5同。
组别色泽气味组织状态口感咸度综合评分C3.25±2.49bc 6.00±2.07a 4.87±2.79b 5.75±2.71a 6.50±2.20a 5.62±2.06ab CR2.00±1.69c 4.75±2.25a 2.25±1.58c 2.87±0.99b 4.62±2.06ab 2.50±1.19c L0.5 4.12±1.24ab 5.37±1.06a 6.50±0.75a 5.37±1.30a 4.37±1.50ab 5.50±0.53b L1.0 4.62±1.68ab 6.37±1.18a 7.00±1.06a 6.75±1.58a 5.37±1.40ab 6.75±0.70a L2.0 5.75±2.37a 5.00±1.69a 7.00±1.69a 6.00±1.69a 5.62±2.19ab 6.50±0.92ab A0.5 4.00±1.85abc 6.25±1.03a 6.37±1.59a 5.87±1.45a 4.62±1.40ab 6.50±1.30ab A1.0 4.50±1.19ab 5.25±1.16a 6.50±0.75a 6.12±0.99a 4.00±1.41b 6.00±0.75ab A2.0 4.12±1.88ab 5.62±2.06a 4.87±2.79b 6.00±0.92a 5.75±1.90ab 6.00±1.60ab
2.2 Lys、Arg添加量对低盐乳化肠贮藏期间色泽的影响
肉制品色泽是影响消费者选择的重要品质指标之一。由图1a可知,贮藏3 d,与CR组相比,仅L2.0、A2.0组L*显著降低(P<0.05)。由图1b可知,贮藏3 d,乳化肠a*随Lys添加量增加而上升,随Arg添加量增加而显著下降(P<0.05)。贮藏20 d,除C组与A2组外,各组a*与贮藏3 d无显著差异(P>0.05)。由图1c可知,贮藏3 d,乳化肠b*随Lys、Arg添加量的增加呈上升趋势,可能是由于Lys水溶液呈黄色,添加量较大时可使乳化肠b*增加。贮藏20 d,各组(除A0.5组外)L*、b*与贮藏3 d无显著差异(P>0.05),提示添加Lys、Arg并未显著影响乳化肠的L*与b*,影响消费者选择的主要是a*[25]。综上,添加Lys对乳化肠的色泽有一定的改善作用。
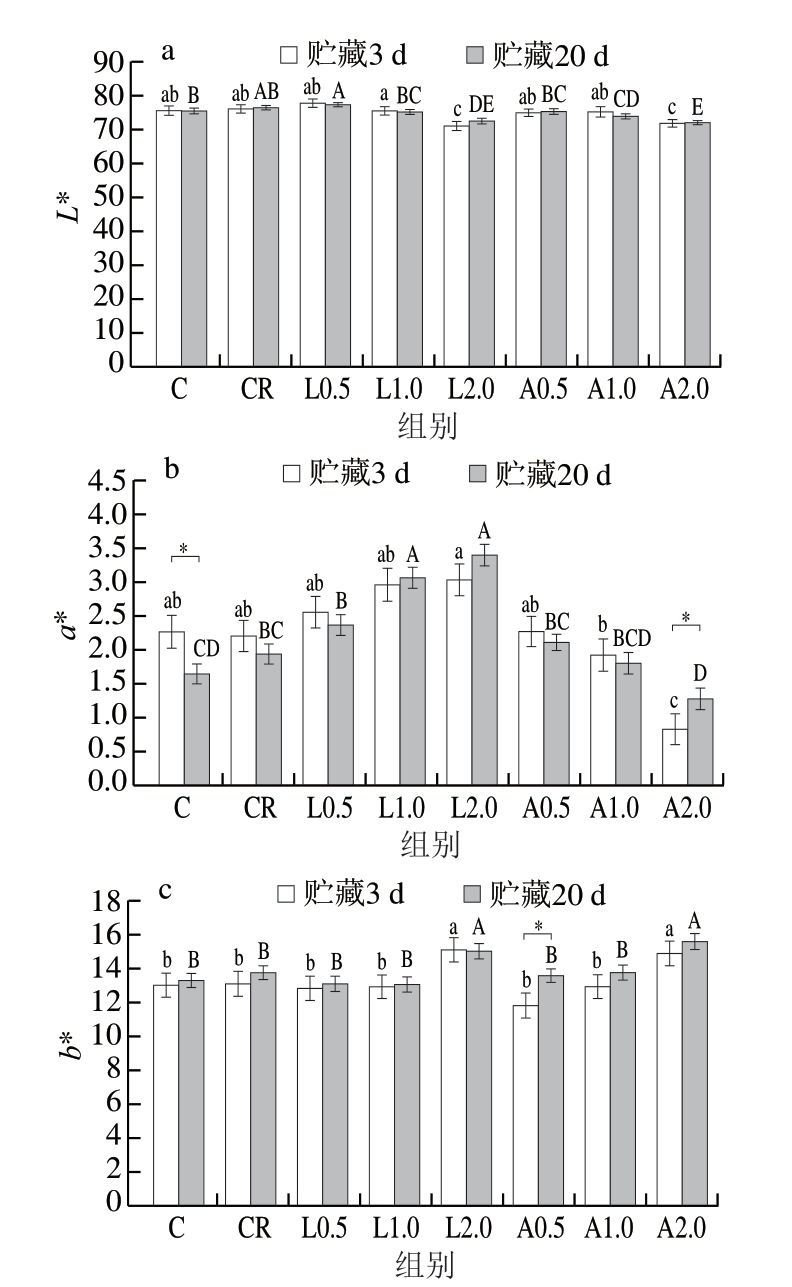
图1 不同Lys、Arg添加量对低盐乳化肠色泽的影响
Fig. 1 Effects of different Lys and Arg additions on the color of low-salt emulsified sausage
a. L*;b. a*;c. b*。小写字母不同表示贮藏3 d组间差异显著;大写字母不同表示贮藏20 d组间差异显著(P<0.05);图3、4、6同。*.不同贮藏时间之间差异显著(P<0.05);图4、6同。
2.3 Lys、Arg添加量对低盐乳化肠保水性和肉糜pH值的影响
保水性是肉制品的关键品质特性,其直接影响产品的出品率及食用时的多汁性[26]。通常可通过蒸煮损失率、离心失水率和水分含量综合评估肉制品保水性。其中,蒸煮损失率是评估乳化肠在熟制过程中保水能力的重要指标之一。由图2a可知,CR组蒸煮损失率为11.1%,显著高于C组(6.9%,P<0.05),L0.5、L1.0、L2.0、A0.5、A1.0、A2.0组蒸煮损失率分别为3.3%、2.5%、1.5%、4.8%、2.7%、2.1%,与CR组相比,添加Lys、Arg乳化肠蒸煮损失率均显著降低(P<0.05)。由图2b可知,CR组离心失水率最高,为40.3%,L0.5、L1.0、L2.0、A0.5、A1.0、A2.0组离心失水率分别为33.1%、26.3%、27.6%、38.5%、28.4%、27.4%。添加Lys、Arg后,乳化肠的离心失水率较CR组均明显降低。由图2c可知,各组乳化肠水分质量分数(55.9%~63.0%)无显著差异(P>0.05)。Li Shiyi等[27]研究表明,Lys和Arg能够通过阳离子-π相互作用和肌球蛋白的芳香氨基酸残基发生相互作用,同时通过静电相互作用与肌球蛋白的酸性氨基酸残基产生交互作用,这导致肌球蛋白的α-螺旋结构展开,暴露疏水性氨基酸残基(如色氨酸和酪氨酸)与巯基,从而提高肌球蛋白的溶解度[28],使之形成均匀的三维网络结构,有效截留水分。另外,李俊[24]研究发现,Lys提高猪肉肠保水性与猪肉肠pH值上升有关。因此,本研究对斩拌后肉糜的pH值进行测定。由图2d可知,与C组相比,CR组pH值无显著变化(P>0.05);与CR组相比,添加Lys、Arg肉糜pH值均显著升高(P<0.05),且pH值随着2 种氨基酸添加量的增加呈上升趋势。Lys、Arg通过其侧链碱性基团(带有正电荷)与肉糜中的氢离子结合[29],导致体系氢氧根离子含量升高,pH值上升(远离肌球蛋白等电点)。这一过程使肌球蛋白表面净负电荷增加,通过静电斥力增强其水合作用,溶解度得以提高,进而形成更稳定的三维网络结构,有效提高肉糜的保水性,降低离心失水率与蒸煮损失率。
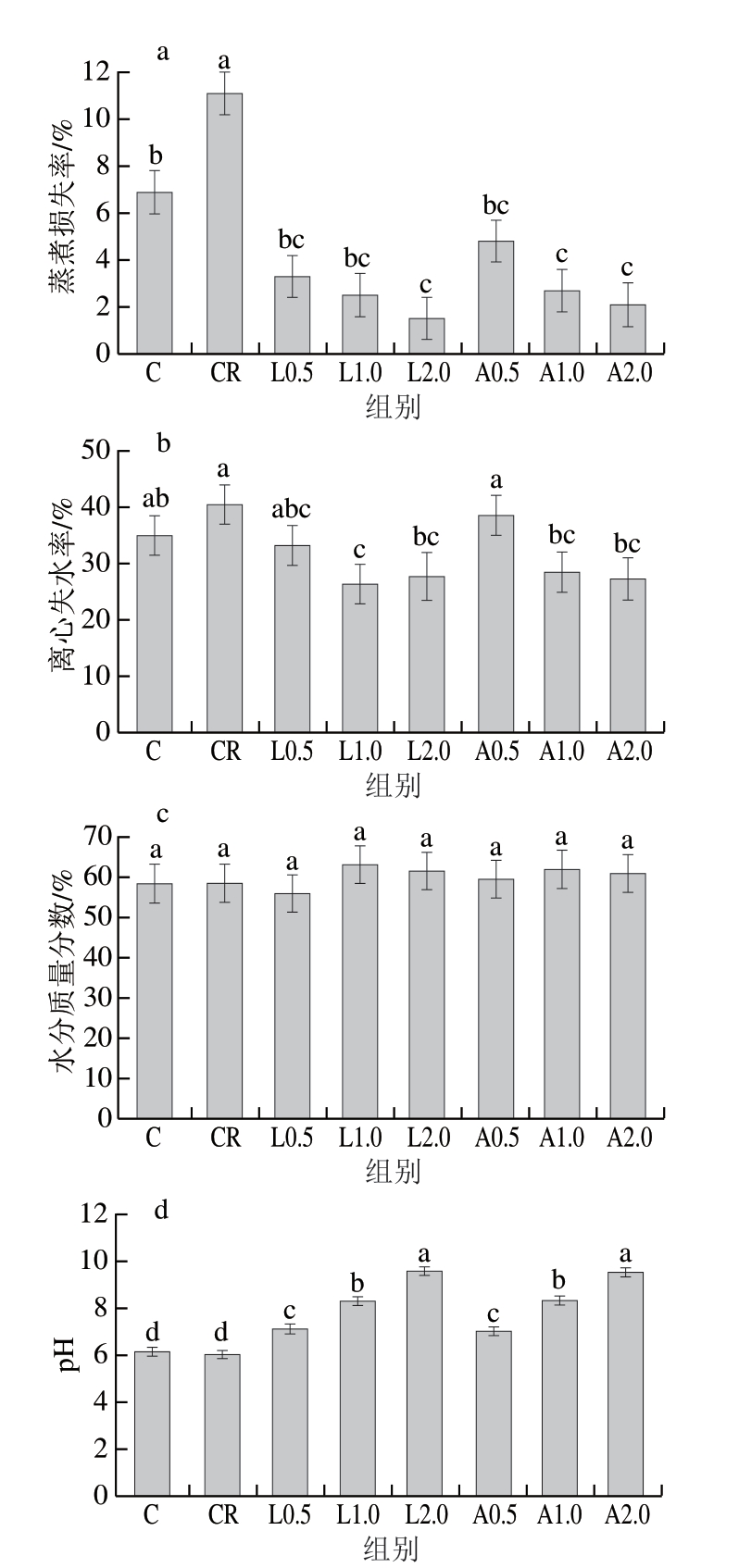
图2 不同Lys、Arg添加量对低盐乳化肠蒸煮损失率(a)、离心失水率(b)、水分含量(c)和肉糜pH值(d)的影响
Fig. 2 Effects of different Lys and Arg additions on cooking loss rate (a),centrifugal water loss rate (b), moisture content of low-salt emulsified sausage (c) and pH of meat emulsion (d)
小写字母不同表示组间差异显著(P<0.05)。
2.4 Lys、Arg添加量对低盐乳化肠贮藏过程中水分状态和水分分布的影响
在乳化肠中识别出3 种不同状态的水分,包括结合水(T2b)、不易流动水(T21)和自由水(T22)[30]。由表4可知,贮藏3 d,与C组相比,CR组T2b、T21显著缩短,T22显著延长(P<0.05);随着Lys、Arg添加量的增加,各组T2b、T21、T22均呈缩短趋势,表明添加Lys、Arg可通过减少自由水比例、提升结合水与不易流动水稳定性改善乳化肠的保水性。与贮藏3 d相比,贮藏20 d时各组(除C组与CR组外)T2均缩短,这表明贮藏后各组乳化肠的水分有所损失。
表4 不同Lys、Arg添加量对低盐乳化肠T2的影响
Table 4 Effect of different Lys and Arg additions on T2 of low-salt emulsified sausage
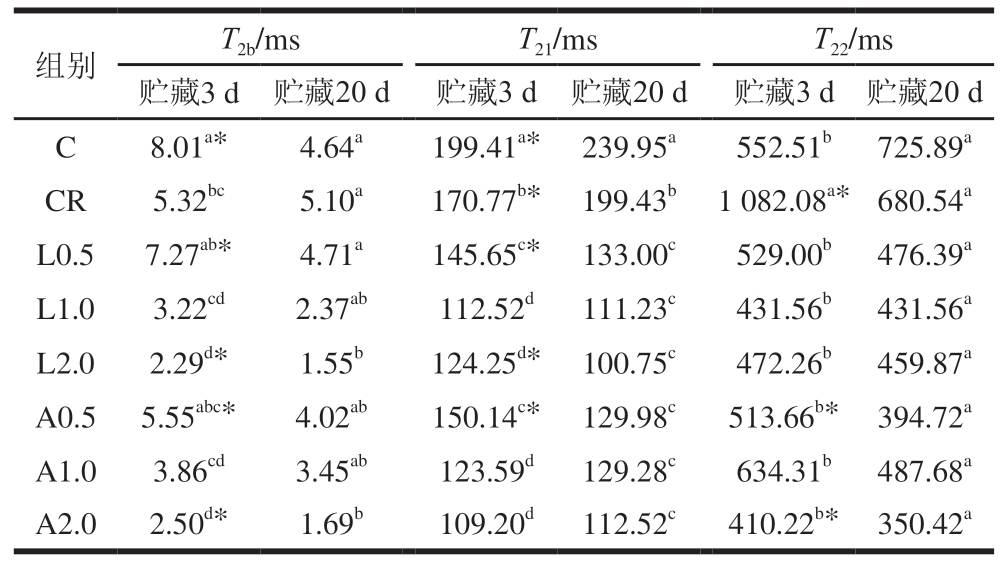
注:*.不同贮藏时间之间差异显著(P<0.05)。表5同。
组别T2b/msT21/msT22/ms贮藏3 d 贮藏20 d 贮藏3 d 贮藏20 d 贮藏3 d 贮藏20 d C8.01a*4.64a199.41a* 239.95a552.51b 725.89a CR5.32bc5.10a170.77b* 199.43b 1 082.08a* 680.54a L0.57.27ab*4.71a145.65c* 133.00c529.00b 476.39a L1.03.22cd2.37ab112.52d111.23c431.56b 431.56a L2.02.29d*1.55b124.25d* 100.75c472.26b 459.87a A0.5 5.55abc*4.02ab150.14c* 129.98c513.66b* 394.72a A1.03.86cd3.45ab123.59d129.28c634.31b 487.68a A2.02.50d*1.69b109.20d112.52c410.22b* 350.42a
T2b、T21、T22对应峰面积(P2b、P21、P22)与各状态水分相对含量呈正相关。由表5可知,贮藏3 d,与C组相比,CR组结合水相对含量降低,自由水相对含量显著增加(P<0.05)。随着Lys添加量的增加,结合水相对含量显著降低(P<0.05),随着Arg添加量的增加,结合水相对含量也存在降低趋势,这可能归因于带正电的Lys和Arg与肌球蛋白带电残基的静电相互作用导致蛋白质分子内及分子间离子键被破坏[19]。该过程促使蛋白质结构展开,疏水性残基暴露,从而削弱蛋白质极性基团与水分子的结合能力,导致结合水比例下降,而自由水比例则相应升高。值得注意的是,无论是贮藏3 d,还是贮藏20 d,各组乳化肠中绝大部分水均以不易流动水形式存在(相对含量达90%以上),与C组和CR组相比,添加Lys、Arg各组不易流动水相对含量均呈增加趋势,说明添加Lys、Arg可有效提升低盐乳化肠中不易流动水的保留率。随着贮藏时间的延长,各组不易流动水相对含量变化较小,而结合水相对含量普遍呈降低趋势,自由水相对含量普遍呈增加趋势,这可能是因为组织中结合水随贮藏时间延长而不断渗出,导致自由水含量增加。尽管添加Lys和Arg各组的蒸煮损失率较低,保水性较高,但乳化肠依然具有较高含量的自由水,可以推测,添加Lys和Arg各组蒸煮损失率和离心损失率较低可能是因为水分更易被束缚在肌原纤维内。
表5 不同Lys、Arg添加量对低盐乳化肠T2分布曲线峰面积占比的影响
Table 5 Effect of different Lys and Arg additions on the proportion of peak area in the T2 distribution curve of low-salt emulsified sausage
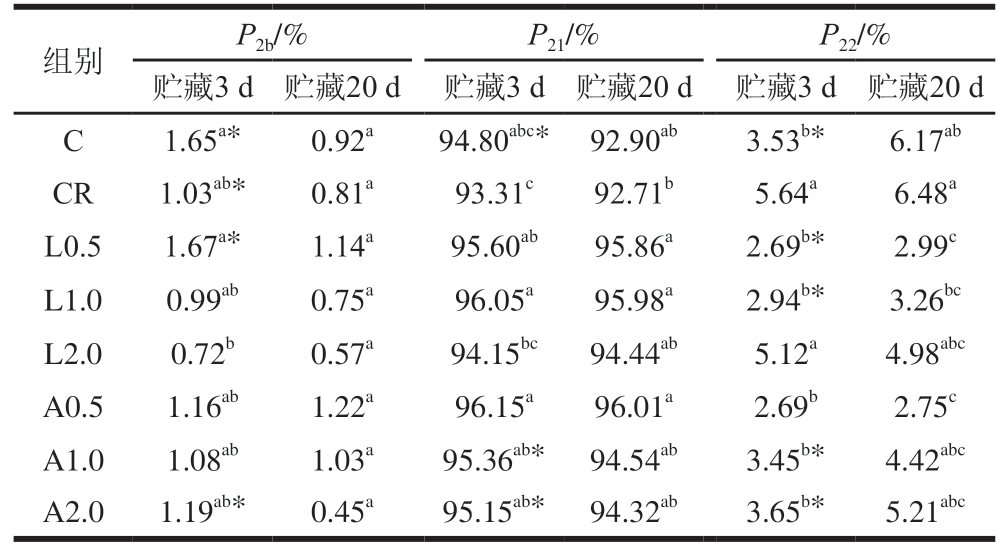
组别P2b/%P21/%P22/%贮藏3 d 贮藏20 d 贮藏3 d 贮藏20 d 贮藏3 d 贮藏20 d C1.65a*0.92a94.80abc* 92.90ab3.53b*6.17ab CR1.03ab*0.81a93.31c92.71b5.64a6.48a L0.51.67a*1.14a95.60ab95.86a2.69b*2.99c L1.00.99ab0.75a96.05a95.98a2.94b*3.26bc L2.00.72b0.57a94.15bc94.44ab5.12a4.98abc A0.51.16ab1.22a96.15a96.01a2.69b2.75c A1.01.08ab1.03a95.36ab* 94.54ab3.45b*4.42abc A2.01.19ab*0.45a95.15ab* 94.32ab3.65b*5.21abc
MRI作为一种快速、无损的食品分析技术,已广泛应用于食品内部结构的可视化研究。MRI不仅能够确定食品中的水分分布特征,还能够实时监测加工过程中的微观结构动态变化[31-32]。由于乳化肠结合水占比较低,MRI主要反映不易流动水和自由水的空间分布。MRI信号强度与水分含量呈正相关,如图3a、b所示,红色区域表示质子密度高(水分含量高),蓝色区域表示质子密度低(水分含量低)。添加Lys和Arg后,低盐乳化肠伪彩图的红色区域扩大,质子密度增加,不易流动水和自由水含量增加。与贮藏3 d相比,贮藏20 d时各组红色区域均扩大,低盐乳化肠水分含量增加。由伪彩图的信号强度反映水分含量,如图3c所示,贮藏3 d时,与C组相比,CR组MRI信号强度减弱,随着Lys和Arg添加量的增加,MRI信号强度显著升高(P<0.05)。除CR组外,各组MRI信号强度在贮藏3 d与贮藏 20 d之间无显著变化(P>0.05)。综上所述,Lys和Arg可有效保持减盐乳化肠的水分含量。
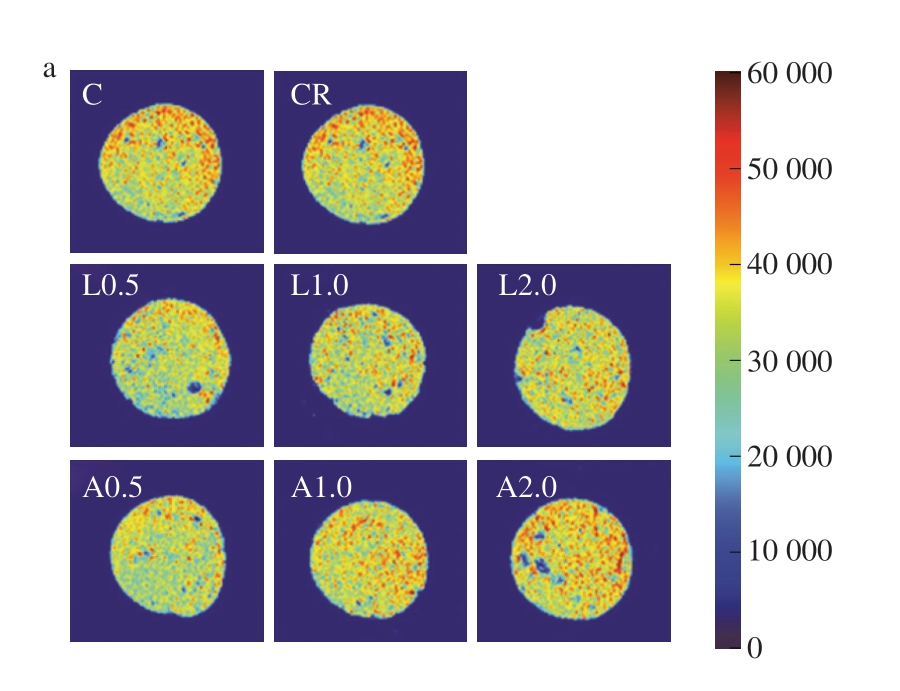
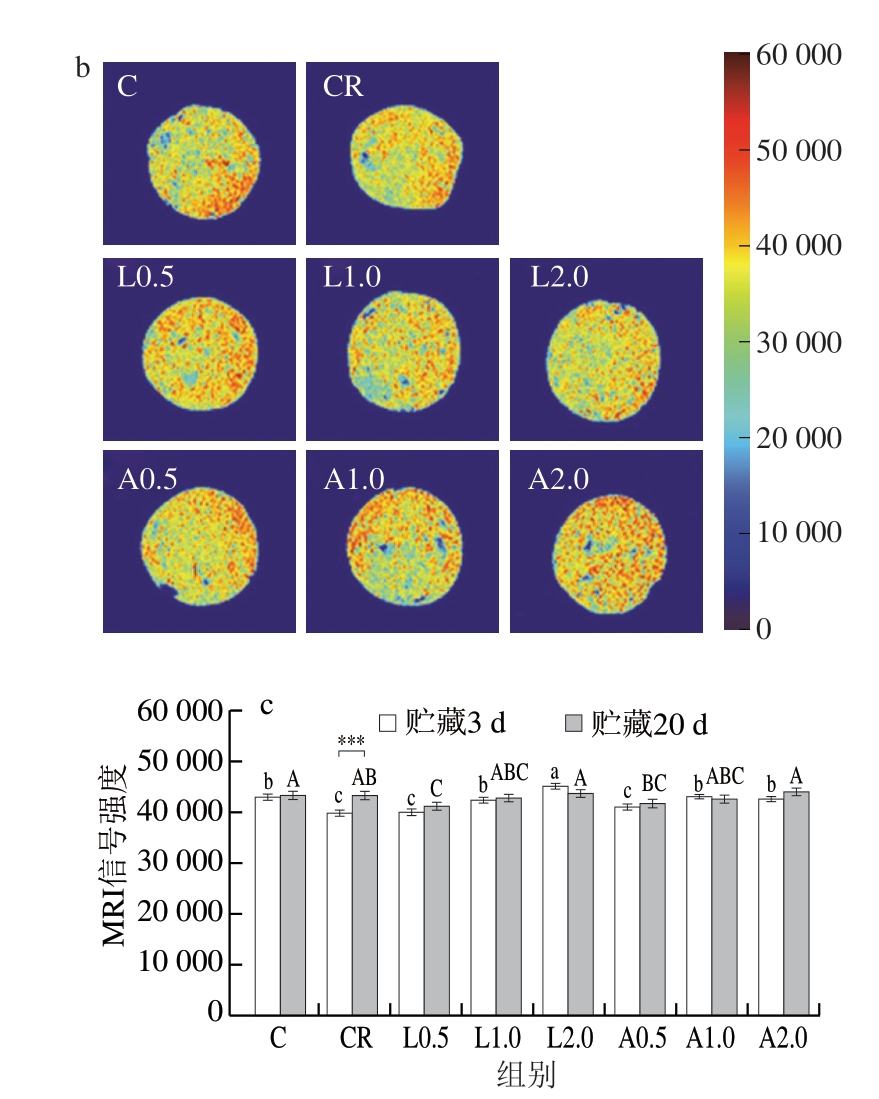
图3 不同Lys、Arg添加量对低盐乳化肠贮藏3 d伪彩图(a)、贮藏20 d伪彩图(b)及MRI信号强度(c)的影响
Fig. 3 Effects of different Lys and Arg additions on pseudo-color images of low-salt emulsified sausages stored for 3 (a), 20 days (b), and MRI signal intensity of low-salt emulsified sausages (c)
***.不同贮藏时间之间差异高度显著(P<0.001)。图6同。
2.5 Lys、Arg添加量对低盐乳化肠贮藏过程中质构特性和肉糜流变学特性的影响
质构特性是决定乳化肠感官品质的重要指标,肉制品的质构特性包括硬度、弹性、咀嚼度等。如图4a~c所示,贮藏3 d时,与C组相比,CR组硬度、弹性、咀嚼度均显著下降(P<0.05),表明减盐会导致乳化肠质构特性下降。与CR组相比,添加Lys、Arg乳化肠硬度、弹性、咀嚼度均显著上升(P<0.05),可能是因为Lys、Arg能够增加肌球蛋白溶解度,改变蛋白质凝胶性质,进而影响肉制品的加工品质。与贮藏3 d相比,贮藏20 d时C组、L1.0、L2.0组咀嚼度均显著下降(P<0.05),L1.0、L2.0组硬度均极显著下降(P<0.01),可能是因为在贮藏过程中脂肪和蛋白质氧化造成组织结构及性状发生改变,研究[33]显示,蛋白质羰基化会对质构特性产生不良影响。综上所述,Lys、Arg可改善低盐乳化肠硬度、弹性、咀嚼度等质构特性。
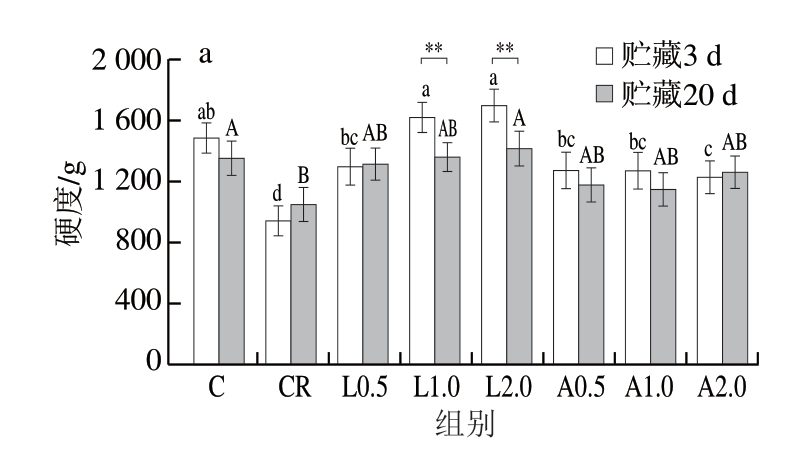
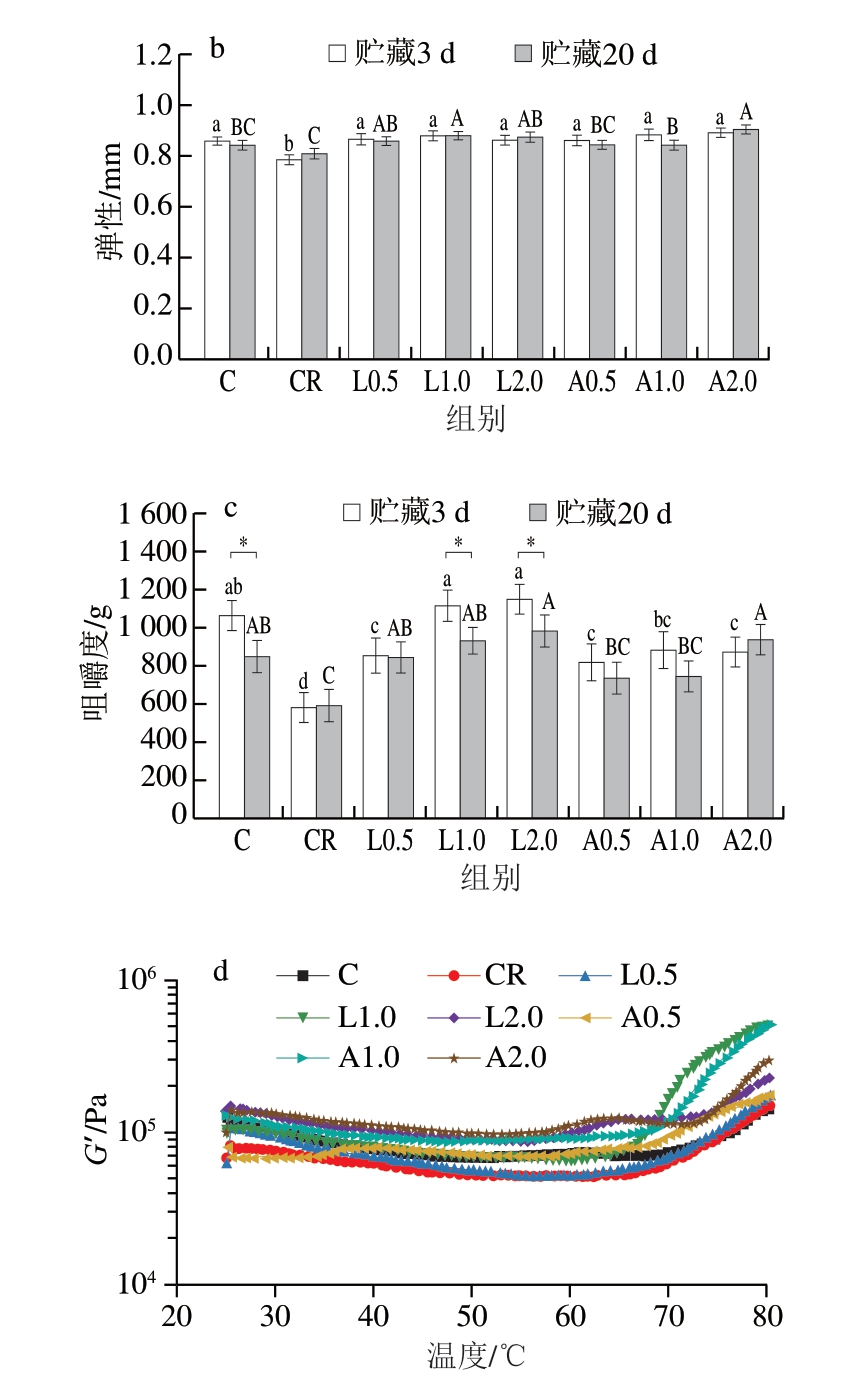
图4 不同Lys、Arg添加量对低盐乳化肠硬度(a)、弹性(b)、咀嚼度(c)和肉糜流变特性(d)的影响
Fig. 4 Effects of different Lys and Arg additions on hardness (a),elasticity (b), chewiness (c) of low-salt emulsified sausage and rheological properties of meat emulsion (d)
**.不同贮藏时间之间差异极显著(P<0.01)。图6同。
乳化肠质构特性与其加热过程中肌原纤维热诱导凝胶的流变学行为密切相关。如图4d所示,各组G′随着温度的升高呈现先降低后升高的变化趋势,25~60 ℃时,G′降低可能系轻肌球蛋白变性所致,60~70 ℃时,G′上升则主要归因于肌球蛋白变性后形成的凝胶网络结构[34]。CR组G′低于其他各组,这可能是因为CR组低盐含量导致肌球蛋白溶解不完全,蛋白质交联不充分。而添加Lys和Arg后,肌球蛋白溶解度增加,加热过程中肌球蛋白分子间形成更多的二硫键,疏水相互作用和二硫键增加,从而显著提升凝胶化能力,G′升高。此外,Arg所含胍基可能进一步增强肌球蛋白的溶解性[35],这解释了添加Arg肉糜G′高于添加Lys肉糜的现象。综上所述,添加Lys、Arg会使G′升高,有效提高减盐乳化肠的质构特性。
2.6 Lys、Arg添加量对低盐乳化肠表观与微观结构的影响
如图5a所示,C组乳化肠表面光滑平整,而CR组乳化肠表面粗糙、质地不均匀,可能与低盐含量导致肌球蛋白溶解不完全,无法更好地发生交联有关,添加Lys、Arg能够有效改善这一情况,使乳化肠切面光滑、平整。
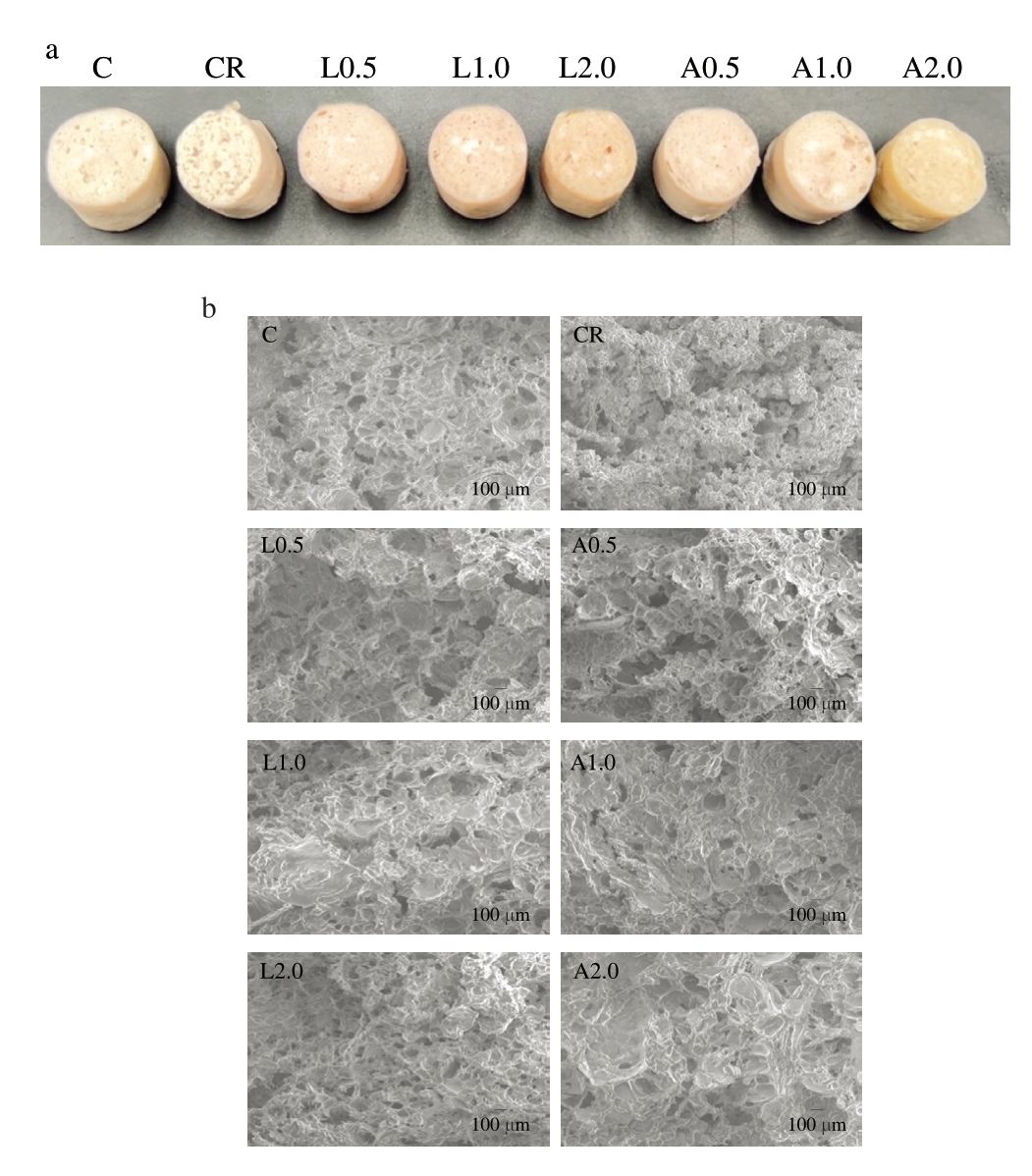
图5 不同Lys、Arg添加量对低盐乳化肠表观特征(a)和微观结构(b)的影响
Fig. 5 Effects of different Lys and Arg additions on the apparent characteristics (a) and microstructure (b) of low-salt emulsified sausage
如图5b所示,与C组相比,CR组乳化肠表面更粗糙、密度更小、孔径不均匀,而添加Lys、Arg能够有效改善乳化肠的微观结构。随着Lys、Arg添加量的增加,乳化肠微观结构更加致密、有序,接近C组网状结构。微观结构中,凝胶网络的形成源于蛋白质分子间吸引力和排斥力的动态平衡,这些作用力来自共价键(如二硫键)和非共价键(如氢键、离子键和疏水相互作用)。添加Lys和Arg能够增加肌球蛋白的溶解性,促使蛋白质分子展开并暴露更多交联位点[28],进而形成致密的三维凝胶网络,展现出优异的凝胶特性和良好的保水能力。综上,添加Lys、Arg可通过促进肌球蛋白溶解和凝胶化改善低盐乳化肠的微观结构,使其呈现良好的质构特性、外观状态及保水性能。
2.7 Lys、Arg添加量对低盐乳化肠贮藏过程中TBARS值、总巯基、总羰基、AAS含量的影响
TBARS值反映肉制品中不饱和脂肪酸氧化分解产生的二次氧化产物(如丙二醛)的积累量,可作为脂肪氧化程度的评价指标。如图6a所示,贮藏3 d时,与C组相比,CR组TBARS值未发生显著变化(P>0.05),但与CR组相比,添加Lys、Arg各组TBARS值呈降低趋势,且TBARS值随着Lys、Arg添加量的增加而降低。贮藏20 d时,各组(除A2.0组外)乳化肠TBARS值较贮藏3 d时显著升高(P<0.01、P<0.001),这表明脂肪氧化程度不断升高,但添加Lys和Arg乳化肠脂肪氧化速率较CR组缓慢。Xu Peng等[36]研究指出,Lys和Arg能够抑制栀子苷混合物中的脂氧合酶活性,其作用机制在于Lys和Arg既能清除自由基,又能螯合亚铁离子,从而显著抑制脂质和蛋白质氧化。贮藏过程中,Lys和Arg持续发挥抗氧化作用,从而有效延缓脂肪氧化进程。
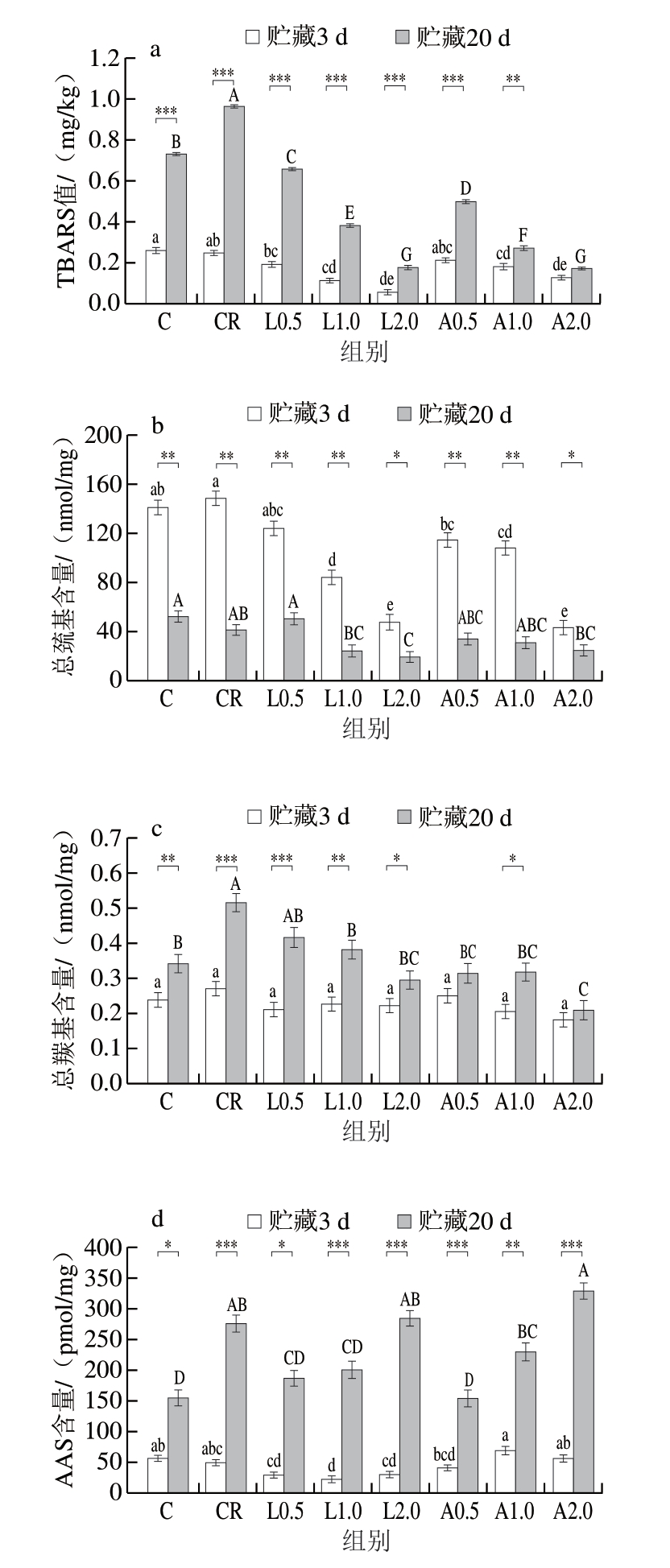
图6 不同Lys、Arg添加量对低盐乳化肠TBARS值(a)、总巯基含量(b)、总羰基含量(c)和AAS含量(d)的影响
Fig. 6 Effects of different Lys and Arg additions on TBARS value (a),total sulfhydryl content (b), total carbonyl content (c), and AAS content (d) of low-salt emulsified sausage
蛋白质氧化会导致营养价值降低和功能特性受损,导致乳化肠品质下降。在加工和贮藏过程中,乳化肠中的蛋白质暴露于氧环境易发生氧化反应,总巯基和总羰基含量变化可有效反映蛋白氧化程度。如图6b所示,贮藏3 d时,CR组与C组总巯基含量差异不显著(P>0.05),除L0.5组外,其余各组总巯基含量均显著低于CR组(P<0.05),随着Lys、Arg添加量的增加,总巯基含量逐渐降低。贮藏20 d时,随着氧化反应的进行,各组总巯基含量均呈现显著下降趋势(P<0.05、P<0.01)。对比可知,添加Lys和Arg后,乳化肠蛋白在贮藏期间会损失更多巯基。添加Lys和Arg可诱导部分肌球蛋白展开,暴露出更多活性巯基,从而提高肌球蛋白溶解度[37]。这些暴露出的巯基在加热形成凝胶过程中将参与形成二硫键,促进更精细凝胶网络结构的形成,这也解释了添加Lys、Arg各组巯基损失更多的现象,间接证实了Lys、Arg可能通过调节肌球蛋白溶解状态改善减盐乳化肠保水性与质构特性的作用机制。
如图6c所示,贮藏3 d时,各组总羰基含量无显著差异(P>0.05),贮藏20 d时,各组总羰基含量均呈上升趋势,但与CR组相比,添加Lys、Arg各组总羰基含量均降低,且随着Lys、Arg添加量的增加,总羰基含量呈下降趋势,可能是由于Lys、Arg可与羟自由基等活性氧物质反应[38],生成2-氨基己二醛、2-氧组氨酸和谷氨酸半醛等产物,Lys和Arg也可通过螯合亚铁离子有效抑制蛋白质氧化,从而有效抑制自由基对蛋白质的氧化损伤,降低乳化肠总羰基含量,且抑制效果与Lys、Arg添加量呈正相关。
Akagawa等[39]在氧化肌球蛋白中鉴定出特征性羰基化合物AAS,该物质是赖氨酸氧化脱氨形成的主要羰基产物,被认为是蛋白质氧化损伤的生物标志物。如图6d所示,贮藏3 d时,C组与CR组AAS含量无显著差异(P>0.05),与CR组相比,Lys添加量为1.0%时,AAS含量显著降低(P<0.05);而Arg添加量对AAS含量无显著影响(P>0.05)。贮藏20 d时,与CR组相比,添加0.5%、1.0% Lys或添加0.5% Arg均能够显著抑制AAS生成,但添加2.0% Lys、Arg未表现出显著的抑制效果。这可能是由于添加Lys、Arg可促使更多肌球蛋白分子展开,暴露出更多Lys残基,而羰基化合物的形成主要来自Lys等氨基酸残基的氧化[40]。另外,与贮藏3 d相比,贮藏20 d时各组AAS含量均显著升高(P<0.05、P<0.01、P<0.001),表明随着贮藏时间的延长,蛋白氧化程度逐渐加深。
3 结 论
本研究发现乳化肠盐含量从1.6%降至0.8%对其保水性、色泽和质构特性等有不利影响,而添加Lys、Arg可有效改善低盐乳化肠保水性、色泽、质构特性等,使pH值升高、微观结构更加致密且有效降低其低温贮藏过程中的脂肪和蛋白质氧化。这可能是由于Lys、Arg能够提高肌球蛋白的溶解度,并促进其凝胶化,进而改善肉糜的流变学特性,同时促进二硫键交联,形成更致密的三维网络结构。综上所述,在肉制品的加工过程中,碱性氨基酸展现出代替钠盐的潜力。然而,本研究中乳化肠仅添加食盐、Lys、Arg 3 种添加剂,与实际生产配方存在较大差异,因此Lys、Arg作用于乳化肠实际生产配方中的作用效果有待进一步研究。
[1] ZHANG Y W, GUO X Y, PENG Z Q, et al. A review of recent progress in reducing NaCl content in meat and fish products using basic amino acids[J]. Trends in Food Science & Technology, 2022, 119: 215-226.DOI:10.1016/j.tifs.2021.12.009.
[2] 王卫, 张锐, 张佳敏, 等. 肉制品加工中的减盐技术: 研究进展与应用展望[J]. 肉类研究, 2022, 36(7): 54-60. DOI:10.7506/rlyj1001-8123-20220328-026.
[3] 刘贺. 减盐相关产品研究进展及开发现状[J]. 中国调味品, 2017,42(11): 175-180. DOI:10.3969/j.issn.1000-9973.2017.11.039.
[4] 张东, 李洪军, 吴练军, 等. 减少肉制品中氯化钠含量的研究进展[J]. 食品与发酵工业, 2017, 43(11): 238-243. DOI:10.13995/j.cnki.11-1802/ts.014561.
[5] COWAN A, LIBBY E N, FITZMAURICE C, et al. Global burden of multiple myeloma: a systematic analysis for the global burden of disease study[J]. Journal of Clinical Oncology, 2018, 386(15): e20023.DOI:10.1200/jco.2018.36.15_suppl.e20023.
[6] 李冬梅, 任响, 林峻鑫, 等. 碱性氨基酸影响肉品品质及机理的研究进展[J]. 食品与生物技术学报, 2022, 41(8): 35-42. DOI:10.3969/jissn.1673-1689.2022.08.004.
[7] 周向辉, 刘昶, 张秋会. L-赖氨酸和L-组氨酸对低盐乳化肠品质特性的影响[J]. 中国食品添加剂, 2023, 34(4): 197-204. DOI:10.19804/j.issn1006-2513.2023.04.023.
[8] 胡跃. 精氨酸/赖氨酸协同天然抗氧化剂对乳化肠稳定性的影响[D].合肥: 合肥工业大学, 2022. DOI:10.27101/d.cnki.ghfgu.2022.000914.
[9] SUN P Z, ZHANG X D, REN X, et al. Effect of basic amino acid pretreatment on the quality of canned Antarctic krill[J]. Food and Bioprocess Technology, 2023, 16(8): 1690-1702. DOI:10.1007/s11947-023-03027-y.
[10] WANG M Y, KANG J C, CHEN L, et al. Suppression mechanism of L-lysine on the epigallocatechin-3-gallate-induced loss of myofibrillar protein gelling potential[J]. Food Research International, 2023, 169:112928. DOI:10.1016/j.foodres.2023.112928.
[11] GUO X X, TAO S, PAN J F, et al. Effects of L-lysine on the physiochemical properties and sensory characteristics of salt-reduced reconstructed ham[J]. Meat Science, 2020, 166: 108133. DOI:10.1016/j.meatsci.2020.108133.
[12] 吕广英, 黄圣杰, 胡荣柳, 等. 脂肪替代物对乳化肠品质的影响研究[J]. 粮食与油脂, 2024, 37(7): 83-87. DOI:10.3969/j.issn.1008-9578.2024.07.014.
[13] BLUMENTHAL J A, SHERWOOD A. Missing ingredients for a lifestyle recipe to treat hypertension[J]. Journal of Thoracic Disease,2018, 10(2): 653. DOI:10.21037/jtd.2018.01.06.
[14] 赵改名, 司羽平, 李嘉辉, 等. 乳化脂对牛肉乳化肠品质的影响[J]. 肉类研究, 2024, 38(5): 7-14. DOI:10.7506/rlyj1001-8123-20240417-082.
[15] 张鑫, 闫玉雯, 朱迎春. 超高压处理对低盐牛肉乳化肠品质的影响[J]. 核农学报, 2021, 35(10): 2352-2360. DOI:10.11869/j.issn.100-8551.2021.10.2352.
[16] 陶硕, 马仁超, 郭秀霞, 等. 氯化钠和三聚磷酸钠添加量对蒸煮火腿品质的影响[J]. 肉类研究, 2019, 33(12): 18-24. DOI:10.7506/rlyj1001-8123-20190916-218.
[17] 陶硕, 郭秀霞, 辛丘岩, 等. 滚揉时间和添加赖氨酸对低盐蒸煮火腿品质的影响[J]. 肉类研究, 2020, 34(5): 11-17. DOI:10.7506/rlyj1001-8123-20200220-044.
[18] LI S, LIN S Y, JIANG P F, et al. Contribution of κ-/ι-carrageenan on the gelling properties of shrimp myofibrillar protein and their interaction mechanism exploration[J]. Journal of the Science of Food and Agriculture, 2023, 103(2): 524-533. DOI:10.1002/jsfa.12163.
[19] WESTPHALEN A D, BRIGGS J L, LONERGAN S M. Influence of pH on rheological properties of porcine myofibrillar protein during heat induced gelation[J]. Meat Science, 2005, 70(2): 293-299.DOI:10.1016/j.meatsci.2005.01.015.
[20] 胡跃, 周存六. L-精氨酸与迷迭香提取物联合处理对低钠低脂乳化香肠品质的影响[J]. 肉类研究, 2022, 36(7): 27-34. DOI:10.7506/rlyj1001-8123-20220315-019.
[21] BOTSOGLOU E, GOVARIS A, AMBROSIADIS I, et al. Effect of olive leaf (Olea europea L.) extracts on protein and lipid oxidation in cooked pork meat patties enriched with n-3 fatty acids[J]. Journal of the Science of Food and Agriculture, 2014, 94(2): 227-234.DOI:10.1002/jsfa.6236.
[22] LUND M N, LAMETSCH R, HVIID M S, et al. High-oxygen packaging atmosphere influences protein oxidation and tenderness of porcine longissimus dorsi during chill storage[J]. Meat Science, 2007,77(3): 295-303. DOI:10.1016/j.meatsci.2007.03.016.
[23] 王守印, 王雯慧, 赵亚楠, 等. 迷迭香提取物与茶多酚对猪肉饼品质及蛋白氧化的影响[J]. 肉类研究, 2023, 37(9): 8-13. DOI:10.7506/rlyj1001-8123-20230509-040.
[24] 李俊. 赖氨酸和精氨酸分别对猪肉肠品质特性影响的研究[D].合肥: 合肥工业大学, 2013. DOI:10.7666/d.D345653.
[25] NING C, LI L X, FANG H M, et al. L-Lysine/L-arginine/L-cysteine synergistically improves the color of cured sausage with NaNO2 by hindering myoglobin oxidation and promoting nitrosylmyoglobin formation[J]. Food Chemistry, 2019, 284: 219-226. DOI:10.1016/j.foodchem.2019.01.116.
[26] 周坤, 盖静. 西式火腿类肉制品保水性问题探析[J]. 肉类工业,2016(12): 6-8. DOI:10.3969/j.issn.1008-5467.2016.12.002.
[27] LI S Y, LI L X, ZHU X X, et al. Conformational and charge changes induced by L-arginine and L-lysine increase the solubility of chicken myosin[J]. Food Hydrocolloids, 2019, 89: 330-336. DOI:10.1016/j.foodhyd.2018.10.059.
[28] 梁海燕. 几种添加剂对肉制品保水性的影响[J]. 食品工程, 2003(3):15-16. DOI:10.3969/j.issn.1673-6044.2003.03.005.
[29] 曹云刚, 梁光灿, 张鑫, 等. 碱性氨基酸调控肌原纤维蛋白加工性能及肉品品质研究进展[J]. 食品科学, 2022, 43(21): 341-348.DOI:10.7506/spkx1002-6630-20210821-284.
[30] MCDONNELL C K, ALLEN P, DUGGAN E, et al. The effect of salt and fibre direction on water dynamics, distribution and mobility in pork muscle: a low field NMR study[J]. Meat Science, 2013, 95(1):51-58. DOI:10.1016/j.meatsci.2013.04.012.
[31] LEI Z, FU Y, XU P, et al. Effects of L-arginine on the physicochemical and gel properties of chicken actomyosin[J]. International Journal of Biological Macromolecules, 2016, 92: 1258-1265. DOI:10.1016/j.ijbiomac.2016.08.040.
[32] GENG S T, WANG H H, WANG X L, et al. A non-invasive NMR and MRI method to analyze the rehydration of dried sea cucumber[J].Analytical Methods, 2015, 7(6): 2413-2419. DOI:10.1039/c4ay03007a.
[33] DOMÍNGUEZ R, PATEIRO M, MUNEKATA P E S, et al. Protein oxidation in muscle foods: a comprehensive review[J]. Antioxidants,2021, 11(1): 60. DOI:10.3390/antiox11010060.
[34] LIU J J, ZHU K K, YE T, et al. Influence of konjac glucomannan on gelling properties and water state in egg white protein gel[J].Food Research International, 2013, 51(2): 437-443. DOI:10.1016/j.foodres.2013.01.002.
[35] REN X, ZHANG X Y, SUN P Z, et al. Impact of L-arginine on the quality of heat-treated Antarctic krill: influence of pH and the guanidinium group[J]. Food Research International, 2023, 174:113499. DOI:10.1016/j.foodres.2023.113499.
[36] XU P, ZHENG Y D, ZHU X X, et al. L-Lysine and L-arginine inhibit the oxidation of lipids and proteins of emulsion sausage by chelating iron ion and scavenging radical[J]. Asian-Australasian Journal of Animal Sciences, 2017, 31(6): 905. DOI:10.5713/ajas.17.0617.
[37] ZHANG X H, PAN H, JIANG X, et al. Study on the mechanism of soy protein isolate to improve quality of reduced-salt Hypophthalmichthys molitrix surimi gel: focus on gel quality, protein structure, and in vitro digestibility[J]. Food Chemistry: X, 2023, 20: 100878. DOI:10.1016/j.fochx.2023.100878.
[38] AYADI M A, KECHAOU A, MAKNI I, et al. Influence of carrageenan addition on turkey meat sausages properties[J].Journal of food Engineering, 2009, 93(3): 278-283. DOI:10.1016/j.jfoodeng.2009.01.033.
[39] AKAGAWA M, SASAKI D, ISHII Y, et al. New method for the quantitative determination of major protein carbonyls, α-aminoadipic and γ-glutamic semialdehydes: investigation of the formation mechanism and chemical nature in vitro and in vivo[J]. Chemical Research in Toxicology,2006, 19(8): 1059-1065. DOI:10.1021/tx060026p.
[40] STADTMAN E R, LEVINE R L. Free radical-mediated oxidation of free amino acids and amino acid residues in proteins[J]. Amino acids,2003, 25: 207-218. DOI:10.1007/s00726-003-0011-2.