熏煮香肠是一种典型的低温肉制品,以牛肉为主要原料,经原料肉处理、腌制、灌肠、蒸煮、干燥、烟熏、冷却等工艺制成的蒸煮灌肠类肉制品[1]。在热加工过程中,肉制品经过煮制、熏制及添加亚硝酸盐等步骤,易形成杂环胺和N-亚硝胺等有害物质。流行病学研究[2]显示,摄入杂环胺与N-亚硝胺会增加患直肠癌、食道癌、胃癌和其他疾病的风险。
随着我国公众健康意识的增强,利用天然抗氧化剂清除自由基已成为抑制肉制品中杂环胺生成的重要途径之一[3]。这类物质的核心功效源于其含有的酚羟基结构赋予的强自由基清除能力,如花青素、草本提取物及香辛料等天然来源成分[4-6]。值得关注的是,维生素类物质在抑制杂环胺方面具有双重作用,一方面,维生素是维持人体健康必需的营养素,另一方面,其抗氧化特性对杂环胺抑制具有显著效果[7]。包香香[8]研究显示,VC、VB3和VB6均可抑制罗非鱼饼中致癌物2-氨基-3,8-二甲基咪唑并喹喔啉(2-amino-3,8-dimethylimidazo[4,5-f]quinoxaline,MeIQx)的生成,其中VB6效果最显著,在模拟实验和实际样品中,其抑制率分别达82.72%和78.54%。张晨霞[9]在油炸鸡肉中量化了茶多酚与VE的剂量效应关系,最佳浓度下分别实现45.2%和67.2%的抑制率,其机制涉及阻断吡嗪阳离子自由基链式反应。Wong等[10]系统揭示了B族维生素(VB1/VB3/VB6/VB7)通过降低中间产物浓度抑制杂环胺合成的路径。综上所述,在肉制品中添加具有天然抗氧化性的维生素具备抑制杂环胺形成的潜力。VC是人体无法自主合成、必须通过膳食摄取的水溶性维生素,具有强抗氧化性。尽管其在抑制肉制品中脂肪和蛋白质氧化方面已有充分研究,但关于VC对熏煮香肠中杂环胺和N-亚硝胺的抑制作用鲜见报道。
本研究分析VC对牛肉熏煮香肠中杂环胺及N-亚硝胺形成的影响,并从分子角度利用密度泛函理论分析其清除自由基的抗氧化机理,为减少肉制品中杂环胺和N-亚硝胺的含量提供理论依据,有效降低此类致癌物带来的健康风险,为开发兼具营养强化与食品安全保障功能的肉制品加工技术提供理论支撑。
1 材料与方法
1.1 材料与试剂
牛肉购自吉林省长春皓月清真肉业股份有限公司。
VC(食品级) 石药集团维生药业(石家庄)有限公司;氢氧化钠、无水硫酸钠、硫酸亚铁、乙醇、水杨酸(均为分析纯) 国药集团化学试剂有限公司;磷酸二氢钾、磷酸氢二钠、浓氨水、过氧化氢、Tris-HCl、邻苯三酚、盐酸(均为分析纯) 上海麦克林生化科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2′-联氮-双(3-乙基苯并噻唑啉-6-磺酸)(2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、乙酸乙酯、乙酸铵、二氯甲烷、甲醇(均为分析纯) 上海阿拉丁生化科技股份有限公司;9H-吡啶[3,4-b]吲哚(9H-pyrido[3,4-b]indole,Norharman)、1-甲基-9H-吡啶并[3,4-b]吲哚(1-methyl-9H-pyrido[3,4-b]indole,Harman)、MeIQx、2-氨基-1-甲基-6-苯基咪唑[4,5-b]吡啶(2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine,PhIP)标准品 美国Santa Cruz Biotechnology公司。
1.2 仪器与设备
HX-J3099小型实验用绞肉机 佛山市海迅电器有限公司;DK-98-1电热恒温水浴锅 天津泰斯特仪器有限公司;UV-8000S紫外-可见分光光度计 上海元析仪器有限公司;GB204电子天平 上海天普分析仪器有限公司;SYZ0.5D-A多功能烟熏炉 青岛德维机械制造有限公司;FJ200-SH数显高速分散均质机 北京标本模型厂;TGL-10B台式离心机 上海安亭仪器厂;DHG-101-3A电热恒温干燥箱 上海一恒科学仪器有限公司;API-4000高效液相色谱串联三重四极杆质谱仪 日本岛津公司;7000D气相色谱-质谱仪 安捷伦科技(中国)有限公司。
1.3 方法
1.3.1 牛肉熏煮香肠基本配方
牛肉100.0 g、食盐2.5 g、复合磷酸盐0.3 g、亚硝酸钠120.0 mg、大豆分离蛋白3.0 g、马铃薯淀粉3.0 g、味精0.6 g、卡拉胶0.3 g、白砂糖1.0 g、五香粉0.4 g、谷氨酰胺转胺酶(酶活力≥100 U/g)0.6 g、水20.0 g。
1.3.2 牛肉熏煮香肠制备工艺流程及操作要点
工艺流程:原料肉处理→绞肉→腌制→斩拌→灌肠→煮制→熏制→冷却→包装→成品。
操作要点:原料肉处理、绞肉:将解冻后的牛肉修整,剔除其筋腱、脂肪和杂物,取修整后的原料肉,按11∶89(m/m)肥瘦比绞成肉糜备用;腌制:添加食盐、复合磷酸盐和亚硝酸钠腌制,与肉糜混合均匀,在4 ℃冰箱中腌制12 h;斩拌:加入其他辅料与腌制好的肉糜均匀混合,斩拌2 min;灌肠:将腌制好的肉糜灌入肠衣,扎针放气;煮制:采用水煮法,于80 ℃煮制40 min;熏制:将煮制后的香肠放入烟熏炉中,在80 ℃下熏制140 min;冷却及包装:冷却后使用真空包装机进行包装;成品:将检验达标的熏煮香肠产品按规定冷藏保存。
1.3.3 单因素试验设计
通过单因素试验研究在腌制过程中分别加入100、200、300、400、500 mg/kg VC对牛肉熏煮香肠中杂环胺及N-亚硝胺形成的影响,并分析其对羟自由基、DPPH自由基、超氧阴离子自由基、ABTS阳离子自由基的清除率。
1.3.4 羟自由基清除率测定
参考Jinap等[11]的方法并加以改进。称取3.0 g肉样,研磨成肉泥,加入100 mL 50%(V/V)乙醇溶液,60 ℃条件下保温17 h,滤纸过滤2 次,得到样品提取液。取4 mL样品提取液,依次加入4 mL 9 mmol/L FeSO4溶液、4 mL 9 mmol/L乙醇-水杨酸溶液,最后加入4 mL 8.8 mmol/L H2O2溶液,摇匀,在37 ℃下恒温水浴加热20 min后取出,测定其在527 nm波长处的吸光度。羟自由基清除率按式(1)计算:
式中:A1为样品提取液+FeSO4溶液+乙醇-水杨酸溶液+H2O2溶液的吸光度;A2为未加入H2O2溶液所测得的吸光度;A0为以4.0 mL去离子水替代样品提取液所测得的吸光度。
1.3.5 DPPH自由基清除率测定
参考郑大贵等[12]的方法并略作修改。称取3.0 g肉样,研磨成肉泥,加入100 mL 50%(V/V)乙醇溶液,60 ℃条件下保温17 h,滤纸过滤2 次,得到样品提取液。取2 mL样品提取液于试管中,加入2 mL 2×10-4 mol/L DPPH-无水乙醇溶液,充分混匀,室温静置30 min,测定其在517 nm波长处的吸光度。DPPH自由基清除率按式(2)计算:
式中:A3为2 mL无水乙醇+2 mL DPPH-无水乙醇溶液的吸光度;A4为2 mL样品提取液+2 mL DPPH-无水乙醇溶液的吸光度;A5为2 mL样品提取液+2 mL无水乙醇的吸光度。
1.3.6 超氧阴离子自由基清除率测定
参照Shah等[13]的方法并略作修改。称取1.0 g搅碎的香肠样品,用含1%盐酸和50%甲醇(V/V)的盐酸-甲醇混合溶液匀浆,将匀浆液定容至40.0 mL,避光放置2 h,离心(6 000 r/min、5 min)3 次后,取20 mL上清液,用甲醇稀释至50.0 mL,得到样品提取液;取4.5 mL 0.05 mol/L Tris-HCl缓冲液于试管中,加入4.0 mL样品提取液,混匀后,25 ℃恒温水浴20 min,取出后加入0.5 mL经25 ℃恒温预热的0.03 mol/L邻苯三酚溶液,迅速混匀,倒入比色皿,反应2 min后,于325 nm波长处测定吸光度,超氧阴离子自由基清除率按式(3)计算:
式中:A7为样品提取液+Tris-HCl缓冲液+邻苯三酚混合液的吸光度;A8为未加入邻苯三酚溶液所测得的吸光度;A6为以等体积去离子水替代样品提取液所测得的吸光度。
1.3.7 ABTS阳离子自由基清除率测定
参考梁红敏等[14]的方法,将pH 7.4的0.1 mol/L磷酸盐缓冲液与7.3 mmol/L ABTS溶液1∶1(V/V)混合,加入适量双氧水,使其在734 nm波长处的吸光度稳定在0.7~0.8。称取3.0 g肉样,研磨成肉泥,加入100 mL 50%(V/V)乙醇溶液,60 ℃条件下保温17 h,滤纸过滤2 次,得到样品提取液。取200 μL样品提取液与6 mL稀释后的ABTS溶液于试管中,充分混匀,室温静置30 min,于734 nm波长处测定吸光度。ABTS阳离子自由基清除率按式(4)计算:
式中:A样品为200 μL样品提取液+6 mL稀释ABTS溶液的吸光度;A空白为200 μL甲醇+6 mL稀释ABTS溶液的吸光度。
1.3.8 杂环胺提取和测定
参照先前报道[14-16]的方法从香肠中提取杂环胺。取(2.000±0.001)g碎肉样品,依次加入200 μL杂环胺内标工作液(100 μg/L)、10 mL乙酸乙酯和2 mL 1 mol/L NaOH溶液,经涡旋振荡3 min(660×g)、超声处理(100 W)20 min(20 ℃)及离心5 min(2 652×g),重复提取2 次。上清液经PRS固相萃取小柱(5 mL二氯甲烷活化)处理后,依次用6 mL二氯甲烷、6 mL 0.1 mol/L HCl溶液、15 mL甲醇-0.1 mol/L HCl溶液(体积比1∶1)和2 mL蒸馏水洗脱,再通过C18小柱(甲醇/水活化)分离,最终收集非极性和极性组分各1 mL(甲醇、氨水体积比9∶1洗脱),合并后经0.22 μm滤膜过滤。
参考Zhang Yuxia等[17]的方法,采用API 4000高效液相色谱-串联质谱系统,使用Agilent SB-C18色谱柱(2.1 mm×50 mm,3.5 μm),流动相为0.1%甲酸(A)和乙腈(B),梯度程序:0~2 min,20% B;2~7 min,45% B;7~13 min,70% B;14~18 min,20% B。质谱参数:电子电离源;电压5.5 kV;离子源温度500 ℃;雾化器压力50 psi;采用多反应监测模式;进样体积10 μL;流速0.20 mL/min;以质量浓度(1~50 ng/mL)为横坐标,峰面积为纵坐标绘制标准曲线,定量4 种杂环胺(Norharman、Harman、MeIQx和PhIP)。
1.3.9 N-亚硝胺提取和测定
参考Yuan Yuan等[18]的方法并进行适当修改。取香肠碎肉(10.00±0.01)g置于50 mL烧杯,用20 mL二氯甲烷萃取15 min,经无水硫酸钠脱水并过滤,40 ℃氮吹仪蒸干后,用1.5 mL甲醇涡旋复溶1 min,最后经0.45 μm尼龙膜过滤,待测。
参照Zhou Yajun等[19]的方法并适当修改,以进行N-亚硝胺检测和定量。使用气相色谱-质谱仪搭载DBWax色谱柱(60 m×250 μm,0.5 μm),进样量1.00 μL,进样口温度250 ℃;载气系统含氦气(2.25 mL/min)和氮气(1.50 mL/min),升温程序:初始温度80 ℃,保温3 min,以10 ℃/min升温至240 ℃,保温15 min,传输线温度260 ℃;质谱采用特定离子监测模式,溶剂延迟3.83 min,总流速54.00 mL/min,系统压力19.36 psi。该方法可定量分析11 种N-亚硝胺化合物。
1.3.10 VC分子羟基键解离晗计算
参考Martínez等[20]的方法,VC分子羟基键解离晗按式(5)计算:
式中:H自由基为VC分子自由基的自由能/(kJ/mol);H原子为H原子的自由能/(kJ/mol);HVC为VC的能量/(kJ/mol)。
1.4 数据处理
使用ORCA 5.0.4量子化学软件[21],采用以水为溶剂的导体极化连续模型,通过密度泛函理论在r2SCAN-3c基组水平进行VC的结构优化、解离焓计算,并利用Multiwfn程序[22]的定量分子表面分析功能结合VMD软件作图功能,进行前线轨道(最高占据分子轨道(highest occupied molecular orbital,HOMO)、最低未占分子轨道(lowest unoccupied molecular orbital,LUMO))和分子表面静电势的可视化分析。
2 结果与分析
2.1 VC对牛肉熏煮香肠中自由基的清除能力
由图1可知,在牛肉熏煮香肠体系中,随着VC添加量不断增加,羟自由基、DPPH自由基、超氧阴离子自由基和ABTS阳离子自由基的清除率均呈持续上升趋势。这一现象可能是由于VC分子中的烯二醇结构可作为供氢体,通过电子转移直接中和羟自由基、DPPH自由基等,将它们还原成稳定分子;同时,VC还能与单线态氧发生反应,通过能量传递使其转化为基态氧。而且,VC在脱氢反应中生成的中间产物半脱氢VC自由基,可通过歧化反应循环再生,进而起到持续的抗氧化作用[23]。随着VC添加量的增加,这些多途径的协同作用使自由基清除效率显著提高(P<0.05)。当VC添加量提高至500 mg/kg时,体系内羟自由基与ABTS阳离子自由基清除率分别达60.25%和58.46%,而DPPH自由基和超氧阴离子自由基清除率相对更高,分别为89.25%和77.31%。
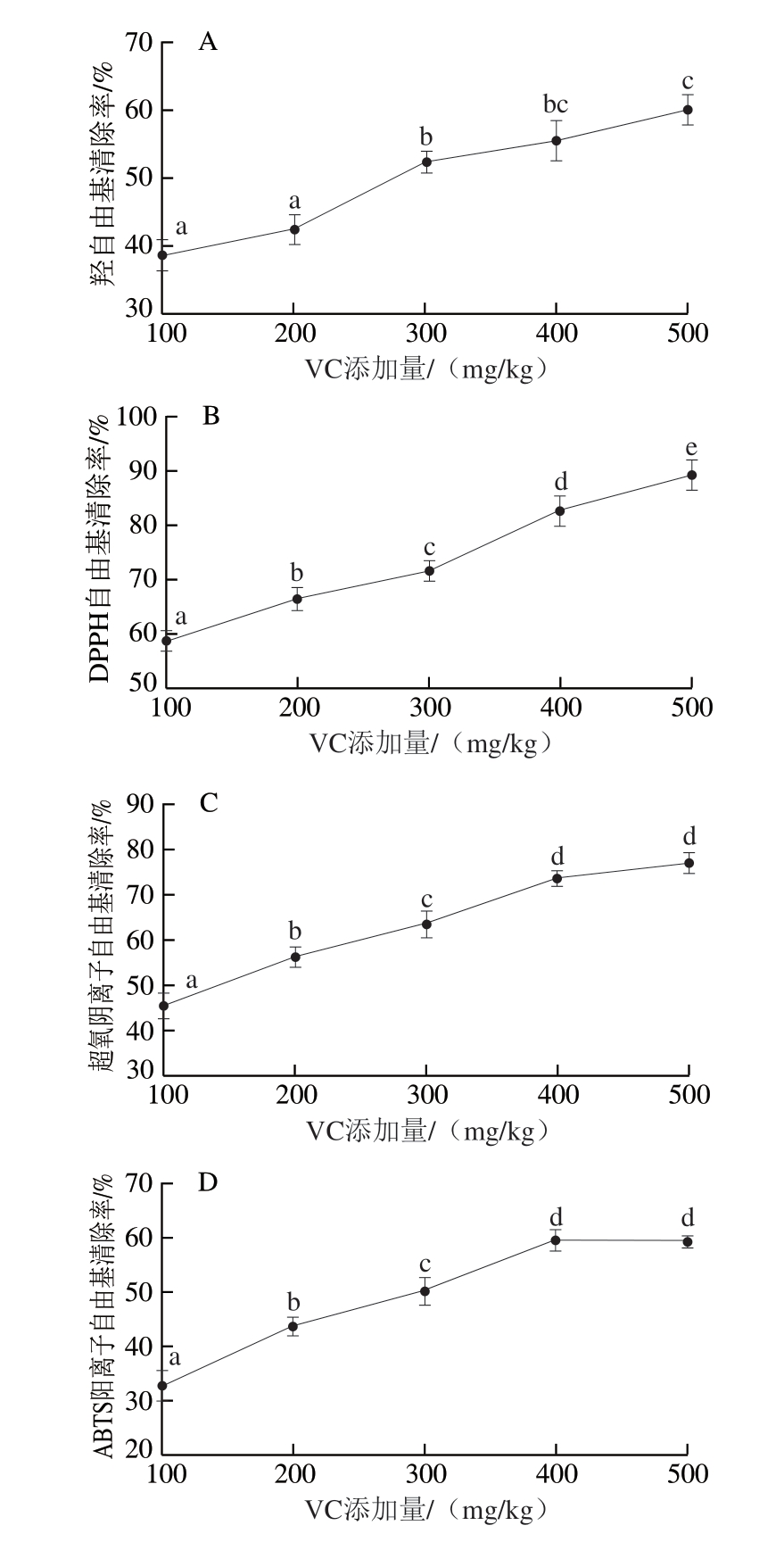
图1 VC对羟自由基(A)、DPPH自由基(B)、超氧阴离子自由基(C)和ABTS阳离子自由基(D)清除率的影响
Fig. 1 Scavenging effects of vitamin C on hydroxyl radical (A), DPPH radial (B), superoxide anion radical (C) and ABTS cation radical (D)
2.2 VC对牛肉熏煮香肠中杂环胺形成的影响
由表1可知,当VC添加量从100 mg/kg增加至500 mg/kg时,总杂环胺含量由9.96 ng/g下降至5.42 ng/g,清除率达到46%。其中,Norharman含量降低幅度最大,下降54%,而MeIQx因结构具有稳定性,抑制难度较高,含量降低约27%。这种现象的主要原因是VC通过阻断自由基生成减少美拉德反应中的羟自由基等、抑制脂肪氧化、干扰美拉德反应路径、抑制前体物质转化,以及络合金属离子等机制协同作用,从而显著降低杂环胺的生成[24-25]。袁怡等[7]研究水溶性维生素对三文鱼烤制中杂环胺形成的影响,结果表明,水溶性维生素可以明显抑制杂环胺的形成,这与本研究结果一致。
表1 VC添加量对香肠中杂环胺含量的影响
Table 1 Effect of vitamin C addition on heterocyclic amine contents in beef sausageng/g
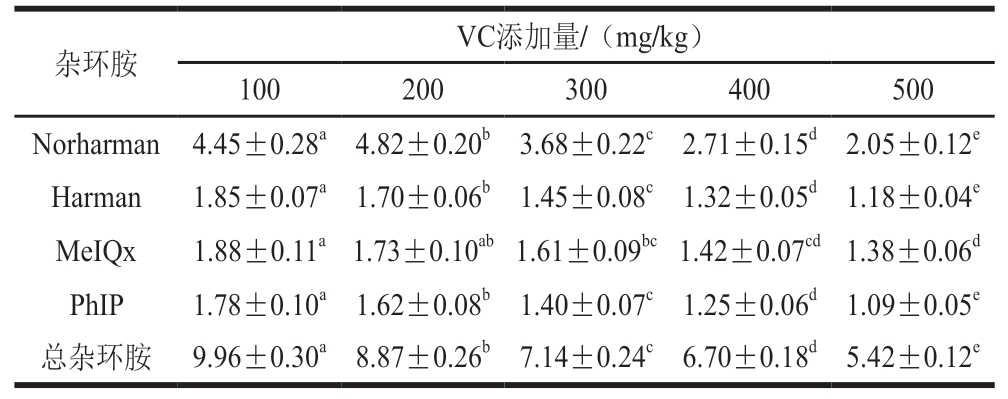
注:同行小写字母不同表示差异显著(P<0.05)。表2同。
杂环胺VC添加量/(mg/kg)100200300400500 Norharman 4.45±0.28a 4.82±0.20b 3.68±0.22c 2.71±0.15d 2.05±0.12e Harman1.85±0.07a 1.70±0.06b 1.45±0.08c 1.32±0.05d 1.18±0.04e MeIQx1.88±0.11a 1.73±0.10ab 1.61±0.09bc 1.42±0.07cd 1.38±0.06d PhIP1.78±0.10a 1.62±0.08b 1.40±0.07c 1.25±0.06d 1.09±0.05e总杂环胺 9.96±0.30a 8.87±0.26b 7.14±0.24c 6.70±0.18d 5.42±0.12e
2.3 VC对牛肉熏煮香肠中N-亚硝胺形成的影响
由表2可知,随着VC添加量的增加,总N-亚硝胺含量从(18.40±0.23)μg/kg显著降低至(11.01±0.33)μg/kg(P<0.05),下降40%。这可能是由于VC具有阻断N-亚硝基化合物合成的作用,使亚硝酸盐氧化生成NO,通过降低NO3-浓度抑制亚硝化反应。这一抑制作用可能源于VC的多重机制:首先,其强还原性可通过竞争性还原亚硝酸盐生成NO,降低亚硝化反应前体含量;其次,其抗氧化特性可清除自由基,减少蛋白质和脂质氧化产生的胺类物质。熊凤娇等[26]研究肉制品加工中控制N-亚硝胺形成的有效抑制剂,结果表明,VC可以有效抑制N-亚硝胺形成,与本研究结果相似。
表2 VC添加量对香肠中N-亚硝胺含量的影响
Table 2 Effect of vitamin C addition on N-nitrosamine contents in beef sausagesμg/kg
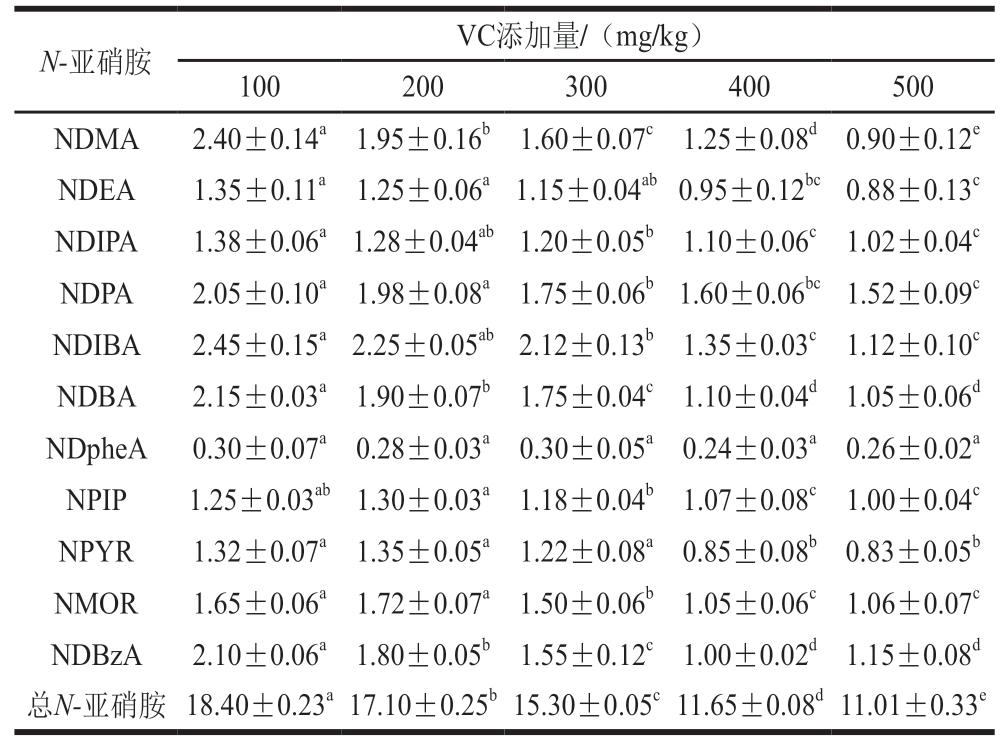
注:NDMA. N-二甲基亚硝胺(N-nitrosodimethylamine);NDEA. N-二乙基亚硝胺(N-nitrosodiethylamine);NDIPA. N-二异丙基亚硝胺(N-nitrosodiisopropylamine);NDPA. N-二丙基亚硝胺(N-nitrosodipropylamine);NDIBA. N-二异丁基亚硝胺(N-nitrosodiisobutylamine);NDBA. N-二丁基亚硝胺(N-nitrosodibutylamine);NDphe A. N-二苯基亚硝胺(N-nitrosodiphenylamine);NPIP. N-亚硝基哌啶(N-nitrosopiperidine);NPYR. N-亚硝基吡咯烷(N-nitrosopyrrolidine);NMOR. N-亚硝基吗啉(N-nitrosomorpholine);NDBzA. N-亚硝基二苄胺(N-nitrosodibenzylamine)。
N-亚硝胺VC添加量/(mg/kg)100200300400500 NDMA2.40±0.14a 1.95±0.16b 1.60±0.07c 1.25±0.08d 0.90±0.12e NDEA1.35±0.11a 1.25±0.06a 1.15±0.04ab 0.95±0.12bc 0.88±0.13c NDIPA1.38±0.06a 1.28±0.04ab 1.20±0.05b 1.10±0.06c 1.02±0.04c NDPA2.05±0.10a 1.98±0.08a 1.75±0.06b 1.60±0.06bc 1.52±0.09c NDIBA2.45±0.15a 2.25±0.05ab 2.12±0.13b 1.35±0.03c 1.12±0.10c NDBA2.15±0.03a 1.90±0.07b 1.75±0.04c 1.10±0.04d 1.05±0.06d NDpheA0.30±0.07a 0.28±0.03a 0.30±0.05a 0.24±0.03a 0.26±0.02a NPIP1.25±0.03ab 1.30±0.03a 1.18±0.04b 1.07±0.08c 1.00±0.04c NPYR1.32±0.07a 1.35±0.05a 1.22±0.08a 0.85±0.08b 0.83±0.05b NMOR1.65±0.06a 1.72±0.07a 1.50±0.06b 1.05±0.06c 1.06±0.07c NDBzA2.10±0.06a 1.80±0.05b 1.55±0.12c 1.00±0.02d 1.15±0.08d总N-亚硝胺 18.40±0.23a 17.10±0.25b 15.30±0.05c 11.65±0.08d 11.01±0.33e
2.4 VC自由基清除能力与杂环胺和N-亚硝胺抑制能力的相关性分析
由表3可知,VC对羟自由基、DPPH自由基、超氧阴离子自由基和ABTS阳离子自由基的清除率与香肠中总杂环胺含量均呈极显著负相关(P<0.01)。这可能是由于自由基是杂环胺生成过程中必不可少的物质,VC可以通过清除香肠中的自由基抑制杂环胺的形成。
表3 VC自由基清除率和杂环胺含量的相关系数
Table 3 Correlation coefficients between radical scavenging effects of vitamin C and heterocyclic amine contents
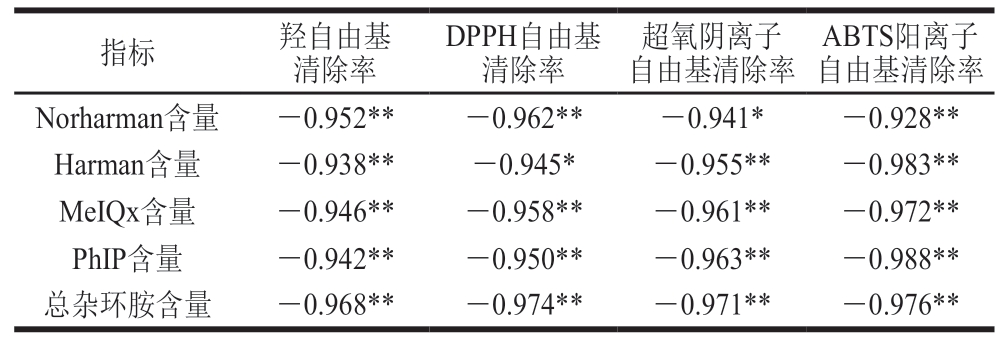
注:*.显著相关(P<0.05);**.极显著相关(P<0.01)。表4同。
ABTS阳离子自由基清除率Norharman含量-0.952**-0.962**-0.941*-0.928**Harman含量-0.938**-0.945*-0.955**-0.983**MeIQx含量-0.946**-0.958**-0.961**-0.972**PhIP含量-0.942**-0.950**-0.963**-0.988**总杂环胺含量-0.968**-0.974**-0.971**-0.976**指标羟自由基清除率DPPH自由基清除率超氧阴离子自由基清除率
由表4可知,VC对熏煮香肠中羟自由基、DPPH自由基、超氧阴离子自由基和ABTS阳离子自由基的清除率与香肠中总N-亚硝胺含量均呈极显著负相关(P<0.01)。这可能是由于VC具有的抗氧化性可将亚硝酸盐还原成NO,抑制自由基的链式反应,从而阻断了N-亚硝胺的形成途径[27]。
表4 VC自由基清除率和N-亚硝胺含量的相关系数
Table 4 Correlation coefficients between radical scavenging effects of vitamin C and N-nitrosamine contents
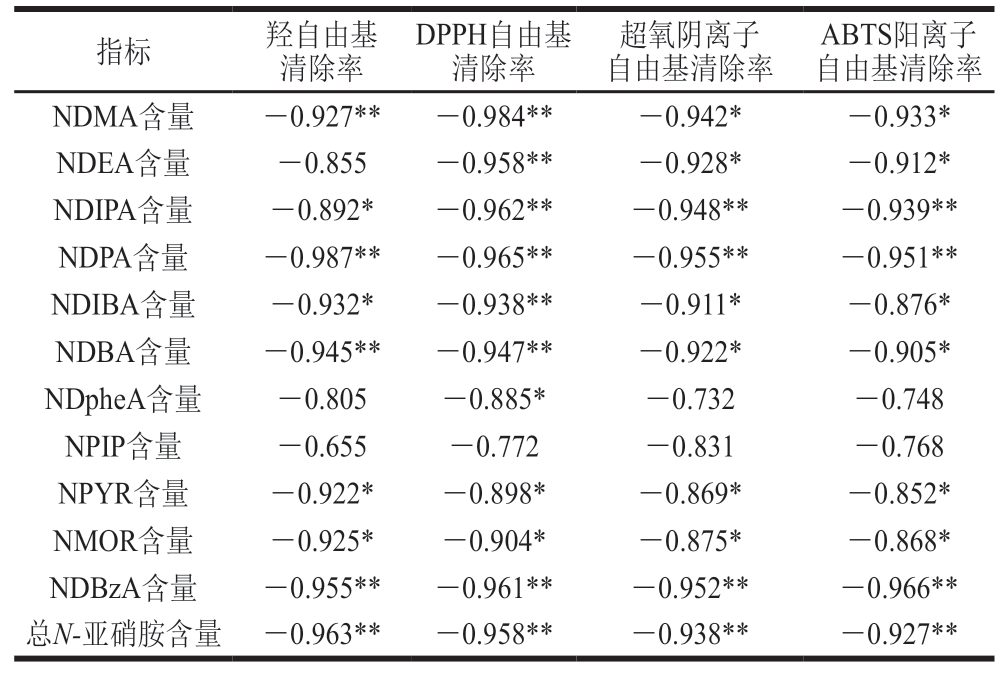
ABTS阳离子自由基清除率NDMA含量-0.927**-0.984**-0.942*-0.933*NDEA含量-0.855-0.958**-0.928*-0.912*NDIPA含量-0.892*-0.962**-0.948**-0.939**NDPA含量-0.987**-0.965**-0.955**-0.951**NDIBA含量-0.932*-0.938**-0.911*-0.876*NDBA含量-0.945**-0.947**-0.922*-0.905*NDpheA含量-0.805-0.885*-0.732-0.748 NPIP含量-0.655-0.772-0.831-0.768 NPYR含量-0.922*-0.898*-0.869*-0.852*NMOR含量-0.925*-0.904*-0.875*-0.868*NDBzA含量-0.955**-0.961**-0.952**-0.966**总N-亚硝胺含量 -0.963**-0.958**-0.938**-0.927**指标羟自由基清除率DPPH自由基清除率超氧阴离子自由基清除率
2.5 基于密度泛函理论的VC清除自由基分子机制分析
2.5.1 VC分子的结构优化
首先,进行VC分子的平面结构初始构建,由图2A可知,初始平面构型显示该分子含有4 个羟基基团,其中O3—H和O5—H位于六元环结构,而O2—H和O4—H则分布在侧链碳原子上,同时分子骨架中存在特征性的连二烯醇共轭体系。采用密度泛函理论进行几何优化后,获得能量最低的立体构型,如图2B所示。经振动频率分析确认该优化结构位于势能面全局极小点,满足后续量子化学计算对基态结构的要求,为研究其抗氧化活性提供了可靠的理论模型。
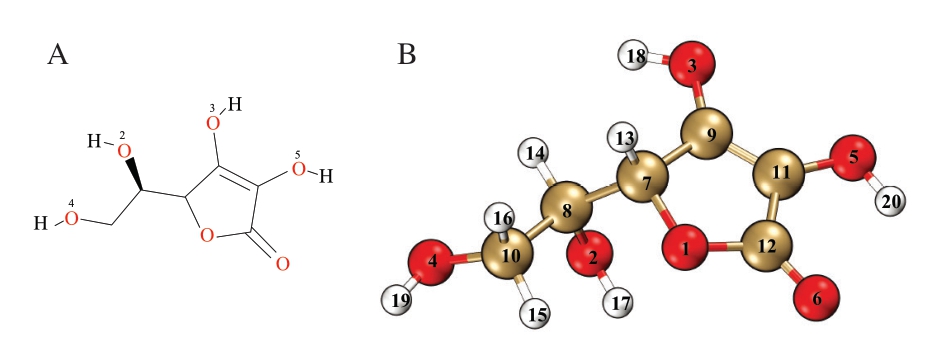
图2 VC分子的平面结构(A)和优化后的立体结构(B)
Fig. 2 Planar structure (A) and optimized three-dimensional structure (B) of vitamin C molecules
2.5.2 VC分子的前线轨道结构
基于量子化学理论,前线轨道(HOMO/LUMO)作为揭示分子反应活性的核心参数,其空间分布特征对阐明物质作用机制具有关键意义[28]。针对VC的轨道进行分析,由图3A可知,其HOMO电子云密集分布于连二烯醇环结构区域,而LUMO则覆盖整个环骨架及相邻羰基位点。作为最高能级占据轨道,HOMO的电子因能量优势更易脱离;LUMO作为最低能级空轨道则表现出显著的电子亲和力。由图3B可知,这种轨道特性表明,环结构上的羟基官能团(特别是O3—H和O5—H)通过释放质子实现电子转移,构成VC清除自由基的主要作用路径。轨道能级差与电子分布模式的综合分析从量子化学层面解释了该分子抗氧化活性的结构基础。
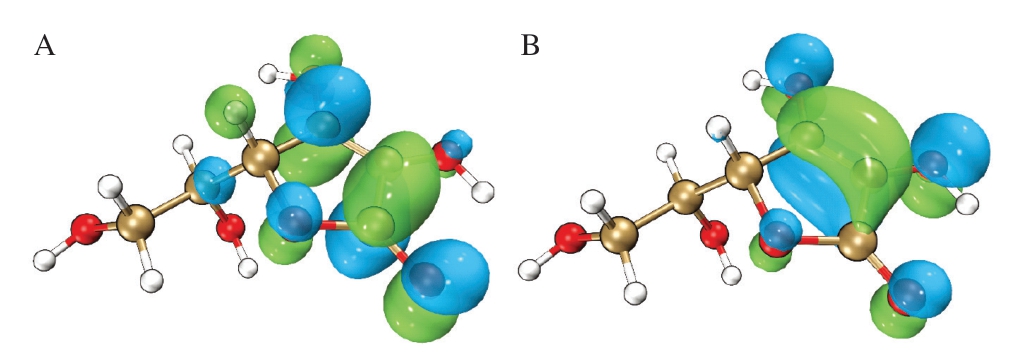
图3 VC的HOMO(A)和LUMO(B)
Fig. 3 Highest occupied molecular orbital (A) and lowest unoccupied molecular orbital (B) of vitamin C
2.5.3 VC分子的表面静电势
由图4A可知,负静电势区域在分子表面占据主导地位。如图4B所示,负静电势区域(蓝色部分)表示分子中具有较强电子供给能力的亲核位点,这类区域易参与电子转移反应,其还原能力与静电势负值呈正相关。相反,正静电势区域(红色部分)则对应电子亲和性较高的亲电活性位点[29],该分子表面静电势极值达到78.37 kcal/mol(最大值),并且分子结构中的O3—H、O5—H和O6—H羟基基团表现出较高的正静电势特征,这些位点因具有较高的电子获取能力,在抗氧化反应中展现出亲核取代倾向。这种电子分布特性与VC分子在生物体系中的强抗氧化活性具有直接关联。
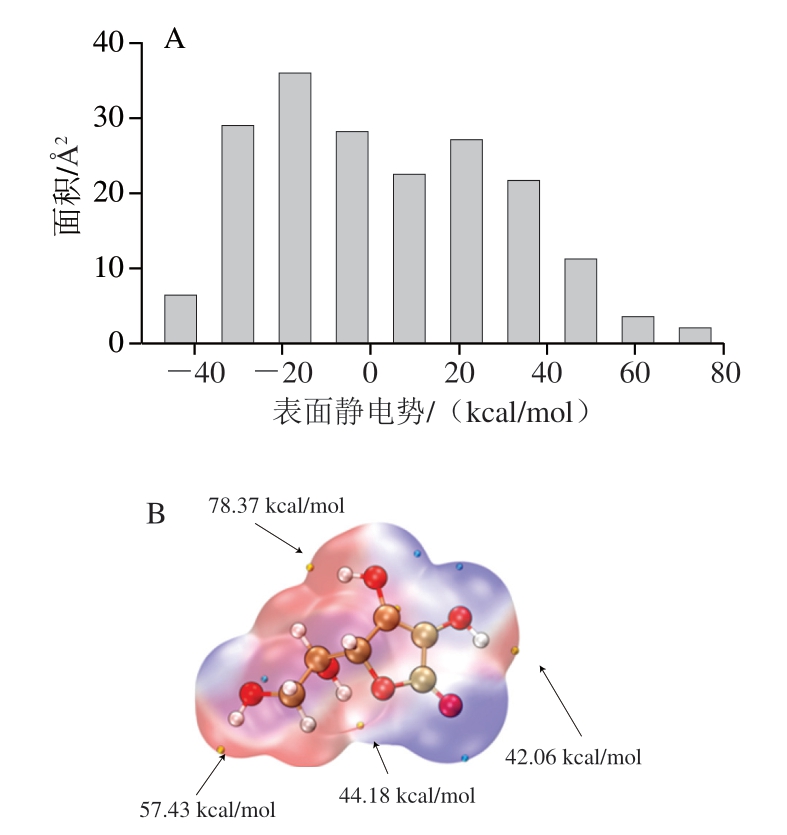
图4 VC分子表面静电势面积分布(A)和分子表面静电势极大值分布(B)
Fig. 4 Area distribution of electrostatic potential (A) and distribution of maximum electrostatic potential (B) on the surface of the vitamin C molecule
2.5.4 VC分子的羟基键解离晗
由表5可知,各羟基位点的键解离焓存在明显差异。具体而言,各羟基的键解离晗值按O3—H<O5—H<O4—H<O2—H的顺序递增,其中O3—H的键解离晗处于最低水平,为279.31 kJ/mol,而O2—H则为最高值,为404.18 kJ/mol。从热力学原理层面深入剖析,键解离焓是衡量化学键稳定性的关键指标。较高的键解离焓意味着破坏该化学键需要更多的能量输入,这表明该化学键具有较高的稳定性;反之,较低的键解离焓则表明化学键相对不稳定,更容易断裂。各羟基位点键解离焓呈现出的这种梯度特征,在VC分子参与自由基清除过程中具有重要意义。在该过程中,化学反应通常遵循能量最低原理,即具有较低活化能垒的反应路径更易发生。由于O3—H和O5—H基团具有相对较低的键解离焓,这使它们在反应中所需的活化能较低,能够通过氢原子转移机制优先参与氧化还原反应。氢原子转移机制是抗氧化反应中的一种重要途径,在这个过程中,VC分子通过提供氢原子与自由基结合,从而将自由基还原为稳定的分子,达到清除自由基的目的。基于以上分析,可以明确VC分子的抗氧化特性主要集中在其环所连接的羟基上。其中,O3—H和O5—H位点的羟基在香肠体系中发挥着关键作用,是VC分子实现自由基清除功能的核心位点。周敏娜[30]研究得出,VC分子环上羟基的还原能力大于链上的羟基,且链上的羟基还原能力仅次于环上,与本研究结果相似。
表5 VC分子的羟基键解离晗
Table 5 Hydroxyl bond dissociation enthalpy in the vitamin C molecule
羟基位点O3—HO5—HO4—HO2—H解离晗/(kJ/mol)279.31296.35393.62404.18
2.5.5 VC清除自由基分子机制
结合密度泛函理论的前线轨道分析、表面静电势分布及羟基键解离焓,VC在香肠体系中的自由基清除机理可系统归纳为:其连二烯醇环上的O3—H和O5—H位点因HOMO电子云高度局域化及最低羟基键解离焓,优先通过氢原子转移机制释放质子,直接中和自由基;同时,环骨架与羰基的LUMO低能级特性驱动电子转移-质子转移协同机制,即VC先向自由基转移电子,随后借助羟基正静电势区域释放H+完成电荷平衡。这2 种路径的协同作用在香肠的亲脂性环境中被强化:环共轭体系通过离域效应稳定反应中间体,而静电势极性分布(负电势占比65%)则定向引导自由基靶向攻击高活性位点,从而高效抑制脂质过氧化进程。反应方程如式(6)、(7)所示:
氢原子转移机制[31]:
电子转移-质子转移机制[32]:
式中:R·和BY-H分别代表自由基和VC;Y代表C或O原子。
3 结 论
本研究揭示了VC在牛肉熏煮香肠体系中的多重抑制作用及其分子层面的抗氧化机理。研究结果表明,随着VC添加量的增加,其对羟自由基、DPPH自由基、超氧阴离子自由基和ABTS阳离子自由基的清除能力显著提升(P<0.05),并有效抑制杂环胺与N-亚硝胺的生成,2 类致癌物含量分别降低46%和40%。相关性分析结果进一步表明,VC的自由基清除能力与致癌物抑制能力呈极显著负相关(P<0.01)。分子机制上,结合密度泛函理论阐明了VC通过连二烯醇环关键位点主导氢原子转移机制和电子转移-质子转移机制实现双路径自由基清除的过程。本研究有助于有效降低热加工肉制品中致癌物风险,为开发基于VC的肉制品绿色加工技术提供了重要理论支撑。
[1] 张翼飞, 朱紫玉, 林小玲, 等. 桔梗粉添加量及目数对熏煮香肠品质特性的影响[J]. 肉类研究, 2019, 33(2): 38-45. DOI:10.7506/rlyj1001-8123-20181214-230.
[2] 陈阳, 陈俏纯, 邓鹏, 等. 苹果与葡萄对烤牛肉饼体外消化过程杂环胺释放的影响[J]. 肉类研究, 2022, 36(9): 7-12. DOI:10.7506/rlyj1001-8123-20220801-088.
[3] XU Y, JIAO Y, LUO J, et al. The influence of deep eutectic solvents extract from ginger on the formation of heterocyclic amines and advanced glycation end products in roast beef patties[J]. Foods, 2022,11(20): 3161. DOI:10.3390/foods11203161.
[4] 王未, 任晓镤, 鲍英杰, 等. 花椒叶提取物对烤牛肉饼杂环胺形成的影响[J]. 食品科学, 2021, 42(24): 40-47. DOI:10.7506/spkx1002-6630-20201028-281.
[5] ZHAO T P, XI J, ZHANG C X, et al. Using Adinandra nitida leaf extract to prevent heterocyclic amine formation in fried chicken patties[J]. RSC Advances, 2021, 11(12): 6831-6841. DOI:10.1039/d0ra09790j.
[6] BAO Y J, REN X P, ZHU Y X, et al. Comparison of lipid radical scavenging capacity of spice extract in situ in roast beef with DPPH and peroxy radical scavenging capacities in vitro models[J]. LWTFood Science and Technology, 2020, 130: 109626. DOI:10.1016/j.lwt.2020.109626.
[7] 袁怡, 赵瑞雪, 王珺瑜, 等. 鱼肉热加工中有害物的生成及抑制研究[J].食品安全质量检测学报, 2025, 16(8): 1-9. DOI:10.19812/j.cnki.jfsq11-5956/ts.20241206005.
[8] 包香香. 油炸罗非鱼中杂环胺的形成及抑制[D]. 上海: 上海海洋大学, 2020. DOI:10.27314/d.cnki.gsscu.2020.000435.
[9] 张晨霞. 油炸鸡肉中杂环胺的形成及控制[D]. 郑州: 河南工业大学,2020. DOI:10.27791/d.cnki.ghegy.2020.000346.
[10] WONG D, CHENG K W, WANG M F. Inhibition of heterocyclic amine formation by water-soluble vitamins in Maillard reaction model systems and beef patties[J]. Food Chemistry, 2012, 133(3): 760-766.DOI:10.1016/j.foodchem.2012.01.089.
[11] JINAP S, MOHD-MOKHTAR M S, FARHADIAN A, et al. Effects of varying degrees of doneness on the formation of heterocyclic aromatic amines in chicken and beef satay[J]. Meat Science, 2013, 94(2): 202-207. DOI:10.1016/j.meatsci.2013.01.013.
[12] 郑大贵, 肖竹平, 余衍文, 等. 5,6-O-苯乙烯基亚甲基-L-抗坏血酸的合成及其清除自由基和抗菌性能研究[J]. 化学试剂, 2010, 32(5):403-406; 436. DOI:10.13822/j.cnki.hxsj.2010.05.027.
[13] SHAH S A, SELAMAT J, AKANDA M J H, et al. Effects of different types of soy sauce on the formation of heterocyclic amines in roasted chicken[J]. Food Additives & Contaminants: Part A, 2018, 35(5): 870-881. DOI:10.1080/19440049.2018.1440639.
[14] 梁红敏, 任继波, 李彦奎, 等. 改良的DPPH与ABTS自由基法评价不同葡萄籽油抗氧化能力[J]. 中国粮油学报, 2018, 33(1): 85-91.
[15] YAO G M, ZHOU Y J, LI Z P, et al. Heterocyclic aromatic amines in roasted chicken: formation and prediction based on heating temperature and time[J]. Food Chemistry, 2023, 405: 134822.DOI:10.1016/j.foodchem.2022.134822.
[16] MA Y L, ZHOU Y J, JIANG X Y, et al. Multi-pathway inhibition of heterocyclic amines in braised chicken by carnosic acid: combined experimental and DFT calculations[J]. Food Chemistry, 2025, 487:144752. DOI:10.1016/j.foodchem.2025.144752.
[17] ZHANG Y X, ZHOU Y J. Formation of heterocyclic aromatic amines in spiced pork shoulder: effects of heat treatment parameters and number of soup cycles[J]. Journal of Food Composition and Analysis,2022, 107: 104382. DOI:10.1016/j.jfca.2021.104382.
[18] YUAN Y, WEI M, MIAO Y T, et al. Determination of eight volatile nitrosamines in meat products by ultrasonic solvent extraction and gas chromatography-mass spectrometry method[J]. International Journal of Food Properties, 2015, 18(6): 1181-1190. DOI:10.1080/10942912.2014.898652.
[19] ZHOU Y J, WANG Q Y, WANG S J. Effects of rosemary extract,grape seed extract and green tea polyphenol on the formation of N-nitrosamines and quality of western-style smoked sausage[J].Journal of Food Processing and Preservation, 2020, 44(6): e14459.DOI:10.1111/jfpp.14459.
[20] MARTÍNEZ A, BARBOSA A. Antiradical power of carotenoids and vitamin E: testing the hydrogen atom transfer mechanism[J].The Journal of Physical Chemistry B, 2008, 112(51): 16945-16951.DOI:10.1021/jp808684q.
[21] NEESE F. Software update: the ORCA program system: version 5.0[J].Wiley Interdisciplinary Reviews: Computational Molecular Science,2022, 12(5): e1606. DOI:10.1002/wcms.1606.
[22] LU T, CHEN F W. Multiwfn: a multifunctional wavefunction analyzer[J]. Journal of Computational Chemistry, 2012, 33(5): 580-592. DOI:10.1002/jcc.22885.
[23] 翟惠敏, 李亚洁. 氧自由基对脑损伤的作用和维生素的防护作用[J].南方护理学报, 2001, 8(1): 17-18.
[24] 聂文, 屠泽慧, 张静, 等. 香兰素和维生素C对卤煮牛肉中杂环胺含量的影响[J]. 食品安全质量检测学报, 2017, 8(6): 1987-1992.
[25] 徐枫. 苦瓜汁抑制杂环胺类物质致突变活性研究[J]. 中国卫生检验杂志, 2007, 17(6): 1044-1047.
[26] 熊凤娇, 马俪珍, 王洋. 2 种模拟体系下VC和VE联合作用对N-亚硝胺形成的影响[J]. 食品科技, 2018, 43(7): 134-143. DOI:10.13684/j.cnki.spkj.2018.07.025.
[27] GAO X Q, XIA L Y, FAN Y Q, et al. Evaluation of coloration, nitrite residue and antioxidant capacity of theaflavins, tea polyphenols in cured sausage[J]. Meat Science, 2022, 192: 108877. DOI:10.1016/j.meatsci.2022.108877.
[28] 谢玉玉, 侯雪玲, 陈志慧, 等. 红景天苷分子结构与光谱的密度泛函理论分析[J]. 光谱学与光谱分析, 2022, 42(6): 1786-1791.DOI:10.3964/j.issn.1000-0593(2022)06-1786-06.
[29] 逯美红, 贾娟, 雷海英, 等. 苋菜红表面增强拉曼光谱的密度泛函理论研究[J]. 光谱学与光谱分析, 2020, 40(6): 1833-1838.
[30] 周敏娜. 维生素类清除自由基机理的密度泛函理论计算[D]. 新乡:河南师范大学, 2011.
[31] BACIOCCHI E, BIETTI M, LANZALUNGA O, et al. N-Demethylation of N,N-dimethylanilines by the benzotriazole N-oxyl radical: evidence for a two-step electron transfer-proton transfer mechanism[J]. Journal of Organic Chemistry, 2010, 75(5): 1378-1385. DOI:10.1021/jo100040y.
[32] MARKOVIĆ Z S, MARKOVIĆ S, et al. Structure and reactivity of baicalein radical cation[J]. International Journal of Quantum Chemistry, 2012, 112(8): 2009-2017. DOI:10.1002/qua.23175.