硝酸盐和亚硝酸盐对食品领域最突出的贡献是对肉制品的保鲜作用[1]。首先,硝酸盐和亚硝酸盐可以抑制一些致病菌的生长,包括单核细胞增生李斯特菌(Listeria monocytogenes)、蜡样芽孢杆菌(Bacillus cereus)、金黄色葡萄球菌(Staphyloccocus aureus)及肉毒梭状芽孢杆菌(Clostridium botulinum)等[2-4]。此外,硝酸盐和亚硝酸盐还可以稳定肉制品的色泽、改善肉制品的风味以及减缓脂质、蛋白质的氧化等[1]。尽管相关研究[5-8]报道了硝酸盐和亚硝酸盐潜在的致癌风险,但是鉴于其对肉制品发挥的多重作用,尤其是对能够产生剧烈毒素的C. botulinum的抑制作用,使其成为肉制品加工中不可被完全替代的一类食品添加剂。如Lebrun等[9]最近的研究表明,加工肉制品中缺乏硝酸盐或亚硝酸盐将导致C. botulinum的生长和毒素的产生。
近些年来,研究人员逐渐发现还原剂可以通过将亚硝化剂还原为N2/一氧化氮(NO)或者清除亚硝鎓离子降低亚硝酸盐的残留并减少亚硝胺在人体中的合成,即还原剂能与前体胺竞争亚硝化剂[10-13]。美国食品药品监督管理局也特别提到了使用抗坏血酸和α-生育酚抑制N-亚硝胺的形成[14-15]。此外,还原剂还有助于肉制品发色。肉类腌制过程中,氧合肌红蛋白(oxymyoglobin,OMb)首先转变为脱氧肌红蛋白(deoxymyoglobin,DeoMb),而其可以作为亚硝酸钠(sodium nitrite,NaNO2)的还原酶,产生高铁肌红蛋白(metmyoglobin,MMb)和NO,NO再与MMb中Fe3+反应形成亚硝酰高铁肌红蛋白复合物,随后该复合物再被抗坏血酸等还原剂还原为亚硝基肌红蛋白(nitrosomyoglobin,NOMb),即赋予肉制品粉红色的关键色素[16-18]。Sebranek等[19]将15N-亚硝酸盐用于腌制肉的研究中,结果发现,约有15%的NaNO2会与肌红蛋白反应。同时,也有研究证实抗坏血酸这类还原剂将会增加过氧亚硝基阴离子/过氧亚硝酸(ONOO-/ONOOH)的合成,促进NaNO2的抗菌活性[20]。但关于D-异抗坏血酸如何影响NaNO2对肉的抑菌及发色双重作用的研究鲜见报道。鉴于D-异抗坏血酸相较于抗坏血酸而言更稳定、价格更低等优势,本研究为了同时探究D-异抗坏血酸对NaNO2抑菌和发色两方面的影响,将肌红蛋白和NaNO2加入溶液体系,以S. aureus作为受试菌,测定不同D-异抗坏血酸质量浓度(0、0.01、0.03、0.05、0.08、0.12 g/100 mL)对溶液pH值、菌落总数、菌体内活性氧(reactive oxygen species,ROS)、细胞膜通透性、细菌形态、发色物质含量及亚硝酸盐残留量的影响,旨在为还原剂如何促进NaNO2发挥作用提供理论及数据支撑。
1 材料与方法
1.1 材料与试剂
金黄色葡萄球菌(S. aureus ACCC 11559)购自中国农业微生物菌种保藏中心。
NaNO2、磷酸二氢钠、磷酸氢二钠、盐酸萘乙二胺天津市大茂化学试剂厂;肌红蛋白(纯度95%~100%)北京索莱宝生物科技有限公司;D-异抗坏血酸、戊二醛(2.5 g/100 mL)、对氨基苯磺酸 上海麦克林生化科技股份有限公司;平板计数琼脂(plate count agar,PCA)、LB(Luria-Bertani)肉汤培养基 青岛高科技工业园海博生物技术有限公司;ROS检测试剂盒(含2′,7′-二氯二氢荧光素二乙酸酯(2′,7′-dichlorodihydrofluo rescein diacetate,DCFH-DA)探针) 碧云天生物技术有限公司;碘化丙啶(propidium iodide,PI)染色试剂盒 生工生物工程(上海)股份有限公司;无水乙醇、氯化钠、浓盐酸 天津市江天化工技术股份有限公司。所用试剂均为分析纯。
1.2 仪器与设备
FE28 pH计 梅特勒-托利多仪器(上海)有限公司;FlexA-200HT酶联免疫分析仪 杭州奥盛仪器有限公司;BX53正置荧光显微镜 日本奥林巴斯公司;UV 3600 Plus紫外分光光度计 日本岛津公司;Infinite 200 Pro荧光酶标仪 帝肯奥地利有限责任公司;SU3800扫描电子显微镜(scanning electron microscope,SEM)日本Hitachi公司。
1.3 方法
1.3.1 样品准备
1.3.1.1 菌种活化及培养
采用划线法将冻存于-80 ℃的S. aureus接种于PCA平板上进行活化,于37 ℃恒温培养箱中倒置培养48 h。随后选取生长良好的S. aureus单菌落,接种于灭菌的LB肉汤培养基中,于37 ℃、200 r/min培养12 h。从中吸取1 mL混合均匀的菌液于含100 mL LB肉汤的锥形瓶中,继续培养4 h。从而获得处于对数生长中期的S. aureus。经8 000×g、4 ℃离心5 min收集菌体沉淀,并使用无菌0.85 g/100 mL NaCl溶液洗涤菌体3 次。将菌体沉淀重悬于0.85 g/100 mL NaCl溶液中,用紫外分光光度计调节菌液浓度至约108 CFU/mL,即OD600nm=0.2(约为4×108 CFU/mL)。稀释得到浓度为4×104 CFU/mL的菌悬液,置于4 ℃冷藏备用。
1.3.1.2 溶液体系制备
灭菌后的离心管中各加入无菌L B 液体培养基(pH 5.6)1.25 mL,依次再吸入溶解于磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 5.6)的肌红蛋白、NaNO2、D-异抗坏血酸溶液及S. aureus菌悬液,使肌红蛋白质量浓度为1 mg/mL,NaNO2质量浓度为0.1 mg/mL,D-异抗坏血酸质量浓度依次为0(对照)、0.01、0.03、0.05、0.08、0.12 g/100 mL,菌浓度为2×103 CFU/mL,各溶液体系体积保持一致。
1.3.2 pH值测定
分别于溶液反应的0、1、8、16、32、48 h取样,用pH计进行测定,将电极浸入被测溶液中,待读数稳定后记录pH值。每个样品进行3 次重复测定,结果取平均值。
1.3.3 抑菌效果评估
1.3.3.1 S. aureus菌落总数测定
分别于溶液反应的0、1、8、16、32、48 h取样,于超净工作台中准确吸取1 mL液体样品,加入9 mL无菌0.85 g/100 mL NaCl溶液稀释得到1∶10的匀液,以此类推进行稀释。不同时间点分别吸取100 μL不同浓度的匀液均匀涂布于PCA培养基,同时吸取无菌0.85 g/100 mL NaCl溶液作为空白对照,所有培养皿均倒置于37 ℃恒温培养箱中培养48 h后计数。
1.3.3.2 S. aureus中ROS测定
溶液反应48 h时取样。配制10 μmol/L DCFH-DA探针溶液。将1 mL样品以8 000×g、4 ℃离心10 min,弃去上清液,用PBS(pH 7.2)缓慢清洗2 次,每次静置1 min。加入300 μL DCFH-DA探针溶液完全覆盖沉淀,混匀,并置于37 ℃避光孵育30 min。再次离心(8 000×g、4 ℃),弃上清,用PBS缓慢清洗2 次,每次静置1 min。重悬于0.5 mL PBS(pH 7.2),取5 μL菌悬液于载玻片上,盖上盖玻片后用荧光显微镜观察荧光分布,判断细菌氧化损伤程度。同时取1 mL样品调整OD600nm约为0.1,再吸取200 μL用酶标仪测定样品的荧光强度(激发波长488 nm、发射波长525 nm),ROS水平用荧光强度表示。
1.3.3.3 S. aureus细胞膜通透性测定
溶液反应48 h时取样。S. aureus细胞膜通透性的测定使用PI染色试剂盒(含1×分析缓冲液)。将1 mL样品以8 000×g、4 ℃离心10 min,弃去上清液,沉淀用PBS(pH 7.2)缓慢清洗2 次,每次静置1 min。重悬于1×分析缓冲液并调整OD600nm约为0.1。吸取190 μL菌悬液,加入10 μL PI染色液(2 mg/mL),37 ℃避光孵育20 min。吸取5 μL菌悬液于载玻片上,盖上盖玻片后用荧光显微镜观察荧光分布,确认细菌细胞膜的完整性。同时取200 μL样品用酶标仪测定荧光强度(激发波长535 nm,发射波长615 nm),以荧光强度(PI水平)表示受损细菌含量。
1.3.3.4 S. aureus形态学观察
溶液反应48 h时取样观察。将1 mL样品于8 000×g、4 ℃离心5 min,弃去上清液,沉淀用PBS(pH 7.2)清洗2 次,每次1 min。用2.5 g/100 mL戊二醛于4 ℃固定5 h,确保细菌浓度大于108 CFU/mL,再次用PBS清洗2 次,每次1 min,用不同体积分数(30%、50%、70%、80%、90%)的乙醇溶液及无水乙醇进行脱水处理,每个梯度脱水15 min,以避免细胞收缩。最后再将细菌悬浮于无水乙醇中,吸取5 μL菌悬液滴到单晶硅片上,干燥后用导电胶将样品粘在样品台上,氩气环境喷金3 min后用SEM观察S. aureus形态(加速电压5.0 kV、放大倍数10 000 倍)。
1.3.4 肌红蛋白及其衍生物测定
1.3.4.1 肌红蛋白紫外-可见吸收光谱测定
分别于溶液反应的0、1、16、32、48 h取样。将500 μL样品以8 000×g、4 ℃离心5 min,取200 μL上清液用酶联免疫分析仪测定肌红蛋白于350~700 nm处的紫外-可见吸收光谱。
1.3.4.2 NOMb含量测定
分别于溶液反应的0、1、16、32、48 h取样。将500 μL样品以8 000×g、4 ℃离心5 min,取200 μL上清液用酶联免疫分析仪测定540 nm处的吸光度(A540nm)。NOMb含量以每升血红素中NOMb含量表示,按式(1)[21]计算:
1.3.4.3 肌红蛋白相对含量测定
参考Zajac等[22]的方法。分别于溶液反应的0、1、16、32、48 h取样。将500 μL样品以8 000×g、4 ℃离心5 min,取200 μL上清液用酶标仪测定525、545、565、572 nm处的吸光度。DeoMb、OMb、MMb相对含量分别按式(2)~(4)进行计算:

1.3.5 亚硝酸盐残留量测定
分别于溶液反应的0、1、16、32、48 h取样。使用分光光度法测定样品中亚硝酸盐残留量[23]。
1.4 数据处理
所有实验均重复3 次,结果以平均值±标准差表示。采用SPSS 12.0软件的单因素方差分析中的Duncan’s多重比较对数据进行统计分析,P<0.05被认为数据之间存在显著差异。通过Origin 2021b软件作图。
2 结果与分析
2.1 D-异抗坏血酸对体系pH值的影响
如图1所示,反应前期体系的pH值随着D-异抗坏血酸添加量的增加呈下降趋势。D-异抗坏血酸能在溶液中释放H+,从而表现出酸性,当添加量增加时,H+相应增加,因此D-异抗坏血酸添加量越多,体系pH值越低。当体系反应到16 h后,D-异抗坏血酸添加量为0.01、0.03 g/100 mL时的pH值与对照组无明显差异,甚至高于对照组。这可能是由于生长后期随着体系中营养物质的消耗,S. aureus生长代谢对pH值有显著影响,产生了更多碱性代谢物,导致pH值上升[24]。
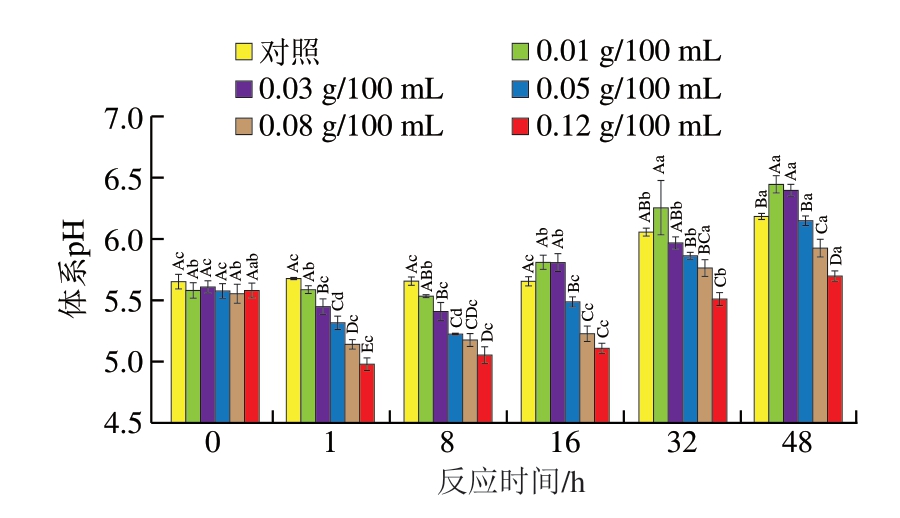
图1 不同质量浓度D-异抗坏血酸对体系pH值的影响
Fig. 1 Effect of different concentrations of D-isoascorbic acid on the pH of mixed system composed of S. aureus suspension, myoglobin and NaNO2 dissolved in phosphate buffered saline
大写字母不同表示组间差异显著(P<0.05);小写字母不同表示组内差异显著(P<0.05)。图2~4、7~9同。
2.2 D-异抗坏血酸对NaNO2抑菌效果的影响
2.2.1 S. aureus菌落总数分析
如图2所示,在反应刚开始时,各组之间菌落总数无显著差异。当体系反应1 h时,对照组菌落总数最多,而D-异抗坏血酸的加入降低了菌落总数,并且D-异抗坏血酸的添加量越高,菌落总数越低。一般来说,体系中的DeoMb会与NaNO2发生反应,结合生成NO,这一过程会在抗坏血酸这类还原剂的存在下得到促进[25]。值得注意的是,这类还原剂不仅直接参与这一还原反应,还间接参与了高铁肌红蛋白还原酶的还原循环,这一循环对于维持体系中NO、超氧阴离子自由基(·O2-)、过氧化氢(H2O2)以及ONOO-/ONOOH等活性氧和活性氮(reactive oxygen and nitrogen species,RONS)的动态平衡至关重要[25-26]。ONOO-/ONOOH作为RONS中的强氧化剂,其存在显著增加了体系的氧化应激水平。这种高度的氧化应激环境极易导致DNA、蛋白质及其他生物大分子发生氧化和硝化损伤,这些损伤累积到一定程度就会触发一系列细胞内的应激反应,最终导致细菌细胞的结构和功能受损,甚至引发细胞死亡[20,27]。因此,反应初期,添加的D-异抗坏血酸加快了NaNO2产生NO的速率,且添加量越高,在同一时间产生的NO越多,相应地,对细菌的抑制效果越好。
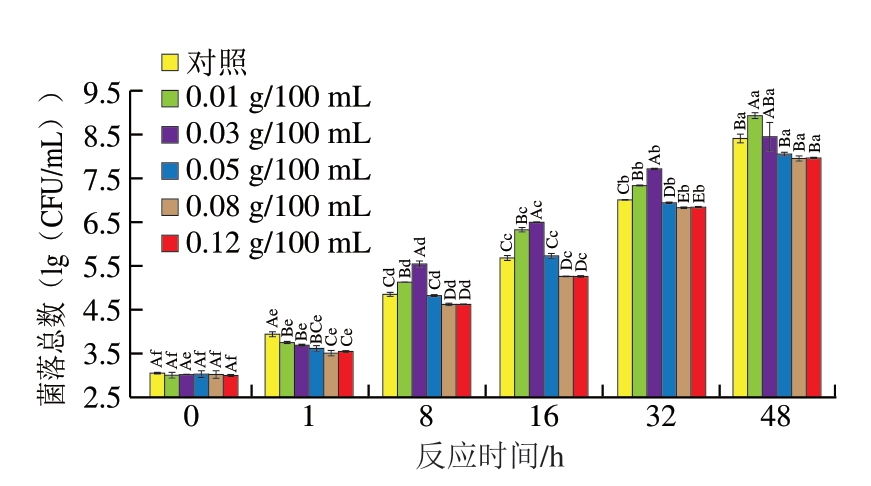
图2 不同质量浓度D-异抗坏血酸对S. aureus菌落总数的影响
Fig. 2 Effect of different concentrations of D-isoascorbic acid on the viability of S. aureus
然而,随着反应的进行,D-异抗坏血酸添加量为0.01、0.03 g/100 mL的2 组中菌落总数几乎均显著高于其他组,且添加量为0.05、0.08、0.12 g/100 mL的体系中所测得的菌落总数相比于对照组始终保持在较低水平,这一效果在0.08、0.12 g/100 mL的体系中更显著,且二者无显著差异。当D-异抗坏血酸添加量较低时(0.01 g/100 mL),其通过加速NaNO2的消耗速率而降低了NaNO2的抗菌效果,同时这一作用也可能间接调节了体系中的RONS水平,特别是减少了可能由过量亚硝酸盐转化而来的有害产物,如NO和ONOO-/ONOOH的生成,从而在某种程度上缓解了氧化应激对细菌细胞的过度损伤。而当D-异抗坏血酸添加量足够多时,即使NaNO2被还原,在前期释放大量NO的基础上,仍有大量的D-异抗坏血酸通过产生ROS和影响细胞膜的通透性进而发挥更强烈的抑菌效果。因而0.08 g/100 mL与0.12 g/100 mL添加组之间始终无显著差异,即D-异抗坏血酸添加量达到0.08 g/100 mL时即可表现出较好的抑菌效果。
2.2.2 S. aureus菌体ROS水平分析
ROS指的是H2O2、羟自由基(·OH)、·O2-、ONOO-等过氧化物的总称[28]。ROS失衡会造成菌体氧化应激损伤或死亡[29]。在酸性条件下,Fe2+可以作为催化剂分解H2O2,产生反应活性较强的·OH,破坏细菌细胞,而导致菌体死亡,这一反应被称为Fenton氧化[30]。但·OH半衰期极短(水溶液中为10-9 s),作用效果有限。因而衍生出类Fenton氧化,即过渡金属离子与有机酸产生·OH的过程[31]。本实验体系中D-异抗坏血酸与铁离子的反应则属于这类氧化反应。因此体系在反应48 h后可以通过荧光显微镜观察到绿色荧光的产生,且D-异抗坏血酸的添加量为0.05、0.08、0.12 g/100 mL时产生的绿色荧光强度最强,其余几组产生的绿色荧光则相对较弱(图3A)。在整个过程中,O2分子与D-异抗坏血酸通过细菌的细胞膜不断进入细胞内,与细胞中的铁离子发生类Fenton反应,产生足以破坏细胞膜脂类成分、DNA和蛋白质的ROS。与此同时,更高浓度的D-异抗坏血酸促进NaNO2更快分解,使之更快地形成ONOO-和NO。
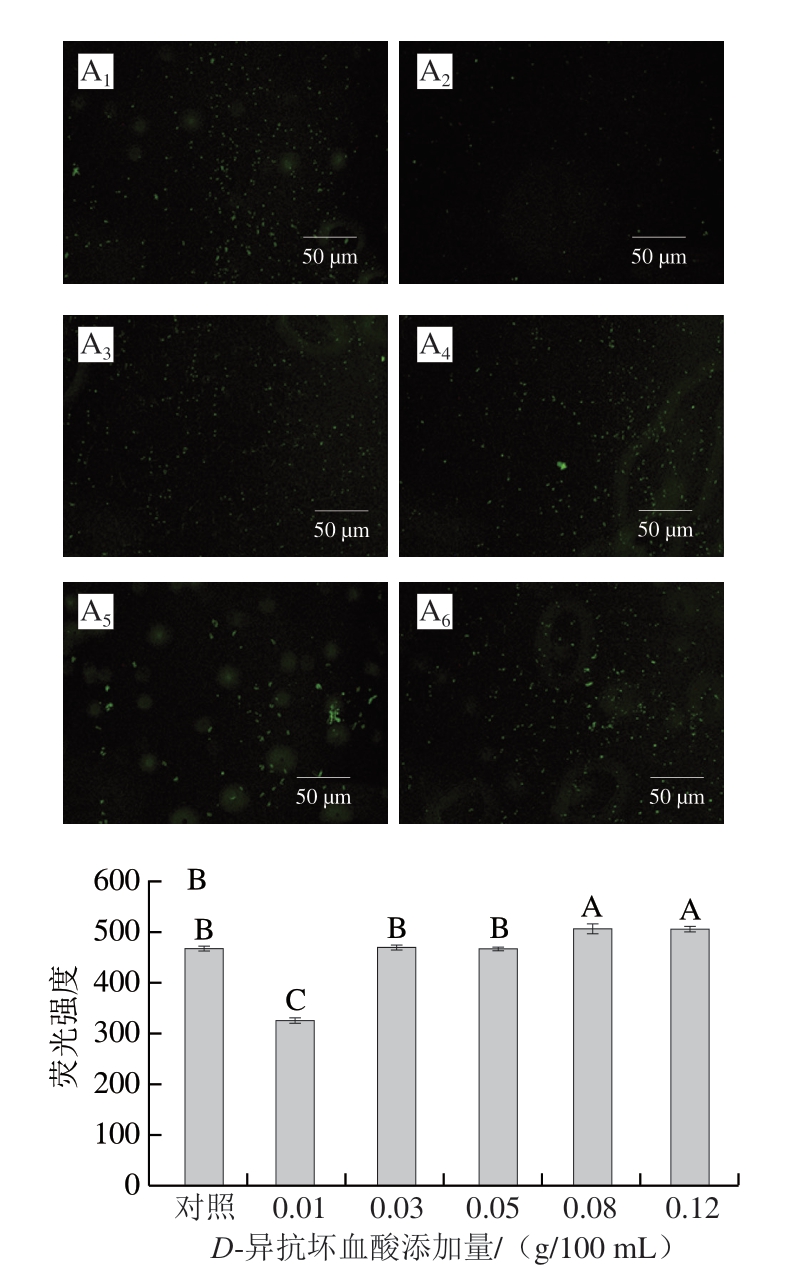
图3 不同质量浓度D-异抗坏血酸处理48 h后S. aureus中ROS荧光图像(A)及菌体内ROS水平(B)
Fig. 3 Fluorescence images (A) and ROS levels (B) in S. aureus after 48 h of treatment with different concentrations of D-isoascorbic acid
下标1~6. D-异抗坏血酸添加量依次为0、0.01、0.03、0.05、0.08、0.12 g/100 mL。图4同。
由图3 B 可知,各组的荧光强度大小依次为0.08 g/100 mL组(507.00)>0.12 g/100 mL组(506.00)>0.03 g/100 mL组(469.33)>对照组(467.67)>0.05 g/100 mL组(466.67)>0.01 g/100 mL组(326.00),表明低质量浓度的D-异抗坏血酸会降低NaNO2诱导ROS的生成,且除了NaNO2本身的作用之外,过量的D-异抗坏血酸加入后,将会诱导细菌产生更多的ROS。Majou等[20]的研究也表明抗坏血酸会增加ONOO-/ONOOH的产生,增强细菌氧化应激,进而促进抑菌活性。
2.2.3 S. aureus菌体细胞膜通透性分析
PI是一种极为有效的荧光染料,其独特的性质在于它能够特异性地与双链DNA紧密结合,并在结合后释放出强烈的荧光信号[32]。值得注意的是,PI分子本身并不具备穿透活细胞膜的能力,它仅仅能够渗透到那些细胞膜已经受损或是已经死亡的细胞中[33]。如图4A所示,几乎所有体系均呈现出红色荧光,其中D-异抗坏血酸添加量为0.05、0.08、0.12 g/100 mL的体系所表现出的红色荧光较强,这表明虽然还原剂的添加会加速NaNO2的分解,进而影响NaNO2的抑菌效果,但是这种效应的出现似乎有一个限定条件,即较低的D-异抗坏血酸添加量。当D-异抗坏血酸添加量足够高时,D-异抗坏血酸除了促进NaNO2分解之外,自身也会影响S. aureus细胞膜通透性,使胞内物质泄漏,干扰细菌正常生长代谢,进而影响细菌细胞正常生理功能的运转和抑制细菌的生长。
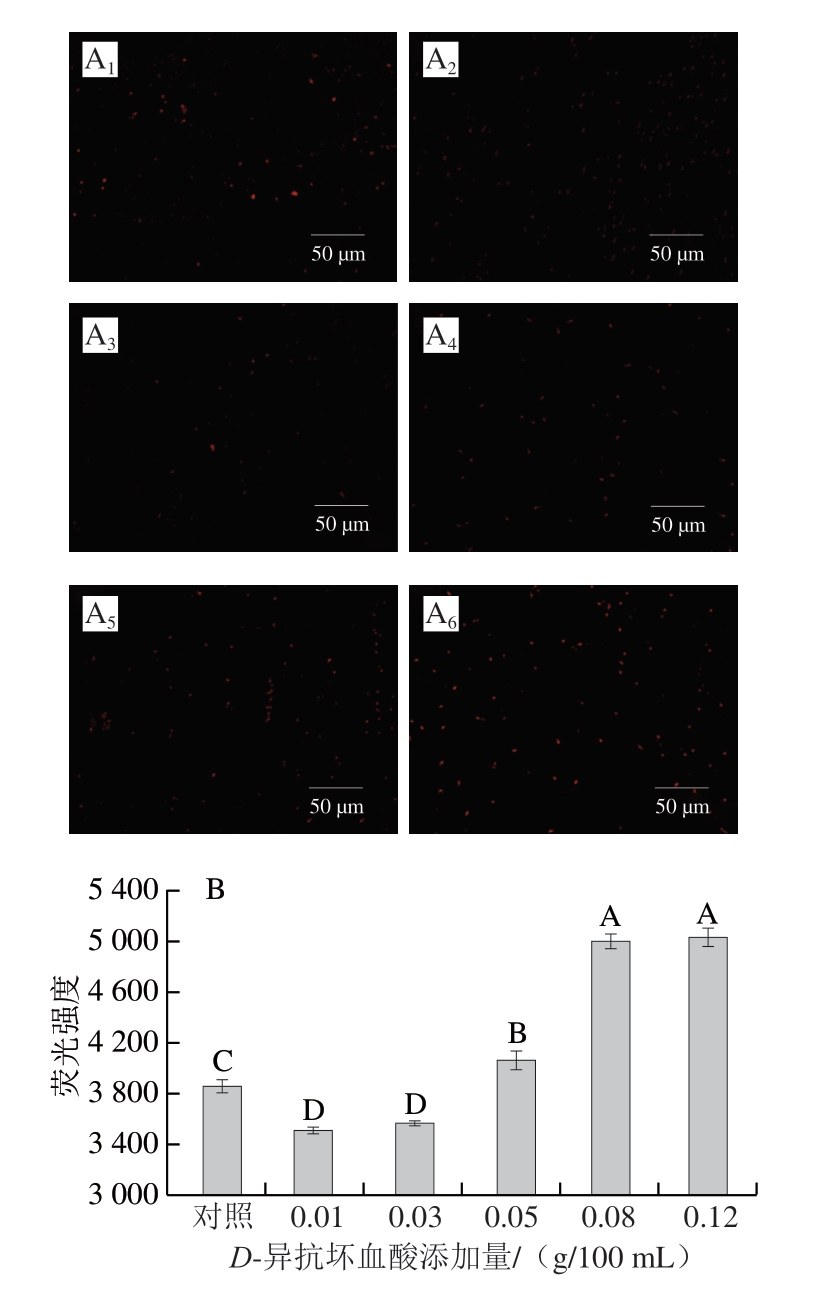
图4 不同质量浓度D-异抗坏血酸处理48 h后S. aureus PI荧光图像(A)及菌体内PI水平(B)
Fig. 4 Propidium iodide-stained fluorescence images (A) and intensity (B) of S. aureus after 48 h of treatment with different concentrations of D-isoascorbic acid
由图4 B 可知,各组的荧光强度大小依次为0.12 g/100 mL组(5 035.67)>0.08 g/100 mL组(5 005.33)>0.05 g/100 mL组(4 065.00)>对照组(3 859.00)>0.03 g/100 mL组(3 565.67)>0.01 g/100 mL组(3 510.00)。因此,D-异抗坏血酸添加量0.01、0.03 g/100 mL组与对照组相比对细胞膜的破坏较弱,0.05、0.08、0.12 g/100 mL添加量组则表现出相反的结果,增加了细胞膜的通透性。
2.2.4 S. aureus形态分析
为了更清晰地观察不同浓度D-异抗坏血酸对细菌细胞壁膜的影响,通过SEM对经48 h处理的菌体样本进行形态分析。如图5所示,经0.01 g/100 mL D-异抗坏血酸处理后的S. aureus形态较为光滑、饱满,呈现出较为典型的葡萄球状。与之差异最大的是D-异抗坏血酸添加量0.08、0.12 g/100 mL组,其细胞膜周围伴有黏性物质,呈黏连状态,且菌体几乎溶解、细胞膜有明显褶皱和凹陷,失去细胞基本结构。其余3 组菌体变化虽不及这2 组,但是菌体形态也发生一定程度的改变,细胞膜周围伴有黏性物质,呈黏连状态,少部分菌体凹陷。由此推测,除了NaNO2会破坏细胞结构之外,D-异抗坏血酸加入后,也会促进菌体内营养成分的外泄,导致细胞表面粗糙度增加、黏连物质积累及细胞膜褶皱的形成。
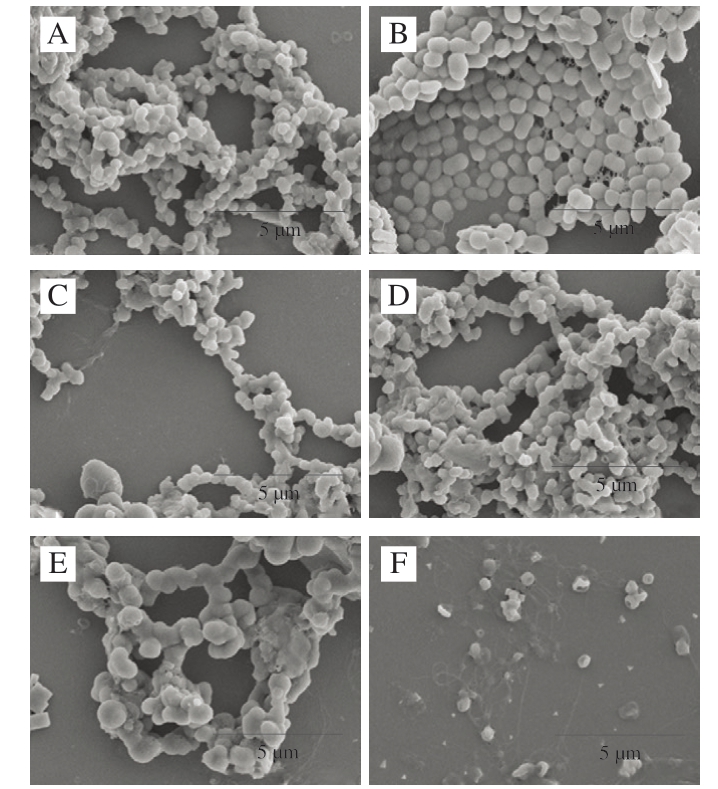
图5 不同质量浓度D-异抗坏血酸处理48 h后S. aureus SEM图像
Fig. 5 Scanning electron microscope images of S. aureus after 48 h treatment with different concentrations of D-isoascorbic acid
A~F. D-异抗坏血酸添加量依次为0、0.01、0.03、0.05、0.08、0.12 g/100 mL。
2.3 D-异抗坏血酸对NaNO2发色效果的影响
2.3.1 肌红蛋白紫外-可见吸收光谱
肌红蛋白在可见光范围内具有特定的吸收光谱,这一特性主要源于其分子中的血红素辅基。血红素辅基内的卟啉环有较强的紫外-可见吸收度,且具有选择性,只吸收特定波长的光[34]。如图6所示,反应1 h时,对照组和添加0.01 g/100 mL D-异抗坏血酸的样品在504 nm和631 nm附近处展现出明显吸收峰。血红素辅基中Fe2+被氧化成Fe3+后,会在505 nm和630 nm处轻微升高,于550 nm处则表现出下降趋势[22],这表明MMb在此溶液中占据主导地位。随着反应的持续进行,相较于544 nm而言,各组在582 nm处更陡峭的吸收峰表明OMb逐渐占据主导地位。这是因为OMb的特征吸收峰在418~419 nm附近的Soret峰,以及535~545 nm和575~585 nm处的Q带。加入D-异抗坏血酸的体系表现出MMb的减少(500、630 nm)和OMb的增加(544、582 nm),且在530~600 nm处整体上转变为更高的值。相反,于544、582 nm处表现较强吸收峰的样品未在504 nm处表现出可见吸收峰。但是这一方法不能精确地确定OMb和NOMb含量的差异,NOMb具有与前者相似的Q带(548、579 nm),因此继续测定各肌红蛋白的含量。
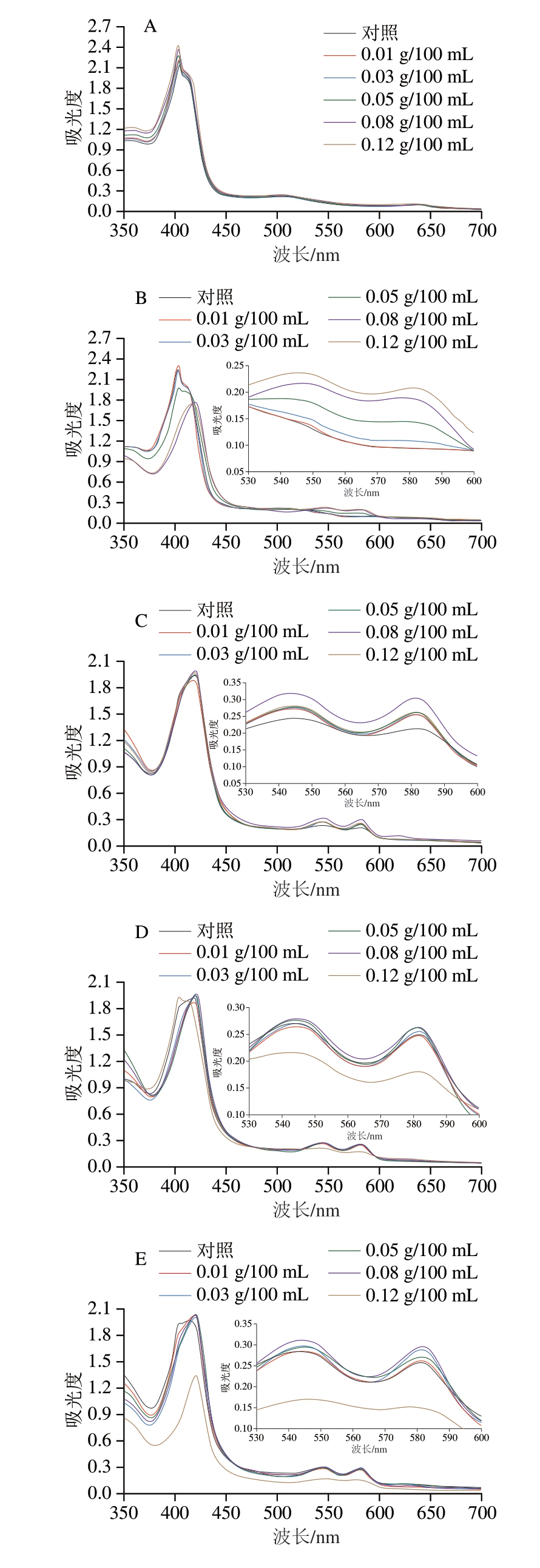
图6 不同质量浓度D-异抗坏血酸处理不同时间肌红蛋白紫外-可见吸收光谱图
Fig. 6 Ultraviolet-visible absorption spectra of myoglobin treated for up to 48 h with different concentrations of D-isoascorbic acid
A~E.反应时间依次为0、1、16、32、48 h。图8同。
2.3.2 NOMb含量
如图7所示,除了0.12 g/100 mL D-异抗坏血酸添加组之外,其余组的NOMb含量均随反应时间延长呈现逐渐升高的趋势。这说明一定浓度的D-异抗坏血酸将促进NOMb的持续产生,而过量的D-异抗坏血酸将会促进NaNO2更快还原为NO,但是呈色不稳定,后续表现出大幅下降的结果。对照组中未添加D-异抗坏血酸,因此整体上NOMb含量及产生速率相较于其他组较慢。D-异抗坏血酸则加快了NaNO2的分解速率,进而加快了NaNO2与肌红蛋白的反应速率,以及NOMMb向NOMb的还原。但随着反应的进行,NOMb的增加逐渐变缓。同时,从16 h开始,D-异抗坏血酸添加量为0.03~0.08 g/100 mL时,各组之间产生的NOMb含量差异不显著。
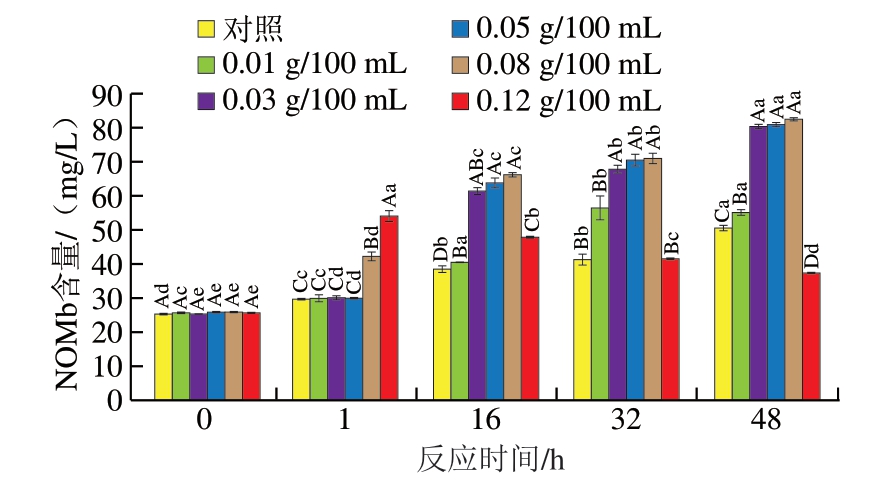
图7 不同质量浓度D-异抗坏血酸对NOMb含量的影响
Fig. 7 Effect of different concentrations of D-isoascorbic acid on NOMb content
2.3.3 肌红蛋白相对含量
当体系的pH值维持在5.0~6.0这一范围时,抗坏血酸的加入能够将MMb还原为亚铁肌红蛋白(MbFe2+,包含DeoMb和OMb)和脱氢抗坏血酸。这一还原过程中,不仅实现了MMb向MbFe2+的转变,还伴随产生脱氢抗坏血酸,后者是抗坏血酸氧化后的产物[35]。如图8所示,随着反应时间延长,除了0.12 g/100 mL D-异抗坏血酸添加组之外,其余各组的MMb相对含量整体均呈现下降趋势,MbFe2+相对含量则整体呈现升高趋势,且随着D-异抗坏血酸添加量的增加,这一现象愈加明显。说明在一定范围内,D-异抗坏血酸的存在不仅可以促进NOMb的产生,还可以促进MMb向MbFe2+的还原[36]。当体系反应1 h时,只有当D-异抗坏血酸添加量较大时(0.08、0.12 g/100 mL),MMb相对含量才表现出较为显著的下降趋势,MbFe2+相对含量表现出显著的上升趋势,其余的几组甚至未检测到DeoMb的存在。当反应48 h时,D-异抗坏血酸添加量为0.03~0.08 g/100 mL的体系未检测到MMb的存在,表明大部分MMb已经被还原为MbFe2+,且此时对照组仍有近90%的MMb。0.12 g/100 mL D-异抗坏血酸添加组则由于还原剂添加量过高而促使NaNO2在反应初期便使NO大量释放,因而后期出现MMb的大量积累。
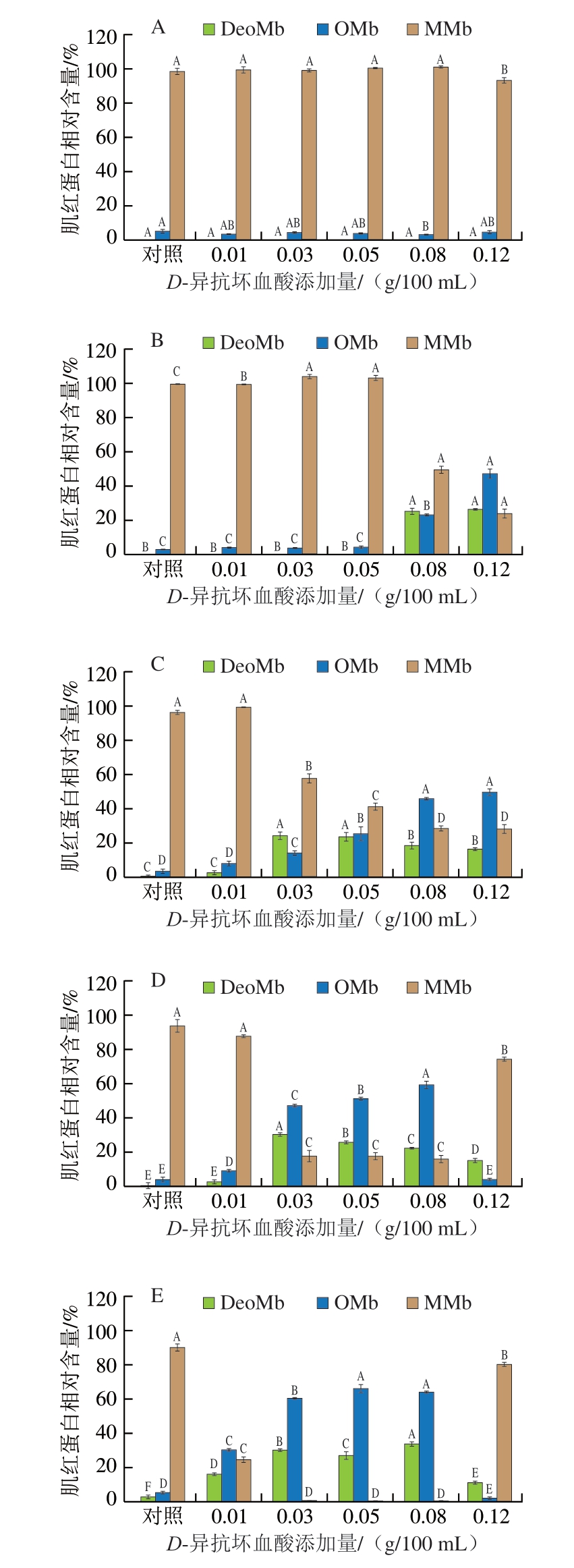
图8 不同质量浓度D-异抗坏血酸处理不同时间对肌红蛋白相对含量的影响
Fig. 8 Effects of different concentrations of D-isoascorbic acid on the relative content of myoglobin with different treatment time
2.4 D-异抗坏血酸对亚硝酸盐残留量的影响
如图9所示,亚硝酸盐残留量随时间的延长整体呈现下降趋势。这是由于NaNO2被消耗,一部分以气体形式溢出,一部分被降解,其余部分与蛋白质及金属离子发生反应。D-异抗坏血酸添加量为0.01 g/100 mL时与对照组无显著差异,添加量为0.12 g/100 mL时所测得的残留量最少。因此,D-异抗坏血酸的加入可以显著降低亚硝酸盐的残留量,且添加量越多,清除效果越明显。分析其原因,可能是因为随着D-异抗坏血酸浓度的升高,溶液pH值更低,溶液的还原性相应提高,此时还原剂的清除效果增强,加快了NaNO2被还原为NO的速率,维持了NO的产生[37-38]。
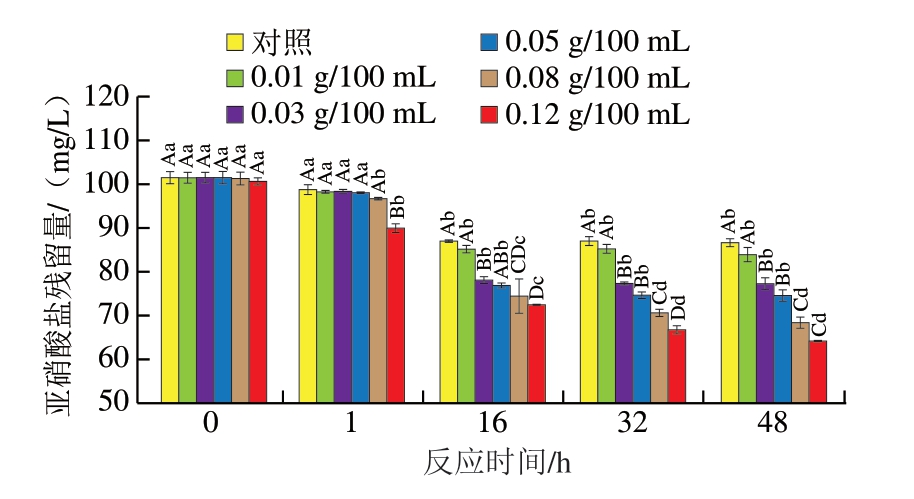
图9 不同质量浓度D-异抗坏血酸处理后体系中亚硝酸盐残留量
Fig. 9 Nitrite residues of the system after treatment with different concentrations of D-isoascorbic acid
3 结 论
低添加量的D-异抗坏血酸(<0.03 g/100 mL)会降低NaNO2的抑菌作用,高添加量的D-异抗坏血酸(0.12 g/100 mL)又将造成NaNO2较快分解,无法长时间发挥发色效果。适当添加量的D-异抗坏血酸(0.08 g/100 mL)可以通过促进MMb的还原和增加NOMb的产生促进NaNO2的发色作用,并且增加细菌细胞内ROS的产生和细胞膜通透性,从而引起细菌生物大分子氧化和硝化,增强NaNO2的抑菌作用,其中损伤细胞膜是D-异抗坏血酸增强抑菌效果的重要方式。因此,在肉制品的实际应用中,应考虑D-异抗坏血酸与NaNO2的添加比例,进而提升D-异抗坏血酸促进发色与抑菌的双重效应。
[1] 谢政泽, 李玉涵, 王琪, 等. 基于Lactate-NAD-LDH模型响应面优化肉制品中亚硝酸盐和肌红蛋白量效关系[J]. 中国调味品, 2023,48(5): 17-23. DOI:10.3969/j.issn.1000-9973.2023.05.003.
[2] REN B B, ZHANG N H, YANG J J, et al. Nitric oxide-induced bacteriostasis and modification of iron-sulphur proteins in Escherichia coli[J]. Molecular Microbiology, 2008, 70(4): 953-964. DOI:10.1111/j.1365-2958.2008.06464.x.
[3] LEDEZMA-ZAMORA K, SÁNCHEZ-GUTIÉRREZ R, RAMÍREZLEIVA A, et al. Residual nitrite in processed meat products in Costa Rica: method validation, long-term survey and intake estimations[J]. Food Chemistry, 2021, 361: 130082. DOI:10.1016/j.foodchem.2021.130082.
[4] 杨世虎, 刘贵珊, 张远绿, 等. 贮藏期间亚硝酸钠对滩羊肉品质特性的影响[J]. 食品与发酵工业, 2024, 50(11): 209-215. DOI:10.13995/j.cnki.11-1802/ts.035325.
[5] 冯晓慧, 申智宇, 薛晓凌, 等. 石榴粉与茶多酚替代部分亚硝酸盐对菊粉火腿肠品质的影响[J]. 食品工业科技, 2024, 45(10): 84-92.DOI:10.13386/j.issn1002-0306.2023070208.
[6] 李宜平, 彭燕. 食品中的亚硝酸盐及其对人体健康的影响[J]. 中国食品工业, 2024(6): 140-142.
[7] 李佳怡, 葛渠锋, 李珏, 等. 乳酸菌源亚硝化抑制剂对酱牛肉中N-亚硝胺形成的影响[J]. 肉类研究, 2023, 37(8): 1-7. DOI:10.7506/rlyj1001-8123-20230517-044.
[8] GASSARA F, KOUASSI A P, BRAR S K, et al. Green alternatives to nitrates and nitrites in meat-based products: a review[J]. Critical Reviews in Food Science and Nutrition, 2016, 56(13): 2133-2148.DOI:10.1080/10408398.2013.812610.
[9] LEBRUN S, VAN NIEUWENHUYSEN T, CRÈVECOEUR S, et al.Influence of reduced levels or suppression of sodium nitrite on the outgrowth and toxinogenesis of psychrotrophic Clostridium botulinum group II type B in cooked ham[J]. International Journal of Food Microbiology, 2020, 334: 108853. DOI:10.1016/j.ijfoodmicro.2020.108853.
[10] RYWOTYCKI R. The effect of baking of various kinds of raw meat from different animal species and meat with functional additives on nitrosamine contamination level[J]. Food Chemistry, 2007, 101(2):540-548. DOI:10.1016/j.foodchem.2006.02.012.
[11] AHN H J, KIM J H, JO C, et al. Effects of gamma irradiation on residual nitrite, residual ascorbate, color, and N-nitrosamines of cooked sausage during storage[J]. Food Control, 2004, 15(3): 197-203.DOI:10.1016/S0956-7135(3)00047-1.
[12] HONIKEL K O. The use and control of nitrate and nitrite for the processing of meat products[J]. Meat Science, 2008, 78(1): 68-76.DOI:10.1016/j.meatsci.2007.05.030.
[13] 孙淑艳. 肉制品加工中有害物检测及控制技术研究[J]. 中国食品工业, 2024(22): 90-92.
[14] BAYNE A C V, MISIC Z, STEMMLER R T, et al. N-Nitrosamine mitigation with nitrite scavengers in oral pharmaceutical drug products[J]. Journal of Pharmaceutical Sciences, 2023, 112(7): 1794-1800. DOI:10.1016/j.xphs.2023.03.022.
[15] 张静, 王淑培, 李炎芳, 等. 低亚硝酸盐型中式发酵香肠的研制[J]. 食品研究与开发, 2021, 42(20): 92-99. DOI:10.12161/j.issn.1005-6521.2021.20.014.
[16] YONG H I, KIM T K, CHOI H D, et al. Clean label meat technology:pe-cnverted ntrite as a ntural cring[J]. Food Science of Animal Resources, 2021, 41(2): 173-184. DOI:0.5851/kosfa.2020.e96.
[17] 张春燕, 卢立新, 潘嘹. 基于香芹酚和亚硝酸钠释放的聚对苯二甲酸乙二醇酯/低密度聚乙烯活性包装膜对猪肉护色保质作用研究[J]. 食品与发酵工业, 2025, 51(2): 8-15. DOI:10.13995/j.cnki.11-1802/ts.038770.
[18] 赵明月, 于颍颖, 周浩然, 等. 新型肉制品护色技术研究进展[J]. 食品科技, 2024, 49(5): 91-97. DOI:10.13684/j.cnki.spkj.2024.05.013.
[19] SEBRANEK J G, CASSENS R G, HOEKSTRA W G, et al. 15N tracer studies of nitrite added to a comminuted meat product[J]. Journal of Food Science, 1973, 38(7): 1220-1223. DOI:10.1111/j.1365-2621.1973.tb07242.x.
[20] MAJOU D, CHRISTIEANS S. Mechanisms of the bactericidal effects of nitrate and nitrite in cured meats[J]. Meat Science, 2018, 145: 273-284. DOI:10.1016/j.meatsci.2018.06.013.
[21] PUJOL A, OSPINA-E J C, ALVAREZ H, et al. Myoglobin content and oxidative status to understand meat products’ color: phenomenological based model[J]. Journal of Food Engineering, 2023, 348: 111439.DOI:10.1016/j.jfoodeng.2023.111439.
[22] ZAJĄC M, ZAJĄC K, DYBAŚ J. The effect of nitric oxide synthase and arginine on the color of cooked meat[J]. Food Chemistry, 2022,373: 131503. DOI:10.1016/j.foodchem.2021.131503.
[23] GAO X Q, XIA L Y, FAN Y Q, et al. Evaluation of coloration, nitrite residue and antioxidant capacity of theaflavins, tea polyphenols in cured sausage[J]. Meat Science, 2022, 192: 108877. DOI:10.1016/j.meatsci.2022.108877.
[24] DANOWSKA-OZIEWICZ M, KURP L. Physicochemical properties,lipid oxidation and sensory attributes of pork patties with lupin protein concentrate stored in vacuum, modified atmosphere and frozen state[J]. Meat Science, 2017, 131: 158-165. DOI:10.1016/j.meatsci.2017.05.009.
[25] KING A M, GLASS K A, MILKOWSKI A L, et al. Modeling the impact of ingoing sodium nitrite, sodium ascorbate, and residual nitrite concentrations on growth parameters of Listeria monocytogenes in cooked, cured pork sausage[J]. Journal of Food Protection, 2016,79(2): 184-193. DOI:10.4315/0362-028X.JFP-15-322.
[26] MCCLURE B N, SEBRANEK J G, KIM Y H, et al. The effects of lactate on nitrosylmyoglobin formation from nitrite and metmyoglobin in a cured meat system[J]. Food Chemistry, 2011, 129(3): 1072-1079.DOI:10.1016/j.foodchem.2011.05.077.
[27] BALAZINSKI M, SCHMIDT-BLEKER A, WINTER J, et al.Peroxynitrous acid generated in situ from acidified H2O2 and NaNO2.A suitable novel antimicrobial agent?[J]. Antibiotics, 2021, 10(8):1003. DOI:10.3390/antibiotics10081003.
[28] BORISOV V B, SILETSKY S A, NASTASI M R, et al. ROS defense systems and terminal oxidases in bacteria[J]. Antioxidants, 2021,10(6): 839. DOI:10.3390/antiox10060839.
[29] 王芳虹, 王萌, 赵晓燕, 等. 虾青素结晶对希瓦氏菌与白色念珠菌抑制作用的研究[J]. 食品科技, 2024, 49(10): 303-310. DOI:10.13684/j.cnki.spkj.2024.10.025.
[30] QI J J, JIANG G Y, WAN Y Q, et al. Nanomaterials-modulated Fenton reactions: strategies, chemodynamic therapy and future trends[J].Chemical Engineering Journal, 2023, 466: 142960. DOI:10.1016/j.cej.2023.142960.
[31] LIU J W, ZHANG J F, WENG S F, et al. A new catalyst derived from the sulfur-doped metal-organic framework for Fenton-like reaction[J].Process Safety and Environmental Protection, 2024, 191: 1659-1671.DOI:10.1016/j.psep.2024.09.082.
[32] EVAVOLD C L, RUAN J, TAN Y, et al. The pore-forming protein gasdermin D regulates interleukin-1 secretion from living macrophages[J]. Immunity, 2018, 48(1): 35-44.e6. DOI:10.1016/j.immuni.2017.11.013.
[33] CHOU S L, GUO H T, ZINGL F G, et al. Synthetic peptides that form nanostructured micelles have potent antibiotic and antibiofilm activity against polymicrobial infections[J]. Proceedings of the National Academy of Sciences of the United States of America, 2023, 120(4):e2219679120. DOI:10.1073/pnas.2219679120.
[34] SU L Y, ZHAO Z R, XIA J L, et al. Protecting meat color: the interplay of betanin red and myoglobin through antioxidation and coloration[J]. Food Chemistry, 2024, 442: 138410. DOI:10.1016/j.foodchem.2024.138410.
[35] ALAHAKOON A U, JAYASENA D D, RAMACHANDRA S, et al.Alternatives to nitrite in processed meat: up to date[J]. Trends in Food Science & Technology, 2015, 45(1): 37-49. DOI:10.1016/j.tifs.2015.05.008.
[36] 任顺成, 牛保清. 5 种酚酸对腌制猪肉糜理化特性的影响[J]. 食品科技, 2022, 47(4): 134-142. DOI:10.13684/j.cnki.spkj.2022.04.034.
[37] 张翔, 熊双丽, 何秀丽, 等. 淫羊藿黄酮对中式香肠贮藏期品质的影响研究[J]. 食品科技, 2023, 48(6): 104-109. DOI:10.13684/j.cnki.spkj.2023.06.006.
[38] 赵长青, 代锦苹, 方春玉, 等. 亚硝酸盐清除剂研究进展及其在肉制品中的应用[J]. 中国调味品, 2024, 49(1): 198-202; 220.DOI:10.3969/j.issn.1000-9973.2024.01.033.