随着邻苯二甲酸酯类增塑剂被限制使用,替代型增塑剂(alternative plasticizers,APs)的生产和消费量呈现爆发式增长[1],其广泛应用于食品包装材料[2-4]、玩具[5-6]、建筑材料[7]和个人护理用品[8]等产品中。目前,APs已广泛存在于环境[9-12]、食品[13-15]和生物基质[16-19]中。APs具有胚胎发育毒性、细胞毒性和激素干扰效应[20-23],能够影响神经发育[24-26]和内分泌[27-28],且具有致畸、致癌和致突变[29-30]等危害。APs通常以物理混合的方式参与产品的生产加工,极易通过磨损、浸出等方式释放到环境中或附着在物体表面,存在较为严重的环境泄漏和污染风险。肉制品是蛋白质的重要来源,在生产、加工阶段,亲脂性APs易通过环境和包装材料转移到肉制品中[31-32]。例如,Edwards等[13]在鸡肉卷饼中检出己二酸二(2-乙基己基)酯(di(2-ethylhexyl)adipate,DEHA),检出率高达71%。鉴于APs潜在的危害性,世界各国及地区对食品包装材料中APs在食品中的特定迁移限量(specific migration limit,SML)进行了规定。肉制品基质复杂,富含脂肪、蛋白质、有机酸等物质,影响目标物的准确定性和定量,且APs种类繁多,化合物性质存在显著差异,要实现肉制品中不同种类APs的同时测定相对比较困难。
目前,用于检测APs的方法主要包括气相色谱-质谱法[2,6,8,13-14]、液相色谱-质谱法[12],或分辨率更高的气相色谱-串联质谱法[9,11,13]和高效液相色谱-串联质谱法[16,26,30],或不同检测技术联合使用等[10,15]。受目标物物理化学性质和灵敏度的影响,低分辨质谱法基本均为针对几种典型的或某一类别APs进行研究。而气相色谱-四极杆-飞行时间质谱(gas chromatography-quadrupole-time of flight-mass spectrometry,GC-Q-TOF-MS)作为高分辨质谱可进行实现精确质量数的全谱采集,实现APs的高通量筛查和分析,陈克云等[33]利用GC-Q-TOF-MS技术实现了芝麻油中54 种APs的高通量筛查和分析。基于此,本研究采用一步式净化和GC-Q-TOF-MS技术相结合的方法,通过精确质量数实现复杂基质中46 种APs目标物的精确表征,实现异构体或具有相似精确质量数分子的准确区分,并通过优化样品提取条件与仪器分析条件提高分析方法的灵敏度和选择性,为肉制品中APs的风险评估和风险监测提供技术支撑。
1 材料与方法
1.1 材料与试剂
100 批肉制品(23 批火腿肠、24 批烧鸡、14 批酱牛肉、13 批卤猪皮、12 批卤鸡腿、8 批猪头肉、6 批酱汁鸭) 市售。
乙腈(色谱纯) 德国Meker公司;氯化钠(分析纯) 国药集团化学试剂有限公司;Oasis PRiME HLB柱(6 mL/200 mg) 美国Waters公司;SinChERSLipid、SinChERS-General净化柱 天津安邦键合科技有限公司;46 种APs标准品(纯度≥96%) 北京曼哈格生物科技有限公司、广州佳途科技股份有限公司。
1.2 仪器与设备
8890-7250 GC-Q-TOF-MS仪 美国Agilent公司;UMV-2涡旋混合器 山东青云实验耗材有限公司;MS204S电子天平(精度0.01 mg) 瑞士梅特勒-托利多公司;SECURA2102-1CN电子天平(精度0.01 g)赛多利斯科学仪器(北京)有限公司;3-18KS离心机德国Sigma公司;KQ-800DE超声清洗机(超声波频率40 kHz) 昆山超声仪器有限公司。
1.3 方法
1.3.1 标准溶液配制
分别精确称取10.00 mg 46 种APs标准品于10 mL容量瓶中,采用乙腈溶解样品,配制成1 000 mg/L的标准储备液。采用乙腈逐级稀释为质量浓度为0.01~0.2 mg/L的系列混合标准工作溶液。
1.3.2 样品前处理
称量2 g(精确至0.01 g)样品于50 mL离心管中,加入10 mL乙腈、1 g氯化钠,涡旋2 min,超声处理10 min,8 000 r/min离心5 min,取上清液进行纯化。将净化柱插入装有提取液的50 mL离心管中,缓慢下压,提取液经净化后进入净化管储液池,将净化柱内溶液用吸管反复吸放几次,混匀后吸取适量于进样瓶,供GC-QTOF-MS分析。
1.3.3 基质匹配工作溶液配制
选取空白样品按1.3.2节制备空白基质,氮吹浓缩至近干,分别加入1 mL 1.3.1节配制的系列混合标准工作溶液,配制成基质匹配标准工作溶液。
1.3.4 仪器条件
1.3.4.1 GC条件
色谱柱:HP-5MS毛细管柱(30 m×250 μm,0.25 μm);进样口温度280 ℃;进样模式:不分流;进样量1 μL;载气:氦气,流速1 mL/min;升温程序:60 ℃保持1 min,20 ℃/min升温至220 ℃,保持1 min,再以5 ℃/min升温至280 ℃,保持4 min。
1.3.4.2 TOF-MS条件
电子电离(electron ionization,EI)源:70 eV;离子源温度280 ℃;四极杆温度150 ℃;传输线温度290 ℃;溶剂延迟3.5 min。
1.3.5 46 种APs标准谱库建立
采集46 种APs混合标准溶液(0.1 mg/L)的GC-QTOF-MS信息,EI源电离产生碎片离子,对m/z 50~550范围内的所有碎片离子进行全扫描。利用Qualitative Analysis 10.0软件将经背景扣除的MS图与NIST标准谱库进行对比,利用碎片离子m/z及其分子式确定目标化合物的保留时间、特征碎片分子式及精确质量数等必要信息。随后,将目标物的名称、分子式、CAS号和MS图传输到MassHunter PCDL Manager(B.08.00),建立标准谱库,以便快速靶向筛选46 种APs。相关特征离子信息见前期研究[33]。
1.3.6 基质效应(matrix effects,ME)
采用基质匹配标准曲线斜率与溶剂标准曲线斜率的比值评价46 种目标物的ME,按下式计算ME:
当0%≤|ME|≤20%时,表现为弱基质增强或抑制效应;当20%<|ME|<50%时,表现为中等基质增强或抑制效应;|ME|≥50%时,表现为强基质增强或抑制效应。
1.4 数据处理
通过MassHunter数据处理系统完成数据采集与处理,采用OriginPro 9软件绘图。
2 结果与分析
2.1 提取溶剂的选择
APs化合物的辛醇/水分配系数(lg Kow)差异较大,极性不同,共萃取的难度较大,筛选合适的提取溶剂以提高提取效率至关重要。最常用的APs提取溶剂包括正己烷、乙酸乙酯和乙腈等,本研究对这3 种溶剂的提取效率进行评价。以0.5 mg/kg水平向空白样品中添加46 种APs标准混合溶液,按照1.3.2节方法制备提取液,进行GCQ-TOF-MS全扫描分析。由图1可知,以正己烷和乙酸乙酯作为提取溶剂时,APs加标回收率在70%~120%范围内的仅分别占20%和63%,以正己烷作为提取溶剂时,加标回收率最高达146%,存在较强的ME,不利于后续净化处理。这可能是因为肉制品中富含脂肪和蛋白质,基质较为复杂,弱极性的正己烷在提取目标物的同时也共萃取出大量非极性脂肪;中极性乙酸乙酯易从样品中提取脂肪和具有极性或离子基团的磷脂,这均会影响目标物的定量分析。而以乙腈作为提取溶剂时,76%的目标物加标回收率在70%~120%范围内,其他目标物的加标回收率最高为128%,ME较弱。因此,最终选择乙腈为本方法的提取溶剂。
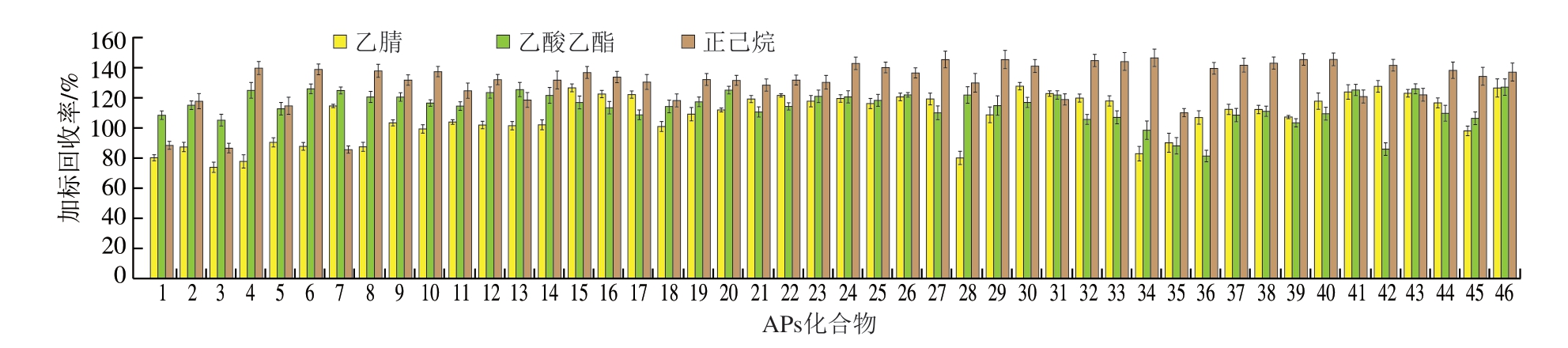
图1 不同提取溶剂对46 种APs加标回收率的影响
Fig.1 Effect of different extraction solvents on spiked recoveries of 46 APs
APs化合物序号与表1对应。图2、4同。
2.2 净化方式的选择
肉制品基质复杂,提取溶剂在提取目标物的同时会不可避免地共萃取出较多杂质。一方面,提取液不经净化直接进行检测时会存在较强的ME,易影响检测结果的准确性;另一方面,脂肪等杂质易污染离子源,影响目标物离子化,降低仪器的灵敏度,而且脂肪也易污染色谱柱并对其造成不可逆损坏。因此,对提取液进行净化是降低ME、提高定性和定量准确性的重要环节。Sin-QuEChERS在QuEChERS基础上进行改进和优化,采用独特的净化技术,可一次性完成提取液净化,节省了离心与多步转移步骤,可有效降低时间成本、提高检测效率。
本研究采用2 种S i n-Q u E C h E R S 固相萃取柱(SinChERS-General固相萃取柱、SinChERS-Lipid固相萃取柱)和1 种PRiME HLB柱对加标(1 mg/kg)样品提取液进行净化。3 种固相萃取柱均为一步式净化,不需要活化、清洗或洗脱步骤。由图2可知,采用PRiME HLB柱和SinChERS-Lipid柱净化时,加标回收率大于120%的目标物分别占38%和30%,去除极性杂质的效果均不突出,净化效果较差。经SinChERS-General柱净化后的目标物加标回收率在73.3%~118.5%之间,不存在回收率大于120%的情况,检测结果更接近于实际值,净化效果明显优于其他2 种净化方式。SinChERS-General柱的填料包括N-丙基乙二胺(primary secondary amine,PSA)和C18,PSA表现出较强的吸附一系列强极性杂质能力,包括色素、糖、脂肪酸和金属离子等。C18表现出吸附非极性干扰物质的能力,包括长链脂肪、甾醇等,该填料具有广泛的极性范围,可有效去除肉制品基质中的大部分杂质,同时减少杂质峰干扰。因此,最终选择SinChERSGeneral柱为本方法的净化方式。
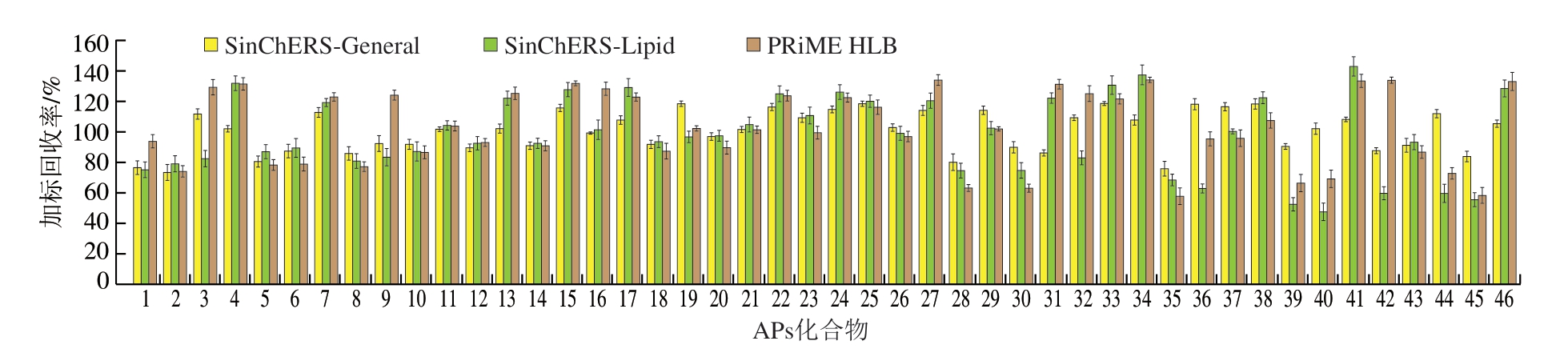
图2 不同净化柱对46 种APs加标回收率的影响
Fig.2 Effect of different purifying columns on spiked recoveries of 46 APs
2.3 GC条件的优化
46 种APs目标物种类较多,理化性质各异,涉及精确质量数相似或同分异构体化合物等问题,为实现所有目标物的有效分离,同时满足响应值的要求,需要对GC分离条件进行优化。GC柱的升温程序是影响APs同分异构体分离效果的关键因素,本研究改变GC的升温程序,使用2 个升温梯度,成功实现所有目标物的有效分离,解决了同分异构体由于无法有效分离而不能准确定性和定量分析的问题。46 种APs的总离子流色谱图见图3。
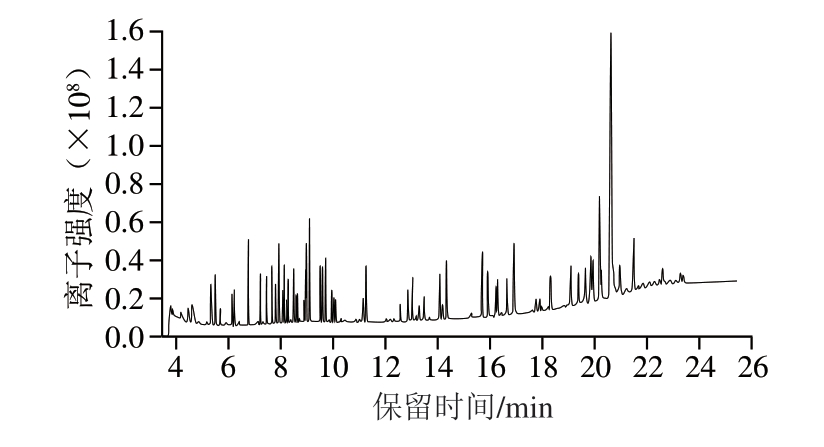
图3 46 种APs的总离子流色谱图
Fig.3 Total ion current chromatogram of 46 APs
2.4 ME的考察
由图4可知,10 种APs存在强基质抑制效应,其余APs存在中等基质抑制效应。为满足分析需求并降低ME对定性和定量分析的影响,需要进行ME校正。因此,本研究采用基质匹配外标法定量。
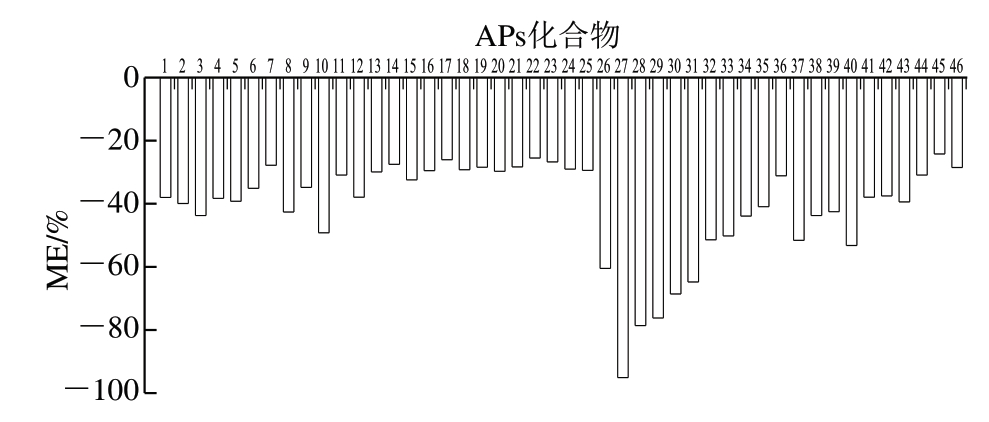
图4 46 种APs的ME
Fig.4 Matrix effects of 46 APs
2.5 筛查参数的优化
针对高分辨质谱,合理设置筛查参数是确保化合物准确定性的前提。为降低分析结果的假阳性率和假阴性率,本研究对质量提取窗口、保留时间偏差等筛查参数进行优化。精确的质量提取窗口可以降低基质干扰、提高分析灵敏度及复杂样品痕量分析结果准确度[34]。本研究将质量提取窗口分别设置为±500×10-6、±100×10-6、±20×10-6 3 个不同水平,分别对磷酸三叔丁酯的特征碎片离子(m/z 98.984 2)进行提取,比较该特征碎片离子在不同质量提取窗口下的干扰峰数量及灵敏度。由图5可知,当质量提取窗口设置为±500×10-6时,目标离子附近出现大量干扰峰(8.146 min),信噪比为50.1。将质量提取窗口减小到±100×10-6后,3 个干扰峰消失,信噪比增加至109.4,分析选择性和灵敏度明显增强。进一步将质量提取窗口缩小到±20×10-6时,基线变平,信噪比提高至152.8,辨认程度有效提高。综上,利用较窄的质量提取窗口可以获得较好的质量、精度和分辨率,从而提高分析的特异性和灵敏度。因此,最终将质量提取窗口设置为±20×10-6。
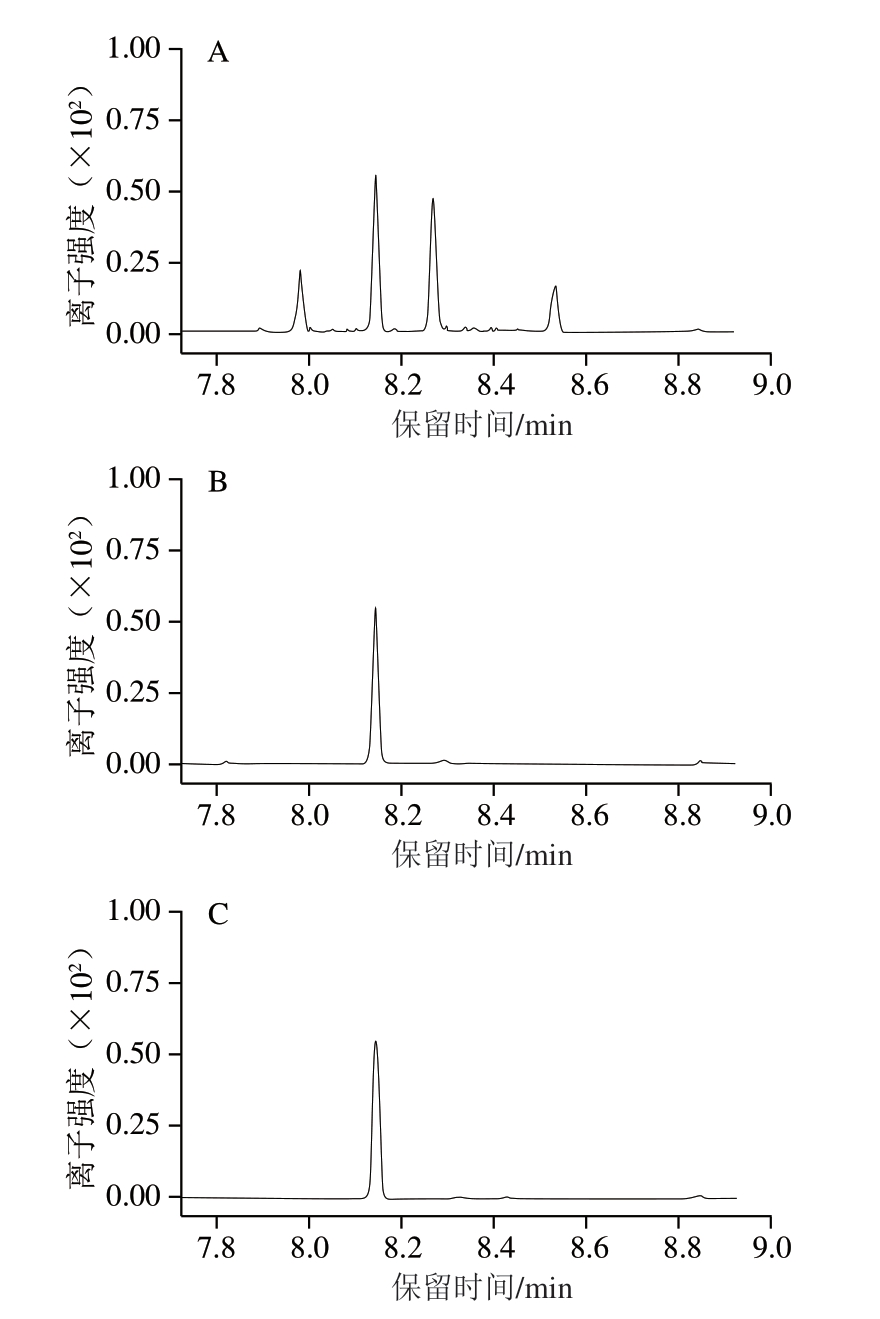
图5 质量提取窗口的选择
Fig.5 Selection of mass extraction window
A~C.质量提取窗口分别为±500×10-6、±100×10-6、±20×10-6。
保留时间偏差是化合物鉴定准确性的另一个重要筛查参数。本研究将保留时间偏差分别设置为±0.10、±0.15、±0.20 min,对空白加标(1 mg/kg)肉制品中的46 种APs进行筛查,考察其假阴性率。结果表明,当保留时间偏差为±0.10 min时,有4 种化合物未筛查到,假阴性率为8.7%;当保留时间偏差为±0.15、±0.20 min时,46 种APs均被筛查出来。因此,最终将保留时间偏差设定为±0.15 min。
为提高定性筛查的准确性,本研究对特征离子数量、谱库匹配综合得分等参数作进一步设置。筛查出的化合物必须同时符合以下条件才可视为阳性检出:每种化合物至少有2 个碎片离子,其质量精度偏差在±5×10-6范围内,色谱峰信噪比≥3,碎片离子的提取色谱图保留时间偏差在±0.15 min范围内,谱库匹配综合得分>75,相对离子丰度偏差<30%。
2.6 方法学评价
2.6.1 线性范围、相关系数及定量限(limit of quantitation,LOQ)
对46 种APs化合物的基质匹配标准工作溶液进行GCQ-TOF-MS分析,以其质量浓度为横坐标(x,mg/L),相应响应值为纵坐标(y)绘制标准曲线。结果表明,在0.01~0.2 mg/L质量浓度范围内,46 种APs呈现良好的线性关系,相关系数均在0.99以上,具体见表1。
表1 46 种APs的方法学参数
Table 1 Methodological parameters for 46 APs
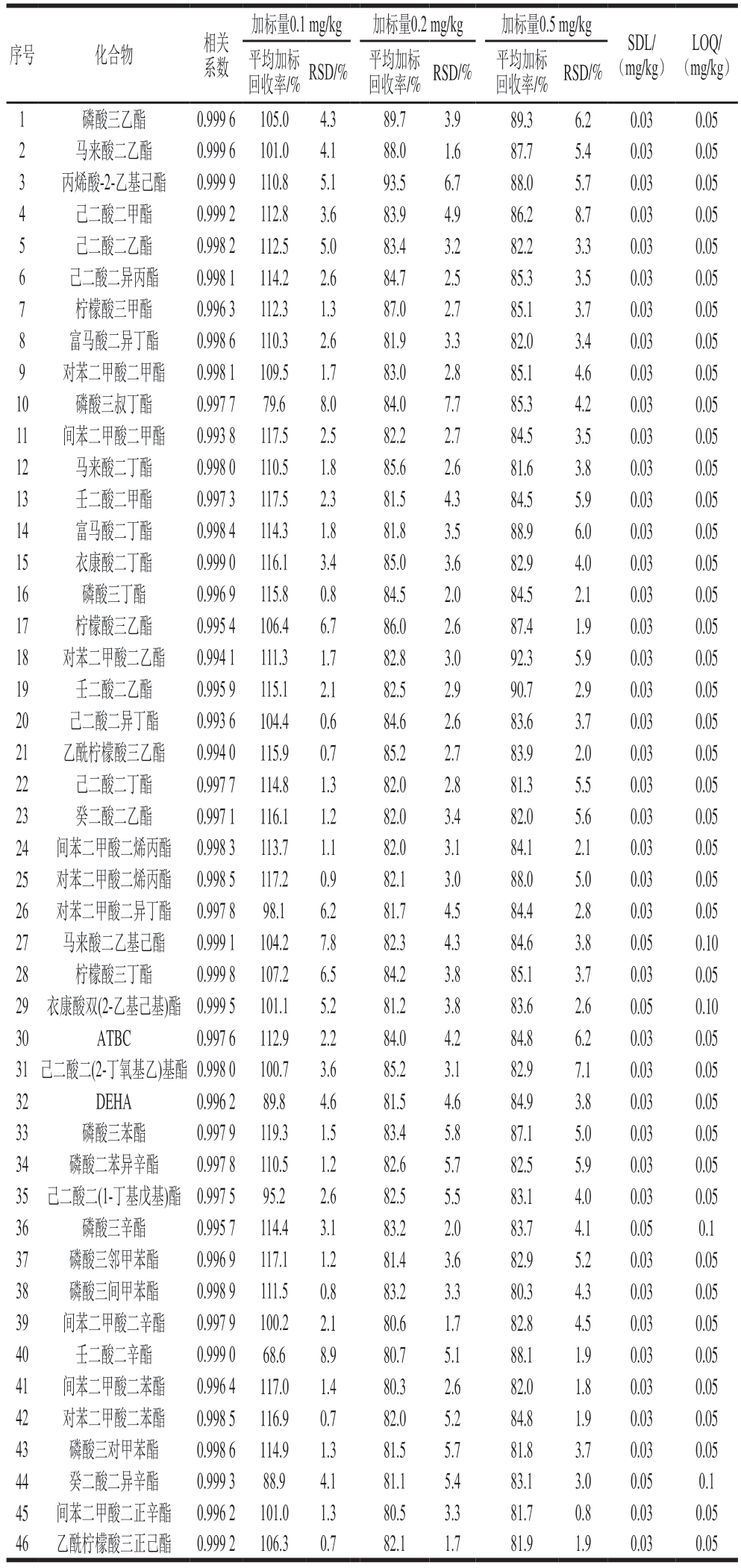
注:SDL.筛查限(screening detection limit);RSD.相对标准偏差(relative standard deviation);ATBC.乙酰柠檬酸三丁酯(acetyl tributyl citrate)。
加标量0.1 mg/kg加标量0.2 mg/kg加标量0.5 mg/kg序号化合物相关系数回收率/% RSD/% 平均加标平均加标回收率/% RSD/% 平均加标回收率/% RSD/%SDL/(mg/kg)LOQ/(mg/kg)1磷酸三乙酯0.999 6 105.04.389.73.989.36.20.030.05 2马来酸二乙酯0.999 6 101.04.188.01.687.75.40.030.05 3丙烯酸-2-乙基己酯0.999 9 110.85.193.56.788.05.70.030.05 4己二酸二甲酯0.999 2 112.83.683.94.986.28.70.030.05 5己二酸二乙酯0.998 2 112.55.083.43.282.23.30.030.05 6己二酸二异丙酯0.998 1 114.22.684.72.585.33.50.030.05 7柠檬酸三甲酯0.996 3 112.31.387.02.785.13.70.030.05 8富马酸二异丁酯0.998 6 110.32.681.93.382.03.40.030.05 9对苯二甲酸二甲酯0.998 1 109.51.783.02.885.14.60.030.05 10磷酸三叔丁酯0.997 779.68.084.07.785.34.20.030.05 11间苯二甲酸二甲酯0.993 8 117.52.582.22.784.53.50.030.05 12马来酸二丁酯0.998 0 110.51.885.62.681.63.80.030.05 13壬二酸二甲酯0.997 3 117.52.381.54.384.55.90.030.05 14富马酸二丁酯0.998 4 114.31.881.83.588.96.00.030.05 15衣康酸二丁酯0.999 0 116.13.485.03.682.94.00.030.05 16磷酸三丁酯0.996 9 115.80.884.52.084.52.10.030.05 17柠檬酸三乙酯0.995 4 106.46.786.02.687.41.90.030.05 18对苯二甲酸二乙酯0.994 1 111.31.782.83.092.35.90.030.05 19壬二酸二乙酯0.995 9 115.12.182.52.990.72.90.030.05 20己二酸二异丁酯0.993 6 104.40.684.62.683.63.70.030.05 21乙酰柠檬酸三乙酯0.994 0 115.90.785.22.783.92.00.030.05 22己二酸二丁酯0.997 7 114.81.382.02.881.35.50.030.05 23癸二酸二乙酯0.997 1 116.11.282.03.482.05.60.030.05 24间苯二甲酸二烯丙酯 0.998 3 113.71.182.03.184.12.10.030.05 25对苯二甲酸二烯丙酯 0.998 5 117.20.982.13.088.05.00.030.05 26对苯二甲酸二异丁酯 0.997 898.16.281.74.584.42.80.030.05 27马来酸二乙基己酯0.999 1 104.27.882.34.384.63.80.050.10 28柠檬酸三丁酯0.999 8 107.26.584.23.885.13.70.030.05 29 衣康酸双(2-乙基己基)酯 0.999 5 101.15.281.23.883.62.60.050.10 30ATBC0.997 6 112.92.284.04.284.86.20.030.05 31 己二酸二(2-丁氧基乙)基酯0.998 0 100.73.685.23.182.97.10.030.05 32DEHA0.996 289.84.681.54.684.93.80.030.05 33磷酸三苯酯0.997 9 119.31.583.45.887.15.00.030.05 34磷酸二苯异辛酯0.997 8 110.51.282.65.782.55.90.030.05 35 己二酸二(1-丁基戊基)酯 0.997 595.22.682.55.583.14.00.030.05 36磷酸三辛酯0.995 7 114.43.183.22.083.74.10.050.1 37磷酸三邻甲苯酯0.996 9 117.11.281.43.682.95.20.030.05 38磷酸三间甲苯酯0.998 9 111.50.883.23.380.34.30.030.05 39间苯二甲酸二辛酯0.997 9 100.22.180.61.782.84.50.030.05 40壬二酸二辛酯0.999 068.68.980.75.188.11.90.030.05 41间苯二甲酸二苯酯0.996 4 117.01.480.32.682.01.80.030.05 42对苯二甲酸二苯酯0.998 5 116.90.782.05.284.81.90.030.05 43磷酸三对甲苯酯0.998 6 114.91.381.55.781.83.70.030.05 44癸二酸二异辛酯0.999 388.94.181.15.483.13.00.050.1 45间苯二甲酸二正辛酯 0.996 2 101.01.380.53.381.70.80.030.05 46乙酰柠檬酸三正己酯 0.999 2 106.30.782.11.781.91.90.030.05
2.6.2 SDL与LOQ
参照SANTE/11312/2021指导文件的要求,在空白肉制品中添加不同水平的标准溶液,每个水平进行20 次重复测试,如果在某个水平下有95%以上的样品能够被筛查出(即假阴性率≤5%),则该水平即为此化合物的SDL。以信噪比≥10对应的水平为此化合物的LOQ。结果表明,46 种APs的SDL在0.03~0.05 mg/kg之间,其中42 种APs的SDL为0.03 mg/kg,4 种APs的SDL为0.05 mg/kg,LOQ在0.05~0.1 mg/kg之间,详见表1。筛查方法的假阴性率低于5%,满足SANTE/11312/2021指导文件对SDL的要求。
2.6.3 准确度和精密度
在低、中、高3 个加标水平(0.1、0.2、0.5 mg/kg)下测定加标样品中目标物的加标回收率(n=6)。由表1可知,46 种APs的平均加标回收率在68.6%~119.3%之间,RSD在0.6%~8.9%之间,表明方法具有较高的准确度和精密度。
2.7 筛查方法的应用
采用自建PCDL数据库对市售的100 批肉制品(23 批火腿肠、24 批烧鸡、14 批酱牛肉、13 批卤猪皮、12 批卤鸡腿、8 批猪头肉、6 批酱汁鸭)中的46 种APs进行快速筛查和确证。在优化的仪器条件下将净化后的样品提取液进行全扫描,利用数据库中特征离子的保留时间和精确质量数进行目标物匹配,谱库匹配综合得分>75,提取的4 个离子中有2 个定性离子检出且精确质量偏差在±5×10-6范围内、保留时间偏差在±0.15 min范围内,离子相对丰度偏差<30%则被视为阳性检出。图6为阳性样品中满足阳性检出的2 种APs的色谱图和质谱图。
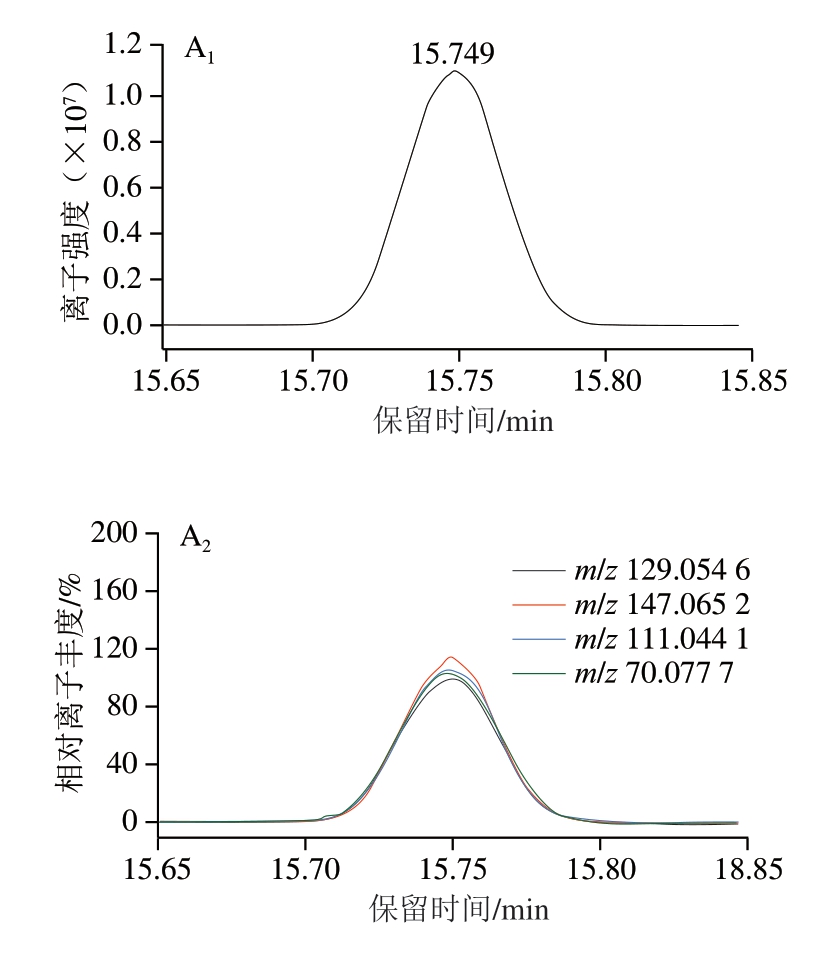
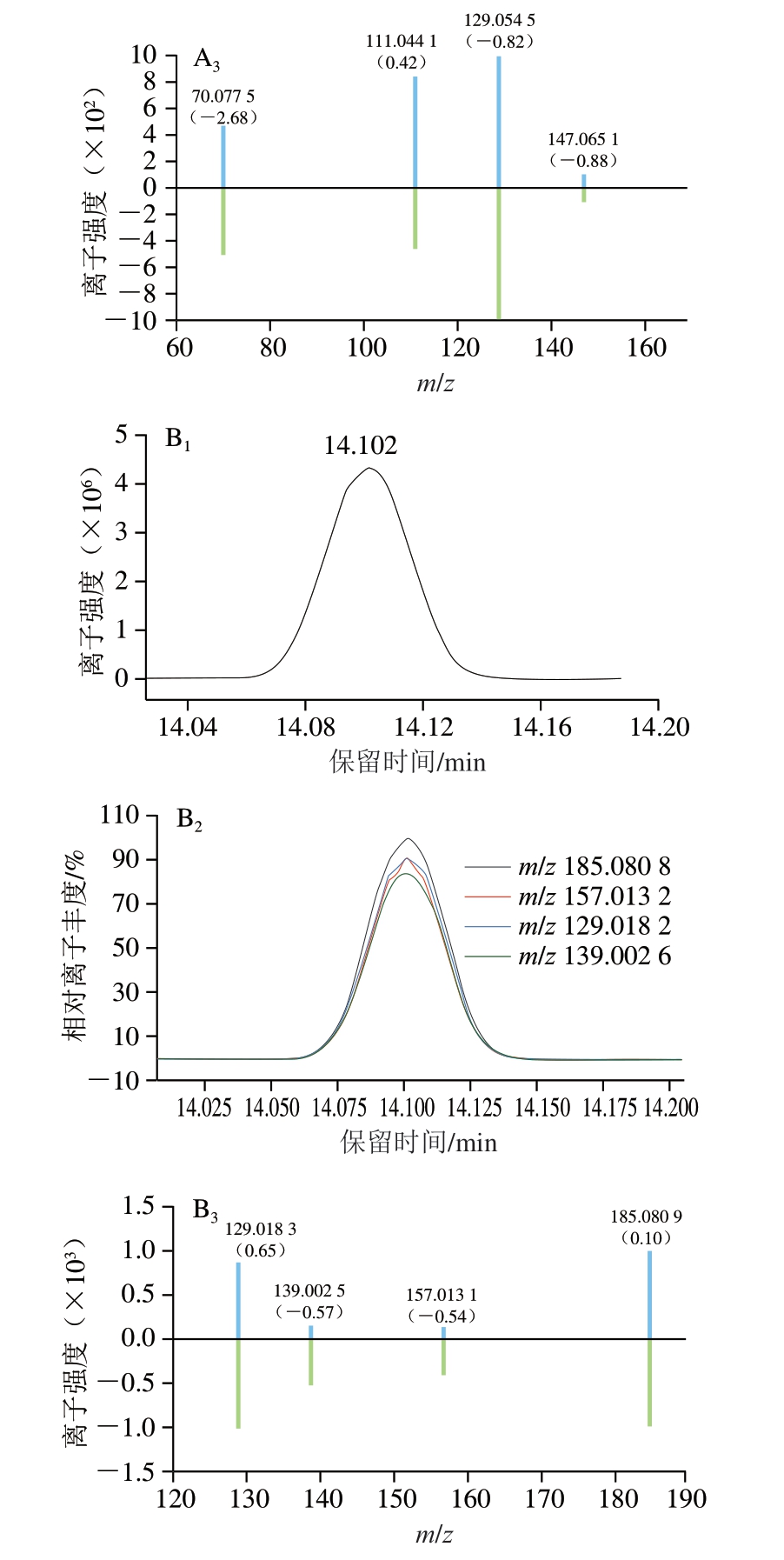
图6 2 种APs的鉴定
Fig.6 Identification of two APs
A.DEHA;B.ATBC;下标1~3.分别为目标离子色谱图、定性离子色谱图及目标离子和定性离子的镜像图。镜像图中,蓝线表示实际样品中4 个特征离子碎片,绿线表示标准溶液中4 个特征离子碎片,括号中为两者的精确质量数偏差。
对鉴定阳性样品进行定量分析。结果表明,1 批猪头肉样品检出DEHA,检出值为0.443 mg/kg,3 批火腿肠样品检出ATBC,检出值分别为0.397、0.559、0.782 mg/kg,远低于GB 9685—2016《食品安全国家标准 食品接触材料及制品用添加剂使用标准》规定的ATBC和DEHA的SML(60、18 mg/kg)。
3 结 论
本研究采用新型净化方式Sin-QuEChERS,结合GCQ-TOF-MS自建PCDL高分辨质谱数据库建立了肉制品中46 种APs的高效筛查策略,并对筛查到的阳性样本进行定量分析。该一步式净化技术操作简便、省时省力,所建立的数据库涵盖精确质量数、特征离子和保留时间等信息,结合质量提取窗口、保留时间偏差等优化参数,有效避免目标物鉴定分析过程中假阴性和假阳性结果的出现,提高了检测的准确度。
GC-Q-TOF-MS对m/z 50~550范围内所有碎片离子的精确质量数进行采集,全扫描数据包含大量信息,无需重复进样,一个全扫描数据可进行无限次解析,得到更多有价值的目标物,将新获得的目标物离子碎片信息发送到PCDL库中,可实现PCDL库的实时扩充与完善,进一步拓展APs的筛查分析范围,提高风险发现能力。综上,本研究建立的方法能够在无标准物质的情况下快速识别目标物,采集的全扫描数据可进行重复分析,发现新的污染物,实时增加PCDL库中目标物的数量,扩大目标物筛查范围,可为肉制品中APs的风险评估和风险监测提供技术支撑。
[1] VIKHAREVA I N, AMINOVA G K, MAZITOVA A K.Development of a highly efficient environmentally friendly plasticizer[J].Polymers,2022, 14(9): 1888.DOI:10.3390/polym14091888.
[2] 周良春, 马俊辉, 张晓飞, 等.ASE-GC-MS法测定食品接触用塑料及制品中两种非邻苯类增塑剂含量[J].包装与食品机械, 2020, 38(5):68-72.DOI:10.3969/j.issn.1005-1295.2020.05.015.
[3] 聂叶, 赵振宇, 曾稳稳, 等.UPLC-Q/Orbitrap HRMS同时测定塑料类食品接触材料及制品中增塑剂特定迁移量[J].中国酿造, 2021,40(1): 164-168.DOI:10.11882/j.issn.0254-5071.2021.01.031.
[4] 何佩霞.食品包装材料中替代型塑化剂的检测方法研究[D].沈阳:中国医科大学, 2020: 1-4.DOI:10.27652/d.cnki.gzyku.2020.001659.
[5] QADEER A, KIRSTEN K L, AJMAL Z, et al.Alternative plasticizers as emerging global environmental and health threat: another regrettable substitution?[J].Environmental Science & Technology, 2022, 56(3):1482-1488.DOI:10.1021/acs.est.1c08365.
[6] SUBEDI B, SULLIVAN K D, DHUNGANA B.Phthalate and nonphthalate plasticizers in indoor dust from childcare facilities, salons,and homes across the USA[J].Environmental Pollution, 2017, 230:701-708.DOI:10.1016/j.envpol.2017.07.02.
[7] HAMMEL S C, LEVASSEUR J L, HOFFMAN K, et al.Children’s exposure to phthalates and non-phthalate plasticizers in the home:the TESIE study[J].Environment International, 2019, 132: 105061.DOI:10.1016/j.envint.2019.105061.
[8] VIMALKUMAR K, ZHU H, KANNAN K.Widespread occurrence of phthalate and non-phthalate plasticizers in single-use facemasks collected in the United States[J].Environment international, 2022,158: 106967.DOI:10.1016/j.envint.2021.106967.
[9] KIM S, KIM Y, MOON H B.Contamination and historical trends of legacy and emerging plasticizers in sediment from highly industrialized bays of Korea[J].Science of the Total Environment,2021, 765: 142751.DOI:10.1016/j.scitotenv.2020.142751.
[10] 刘晓途, 彭长凤, 陈达, 等.广州地区室内灰尘中典型非邻苯增塑剂的污染特征与暴露风险[J].环境科学, 2021, 42(8): 3676-3681.DOI:10.13227/j.hjkx.202012117.
[11] LARSSON K, LINDH C H, JÖNSSON B A, et al.Phthalates, nonphthalate plasticizers and bisphenols in Swedish preschool dust in relation to children’s exposure[J].Environment International, 2017,102: 114-124.DOI:10.1016/j.envint.2017.02.006.
[12] NAGORKA R, KOSCHORRECK J.Trends for plasticizers in German freshwater environments-evidence for the substitution of DEHP with emerging phthalate and non-phthalate alternatives[J].Environmental Pollution, 2020, 262: 114237.DOI:10.1016/j.envpol.2020.114237.
[13] EDWARDS L, MCCRAY N L, VANNOY B N, et al.Phthalate and novel plasticizer concentrations in food items from U.S.fast food chains: a preliminary analysis[J].Journal of Exposure Science &Environmental Epidemiology, 2022, 32(3): 366-373.DOI:10.1038/s41370-021-00392-8.
[14] SAMBOLINO A, ORTEGA-ZAMORA C, GONZÁLEZ-SÁLAMO J,et al.Determination of phthalic acid esters and di(2-ethylhexyl)adipate in fish and squid using the ammonium formate version of the QuEChERS method combined with gas chromatography mass spectrometry[J].Food Chemistry, 2022, 380: 132174.DOI:10.1016/j.foodchem.2022.132174.
[15] FROMME H, SCHÜTZE A, LAHRZ T, et al.Non-phthalate plasticizers in German daycare centers and human biomonitoring of DINCH metabolites in children attending the centers (LUPE 3)[J].International Journal of Hygiene and Environmental Health, 2016,219(1): 33-39.DOI:10.1016/j.ijheh.2015.08.002.
[16] LEE I, PÄLMKE C, RINGBECK B, et al.Urinary concentrations of major phthalate and alternative plasticizer metabolites in children of Thailand, Indonesia, and Saudi Arabia, and associated risks[J].Environmental Science & Technology, 2021, 55(24): 16526-16537.DOI:10.1021/acs.est.1c04716.
[17] ZUGHAIBI T A, SHEIKH I A, BEG M A.Insights into the endocrine disrupting activity of emerging non-phthalate alternate plasticizers against thyroid hormone receptor: a structural perspective[J].Toxics,2022, 10(5): 263.DOI:10.3390/toxics10050263.
[18] DOMÍNGUEZ-ROMERO E, KOMPRDOVÁ K, KALINA J, et al.Time-trends in human urinary concentrations of phthalates and substitutes DEHT and DINCH in Asian and North American countries(2009—2019)[J].Journal of Exposure Science & Environmental Epidemiology, 2023, 33(2): 244-254.DOI:10.1038/s41370-022-00441-w.
[19] MÍNGUEZ-ALARCÓN L, SOUTER I, CHIU Y H, et al.Urinary concentrations of cyclohexane-1,2-dicarboxylic acid monohydroxy isononyl ester, a metabolite of the non-phthalate plasticizer di(isononyl)cyclohexane-1,2-dicarboxylate (DINCH), and markers of ovarian response among women attending a fertility center[J].Environmental Research, 2016, 151: 595-600.DOI:10.1016/j.envres.2016.08.012.
[20] ZHANG Y, LI J, SU G.Identifying citric acid esters, a class of phthalate substitute plasticizers, in indoor dust via an integrated target,suspect, and characteristic fragment-dependent screening strategy[J].Environmental Science & Technology, 2021, 55(20): 13961-13970.DOI:10.1021/acs.est.1c04402.
[21] KIM H, NAM K, OH S, et al.Toxicological assessment of phthalates and their alternatives using human keratinocytes[J].Environmental Research, 2019, 175: 316-322.DOI:10.1016/j.envres.2019.05.007.
[22] PARK J, PARK C, GYE M C, et al.Assessment of endocrinedisrupting activities of alternative chemicals for bis(2-ethylhexyl)phthalate[J].Environmental Research, 2019, 172: 10-17.DOI:10.1016/j.envres.2019.02.001.
[23] SHEIKH I A, BEG M A.Structural characterization of potential endocrine disrupting activity of alternate plasticizers di-(2-ethylhexyl)dipate(DEHA), acetyl tributyl citrate (ATBC) and 2,2,4-trimethyl 1,3-pentanediol diisobutyrate (TPIB) with human sex hormone-binding globulin[J].Reproductive Toxicology, 2019, 83: 46-53.DOI:10.1016/j.reprotox.2018.11.003.
[24] SAILLENFAIT A M, NDAW S, ROBERT A, et al.Recent biomonitoring reports on phosphate ester flame retardants: a short review[J].Archives of Toxicology, 2018, 92(9): 2749-2778.DOI:10.1007/s00204-018-2275-z.
[25] XIAO K Y, LU Z B, YANG C, et al.Occurrence, distribution and risk assessment of organophosphate ester flame retardants and plasticizers in surface seawater of the West Pacific[J].Marine Pollution Bulletin,2021, 170: 112691.DOI:10.1016/j.marpolbul.2021.112691.
[26] LI M Q, YAO Y M, WANG Y, et al.Organophosphate ester flame retardants and plasticizers in a Chinese population: significance of hydroxylated metabolites and implication for human exposure[J].Environmental Pollution, 2020, 257: 113633.DOI:10.1016/j.envpol.2019.113633.
[27] KAMBIA N K, SÉVERIN I, FARCE A, et al.In vitro and in silico hormonal activity studies of di-(2-ethylhexyl)terephthalate, a di-(2-ethylhexyl)phthalate substitute used in medical devices, and its metabolites[J].Journal of Applied Toxicology, 2019, 39(7): 1043-1056.DOI:10.1002/jat.3792.
[28] LEE G, KIM S, BASTIAENSEN M, et al.Exposure to organophosphate esters, phthalates, and alternative plasticizers in association with uterine fibroids[J].Environmental Research, 2020,189: 109874.DOI:10.1016/j.envres.2020.109874.
[29] 黄永辉.同位素稀释-气相色谱-质谱法同时测定婴幼儿配方奶粉中8 种己二酸酯塑化剂[J].食品与机械, 2020, 36(9): 77-81.DOI:10.13652/j.issn.1003-5788.2020.09.013.
[30] YIN S S, BEEN F, LIU W P, et al.Hair as an alternative matrix to monitor human exposure to plasticizers-development of a liquid chromatography-tandem mass spectrometry method[J].Journal of Chromatography B, 2019, 1104: 94-101.DOI:10.1016/j.jchromb.2018.09.031.
[31] KAWAMURA Y, OGAWA Y, MUTSUGA M.Migration of nonylphenol and plasticizers from polyvinyl chloride stretch film into food simulants, rapeseed oil, and foods[J].Food Science & Nutrition.2016, 5(3): 390-398.DOI:10.1002/fsn3.404.
[32] GUART A, BONO-BLAY F, BORRELL A, et al.Migration of plasticizers phthalates, bisphenol A and alkylphenols from plastic containers and evaluation of risk[J].Food Additives & Contaminants:Part A, 2011, 28(5): 676-685.DOI:10.1080/19440049.2011.555845.
[33] 陈克云, 鞠香, 王艳丽, 等.基于气相色谱-四极杆-飞行时间质谱高通量筛查芝麻油中54 种替代型增塑剂[J].色谱, 2023, 41(11): 1010-1020.DOI:10.3724/SP.J.1123.2023.08007.
[34] 李康聪, 杨吉双, 李秀琴, 等.QuEChERS-气相色谱-四极杆飞行时间质谱筛查大米中有机磷阻燃剂残留[J].色谱, 2023, 41(11): 1021-1029.DOI:10.3724/SP.J.1123.2023.08022.