热带海参(Holothuria leucospilota)主要分布在热带及亚热带海洋地区,国内主要分布在南方沿海地区[1]。热带海参具有较高营养价值,高水分、高蛋白[2],富含氨基酸、维生素及人体所必需的微量元素,除此之外,还含有多糖、皂苷、神经酰胺、脑苷脂等成分[3]。热带海参具有较好的药理作用,如总蛋白具有抗癌作用;对肝癌细胞HepG2和A549及乳腺癌细胞Panc02具有显著抑制性[4];Cai Lei等[5]采用计算机虚拟筛选获得6 种具有潜在降血糖活性的肽;Zhao Fuqiang等[6]研究发现,海参多糖可以调节肠道微生物群及其代谢物质,改善葡萄糖耐受不良并调节血脂和激素水平。但人工过量捕捞和自然环境被破坏等原因导致热带海参资源一度短缺。近年来,随着人工育种和热带海参养殖技术的突破,其产量显著提升[4,6-7]。然而,热带海参的加工利用度并未随着产量的增加而受到重视,需要加大对热带海参的研究力度,拓宽其应用。
目前,海参产品主要以干制品和即食海参为主,其中加工技术主要以长时间炖煮后真空包装或长时间炖煮后干燥为主。但这些加工方式会导致海参的营养损失,如即食海参口感普遍较软,保质期较短,贮藏期间易发生口感下降、品质劣化及稳定性变差等现象[8];而海参干制品的缺点是反复清洗、煮制等过程中营养流失严重[9]。食品高静水压(high hydrostatic pressure,HHP)技术是通过水等介质传递压力,在一定温度下进行加压处理的一种物理加工技术,可以起到杀菌效果[10]。因此,利用HHP技术改善水产品的品质及营养特性具有重要意义[11]。郑明静等[12]研究表明,HHP通过改变微观结构改善海参品质,同时可以降低贮藏期间海参体内营养物质的损耗,并使海参的微生物残存量变少,从而延长产品货架期。郝梦甄等[13]研究得出,在4 ℃冷藏28 d,HHP海参的质构特性、蛋白质和多糖等功能成分的保留程度均优于鲜海参和盐渍泡发海参。侯虎等[14]研究表明,HHP刺参体壁凝胶发生劣化,其原因是胶原纤维断裂、弛豫时间较短的水分向弛豫时间较长的水分转化、蛋白降解等。Xia Yuanjing等[15]研究表明,HHP能显著延长海参的货架期,有效降低总挥发性盐基氮含量,灭活自溶酶,并诱导蛋白质的变性。Hossain等[16]研究表明,HHP显著影响大西洋海参内脏酚类物质的提取及其抗氧化性能和其他生物活性。
前人关于HHP海参的研究主要集中在基本营养成分和微观结构方面,而对加工过程中蛋白结构的变化研究较少。虽有研究者采用HHP协同水煮工艺加工海参,但没有对比研究先HHP后水煮和先水煮后HHP 2 种加工方式对海参品质的影响。因此,本研究在此基础上研究不同加工方式下热带海参的微观结构、质构特性、营养组成、水分状态及蛋白理化性质等,分析不同HHP与热处理顺序对热带海参营养品质及蛋白结构的作用规律,为热带海参加工与利用提供新的思路。
1 材料与方法
1.1 材料与试剂
热带海参由广东省农科院动科所提供,取到后立即处理。
硫酸、苯酚、硼酸、盐酸、Triton X-100、石油醚(均为分析纯) 天津市富宇精细化工有限公司;甲基红、无水碳酸钠、氢氧化钠、溴甲酚绿、木瓜蛋白酶、二硫苏糖醇、十二烷基硫酸锂(均为分析纯)上海麦克林生化科技股份有限公司;Tris、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、乙二胺四乙酸(均为分析纯) 德国Biofroxx公司;10×Tris-Tricine-SDS电泳缓冲液 生工生物工程(上海)有限公司;BeyoColorTM彩色预染蛋白分子质量标准(65~270 kDa)上海碧天云生物技术公司。
1.2 仪器与设备
KieltecTM 8400全自动凯氏定氮仪 丹麦福斯分析仪器公司;D-160手持式均质机 大龙兴创实验仪器(北京)股份公司;CT-3质构仪 美国Brookfield公司;SOX416全自动索氏抽提仪 德国格哈特公司;UV-1800紫外-可见分光光度计 日本Shimmadz公司;SHPP-57DZM-600超高压设备 山西力德福科技有限公司;Cary Eclipse分子荧光光度计 安捷伦科技(中国)有限公司;NMI20-Analyst核磁共振成像分析仪 上海纽脉医疗科技股份有限公司;S-3400N-II扫描电子显微镜 日本日立公司。
1.3 方法
1.3.1 样品处理
取36 只(160±10)g的新鲜热带海参,用剪刀沿腹部剪开,去除内脏和沙嘴,用清水冲洗干净备用。将热带海参分成3 组,分别为水煮组、先HHP后水煮组、先水煮后HHP组,热带海参与水的比例为1∶10(g/mL)。水煮组的海参分别采用电磁炉于1 000 W沸腾慢煮30、60、90 min,分别命名为B30、B60、B90;先HHP后水煮组的海参先于20 ℃分别在100、300、500 MPa压力下保压5 min,后采用电磁炉于1 000 W沸腾慢煮30 min,分别命名为HHP-B100、HHP-B300、HHP-B500;先水煮后HHP组的海参先采用电磁炉于1 000 W沸腾慢煮30 min,后于20 ℃分别在100、300、500 MPa压力下保压5 min,分别命名为B-HHP100、B-HHP300、B-HHP500。所得样品取一部分放置于-80 ℃冰箱冷冻贮藏,其余部分进行冷冻干燥,于-18 ℃冰箱保存。
1.3.2 质量损失率测定
海参加工过程中的质量损失率按式(1)计算:
式中:m1为处理前海参体壁质量/g;m2为处理后海参体壁质量/g。
1.3.3 持水率及水分含量测定
取1 g海参样品用滤纸包裹放置于离心管中,在4 ℃、3 000 r/min条件下离心10 min,持水率按式(2)计算:
式中:m3为离心后海参体壁质量/g;m4为离心前海参体壁质量/g。
水分含量采用GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中的直接干燥法进行测定。
1.3.4 质构特性测定
参考郑明静等[12]的方法,将海参切成2 c m×2 cm×2 cm的立方体,测定海参的硬度、弹性、内聚性、黏性和咀嚼性。测试选用的探头为P5,测试模式为质地剖面分析,具体测试参数:下压速率1 mm/s,回复速率1 mm/s,下压距离为样品高度的30%,触发力5 g。
1.3.5 基本营养成分测定
灰分含量采用GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》中的高温灼烧法进行测定;粗蛋白含量采用GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中的凯氏定氮法进行测定;脂肪含量采用GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》中的索氏抽提法进行测定;总糖的提取采用王义轩[17]的方法并稍作修改,取适量样品于蒸馏水中,使底物质量浓度为3 g/100 mL,8 000 r/min均质1 min,调节pH值至7.0,以样品质量为基准,加入质量分数1.5%的木瓜蛋白酶(>200 U/mg),在55 ℃水浴锅酶解3 h后于沸水浴中灭酶10 min,8 000 r/min离心15 min,收集上清液,采用苯酚硫酸法于490 nm波长处测定吸光度,后续步骤与王义轩[17]方法一致。
1.3.6 水分分布测定
称取1 g长条状热带海参样品,用保鲜膜包裹后放入核磁管中。采用核磁共振成像分析仪测定热带海参的水分迁移率和分布。测定方法为质子共振频率20 MHz,磁体温度32 ℃,间隔时间11 000 ms,回波时间0.250 ms,回波个数1 800[18],每个样品重复测定3 次。
1.3.7 微观结构观察
将热带海参样品切成5 mm×5 mm×5 mm的薄片,用2.5%戊二醛固定过夜后,用10×磷酸盐缓冲液(pH 7.0)清洗3 次,每次浸泡15 min。清洗结束后,依次使用30%、50%、70%、80%、90%乙醇溶液和无水乙醇对样品进行梯度脱水,每个梯度浸泡15 min,脱水后进行CO2临界点干燥,随后进行喷金处理,在扫描电子显微镜下观察。
1.3.8 SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)
将样品和提取液(20 mmol/L Tris-HCl、150 mmol/L NaCl、2 mmol/L乙二胺四乙酸二钠盐、10 mmol/L二硫苏糖醇、1%(V/V)Triton X-100、0.1 g/100 mL SDS,pH 7.4)以1∶3(g/mL)的比例混合,在冰上均质提取20 min,4 ℃条件下12 000×g离心15 min,取上清液,采用BCA比色法测定蛋白质量浓度,用样品缓冲液(277 mmol/L Tris-HCl、44.4%(V/V)甘油、4.4 g/100 mL十二烷基硫酸锂,pH 6.8)将蛋白样品稀释至质量浓度为2 mg/mL,将稀释后的样品溶液100 ℃加热5 min,冷却后取20 μL样品溶液上样,以5%浓缩胶、10%分离胶为基础,采用Tris-Tricine-SDS电泳缓冲液,先以80 V运行30 min,再以120 V运行60 min[18]。
1.3.9 蛋白内源荧光光谱检测
采用Zhang Qian等[18]的方法,将1.3.8节提取的蛋白溶液质量浓度调整为0.5 mg/mL,采用荧光分光光度计进行荧光光谱扫描,激发波长280 nm,扫描范围290~400 nm,测定荧光强度。
1.3.10 蛋白质二级结构测定
采用Zhang Qian等[18]的方法,取3 g海参样品,加入30 mL 10 g/100 mL SDS溶液,8 000 r/min均质1 min,于85 ℃加热1 h,10 000×g离心15 min,收集上清液进行真空冷冻干燥。取冷冻干燥后的蛋白粉末与无水溴化钾充分研磨混合,在一定压力下压制成溴化钾压片进行傅里叶变换红外光谱测定和分析。利用Peakfit软件对图谱进行去卷积和曲线拟合分析,根据各子峰的积分面积计算蛋白质二级结构的相对含量。
1.4 数据处理
所有实验均重复3 次,采用Excel 2016软件进行数据整理及分析,采用SPSS 29软件进行单因素显著性差异分析,以P<0.05作为差异显著检验,利用Origin 2021、GraphPad Prism 10软件作图。
2 结果与分析
2.1 不同加工方式对热带海参质量损失率的影响
质量损失率能直观体现出加热过程中海参水分及水溶性成分的流失情况。经过沸水熬煮后,海参肉从无定形状态收缩成坚挺、轮廓清晰的状态,体积明显缩小,质量下降。如图1所示,B30组质量损失率为42.85%,而B60和B90组分别为57.15%、58.51%。随着水煮时间延长,海参体壁蛋白质的热收缩和热变性更加彻底,导致更多的水溶性物质溶出[17]。B-HHP100、B-HHP300、B-HHP500组的质量损失率分别49.75%、56.41%、51.88%,HHP-B100、HHP-B300、HHP-B500组的质量损失率分别为59.43%、67.68%、63.46%。经过HHP的热带海参质量损失率相比于B30组均显著增加(P<0.05),随着HHP压力的增加,质量损失率呈现先增加后减少的趋势。叶安妮[19]研究得出,随着压力的增大,海鲈鱼和对虾的质量损失率呈增大趋势。因此HHP可能促进海参体内汁液的流失,其中先HHP后水煮的热带海参比先水煮后HHP的热带海参质量损失率高。
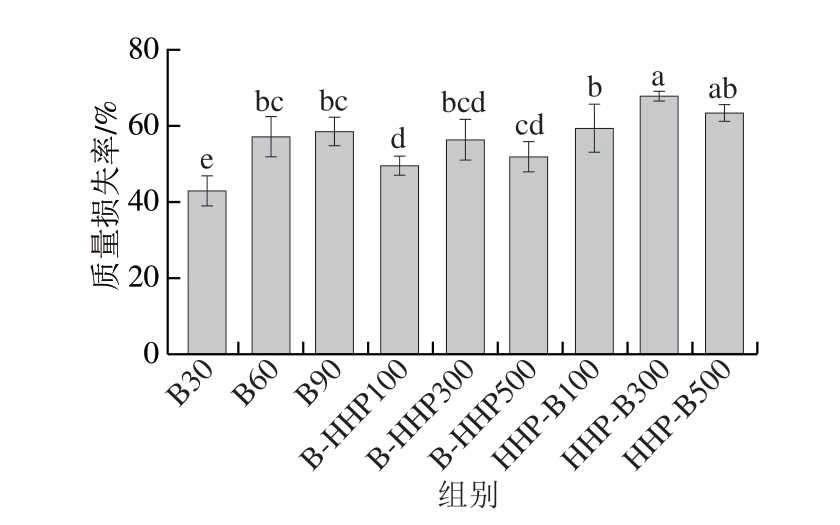
图1 不同加工方式对热带海参质量损失率的影响
Fig.1 Effect of processing sequences on the mass loss rate of tropical sea cucumbers
小写字母不同表示差异显著(P<0.05)。图2同。
2.2 不同加工方式对热带海参持水率及水分含量的影响
水分是热带海参的主要成分之一,其持水性能的好坏会影响产品的多汁性、嫩度及风味等[20]。由图2A可知,B30、B60、B90组的持水率分别为89.47%、86.69%、86.90%。B-HHP100、B-HHP300、B-HHP500组的热带海参持水率分别为87.98%、90.03%、88.86%;HHP-B100、HHP-B300、HHP-B500组的热带海参持水率分别为91.32%、92.12%、94.01%。先HHP后水煮的热带海参相较于水煮组和先水煮后HHP的海参持水率均增加。由图2B可知,B30组的水分质量分数为84.42%,除B-HHP300、B-HHP500组外,其余处理组水分含量与B30组相比均呈降低趋势,其中HHP-B300和HHP-B500组热带海参水分含量显著降低(P<0.05)。这与孙梦等[21]的研究结果相似,水分含量与处理压力成反比,这是由于HHP过程破坏海参的细胞结构,提高细胞渗透性,促进水分迁移,增加渗透期间的水分损失[22]。其中B-HHP500组水分含量最高,可能是由于HHP将一些埋藏的疏水基团暴露,表面积与体积之比增加,诱导蛋白质变性,从而增强蛋白质的水合作用,使水分含量增加[23]。
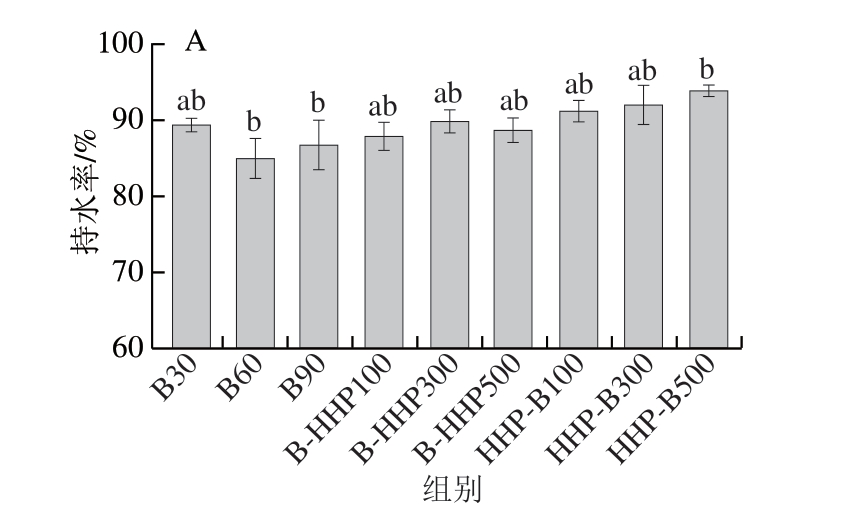
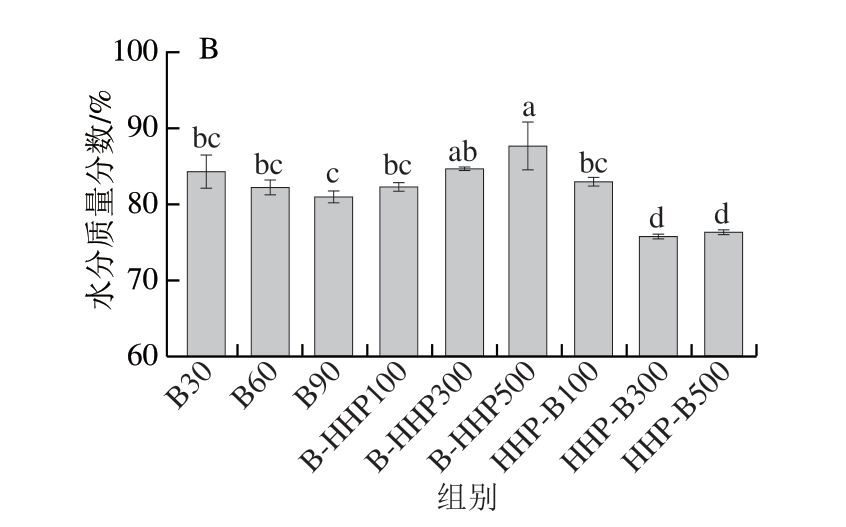
图2 不同加工方式对热带海参持水率(A)及水分含量(B)的影响
Fig.2 Effects of processing sequences on the water-holding capacity (A) and moisture content (B) of tropical sea cucumbers
2.3 不同加工方式对热带海参质构特性的影响
质构特性是影响海参口感的重要指标。由表1可知,经水煮处理后热带海参的硬度、黏附性和咀嚼性较高,而弹性和内聚力较低。发生这样的变化是因为加热后,热带海参的真皮层收紧并向内卷曲,使经过热处理后的热带海参更脆[20]。随着加热时间的延长,其咀嚼性、硬度、黏性均有一定程度下降,而内聚力和弹性无明显变化。经HHP热带海参的质构特性有明显的变化。其原因是在压力的作用下,蛋白质出现空间构型改变、肽链解开,引起溶酶体破裂,促进机体肌肉自溶和嫩化,可以改变产品的硬度、黏性和咀嚼性等[14]。B-HHP100、B-HHP300、B-HHP500组热带海参的硬度、黏性和咀嚼性较B30组热带海参均呈降低趋势,随着压力的增加,硬度和黏性呈现先增加后降低的趋势,而咀嚼性呈降低趋势。HHP-B100、HHP-B300、HHP-B500组热带海参的弹性和内聚力的变化不大,随着压力的增加,硬度先增加后降低,黏性和咀嚼性呈增加趋势。HHP-B300和HHP-B500组热带海参的质构特性与水煮热带海参的质构特性接近且硬度略有提升。
表1 不同加工方式对热带海参质构的影响
Table 1 Effects of processing sequences on the texture of tropical sea cucumbers
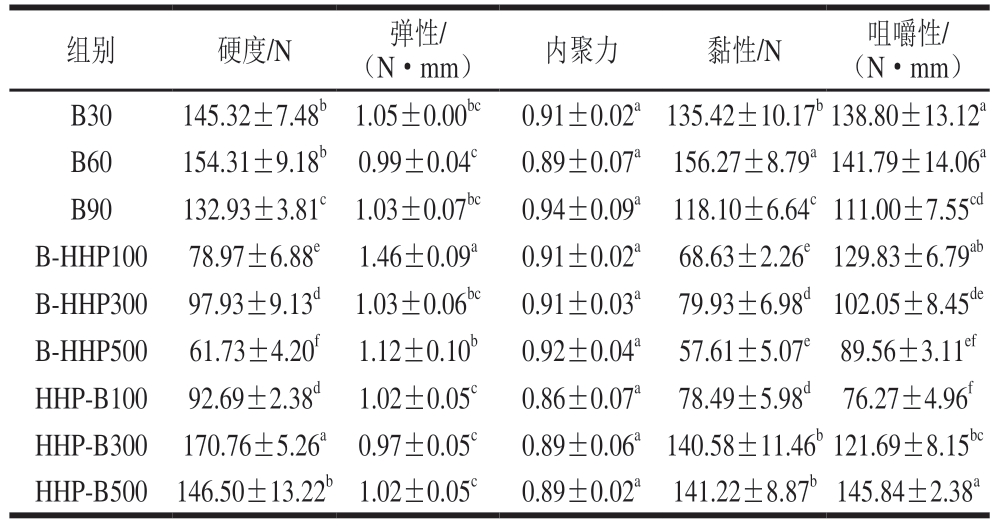
注:同列小写字母不同表示差异显著(P<0.05)。表2同。
(N·mm)内聚力黏性/N咀嚼性/(N·mm)B30145.32±7.48b 1.05±0.00bc 0.91±0.02a 135.42±10.17b 138.80±13.12a B60154.31±9.18b 0.99±0.04c0.89±0.07a 156.27±8.79a 141.79±14.06a B90132.93±3.81c 1.03±0.07bc 0.94±0.09a 118.10±6.64c 111.00±7.55cd B-HHP100 78.97±6.88e 1.46±0.09a0.91±0.02a 68.63±2.26e 129.83±6.79ab B-HHP300 97.93±9.13d 1.03±0.06bc 0.91±0.03a 79.93±6.98d 102.05±8.45de B-HHP50061.73±4.20f 1.12±0.10b0.92±0.04a 57.61±5.07e 89.56±3.11ef HHP-B100 92.69±2.38d 1.02±0.05c0.86±0.07a 78.49±5.98d 76.27±4.96f HHP-B300 170.76±5.26a 0.97±0.05c0.89±0.06a 140.58±11.46b 121.69±8.15bc HHP-B500 146.50±13.22b 1.02±0.05c0.89±0.02a 141.22±8.87b 145.84±2.38a组别硬度/N弹性/
2.4 不同加工方式对热带海参基本营养成分含量的影响
如表2所示,每组海参中蛋白质含量均为最高,总糖和灰分含量较低,脂肪含量最低,其基本营养成分组成表现出高蛋白、低脂肪的特性。所有样品经过加工处理后的脂肪含量变化不显著。随着水煮时间的延长,热带海参的灰分和总糖含量整体下降。HHP-B100、HHP-B300、HHP-B500组热带海参的灰分含量相较于B30组呈降低趋势,而B-HHP100、B-HHP300、B-HHP500组热带海参的灰分含量与B30组含量相近,经过HHP的热带海参灰分含量随着压力的增加而降低,先HHP后水煮的海参灰分含量相较于先水煮后HHP的灰分含量有所降低。经过HHP的热带海参的总糖含量较B30组均降低,其原因可能是HHP会导致水溶性物质溶出。虽然加工后的海参蛋白含量增加,但实际上蛋白存在一定程度的流失,其原因可能是在加工过程中海参的体积收缩、质量损失率显著增加(P<0.05),导致蛋白相对含量增加。研究[24-27]表明,超高压可以明显降低肌动蛋白和肌球蛋白的热稳定性,引起蛋白质构象改变,疏水性蛋白相互聚集结合,导致蛋白变性或改性。HHP热带海参的蛋白含量随着压力增加而降低,其中B-HHP100、B-HHP300、HHP-B100、HHP-B300组热带海参蛋白含量相较于B30组有所增加,B-HHP500、HHP-B500组热带海参蛋白含量相较于B30组明显减少。
表2 不同加工方式对海参基本营养成分含量的影响(干基)
Table 2 Effects of processing sequences on basic nutrients of sea cucumber (on a dry basis)%
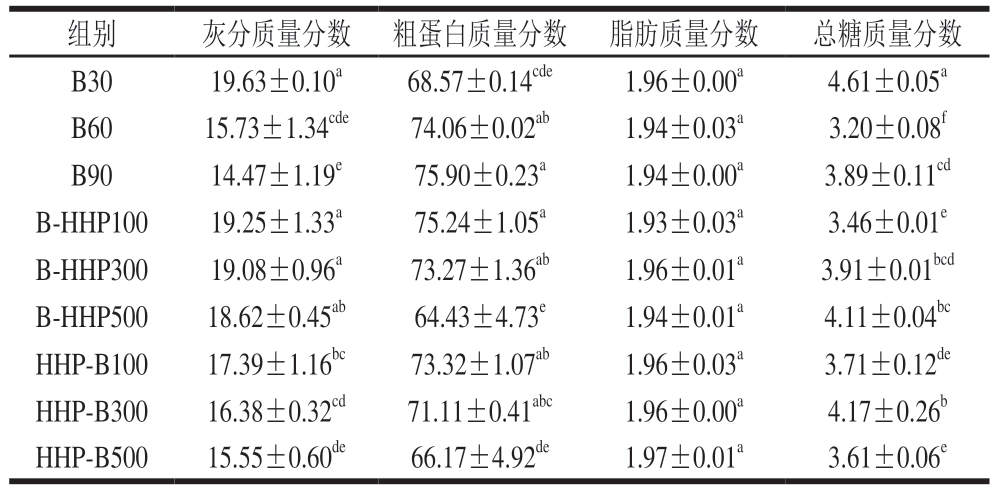
组别灰分质量分数 粗蛋白质量分数 脂肪质量分数总糖质量分数B3019.63±0.10a68.57±0.14cde1.96±0.00a4.61±0.05a B6015.73±1.34cde74.06±0.02ab1.94±0.03a3.20±0.08f B9014.47±1.19e75.90±0.23a1.94±0.00a3.89±0.11cd B-HHP10019.25±1.33a75.24±1.05a1.93±0.03a3.46±0.01e B-HHP30019.08±0.96a73.27±1.36ab1.96±0.01a3.91±0.01bcd B-HHP50018.62±0.45ab64.43±4.73e1.94±0.01a4.11±0.04bc HHP-B10017.39±1.16bc73.32±1.07ab1.96±0.03a3.71±0.12de HHP-B30016.38±0.32cd71.11±0.41abc1.96±0.00a4.17±0.26b HHP-B50015.55±0.60de66.17±4.92de1.97±0.01a3.61±0.06e
2.5 不同加工方式对热带海参水分状态的影响
低场核磁共振技术通过捕捉T2横向弛豫信号,可有效监测热带海参制品内部水分状态的变化规律,进而反映持水力的强弱[28]。因此,弛豫时间越短,水分子和底物的结合越强;同时,较长的弛豫时间反映出水分子具有更大的自由度。据此,T21为结合水(0~10 ms),T 2 2为不易流动水(1 0 ~1 0 0 m s),T 2 3为自由水(>100 ms)[29]。如图3A所示,经过加工的热带海参水分信号峰主要位于100~1 000 ms,水煮时间的变化未使弛豫时间发生改变;先水煮后HHP的热带海参弛豫时间相比于B30有所延长;而先HHP后水煮的热带海参弛豫时间缩短。
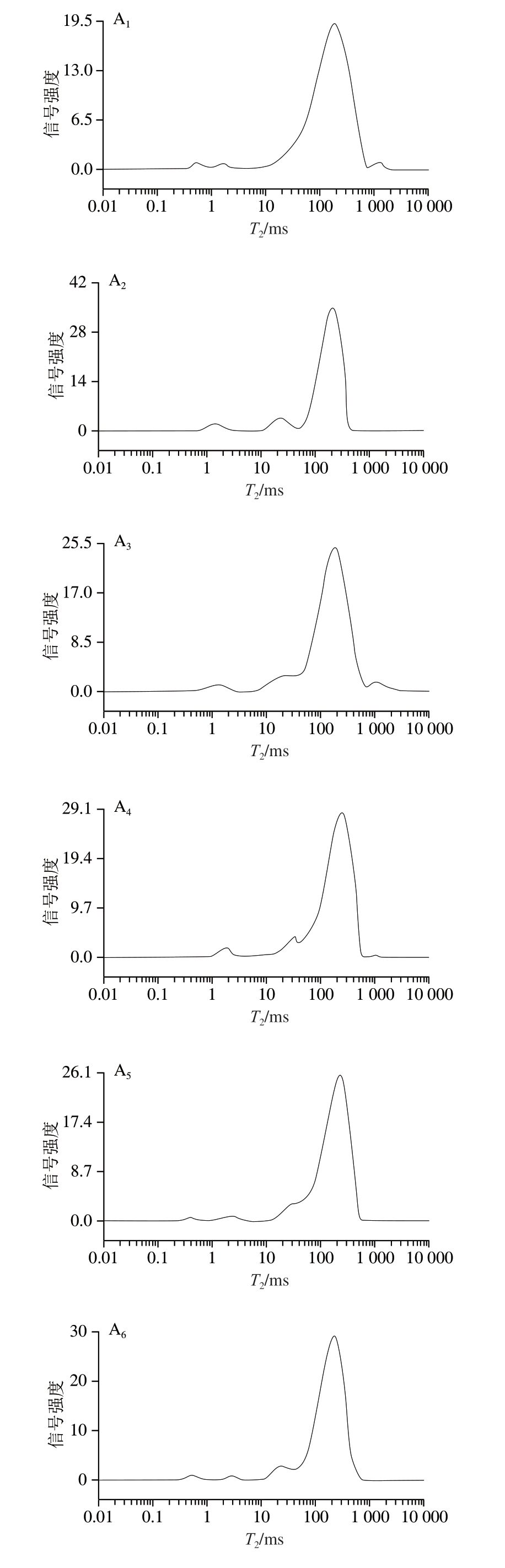
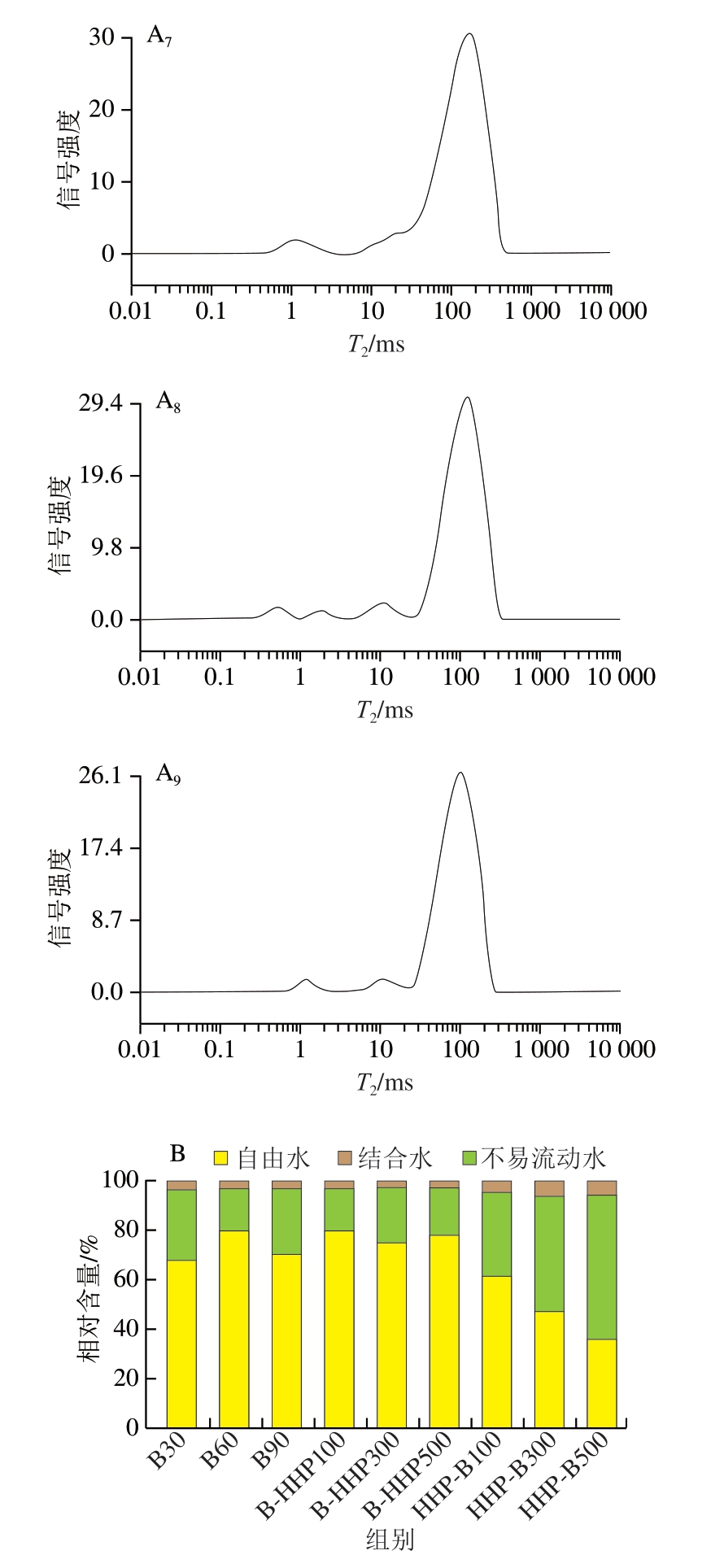
图3 不同加工方式对热带海参中各状态水分的T2(A)和相对含量(B)的影响
Fig.3 Effect of processing sequences on the T2 (A) and relative content (B) of each water state in tropical sea cucumbers
A1.B30;A2.B60;A3.B90;A4.B-HHP100;A5.B-HHP300;A6.B-HHP500;A7.HHP-B100;A8.HHP-B300;A9.HHP-B500。
图3B反映了不同加工方式的热带海参中各状态水分的峰面积占比情况,其中B30不易流动水相对含量约为28%,B60和B90的不易流动水相对含量减少,自由水相对含量增加,可能是由于高温处理在一定程度上破坏了蛋白质之间的交联性,导致蛋白网络结构的部分断裂,进而使部分水分从蛋白网络结构的内部转移到外部,造成不易流动水向自由水迁移[30]。先水煮后HHP的热带海参自由水相对含量增加,不易流动水相对含量减少,其原因可能是先进行热处理破坏了蛋白的交联性,使蛋白结构无法逆转,之后进行的HHP使热带海参肌肉组织结构进一步被破坏,导致样品组织中的不易流动水向自由水转变[30-31]。而先HHP后水煮的热带海参随着压力的增加,不易流动水和结合水的相对含量均增加,可能是由于先HHP后水煮处理诱导热带海参蛋白展开,疏水相互作用增强,使蛋白质与水结合更稳定[32],这与持水率结果一致。
2.6 不同加工方式对热带海参微观结构的影响
海参经过热处理后,会使束状纤维发生热收缩、卷曲、解聚,纤维表面变粗,纤维间间隙增大[33]。如图4所示,B30组的胶原纤维排列较紧密、有序,纤维表面较光滑,具有一定的方向性,有少量缝隙;而B60和B90组海参体壁组织结构发生明显变化,体壁胶原纤维发生解聚、变粗,纤维间间隙增大,缝隙变大、变多。在HHP过程中,由于蛋白质体积缩小,形成立体结构的各种化学键切断或重新形成,破坏了原有的立体结构,蛋白质发生变性,导致结构紧密,胶原纤维之间的空隙因受到压力作用而变小,同时肌肉纤维发生聚集[12]。B-HHP组中,300 MPa处理组的纤维表面更紧密,其次为500 MPa处理组,最后为100 MPa处理组;HHP-B组随着压力的增加,热带海参胶原纤维排列越来越紧密,纤维表面开始逐渐变粗糙,缝隙逐渐变小、变少。先HHP后水煮的热带海参比先水煮后HHP热带海参的胶原纤维排列更加紧密,缝隙也更小,其原因可能是先进行水煮处理的海参,其蛋白的交联性被破坏,蛋白结构无法逆转,再进行超高压处理作用效果不明显[30-31]。

图4 不同加工方式的热带海参扫描电子显微镜观察结果(×5 000)
Fig.4 Scanning electron microscope images of tropical sea cucumbers subjected to different processing sequences (× 5 000)
A.B30;B.B60;C.B90;D.B-HHP100;E.B-HHP300;F.B-HHP500;G.HHP-B100;H.HHP-B300;I.HHP-B500。
2.7 SDS-PAGE分析
如图5所示,海参主要有3 个条带(卵黄蛋白、肌动蛋白、未鉴定低分子质量蛋白),分子质量分别为270、44、29 kDa。条带II是海参中常见的结构蛋白,即肌动蛋白[18,34]。B30组的270 kDa条带较深,B90组的3 个蛋白条带出现明显减少或几乎消失,说明经长时间的热处理会导致海参体壁组织结构变性甚至丧失,蛋白质发生明显降解;除270 kDa条带外,与B30组相比,其余蛋白条带均加深,说明卵黄蛋白在经过HHP后出现明显降解。其中先水煮后HHP和HHP-B300组热带海参的29 kDa条带明显加深,说明HHP使热带海参卵黄蛋白和肌动蛋白发生降解,且降解程度与压力大小相关。
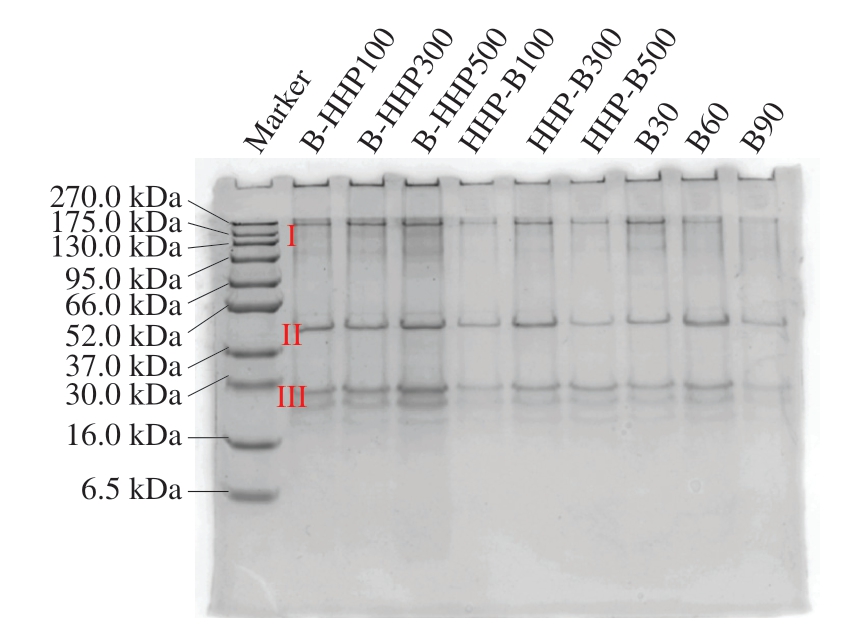
图5 不同加工方式热带海参的SDS-PAGE图
Fig.5 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis patterns of tropical sea cucumbers subjected to different processing sequences
I.卵黄蛋白;II.肌动蛋白;III.未鉴定低分子质量蛋白。
2.8 不同加工方式热带海参的荧光光谱分析
荧光光谱可用于监测蛋白质的三级结构,蛋白质结构的扭曲会导致一些氨基酸的荧光作用发生相应变化,如疏水性氨基酸及芳香族氨基酸残基均具有荧光性[35]。如图6所示,随着水煮时间延长,热带海参荧光强度呈现先增加后降低的趋势。先HHP后水煮的热带海参蛋白随着压力增加,其荧光强度随之增加,这是由于压力的增加使蛋白分子内部疏水区被破坏,芳香族疏水性基团逐渐暴露,导致荧光强度升高[36]。先水煮后HHP的热带海参蛋白随着压力增加,其荧光强度降低,其原因可能是这种加工方式导致蛋白质发生去折叠和聚集,暴露出的Trp残基等发色基团导致荧光强度降低[37]。
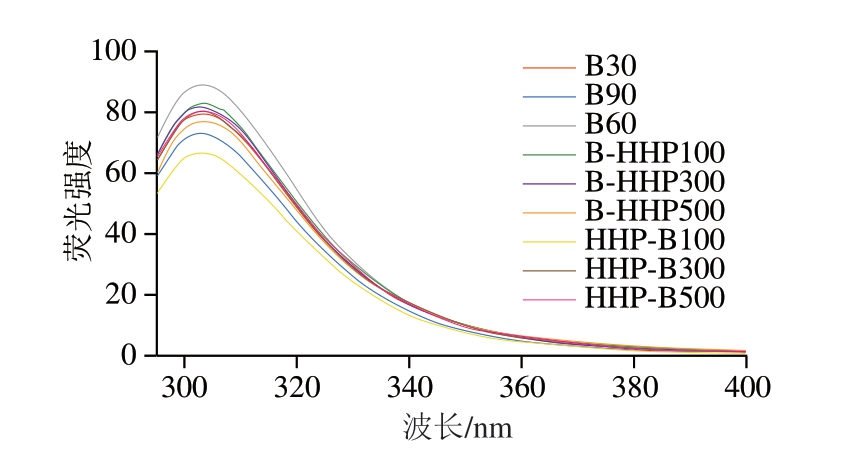
图6 不同加工方式的热带海参蛋白荧光光谱
Fig.6 Fluorescence spectra of proteins in tropical sea cucumbers subjected to different processing sequences
2.9 不同加工方式热带海参的傅里叶变换红外光谱分析
傅立叶变换红外光谱常被用于分析蛋白质中氨基酸基团变化情况,是探究蛋白质和多肽二级结构变化的重要手段[36]。如图7所示,蛋白质在3 464、2 920、2 850、1 660、1 469、1 220 cm-1附近存在明显吸收峰,其中3 464 cm-1附近的吸收峰是酰胺A带中N—H的伸缩振动;2 920、2 850 cm-1附近的吸收峰是酰胺B带中与—CH3对称和反对称的伸缩振动;1 660 cm-1附近的吸收峰是酰胺I带的C=O伸缩振动;1 496 cm-1附近的吸收峰是酰胺II带中N—H的弯曲振动;1 220 cm-1附近的吸收峰是酰胺III带中C—N伸缩振动[38]。
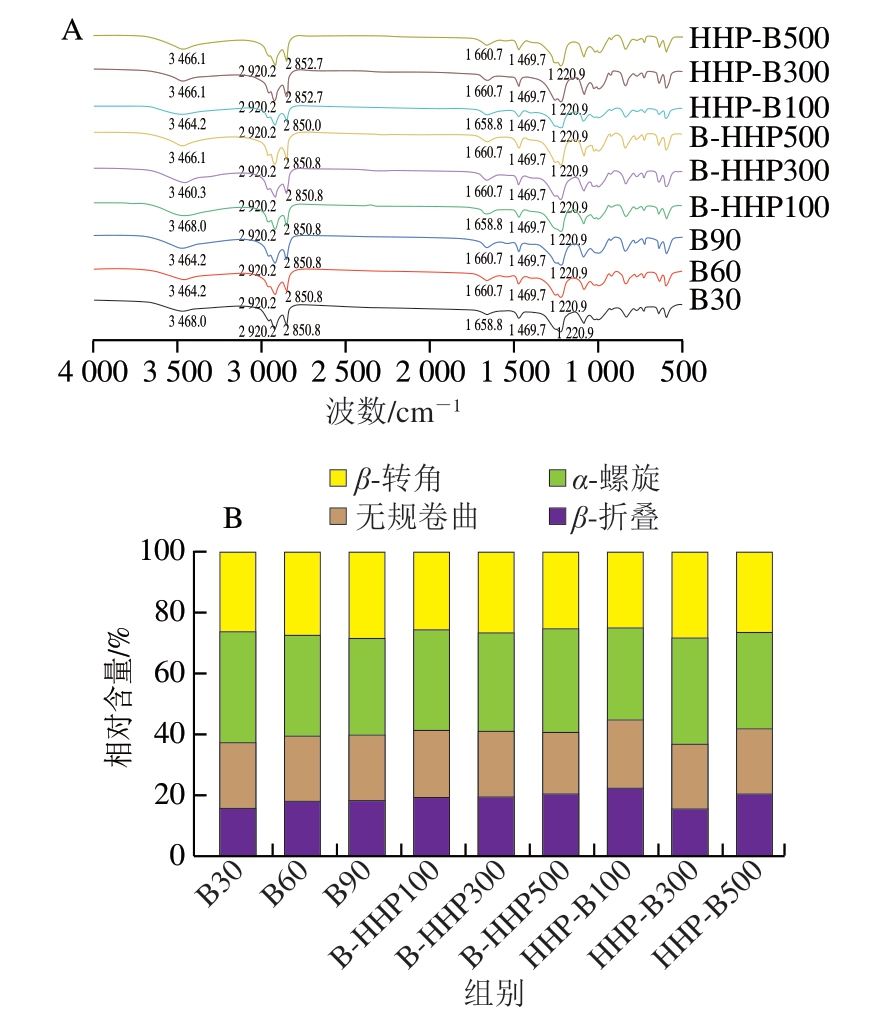
图7 不同加工方式的热带海参蛋白傅里叶变换红外图谱(A)和二级结构相对含量(B)
Fig.7 Fourier transform infrared spectra (A) and relative contents of secondary structures (B) of proteins in tropical sea cucumbers subjected to different processing sequences
酰胺I带(1 600~1 700 cm-1)可用于分析蛋白质二级结构的变化,通常认定1 600~1 640 cm-1波数范围表征β-折叠;1 640~1 650 cm-1波数范围表征无规卷曲;1 650~1 660 cm-1波数范围表征α-螺旋;1 660~1 695 cm-1波数范围表征β-转角。如图7B所示,随着加热时间的延长,β-折叠和β-转角相对含量增加,α-螺旋相对含量减少;与B30相比,经HHP的样品β-折叠相对含量均增加,α-螺旋相对含量均减少。这与孙良格等[39]研究结果一致,HHP降低了肌原纤维蛋白结构中α-螺旋的占比,提高了β-折叠的占比,其原因可能是HHP会破坏第n个氨基酸残基的酰基氮与多肽链C端方向的第(n+4)个氨基酸残基的羰基碳之间形成的氢键,同时相邻肽链主链的N—H和C=O之间形成了有规律的氢键,使α-螺旋结构伸展为β-折叠结构,导致α-螺旋相对含量减少,β-折叠相对含量增加[40]。先水煮后HHP样品随压力增加,β-折叠相对含量增加,α-螺旋相对含量呈先减少后增加趋势;先HHP后水煮的样品随压力增加,β-折叠相对含量先减少后增加,α-螺旋相对含量先增加后减少。相较于B30,B-HHP300、HHP-B300、HHP-B500的β-转角相对含量增加,说明更多的多肽链形成了稳定的环状结构,多肽链的稳定性得到提高。与B30相比,B-HHP100、HHP-B100的无规卷曲相对含量增加,B-HHP300、B-HHP500、HHP-B300、HHP-B500的无规卷曲相对含量减少,但差异不明显,无序松散肽链并没有发生较大的变化。因此不同HHP与热处理顺序使热带海参的蛋白二级结构发生了比较明显的变化,但变性程度并不高。
3 结 论
不同压力的HHP与热处理加工会改变热带海参的水分状态、肌原纤维结构和蛋白的二级结构等,从而对热带海参的口感、营养成分及外观产生影响。经HHP处理的热带海参质量损失率增加,水分含量减少。HHP热带海参蛋白含量基本大于B30,总糖含量基本小于B30。在2 组不同处理顺序的样品中,先水煮后HHP的热带海参蛋白质和水分含量较高,而先HHP后水煮样品总糖含量和质量损失率较高。先HHP后水煮样品的硬度、黏度和咀嚼性等均小于B30组,而HHP-B300、HHP-500样品的硬度、黏度和咀嚼性均大于B30,与B60相似。HHP处理使肌原纤维更加紧密,粗糙孔隙变小,并使蛋白二级结构中的α-螺旋相对含量均减少,β-折叠相对含量均增加。先HHP后水煮的样品中的水分由自由水向不易流动水和结合水移动,其疏水性降低,持水率增加;先水煮后HHP的样品中的水分由不易流动水向自由水移动,疏水性提高,持水率下降。先HHP后水煮的热带海参营养品质及特性更好,其肉质结构更紧密,咀嚼性更好。
[1] ZHANG J, LIU X, WANG Y K, et al.Transcriptome and metabolome analyses reveal gender-specific expression genes in sea cucumber(Holothuria leucospilota)[J].Comparative Biochemistry and Physiology, 2023, 47: 101112.DOI:10.1016/j.cbd.2023.101117.
[2] 吴可, 李萌, 李莹, 等.海参贮藏保鲜机理及保鲜技术研究进展[J].肉类研究, 2023, 37(2): 46-53.DOI:10.7506/rlyj1001-8123-20221215-157.
[3] 肖同杰, 陈廿虹, 张翠侠, 等.南海产玉足海参的营养成分分析及评价[J].广州化工, 2022, 50(17): 102-104.DOI:10.3969/j.issn.1001-9677.2022.17.031.
[4] RU R Z, GUO Y Z, MAO J X, et al.Cancer cell inhibiting sea cucumber (Holothuria leucospilota) protein as a novel anti-cancer drug[J].Nutrients, 2022, 14(4): 786.DOI:10.3390/nu14040786.
[5] CAI L, WU S W, JIA C G, et al.Active peptides with hypoglycemic effect obtained from hemp (Cannabis sativa L.) protein through identification, molecular docking, and virtual screening[J].Food Chemistry, 2023, 429: 136912.DOI:10.1016/j.foodchem.2023.136912.
[6] ZHAO F Q, LIU Q B, CAO J, et al.A sea cucumber (Holothuria leucospilota) polysaccharide improves the gut microbiome to alleviate the symptoms of type 2 diabetes mellitus in Goto-Kakizaki rats[J].Food and Chemical Toxicology, 2020, 135: 110886.DOI:10.1016/j.fct.2019.110886.
[7] WOLFE K, BYRNE M.Overview of the Great Barrier Reef sea cucumber fishery with focus on vulnerable and endangered species[J].Biological Conservation, 2022, 266: 109451.DOI:10.1016/j.biocon.2022.109451.
[8] 唐亮.即食海参贮藏期间品质变化及货架期预测[D].大连: 大连工业大学, 2014: 1-4.
[9] 杜美玲, 陈忻, 欧阳永中, 等.海参营养成分及加工技术的研究进展[J].现代食品, 2020, 26(20): 31-32; 40.DOI:10.16736/j.cnki.cn41-1434/ts.2020.20.010.
[10] 张根生, 孙维宝, 岳晓霞, 等.超高压在冷藏肉类产品贮藏保鲜中的应用研究进展[J].肉类研究, 2020, 34(11): 84-88.DOI:10.7506/yj1001-8123-20201105-260.
[11] 朱松明, 苏光明, 王春芳, 等.水产品超高压加工技术研究与应用[J].农业机械学报, 2014, 45(1): 168-177.DOI:10.6041/j.issn.1000-1298.2014.01.027.
[12] 郑明静, 周美龄, 陈妮, 等.超高压处理对海参组织结构及品质影响的研究[J].食品工业科技, 2016, 37(4): 187-191; 210.DOI:10.13386/j.issn1002-0306.2016.04.029.
[13] 郝梦甄, 胡志和.超高压和盐渍泡发处理海参的质构和功能成分比较研究[J].食品科学, 2013, 34(5): 115-119.DOI:10.7506/spkx1002-6630-201305024.
[14] 侯虎, 陈铁军, 彭喆, 等.超高压处理对海参体壁凝胶稳定性及其劣化的影响[J].农业工程学报, 2014, 30(22): 316-322.DOI:10.3969/j.issn.1002-6819.2014.22.039.
[15] XIA Y J, LIU Z J, LI Z Y.Effects of high hydrostatic pressure treatment on physicochemical characteristics of sea cucumber[J].Journal of Food Science and Engineering, 2012, 2(4): 227.DOI:10.1007/s11947-021-02658-3.
[16] HOSSAIN A, YEO J, DAVE D, et al.Phenolic compounds and antioxidant capacity of sea cucumber (Cucumaria frondosa)processing discards as affected by high-pressure processing (HPP)[J].Antioxidants, 2022, 11(2): 337.DOI:10.3390/antiox11020337.
[17] 王义轩.海参加工、贮藏过程中品质变化及消化产物蛋白质组学研究[D].大连: 大连海洋大学, 2022: 8-19.DOI:10.27821/d.cnki.gdlhy.2022.000178.
[18] ZHANG Q, LIU R, GEIRSDÓTTIR M, et al.Thermal-induced autolysis enzymes inactivation, protein degradation and physical properties of sea cucumber, Cucumaria frondosa[J].Processes, 2022,10(5): 847.DOI:10.3390/pr10050847.
[19] 叶安妮.超高压处理不同水产品的品质变化及其机理研究[D].广州: 华南理工大学, 2019.DOI:10.27151/d.cnki.ghnlu.2019.002757.
[20] BI J R, LI Y, CHENG S S, et al.Changes in body wall of sea cucumber(Stichopus japonicus) during a two-step heating process assessed by rheology, LF-NMR, and texture profile analysis[J].Food Biophysics,2016, 11(3): 257-265.DOI:10.1007/s11483-016-9437-4.
[21] 孙梦, 冉佩灵, 黄业传, 等.超高压杀菌对低盐切片腊肉风味及理化性质的影响[J].食品工业科技, 2024, 45(2): 101-109.DOI:10.13386/j.issn1002-0306.2023040209.
[22] DASH K K, BALASUBRAMANIAM V M, KAMAT S.High pressure assisted osmotic dehydrated ginger slices[J].Journal of Food Engineering, 2019, 247: 19-29.DOI:10.1016/j.jfoodeng.2018.11.024.
[23] 邓记松.超高压处理海珍品保鲜实验研究[D].大连: 大连理工大学,2009: 59-60.
[24] TABILO-MUNIZAGA G, BARBOSA-CÁNOVAS G V.Ultra high pressure technology and its use in surimi manufacture: an overview[J].Food Science and Technology International, 2004, 10(4): 207-222.DOI:10.1177/1082013204045687.
[25] QIU C J, XIA W S, JIANG Q X.Pressure-induced changes of siliver carp (Hypophthalmichthys molitrix) myofbrillar protein structure[J].European Food Research Technology, 2014, 238(5): 753-761.DOI:10.1007/s00217-014-2155-6.
[26] LARREA-WACHTENDORFF D, TABILO-MUNIZAGA G,MORENO-OSORIO L, et al.Protein changes caused by high hydrostatic pressure (HHP): a study using differential scanning calorimetry (DSC) and Fourier transform infrared (FTIR)spectroscopy[J].Food Engineering Reviews, 2015, 7(2): 222-230.DOI:10.1007/s12393-015-9107-1.
[27] FAN X R, MA Y S, LI M, et al.Thermal treatments and their influence on physicochemical properties of sea cucumbers: a comprehensive review[J].International Journal of Food Science & Technology, 2022,57(9): 5790-5800.DOI:10.1111/ijfs.15922.
[28] 王恒鹏, 王引兰, 姜松松, 等.不同干燥方式下调理猪肉干品质变化及其机制[J].农业工程学报, 2021, 37(24): 317-326.DOI:10.11975/j.issn.1002-6819.2021.24.035.
[29] WANG J Y, LI Z Y, ZHENG B D, et al.Effect of ultra-high pressure on the structure and gelling properties of low salt golden threadfin bream myosin[J].LWT-Food Science and Technology, 2019, 100: 381-390.DOI:10.1016/j.lwt.2018.10.053.
[30] PENG Z, HOU H, BU L, et al.Nonenzymatic softening mechanism of collagen gel of sea cucumber (Apostichopus japonicus)[J].Journal of Food Processing and Preservation, 2015, 39(6): 2322-2331.DOI:10.1111/jfpp.12479.
[31] 赵立柱, 魏占楠, 张燕, 等.不同压力熟制对牦牛平滑肌质构和微观结构的影响[J].食品研究与开发, 2023, 44(19): 28-33.DOI:10.12161/j.issn.1005-6521.2023.19.004.
[32] 邹怡茜, 陈海强, 潘卓官, 等.超高压耦合热处理过程对鳙鱼鱼糜凝胶特性及水分迁移的影响[J].食品工业科技, 2023, 44(23): 70-79.DOI:10.13386/j.issn1002-0306.2023020083.
[33] YU X L, WEI S B, ZHAO M Y, et al.Effect of heat-treatment times on the microstructure and water absorption properties of sea cucumber[J].International Journal of Food Science & Technology, 2023, 58(2): 701-711.DOI:10.1111/ijfs.16220.
[34] QI H, FU H, DONG X F, et al.Apoptosis induction is involved in UVA-induced autolysis in sea cucumber Stichopus japonicus[J].Journal of Photochemistry and Photobiology B: Biology, 2016, 158:130-135.DOI:10.1016/j.jphotobiol.2016.02.034.
[35] JIA J Q, MA H L, ZHAO W R, et al.The use of ultrasound for enzymatic preparation of ACE-inhibitory peptides from wheat germ protein[J].Food Chemistry, 2010, 119(1): 336-342.DOI:10.1016/j.foodchem.2009.06.036.
[36] 刘容旭, 王语聪, 刘金阳, 等.超高压辅助酶解对汉麻分离蛋白结构和抗氧化活性的影响[J].食品工业科技, 2024, 45(4): 24-32.DOI:10.13386/j.issn1002-0306.2023020122.
[37] LIU Z F, GUO Z X, WU D, et al.High-pressure homogenization influences the functional properties of protein from oyster (Crassostrea gigas)[J].LWT-Food Science and Technology, 2021, 151: 112107.DOI:10.1016/j.lwt.2021.112107.
[38] GOUDA M, ZU L L, MA S M, et al.Influence of bio-active terpenes on the characteristics and functional properties of egg yolk[J].Food Hydrocolloids, 2018, 80: 222-230.DOI:10.1016/j.foodhyd.2018.02.009.
[39] 孙良格, 徐佳美, 吕经秀, 等.肌肽联合超高压对黑鱼肉脂质氧化及肌原纤维蛋白的影响[J].食品工业科技, 2022, 43(4): 114-122.DOI:10.13386/j.issn1002-0306.2021060258.
[40] 常江, 巩雪, 孙智慧.超高压处理对扇贝界面闭壳肌结构的影响[J].中国食品学报, 2022, 22(8): 136-144.DOI:10.16429/j.1009-7848.2022.08.015.