鱼糜制品,如鱼肠、鱼丸、蟹棒和鱼饼等,因其高蛋白和低脂肪含量而受到消费者的喜爱[1]。肌原纤维蛋白是一种盐溶性蛋白,它是影响鱼糜制品品质的关键因素。在鱼糜制品的加工过程中,通常需要加入盐(质量分数2%~3%)以溶解肌原纤维蛋白,以便在煮制过程中增加水合作用并获得具有理想质地的鱼糜凝胶[2]。然而,过量摄入盐会增加患高血压和心血管疾病的风险。但是,减少鱼糜的盐含量又会降低其凝胶性能,肌原纤维蛋白在低盐条件下不能完全溶解和展开[3]。目前,食品添加剂的加入[4]、物理场辅助加工[5]等方法虽已被证明能够改善低盐鱼糜凝胶的特性,但消费者仍然更倾向于新鲜无添加、少处理的食品。
动物宰后,肌肉发生一系列的生化变化,ATP降解、pH值降低、Ca2+浓度升高、蛋白质亚基结构变化并形成肌动球蛋白复合体,僵直随之发生[6]。Song等[7]发现,在僵直前添加盐的碎鸡胸肉的最终pH值、蛋白质溶解度和最终产量均高于僵直后添加盐的碎鸡胸肉。蛋白质溶解度是影响肉制品持水性(water holding capacity,WHC)和质地最重要的工艺特性之一[8-9]。而肌原纤维蛋白的凝胶化性质同时受离子强度、pH值和加热模式等因素的影响[10]。已有研究[11-12]表明,僵直前添加盐能够提升肉的品质。Hamm[13]将僵直前肌肉优良的加工性能归因于更松弛的微观结构、更强的肌原纤维水合作用和更高的溶解度。
在鱼糜的生产中,经常使用活鱼或非常新鲜的鱼。吕顺等[14]针对鲢鱼新鲜度对鱼糜凝胶品质的影响进行研究,发现采用死后不同时间的鲢鱼肉制作的鱼糜凝胶,其凝胶强度、保水性和白度均有显著差异,其中以新鲜鲢鱼为原料制作的鱼糜凝胶的凝胶强度最高。而向僵直前肌肉添加低含量盐所制得的鱼糜凝胶是否能达到高盐效果仍需进一步探究。因此,本研究选择鲢鱼作为实验对象,将不同含量的盐(质量分数1%、2%和3%)分别添加到僵直前和僵直后的肌肉中并制成鱼糜凝胶,通过观察微观结构、测定凝胶强度、质构特性和流变学特性等指标评估鱼糜的凝胶特性。
1 材料与方法
1.1 材料与试剂
新鲜鲢鱼购于镇江市京口区农贸市场,平均体长(49.3±1.5)cm,体质量(1.79±0.20)kg。
食盐 镇江市京口区吉麦隆超市;尿素、NaCl、β-巯基乙醇、2.5%戊二醛、叔丁醇、乙醇(均为分析纯) 国药集团化学试剂(上海)有限公司。
1.2 仪器与设备
S18-LA170碎肉机 九阳股份有限公司;CR-400色差仪 日本柯尼卡美能达株式会社;T18均质机 德国IKA集团;TGL-16gR高速台式冷冻离心机 上海安亭科学仪器厂;UV1601紫外-可见分光光度计 北京瑞利分析仪器有限公司;NMI20-060VJS-I低场核磁共振(lowfield nuclear magnetic resonance,LF-NMR)食品分析仪苏州纽迈分析仪器股份有限公司;TA.XT Plus食品物性测试仪 英国Stable Micro Systems公司;DHR-1旋转流变仪沃特世科技(上海)有限公司;MIRA场发射扫描电子显微镜 泰思肯贸易(上海)有限公司。
1.3 方法
1.3.1 样品处理
新鲜鲢鱼在15 min内运到实验室。到达实验室后,在水箱中静置20 min,随后将其敲晕并在10 min内去头、去皮、去内脏,冲洗并收集鱼肉中的白肉,将白肉分成2 组:僵直前组:将鱼肉切成约2 cm×2 cm的肉块,用液氮快速冷冻(-196 ℃);僵直后组:僵直前组在4 ℃冷藏24 h后获得。2 组样品均在-80 ℃下保存,待测。
1.3.2 凝胶制备
将鱼肉置于碎肉机中冰浴空斩1 min,调节水分质量分数至80%并添加不同质量分数的食盐(1%、2%和3%),继续斩拌4 min得到鱼糜。将鱼糜填入直径38 mm的塑料肠衣中,二段式加热(40 ℃水浴加热60 min,90 ℃水浴加热30 min)形成凝胶,冰水快速冷却30 min后置于4 ℃过夜。
1.3.3 凝胶强度测定
参照宁云霞等[15]的方法进行凝胶强度的测定。将凝胶切成高度为20 mm的圆柱,在食品物性测试仪上选用P/5S球形探头测定鱼糜凝胶的破断力和破断距离。参数设定:测前速率1.00 mm/s;测试速率1.00 mm/s;测后速率1.00 mm/s;穿刺距离15 mm;触发力5.0 g。凝胶强度按式(1)计算:
1.3.4 质构特性测定
参照谢航涛等[16]的方法并稍加修改。将凝胶切成高度为20 mm的圆柱,并采用食品物性测试仪的质地剖面分析模式进行质构测定,采用圆柱形探头P/50。参数设定:测前速率1.00 mm/s;测试速率1.00 mm/s;测后速率1.00 mm/s;触发力5.0 g。每个样品经历2 次压缩,压缩程度40%,2 次压缩之间的停留时间5 s。
1.3.5 微观结构观察
参照Htwe等[17]的方法,通过扫描电子显微镜观察鱼糜凝胶的微观结构。将凝胶切成3 mm×3 mm×1 mm的块状,用2.5%戊二醛在4 ℃固定3 h,蒸馏水冲洗3 次,每次10 min。在梯度乙醇溶液(30%、50%、70%、90%、95%,V/V)中脱水,每个梯度脱水10 min。在无水乙醇中脱水3 次,每次15 min。脱水凝胶样品在叔丁醇-乙醇(1∶1,V/V)中置换15 min。随后,用纯叔丁醇置换3 次,每次15 min。将置换的样品于4 ℃条件下置于纯叔丁醇中,直至结晶,随后转移至真空冷冻干燥机中冻干48 h。将干燥后的样品固定在铝合金样品台上,使用离子溅射仪镀金。使用扫描电子显微镜在10 keV下,放大约20 000 倍观察样品。
1.3.6 流变学特性测定
参照Chen Huizhi等[18]的方法,采用流变仪测定鱼糜凝胶的流变学特性。选用20 mm平板夹具,测量间隙1 mm。角频率范围0.1~100 rad/s,应变0.5%(在线性黏弹性区域内),在25 ℃下进行测定,记录储能模量(G’)和损耗模量(G”)变化。
1.3.7 分子间化学作用力测定
参照He Ni等[19]的方法并稍加修改,测定分子间化学作用力。称取2.0 g鱼糜凝胶样品,分别加入10 mL S1(0.05 mol/L NaCl)、S2(0.6 mol/L NaCl)、S3(0.6 mol/L NaCl+1.5 mol/L尿素)、S4(0.6 mol/L NaCl+8 mol/L尿素)和S5(0.6 mol/L NaCl+8 mol/L尿素+0.5 mol/L β-巯基乙醇),10 000 r/min下均质1 min。均相溶液在4 ℃过夜反应,随后在4 ℃、10 000 r/min条件下离心15 min。采用考马斯亮蓝法测定上清液中的蛋白质量浓度,结果以每升溶液中所含的溶出蛋白质量浓度表示(g/L)。蛋白质凝胶在不同溶剂(S1、S2、S3、S4和S5)中的溶出量反映了凝胶结构中不同的分子相互作用(非特异性交联、离子键、氢键、疏水相互作用和二硫键)。
1.3.8 白度测定
采用色差仪测定凝胶色度[20],记录亮度值(L*)、红度值(a*)和黄度值(b*)。白度按式(2)计算:
1.3.9 pH值测定
称取2.0 g鱼糜凝胶,加入10 mL蒸馏水,8 400 r/min均质1 min,测定各样品的pH值。
1.3.10 WHC测定
参照张钰嘉等[21]的方法并稍加修改。称取(3.00±0.50)g凝胶,记录初始质量(m1/g),用3 层滤纸将其包裹并塞入50 mL离心管中,在4 ℃、8 000 r/min下离心15 min,准确记录离心后的样品质量(m2/g),WHC按式(3)计算:
1.3.11 LF-NMR分析
参照Wang Xuejiao等[22]的方法并采用CPMG(Carr-Purcell-Meiboom-Gill)脉冲序列进行凝胶横向弛豫时间(T2)的测定。将凝胶切成高度为20 mm的圆柱体,装入直径为40 mm的核磁管中。参数设定:采样频率200 kHz,共振中心主频率21 MHz,激发脉冲宽度7.52 μs,回波时间1 500 ms,扫描次数4 次。通过累加采样后反演得到T2图谱,并累计积分图谱中各峰面积,峰面积表示各状态水分的相对含量。
1.4 数据处理
所有指标平行测定3 次及以上,结果以平均值±标准差表示。采用IBM SPSS Statistics 26软件进行单因素方差分析,采用Duncan多重极差检验确定不同处理组间的显著差异,以P<0.05为差异有统计学意义。采用Origin 2021软件进行作图。
2 结果与分析
2.1 僵直前后不同盐含量白鲢鱼糜凝胶的凝胶强度和质构特性分析
如表1所示,盐含量的增加提高了鱼糜凝胶强度,而相较于僵直前,僵直后的鱼肉制备的鱼糜凝胶强度降低。僵直前肌肉制成的鱼糜凝胶强度从1%盐含量的1.54 kg·mm增加到3%盐含量的2.57 kg·mm。1%盐含量的鱼糜凝胶强度从僵直前的1.54 kg·mm降低到僵直后的1.23 kg·mm。而僵直后-2% NaCl组与僵直前-1% NaCl组的凝胶强度水平相当。盐含量的增加促进盐溶性肌原纤维蛋白的溶出[23],使得肌球蛋白分子在加热过程中充分展开和聚集,形成致密的凝胶网络结构,增加其凝胶强度。Offer等[24]发现,在僵直过程中肌动球蛋白键的形成可能会限制肌原纤维蛋白的溶出,阻碍蛋白质提取。僵直后肌肉的蛋白质溶解度较低,肌球蛋白受热展开程度不足,进而导致凝胶强度较弱。
表1 僵直前后不同盐含量对白鲢鱼糜凝胶强度和质构特性的影响
Table 1 Effects of different salt contents on gel strength and texture properties of surimi gels made from pre- or post-rigor silver carp muscle
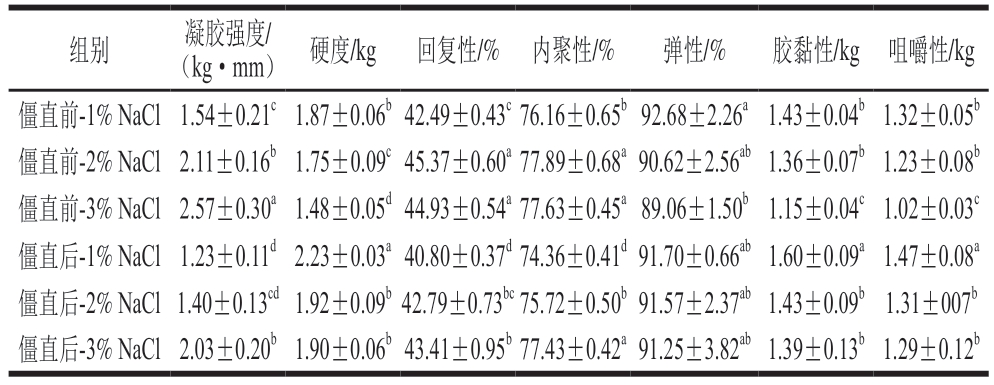
注:同列小写字母不同表示差异显著(P<0.05)。表2、3同。
组别凝胶强度/(kg·mm) 硬度/kg回复性/% 内聚性/%弹性/%胶黏性/kg 咀嚼性/kg僵直前-1% NaCl 1.54±0.21c 1.87±0.06b 42.49±0.43c 76.16±0.65b 92.68±2.26a 1.43±0.04b 1.32±0.05b僵直前-2% NaCl 2.11±0.16b 1.75±0.09c 45.37±0.60a 77.89±0.68a 90.62±2.56ab 1.36±0.07b 1.23±0.08b僵直前-3% NaCl 2.57±0.30a 1.48±0.05d 44.93±0.54a 77.63±0.45a 89.06±1.50b 1.15±0.04c 1.02±0.03c僵直后-1% NaCl 1.23±0.11d 2.23±0.03a 40.80±0.37d 74.36±0.41d 91.70±0.66ab 1.60±0.09a 1.47±0.08a僵直后-2% NaCl 1.40±0.13cd 1.92±0.09b 42.79±0.73bc 75.72±0.50b 91.57±2.37ab 1.43±0.09b 1.31±007b僵直后-3% NaCl 2.03±0.20b 1.90±0.06b 43.41±0.95b 77.43±0.42a 91.25±3.82ab 1.39±0.13b 1.29±0.12b
不同盐含量对僵直前后鱼糜凝胶的硬度、回复性、内聚性、弹性、胶黏性和咀嚼性等质构特性也有显著影响(P<0.05)。与僵直前肌肉制成的鱼糜凝胶相比,虽然僵直后肌肉制成的鱼糜凝胶硬度有所增加,但其回复性和内聚性均降低,表明僵直后肌肉制成的鱼糜凝胶质构特性较差,而其硬度的增加可能归因于僵直后的肌原纤维蛋白溶解性差,又由于水分流失及聚集速率过快,蛋白聚集体未能充分水合便堆积。随着盐含量的增加,虽然鱼糜凝胶的硬度有所降低,但其回复性和内聚性增加。这可能是因为盐含量的增加提高了肌原纤维蛋白的溶解度并促进其展开,增加了肌原纤维蛋白的水合作用,改善了鱼糜凝胶的回复性和内聚性。僵直前肌肉制成的鱼糜凝胶的回复性从1%盐含量的42.49%增加到3%盐含量的44.93%。1%盐含量制成的鱼糜凝胶回复性从僵直前的42.49%降低到僵直后的40.80%。而僵直后-2% NaCl组与僵直前-1% NaCl组鱼糜凝胶的回复性水平相当。Yan Dan等[25]的研究结果也表明,添加质量分数3% NaCl鱼糜凝胶的强度、硬度、黏性、回复性、内聚性和咀嚼性均显著大于添加0.3% NaCl的鱼糜凝胶,并且在3% NaCl添加量下,僵直前肌肉制成的鱼糜凝胶的凝胶强度、硬度、回复性和咀嚼性均高于僵直后组。
2.2 僵直前后不同盐含量白鲢鱼糜凝胶的微观结构分析
如图1所示,1%盐含量的鱼糜凝胶中存在很多聚集体,这可能是未溶解的肌原纤维蛋白形成的聚集体,也导致鱼糜凝胶硬度的增加(表1)。随着盐含量的提高,鱼糜凝胶的微观结构变得更加致密均匀,孔隙也更小。这是由于肌原纤维蛋白在凝胶形成过程中起关键作用,而肌原纤维蛋白是盐溶性蛋白。在低盐环境中,肌原纤维蛋白不能被完全溶解,因此在凝胶网络中形成比较粗糙的网络结构;随着盐含量的增加,致密的凝胶网络可能与肌原纤维蛋白的良好溶解和更多化学键的形成密切相关[10]。此外,相较于僵直后肌肉制成的鱼糜凝胶,僵直前肌肉制成的鱼糜凝胶聚集体更少,孔隙更小,网络结构也更致密,这也是其凝胶强度较大、质构特性较好的原因。Li Shaobo等[26]的研究结果也表明,与用僵直肌肉生产的凝胶相比,用僵直前肌肉生产的凝胶网络结构更加致密,但僵直后肌肉制得的凝胶又比僵直肌肉制得的凝胶结构更致密。结果表明,僵直对凝胶形成能力有负面影响,而僵直进程完成后在一定程度上又可以提高凝胶的形成能力。

图1 僵直前后不同盐含量对白鲢鱼糜凝胶微观结构的影响
Fig.1 Effects of different salt contents on the microstructure of surimi gels made from pre- or post-rigor silver carp muscle
A1.僵直前-1% NaCl;A2.僵直前-2% NaCl;A3.僵直前-3% NaCl;B1.僵直后-1% NaCl;B2.僵直后-2% NaCl;B3.僵直后-3% NaCl。
2.3 僵直前后不同盐含量白鲢鱼糜凝胶的流变学行为分析
如图2所示,所有样品的G’和G”表现出非常相似的趋势,并且在整个频率范围内,所有样品的G’始终高于G”,这表明凝胶特性对鱼糜凝胶网络结构的保持具有重要作用[27]。此外,僵直前鱼糜凝胶的G’高于僵直后;随着盐含量的增加,G’也随之增加。这一结果再次证实僵直前肌肉和高盐含量制备的鱼糜凝胶性能优于僵直后肌肉和低盐含量制备的鱼糜凝胶。
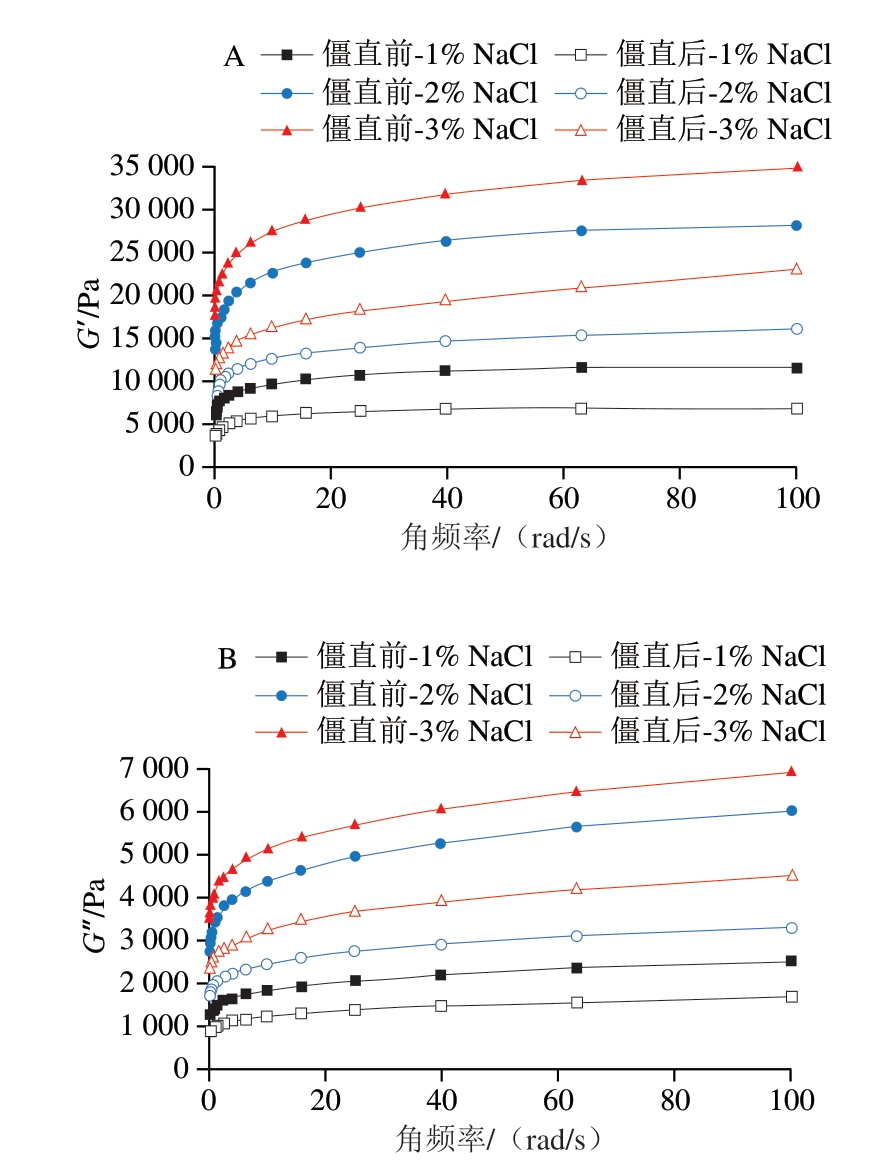
图2 僵直前后不同盐含量对白鲢鱼糜凝胶G’(A)和G”(B)的影响
Fig.2 Effects of different salt contents on the G’ (A) and G” (B)made from pre- or post-rigor silver carp muscle
2.4 僵直前后不同盐含量白鲢鱼糜凝胶的分子间相互作用分析
在凝胶化过程中,肌原纤维蛋白分子展开,功能基团暴露,通过肌原纤维蛋白分子内和分子间的结合形成三维网络[19]。在蛋白质凝胶化过程中形成了非特异性连接作用、离子键、氢键、疏水相互作用和二硫键。如图3所示,疏水相互作用和二硫键是促进鱼糜凝胶形成的最主要作用力。Du Zhiyin等[28]的研究也表明,冷藏过程中鱼糜凝胶蛋白质交联的非共价键主要作用力是疏水相互作用。僵直前肌肉中添加3% NaCl制成的鱼糜凝胶的疏水相互作用为12.48 g/L,显著高于其他组(P<0.05)。这可能是僵直前肌肉中添加3% NaCl制成的鱼糜凝胶强度高(表1)、凝胶网络结构致密而均匀(图1)的原因,由此可推测疏水相互作用与鱼糜凝胶强度呈正相关。
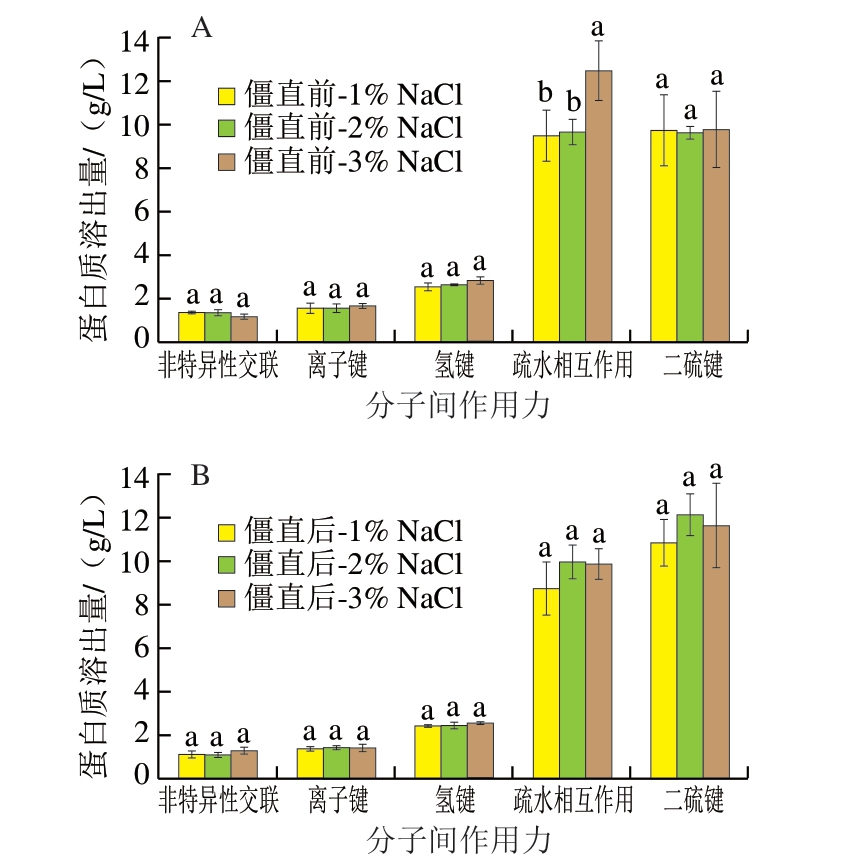
图3 不同盐含量对白鲢鱼糜凝胶分子间相互作用的影响
Fig.3 Effects of different salt contents on the intermolecular interaction of surimi gels made from silver carp muscle
小写字母不同表示组间差异显著(P<0.05)。
2.5 僵直前后不同盐含量白鲢鱼糜凝胶的色泽分析
如表2所示,不同盐含量对僵直前后鱼糜凝胶的色泽影响显著(P<0.05)。1%盐含量的鱼糜凝胶白度从僵直前的78.80增加到僵直后的81.62。僵直前肌肉添加1% NaCl制成的鱼糜凝胶白度、L*和a*均低于僵直后,而b*高于僵直后。这可以归因于肌肉在僵直过程中pH值下降,肌原纤维蛋白变性和自由水增加促进了光的散射和反射,进而表现为僵直后肌肉制得的鱼糜凝胶的L*和白度高于僵直前[29]。Ijaz等[30]也得到了类似的结论,正常和非典型DFD(dark, firm, and dry)牛肉从贮藏第1天到第3天的L*增加可能是由于酶解使蛋白质结构减弱,从而导致更多的光色散。而添加3% NaCl鱼糜凝胶的色差结果与添加1% NaCl的鱼糜凝胶相反。盐含量的增加降低了鱼糜凝胶的L*和白度,这可能是由于盐能够促进蛋白质和脂质氧化[31],降低肉制品的L*和白度。由此说明,僵硬状态和盐含量均能够影响肉制品的颜色(经历僵直过程的肌肉制成的肉制品白度有所提高,而盐含量增加则降低其白度)。肉的颜色通常与肌肉的WHC密切相关,WHC增加会吸收光而不反射表面的光,使肉色看起来更暗[8]。
表2 僵直前后不同盐含量对白鲢鱼糜凝胶色泽的影响
Table 2 Effects of different salt contents on the color of surimi gels made from pre- or post-rigor silver carp muscle
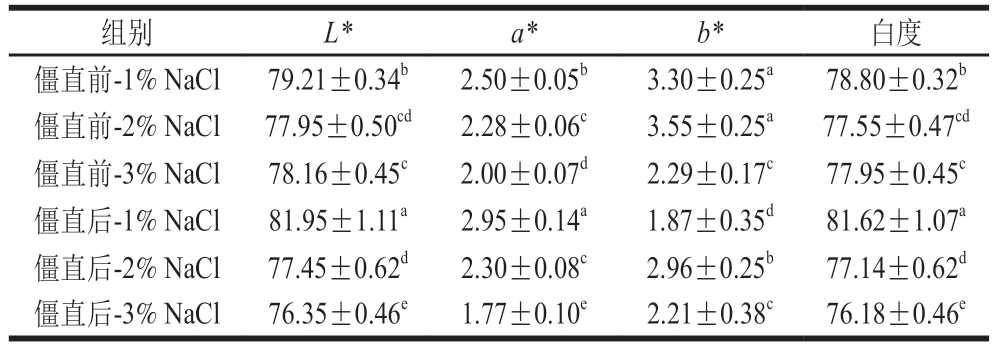
组别L*a*b*白度僵直前-1% NaCl79.21±0.34b2.50±0.05b3.30±0.25a78.80±0.32b僵直前-2% NaCl77.95±0.50cd2.28±0.06c3.55±0.25a77.55±0.47cd僵直前-3% NaCl78.16±0.45c2.00±0.07d2.29±0.17c77.95±0.45c僵直后-1% NaCl81.95±1.11a2.95±0.14a1.87±0.35d81.62±1.07a僵直后-2% NaCl77.45±0.62d2.30±0.08c2.96±0.25b77.14±0.62d僵直后-3% NaCl76.35±0.46e1.77±0.10e2.21±0.38c76.18±0.46e
2.6 僵直前后不同盐含量白鲢鱼糜凝胶的pH值和WHC分析
不同盐含量对僵直前后肌肉所制鱼糜凝胶pH值的影响没有明显规律(表3)。WHC的增加对肉制品有积极影响,能够提高肉品质量和销售价值。僵直前肌肉制成的鱼糜凝胶WHC从1%盐含量的76.97%增加到3%盐含量的85.25%。1%盐含量制成的鱼糜凝胶WHC从僵直前的76.97%降低到僵直后的73.99%。而僵直后-2% NaCl组与僵直前-1% NaCl组鱼糜凝胶的WHC水平相当。盐含量的增加提高了鱼糜凝胶的WHC,而僵直则降低了鱼糜凝胶的WHC,这可能是由于僵直前的肌肉具有较高的pH值和相对完整的组织结构,这是肉保持WHC的重要因素。这与Li Shaobo等[26]的报道相似,相较于僵直后,僵直前肌肉制成的肉糜蒸煮损失和离心损失均有所下降。此外,Blikra等[32]的研究表明,盐渍提高了鱼肉的WHC。
表3 僵直前后不同盐含量对白鲢鱼糜凝胶pH值、WHC、T2和T2峰面积比例的影响
Table 3 Effects of different salt contents on the pH, WHC, T2 relaxation time, and T2 peak area ratio of surimi gels made from pre- or post-rigor silver carp muscle
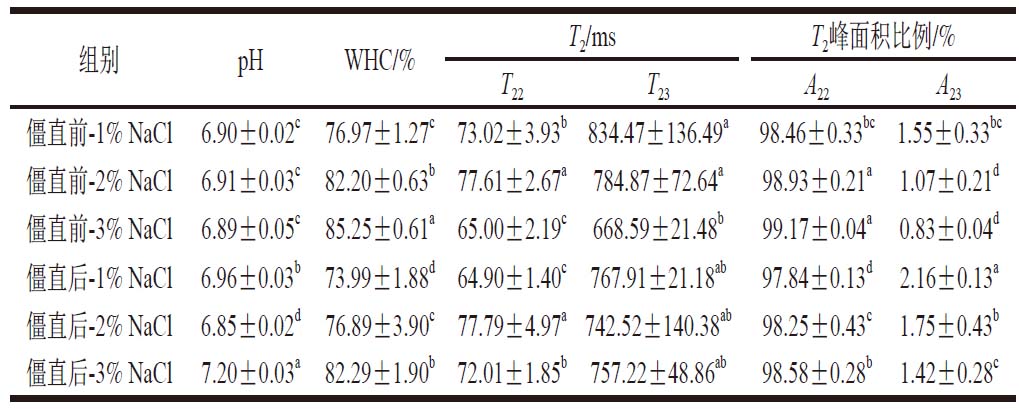
僵直前-1% NaCl 6.90±0.02c 76.97±1.27c 73.02±3.93b 834.47±136.49a 98.46±0.33bc 1.55±0.33bc僵直前-2% NaCl 6.91±0.03c 82.20±0.63b 77.61±2.67a 784.87±72.64a98.93±0.21a 1.07±0.21d僵直前-3% NaCl 6.89±0.05c 85.25±0.61a 65.00±2.19c 668.59±21.48b 99.17±0.04a 0.83±0.04d僵直后-1% NaCl 6.96±0.03b 73.99±1.88d 64.90±1.40c 767.91±21.18ab 97.84±0.13d 2.16±0.13a僵直后-2% NaCl 6.85±0.02d 76.89±3.90c 77.79±4.97a 742.52±140.38ab 98.25±0.43c 1.75±0.43b僵直后-3% NaCl 7.20±0.03a 82.29±1.90b 72.01±1.85b 757.22±48.86ab 98.58±0.28b 1.42±0.28c
2.7 僵直前后不同盐含量白鲢鱼糜凝胶的水分分布分析
通过LF-NMR在鱼糜凝胶中检测到2 组峰(表3、图4)。在弛豫时间10~100 ms范围内检测到峰T22(不易流动水),100~1 000 ms范围内检测到峰T23(自由水)。鱼糜凝胶中最主要的水分是不易流动水,其相对含量会影响WHC,这与Mi Hongbo等[33]的研究结果一致。僵直前肌肉制成的鱼糜凝胶的不易流动水占比从1%盐含量的98.46%增加到3%盐含量的99.17%。1%盐含量制成的鱼糜凝胶的不易流动水比例从僵直前的98.46%降低到僵直后的97.84%。而僵直后-2% NaCl与僵直前-1% NaCl鱼糜凝胶的不易流动水比例水平相当。盐添加量的增加提高了不易流动水的比例,降低了自由水的比例。而相较于僵直前,僵直后肌肉制成的鱼糜凝胶不易流动水的比例降低,自由水的比例增加。结果表明,盐的加入使更多的肌球蛋白从肌原纤维蛋白网络中释放出来,形成了更加稳定的网络结构,改善了鱼糜凝胶的水分流失。而僵直后的肌肉,蛋白质降解损伤了细胞膜和肌原纤维蛋白,削弱了水-蛋白质的相互作用,使部分截留在网络结构中的水分流失[34],这与WHC的结果相一致。WHC和水分分布也可以反映凝胶网络的强度,凝胶网络结构越好,其固定水分的能力越强[35]。
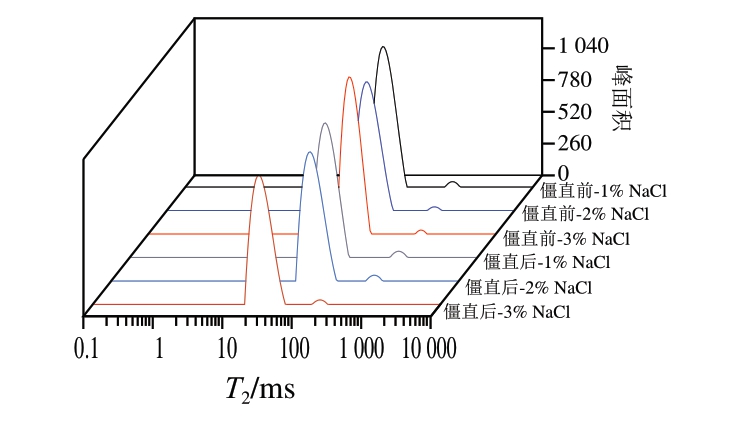
图4 僵直前后不同盐含量对白鲢鱼糜凝胶水分分布的影响
Fig.4 Effects of different salt contents on the water distribution of surimi gels made from pre- or post-rigor silver carp muscle
3 结 论
本研究探究了鱼肉僵直进程和盐含量对白鲢鱼糜凝胶特性的影响。结果表明,随着盐含量的提高,鱼糜凝胶的凝胶强度和WHC均增加。相较于僵直后,用僵直前肌肉制备的鱼糜凝胶具有更好的凝胶特性和WHC。扫描电子显微镜图像也显示,僵直前肌肉及添加更多盐制成的鱼糜凝胶结构更致密、孔隙也更小。僵直前肌肉改善鱼糜凝胶特性与许多因素有关,如肌肉的pH值、蛋白质的变性程度、蛋白水解等,都可能影响肌肉蛋白质在僵直转化过程中的功能。采用僵直前肌肉制备鱼糜凝胶改善了低盐鱼糜凝胶的品质,僵直前肌肉和低盐含量(1%NaCl)制备的鱼糜凝胶的质构特性和WHC能够达到与僵直后肌肉添加2% NaCl制成的鱼糜凝胶相当的水平。本研究不仅有助于了解僵直前肌肉制备鱼糜凝胶的作用,还有助于开发绿色、高质量的低盐鱼糜产品。
[1] WU D, XIONG J, LI P, et al.Dual enhancement effects of different yeast extract on gel properties and saltiness perception of low-salt surimi gel from silver carp[J].Food Hydrocolloids, 2024, 152: 109925.DOI:10.1016/j.foodhyd.2024.109925.
[2] ZHANG C, CHEN L, LU M X, et al.Effect of cellulose on gel properties of heat-induced low-salt surimi gels: physicochemical characteristics, water distribution and microstructure[J].Food Chemistry: X, 2023, 19: 100820.DOI:10.1016/j.fochx.2023.100820.
[3] DESMOND E.Reducing salt: a challenge for the meat industry[J].Meat Science, 2006, 74(1): 188-196.DOI:10.1016/j.meatsci.2006.04.014.
[4] TAHERGORABI R, JACZYNSKI J.Physicochemical changes in surimi with salt substitute[J].Food Chemistry, 2012, 132(3): 1281-1286.DOI:10.1016/j.foodchem.2011.11.104.
[5] CANDO D, BORDERÍAS A J, MORENO H M.Influence of amino acid addition during the storage life of high pressure processed low salt surimi gels[J].LWT-Food Science and Technology, 2017, 75: 599-607.DOI:10.1016/j.lwt.2016.10.012.
[6] HAMM R.Postmortem breakdown of ATP and glycogen in ground muscle: a review[J].Meat Science, 1977, 1(1): 15-39.DOI:10.1016/0309-1740(77)90029-8.
[7] SONG D H, HAM Y K, HA J H, et al.Impacts of pre-rigor salting with KCl on technological properties of ground chicken breast[J].Poultry Science, 2020, 99(1): 597-603.DOI:10.3382/ps/pez527.
[8] OFFER G, KNIGHT P, JEACOCKE R, et al.The structural basis of the water-holding, appearance and toughness of meat and meat products[J].Food Microstructure, 1989, 8(1): 17.DOI:10.1016/0044-8486(82)90166-1.
[9] JOO S T, KAUFFMAN R G, KIM B C, et al.The relationship of sarcoplasmic and myofibrillar protein solubility to colour and waterholding capacity in porcine longissimus muscle[J].Meat Science,1999, 52(3): 291-297.DOI:10.1016/s0309-1740(99)00005-4.
[10] GAO X, YOU J, YIN T, et al.Simultaneous effect of high intensity ultrasound power, time, and salt contents on gelling properties of silver carp surimi[J].Food Chemistry, 2023, 403: 134478.DOI:10.1016/j.foodchem.2022.134478.
[11] BJØRNEVIK M, CARDINAL M, VALLET J L, et al.Effect of salting and cold-smoking procedures on Atlantic salmon originating from pre-or post rigor filleted raw material.Based on the measurement of physiochemical characteristics[J].LWT-Food Science and Technology,2018, 91: 431-438.DOI:10.1016/j.lwt.2018.01.047.
[12] CLAUS J R, SØRHEIM O.Preserving pre-rigor meat functionality for beef patty production[J].Meat Science, 2006, 73(2): 287-294.DOI:10.1016/j.meatsci.2005.12.004.
[13] HAMM R.Post-mortem changes in muscle with regard to processing of hot-boned beef[J].Acta Alimentaria Polonica, 1982, 8(3/4): 105-115.
[14] 吕顺, 王冠, 陆剑锋, 等.鲢鱼新鲜度对鱼糜凝胶品质的影响[J].食品科学, 2015, 36(4): 241-246.DOI:10.7506/spkx1002-6630-201504048.
[15] 宁云霞, 杨淇越, 鲍佳彤, 等.抗氧化剂对未漂洗革胡子鲶鱼鱼糜品质的影响[J].肉类研究, 2020, 34(7): 84-90.DOI:10.7506/rlyj1001-8123-20200410-091.
[16] 谢航涛, 杨玥, 罗永康, 等.KCl复配5’-肌苷酸二钠替代钠盐对鱼糜凝胶特性的影响[J].肉类研究, 2022, 36(1): 14-19.DOI:10.7506/rlyj1001-8123-20210813-201.
[17] HTWE K K, DUAN W W, WEI S, et al.Quantitative analysis of the correlation between gel strength and microstructure of shrimp surimi gel induced by dense phase carbon dioxide[J].Food Research International, 2023, 174: 113623.DOI:10.1016/j.foodres.2023.113623.
[18] CHEN H Z, ZHANG M, YANG C H.Comparative analysis of 3D printability and rheological properties of surimi gels via LF-NMR and dielectric characteristics[J].Journal of Food Engineering, 2021, 292:110278.DOI:10.1016/j.jfoodeng.2020.110278.
[19] HE N, CHEN X R, LI L, et al.κ-Carrageenan masking bitterness perception in surimi gels containing potassium chloride-based salt substitutes: gel properties, oral processing, and sensory evaluation[J].Food Chemistry, 2024, 456: 139859.DOI:10.1016/j.foodchem.2024.139859.
[20] 王悦松, 刘香玲, 李学鹏, 等.白藜芦醇对鲢鱼肌原纤维蛋白凝胶特性的影响[J].食品科学, 2023, 44(12): 42-49.DOI:10.7506/spkx1002-6630-20220923-235.
[21] 张钰嘉, 万杨卓群, 石尚轩, 等.磷酸盐-大豆分离蛋白联合处理对草鱼肌原纤维蛋白凝胶化的影响[J].肉类研究, 2022, 36(2): 21-26.DOI:10.7506/rlyj1001-8123-20210527-157.
[22] WANG X J, YI Y X, GUO C F, et al.Enhanced sodium release and saltiness perception of surimi gels by microwave combined with water bath heating[J].Food Hydrocolloids, 2023, 134: 108018.DOI:10.1016/j.foodhyd.2022.108018.
[23] ZHAO S M, YANG L, CHEN X, et al.Modulation of the conformation, water distribution, and rheological properties of lowsalt porcine myofibrillar protein gel influenced by modified quinoa protein[J].Food Chemistry, 2024, 455: 139902.DOI:10.1016/j.foodchem.2024.139902.
[24] OFFER G, JOHN T.On the mechanism of water holding in meat: the swelling and shrinking of myofibrils[J].Meat Science, 1983, 8(4):245-281.DOI:10.1016/0309-1740(83)90013-x.
[25] YAN D, XU W J, YU Q Q, et al.Pre-rigor salting improves gel strength and water-holding of surimi gel made from snakehead fish(Channa argus): the role of protein oxidation[J].Food Chemistry,2024, 450: 139269.DOI:10.1016/j.foodchem.2024.139269.
[26] LI S B, ZHANG D Q, XIANG C, et al.Insights into the gel and electronic sense characteristics of meat batters made from Funiu white goat and Oula sheep meat in different rigor states[J].Food Chemistry:X, 2023, 17: 100523.DOI:10.1016/j.fochx.2022.100523.
[27] LIN Y D, SHI X J, ZHOU C Y, et al.Insight into the effects of chitosan on the gelling properties of Tilapia surimi gel under microwave heating treatment[J].Food Bioscience, 2024, 58: 103619.DOI:10.1016/j.fbio.2024.103619.
[28] DU Z Y, YAN S J, FENG R N, et al.Gel properties of refrigerated silver carp surimi sol as affected by cold-induced sol-gel transition and shearing[J].LWT-Food Science and Technology, 2023, 190: 115579.DOI:10.1016/j.lwt.2023.115579.
[29] HUGHES J M, CLARKE F M, PURSLOW P P, et al.Meat color is determined not only by chromatic heme pigments but also by the physical structure and achromatic light scattering properties of the muscle[J].Comprehensive Reviews in Food Science and Food Safety,2019, 19(1): 44-63.DOI:10.1111/1541-4337.12509.
[30] IJAZ M, LI X, ZHANG D Q, et al.Association between meat color of DFD beef and other quality attributes[J].Meat Science, 2020, 161:107954.DOI:10.1016/j.meatsci.2019.107954.
[31] LI C L, MORA L, GALLEGO M, et al.Evaluation of main posttranslational modifications occurring in naturally generated peptides during the ripening of Spanish dry-cured ham[J].Food Chemistry,2020, 332: 127388.DOI:10.1016/j.foodchem.2020.127388.
[32] BLIKRA M J, JESSEN F, FEYISSA A H, et al.Low-concentration salting of cod loins: the effect on biochemical properties and predicted water retention during heating[J].LWT-Food Science and Technology,2020, 118: 108702.DOI:10.1016/j.lwt.2019.108702.
[33] MI H B, YU W S, LI Y, et al.Effect of modified cellulose-based emulsion on gel properties and protein conformation of Nemipterus virgatus surimi[J].Food Chemistry, 2024, 455: 139841.DOI:10.1016/j.foodchem.2024.139841.
[34] LI S B, XIANG C, GE Y, et al.Differences in eating quality and electronic sense of meat samples as a function of goat breed and postmortem rigor state[J].Food Research International, 2022, 152:110923.DOI:10.1016/j.foodres.2021.110923.
[35] GU R J, XIAO X H, SUN J W, et al.Effects of rice residue on physicochemical properties of silver carp surimi gels[J].International Journal of Food Properties, 2018, 21(1): 1743-1754.DOI:10.1080/109 42912.2016.1214146.