调理牛排烹饪简单、方便快捷、营养美味,备受消费者青睐,然而,在其加工及销售过程中,由于自溶酶和微生物的作用,会不断积累醛、酮、胺等有害物质,导致牛肉颜色、质地、气味发生劣变,不适宜消费者食用[1-3]。在肉类微生物菌群中,优势腐败菌能够在低温和长时间贮藏条件下大量增殖,占据主导地位,最终导致食品腐败[4-5]。
目前,传统培养基分离仍是筛选优势腐败菌最常见的方法,但其分离出的菌株往往不能代表微生物菌群的真实分布情况。聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)技术可以通过监测微生物菌群组成变化判断样本中的优势菌,常用于研究白酒酿造[6]、陈醋醋醅[7]、土壤中的微生物菌群结构及种群分析,但该技术无法检测出DNA含量<1.5%的物种,在全面揭示菌群多样性上具有一定局限性[6]。已经有学者通过MRS平板分离结合PCR-DGGE技术监测真空包装猪肉的贮藏期,得到了优势菌群(清酒乳杆菌)[8]。因此,传统培养基结合PCR-DGGE技术确定调理牛排中的优势腐败菌,进行特异性防腐是解决其货架期较短的有效措施。
植物精油是从种子、花、茎、叶、果实中提取的具有特征香气的挥发性液体,具有很强的生物活性[9],可以抑制由肠沙门氏菌和大肠杆菌侵害及蛋白质和脂质氧化引起的食品腐败、变质,是天然的抗菌剂和抗氧化剂,常被用来替代合成防腐剂[10]。Manjankattil等[11]发现,在火鸡肉中添加辣椒精油能够有效抑制其生产和加工过程中的耐药沙门氏菌生长。Buckiuniene等[12]用罗勒精油腌制牛肉糜,发现处理后的牛肉蒸煮损失和霉菌/酵母数量比值显著降低,牛肉品质得到显著提升。此外,Kasi等[13]发现在花生油中添加具有强抗氧化活性(2,2’-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)阳离子自由基清除能力)的生姜精油,能降低其受黄曲霉毒素污染的风险,并有效延长保质期。然而,植物精油对调理牛排优势腐败菌的抑菌性研究却鲜有报道。
基于此,本研究拟通过传统培养基法结合PCRDGGE技术验证调理牛排贮藏期间的优势腐败菌,并引入丁香精油(clove essential oil,CEO)、豆蔻精油(cardamom seeds essential oil,CSEO)及黑胡椒精油(blank pepper essential oil,BPEO),以期通过抑菌实验筛选出一种高效、精准抑菌的植物精油,为调理牛排的特异性防腐提供理论参考。
1 材料与方法
1.1 材料与试剂
冷鲜调理牛排(牧童村菲力牛排)购于石河子市友好超市。
PDA马铃薯葡萄糖琼脂培养基、LB肉汤培养基、MRS、STAA、CFC固体培养基、PCA技术琼脂培养基、VRBA结晶紫中性红胆盐培养基 青岛高科技工业园海博生物技术有限公司;琼脂(分析级) 国药集团化学试剂有限公司;细菌DNA提取试剂盒(50 preps)、2×Taq Master Mix 北京天根生化科技(化工)有限公司;CEO、CSEO、BPEO 多特瑞商贸有限公司;Gel-Green DNA染色剂、TE缓冲液 上海麦克林生化科技股份有限公司;1×TAE电泳缓冲液 美国赛默飞世尔科技公司。
1.2 仪器与设备
LDZX-30KBS立式压力蒸汽灭菌锅 上海申安医疗机械厂;S100 Themal Cycler PCR扩增仪、UniversalHood11凝胶成像系统 美国Bio-Rad公司;ZHWY-118落地普通型大容量恒温培养振荡器 上海智城分析仪器制造有限公司;DCodeTM System DGGE仪孚约生物科技(上海)有限公司;C h e m i S c o p e 6100化学发光仪 上海勤翔科学仪器有限公司;CX23LEDRFS1C生物显微镜 奥林巴斯(中国)有限公司。
1.3 方法
1.3.1 腐败微生物的分离纯化
无菌条件下称取调理牛排20 g,放入装有180 mL生理盐水的均质袋中。密封后于拍击式均质器中破碎,每20 min停歇10 min,避免过热,重复2 次。取1 mL原液进行梯度稀释,选取3 个合适稀释度的样品分别涂布于各选择性培养基上培养。挑取培养基上大小、形状、颜色不同的菌落,通过平板划线法对其进行纯化,得到单一菌落。各选择性培养基的目标腐败菌和培养条件如表1所示。
表1 调理牛排腐败菌的筛选培养基及培养条件
Table 1 Culture media and culture conditions for isolation and identification of spoilage bacteria in processed beef steak
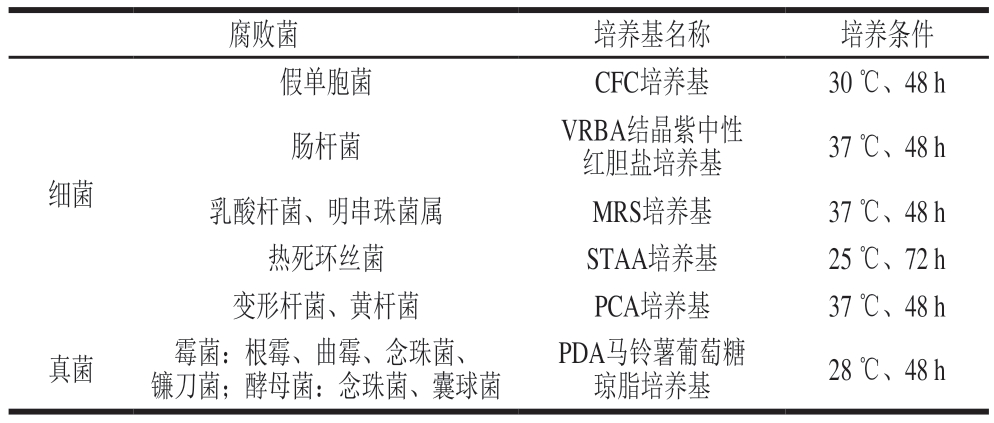
腐败菌培养基名称培养条件假单胞菌CFC培养基30 ℃、48 h肠杆菌VRBA结晶紫中性红胆盐培养基37 ℃、48 h乳酸杆菌、明串珠菌属MRS培养基37 ℃、48 h热死环丝菌STAA培养基25 ℃、72 h变形杆菌、黄杆菌PCA培养基37 ℃、48 h真菌霉菌:根霉、曲霉、念珠菌、镰刀菌;酵母菌:念珠菌、囊球菌细菌PDA马铃薯葡萄糖琼脂培养基28 ℃、48 h
1.3.2 细菌16S rDNA鉴定
采用DNA提取试剂盒提取腐败菌的DNA,以通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-TACCTTGTTACGACTT-3’)[14]对目标细菌的V 3 区进行P C R 扩增。5 0 μ L P C R 扩增体系:2×Taq Master Mix 25 μL,DNA模板1 μL,引物(10 μmol/L)各1.5 μL,ddH2O 21 μL。PCR扩增程序:95 ℃预变性10 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,30 个循环;最后72 ℃再延伸10 min[15]。
PCR扩增产物通过1.2%琼脂糖凝胶电泳检测,将条带清晰的扩增产物送往生工生物工程(上海)股份有限公司进行测序,通过www.NCBI.nlm.gov./blast网站进行序列同源性比对。
1.3.3 PCR-DGGE分析
1.3.3.1 微生物总基因组DNA提取
样品处理同1.3.1节,采用细菌DNA提取试剂盒提取4 ℃贮藏6 d调理牛排的总DNA。
1.3.3.2 PCR扩增
PCR-DGGE技术根据芦文娟[16]的方法稍作修改。PCR扩增采用带GC夹子的特异性引物U968-GC(CG CCCGGGGCGCGCCCCGGGCGGGGCGGGGGCA CGGGGGGGAACGCGAAGAACCTTAC)和L1401(CGGTGTGTACAAGACCC)对细菌16S rDNA的V6~V8区进行PCR扩增。25 μL PCR扩增体系为:2×Taq Master Mix 12.5 μL,DNA模板1 μL,引物(10 μmol/L)各1.5 μL,ddH2O 8.5 μL。PCR扩增程序:95 ℃预变性10 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,32 个循环;最后72 ℃再延伸10 min。
1.3.3.3 DGGE
使用8%聚丙烯酰胺凝胶,采用40%~60%的变性胶。将灌好胶的玻璃板放入电泳槽内升温至60 ℃,130 V预跑胶20 min。点样20 μL,200 V、90 mA高压预跑胶10 min后,85 V、50 mA恒压下电泳16 h。电泳结束后,将变性胶放入50 mL 1×TAE电泳缓冲液(含5 μL Gel-Green DNA染色剂)染色30 min。用ddH2O漂洗2~3 次后用化学发光仪系统拍照。
1.3.3.4 DGGE条带回收与测序
DGGE产物的回收参考曾玲等[17]的方法。将变性胶置于紫外条件下,用无菌手术刀切下各泳道的主要条带,溶于盛有20 μL TE缓冲液的PE管中,4 ℃过夜提取DNA。以回收的DNA为模板,以U968(AACGCGAAGAACCTTAC)(无GC夹子)和L1401(CGGTGTGTACAAGACCC)为引物进行扩增。PCR扩增体系和条件同1.3.3.2节。
1.3.4 CEO、CSEO、BPEO抑菌性能测定
1.3.4.1 抑菌圈直径
抑菌圈的测量采用赵楠楠[18]的方法并稍作修改。将优势腐败菌接种于LB琼脂培养基,37 ℃培养24 h。用无菌生理盐水调节制成106 CFU/mL的菌悬液,置于4 ℃冰箱备用。用无菌棉签蘸取菌液,在培养基上划线涂布。将6 mm的无菌空白药敏纸片放置于培养基上,分别滴加10 μL CEO、CSEO、BPEO,每皿4 片,以无菌生理盐水为空白对照。在4 ℃冰箱中放置4 h,使精油在含菌平板上自纸片中心向外围扩散,随后放入各温度培养箱培养16~24 h。用游标卡尺测量抑菌圈直径。抑菌作用判断:抑菌圈直径>20 mm为高度敏感;10~20 mm为中度敏感;6~10 mm为低度敏感;<6 mm为无抑菌作用[19]。重复3 次实验均有抑菌作用的结果判为合格。
1.3.4.2 最小抑菌浓度(minimum inhibitory concentrate,M I C)和最小杀菌浓度(m i n i m u m b a c t e r i c i d a l concentrate,MBC)
采用二倍稀释法测定精油的MIC与MBC[20]。分别吸取一定量的CEO、CSEO、BPEO,加入1%(V/V)吐温-80无菌水溶液,使其体积浓度为64 μL/mL。吸取1 mL上述植物精油溶液,加入LB培养基,将其体积浓度依次稀释为32.0、16.0、8.0、4.0、2.0、1.0、0.5 μL/mL,最后一管移取1 mL植物精油溶液。每个试管中加入等体积的菌悬液,在培养箱中培养16~24 h,若溶液呈现澄清状态,对应的植物精油体积浓度则为MIC。蘸取澄清试管中的溶液划线,24 h未长菌的植物精油体积浓度即为MBC。
1.3.4.3 细菌生长曲线
各精油的细菌生长曲线通过光密度测定,参考王若男[21]的方法并稍作修改。吸取一定量的植物精油和菌悬液置于酶标板,使精油体积浓度分别为MIC和2MIC,放入培养箱培养,每隔2 h取出测定OD600 nm。实验重复操作3 次,每次设置3 个平行,记录并绘制生长曲线。
1.4 数据处理
使用IBM SPSS Statistics 26.0对实验数据进行单因素方差分析,结果用平均值±标准差表示,并以Duncan检验进行显著性(以P<0.05为差异显著)标记。
2 结果与分析
2.1 调理牛排腐败菌分离鉴定结果
对腐败末期调理牛排的微生物进行分离纯化,结果如表2所示。从6 种传统培养基中共分离纯化得到10 株菌,其中PDA、STAA培养基各1 株,VRBA、CFC、PCA、MRS培养基各2 株。但是,采用培养基分离筛选出的菌株往往不能代表微生物的真实分布情况,也无法仅凭此判断优势腐败菌。因此,优势腐败菌的确定还需要进一步验证。
表2 调理牛排腐败菌的形态结构及鉴定结果
Table 2 Colony characteristics, morphology and identification results of spoilage bacteria in processed beef steak
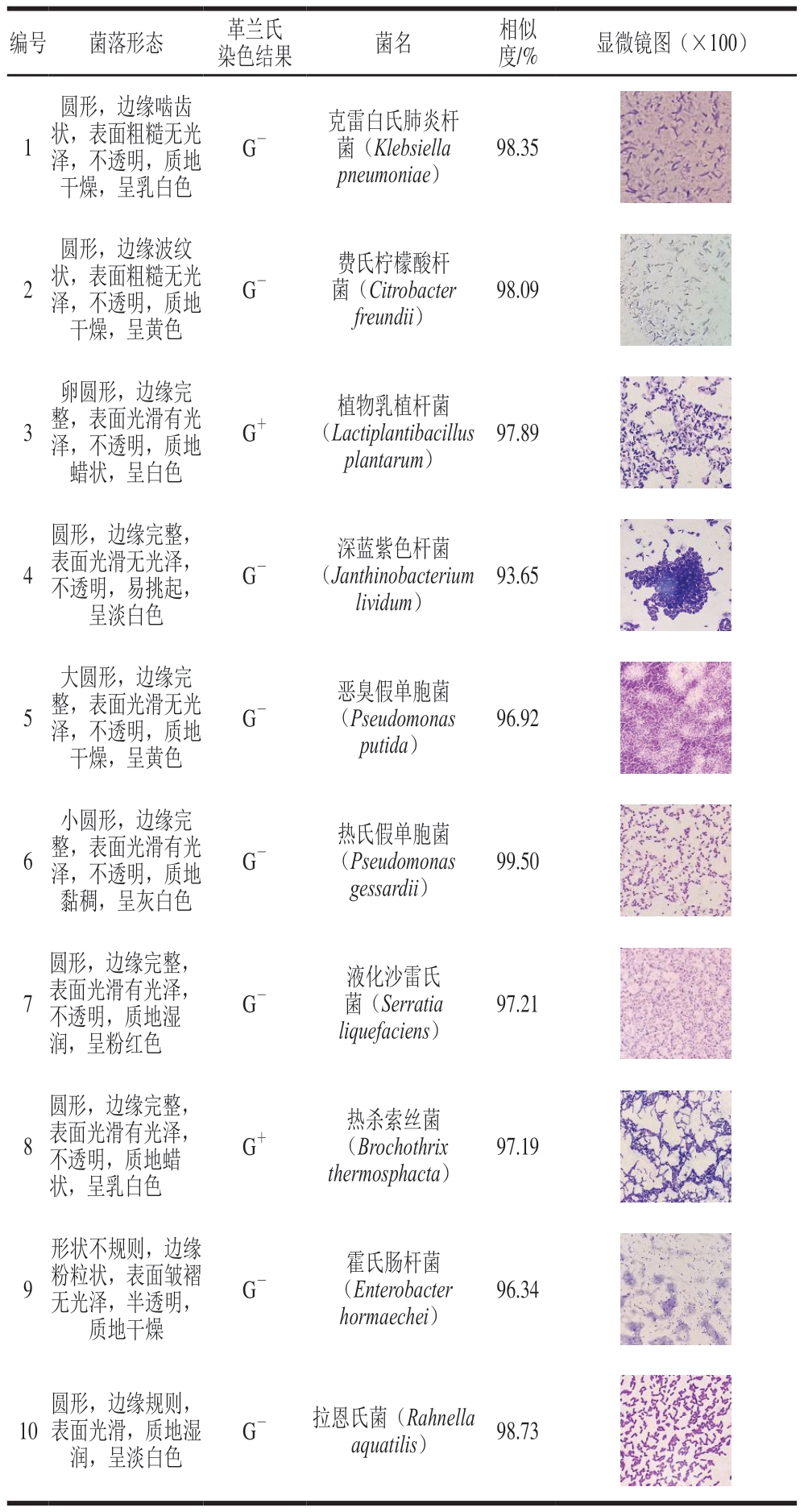
编号菌落形态革兰氏染色结果菌名相似度/%显微镜图(×100)1圆形,边缘啮齿状,表面粗糙无光泽,不透明,质地干燥,呈乳白色G-克雷白氏肺炎杆菌(Klebsiella pneumoniae)98.35images/BZ_54_962_586_1100_724.png2圆形,边缘波纹状,表面粗糙无光泽,不透明,质地干燥,呈黄色G-费氏柠檬酸杆菌(Citrobacter freundii)98.09images/BZ_54_962_762_1100_900.png3卵圆形,边缘完整,表面光滑有光泽,不透明,质地蜡状,呈白色G+植物乳植杆菌(Lactiplantibacillus plantarum)97.89images/BZ_54_962_939_1100_1077.png4圆形,边缘完整,表面光滑无光泽,不透明,易挑起,呈淡白色G-深蓝紫色杆菌(Janthinobacterium lividum)93.65images/BZ_54_962_1117_1100_1254.png5大圆形,边缘完整,表面光滑无光泽,不透明,质地干燥,呈黄色G-恶臭假单胞菌(Pseudomonas putida)96.92images/BZ_54_962_1294_1100_1432.png6小圆形,边缘完整,表面光滑有光泽,不透明,质地黏稠,呈灰白色G-热氏假单胞菌(Pseudomonas gessardii)99.50images/BZ_54_962_1471_1100_1609.png7圆形,边缘完整,表面光滑有光泽,不透明,质地湿润,呈粉红色G-液化沙雷氏菌(Serratia liquefaciens)97.21images/BZ_54_962_1648_1100_1786.png8圆形,边缘完整,表面光滑有光泽,不透明,质地蜡状,呈乳白色G+热杀索丝菌(Brochothrix thermosphacta)97.19images/BZ_54_962_1825_1100_1963.png9形状不规则,边缘粉粒状,表面皱褶无光泽,半透明,质地干燥G-霍氏肠杆菌(Enterobacter hormaechei)96.34images/BZ_54_962_2002_1100_2140.png10圆形,边缘规则,表面光滑,质地湿润,呈淡白色G-拉恩氏菌(Rahnella aquatilis)98.73images/BZ_54_962_2178_1100_2316.png
2.2 PCR-DGGE分析调理牛排菌群变化
DGGE指纹图谱上的1 个水平条带代表1 个微生物类群,条带越多表示样品中的微生物多样性越丰富[22]。其中,条带越亮,则表示该种菌的数量相对越多。调理牛排作为冷鲜食品,其最佳食用期为2~3 d。从第3天开始,牛肉品质开始下降,表面略微变绿,质地松散,回弹缓慢,处于次鲜肉,已不适宜消费者食用。从4 d开始,肉制品底部渗出恶臭血水,不能食用。Sul等[23]在研究牛肉的贮藏期时也发现了相似的变化。因此,提取调理牛排6 d内的总菌落DNA,进行DGGE,分析菌落的变化及微生物演替过程。
图1显示,在4 ℃低温贮藏过程中,微生物菌群具有一定的差异性和动态演替。在贮藏初期(1~3 d),样品还在可食用范围内,样品中的初始菌相并不复杂,微生物数量不多,这说明冷藏起到了暂时性的保鲜效果,延缓了细菌的繁殖速率。随着贮藏时间延长,条带由少变多,在末期还出现了一些新的条带。但是,条带1、2、3贯穿整个贮藏期,且亮度并未随着时间的延长而变暗。在后期,条带4、5、6、7、8开始逐渐由暗变亮,这说明冷藏能够在一定程度上抑制这些微生物生长,但并不能完全抑制。随着贮藏时间延长,抑菌效果逐渐减弱,微生物快速繁殖,导致调理牛排加速腐败变质。因此,确定条带1、2、3为调理牛排的优势腐败菌。
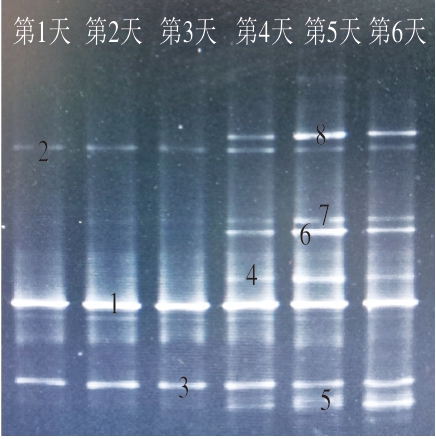
图1 调理牛排腐败期细菌16S rDNA V6~V8区基因的PCR-DGGE指纹图谱
Fig. 1 PCR-DGGE fingerprint of the V6–V8 variable region of bacterial 16S rDNA from processed beef steak in different spoilage stages
2.3 DGGE分离鉴定结果
如表3所示,在DGGE谱图中,条带较弱的DNA未检测出菌株类别,只检测到菌属水平。其中条带1、2、3分别为深蓝紫色杆菌、恶臭假单胞菌和热杀索丝菌,即调理牛排中的优势腐败菌。先前的研究结果表明,假单胞菌属是导致冷鲜肉产生不良气味和腐败变质的主要菌群[24]。
表3 PCR-DGGE条带的基因片段序列比对结果
Table 3 Results of sequence alignment of PCR-DGGE bands by BLAST
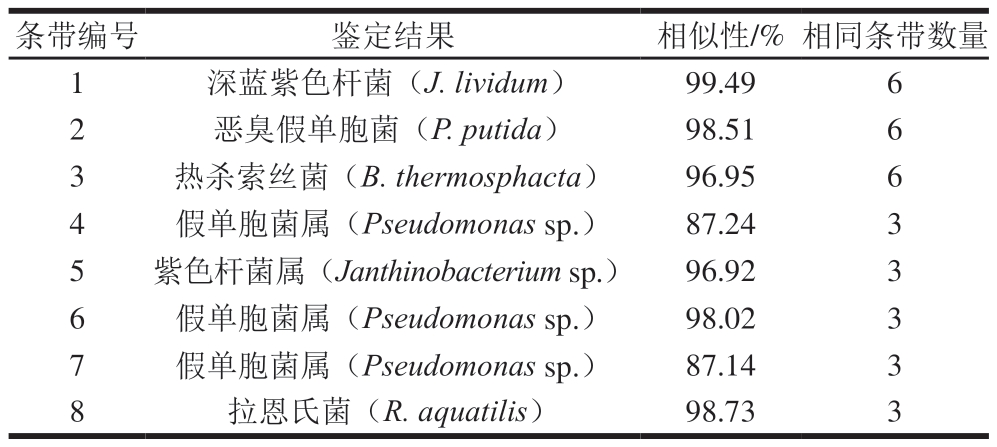
条带编号鉴定结果相似性/% 相同条带数量1深蓝紫色杆菌(J. lividum)99.496 2恶臭假单胞菌(P. putida)98.516 3热杀索丝菌(B. thermosphacta)96.956 4假单胞菌属(Pseudomonas sp.)87.243 5紫色杆菌属(Janthinobacterium sp.)96.923 6假单胞菌属(Pseudomonas sp.)98.023 7假单胞菌属(Pseudomonas sp.)87.143 8拉恩氏菌(R. aquatilis)98.733
2.4 3 种植物精油的抑菌性能评价
2.4.1 抑菌圈直径测定结果
通过测定3 种植物精油对优势腐败菌的抑菌圈直径,初步筛选出具有优良抑菌效果的植物精油。由表4可知,CEO对3 株腐败菌均有明显抑菌性。其中,对热杀索丝菌的抑制效果最为显著(P<0.05),抑菌圈直径为13.900 mm。CSEO的抑菌效果稍弱,对深蓝紫杆菌的抑菌性显著高于其他菌(P<0.05)。而BPEO对3 株菌均无抑菌效果。因此,可以初步判断CEO的抑菌性最强。吴天琳[25]比较60 种植物精油对立枯丝核菌、核盘菌、灰葡萄孢等6 种植物病原真菌的体外抗菌活性,发现CEO对6 株菌的抑制率最高,均达到100%;CSEO抑菌性稍弱,抑制率最高为69.54%;黑胡椒精油抑菌性最弱,抑菌性最高为55.28%。
表4 CEO、CSEO和PBEO对优势腐败菌的抑菌圈直径
Table 4 Inhibition zone diameters of CEO, CSEO and PBEO against dominant spoilage bacteria mm

注:—.没有抑菌圈;同列小写字母不同表示差异显著(P<0.05)。
优势腐败菌CEOCSEOBPEO深蓝紫色杆菌12.499±0.585b11.177±0.720a—热杀索丝菌13.900±1.390a7.687±0.540b—恶臭假单胞菌10.803±0.701b8.250±0.174b—
综上,可以初步判断,CEO的抑菌效果最强。这可能是由于其主要成分为丁香酚、百里香酚、肉桂醛和石竹烯[26]等芳香环和酚类物质,能够与膜蛋白相互作用,诱导生物分子从细胞内部流失,影响电子传递、酶活性和蛋白质合成[27-28],从而抑制微生物生长繁殖。有相关研究报道,酚类物质在不同体积浓度下对微生物的抑菌机制有所差异。在低体积浓度下,酚类物质的抑菌性能主要通过抑制酶活体现,而在高体积浓度下则通过诱导蛋白质变性实现高效抗菌[29]。CSEO的主要成分是黄酮类、生物碱和花青素[30],通过攻击细菌细胞膜,引起细菌内蛋白质、ATP和DNA的泄漏[31]。而深蓝紫色杆菌和恶臭假单胞菌均属于革兰氏阴性菌,细胞膜外层的肽聚糖作为细胞保护结构[32],从而减缓了CSEO的抑菌性。
2.4.2 MIC与MBC测定结果
MIC和MBC为抑制病原微生物繁殖或杀灭病原微生物的最小药物浓度。由表5可知,总体来看,CEO的MIC和MBC最低,2 μL/mL的精油添加量就具备明显的抑菌效果。3 种优势腐败菌中,CSEO对深蓝紫色杆菌的抑菌效果最强,这与上述抑菌圈结果一致。在精油添加量为最大体积浓度(32 μL/mL)时,CSEO与恶臭假单胞菌、热杀索丝菌的细菌培养液在培养16~24 h后仍然浑浊,说明在此精油添加量下,CSEO没有发挥出抑菌效果。通过抑菌圈、MIC和MBC实验结果可以明确,BPEO对3 株优势腐败菌均未表现出抑菌效果,所以通过细菌生长曲线进一步比较CSEO、CEO的抑菌性能强弱。
表5 CEO、CSEO、BPEO对优势腐败菌的MIC和MBC
Table 5 MIC and MBC of CEO, CSEO, BPEO against dominant spoilage bacteria μL/mL
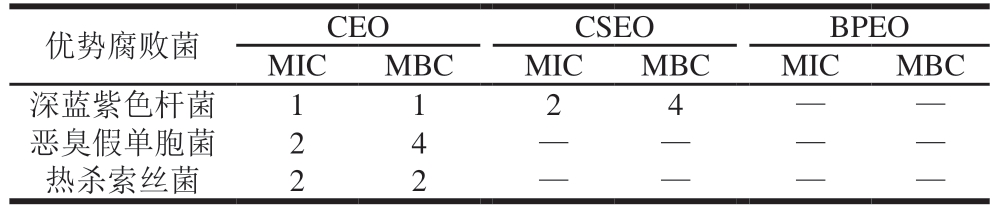
注:—.在最高精油添加量下试管溶液浑浊。
优势腐败菌CEOCSEOBPEO MICMBCMICMBCMICMBC深蓝紫色杆菌1124——恶臭假单胞菌24——热杀索丝菌22——
2.4.3 优势腐败菌生长曲线
OD600 nm可以直接或间接反映样品中细菌的生长情况[33]。由图2可知,未被CEO处理的各优势腐败菌生长情况符合典型的细菌生长曲线。由图2a可知,MIC和2MIC体积浓度的CEO在8 h内就能抑制90%的深蓝紫色杆菌生长,并且在较长时间内使其维持较低的生长活性。相比之下,2MIC体积浓度的CEO具有更强的抑制效果,在12~20 h还能持续降低细菌的OD600 nm。从图2b可以明显观察到,恶臭假单胞菌的细菌生长趋势为空白对照组>MIC处理菌悬液>2MIC处理菌悬液,与热杀索丝菌一致(图2c),都证明CEO能够有效抑制优势腐败菌的生长。
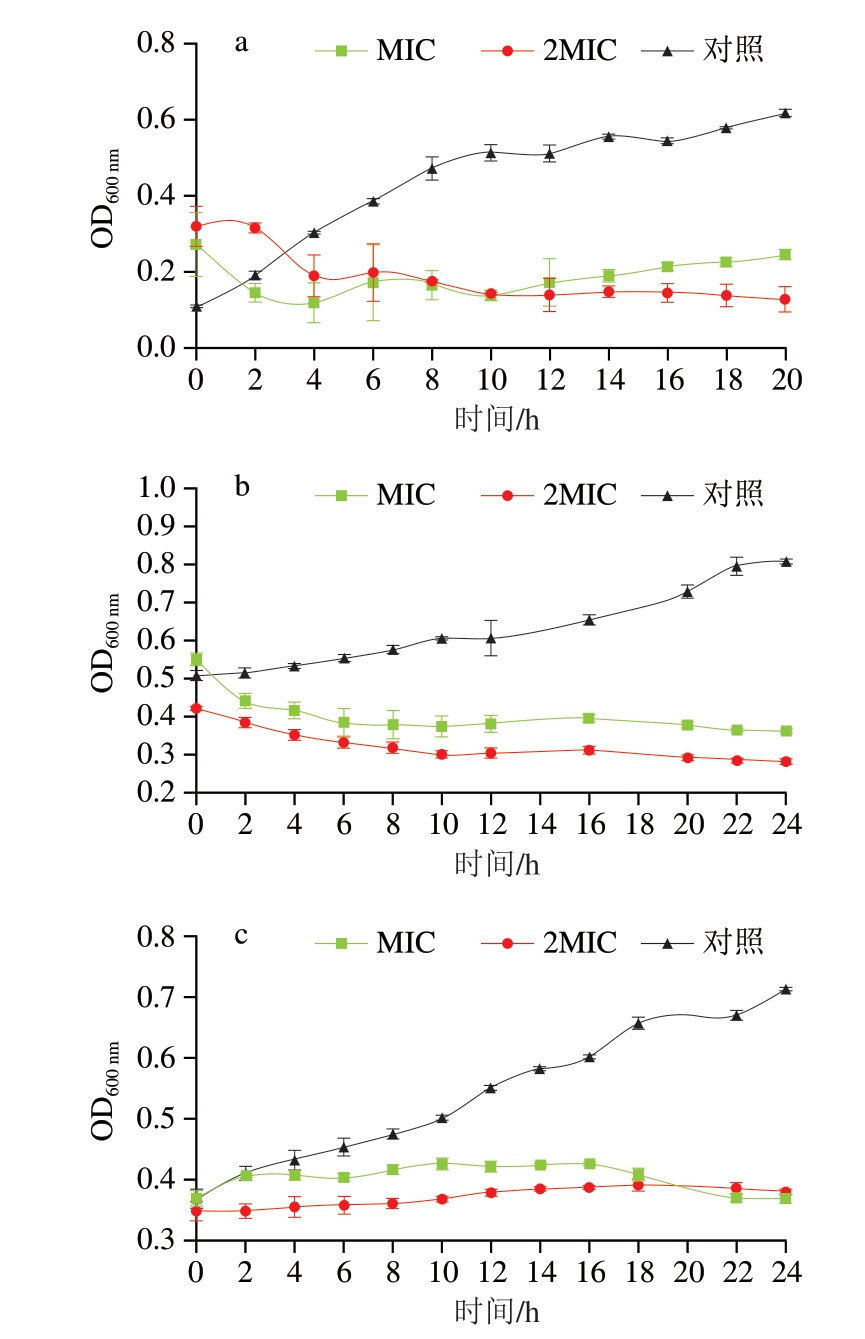
图2 CEO对深蓝紫色杆菌(a)、恶臭假单胞菌(b)、热杀索丝菌(c)生长曲线的影响
Fig. 2 Effect of CEO on the growth curve of J. lividum (a), P. putida (b) and B. thermosphacta (c)
由图3a可知,2MIC体积浓度的CSEO能够作用于深蓝紫色杆菌的对数生长期,使其生长繁殖受到抑制。抑菌圈实验表明,CSEO对热杀索丝菌和恶臭假单胞菌具有低敏抑菌性。但在进行MIC和MBC实验时,即使在最大精油添加量下,CSEO对2 株优势腐败菌均未表现出抑菌性。因此,以最大精油添加量(32 μL/mL)进行细菌生长曲线实验,进一步研究CSEO对这2 株菌的生长抑制效果。由图3b、c可知,添加精油的细菌生长曲线与对照组一致,无抑菌性。综上所述,针对3 株优势腐败菌,CEO为抑菌性最强的植物精油。
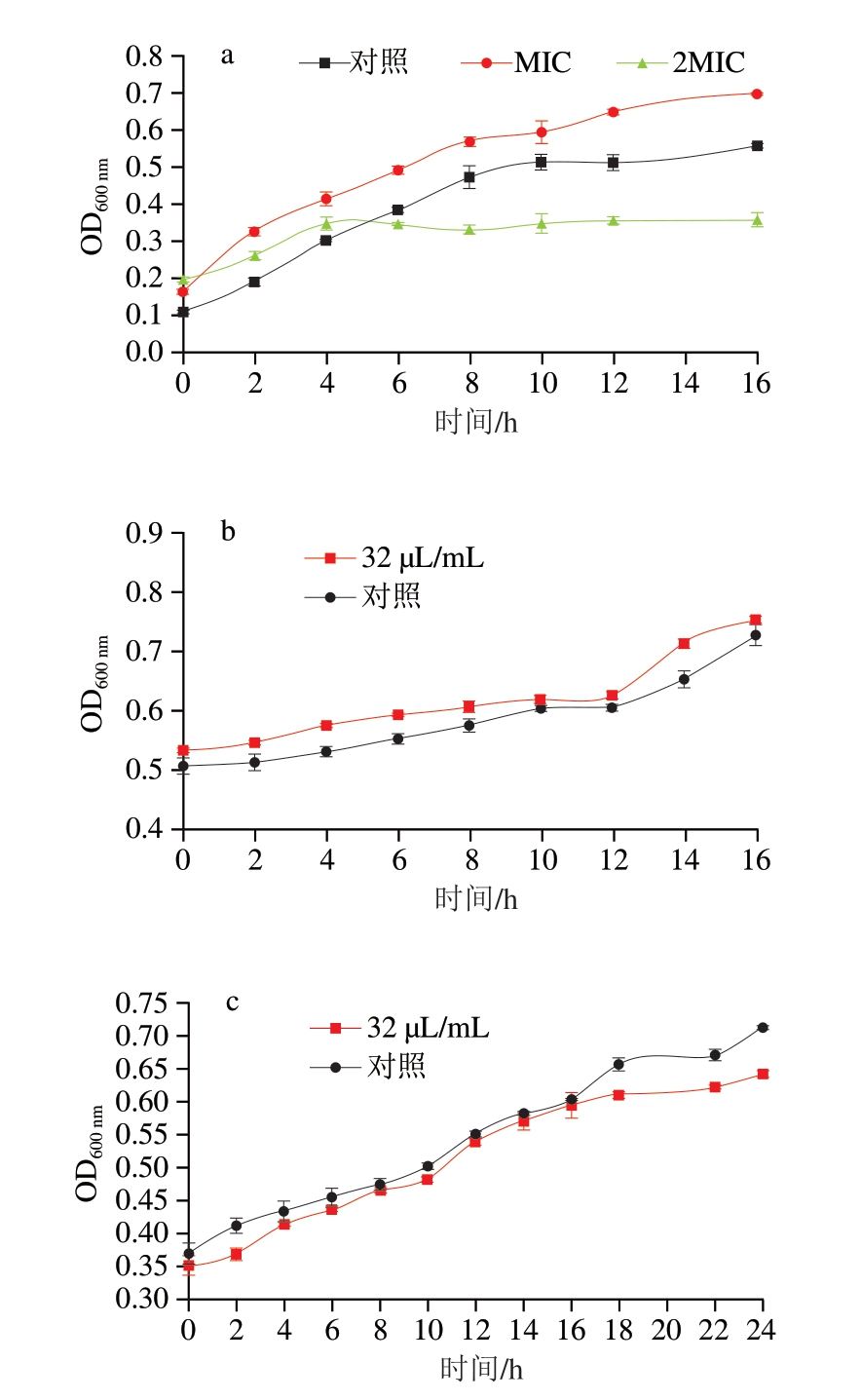
图3 CSEO对深蓝紫色杆菌(a)、恶臭假单胞菌(b)、热杀索丝菌(c)生长曲线的影响
Fig. 3 Effect of CSEO on the growth curve of J. lividum (a), P. putida (b) and B. thermosphacta (c)
3 结 论
通过传统培养基分离腐败菌株,结合PCR-DGGE技术对调理牛排腐败贮藏过程中微生物的消长规律和菌群变化进行检测,明确优势腐败菌为深蓝紫色杆菌、恶臭假单胞菌和热杀索丝菌。针对优势腐败菌,再通过抑菌圈、MIC、MBC和细菌生长曲线从CEO、CSEO和BPEO 3 种香辛料植物精油中筛选出抑菌性最强的植物精油为CEO,为后续调理牛排的防腐保鲜提供了参考。
[1] 顾春涛. 冷鲜牛肉特定腐败菌假单胞菌鉴定及肉桂醛对其抑制的研究[D]. 杭州: 浙江工商大学, 2019: 1-25.
[2] 方金玉. 冷鲜牛肉中假单胞菌和热死环丝菌致腐机制及其光动力杀菌控制研究[D]. 杭州: 浙江工商大学, 2022: 13-33.
[3] 周秀丽. 包装方式对调理牛排冷藏品质及菌相的影响[D]. 锦州: 锦州医科大学, 2018: 1-20.
[4] DE ANDRADE CAVALARI C M, IMAZAKI P H, PIRARD B, et al.Carnobacterium maltaromaticum as bioprotective culture against spoilage bacteria in ground meat and cooked ham[J]. Meat Science,2024, 211: 109441. DOI:10.1016/j.meatsci.2024.109441.
[5] SAELENS G, HOUF K. Systematic review and critical reflection on the isolation and identification methods for spoilage associated bacteria in fresh marine fish[J]. Journal of Microbiological Methods,2022, 203: 106599. DOI:10.1016/j.mimet.2022.106599.
[6] 侯议轲. 清香型白酒酿造微生物菌群快速检测方法的研究与应用[D].太原: 山西大学, 2023: 17-22.
[7] 刘聪. 山西老陈醋醋醅中微生物多样性分析及高粱单宁对真菌生长的影响[D]. 太原: 山西大学, 2019: 14-30.
[8] JIANG Y, GAO F, XU X L, et al. Changes in the bacterial communities of vacuum-packaged pork during chilled storage analyzed by PCRDGGE[J]. Meat Science, 2010, 86(4): 889-895. DOI:10.1016/j.meatsci.2010.05.021.
[9] MA L, WEI L, CHEN X Q, et al. Chemical composition, antioxidative and antimicrobial activities of essential oil of wild Artemisia annua from Ningxia, China[J]. Natural Product Research, 2023: 1-7. DOI:10.1080/14786419.2023.2281001.
[10] LIU M M, PAN Y, FENG M X, et al. Garlic essential oil in water nanoemulsion prepared by high-power ultrasound: properties,stability and its antibacterial mechanism against MRSA isolated from pork[J]. Ultrasonics Sonochemistry, 2022, 90: 106201. DOI:10.1016/j.ultsonch.2022.106201.
[11] MANJANKATTIL S, DEWI G, PEICHEL C, et al. Effect of pimenta essential oil against Salmonella Agona and Salmonella Saintpaul in ground Turkey meat and nonprocessed Turkey breast meat[J]. Poultry Science, 2024, 103(2): 103279. DOI:10.1016/j.psj.2023.103279.
[12] BUCKIUNIENE V, KLUPSAITE D, ZAVISTANAVICIUTE P,et al. O-012 Influence of lactic acid bacteria fresh basil and basil essential oil on Berrichon du Cher breed meat (Musculus gluteus)quality parameters[J]. Animal-Science Proceedings, 2023, 14(1): 62.DOI:10.1016/j.anscip.2023.01.088.
[13] KASI M, ANANDARAJ K, HATAMLEH A A, et al. Groundnut oil biopreservation: bioactive components, nutritional value and antiaflatoxigenic effects of traditional ginger seasoning[J]. Journal of Food Processing and Preservation, 2017, 41(3): e12984. DOI:10.1111/jfpp.12984.
[14] 黄盈. 北海涠洲岛可培养细菌多样性及生物活性研究[D]. 南宁:广西民族大学, 2023: 13-14.
[15] 黄爱霞, 林锋, 崔雁娜, 等. 冷藏大口黑鲈鱼片品质变化规律及优势腐败菌致腐能力分析[J]. 食品安全质量检测学报, 2023, 14(15): 93-100. DOI:10.19812/j.cnki.jfsq11-5956/ts.2023.15.029.
[16] 芦文娟. 新疆塔城地区原料乳及奶酪中酵母菌多样性的研究[D].石河子: 石河子大学, 2016: 36-40.
[17] 曾玲, 金清. PCR-DGGE技术分析韩式大酱与中式大酱中微生物多样性[J]. 食品与发酵工业, 2023, 49(5): 269-274. DOI:10.13995/j.cnki.11-1802/ts.032272.
[18] 赵楠楠. 偃松松塔精油抑菌机理的研究及其微囊制备[D]. 哈尔滨:东北林业大学, 2019: 22-26.
[19] 余梦博, 谢志恒, 黎家明, 等. 抑菌性芽孢杆菌的筛选及特性研究[J].饲料研究, 2024, 47(9): 99-105. DOI:10.13557/j.cnki.issn1002-2813.2024.09.018.
[20] RIAHI S, BEN MOUSSA N, LAJNEF M, et al. Bactericidal activity of ZnO nanoparticles against multidrug-resistant bacteria[J].Journal of Molecular Liquids, 2023, 387: 122596. DOI:10.1016/j.molliq.2023.122596.
[21] 王若男. 黄精多糖的制备及在抗菌材料中的应用研究[D]. 芜湖:安徽工程大学, 2023: 1-29.
[22] 王文凤. 酵母发酵老青茶的品质研究[D]. 武汉: 华中农业大学,2023: 36-52.
[23] SUL Y, EZATI P, RHIM J W. Preparation of chitosan/gelatinbased functional films integrated with carbon dots from banana peel for active packaging application[J]. International Journal of Biological Macromolecules, 2023, 246: 125600. DOI:10.1016/j.ijbiomac.2023.125600.
[24] CASABURI A, PIOMBINO P, NYCHAS G J, et al. Bacterial populations and the volatilome associated to meat spoilage[J]. Food Microbiology, 2015, 45: 83-102. DOI:10.1016/j.fm.2014.02.002.
[25] 吴天琳. 60 种植物精油的抗菌活性筛选及牛至精油的抗菌作用机制研究[D]. 兰州: 兰州大学, 2022: 28-37.
[26] CHAIEB K, HAJLAOUI H, ZMANTAR T, et al. The chemical composition and biological activity of clove essential oil, Eugenia caryophyllata (Syzigium aromaticum L. myrtaceae): a short review[J].Phytotherapy Research, 2007, 21(6): 501-506. DOI:10.1002/ptr.2124.
[27] RODRIGUES F J, CEDRAN M F, BICAS J L, et al. Inhibitory effect of reuterin-producing Limosilactobacillus reuteri and edible alginate-konjac gum film against foodborne pathogens and spoilage microorganisms[J]. Food Bioscience, 2023, 52: 102443. DOI:10.1016/j.fbio.2023.102443.
[28] GYAWALI R, IBRAHIM S A. Natural products as antimicrobial agents[J]. Food Control, 2014, 46: 412-429. DOI:10.1016/j.foodcont.2014.05.047.
[29] BAJPAI V K, RAHMAN A, DUNG N T, et al. In vitro inhibition of food spoilage and foodborne pathogenic bacteria by essential oil and leaf extracts of Magnolia liliflora Desr.[J]. Journal of Food Science,2008, 73(6): M314-M320. DOI:10.1111/j.1750-3841.2008.00841.x.
[30] NOUMI E, SNOUSSI M, ALRESHIDI M M, et al. Chemical and biological evaluation of essential oils from cardamom species[J].Molecules, 2018, 23(11): 2818. DOI:10.3390/molecules23112818.
[31] SOBHY M, ALI S S, CUI H Y, et al. Exploring the potential of 1,8-cineole from cardamom oil against food-borne pathogens:antibacterial mechanisms and its application in meat preservation[J].Microbial Pathogenesis, 2023, 184: 106375. DOI:10.1016/j.micpath.2023.106375.
[32] JIANG L W, LIU F Y, WANG F H, et al. Development and characterization of zein-based active packaging films containing catechin loaded β-cyclodextrin metal-organic frameworks[J].Food Packaging and Shelf Life, 2022, 31: 100810. DOI:10.1016/j.fpsl.2022.100810.
[33] 周典. 溶菌酶修饰的百里香精油脂质体的制备及其在牛肉保鲜中的应用[D]. 成都: 成都大学, 2023: 42-56.